Кислотные свойства оксидов и гидроксидовКак изменяются кислотные свойства оксидов и гидроксидов в группах сверху вниз? Свойства оксидов и гидроксидов определяются неметаллическими свойствами простых веществ, образованных их центральными элементами. Т.е. если их неметаллические свойства в группе сверху вниз ослабевают, то и кислотные свойства их соединений (оксидов и гидроксидов) также будут ослабевать. Чем же определяются неметаллические свойства простых веществ?
Неметаллические свойства определяются способностью атомов принимать электроны. Эта способность уменьшается в группах сверху вниз. Почему? Это легче всего понять, посмотрев на следующую картинку. Источник: [3], стр. 13.
Как мы видим, радиусы атомов сверху вниз увеличиваются (так как увеличивается число заполненных электронных слоев), внешние электроны находятся все дальше и дальше от ядра, притяжение к положительно заряженному ядру атома уменьшается.
Основные свойства меняются в противоположную сторону, т.е. они возрастают в группах сверху вниз. Это объясняется тем, что чем больше радиус атома, тем легче атому отдавать электроны и тем выше металлические свойства (которыми и определяются основные свойства соединений). В качестве примера рассмотрим ряд HNO3, h4PO4, h4AsO4. Согласно рассуждениям выше, кислотные свойства в этом ряду ослабевают, так как ослабевают неметаллические свойства в ряду N → P → As (по группе сверху вниз).
Кислотные свойства водородных соединений (бескислородных кислот)Рассмотрим ряд соединений (а точнее их водные растворы): HF, HCl, HBr, HI. Двигаясь по группе сверху вниз, размер атомов F, Cl, Br, I увеличивается (так как растет число электронных слоев). В результате чего связь H-Г (Г — галоген) ослабевает и удлиняется. Так как эта связь становится слабее (в группе сверху вниз), кислота становится сильнее (так как становится все проще и проще отщепить протон).
Кислотные свойства кислородсодержащих кислот в зависимости от степени окисления центрального элементаПолярность связи O-H играет ключевую роль в определении кислотных свойств кислородсодержащих кислот. Она в свою очередь зависит от центрального атома (его способности притягивать электроны) и от количества негидроксильных атомов кислорода. В нашем случае центральные атомы одинаковые, т.е. все зависит от негидроксильных атомов кислорода. Чем больше таких атомов, тем сильнее они оттягивают электронную плотность со связи O-H, делая её более полярной, а кислоту более сильной.
В качестве примера рассмотрим ряд кислородсодержащих кислот хлора. Согласно рассуждениям выше, сила кислот сверху вниз увеличивается: HClO и HClO2 — слабые, а HClO3 и HClO4 — сильные кислоты.
Аналогично, серная кислота является более сильной, чем сернистая. |
Химические свойства кислотных оксидов – характерные особенности
4.
Средняя оценка: 4.4
Всего получено оценок: 280.
4.4
Средняя оценка: 4.4
Всего получено оценок: 280.
Оксиды – неорганические вещества, одним из элементов которых обязательно является кислород в степени окисления -2. Оксиды бывают солеобразующие и несолеобразующие: одним из видов солеобразующих оксидов являются кислотные оксиды. Каковы же их особенности, и на какие характерные свойства кислотных оксидов стоит обратить внимание?
Характеристика кислотных оксидов
Кислотные оксиды – это оксиды неметаллов или переходных металлов в высоких степенях окисления (от +4 до +7). Кислотные оксиды (ангидриды) проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO
Если кислотный оксид имеет высшую степень окисления, то его относят к высшим оксидам. В периоде слева направо металлические свойства химических элементов ослабевают, соответственно, кислотные свойства высших оксидов и их гидратов постепенно изменяются от основных к кислотным (кислотные свойства оксидов и их гидратов слева направо в периоде усиливаются).
В периоде слева направо металлические свойства химических элементов ослабевают, соответственно, кислотные свойства высших оксидов и их гидратов постепенно изменяются от основных к кислотным (кислотные свойства оксидов и их гидратов слева направо в периоде усиливаются).
Химические свойства кислотных оксидов
- Кислотные оксиды вступают в реакцию с водой, в результате с которой образуют кислоты:
CO2 (углекислый газ)+H2 O (вода)=H2 CO3 (угольная кислота)
Cуществуют оксиды, которые не вступают в реакцию с водой, например, оксид кремния – SiO2
- Кислотные оксиды могут взаимодействовать с другими видами оксидов – основными, образуя при этом соли:
SO3 (кислотный оксид)+Na2 O (основной оксид)=Na2 So4 (соль – сульфат натрия)
- Также кислотные оксиды взаимодействуют с основаниями, в результате чего образуются соли:
SO3 (кислотный оксид)+2NaOH (основание)=Na2 SO4 (соль- сульфат натрия)+H2 O (вода)
- Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:
Na2 SO4 (сульфат натрия)+2H2 O (вода)+SO3 (оксид серы)=2NaHSO4 (кислая соль – гидросульфат натрия)+H2 O (вода)
- Нелетучие кислотные оксиды в солях имеют способность замещать летучие оксиды:
SiO2 (оксид кремния)+Na2 CO3 (карбонат натрия)3+Na2
- Кислотные оксиды могут образовываться при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей:
H2 SiO3 (кремниевая кислота)=SiO2 (оксид кремния)+H2 O (вода).
Что мы узнали?
Кислотные оксиды – вещества, образованные из атомов кислорода и неметаллов или переходных металлов. Они могут взаимодействовать и вступать в реакцию с водой, основными оксидами, основаниями, а нелетучие оксиды имеют способность в солях заменять летучие оксиды.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.4
Средняя оценка: 4.4
Всего получено оценок: 280.
А какая ваша оценка?
Кислотная и щелочная сила — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1314
Все кислоты и основания не ионизируются и не диссоциируют в одинаковой степени.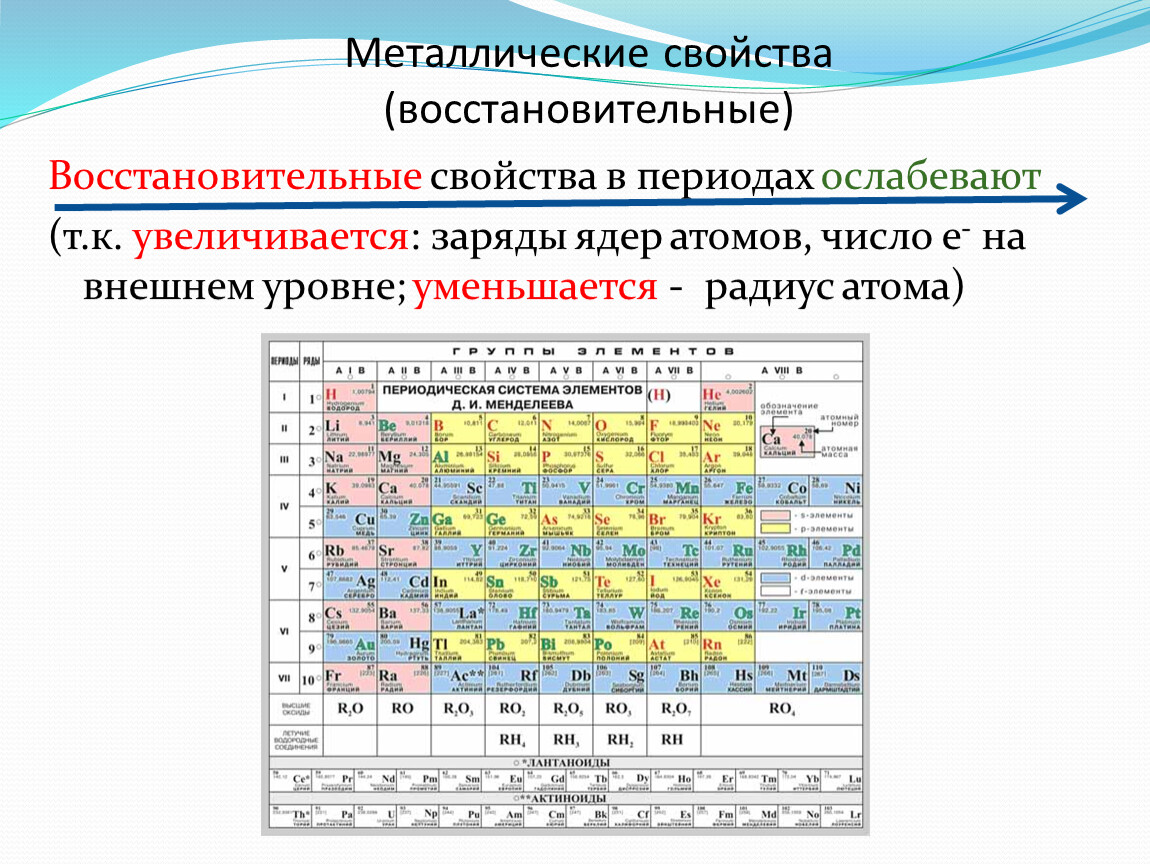 Это приводит к утверждению, что кислоты и основания не все имеют одинаковую силу в производстве H + и ионы ОН — в растворе. Термины «сильный» и «слабый» указывают на силу кислоты или основания. Термины сильный и слабый описывают способность растворов кислот и оснований проводить электричество. Если кислота или основание сильно проводят электричество, это сильная кислота или основание. Если кислота или основание слабо проводят электричество, то это слабая кислота или основание.
Это приводит к утверждению, что кислоты и основания не все имеют одинаковую силу в производстве H + и ионы ОН — в растворе. Термины «сильный» и «слабый» указывают на силу кислоты или основания. Термины сильный и слабый описывают способность растворов кислот и оснований проводить электричество. Если кислота или основание сильно проводят электричество, это сильная кислота или основание. Если кислота или основание слабо проводят электричество, то это слабая кислота или основание.
Демонстрация кислотной и щелочной проводимости
Инструктор проверит проводимость различных растворов с помощью прибора с лампочкой. Цепь лампочки неполная. Если цепь замыкается раствором, содержащим большое количество ионов, лампочка будет ярко светиться, указывая на сильную способность проводить электричество, как это показано для HCl. Если цепь замыкается раствором, содержащим большое количество молекул и либо отсутствием ионов, либо небольшим количеством ионов, раствор не проводит или проводит очень слабо, как это показано для уксусной кислоты.
Кислота или основание, которые хорошо проводят электричество, содержат большое количество ионов и называются
| Соединения | Внешний вид лампочки | Классификация Слабый или сильный | Вывод ионов или молекул |
|---|---|---|---|
| нет света | слабый | молекул | |
| HCl | яркий | сильный | ионов |
| HC 2 H 3 O 2 | тусклый | слабый | молекул |
| Н 2 SO 4 | яркий | Ответсильный | ответов |
| H 2 CO 3 | тусклый | Ответ слабый | Молекулы ответов |
| NaOH | яркий | Ответсильный | ответов |
| КОН | яркий | Ответсильный | ответов |
| НХ 4 ОХ | тусклый | Ответ слабый |
Сила связи
Сила связи кислот и оснований определяется относительным количеством молекул и ионов, присутствующих в растворе. Облигации представлены как:
Облигации представлены как:
| кислота | база |
| Х-А | М-ОН |
где А — отрицательный ион, а М — положительный ион
- Сильные кислоты содержат в растворе в основном ионы, поэтому связи, удерживающие Н и А вместе, должны быть слабыми. Сильные кислоты легко распадаются на ионы.
- Слабые кислоты существуют в основном в виде молекул с небольшим количеством ионов в растворе, поэтому связи, связывающие Н и А вместе, должны быть прочными. Слабые кислоты не распадаются на ионы, но остаются связанными вместе в виде молекул.
Принцип силы связи
Кислоты или основания с сильными связями существуют преимущественно в виде молекул в растворах и называются «слабыми» кислотами или основаниями. Кислоты или основания со слабыми связями легко диссоциируют на ионы и называются «сильными» кислотами или основаниями.
| Характеристика | Сильная кислота или основание | Слабая кислота или основание |
|---|---|---|
| Молекулы | несколько | большое число |
| Ионы | большое число | маленький номер |
| Проводимость | сильный | слабый |
| Сила связи | слабый | сильный |
Кислоты и основания ведут себя в растворе по-разному в зависимости от их силы. Кислотная или щелочная «сила» является мерой того, насколько легко молекула ионизируется в воде.
Кислотная или щелочная «сила» является мерой того, насколько легко молекула ионизируется в воде.
Введение Еще раз
Некоторые кислоты и основания быстро и почти полностью ионизируются в растворе; их называют сильными кислотами и сильными основаниями. Например, соляная кислота (HCl) является сильной кислотой. При помещении в воду практически каждая молекула HCl расщепляется на H 9{-}(aq)} \nonumber\]
Для сильной кислоты, такой как HCl, если вы поместите 1 моль HCl в литр воды, вы получите примерно 1 моль H 3 0 + ионов и 1 моль ионов Cl — . В слабой кислоте, такой как плавиковая кислота (HF), не все молекулы HF расщепляются, и хотя будут высвобождаться некоторые ионы H + и F — , в растворе все еще будут молекулы HF 1 . Аналогичная концепция применима к основаниям, за исключением того, что реакция отличается. Сильное основание, такое как гидроксид натрия (NaOH), также полностью диссоциирует в воду; если в воду добавить 1 моль NaOH, то получится 1 моль гидроксид-ионов. 9{-}(aq) + h3O(l)} \nonumber\]
9{-}(aq) + h3O(l)} \nonumber\]
Термины «сильный» и «слабый» в данном контексте не относятся к тому, насколько коррозионным или едким является вещество, а относятся только к его способности ионизироваться в воде . Способность вещества проедать другие материалы или повреждать кожу больше зависит от свойств этой кислоты, а также от ее концентрации. Хотя сильные кислоты более опасны при более низких концентрациях, сильная кислота не обязательно более опасна, чем слабая. Например, плавиковая кислота является слабой кислотой 1 , но он чрезвычайно опасен, и с ним следует обращаться с большой осторожностью. Плавиковая кислота особенно опасна тем, что способна проедать стекло, как видно на видео в разделе ссылок V1 . Процент диссоциации кислоты или основания математически определяется константой ионизации кислоты (K a ) или константой ионизации основания (K b ) 1 . Эти термины относятся к соотношению реагентов к продуктам, находящимся в равновесии, когда кислота или основание реагируют с водой. Для кислот выражение будет 9{+}}]}{\ce{B}}\]
Для кислот выражение будет 9{+}}]}{\ce{B}}\]
где B — концентрация основания в равновесии, а HB + — концентрация его сопряженной кислоты в равновесии
Чем сильнее кислота, тем снизить pH, который он будет производить в растворе. pH рассчитывается путем отрицательного логарифма концентрации ионов гидроксония. Для сильных кислот вы можете рассчитать pH, просто взяв отрицательный логарифм его молярности, поскольку он полностью диссоциирует на сопряженное основание и гидроксоний. То же самое относится и к сильным основаниям, за исключением того, что отрицательный логарифм дает вам pOH, а не pH. Для слабых кислот и оснований чем выше K a или K b , тем более кислым или основным является раствор. Чтобы найти pH для слабой кислоты или основания, вы должны использовать уравнение K и таблицу RICE для определения pH.
Все кислоты имеют сопряженное основание, которое образуется, когда они реагируют с водой, и аналогичным образом все основания имеют сопряженную кислоту, которая реагирует, когда они реагируют с водой.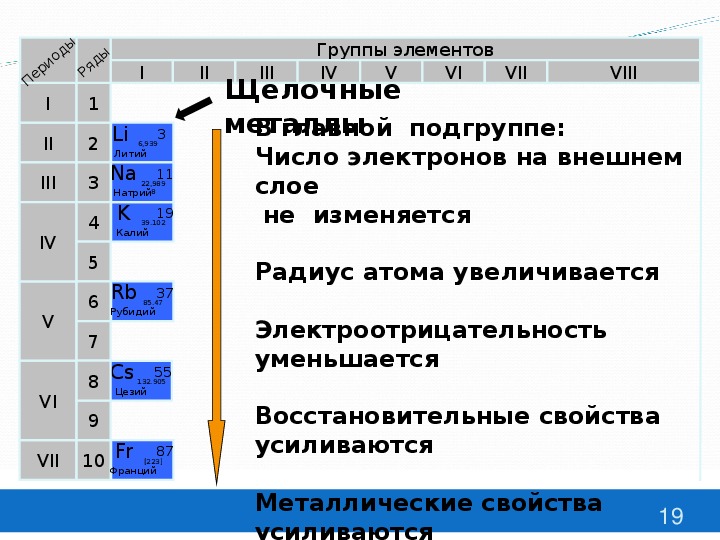 1 Об относительной силе конъюгата можно судить по величине \(K_a\) или \(K_b\) вещества, поскольку \(K_a \times K_b\) равно константе ионизации воды, K 9-]}{[HA]}\]
1 Об относительной силе конъюгата можно судить по величине \(K_a\) или \(K_b\) вещества, поскольку \(K_a \times K_b\) равно константе ионизации воды, K 9-]}{[HA]}\]
, где каждый член в квадратных скобках представляет концентрацию этого вещества в растворе.
Соотношение K w , K b , K a
\[K_w = K_a \times K_b \номер\]
Неполный список сильных кислот: соляная кислота (HCl), азотная кислота 3 ), хлорная кислота (HClO 4 ), серная кислота (H 2 SO 4 )
Частичный список сильных оснований: гидроксид натрия (NaOH), гидроксид бария (Ba(OH) 2 ), гидроксид кальция (Ca(OH) 2 ), гидроксид лития (LiOH) (гидроксиды элементов группы I и II обычно являются сильными основаниями)
Частичный список слабых кислот: уксусная кислота (CH 3 COOH), угольная кислота (H 2 CO 3 ), фосфорная кислота (H 3 PO 4 )
Неполный список слабых оснований: аммиак (NH 3 ), карбонат кальция ), ацетат натрия (NaCH 3 COO)
Пример \(\PageIndex{1}\)
Найдите рН 0,5 г HCl, растворенной в 100 мл воды:
Раствор
Первое определение молей кислоты:
грамм/молярная масса = моль
0,5 грамм/(36,5 г/моль) = 0,014 моль HCl
Тогда находим молярность:
моль/объем = молярность
0,014 моль/0,100 л = 0,14 М
HCl является сильной кислотой и полностью диссоциирует в воде, поэтому рН будет равен отрицательному логарифму концентрации HCl
pH = -log(H 3 O + )
pH = -log(0,14) = 0,85 равно 1,76*10 -5 , а значение K a для бензойной кислоты равно 6,46*10 -5 , если приготовить два раствора, по одному от каждой кислоты, с одинаковыми концентрациями, какой из них будет иметь более низкий рН ?
Раствор
Значение K a является мерой соотношения между реагентами и продуктами при равновесии. Для кислоты реакция будет HA + H 2 О —> А — + Н 3 О + . PH основан на концентрации иона гидроксония (H 3 O + ), который является продуктом реакции кислоты и воды. Более высокое значение K a означает более высокое отношение реагентов к продуктам, поэтому кислота с более высоким значением K a будет производить больше гидроксония и, следовательно, будет иметь более низкий pH. Поэтому раствор бензойной кислоты будет иметь более низкий рН.
Для кислоты реакция будет HA + H 2 О —> А — + Н 3 О + . PH основан на концентрации иона гидроксония (H 3 O + ), который является продуктом реакции кислоты и воды. Более высокое значение K a означает более высокое отношение реагентов к продуктам, поэтому кислота с более высоким значением K a будет производить больше гидроксония и, следовательно, будет иметь более низкий pH. Поэтому раствор бензойной кислоты будет иметь более низкий рН.
Пример \(\PageIndex{3}\)
Значение K a для аммония (NH 4 + ) составляет 5,6*10 -10 , значение K b для аммиака (NH 3) 5 5 020 9,9040 9,8*10 9,8*10 -10 . Является ли аммоний более сильнокислотным, чем аммиак щелочным?
Раствор
Относительная сила кислоты или основания зависит от того, насколько велико значение K a или K b . В этом случае значение K a намного ниже, чем значение K b поэтому аммиак является более сильным основанием, чем аммоний кислым.
В этом случае значение K a намного ниже, чем значение K b поэтому аммиак является более сильным основанием, чем аммоний кислым.
Ссылки
- Oxtboy, Gillis, Campion, David W., H.P., Alan. «Кислотно-основное равновесие». Принципы современной химии. Белмонт: Высшее образование Томсона, 2008. .
Авторы и ссылки
- Чарльз Офардт, почетный профессор Элмхерстского колледжа; Виртуальный химбук. Ллойд Маккарти (UCD)
Acid and Base Strength распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- кислотность
- базовая прочность
7.8: Кислотно-основные свойства солей
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15161
Соли, помещенные в воду, часто реагируют с водой с образованием H 3 O + или OH — . Это известно как реакция гидролиза. В зависимости от того, насколько сильно ион действует как кислота или основание, он будет создавать различные уровни pH. Когда вода и соли реагируют, существует много возможностей из-за различной структуры солей. Соль может состоять из слабой кислоты и сильного основания, сильной кислоты и слабого основания, сильной кислоты и сильного основания или слабой кислоты и слабого основания. Реагенты состоят из соли и воды, а продукты состоят из сопряженного основания (из кислоты реакционной стороны) или сопряженной кислоты (из основания реакционной стороны). В этом разделе химии мы обсудим значения pH солей на основе нескольких условий.
Когда вода и соли реагируют, существует много возможностей из-за различной структуры солей. Соль может состоять из слабой кислоты и сильного основания, сильной кислоты и слабого основания, сильной кислоты и сильного основания или слабой кислоты и слабого основания. Реагенты состоят из соли и воды, а продукты состоят из сопряженного основания (из кислоты реакционной стороны) или сопряженной кислоты (из основания реакционной стороны). В этом разделе химии мы обсудим значения pH солей на основе нескольких условий.
Когда солевой раствор является щелочным или кислым?
Существует несколько руководящих принципов, обобщающих результаты:
- Соли, полученные из сильных оснований и сильных кислот, не гидролизуются. pH останется нейтральным при 7. Галогениды и щелочные металлы диссоциируют и не влияют на H + , поскольку катион не изменяет H + , а анион не притягивает H + из воды. Вот почему NaCl является нейтральной солью.
 Всего: Соли, содержащие галогениды (кроме F —) и щелочные металлы (кроме Be 2 + ), диссоциируют на ионы-спектаторы.
Всего: Соли, содержащие галогениды (кроме F —) и щелочные металлы (кроме Be 2 + ), диссоциируют на ионы-спектаторы. - Соли, состоящие из сильных оснований и слабых кислот, гидролизуются, в результате чего их рН превышает 7. вода в реакции. Это приведет к тому, что вода будет действовать как кислота, которая в этом случае оставит ион гидроксида (OH —) . Катион будет из сильного основания, то есть из щелочного или щелочноземельного металла, и, как и раньше, он диссоциирует на ион и не повлияет на H + .
- Соли слабых оснований и сильных кислот гидролизуются, в результате чего его рН составляет менее 7 . Это связано с тем, что анион станет ионом-спектатором и не сможет притягивать H + , а катион из слабого основания отдаст протон воде, образуя ион гидроксония.
- Соли слабого основания и слабой кислоты также гидролизуются, как и другие, но немного сложнее и требуют учета K a и K b .
 Какая бы кислота ни была сильнее, она будет определяющим фактором при определении того, является ли она кислотной или основной. Катион будет кислотой, а анион будет основанием и будет образовывать либо ион гидроксония, либо ион гидроксида, в зависимости от того, какой ион легче реагирует с водой.
Какая бы кислота ни была сильнее, она будет определяющим фактором при определении того, является ли она кислотной или основной. Катион будет кислотой, а анион будет основанием и будет образовывать либо ион гидроксония, либо ион гидроксида, в зависимости от того, какой ион легче реагирует с водой.
Соли полипротоновых кислот
Не пугайтесь солей полипротоновых кислот. Да, они крупнее и «круче», чем большинство других солей. Но с ними можно обращаться точно так же, как и с другими солями, только с немного большей математикой. Во-первых, мы знаем несколько вещей:
- Это все еще просто соль. Все вышеперечисленные правила остаются в силе. К счастью, поскольку мы имеем дело с кислотами, pH соли полипротонной кислоты всегда будет больше 7.
- Так же, как полипротонные кислоты теряют H 9{-11}\).
Это означает, что при расчете значений K b CO 3 2 — , K b первой реакции гидролиза будет \(K_{b1} = \dfrac{K_w} {K_{a2}}\), так как он пойдет в обратном порядке.

Краткое изложение кислотно-основных свойств солей Тип решения Катионы Анионы рН Кислотный Из слабых оснований NH 4 + , Al 3 + , Fe 3 +
Из сильных кислот: Cl — , Br — , I — , NO 3 — , ClO 4 —
< 7 Базовый Из сильных оснований: Группа 1 и Группа 2, но не Be 2 + Из слабых кислот: F — , NO 2 — , CN — , CH 3 COO —
> 7 Нейтральный Из сильных оснований: Группа 1 и Группа 2, но не Be 2 + .

Из сильных кислот: Cl — , Br — , I — , NO 3 — , ClO 4 —
= 7 Вопросы
- Предскажите, является ли pH каждой из следующих солей, помещенных в воду, кислой, щелочной или нейтральной.
- NaOCl (т)
- KCN (с)
- NH 4 NO 3 (с)
- Найти рН раствора 0,200 М NH 4 NO 3 где (К a = 1,8 * 10 -5 ).
- Найти рН раствора 0,200 М Na 3 PO 4 где (К а 1 = 7,25 * 10 -5 , К а2 2 0 90 — 5 = 16,3 К 9-]\]
\[pH = 12,77\]
Практические вопросы
- Почему соль, содержащая катион сильного основания и анион слабой кислоты, образует щелочной раствор?
- Почему соль, содержащая катион слабого основания и анион сильной кислоты, образует кислый раствор?
- Как значения K a или K b помогают определить, будет ли доминирующей движущей силой реакции слабая кислота или слабое основание?
Ответы на эти вопросы можно найти в разделе прикрепленных файлов внизу страницы.

- Предскажите, является ли pH каждой из следующих солей, помещенных в воду, кислой, щелочной или нейтральной.

 Поэтому и уменьшается способность атомов принимать (притягивать) электроны.
Поэтому и уменьшается способность атомов принимать (притягивать) электроны.

 Всего: Соли, содержащие галогениды (кроме F —) и щелочные металлы (кроме Be 2 + ), диссоциируют на ионы-спектаторы.
Всего: Соли, содержащие галогениды (кроме F —) и щелочные металлы (кроме Be 2 + ), диссоциируют на ионы-спектаторы. Какая бы кислота ни была сильнее, она будет определяющим фактором при определении того, является ли она кислотной или основной. Катион будет кислотой, а анион будет основанием и будет образовывать либо ион гидроксония, либо ион гидроксида, в зависимости от того, какой ион легче реагирует с водой.
Какая бы кислота ни была сильнее, она будет определяющим фактором при определении того, является ли она кислотной или основной. Катион будет кислотой, а анион будет основанием и будет образовывать либо ион гидроксония, либо ион гидроксида, в зависимости от того, какой ион легче реагирует с водой.


Leave A Comment