1.4. Оксиды — ЗФТШ, МФТИ
Многие элементы проявляют переменную валентность и дают оксиды различного состава, что учитывается по международной номенклатуре с указанием степени окисления элемента римскими цифрами, например, `»SO»_3` — оксид серы (VI), `»SO»_2` — оксид серы (IV).
Можно представить следующую схему:
Название оксида `=` «Оксид» `+` название элемента в род. падеже `+` (валентность римскими цифрами).
По своим химическим свойствам все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие оксиды принято делить на три основные группы: основные, амфотерные и кислотные.
Получение основных оксидов
а) разложение нерастворимых гидроксидов:
нерастворимые основания при нагревании разлагаются на соответствующий оксид и воду:
$$ \mathrm{Cu}{\left(\mathrm{OH}\right)}_{2}\stackrel{\mathrm{t}°\mathrm{C}}{\to }\mathrm{CuO}+{\mathrm{H}}_{2}\mathrm{O}$$.
Этим методом нельзя получить гидроксиды щелочных металлов.
б) разложение солей кислородсодержащих кислот:
- разложение карбонатов:
карбонаты щелочноземельных металлов и магния разлагаются на соответствующие основный и кислотный оксиды:
$$ {\mathrm{BaCO}}_{3}\stackrel{\mathrm{t}°\mathrm{C}}{\to }\mathrm{BaO}+{\mathrm{CO}}_{2}\uparrow $$.
Ниже приведены уравнения реакций разложения карбоната аммония и карбоната серебра:
$$ {\left({\mathrm{NH}}_{4}\right)}_{2}{\mathrm{CO}}_{3}\stackrel{t°\mathrm{C}}{\to }2{\mathrm{NH}}_{3}\uparrow +{\mathrm{CO}}_{2}+{\mathrm{H}}_{2}\mathrm{O}$$;
$$ 2{\mathrm{Ag}}_{2}{\mathrm{CO}}_{3}\stackrel{t°\mathrm{C}}{\to }4\mathrm{Ag}\downarrow +2{\mathrm{CO}}_{2}\uparrow +{\mathrm{O}}_{2}\uparrow $$.
Карбонаты щелочных металлов плавятся без разложения, исключение составляет карбонат лития :
$$ {\mathrm{Li}}_{2}{\mathrm{CO}}_{3}\stackrel{\mathrm{t}°\mathrm{C}}{\to }{\mathrm{Li}}_{2}\mathrm{O}+{\mathrm{CO}}_{2}\uparrow $$.
- разложение гидрокарбонатов металлов:
гидрокарбонаты разлагаются на карбонат, воду и углекислый газ.
$$ 2{\mathrm{NaHCO}}_{3}\stackrel{\mathrm{t}°\mathrm{C}}{\to }{\mathrm{Na}}_{2}{\mathrm{CO}}_{3} + {\mathrm{CO}}_{2}\uparrow + {\mathrm{H}}_{2}\mathrm{O}$$.
- разложение нитратов
разложение нитратов металлов определяется положением металла в электрохимическом ряду напряжений металлов:
$$ 2{\mathrm{KNO}}_{3} \stackrel{\mathrm{t}°\mathrm{C}}{\to }2{\mathrm{KNO}}_{2} + {\mathrm{O}}_{2}\uparrow $$
(если металл в ряду напряжения стоит до магния),
$$ 2\mathrm{Pb}({\mathrm{NO}}_{3}{)}_{2} \stackrel{\mathrm{t}°\mathrm{C}}{\to } 2\mathrm{PbO} + 4{\mathrm{NO}}_{2}\uparrow + {\mathrm{O}}_{2}\uparrow $$
(если металл в ряду напряжения стоит от магния до меди включительно),
$$ 2{\mathrm{AgNO}}_{3}\stackrel{\mathrm{t}°\mathrm{C}}{\to } 2\mathrm{Ag} + 2{\mathrm{NO}}_{2}\uparrow + {\mathrm{O}}_{2}\uparrow $$
(если металл в ряду напряжения стоит после меди).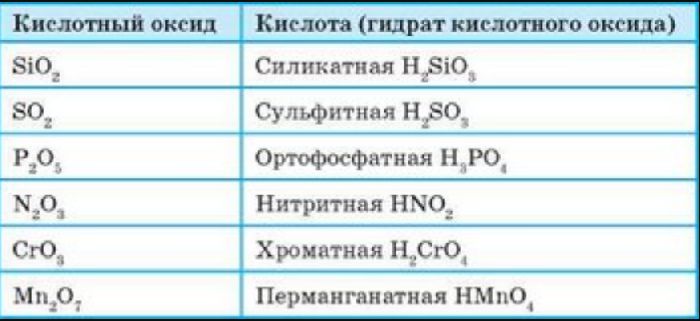
ВНИМАНИЕ!!!
$$ {\mathrm{NH}}_{4}{\mathrm{NO}}_{3} \stackrel{\mathrm{t}°\mathrm{C}}{\to } {\mathrm{N}}_{2}\mathrm{O}\uparrow + 2{\mathrm{H}}_{2}\mathrm{O}$$;
$$ 4{\mathrm{LiNO}}_{3}\stackrel{t°\mathrm{C}}{\to }2\mathrm{LiO}+4{\mathrm{NO}}_{2}\uparrow +{\mathrm{O}}_{2}\uparrow $$;
$$ 4\mathrm{Fe}{\left({\mathrm{NO}}_{3}\right)}_{2}\stackrel{t°\mathrm{C}}{\to }2{\mathrm{Fe}}_{2}{\mathrm{O}}_{3}+8{\mathrm{NO}}_{2}\uparrow +{\mathrm{O}}_{2}\uparrow $$;
$$ \mathrm{Mn}{\left({\mathrm{NO}}_{3}\right)}_{2}\stackrel{\mathrm{t}°\mathrm{C}}{\to }{\mathrm{MnO}}_{2}\downarrow +2{\mathrm{NO}}_{2}\uparrow $$.
- разложение основных солей:
$$ (\mathrm{ZnOH}{)}_{2}{\mathrm{CO}}_{3} \stackrel{\mathrm{t}°\mathrm{C}}{\to } 2\mathrm{ZnO} + {\mathrm{CO}}_{2}\uparrow + {\mathrm{H}}_{2}\mathrm{O}$$.
в) разложение кислородсодержащих кислот:
`»H»_2″SO»_3 → «SO»_2 + «H»_2″O»`.
г) обработка солей растворами кислот:
`»K»_2″Cr»_2″O»_7 + «H»_2″SO»_4 →2″CrO»_3+»K»_2″SO»_4+»H»_2″O»`,
`»Na»_2″SiO»_3+2″HCl» -> 2″NaCl»+»SiO»_2+»H»_2″O»`.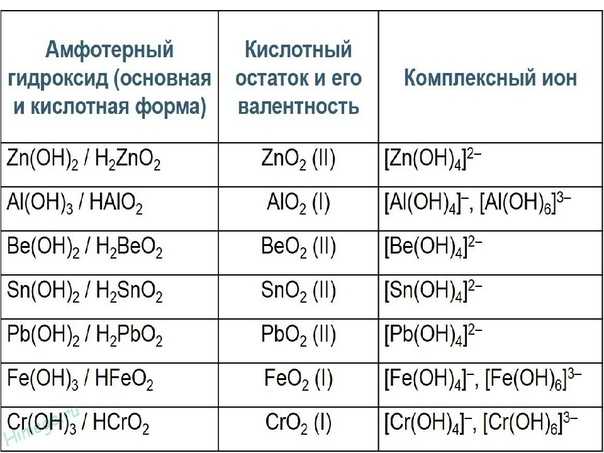
Химические свойства основных оксидов
Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, амфотерными гидроксидами, с кислотами.
Большинство кислотных оксидов непосредственно взаимодействуют с водой с образованием кислот (исключение `»SiO»_2`):
`»P»_2″O»_5+3″H»_2″O» -> 2″H»_3″PO»_4`;
Оксиды, которым соответствуют неустойчивые кислоты, реагируют с водой обратимо и в очень малой степени.
$$ {\mathrm{CO}}_{2} + {\mathrm{H}}_{2}\mathrm{O}\rightleftarrows {\mathrm{H}}_{2}{\mathrm{CO}}_{3}$$;
$$ {\mathrm{SO}}_{2} + {\mathrm{H}}_{2}\mathrm{O}\rightleftarrows {\mathrm{H}}_{2}{\mathrm{SO}}_{3}$$.
Азот в оксидах способен проявлять в соединениях степени окисления `+1`, `+2`, `+3`, `+4`, `+5`. Оксиды `»N»_2″O»` и `»NO»` является несолеобразующими оксидами, оксиды `»N»_2″O»_3` и `»N»_2″O»_5` являются кислотными оксидами, которым соответствуют азотистая и азотная кислота соответственно:
$$ {\mathrm{N}}_{2}{\mathrm{O}}_{3} + {\mathrm{H}}_{2}\mathrm{O} \to 2{\mathrm{HNO}}_{2}$$;
$$ {\mathrm{N}}_{2}{\mathrm{O}}_{5} + {\mathrm{H}}_{2}\mathrm{O} \to 2{\mathrm{HNO}}_{3}$$.
Оксид `»NO»_2` является кислотным оксидом, которому соответствуют сразу две кислоты:
$$ 2{\mathrm{NO}}_{2} + {\mathrm{H}}_{2}\mathrm{O} \to {\mathrm{HNO}}_{2} + {\mathrm{HNO}}_{3} $$.
Наряду с современной номенклатурой для кислотных оксидов до сих пор широко используется старинная система названий как ангидридов кислот – продуктов отщепления воды от соответствующих кислот. Например, `»SO»_3` – ангидрид серной кислоты, `»SO»_2` – ангидрид сернистой кислоты. Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, амфотерными гидроксидами, щелочами:
$$ {\mathrm{SO}}_{3} + \mathrm{CuO} \to {\mathrm{CuSO}}_{4}$$;
$$ {\mathrm{SO}}_{3} + {\mathrm{Na}}_{2}\mathrm{O} \to {\mathrm{Na}}_{2}{\mathrm{SO}}_{4}$$.
$$ {\mathrm{P}}_{2}{\mathrm{O}}_{5}+ {\mathrm{Al}}_{2}{\mathrm{O}}_{3} \stackrel{\mathrm{t}°\mathrm{C}}{\to } 2{\mathrm{AlPO}}_{4}$$;
$$ 3{\mathrm{SO}}_{3} + 2\mathrm{Al}(\mathrm{OH}{)}_{3} \to {\mathrm{Al}}_{2}({\mathrm{SO}}_{4}{)}_{3} +3{\mathrm{H}}_{2}\mathrm{O}$$.
$$ {\mathrm{SO}}_{3} + 2\mathrm{NaOH} \to {\mathrm{Na}}_{2}{\mathrm{SO}}_{4} + {\mathrm{H}}_{2}\mathrm{O}$$;
$$ {\mathrm{SO}}_{3} + \mathrm{NaOH} \to {\mathrm{NaHSO}}_{4}$$.
Кислотные оксиды слабых кислот взаимодействуют только с сильными основаниями (щелочами) и их оксидами:
$$ {\mathrm{Na}}_{2}\mathrm{O}+{\mathrm{CO}}_{2}\to {\mathrm{Na}}_{2}{\mathrm{CO}}_{3}$$;
`»CuO»+»CO»_2`$$ \overline{)\to }$$.
Выше упоминалось, что кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например:
$$ {\mathrm{CO}}_{2} + \mathrm{C} \to 2\mathrm{CO}\uparrow $$;
$$ {\mathrm{SO}}_{2} + 2{\mathrm{H}}_{2}\mathrm{S} \to 3\mathrm{S}\downarrow + 2{\mathrm{H}}_{2}\mathrm{O}$$.
В состав амфотерного окcида входит элемент, который обладает амфотерными свойствами. Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка `»ZnO»` может быть как основанием, так и кислотой (`»Zn»(«OH»)_2` и `»H»_2″ZnO»_2`). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства:
Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка `»ZnO»` может быть как основанием, так и кислотой (`»Zn»(«OH»)_2` и `»H»_2″ZnO»_2`). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства:
$$ \mathrm{ZnO} + {\mathrm{CO}}_{2} \to {\mathrm{ZnCO}}_{3}$$;
$$ \mathrm{ZnO} + 2{\mathrm{NaOH}}_{\left(\mathrm{расплав}\right)} \to {\mathrm{Na}}_{2}{\mathrm{ZnO}}_{2} + {\mathrm{H}}_{2}\mathrm{O}$$;
$$ \mathrm{ZnO} + 2\mathrm{NaOH} + {\mathrm{H}}_{2}\mathrm{O} \to {\mathrm{Na}}_{2}[\mathrm{Zn} (\mathrm{OH}{)}_{4}]$$;
$$ \mathrm{ZnO} + 2\mathrm{HCl} \to {\mathrm{ZnCl}}_{2} + {\mathrm{H}}_{2}\mathrm{O}$$.
8 класс. Химия. Кислотные оксиды — Кислотные оксиды
Комментарии преподавателяОксиды неметаллов
Вы уже знаете, что все вещества делят на две большие группы – органические и неорганические вещества. В 8 классе изучается классификация неорганических веществ. Вам уже знакомы некоторые группы неорганических веществ – оксиды, хлориды, сульфиды, кислоты и т.д.
В 8 классе изучается классификация неорганических веществ. Вам уже знакомы некоторые группы неорганических веществ – оксиды, хлориды, сульфиды, кислоты и т.д.
Изучение классов неорганических веществ мы начнем с группы веществ, которую называют кислотными оксидами. Многие простые вещества – неметаллы при взаимодействии с кислородом образуют оксиды.
Уголь сгорает в атмосфере кислорода с образованием оксида углерода (IV):
С+О2 = СО2
Фосфор тоже горит в кислороде, при этом образуется оксид фосфора (V):
4P + 5O2 = 2P2O5
Рис. 1. Горение фосфора в кислороде
При растворении полученных оксидов в воде образуются растворы, обладающие общими свойствами. Эти растворы кислые на вкус. В ходе растворения оксида углерода (IV) и оксида фосфора (V) в воде образуются кислоты. Запишем уравнения этих реакций.
При растворении в воде оксида углерода (IV) образуется угольная кислота – Н2СО3:
СO2 + h3O ↔h3CO3
Угольная кислота – нестойкое вещество, она разлагается на исходные вещества. Поэтому правильнее вместо знака равенства поставить знак обратимости в уравнении этой реакции.
Поэтому правильнее вместо знака равенства поставить знак обратимости в уравнении этой реакции.
Оксид фосфора (V) хорошо растворяется в воде с образованием ортофосфорной кислоты h4PO4:
P2O5+3h3O=2h4PO4
Данные реакции являются реакциями соединения.
Теперь мы можем объяснить происхождение названия химического элемента кислорода. «кислород» — «рождающий кислоты»: при взаимодействии некоторых неметаллов с кислородом образуются оксиды, растворение которых в воде позволяет получить кислоты.
Оксиды, которым соответствуют кислоты, называют кислотными оксидами.
Например, оксид углерода (IV) и оксид фосфора (V) – кислотные оксиды.
Но не все оксиды неметаллов являются кислотными. Есть оксиды неметаллов, которым не соответствуют кислоты. Среди них, оксид углерода (II) или угарный газ — СО, оксиды азота (I) и (II) – N2O, NO. Этим оксидам кислоты не соответствуют.
Есть еще один интересный факт – не все кислотные оксиды взаимодействуют с водой. Например, оксид кремния (IV) не растворяется в воде. Это вещество составляет основу кварца и белого речного песка. Но оксид кремния является кислотным оксидом, т.к. ему соответствует кремниевая кислота h3SiO3. Это стало известно благодаря тому, что кремниевая кислота разлагается на оксид кремния и воду:
Это вещество составляет основу кварца и белого речного песка. Но оксид кремния является кислотным оксидом, т.к. ему соответствует кремниевая кислота h3SiO3. Это стало известно благодаря тому, что кремниевая кислота разлагается на оксид кремния и воду:
h3SiO3 = SiO2 + h3O
К классу кислотных оксидов относятся не только оксиды неметаллов. Кислотные оксиды могут образовать и некоторые металлы с валентностью более III.
Например оксид хрома (VI) является кислотным оксидом, т.к. ем соответствует хромовая кислота h3CrO4. Эту кислоту можно получить при взаимодействии оксида хрома (VI) с водой:
CrO3+h3O=h3CrO4
[00:04:35/Составление формул кислот, соответствующих оксидам]
Не надо заучивать какая кислота какому оксиду соответствует. Чтобы составить формулу кислоты, соответствующей оксиду, надо запомнить несколько правил. Во-первых, валентность химического элемента в оксиде и соответствующей ему кислоте должна быть одинакова.
Валентности элементов в оксиде вы уже умеете определять.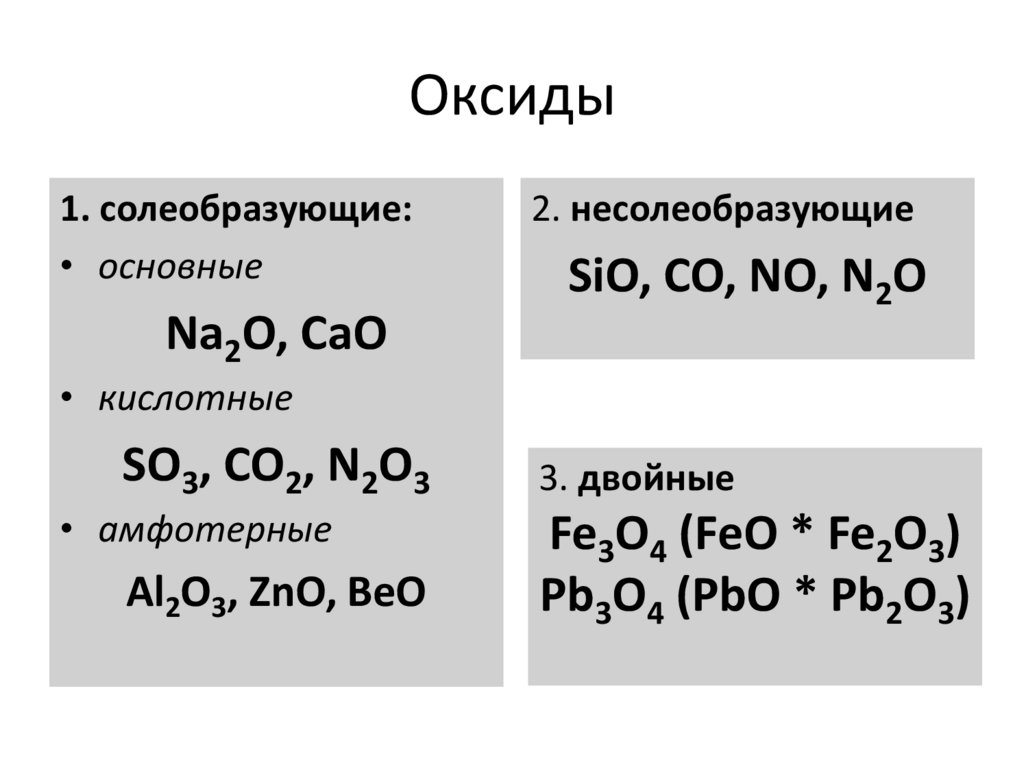 Например, в оксиде азота N2O5 валентность азота равна V. Валентности элементов в кислоте, состоящей из трех химических элементов, определить также несложно. Определим валентности элементов в азотной кислоте HNO3.Валентность водорода в кислотах равна I, валентность кислорода равна II. Чтобы найти валентность азота, нужно из общего числа валентностей кислорода вычесть общее число валентностей водорода, т.е. из 6 вычесть 1.
Например, в оксиде азота N2O5 валентность азота равна V. Валентности элементов в кислоте, состоящей из трех химических элементов, определить также несложно. Определим валентности элементов в азотной кислоте HNO3.Валентность водорода в кислотах равна I, валентность кислорода равна II. Чтобы найти валентность азота, нужно из общего числа валентностей кислорода вычесть общее число валентностей водорода, т.е. из 6 вычесть 1.
Рис. 2. Валентность азота в N2O5 и HNO3 одинакова и равна V
Формулу кислоты, соответствующей оксиду можно составить, используя реакцию соединения кислотного оксида с водой. Если суммировать атомы одной молекулы оксида и одной молекулы воды, то в большинстве случаев получится формула искомой кислоты.
Рассмотрим два примера. Составим формулы кислот, соответствующих оксиду углерода (IV) и оксиду азота (III). Просуммируем атомы одной молекулы углекислого газа и одной молекулы воды. Получилась формула угольной кислоты h3CO3.
То же проделаем с одной молекулой N2O3 и одной молекулой Н2О. Получили Н2N2O4. В получившейся формуле можно сократить индексы на 2. Получим HNO2 – азотистую кислоту (Рис. 3).
Получили Н2N2O4. В получившейся формуле можно сократить индексы на 2. Получим HNO2 – азотистую кислоту (Рис. 3).
Рис. 3. Составление формул кислот, соответствующих оксидам
Этим правилом нельзя воспользоваться для составления формулы ортофосфорной кислоты. Чтобы ее получить к молекуле оксида фосфора (V) надо прибавить 3 молекулы воды.
ИСТОЧНИКИ
источник конспекта — http://interneturok.ru/ru/school/chemistry/8-klass/bklassy-neorganicheskih-vewestv-b/kislotnye-oksidy
исчтонки видео — http://www.youtube.com/watch?v=8rRoZ1UiPrQ
источник видео — http://www.youtube.com/watch?v=YLxqe0Dc130
источник презентации — http://ppt4web.ru/khimija/oksidy1.html
источник презентации — http://www.myshared.ru/slide/1002808/
http://www.youtube.com/watch?v=bT0Olh2Cn1c
неорганическая химия — Что такое «кислотный» оксид?
Задавать вопрос
спросил
Изменено 5 лет, 3 месяца назад
Просмотрено 4к раз
$\begingroup$
В моей книге написано, что:
Оксиды в более высоких степенях окисления элементов группы 14 обычно более кислые, чем в более низких степенях окисления.
Диоксиды $\ce{CO2}$, $\ce{SiO2}$ и $\ce{GeO2}$ являются кислыми, тогда $\ce{SnO2}$ и $\ce{PbO2}$ имеют амфотерную природу. Среди монооксидов $\ce{CO}$ является нейтральным, $\ce{GeO}$ — явно кислым, а $\ce{SnO}$ и $\ce{PbO}$ — амфотерными.
Прежде всего:
Как оксид может быть кислотным? Это из-за их реакции с другими соединениями? Я знаю о кислотах и основаниях Аррениуса, Льюиса и Бренстеда, но до сих пор не могу связать!Во-вторых, почему в книге говорится: «Окислы в более высоких степенях окисления элементов группы 14 обычно более кислые, чем оксиды в более низких степенях окисления»? Есть ли за этим логическая причина?
Прослеживается ли тенденция, указанная во втором вопросе, во всех группах периодической таблицы, а не только в группе 14?
Под «всеми группами» я подразумеваю элементы блока s и p. Я мало что знаю о химии блочных элементов d и f — я изучу их через несколько недель, но я считаю, что они также должны следовать этой тенденции.

- неорганическая химия
- кислотно-щелочная
- периодические тенденции
$\endgroup$
4
$\begingroup$
- Оксиды являются кислотными или основными в зависимости от их реакции с основанием или кислотой.
Здесь в элементах группы 14 $\ce{CO2}$ является кислым, т.е. он реагирует с основанием. Когда оксиды амфотерны, они реагируют как с кислотами, так и с основаниями.
- Оксиды с более высокими степенями окисления более кислые из-за более высокого положительного заряда. С понижением группы снижается способность притягивать электроны и возрастает электроположительный характер. Поэтому элемент становится менее кислотным и более основным вниз по группе.
Я не понял вашего последнего вопроса, но каждый период имеет тенденцию к своей кислотной и основной природе оксидов.

$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Оксид | химическое соединение | Британика
оксид железа
Посмотреть все СМИ
- Ключевые люди:
- Джозеф Пристли
- Похожие темы:
- вода оксид серы глинозем диоксид титана оксидный минерал
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
оксид , любое из большого и важного класса химических соединений, в которых кислород связан с другим элементом. За исключением более легких инертных газов (гелия [He], неона [Ne], аргона [Ar] и криптона [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
И металлы, и неметаллы могут достигать наивысших степеней окисления (т. е. отдавать максимальное количество доступных валентных электронов) в соединениях с кислородом. Щелочные и щелочноземельные металлы, а также переходные и постпереходные металлы (в их низших степенях окисления) образуют ионные оксиды, т. е. соединения, содержащие анион О 2-. Металлы с высокими степенями окисления образуют оксиды, связи которых имеют более ковалентный характер. Неметаллы также образуют ковалентные оксиды, которые обычно имеют молекулярный характер. Плавное изменение типа связи в оксидах от ионных к ковалентным наблюдается по мере того, как периодическая таблица перемещается от металлов слева к неметаллам справа. Такая же вариация наблюдается в реакции оксидов с водой и обусловленном этим кислотно-основном характере продуктов. Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих OH − ион) и образующиеся щелочные растворы, в то время как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. таблицу).
Щелочные и щелочноземельные металлы, а также переходные и постпереходные металлы (в их низших степенях окисления) образуют ионные оксиды, т. е. соединения, содержащие анион О 2-. Металлы с высокими степенями окисления образуют оксиды, связи которых имеют более ковалентный характер. Неметаллы также образуют ковалентные оксиды, которые обычно имеют молекулярный характер. Плавное изменение типа связи в оксидах от ионных к ковалентным наблюдается по мере того, как периодическая таблица перемещается от металлов слева к неметаллам справа. Такая же вариация наблюдается в реакции оксидов с водой и обусловленном этим кислотно-основном характере продуктов. Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих OH − ион) и образующиеся щелочные растворы, в то время как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. таблицу).
| группа 1 | группа 2 | группа 13 | группа 14 | группа 15 | группа 16 | группа 17 | |
|---|---|---|---|---|---|---|---|
Источник: Из W. Robinson, J. Odom, and H. Holtzclaw, Jr., Chemistry: Concepts and Models, DC Heath and Co., 1992. Robinson, J. Odom, and H. Holtzclaw, Jr., Chemistry: Concepts and Models, DC Heath and Co., 1992. | |||||||
| реакция оксидов с водой и кислотно-щелочной характер гидроксидов | Na 2 O дает NaOH (сильное основание) | MgO дает Mg(OH) 2 (слабое основание) | Al 2 O 3 нереагирующий | SiO 2 нереагирующий | P 4 O 10 дает H 3 PO 4 (слабая кислота) | SO 3 дает H 2 SO 4 (сильная кислота) | Кл 2 O 7 дает HClO 4 (сильная кислота) |
| связывание в оксидах | Na 2 O ионный | ионный MgO | Al 2 O 3 ионный | SiO 2 ковалентная | P 4 O 10 ковалентная | СО 3 ковалентный | Cl 2 O 7 ковалентная |
Некоторые органические соединения реагируют с кислородом или другими окислителями с образованием веществ, называемых оксидами. Так, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические эфиры.
Так, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические эфиры.
Оксиды металлов представляют собой твердые кристаллические вещества, содержащие катион металла и анион оксида. Обычно они реагируют с водой с образованием оснований или с кислотами с образованием солей.
Щелочные и щелочноземельные металлы образуют три разных типа бинарных соединений кислорода: (1) оксиды, содержащие оксид-ионы, O 2− , (2) пероксиды, содержащие пероксид-ионы, O 2 2− , которые содержат ковалентные одинарные связи кислород-кислород, и (3) супероксиды, содержащие ионы супероксида, O 2 − , которые также имеют ковалентные связи кислород-кислород, но имеют на один отрицательный заряд меньше, чем ионы перекиси. Щелочные металлы (имеющие степень окисления +1) образуют оксиды M 2 O, пероксиды M 2 O 2 и супероксиды MO 2 . (M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO, и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены нагреванием соответствующего нитрата металла с элементарным металлом.
2МНО 3 + 10M + тепло → 6M 2 O + N 2 Общее получение оксидов щелочноземельных металлов включает нагревание карбонатов металлов.
MCO 3 + тепло → MO + CO 2 Как оксиды щелочных металлов, так и оксиды щелочноземельных металлов являются ионными и реагируют с водой с образованием основных растворов гидроксида металла.
M 2 O + H 2 O → 2MOH (где M = металл группы 1)
(M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO, и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены нагреванием соответствующего нитрата металла с элементарным металлом.
2МНО 3 + 10M + тепло → 6M 2 O + N 2 Общее получение оксидов щелочноземельных металлов включает нагревание карбонатов металлов.
MCO 3 + тепло → MO + CO 2 Как оксиды щелочных металлов, так и оксиды щелочноземельных металлов являются ионными и реагируют с водой с образованием основных растворов гидроксида металла.
M 2 O + H 2 O → 2MOH (где M = металл группы 1)
MO + H 2 O → M(OH) 2 (где M = металл группы 2)
Поэтому эти соединения часто называют основными оксидами. В соответствии со своим основным поведением они реагируют с кислотами в типичных кислотно-щелочных реакциях с образованием солей и воды; например,
М 2 O + 2HCl → 2MCl + H 2 O (где M = металл группы 1). Эти реакции также часто называют реакциями нейтрализации. Наиболее важными основными оксидами являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорном кирпиче и теплоизоляции, и оксид кальция (CaO), также называемый негашеной известью или известью, широко используемый в сталелитейной промышленности и в воде. очищение.
Эти реакции также часто называют реакциями нейтрализации. Наиболее важными основными оксидами являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорном кирпиче и теплоизоляции, и оксид кальция (CaO), также называемый негашеной известью или известью, широко используемый в сталелитейной промышленности и в воде. очищение.
Тщательно изучены периодические тренды оксидов. В любой данный период связь в оксидах прогрессирует от ионной к ковалентной, а их кислотно-основной характер меняется от сильно основного к слабоосновному, амфотерному, слабокислому и, наконец, сильнокислому. Как правило, основность увеличивается вниз по группе (например, в оксидах щелочноземельных металлов BeO < MgO < CaO < SrO < BaO). Кислотность увеличивается с увеличением степени окисления элемента. Например, из пяти оксидов марганца MnO (в котором марганец имеет степень окисления +2) является наименее кислотным, а Mn 2 O 7 (содержащий Mn 7+ ) самый кислый. Оксиды переходных металлов со степенями окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и ионов оксидов. Эти оксиды переходных металлов со степенями окисления +4, +5, +6 и +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород. Как правило, ионные оксиды переходных металлов являются основными. То есть они будут реагировать с водными кислотами с образованием растворов солей и воды; например,
СоО + 2Н 3 О + → Co 2+ + 3H 2 О.
Оксиды со степенями окисления +5, +6 и +7 являются кислыми и реагируют с растворами гидроксида с образованием солей и воды; например,
CrO 3 + 2OH — → CrO 4 2− + H 2 O.
Оксиды со степенью окисления +4 обычно являются амфотерными (от греческого amphoteros, «в обоих направлениях»), что означает, что эти соединения могут вести себя либо как кислоты, либо как основания. Амфотерные оксиды растворяются не только в кислых, но и в основных растворах.
Оксиды переходных металлов со степенями окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и ионов оксидов. Эти оксиды переходных металлов со степенями окисления +4, +5, +6 и +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород. Как правило, ионные оксиды переходных металлов являются основными. То есть они будут реагировать с водными кислотами с образованием растворов солей и воды; например,
СоО + 2Н 3 О + → Co 2+ + 3H 2 О.
Оксиды со степенями окисления +5, +6 и +7 являются кислыми и реагируют с растворами гидроксида с образованием солей и воды; например,
CrO 3 + 2OH — → CrO 4 2− + H 2 O.
Оксиды со степенью окисления +4 обычно являются амфотерными (от греческого amphoteros, «в обоих направлениях»), что означает, что эти соединения могут вести себя либо как кислоты, либо как основания. Амфотерные оксиды растворяются не только в кислых, но и в основных растворах.

 Диоксиды $\ce{CO2}$, $\ce{SiO2}$ и $\ce{GeO2}$ являются кислыми, тогда $\ce{SnO2}$ и $\ce{PbO2}$ имеют амфотерную природу. Среди монооксидов $\ce{CO}$ является нейтральным, $\ce{GeO}$ — явно кислым, а $\ce{SnO}$ и $\ce{PbO}$ — амфотерными.
Диоксиды $\ce{CO2}$, $\ce{SiO2}$ и $\ce{GeO2}$ являются кислыми, тогда $\ce{SnO2}$ и $\ce{PbO2}$ имеют амфотерную природу. Среди монооксидов $\ce{CO}$ является нейтральным, $\ce{GeO}$ — явно кислым, а $\ce{SnO}$ и $\ce{PbO}$ — амфотерными.

Leave A Comment