Запишите уравнение химической реакции между калием и водой
СРОЧНО, напишите названия
Можете помочь пожалуйста.Сколько литров газа получится при взаимодействии 325 г цинка с соляной кислотой?
ПЖЖЖЖЖЖЖЖ ПОМОГИТЕ СРОЧНО. Нитрат цинка реагировал с раствором, содержащим 8 г гидроксида натрия. Какая масса осадка? даю 15 баллов
ПЖЖЖЖЖЖЖЖ ПОМОГИТЕ СРОЧНО. Нитрат цинка реагировал с раствором, содержащим 8 г гидроксида натрия. Какая масса осадка?
Определите количество вещества (в молях) оксида серы (IV), занимающего объем 2,688 л при н. у. В ответ запишите число с точностью до сотых. помогитеее … е
Определите координационное число (КЧ) и координационный полиэдр (КП) атома в простой кубической кладке.КЧЧислокубооктаэдркубтригональная призматетраэд … роктаэдрфигура октаэдр потому что с любым числом и октаэдром частично верно
Сопоставьте свойства твёрдого вещества и тип его структуры. Ионная кристаллическая решётка Металлическая кристаллическая решётка Атомная кристаллическ … ая решётка Молекулярная кристаллическая решётка Аморфное вещество Размягчается при нагревании, прозрачное, не проводит электрический ток Хорошо проводит электрический ток и тепло, ковкое Хорошо растворимо в органическом растворителе, нерастворимо в воде, самовоспламеняется на воздухе, мягкое Высокая температура плавления, твёрдое, не проводит электрический ток, нерастворимо в воде Летучее вещество с резким запахом, хорошо растворимо в воде Низкая температура плавления, ковкое, реагирует с водой, прекрасно проводит электрический ток Высокая температура плавления, без запаха, хорошо растворимо в воде, проводит электрический ток лишь в расплавленном виде ЗАДАЧА ИЗ СИРИУСА ДАЙТЕ ОТВЕТ ПОЖАЛУЙСТА
В молекуле N2 реализуется ковалентная химическая связь с кратностью, равной 3.
1. Какая частица вылетает из ядра при бетта-распаде? a. нейтрон b. фотон c. протон d. электрон 2. Какая из частиц является движущейся в атоме? a. ядр … о b. протон c. нейтрон d. электрон
Верны ли суждения о способах разделения смесей? 1. Бензин разделяют на компоненты с помощью делительной воронки. 2. Действие на смесь магнитом являетс … я физическим способом разделения веществ. А верно только 1 Б верно только 2 В верны оба суждения Г оба суждения неверны
Калий
|
Калий |
|
|---|---|
| Атомный номер |
19 |
| Внешний вид простого вещества |
Серебристо-белый мягкий металл |
| Свойства атома | |
|
Атомная масса |
39,0983 а. |
| Радиус атома |
235 пм |
|
Энергия ионизации (первый электрон) |
418,5 (4,34) кДж/моль (эВ) |
| Электронная конфигурация |
[Ar] 4s1 |
| Химические свойства | |
| Ковалентный радиус |
203 пм |
| Радиус иона |
133 пм |
|
Электроотрицательность (по Полингу) |
0,82 |
| Электродный потенциал |
−2,92 В |
| Степени окисления |
1 |
| Термодинамические свойства простого вещества | |
| Плотность |
0,856 г/см³ |
| Молярная теплоёмкость |
29,6 Дж/(K·моль) |
| Теплопроводность |
79,0 Вт/(м·K) |
| Температура плавления |
336,8 K |
| Теплота плавления |
102,5 кДж/моль |
| Температура кипения |
1047 K |
| Теплота испарения |
2,33 кДж/моль |
| Молярный объём |
45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая объёмноцентрированная |
| Параметры решётки |
5,332 Å |
| Отношение c/a | — |
| Температура Дебая |
100 K |
| K | 19 |
| 39,0983 | |
| 4s1 | |
| Калий | |
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
2Cl− − 2e− → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH− − 4e− → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
Применение калия
-
Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.

- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Фиолетовый цвет пламени ионов калия в пламени горелки
- Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) — используется как удобрение, при варке стекла.
- Хлорид калия (сильвин, «калийная соль») — используется как удобрение.
-
Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.

- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
-
Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).

- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.
Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация различных ферментов.
- Нормализация ритма сердца.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Дополнительная информация
Соединения калия
Щелочные металлы
Натрий, по химическим свойствам очень схожий с калием
Реакции ионного обмена и условия их протекания.
Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
HNO3 + KOH = KNO3 + H2O (1)
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
H+ + NO3− + K+ + OH‑ = K+ + NO3− + H2O (2)
Как можно заметить из уравнения (2), что до реакции, что после в растворе находятся ионы NO3− и K+ . Другими словами, по сути, нитрат-ионы и ионы калия никак не участвовали в реакции. Реакция произошла только благодаря объединению частиц H+ и OH− в молекулы воды. Таким образом, произведя алгебраически сокращение одинаковых ионов в уравнении (2):
Другими словами, по сути, нитрат-ионы и ионы калия никак не участвовали в реакции. Реакция произошла только благодаря объединению частиц H+ и OH− в молекулы воды. Таким образом, произведя алгебраически сокращение одинаковых ионов в уравнении (2):
H+ + NO3− + K+ + OH‑ = K+ + NO3− + H2O
мы получим:
H+ + OH‑ = H2O (3)
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
2HCl+ Ba(OH)2 = BaCl2 + 2H2O
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H+ + 2Cl− + Ba2+ + 2OH− = Ba2+ + 2Cl− + 2H2O
Сократим одинаковые ионы слева и справа и получим:
2H+ + 2OH− = 2H2O
Разделив и левую и правую часть на 2, получим:
H+ + OH− = H2O,
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
практически все органические)).
3) Слабых оcнований (NH4OH и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
2Fe(OH)3+ 3H2SO4 = Fe2(SO4)3 + 6H2O
Гидроксиду железа (III) соответствует в таблице растворимости обозначение «Н», что говорит нам о его нерастворимости, т.е. в ионном уравнении его надо записывать целиком, т.е. как Fe(OH)3 . Серная кислота растворима и относится к сильным электролитам, то есть существует в растворе преимущественно в продиссоциированном состоянии. Сульфат железа (III), как и практически все другие соли, относится к сильным электролитам, и, поскольку он растворим в воде, в ионном уравнении его нужно писать в виде ионов. Учитывая все вышесказанное, получаем полное ионное уравнение следующего вида:
Учитывая все вышесказанное, получаем полное ионное уравнение следующего вида:
2Fe(OH)3 + 6H+ + 3SO42- = 2Fe3+ + 3SO42- + 6H2O
Сократив сульфат-ионы слева и справа, получаем:
2Fe(OH)3 + 6H+ = 2Fe3+ + 6H2O
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na+ + CO32- + Ca2+ + 2Cl− = CaCO3↓+ 2Na+ + 2Cl−
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
CO32- + Ca2+ = CaCO3↓
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
CuS + Fe(NO3)2 ≠ FeS + Cu(NO3)2
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
А вот, например,
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
Cu(OH)2 + Na2S – не протекает,
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
2NaOH + Cu(NO3)2 = Cu(OH)2 ↓+ 2NaNO3
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
Другими словами:
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
K2S + 2HBr = 2KBr + H2S↑
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, NH4OH и H2SO3:
H2CO3 = H2O + CO2 ↑
NH4OH = H2O + NH3 ↑
H2SO3 = H2O + SO2 ↑
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 ↑
NH4NO3 + KOH = KNO3 + H2O + NH3 ↑
Na2SO3 + 2HCl = 2NaCl + H2O + SO2 ↑
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
1) Для реакции:
K2S + 2HBr = 2KBr + H2S↑
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K+ + S2- + 2H+ + 2Br— = 2K+ + 2Br— + H2S↑
Сократив одинаковые ионы получаем:
S2- + 2H+ = H2S↑
2) Для уравнения:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 ↑
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
2Na+ + CO32- + 2H + + SO42- = 2Na+ + SO42 + H2O + CO2 ↑
CO32- + 2H + = H2O + CO2↑
3) для уравнения:
NH4NO3 + KOH = KNO3 + H2O + NH3↑
Молекулы воды и аммиака запишутся целиком, а NH4NO3, KNO3 и KOH запишутся в ионном виде , т. к. все нитраты являются хорошо растворимыми солями, а KOH является гидроксидом щелочного металла, т.е. сильным основанием:
к. все нитраты являются хорошо растворимыми солями, а KOH является гидроксидом щелочного металла, т.е. сильным основанием:
NH4+ + NO3−+ K+ + OH− = K+ + NO3− + H2O + NH3↑
NH4+ + OH− = H2O + NH3↑
Для уравнения:
Na2SO3 + 2HCl = 2NaCl + H2O + SO2 ↑
Полное и сокращенное уравнение будут иметь вид:
2Na+ + SO32- + 2H+ + 2Cl− = 2Na+ + 2Cl− + H2O + SO2 ↑
SO32- + 2H+ = H2O + SO2 ↑
Химия
- Подробности
Просмотров: 18895
8 класс
Готовимся к контрольной работе по теме
«Основные классы неорганических соединений»
Написать уравнения реакций с помощью которых можно осуществить превращения:
Zn → ZnO → ZnCl2 →Zn(OH)2 → ZnO → Zn
1) 2Zn + O2 = 2ZnO реакция соединения
2) ZnO + 2HCl = ZnCl2 + H2O реакция обмена
3) ZnCl2 + 2KOH = Zn(OH)2 + 2KCl реакция обмена
4) Zn(OH)2 = ZnO + H2O реакция разложения
ZnO + H2 = Zn + H2O реакция замещения
Ca → Ca(OH)2 → CaSO4 → BaSO4
1) Ca + 2H2O = Ca(OH)2 + H2↑ реакция замещения
2) Ca(OH)2 + H2SO4 = CaSO4 + 2H2O реакцияобмена
3) CaSO4 + BaCl2 = BaSO4↓ + CaCl2 реакцияобмена
S → SO2 → SO3 → H2SO4→ Na2SO4
1) S + O2 = SO2 реакция соединения
2) 2SO2 + O2 = 2SO3 реакция соединения
3) SO3 + H2O = H2SO4 реакция соединения
4) Na2O + H2SO4 = Na2SO4 + H2O реакцияобмена
C → CO2 → CaCO3 → CO2 → CaCO3 → Ca(NO3)2
1) C + O2 = CO2 реакция соединения
2) CO2 + Ca(OH)2 =CaCO3 + H2O реакция обмена или
CO2 + CaO =CaCO3 реакция соединения
3) CaСO3 + 2HСl = CaCl2 + H2O + CO2↑ реакция обмена
4) см. реакцию №2
реакцию №2
5) CaСO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2↑ реакция обмена
Как работать с цепочками превращений.
Цепочки превращений являются важным механизмом проверки знаний и умений, умению применять их на практике, способствуют развитию логического мышления учащихся.
Разберемся с выполнением подобных заданий на конкретном примере:
Mg → MgO → MgCl2 → Mg(OH)2 → MgO → Mg
Итак, первое задание – исходя из магния, получить оксид магния. Анализируя предложенные вещества, видим, что необходимо металл превратить в оксид металла. Различие между двумя веществами в наличии у оксида магния кислорода. Вспомним свойства металлов. Металлы взаимодействуют с неметаллами, в том числе, и с кислородом. Осталось записать уравнение химической реакции и расставить коэффициенты:
2Mg + O2 = 2MgO
Второе задание – исходя из оксида магния, получить хлорид магния. Анализируем: имеем оксид магния, получаем соль – хлорид магния. Из оксида необходимо получить соль. Вспомним свойства оксидов. Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Хлор входит в состав соляной кислоты, значить записываем уравнение реакции между оксидом магния и соляной кислотой и расставляем коэффициенты:
Анализируем: имеем оксид магния, получаем соль – хлорид магния. Из оксида необходимо получить соль. Вспомним свойства оксидов. Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Хлор входит в состав соляной кислоты, значить записываем уравнение реакции между оксидом магния и соляной кислотой и расставляем коэффициенты:
MgO + 2HCl = MgCl2 + H2O
Третье задание – исходя из хлорида магния, получить гидроксид магния. Анализируем: имеем соль, необходимо получить основание. Вспоминаем свойства солей. Соли взаимодействуют с растворимыми основаниями (щелочами) с образованием нового основания и новой соли. Записываем уравнение реакции:
MgCl2 + 2NaOH = Mg(OH)2 + 2NaCl
Четвертое задание – исходя из гидроксида магния, получить оксид магния. Анализируем: имеем основание, необходимо получить основный оксид. Вспоминаем свойства оснований. Нерастворимые основания при нагревании разлагаются на основный оксид и воду. Записываем уравнение химической реакции термического разложения гидроксида магния:
Записываем уравнение химической реакции термического разложения гидроксида магния:
Mg(OH)2 = MgO + H2O
Пятое задание – исходя из оксида магния, получить чистый металл магний. Анализируем: имеем основный оксид, необходимо получить металл. Вспоминаем свойства основных оксидов. Из оксида металла можно получить чистый металл несколькими способами с помощью восстановителей (C, CO, H2, более активный металл, электролиз). Записываем уравнение химической реакции восстановления металла из его оксида:
MgO + H2 = Mg + H2O
Всё! Задание выполнено!
Вы убедились в том, что если хорошо знаешь свойство классов неорганических веществ, выполнить задания цепочек превращений не представляет труда. Ну а если не знаешь, можно воспользоваться следующей шпаргалкой.
Свойства классов неорганических веществ.
(шпаргалка)
Основные оксиды:
1. Взаимодействуют с кислотными оксидами с образованием соли.
Взаимодействуют с кислотными оксидами с образованием соли.
Пример: CaO + CO2 = CaCO3
2. Взаимодействуют с более активными металлами с образованием нового оксида и металла.
Пример: СuO + Mg = Cu + MgO
3. Взаимодействуют с восстановителями (С, CO, H2) с образованием чистого металла и нового оксида.
Пример: Fe2O3 + 3H2 = 2Fe + 3H2O
4. Взаимодействуют с кислотами с образованием соли и воды.
Пример: CaO + 2HCl = CaCl2 + H2O
5. Взаимодействуют с водой (оксиды щелочных и щелочноземельных металлов) с образованием щелочей.
Пример: Na2O + H2O = 2NaOH
Кислотные оксиды:
1. Взаимодействуют с основными оксидами с образованием соли.
Пример: CaO + CO2 = CaCO3
2. Взаимодействуют с основаниями с образованием соли и воды.
Пример: CO2 + 2NaOH = Na2CO3 + H2O
3. Взаимодействуют с солями, образованными более слабой кислотой с образованием новой соли и нового оксида.
Взаимодействуют с солями, образованными более слабой кислотой с образованием новой соли и нового оксида.
Пример: SO3 + Na2SiO3 = Na2SO4 + SiO2
Основания:
1. Взаимодействуют с кислотными оксидами с образованием соли и воды.
Пример: CO2 + 2NaOH = Na2CO3 + H2O
2. Щелочи взаимодействуют с солями с образованием нового основания и новой соли.
Пример: 2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
3. Взаимодействуют с кислотами с образованием соли и воды.
Пример: NaOH + HCl = NaCl + H2O
Кислоты:
1. Взаимодействуют с металлами, стоящими в ряду активности перед водородом с образованием соли и водорода.
Пример: Zn + 2HCl = ZnCl2 + H2↑
2. Взаимодействуют с основными оксидами с образованием соли и воды.
Пример: CaO + 2HCl = CaCl2 + H2O
3. Взаимодействуют с основаниями с образованием соли и воды.
Пример: NaOH + HCl = NaCl + H2O
4. Взаимодействуют с солями с образованием новой соли и новой кислоты.
Пример: HCl + AgNO3 = AgCl↓ + HNO3
Соли:
1. Взаимодействуют с солями с образованием новых солей.
Пример: BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
2. Взаимодействуют с металлами, если в ряду активности металл стоит перед металлом входящим в состав соли с образованием новой соли и металла.
Пример: CuCl2 + Mg = Cu + MgCl2
3. Взаимодействуют с кислотами с образованием новой соли и новой кислоты.
Пример: HCl + AgNO3 = AgCl↓ + HNO3
4. Взаимодействуют со щелочами с образованием нового основания и новой соли.
Пример: 2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
5. Взаимодействуют с кислотными оксидами, если оксид образует более сильную кислоту с образованием новой соли и нового оксида.
Взаимодействуют с кислотными оксидами, если оксид образует более сильную кислоту с образованием новой соли и нового оксида.
Пример: SO3 + Na2SiO3 = Na2SO4 + SiO2
Выполнить задания:
Осуществите цепочки превращений:
а Sr →SrO → Sr(OH)2,
б Р → Р2О5 → Н3РО4.
Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
1.К2ОАl(OH)3 HNO3 HCl BaO BaSO4 AlPO4 CO2 H3PО4 Fe(OH)2 Ag Cl NaNO3 Al2O3
2. Дана схема превращений. Составьте уравнения реакций.
Cu ® CuO ® CuCl2 → Cu(OH)2 Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать соляная кислота: HCl, CaO, CO2, H2O, Mg, Ba(OH)2. Напишите уравнения осуществимых реакций.
Напишите уравнения осуществимых реакций.
4. Напишите формулы следующих солей: сульфата калия, нитрата бария, карбоната натрия, фосфата кальция, сульфата цинка, сульфида железа (II), хлорида меди (II), силиката калия, сульфита натрия, бромида алюминия, иодида калия, гидрокарбоната магния, дигидрофосфата калия.
Домашнее задание.
9АБВГД
| Железо. Нахождение в природе. Свойства железа. |
* 43 у 1-5 с 135 задача 102 с 136 |
| Оксиды, гидроксиды и соли железа (II) и железа (Ш). |
* 44 у 6-11 з 3-4 с 136 |
91
|
Железо. Нахождение в природе. Свойства железа. Оксиды, гидроксиды и соли железа (II) и железа (Ш). |
* 43 у 1-5 с 135 з 102 с 136 * 44 у 6-11 з 3-4 с 136 |
|
Понятие о металлургии. Способы получения металлов. Проблемы безотходных производств в металлургии и охрана окружающей среды. Сплавы. Вычисления по химическим уравнениям массы, объёма или количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей |
* 45 у 1-4 з 1-3 с 147, * 46- *47 у 5-14 з 4-6с147 |
10АБ
|
Одноосновные предельные карбоновые кислоты. Строение молекул. Функциональная группа. Изомерия и номенклатура. Свойства карбоновых кислот. Реакция этерификации. Краткие сведения о непредельных карбоновых кислотах. Генетическая связь карбоновых кислот с другими классами органических соединений |
**27 -29 у 1-4, 11- 18 с 117-118 З 1 с118 |
111
|
Окислительно–восстановительные реакции |
* 11, записи в тетради |
12АБ
| Металлы побочных подгрупп (Б — групп) периодической системы химических элементов |
** 22 – 27 У 1- 12 с 118 з 1-4 с 118 |
| Оксиды и гидроксиды металлов |
*29 у 16-18 с 118 З 6 с 118 |
Сплавы металлов. Решение расчётных задач. Расчёты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного. Решение расчётных задач. Расчёты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного. |
* 28 у 13- 15 с 118 |
121
|
Генетическая связь неорганических и органических веществ |
* 33 у с 143 |
Пропилат калия, структурная формула, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| Морская вода содержит около 400 частей на миллион калия. Он имеет тенденцию оседать и, следовательно, в основном оседает в осадке. Реки обычно содержат около 2-3 промилле калия. Это различие в основном вызвано высокой концентрацией калия в океанических базальтах. Гранит, богатый кальцием, содержит до 2,5% калия. В воде этот элемент в основном присутствует в виде ионов K + (водн.). 40 K — это радиоактивный изотоп калия в большом количестве в природе. Морская вода содержит естественную концентрацию около 4.5. 10 -5 г / л. Калий быстро и интенсивно реагирует с водой с образованием бесцветного основного раствора гидроксида калия и газообразного водорода в соответствии со следующим механизмом реакции: 2K (s) + 2H 2 O (l) -> 2KOH (водн. Это экзотермическая реакция, и калий нагревается до такой степени, что горит пурпурное пламя.Кроме того, водород, выделяющийся во время реакции, сильно реагирует с кислородом и воспламеняется. Калий реагирует с водой медленнее, чем рубидий, который в периодической таблице находится под калием. Он вступает в реакцию с водой быстрее, чем натрий, который находится выше в периодической таблице. Калий не растворяется в воде, но он реагирует с водой, как было объяснено ранее. Соединения калия могут быть водорастворимыми.Примерами являются дихромат калия с растворимостью в воде 115 г / л, перманганат калия с растворимостью в воде 76 г / л, йодид калия с растворимостью в воде 92 г / л и йодид калия, из которых даже до 1480 г может растворить в одном литре воды. Калий содержится в различных минералах, из которых он может растворяться в результате процессов выветривания. Калий является диетической потребностью практически для любого организма, кроме ряда бактерий, поскольку он играет важную роль в нервных функциях. Калий является нашей диетической потребностью, и мы принимаем около 1-6 г в день при потребности 2-3.5 г в сутки. Общее количество калия в организме человека составляет от 110 до 140 г и в основном зависит от мышечной массы. Мышцы содержат больше всего калия после красных кровяных телец и тканей мозга. Калий можно удалить из воды с помощью обратного осмоса. Литература и другие элементы и их взаимодействие с водой |
Металлический калий реагирует с водой с образованием калия класса 10 по химическому составу CBSE
Подсказка: Реакция является экзотермической, то есть во время реакции выделяется энергия, а также раствор, полученный в результате реакции, является сильно щелочным из-за присутствия гидроксид-иона, происходящего от сильного основания гидроксида калия. Полный пошаговый ответ: Металлический калий очень быстро реагирует с водой с образованием бесцветного раствора гидроксида калия (КОН) и газообразного водорода ($ {{H} _ {2}} $). Водород, выделяющийся во время реакции, воспламеняется быстро. Полученный раствор является щелочным из-за растворенного гидроксида. Реакция экзотермическая. В начале реакции металлический калий становится настолько горячим, что загорается и горит характерным пластинчатым сиреневым цветом. Реакция медленнее, чем у рубидия (непосредственно ниже калия в периодической таблице), но быстрее, чем у натрия (непосредственно выше калия в периодической таблице).Балансная реакция определяется следующим образом —
Реакция медленнее, чем у рубидия (непосредственно ниже калия в периодической таблице), но быстрее, чем у натрия (непосредственно выше калия в периодической таблице).Балансная реакция определяется следующим образом —
\ [2K (s) +2 {{H} _ {2}} O \ to 2KOH (aq) + {{H} _ {2}} (g) \]
All щелочные металлы бурно реагируют с холодной водой. В каждой реакции выделяется газообразный водород и образуется гидроксид металла. Скорость и жестокость реакции возрастают по мере того, как вы спускаетесь по группе. Это показывает, что реакционная способность щелочных металлов возрастает по мере того, как вы опускаетесь в группу 1.
Примечание: Гидроксид калия (КОН) — неорганическое соединение, обычно известное как едкий калий.Это прочная база. Гидроксид калия обычно представляет собой полупрозрачные гранулы, которые становятся липкими при контакте с воздухом, поскольку КОН гигроскопичен.
Вы в одном шаге от ответа!
Подпишитесь бесплатно!
Регистрируясь, вы также получаете доступ к тысячам решенных вопросов, викторин
и загружаемым PDF-файлам БЕСПЛАТНО!
Химия калия (Z = 19) — Chemistry LibreTexts
Калий — это металл группы 1, обозначаемый в периодической таблице как K. В чистом виде калий имеет бело-серебристый цвет, но быстро окисляется на воздухе и тускнеет за считанные минуты, если его не хранить в масле или смазке. Калий необходим для нескольких аспектов жизни растений, животных и человека, поэтому его добывают, производят и потребляют в огромных количествах по всему миру.
В чистом виде калий имеет бело-серебристый цвет, но быстро окисляется на воздухе и тускнеет за считанные минуты, если его не хранить в масле или смазке. Калий необходим для нескольких аспектов жизни растений, животных и человека, поэтому его добывают, производят и потребляют в огромных количествах по всему миру.
Седьмой по распространенности элемент, калий, был открыт и выделен в 1807 году сэром Хамфри Дэви. Важные соединения калия включают гидроксид калия (используется в некоторых очистителях канализации), супероксид калия, \ (KO_2 \), который используется в респираторном оборудовании, и нитрат калия, используемый в удобрениях и пиротехнике.Калий, как и натрий, плавится ниже точки кипения воды (63 ° C) и также менее плотен, чем вода. Как и большинство щелочных металлов, соединения калия придают пламени характерный цвет. В случае 19-го элемента цвет бледно-лиловый. Как и в случае с ионами натрия, присутствие ионов калия в организме необходимо для правильного функционирования многих клеток.
| Атомный номер | 19 |
| Атомная масса | 39.098 г / моль |
| Электроотрицательность | 0,8 |
| Плотность | 0,862 г / см 3 (при 0 o C) (плавает на воде) |
| Точка плавления | 63,65 o С |
| Температура кипения | 773,9 o С |
| Атомный радиус | 227 вечера |
| Ионный радиус | 0.133 (+1) |
| Изотопы | 5 |
| Электронная оболочка | [Ar] 4s 1 |
| Энергия первой ионизации | 418,8 кДж / моль |
| Электродный потенциал | -2,924 |
| Твердость | 0,5 |
| Кристаллическая решетка | объемно-центрированная кубическая |
| Удельная теплоемкость | 0. 741 Дж / г · К 741 Дж / г · К |
| Тепло плавления | 59,591 Дж / г |
| Теплота испарения | 2075 кДж / г |
| Электронная конфигурация | 1 с 2 2 с 2 2 с 6 3 с 2 3 с 6 4 с 1 |
Заметные реакции с фосфором
Калий настолько бурно реагирует с водой, что воспламеняется.Серебристо-белый металл очень мягкий и быстро реагирует с кислородом воздуха. Его химический символ происходит от латинского слова kalium, что означает «щелочь». Его английское название происходит от поташа, который является общим названием соединения, содержащего его.
| Реагент | Реакция | Продукт |
|---|---|---|
| H 2 | начинается медленно примерно при 200 ° C; быстрая выше 300 ° C | KH |
| О 2 | начинается медленно с твердого тела; довольно быстро с жидкостью | К 2 О, К 2 О 2 , КО 2 |
| H 2 O | чрезвычайно сильна и часто приводит к водородно-воздушным взрывам. | КОН, H 2 |
| C (графит) | 150–400 ° С | KC 4 , KC 8 , KC 24 |
| CO | образует нестабильные карбонилы | (KCO) |
| NH 3 | растворяется как K; железо, никель и другие металлы катализируют в газовой и жидкой фазах | КНХ 2 |
| S | расплав в жидком аммиаке | К 2 S, К 2 S 2 , К 2 S 4 |
| F 2 , Класс 2 , Br 2 | от насилия до взрывоопасности | KF, KCl, KBr |
| I 2 | зажигание | КИ |
| CO 2 | встречается легко, но иногда может быть взрывоопасным | СО, К, К 2 СО 3 |
Калий в окружающей среде
Калий имеет 2. 6% по массе в земной коре и встречается в основном в минеральной форме в составе полевых шпатов (группы минералов) и глин. Калий легко вымывается из этих минералов с течением времени и, следовательно, имеет относительно высокую концентрацию и в морской воде (0,75 г / л). Сегодня большая часть мирового калия добывается в Канаде, США и Чили, но изначально монополизировалась Германией.
6% по массе в земной коре и встречается в основном в минеральной форме в составе полевых шпатов (группы минералов) и глин. Калий легко вымывается из этих минералов с течением времени и, следовательно, имеет относительно высокую концентрацию и в морской воде (0,75 г / л). Сегодня большая часть мирового калия добывается в Канаде, США и Чили, но изначально монополизировалась Германией.
Калий и живые организмы
Растения, животные и люди — все зависит от калия для выживания и хорошего здоровья.Этот элемент входит в состав многих жидкостей организма и поддерживает связанные с ним функции человеческого тела. В частности, калий помогает нервным функциям и содержится в нескольких типах клеток (включая скелетные клетки, клетки гладкой мускулатуры, эндокринные клетки, сердечные клетки и центральные нейроны). Для здорового роста растениям необходим калий. Калий, содержащийся в экскрементах животных и мертвых растениях, легко связывается с глиной в почве, на которую они падают, и, таким образом, используется растениями. Этот элемент помогает поддерживать осмотическое давление и размер клеток, а также играет роль в фотосинтезе и производстве энергии.
Этот элемент помогает поддерживать осмотическое давление и размер клеток, а также играет роль в фотосинтезе и производстве энергии.
Приложения
95% произведенного калия используется в удобрениях, а остальная часть используется для производства определенных соединений калия, таких как гидроксид калия (\ (KOH \)), который затем может быть превращен в карбонат калия (\ (K_2CO_3 \)). Карбонат калия используется в производстве стекла, а гидроксид калия содержится в жидком мыле и моющих средствах. Хлорид калия используется во многих фармацевтических препаратах, а другие соли калия используются в выпечке, фотографии, дублении кожи и йодированной соли.В этих случаях калий используется в качестве отрицательного аниона.
Калий можно получить с помощью различных известных реакций, каждая из которых требует термической обработки:
\ [K_2CO_3 + 2C \ overset {\ Delta} {\ longrightarrow} 3CO + 2K \ label {1} \]
\ [2KCl + CaC_2 \ overset {\ Delta} {\ longrightarrow} CaCl_2 + 2C + K \ label {2} \]
\ [2KN_3 \ overset {\ Delta} {\ longrightarrow} 3N_2 + 2K \ label {3} \]
Эти процессы коммерчески непригодны из-за затрат. Поэтому элемент обычно получают путем восстановления при повышенных температурах (т.е.э., пирометаллургия). Натрий часто сочетается с \ (KCl \), \ (KOH \) или \ (K_2CO_3 \) для производства калийно-натриевых сплавов, а в 1950-х годах компания Mine Safety Appliances разработала процесс восстановления, который дает калий высокой чистоты:
Поэтому элемент обычно получают путем восстановления при повышенных температурах (т.е.э., пирометаллургия). Натрий часто сочетается с \ (KCl \), \ (KOH \) или \ (K_2CO_3 \) для производства калийно-натриевых сплавов, а в 1950-х годах компания Mine Safety Appliances разработала процесс восстановления, который дает калий высокой чистоты:
\ [KCl + Na \ overset {\ Delta} {\ longrightarrow} K + NaCl \ label {4} \]
Реакция нагревается в специальном устройстве, оборудованном печью, теплообменными трубами, ректификационной колонной, загрузкой \ (KCl \), системой удаления отходов и системой конденсации пара.Поскольку реакция быстро достигает равновесия, калий можно непрерывно удалять как продукт, чтобы сместить равновесие вправо и произвести на его месте еще больше калия.
Сплавы калия включают \ (NaK \) (натрий) и \ (KLi \) (литий). Оба этих сплава производят металлы с низким давлением пара и температурой плавления.
Список литературы
- Чиу, Куен-Вай, «Калий».
 Энциклопедия химической технологии Кирка-Отмера . John Wiley & Sons, Inc.2005.
Энциклопедия химической технологии Кирка-Отмера . John Wiley & Sons, Inc.2005. - Фрейлих, Марк и Ричард Петерсоны. «Соединения калия». Кирк — Othermer Энциклопедия химической технологии. John Wiley & Sons, Inc., 2000.
- Руководство по предметам библиотеки университета UCD, Комбинированный химический словарь. «Калий». Chem Net Base.
Проблемы
- Почему калий никогда не бывает чистым в природе?
- Запишите химическую реакцию между калием и водой.
- Назовите 3 применения калия.
- Где находится калий в периодической таблице. Какие несколько вещей вы можете вывести прямо из этого места?
- Назовите распространенный сплав калия. Какие полезные свойства у этого сплава?
ответы
- Он слишком реактивный. Калий является очень сильным восстановителем из-за его желания получить электронную конфигурацию инертного газа (как и другие щелочные металлы).
 Это означает, что он легко откажется от электронов, давая ему возможность восстанавливать множество других элементов.
Это означает, что он легко откажется от электронов, давая ему возможность восстанавливать множество других элементов. - \ (K + H_2O \ rightarrow KOH + H_ {2 (g)} \): Как и другие металлы группы 1, калий легко реагирует с водой с образованием газообразного водорода.
- Калий используется в производстве стекла, содержится в удобрениях и мыле.
- Калий находится в первой группе и является 4-м элементом в нижнем столбце. Это говорит нам о том, что это щелочной металл. Он очень реактивен, имеет низкую плотность и является хорошим восстановителем.
- Калий может образовывать сплав с \ (Na \), который имеет низкое давление пара и температуру плавления.
Неорганическая химия. Реакция калия с водой
Реакция идет следующим образом:
Относительно свободные электроны калия восстанавливают воду:
$$ \ ce {2 e- + 2 h3O -> h3 + 2 OH -} \ tag {1} $$
Остается положительно заряженный металл.
Жидкий аммиак при воздействии щелочного металла реагирует с электронами намного медленнее, чем вода, образуя темно-синий раствор сольватированных электронов. Поскольку электроны постепенно выталкивают протоны из аммиака, образуя водород, раствор, наконец, превращается в бесцветный раствор NaNh3.{(n-m) +} + m K +} \ tag {2} $$
Поскольку электроны постепенно выталкивают протоны из аммиака, образуя водород, раствор, наконец, превращается в бесцветный раствор NaNh3.{(n-m) +} + m K +} \ tag {2} $$
образует раствор $ \ ce {KOH} $ в виде смеси гидратированных ионов $ \ ce {K + + OH -} $
Но тяжелые ионы калия не могут поспевать за легкими и быстрыми электронами, и капля расплавленного металла постепенно приобретает положительный заряд и, наконец, заканчивается — как называют это авторы — кулоновским взрывом.
Водород в конечном итоге воспламеняется от микросвет из-за нестабильности заряда еще до взрыва. Как «Терминатор Т1000», шипы жидкого металла в конечном итоге пробивают изолирующий пар + водородный слой, вступая в контакт с горючей водородно-воздушной смесью.
Это было недавно теоретически предсказано с помощью моделирования квантовой химии для нескольких десятков щелочных атомов чешским химиком Павлом Юнгвиртом И Кол. Chemistryworld — объяснение взрыва щелочного металла
Они экспериментально подтвердили это с помощью высокоскоростной камеры со скоростью 10000 кадров в секунду, используя натрий-калиевый сплав, образующий эвтектику с низкой температурой плавления.
Я знал это из интервью по научно-популярной радиопередаче, найдя на это обратную ссылку.
См. Также их статью в Nature (о которой я забыл и нашел позже):
Кулоновский взрыв на ранних стадиях реакции щелочных металлов с водой
Аннотация Щелочные металлы могут взрывоопасно реагировать с водой, и из хрестоматий известно, что такое бурное поведение является результатом выделения тепла, образования пара и воспламенения образующегося газообразного водорода.Здесь мы предполагаем, что первоначальный процесс, приводящий к взрыву щелочного металла в воде, имеет, однако, совершенно иную природу. Получение изображений с помощью высокоскоростной камеры жидких капель сплава натрия и калия в воде выявляет субмиллисекундные образования металлических шипов, которые выступают из поверхности капли. Моделирование молекулярной динамики демонстрирует, что при погружении в воду происходит почти немедленное высвобождение электронов с поверхности металла.
Таким образом, система быстро достигает предела нестабильности Рэлея, что приводит к «кулоновскому взрыву» капли щелочного металла.Следовательно, образуется новая металлическая поверхность, контактирующая с водой, что объясняет, почему реакция не затухает за счет ее продуктов, а скорее может привести к взрывному поведению.
РЕАКЦИИ ЭЛЕМЕНТОВ ГРУППЫ 1 С ВОДОЙ На этой странице рассматриваются реакции элементов группы 1 — лития, натрия, калия, рубидия и цезия — с водой.Он использует эти реакции для изучения тенденции реактивности в Группе 1. Факты Общие Все эти металлы бурно или даже взрывно реагируют с холодной водой. В каждом случае раствор гидроксида металла получают вместе с газообразным водородом. Это уравнение применимо к любому из этих металлов и воды — просто замените X на нужный символ. В каждом из следующих описаний я предполагаю, что очень маленький кусок металла упал в воду в довольно большом контейнере. Детали для отдельных металлов Литий Литийпо плотности примерно вдвое меньше плотности воды, поэтому он плавает на поверхности, слегка шипит и выделяет водород. Он постепенно вступает в реакцию и исчезает, образуя бесцветный раствор гидроксида лития. При реакции выделяется тепло слишком медленно, а температура плавления лития слишком высока для его плавления (см. Натрий ниже). Натрий Натрий также плавает на поверхности, но выделяется достаточно тепла, чтобы расплавить натрий (натрий имеет более низкую температуру плавления, чем литий, и реакция выделяет тепло быстрее), и он плавится почти сразу, образуя маленький серебристый шар, который разбегается по поверхности. поверхность.Белый след гидроксида натрия виден в воде под натрием, но вскоре он растворяется, образуя бесцветный раствор гидроксида натрия. Натрий движется, потому что его выталкивает водород, выделяющийся во время реакции. Если натрий застрянет сбоку емкости, водород может загореться и загореться оранжевым пламенем. Цвет обусловлен загрязнением обычно синего водородного пламени соединениями натрия. Калий Калий ведет себя скорее как натрий, за исключением того, что реакция идет быстрее и выделяется достаточно тепла, чтобы осветить водород.На этот раз обычное водородное пламя загрязнено соединениями калия, поэтому оно окрашено в сиреневый (слегка голубовато-розовый) цвет. Рубидий Рубидий плотнее воды и тонет. Он реагирует бурно и немедленно, все снова выплевывает из контейнера. Образуется раствор гидроксида рубидия и водород. Цезий Цезий взрывается при контакте с водой, вполне возможно, что контейнер разрушится.Образуются гидроксид цезия и водород Сводка динамики реактивности Металлы Группы 1 становятся более активными по отношению к воде по мере того, как вы спускаетесь по Группе. Объяснение тенденции реактивности Анализ изменений энтальпии для реакций Общее изменение энтальпии Вы можете подумать, что, поскольку реакции становятся более драматичными по мере того, как вы спускаетесь по группе, количество выделяемого тепла увеличивается по мере того, как вы переходите от лития к цезию.Не так! В таблице приведены оценки изменения энтальпии для каждого из элементов, вступающих в реакцию: | |||||||||||||||||||||||||||||
Примечание: Это то же уравнение, что и раньше, но я разделил его на два, чтобы показать изменение энтальпии на моль реагирующего металла. | |||||||||||||||||||||||||||||
Вы увидите, что в этих значениях нет никакого шаблона . | |||||||||||||||||||||||||||||
Примечание: Мне не удалось подтвердить эти цифры, за исключением количества лития. Для лития, натрия и калия они рассчитаны на основе информации, содержащейся в книге данных Nuffield Advanced Science Book of Data (стр. 114 моего издания 1984 года). Ценность лития почти полностью совпадает со значением, которое я нашел во время поиска в Интернете.Значения для рубидия и цезия вычисляются косвенно из значений Li, Na и K и другой информации, которую вы найдете в следующей таблице на этой странице. | |||||||||||||||||||||||||||||
Копаться в изменениях энтальпии Когда происходят эти реакции, разница между ними полностью заключается в том, что происходит с присутствующими атомами металла. В каждом случае вы начинаете с атомов металла в твердом теле и заканчиваете ионами металлов в растворе. В целом, с металлом происходит следующее: Вы можете рассчитать общее изменение энтальпии для этого процесса, используя закон Гесса и разбив его на несколько этапов, для которых нам известны изменения энтальпии. Во-первых, вам нужно будет подать энергию распыления , чтобы получить газообразные атомы металла. Затем ионизируйте металл путем подачи его первой энергии ионизации . И, наконец, вы получите энтальпию гидратации , высвобождаемую, когда газообразный ион вступает в контакт с водой. | |||||||||||||||||||||||||||||
Примечание: Нет никаких предположений, что реакция действительно происходит по этому пути. Все, что мы делаем, — это изобретаем воображаемый маршрут от начальной до конечной точки реакции и используем закон Гесса, чтобы сказать, что общее изменение энтальпии будет точно таким же, как мы можем рассчитать, используя этот воображаемый маршрут.  Если вы не знаете о законе Гесса, вы, вероятно, в любом случае вряд ли поймете смысл всей этой части страницы. Если вас не устраивают изменения энтальпии, вы можете изучить раздел «Энергетика» в Chemguide или мою книгу расчетов по химии. Если вы не знаете о законе Гесса, вы, вероятно, в любом случае вряд ли поймете смысл всей этой части страницы. Если вас не устраивают изменения энтальпии, вы можете изучить раздел «Энергетика» в Chemguide или мою книгу расчетов по химии. | |||||||||||||||||||||||||||||
Если мы поместим значения для всех этих шагов в таблицу, они будут выглядеть следующим образом (все значения в кДж / моль):
| |||||||||||||||||||||||||||||
Примечание: Помните, что это не общие изменения энтальпии реакций, когда металл реагирует с водой.  Они предназначены только для той части реакции, в которой участвует металл. С присутствующей водой также происходят изменения — она превращается в газообразный водород и ионы гидроксида. Чтобы получить изменения общей энтальпии, вам также необходимо добавить эти значения. Они предназначены только для той части реакции, в которой участвует металл. С присутствующей водой также происходят изменения — она превращается в газообразный водород и ионы гидроксида. Чтобы получить изменения общей энтальпии, вам также необходимо добавить эти значения. Однако изменения из-за воды будут одинаковыми для каждой реакции — в каждом случае около -382 кДж / моль. Добавление этого к цифрам в этой таблице дает значения из предыдущей с точностью до одного-двух кДж. Значения рубидия и цезия будут точно совпадать, потому что именно так я рассчитал их в первой таблице.Остальные три в предыдущей таблице были рассчитаны на основе информации из другого источника. | |||||||||||||||||||||||||||||
Так почему же в этих значениях нет никакой закономерности? Если вы посмотрите на различные фрагменты информации, вы обнаружите, что по мере того, как вы спускаетесь по группе, каждый из них уменьшается:
Происходит то, что различные факторы падают с разной скоростью. Это разрушает любой общий шаблон. Тем не менее, можно еще раз взглянуть на таблицу и найти шаблон, который является полезным для . Рассмотрим энергии активации реакций Давайте возьмем последнюю таблицу и просто рассмотрим термины ввода энергии — два процесса, в которых вы должны подавать энергию, чтобы они работали.
Теперь вы можете видеть, что по мере того, как вы спускаетесь вниз по Группе, наблюдается неуклонное падение.Когда вы переходите от лития к цезию, вам нужно вкладывать меньше энергии в реакцию, чтобы образовался положительный ион. Чем ниже энергия активации, тем быстрее реакция. Итак, хотя литий выделяет больше всего тепла во время реакции, он делает это относительно медленно — не весь он выделяется за один короткий резкий всплеск.Цезий, с другой стороны, имеет значительно более низкую энергию активации, и поэтому, хотя он не выделяет столько тепла в целом, он делает это очень быстро — и вы получаете взрыв. | |||||||||||||||||||||||||||||
Примечание: Вы должны быть осторожны, говоря это! Вы, вероятно, не заметили, как я использую фразу «Это будет , связанный с , энергия активации реакции». Переписывая его, я сделал ударение на словах «связанных с». Реакция определенно не будет включать в себя именно те энергетические термины, о которых мы говорим. Металл не будет сначала превращаться в атомы газа , которые затем теряют электрон. Однако другие процессы , высвобождающие энергию, могут происходить в одно и то же время — например, если атом металла теряет электрон, что-то почти наверняка улавливает его одновременно.Электрон никогда не будет полностью свободным. Это приведет к уменьшению высоты реального энергетического барьера активации. Значения, которые мы вычислили путем сложения энергий атомизации и ионизации, очень велики с точки зрения энергии активации, и реакции были бы чрезвычайно медленными, если бы они были реальными. | |||||||||||||||||||||||||||||
Обобщая причину увеличения реактивности при спуске по группе Реакции становятся легче, поскольку энергия, необходимая для образования положительных ионов, падает.Частично это связано с уменьшением энергии ионизации при переходе вниз по группе, а частично — с падением энергии атомизации, отражающим более слабые металлические связи при переходе от лития к цезию. Это приводит к более низким энергиям активации и, следовательно, более быстрым реакциям. | |||||||||||||||||||||||||||||
Примечание: Если вы студент уровня A в Великобритании, вы почти наверняка обнаружите, что экзаменаторы будут ожидать, что вы объясните это только в терминах падения энергии ионизации по мере того, как вы спускаетесь по группе.Другими словами, они упрощают ситуацию, игнорируя вклад энергии атомизации. Придерживайтесь ожиданий экзаменаторов — не усложняйте себе жизнь! Я стараюсь быть максимально строгим, потому что значительная часть моей аудитории работает в системах за пределами Великобритании или выше уровня A. | |||||||||||||||||||||||||||||
В меню Группы 1.. . В меню «Неорганическая химия». . . В главное меню. . . © Джим Кларк 2005 (изменено в феврале 2015 г.) | |||||||||||||||||||||||||||||
Когда металлический калий помещается в воду, большое количество энергии выделяется в виде гидроксида калия и газообразного водорода в реакции 2 K (s) + 2 H 2 O (l) KOH (водн.) + H 2 ( грамм ) . Ваш партнер по лаборатории говорит, что это окислительно-восстановительная реакция, и
Вопрос:
Когда металлический калий помещается в воду, в реакции выделяется большое количество энергии, так как гидроксид калия и газообразный водород
{eq} 2K (s) + 2H_2O (l) \ rightarrow KOH (водный) + H_2 (g) {/ экв}.
Ваш партнер по лаборатории говорит, что это окислительно-восстановительная реакция и реакция горения. Вы согласны? Защитите свой ответ, объяснив, соответствует ли он требованиям каждого типа реакции.
Редокс-реакция:
Когда два или более атомов химической реакции претерпевают изменения в степени окисления во время образования продукта, это называется окислительно-восстановительной реакцией. Слово «окислительно-восстановительный потенциал» означает сочетание процессов окисления (потеря электронов) и восстановления (усиление электронов), потому что эта реакция включает перенос электронов между затронутыми атомами.
Ответ и пояснение: 1
Данное уравнение реакции:
{eq} 2K (s) + 2H_2O (l) \ rightarrow KOH (водный) + H_2 (g) {/ экв}.
Чтобы подтвердить, является ли это окислительно-восстановительной реакцией, нам нужно присвоить степени окисления всем атомам в соответствии со следующими правилами:
- Нейтральный элемент сам по себе в стандартном состоянии имеет нулевую степень окисления.
- Сумма степеней окисления нейтральной молекулы должна быть равна нулю.
- Сумма степеней окисления иона равна чистому заряду иона.
- В составном или простом ионе: металлы 1-й группы всегда +1, металлы 2-й группы всегда +2.
- В соединении: другие металлы (не группы 1 или 2) предпочитают положительную степень окисления.
- В составе: водород предпочитает +1, кислород предпочитает -2, фтор предпочитает -1.
- В соединении с без кислорода другие галогены также предпочтут -1.
Со стороны реагента:
{экв} K: \ K = ноль \\ H_2O: \ H = +1, O = -2 {/ экв}
Со стороны продукта:
{экв} КОН: \ K = +1, O = -2, H = +1 \\ H_2: \ H = ноль {/ eq}
Есть изменения в степени окисления для двух присутствующих атомов, так что это — это окислительно-восстановительная реакция.Это , а не реакция горения, потому что для этого типа реакции конкретно требуется, чтобы одним из реагентов был газообразный (двухатомный) кислород.
Реакции щелочных металлов с водой — Группа 1 — щелочные металлы — GCSE Chemistry (Single Science) Revision — Other
Все щелочные металлы бурно реагируют с холодной водой. В каждой реакции выделяется газообразного водорода и образуется гидроксид металла .Скорость и сила реакции возрастает на по мере того, как вы спускаетесь по группе. Это показывает, что реакционная способность щелочных металлов возрастает по мере того, как вы спускаетесь в группу 1.
Литий
Когда литий добавляется в воду, литий всплывает. Он постоянно шипит и становится меньше, пока в конце концов не исчезнет.
- литий + вода → гидроксид лития + водород
- 2Li (s) + 2H 2 O (л) → 2LiOH (водн.) + H 2 (г)
Натрий
При добавлении натрия к В воде натрий плавится, образуя шар, который движется по поверхности.Он быстро шипит, и образовавшийся водород может загореться оранжевым пламенем, прежде чем натрий исчезнет.
- натрий + вода → гидроксид натрия + водород
- 2Na (s) + 2H 2 O (л) → 2NaOH (водн.) + H 2 (г)
Калий
При добавлении калия к вода, металл плавится и плавает. Он очень быстро перемещается по поверхности воды. Водород мгновенно воспламеняется. Металл тоже загорелся, с искрами и сиреневым пламенем.Иногда в конце реакции происходит небольшой взрыв.
- калий + вода → гидроксид калия + водород
- 2K (s) + 2H 2 O (l) → 2KOH (вод.) + H 2 (г)
Сильные щелочи
Гидроксиды, образующиеся в все эти реакции растворяются в воде с образованием щелочных растворов. Эти растворы становятся универсальными индикаторами пурпурного цвета, показывая, что они сильно щелочные Share This Story, Choose Your Platform!

 е. м. (г/моль)
е. м. (г/моль)
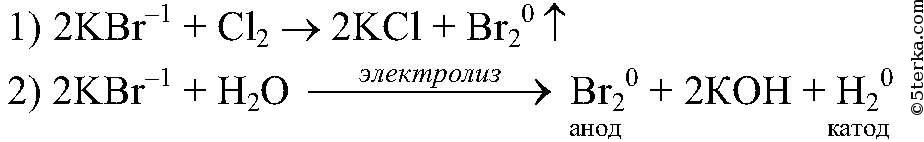
 ) + H 2 (g)
) + H 2 (g) Примерами являются полевые шпаты (ортоклаз и микроклин), которые, однако, не очень важны для производства соединений калия, и хлорные минералы карналит и сильвит, которые наиболее подходят для производственных целей.Некоторые глинистые минералы содержат калий. В результате естественных процессов он попадает в морскую воду, где в основном оседает в отложениях.
Примерами являются полевые шпаты (ортоклаз и микроклин), которые, однако, не очень важны для производства соединений калия, и хлорные минералы карналит и сильвит, которые наиболее подходят для производственных целей.Некоторые глинистые минералы содержат калий. В результате естественных процессов он попадает в морскую воду, где в основном оседает в отложениях.  Другие соединения калия применяются при производстве жидкого мыла, добавляются в лекарства или настои, применяются в фотографии или при дублении. В большинстве случаев активным ингредиентом является не калий, а соседний анион. Это также относится к применению хлората калия в спичках и фейерверках, а также к нитрату калия в порошке.Квасцы калия являются основой для бумажного клея и применяются в качестве наполнителя синтетического каучука.
Другие соединения калия применяются при производстве жидкого мыла, добавляются в лекарства или настои, применяются в фотографии или при дублении. В большинстве случаев активным ингредиентом является не калий, а соседний анион. Это также относится к применению хлората калия в спичках и фейерверках, а также к нитрату калия в порошке.Квасцы калия являются основой для бумажного клея и применяются в качестве наполнителя синтетического каучука.  Соединения калия могут попадать в сточные воды с мочой. Необычное применение хлорида калия — увеличение количества дождя в засушливых регионах. Он выпускается с самолетов чуть ниже облаков, поднимается вверх и удваивает количество влаги в облаках, в результате чего дождь становится сильнее.
Соединения калия могут попадать в сточные воды с мочой. Необычное применение хлорида калия — увеличение количества дождя в засушливых регионах. Он выпускается с самолетов чуть ниже облаков, поднимается вверх и удваивает количество влаги в облаках, в результате чего дождь становится сильнее.  Следовательно, в сельскохозяйственные почвы часто добавляют калийные удобрения. Растения содержат в среднем около 2% калия (по сухой массе), но значения могут варьироваться от 0,1 до 6,8%. Личинки комаров содержат от 0,5 до 0.6% калия, а жуки содержат от 0,6 до 0,9% калия (по сухой массе). Соли калия могут убивать растительные клетки из-за высокой осмотической активности.
Следовательно, в сельскохозяйственные почвы часто добавляют калийные удобрения. Растения содержат в среднем около 2% калия (по сухой массе), но значения могут варьироваться от 0,1 до 6,8%. Личинки комаров содержат от 0,5 до 0.6% калия, а жуки содержат от 0,6 до 0,9% калия (по сухой массе). Соли калия могут убивать растительные клетки из-за высокой осмотической активности.  Однако он не имеет класса радиотоксичности из-за своего природного происхождения. Всего существует двенадцать нестабильных изотопов калия.
Однако он не имеет класса радиотоксичности из-за своего природного происхождения. Всего существует двенадцать нестабильных изотопов калия. Отношение натрия к калию раньше составляло 1:16, а теперь составляет около 3: 1, что в основном предотвращает высокое поглощение натрия.
Отношение натрия к калию раньше составляло 1:16, а теперь составляет около 3: 1, что в основном предотвращает высокое поглощение натрия.  Карбонат калия смертелен для взрослых в дозах выше 15 г. То же самое касается 1 г тартрата калия и 50 мг цианида калия. Дихромат калия является смертельным в количестве от 6 до 8 г, а 30 г нитрата калия вызывают тяжелую интоксикацию, которая может привести к смерти. Из-за его сильного коррозионного механизма концентрации гидроксида калия от 10 до 12 мл в 15% каустике могут быть смертельными. Перманганат калия применяется в отбеливателях и дезинфекционных средствах, и его количество смертельно составляет от 5 до 8 г.
Карбонат калия смертелен для взрослых в дозах выше 15 г. То же самое касается 1 г тартрата калия и 50 мг цианида калия. Дихромат калия является смертельным в количестве от 6 до 8 г, а 30 г нитрата калия вызывают тяжелую интоксикацию, которая может привести к смерти. Из-за его сильного коррозионного механизма концентрации гидроксида калия от 10 до 12 мл в 15% каустике могут быть смертельными. Перманганат калия применяется в отбеливателях и дезинфекционных средствах, и его количество смертельно составляет от 5 до 8 г. Обычно это превышает БПК. Дихромат калия применяется для определения ХПК.
Обычно это превышает БПК. Дихромат калия применяется для определения ХПК. Энциклопедия химической технологии Кирка-Отмера . John Wiley & Sons, Inc.2005.
Энциклопедия химической технологии Кирка-Отмера . John Wiley & Sons, Inc.2005. Таким образом, система быстро достигает предела нестабильности Рэлея, что приводит к «кулоновскому взрыву» капли щелочного металла.Следовательно, образуется новая металлическая поверхность, контактирующая с водой, что объясняет, почему реакция не затухает за счет ее продуктов, а скорее может привести к взрывному поведению.
Таким образом, система быстро достигает предела нестабильности Рэлея, что приводит к «кулоновскому взрыву» капли щелочного металла.Следовательно, образуется новая металлическая поверхность, контактирующая с водой, что объясняет, почему реакция не затухает за счет ее продуктов, а скорее может привести к взрывному поведению.

 Все они довольно похожи, и, что удивительно, литий — это металл, который выделяет больше всего тепла во время реакции!
Все они довольно похожи, и, что удивительно, литий — это металл, который выделяет больше всего тепла во время реакции!
 Оно уменьшается по мере того, как атом становится больше, а металлическая связь удлиняется.Делокализованные электроны находятся дальше от притяжения ядер в более крупных атомах.
Оно уменьшается по мере того, как атом становится больше, а металлическая связь удлиняется.Делокализованные электроны находятся дальше от притяжения ядер в более крупных атомах. Другими словами, мы упустим член энтальпии гидратации и просто сложим два других.
Другими словами, мы упустим член энтальпии гидратации и просто сложим два других. Эта энергия будет восстановлена позже (а также намного больше!), Но должна быть подана изначально. Это будет связано с энергией активации реакции.
Эта энергия будет восстановлена позже (а также намного больше!), Но должна быть подана изначально. Это будет связано с энергией активации реакции. Но в какой-то момент атомам придется оторваться от металлической структуры, и им придется потерять электроны.
Но в какой-то момент атомам придется оторваться от металлической структуры, и им придется потерять электроны.
Leave A Comment