Кристаллическая решетка алмаза и его свойства
В этой статье:
- Формы углерода и их кристаллические решетки
- Аллотропные модификации камня
- Синтетические алмазы
- Свойства алмазов
Алмаз является красивым минералом, а после огранки в виде бриллианта ценится любителями ювелирных украшений. Но не все знают, что скрывается в составе этого вещества, в чем заключается секрет его популярности, а также почему камень является действительно уникальным? В этих вопросах поможет разобраться кристаллическая решетка алмаза, его химический состав и свойства камня.
Формы углерода и их кристаллические решетки
Если описывать строение решетки, то можно использовать атомный и молекулярный типы вещества. Правда, такого понятия, как молекула углерода, в природе не существует, поэтому можно говорить только об атомном типе строения. Именно атом, а не молекула, лежит в основе решетки и образует соединения между остальными атомами.
Структура алмаза
А говоря о химических модификациях углерода, то ученые в конце восьмидесятых годов ХХ века вывели такое понятие, как фуллерен. Это шестидесятиатомная молекула, которая внешне напоминает строением футбольный мяч. Позже обнаружили молекулу фуллерена, которая имела еще больше атомов в своем составе. Это помогло исследовать графит, а также другие модификации углерода с использованием лазерного спектра.
Кристаллическая решетка рассматривает строение вещества с точки зрения соединения атомов элемента между собой. Существует несколько типов связи:
- ионная;
- ковалентная;
- металлическая;
- водородная.
В данном случае алмаз имеет ковалентные связи, которые образуются между одинаковыми атомами и считаются самыми прочными в химии. Алмаз является чистой кристаллической модификацией углерода, а его кристаллическая решетка имеет форму куба. Это самая плотная упаковка атомов, которая существует.
Если выражаться по-научному, то минерал кристаллизуется в кубической сингонии.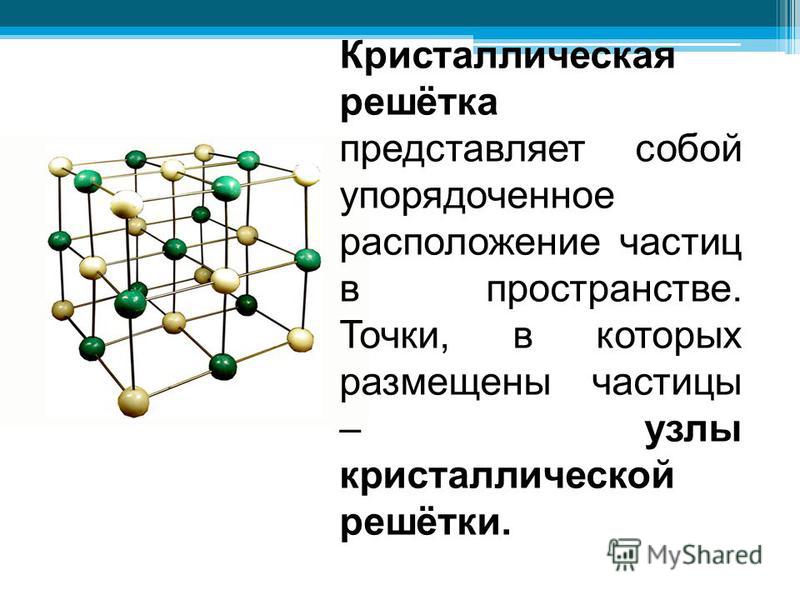 Соответственно, в каждой вершине куба располагается атом углерода, а гранями куба выступают ковалентные связи. При этом в центре каждой грани размещено еще по одному атому углерода, которые также связаны между собой.
Соответственно, в каждой вершине куба располагается атом углерода, а гранями куба выступают ковалентные связи. При этом в центре каждой грани размещено еще по одному атому углерода, которые также связаны между собой.
Форма кристаллической решетки изображается схематически, потому что точно неизвестно из скольких кубов состоит целостный алмаз. Но именно благодаря такому расположению атомов камень и является самым твердым минералом на планете.
Аллотропные модификации камня
Если химический состав алмаза — углерод в чистом виде, то стоит выяснить, что это за элемент, а также разобраться в его модификациях и физических формах. Согласно мнению ученых, это вещество изначально входило в газовое облако, из которого постепенно образовывались планеты. Так или иначе, в составе каждой из планет Солнечной системы присутствует углерод в каком-то агрегатном состоянии.
Если говорить о земной коре, то она на 0,14% состоит из этого неметаллического элемента. А также по одной из теорий происхождения человека считается, что углерод — один из четырех макроэлементов, являющихся «стройматериалом» тела.
- алмаз — наиболее дорогая форма;
- графит — известное вещество, которое используется в промышленности;
- карбин;
- лонсдейлит — содержится в метеоритах;
- фуллерены — наиболее молодые формы, которые были открыты;
- углеродные нанотрубки — применяются в каркасах к наноизделиям;
- графен;
- уголь — вещество, которое используется в качестве промышленного сырья для получения тепла;
- сажа.
Казалось бы, что общего может быть у кристально чистого алмаза с графитом или углем? А вот состав этих веществ говорит об обратном и наглядно демонстрирует важность расположения атомов в кристаллической решетке. Притом, что кроме углерода, в веществах ничего нет.
Вполне реально, что кроме этих элементов, существуют другие не открытые формы. А их исследование во многом зависит от алмазов, поскольку во время работы с этим драгоценным камнем ученые пытаются расшифровать его структуру, чтоб производить искусственно, и, вместе с тем, находят новые модификации элемента.
Исходя из структуры алмаза, можно сделать вывод, что камень абсолютно прозрачен и пропускает весь видимый спектр через себя. Но ничего идеального в природе не существует. Поэтому даже у такого кристалла могут быть примеси в решетке. Если рассматривать наиболее чистые экземпляры камня, то там содержится до 1018 атомов на 1 кубический сантиметр. И это нормальное явление, поскольку количество примесей зависит от процессов, в которых рос камень. И не факт, что посторонние вещества будут видны невооруженным глазом.
Среди примесей встречаются такие элементы, как:
- азот;
- кремний;
- кальций;
- магний;
- бор;
- алюминий.
Конечно, если их много, то от этого страдает чистота камня и, соответственно, падает стоимость. Или же такие алмазы направляют для использования в промышленность. При этом в алмазах встречаются не только твердые, но и жидкие и даже газообразные формы включений. Они могут располагаться неравномерно, а также скапливаться в центре либо на периферии камня.
Алмазы
По спектрам поглощения в ИК- и УФ-диапазонах выделяют три типа алмазов:
- Первый тип. В них азот содержится либо в виде пар атомов и плоских встроек, либо в виде одиночных атомов, которые равномерно распределены по объему камня.
- Третий тип может включать в себя примеси кремния.
Синтетические алмазы
Открытие аллотропных модификаций дало ученым надежду на синтетическое произведение алмазов. И у них отчасти это получилось, хотя сам процесс нельзя назвать легким. С химической точки зрения, тот же графит, например, должен получить сигма-связи. Такие условия воссоздать можно только в самых мощных лабораториях под действием больших температур и давления.
- HPHT — тип алмаза получается из растворения графита и оседания его в катализаторе на затравочном минерале.

- CVD тип — основывается на пленочном осаждении графита с использованием паров метана.
- Метод взрывного синтеза — наиболее естественный, с использованием углерода под высоким давлением.
Пока даже эти методы осуществляются с трудом, поэтому стоимость алмазов остается высокой. Но технологии продолжают развиваться в этом направлении.
Свойства алмазов
Благодаря своему составу и строению, алмаз получил такие свойства, как:
- Стойкость к воздействию химических веществ, кислот, щелочей.
- Наивысшая твердость вещества (абсолютный показатель, который равняется 10 по шкале Мооса), но при этом хрупкость камня.
- При нагреве без доступа кислорода взрывается и превращается в графит, а дальнейшее плавление алмаза аномально. С кислородом температура плавления находится на уровне 4 тысяч градусов по Цельсию.
- 20-24 Вт/см — это показатель теплопроводности. Настоящий алмаз не нагреется, даже если его долго держать в руке.

- Алмаз отлично подходит в роли изолятора.
- Камень обладает уникальным свойством преломлять лучи и при этом светиться.
Если говорить об отличиях алмаза и графита, самого доступного для нас вещества, то стоит сказать, что свойства разнятся из-за строения кристаллической решетки. О строении алмаза уже известно, а вот у графита ситуация обстоит по-другому. Его кристаллическая решетка имеет два типа связи: ковалентная сигма-связь находится только в одной плоскости, а в других плоскостях связь между атомами не такая устойчивая — ковалентная пи-связь. Такое строение позволяет электронам графита перемещаться на другие уровни, а также этот эффект объясняет наличие металлических свойств графита. Решетка алмаза и графита обусловила свойства и применение каждого вещества.
В природе алмаз встречается в кимберлитовых и лампроитовых трубках. Считается, что камень сформировался под действием магмы, также есть версия о космическом происхождении алмаза. Сейчас основная добыча камня ведется в ЮАР, а также в Бразилии, Австралии и России, в частности, в Якутии.
Если позволяют внешние и химические свойства, то камень отправляется к ювелирам. В остальных случаях его используют в промышленности. В производстве используют такие типы, как: борт, баллас и карбонадо. Широко используются в качестве абразивов.
Камень замечательно нашел свои сферы применения. А вот его свойства, происхождение и строение решетки продолжает активно изучаться. Но пока ученые не смогли до конца понять все тонкости этого минерала.
Рекомендуем похожие статьи
|
Область применения графита, описание и свойства. Виды природного и искусственного графита — химическая структура, механические и физические характеристики. Графит (от др.-греч. γράφω — пишу) – это природный материал, относящийся к классу самородных элементов, аллотропная модификация углерода. Он имеет слоистую структуру. Каждый слой кристаллической решетки графита может по-разному располагаться по отношению друг к другу, образуя политипы. Графит находит свое применение в производственной и промышленной деятельности. Графитовые изделия отличаются повышенными эксплуатационными характеристиками. Графит устойчив к химическим и природным воздействиям, он достаточно прочный, хорошо проводит электрический ток, отличается низкой твердостью, относительной мягкостью, после воздействия высоких температур затвердевает. Плотность составляет 2.23 г/см3. Графит имеет металлический блеск и темно-серый цвет. Теплопроводность этого минерала достаточно большая, поэтому его используют для изготовления комплектующих деталей электрооборудования. Структура и состав графитаСтруктура имеет свои определенные особенности. Модификаций природного минерала существует две:
Химический состав графита не отличается чистотой. В большом количестве (до 10-20%) присутствует зола, состоящая из разных составляющих (FeO, SiO2, Аl2O3, MgO, Р2О5, CuO, СаО и др.), газы (до 2%) и битумы, иногда вода. Цвет преобладает железно-черный, доходя до стально-серого. Имеет сильный металловидный блеск; скрытокристаллические агрегаты не блестят, матовые. Показатель преломления графита Nm==l,93-2,07. На ощупь жирный, оставляет след на бумаге и пальцах. Графит не плавится, если накаливать в струе кислорода, то сгорает тяжелее в сравнении с алмазом. Улетучивается лишь в пламени вольтовой дуги, не плавясь. В кислотах не растворяется. В смеси с KNO3 порошок при нагревании дает вспышку. Графит в природеВ природе содержится в гранитах, пирите. Он образуется в магматических и вулканических горных породах, скарнах и пегматитах при высоких температурах, встречается в кварцевых жилах с различными материалами, широко распространен в мраморе, кристаллических сланцах, гнейсах. В результате пиролиза под воздействием на каменноугольные отложения траппов образуются крупные залежи природного минерала. Показатели:
Виды природного графита:
Искусственный графит — область примененияИскусственно производится конструкционный, мелкозернистый, антифрикционный и литейный графит. Область применения материала достаточно широкая. Графит используется для изготовления огнеупорных материалов, электрических машин и установок, в химической, горнодобывающей промышленности, а также на производстве. Из него также изготавливают стержневые карандаши, краски, покрытия и аккумуляторные батареи. Графит незаменим в ядерной промышленности и в других узконаправленных областях. Заказать |
Новости и акции [ 25.01.2021 ] На складе появился графит ГК-1 и ГАК-1…. >> [ 24.12.2019 ] Поздравляем покупателей из РФ, СНГ с Новым годом!… >> [ 16.10.2017 ] Готовы поставить графит С-0 партией любого объема. Отгрузка в день оплаты…. >> Архив новостей |
Графитовая структура | Asbury Carbons
Кристаллический графит — это не просто набор слоев графена, наложенных друг на друга, а высокоупорядоченная структура.
Графит состоит из слоев атомов углерода, расположенных в виде 6-членных гексагональных колец. Эти кольца прикреплены друг к другу по краям. Слои сплавленных колец можно смоделировать как бесконечный ряд сплавленных бензольных колец (без атомов водорода). Атомы углерода в этих кольцевых массивах находятся в состоянии sp2-гибридизации. В модели молекулярных орбиталей sp2 каждый атом углерода связан с тремя другими частицами, с тремя другими атомами углерода в случае графита. В этом режиме связи угол связи между соседними атомами углерода составляет 120°. Эти «кольцевые массивы» расположены в виде больших листов атомов углерода, а отдельные листы известны как графеновые слои. Длина связи углерод-углерод в плоскости слоя равна 1,418. Слои графена уложены друг на друга параллельно кристаллографической оси «С» гексагональной 4-осевой системы, в которой кристаллизуется графит.
Слои графена точно «индексированы», так что точный трехмерный повторяющийся порядок развивается и поддерживается во всем кристалле (как это требуется для любого кристаллического твердого тела).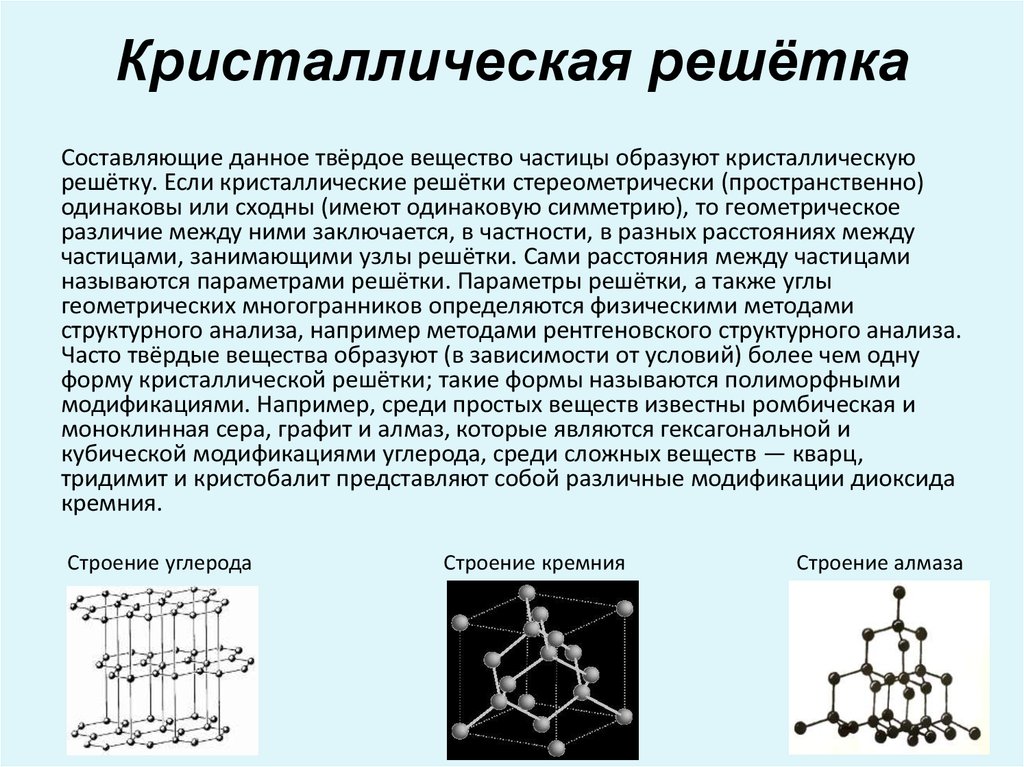 В этом устройстве каждый слой графена индексируется по слою выше и слою ниже таким образом, чтобы сформировать повторяющееся выравнивание для каждого второго слоя. Другими словами, атомы углерода в первом индексированном слое расположены в точном соответствии с атомами углерода в третьем индексированном слое. Соответственно, атомы углерода второго графенового слоя выровнены с атомами четвертого слоя. Эта конфигурация известна как структура «ABABAB». Все слои «A» выровнены с другими слоями «A», а все слои «B» выровнены с другими слоями «B». Упрощенное представление этой модели состоит в том, чтобы представить слой «А», фиксированный в пространстве. Затем выровняйте слой «В» так, чтобы непосредственно под центром каждого шестиугольника слоя «А» располагался мертвый центр атома углерода в слое «В».
В этом устройстве каждый слой графена индексируется по слою выше и слою ниже таким образом, чтобы сформировать повторяющееся выравнивание для каждого второго слоя. Другими словами, атомы углерода в первом индексированном слое расположены в точном соответствии с атомами углерода в третьем индексированном слое. Соответственно, атомы углерода второго графенового слоя выровнены с атомами четвертого слоя. Эта конфигурация известна как структура «ABABAB». Все слои «A» выровнены с другими слоями «A», а все слои «B» выровнены с другими слоями «B». Упрощенное представление этой модели состоит в том, чтобы представить слой «А», фиксированный в пространстве. Затем выровняйте слой «В» так, чтобы непосредственно под центром каждого шестиугольника слоя «А» располагался мертвый центр атома углерода в слое «В».
Поскольку графит представляет собой кристаллическое твердое вещество, его можно определить по базовой элементарной ячейке. Графит гексагональный и поэтому определяется гексагональной элементарной ячейкой. Шестиугольная элементарная ячейка графита представляет собой ромбическую призму (не шестиугольную призму). Призма определяется шестью поверхностями: четырьмя сторонами и верхней и нижней. Эта ячейка заключает в себе или частично заключает в себе атомы углерода из трех слоев графена, поэтому можно сказать, что элементарная ячейка начинается со слоя «А1» и заканчивается на слое «А2». Слой «B1» тогда будет расположен внутри элементарной ячейки. Каждая элементарная ячейка содержит всего четыре атома углерода (z=4). По одному и по одной шестой (1 1/6) атомов приходятся на первый и третий слой элементарной ячейки (верхний и нижний), а на одну и две трети (1 2/3) атомов приходятся на второй слой (средний слой). Поскольку каждая элементарная ячейка содержит «центрированные» и «краевые» атомы углерода, элементарная ячейка считается «центрированной» элементарной ячейкой, в отличие от примитивной элементарной ячейки. Размерами элементарной ячейки являются длины воображаемой линии, соединяющей плоские атомы углерода (а) вдоль ребер ячейки, параллельных слоям графита, и длина воображаемой линии, соединяющей межплоскостные атомы углерода (в) между первыми и третий слой (край, перпендикулярный графеновому слою).
Шестиугольная элементарная ячейка графита представляет собой ромбическую призму (не шестиугольную призму). Призма определяется шестью поверхностями: четырьмя сторонами и верхней и нижней. Эта ячейка заключает в себе или частично заключает в себе атомы углерода из трех слоев графена, поэтому можно сказать, что элементарная ячейка начинается со слоя «А1» и заканчивается на слое «А2». Слой «B1» тогда будет расположен внутри элементарной ячейки. Каждая элементарная ячейка содержит всего четыре атома углерода (z=4). По одному и по одной шестой (1 1/6) атомов приходятся на первый и третий слой элементарной ячейки (верхний и нижний), а на одну и две трети (1 2/3) атомов приходятся на второй слой (средний слой). Поскольку каждая элементарная ячейка содержит «центрированные» и «краевые» атомы углерода, элементарная ячейка считается «центрированной» элементарной ячейкой, в отличие от примитивной элементарной ячейки. Размерами элементарной ячейки являются длины воображаемой линии, соединяющей плоские атомы углерода (а) вдоль ребер ячейки, параллельных слоям графита, и длина воображаемой линии, соединяющей межплоскостные атомы углерода (в) между первыми и третий слой (край, перпендикулярный графеновому слою). Эти размеры: а = 2,456, с = 6,694. Поскольку расстояние между двумя слоями (с) равно 6,694, расстояние между любыми двумя соседними слоями равно 6,692/2 = 3,346 (с/2).
Эти размеры: а = 2,456, с = 6,694. Поскольку расстояние между двумя слоями (с) равно 6,694, расстояние между любыми двумя соседними слоями равно 6,692/2 = 3,346 (с/2).
Атомы углерода в кристалле графита находятся в состоянии sp2-гибридизации. Как обсуждалось в разделе, посвященном органической химии, это означает, что атомы углерода поддерживают два компонента связи: сигма-компонент (σ) и пи-компонент (π).
Сигма-связи являются «жесткими» связями и по своему характеру аналогичны чистым сигма-связям типа sp3, которые образуют трехмерную гигантскую молекулярную структуру алмаза. Система сигма-связей, действующая внутри одного слоя графена, чрезвычайно прочна. На самом деле, это, вероятно, самая прочная из известных двумерных сетчатых структур, и она является структурной основой всех углеродных/графитовых волокон и углеродных нанотрубок. Прочность сигма-связи в углероде также иллюстрируется высокой твердостью алмаза. Каждый атом углерода в графеновом слое имеет три из этих сигма-атомных орбиталей, которые объединяются с аналогичными орбиталями соседних атомов углерода, образуя молекулярные связи, удерживающие слой вместе (см. sp2-связь в разделе органической химии). Напротив, каждый атом углерода в структуре алмаза имеет по 4 таких связи. С атомной точки зрения можно было бы «перейти» от одного атома углерода к любому атому углерода в слое графена, используя «жесткие» сигма-связи в качестве мостов для прохождения пути между атомами углерода. Однако ваша прогулка будет ограничена только двумя измерениями, покрытыми графеновым слоем, на котором вы находитесь. В алмазе вся молекула алмаза может быть пройдена аналогичным образом в любом направлении вверх, вниз или из стороны в сторону, так что любой атом углерода может быть достигнут от любого другого атома углерода с использованием «мостов сигма-связей». пройти путь.
sp2-связь в разделе органической химии). Напротив, каждый атом углерода в структуре алмаза имеет по 4 таких связи. С атомной точки зрения можно было бы «перейти» от одного атома углерода к любому атому углерода в слое графена, используя «жесткие» сигма-связи в качестве мостов для прохождения пути между атомами углерода. Однако ваша прогулка будет ограничена только двумя измерениями, покрытыми графеновым слоем, на котором вы находитесь. В алмазе вся молекула алмаза может быть пройдена аналогичным образом в любом направлении вверх, вниз или из стороны в сторону, так что любой атом углерода может быть достигнут от любого другого атома углерода с использованием «мостов сигма-связей». пройти путь.
Жесткие сигма-связи, которые придают графеновому слою жесткость и высокую прочность на растяжение, не обеспечивают никакой поддержки в перпендикулярном направлении. Другими словами, они не делают ничего, чтобы скрепить кристалл графита в направлении «с». Слои графена являются реальными структурами и требуют некоторой силы для поддержания выравнивания листов, а также надлежащего равновесного разделительного расстояния. Функция поддержки кристалла в третьем измерении, измерении «с», обеспечивается вторым связующим компонентом модели sp2, известным как пи-компонент или пи-связь.
Функция поддержки кристалла в третьем измерении, измерении «с», обеспечивается вторым связующим компонентом модели sp2, известным как пи-компонент или пи-связь.
Компонент pi является результатом слабых вторичных электрических связей, образованных перекрывающимися орбиталями pi (p) углеродной сети sp2 внутри каждого листа графена. Каждый атом углерода имеет один пи-электрон. Этот электрон с высокой вероятностью находится в области чуть выше или ниже плоскости, образованной атомами углерода в графеновом слое. Поскольку каждый слой графена можно рассматривать как систему сплавленных шестиуглеродных колец, можно также представить, что над и под каждым кольцом существует область в форме кольца или пончика, содержащая шесть пи-электронов (по одному от каждого атома углерода). Эти пи-электроны не стационарны, а «делокализованы» в пределах области в форме пончика, которую они занимают. Эта делокализация пи-электронов приводит к тому, что известно как резонансная энергия или резонансная стабильность (см. Раздел об ароматичности и резонансе). Под стабильностью здесь понимается химическая устойчивость, которая распространяется на всю структуру графита. Говоря неквантовыми терминами, эффект заключается в «распространении» электрического заряда по всему массиву атомов углерода. В дополнение к делокализации пи-орбитальных электронов в области, расположенной непосредственно над данным кольцом, эта делокализация «сопряжена» во всем смежном графеновом слое. Это означает, что существует некий механизм делокализации пи-электронов не только на их непосредственной орбитали, но и для перемещения туда и обратно между соседними орбиталями и внутри них.
Раздел об ароматичности и резонансе). Под стабильностью здесь понимается химическая устойчивость, которая распространяется на всю структуру графита. Говоря неквантовыми терминами, эффект заключается в «распространении» электрического заряда по всему массиву атомов углерода. В дополнение к делокализации пи-орбитальных электронов в области, расположенной непосредственно над данным кольцом, эта делокализация «сопряжена» во всем смежном графеновом слое. Это означает, что существует некий механизм делокализации пи-электронов не только на их непосредственной орбитали, но и для перемещения туда и обратно между соседними орбиталями и внутри них.
Как упоминалось выше, пи-система в графите не обеспечивает существенной структурной поддержки в плоскости. Однако каждая пи-система создает «силовое поле», которое «общается» с полем, генерируемым слоями графена, расположенными выше и ниже нее. Эти взаимодействующие поля обеспечивают слабую систему вторичной ковалентной связи, которая удерживает соседние слои графена в их равновесном положении на расстоянии 3,346, параллельном оси «с».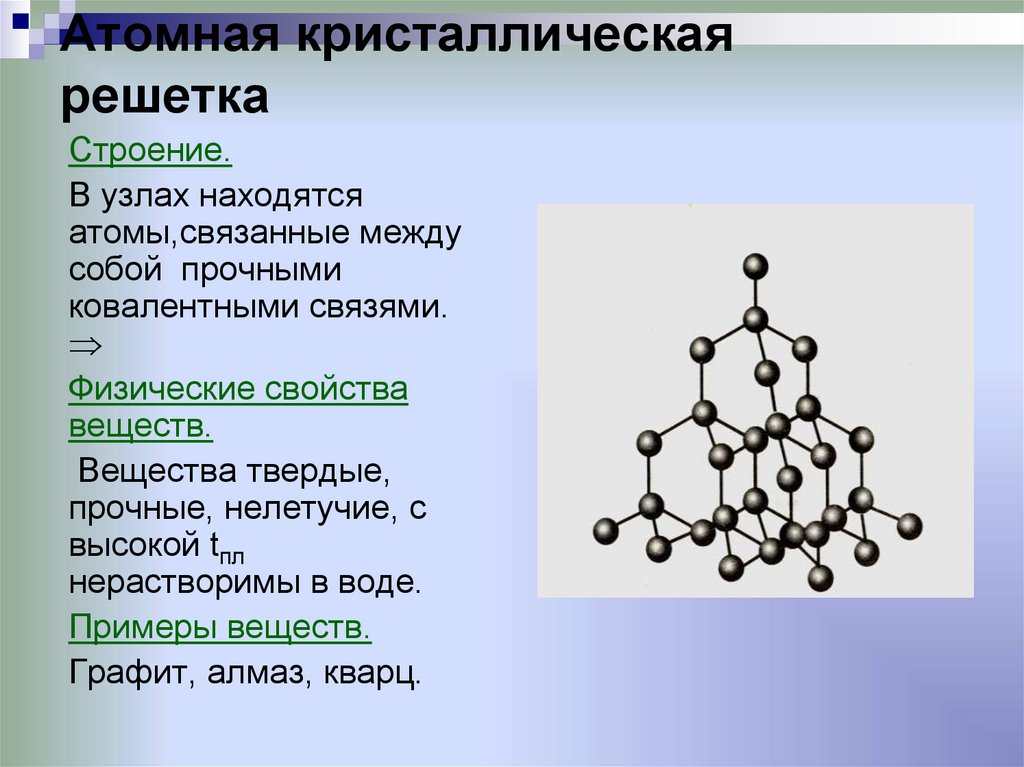 Однако, поскольку эти силы действительно слабы, соседние слои графена легко отделяются друг от друга или перемещаются горизонтально относительно друг друга. Способность графита образовывать смазывающую пленку является результатом такой структуры «отрывного» слоя.
Однако, поскольку эти силы действительно слабы, соседние слои графена легко отделяются друг от друга или перемещаются горизонтально относительно друг друга. Способность графита образовывать смазывающую пленку является результатом такой структуры «отрывного» слоя.
описание структуры кристаллической решетки
описание структуры кристаллической решетки Красота и симметрия кристаллов восхищали тысячи людей
лет. Почему-то они кажутся отличными от более обычной материи. Однако,
большинство твердых объектов состоят из множества крошечных взаимосвязанных кристаллов. Это только
иногда отдельные кристаллы достаточно велики, чтобы поймать нашу
внимание, как в этих красивых примерах.
Целестин
Сера
Пирит
Приведенные выше изображения являются собственностью компании Amethyst.
Galleries, Inc., и их копирование в коммерческих целях запрещено.
Разрешено копировать описания и изображения
только для личного и образовательного использования.
См. http://mineral.galleries.com/
Это изображение является собственностью IBM Research
Исследовательский центр Алмаден
Решетка может сильно влиять на свойства материала. Например, ниже мы видим два кристалла — графит и алмаз. Каждый из них содержат только 1 вид атома — углерод. Разница в том, как эти атомы расположены.
Графит
Алмаз
Вышеуказанные изображения являются собственностью Amethyst Galleries,
Inc. , и его нельзя копировать в коммерческих целях.
, и его нельзя копировать в коммерческих целях.
Разрешено копировать описания и изображения
только для личного и образовательного использования.
См. http://mineral.galleries.com/
Графит черного цвета, мягкий и является отличной смазкой. Это говорит о том что в графите должно быть легко разделить атомы или, по крайней мере, сделать они скользят друг мимо друга.
Алмаз прозрачный, прочный и очень твердый. Это превосходная нарезка инструмент. Атомы в алмазе должны очень сильно удерживаться на месте.
Химически алмаз инертен. Графит, с другой стороны, очень полезен для поглощения и катализа реакций. Структуры алмаз и графит объясняют эти различия.
Каждый атом углерода в алмазе связан с 4 другими в трехмерном пространстве.
сеть. Чтобы изменить форму бриллианта или сломать его, требуется много
эти прочные связи разорвутся одновременно. Так как мало места
чтобы другие молекулы попали в структуру, алмаз не очень реакционноспособен.
Нажмите на изображение ниже, чтобы увидеть структуру алмаза.
Нажмите на изображение ниже, чтобы увидеть структуру графита.
Ниже показано СТМ-изображение поверхности графита. Это фактический изображение , а не симуляция. На ней четко видны взаимосвязанные 6-членные кольца графита и треугольная геометрия вокруг каждого атома углерода.
Используется с разрешения TopoMetrix Corporation
5403 Бетси Росс Драйв, Санта-Клара, Калифорния 95054
Нитрид бора также существует в двух различных кристаллических структурах.
Нажмите на каждое изображение ниже, чтобы просмотреть эту структуру.
Шестиугольный нитрид бора Кубический
нитрид бора
Нажмите
здесь, чтобы перейти на следующую страницу.
Структура
кристаллов
Кристаллические решетки
Элементарные ячейки
От элементарной ячейки к решетке
От решетки к элементарной ячейке
Стехиометрия
Уплотнение и геометрия
Простые кубические металлы
Плотно упакованные конструкции
Кубический, центрированный по телу
Хлорид цезия
Хлорид натрия
Оксид рения
Оксид ниобия
Если не указано иное, все изображения, фильмы и
VRML являются собственностью и авторскими правами
по
Барбара Л.




 Атомы углерода ковалентно связаны между собой.
Атомы углерода ковалентно связаны между собой. Удельный вес графита 2,09-2,23 (меняется исходя от степени дисперсности и присутствия тончайших пор), у шунгита 1,84-1,98. Обладает высокой электропроводностью, что связано с очень плотным расположением атомов в листах.
Удельный вес графита 2,09-2,23 (меняется исходя от степени дисперсности и присутствия тончайших пор), у шунгита 1,84-1,98. Обладает высокой электропроводностью, что связано с очень плотным расположением атомов в листах. ..3000°C
..3000°C
Leave A Comment