что это такое, как применяются
Cостояние печени играет жизненно важную роль для здоровья человека. Этот орган весом более килограмма выполняет множество задач. В одной клетке печени, гепатоците, протекает около 500 различных биохимических процессов1. В печени осуществляется распад и/или детоксикация вредных веществ, а также выведение их из организма. Кроме того, орган синтезирует важнейшие составные части биологических мембран — фосфолипиды2.
Что такое клеточная мембрана?
Клетки — основные строительные блоки человеческого организма. Они, в свою очередь, не могут существовать без жиров и фосфолипидов, образующих наружную мембрану, «стенку» клетки, которая удерживает внутри нее цитоплазму. Мембрана представляет собой два слоя фосфолипидов, которые состоят из гидрофильной «головки», притягивающейся к воде, и гидрофобного, то есть водоустойчивого «хвоста». «Головки» двух рядов фосфолипидов обращены наружу, к жидкости, а «хвосты» скрепляются друг с другом, обеспечивая клеточным стенкам высокую прочность2.
Фосфолипиды выполняют структурную функцию, поддерживая клеточный каркас, участвуют в процессах молекулярного транспорта, ферментативных и других, не менее значимых процессах. Любое нарушение их деятельности может иметь самые серьезные последствия2.
Гепатоциты — «кирпичики» печени
Клетки печени, гепатоциты, составляют до 70 — 85% массы органа. Они несут основную ответственность за деятельность печени, участвуя в таких процессах, как:
- Синтез и хранение протеинов
- Расщепление углеводов
- Синтез холестерина, желчных солей и фосфолипидов
- Детоксикация, расщепление и выведение веществ
- Инициирование образования и, собственно, выработка желчи.
Клеточная стенка гепатоцитов, как и любых других клеток, состоит из фосфолипидов, обеспечивающих ее полноценное функционирование. Однако, к сожалению, она уязвима. Воздействие негативных факторов, например, некоторых лекарственных препаратов, токсичных веществ и особенно алкоголя и даже несбалансированного рациона приводит к нарушению внутриклеточного обмена и гибели гепатоцитов.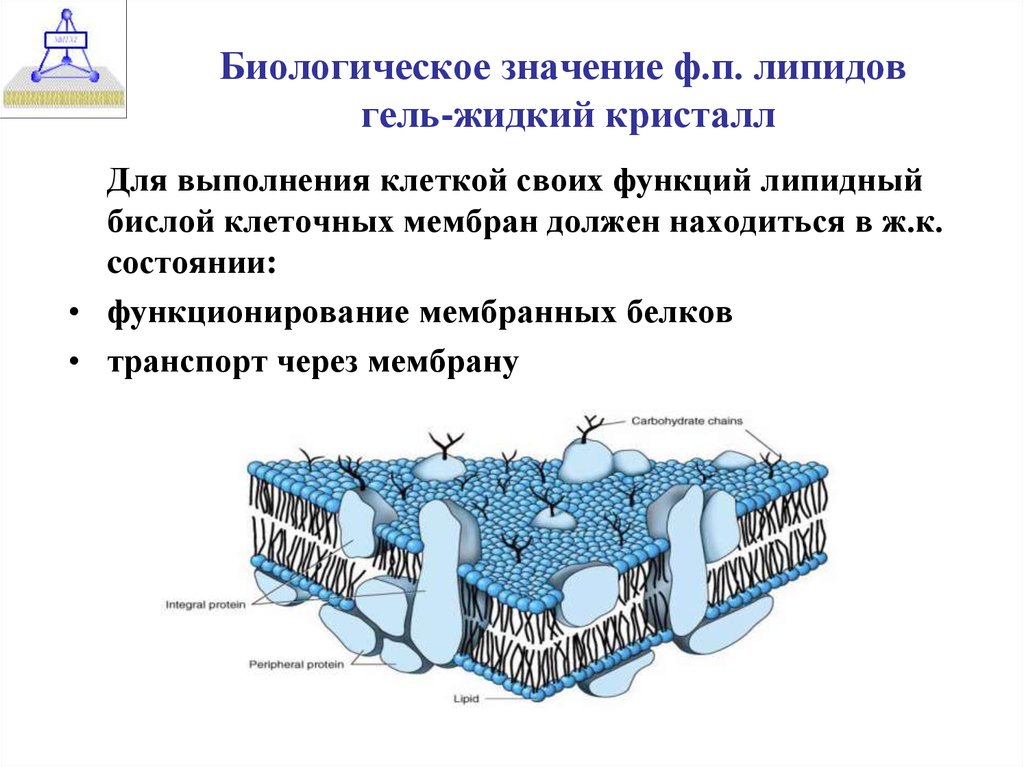
Когда печень «шалит»?
Проблемы с печенью прежде всего связаны с хронической интоксикацией, которая, в свою очередь, может быть вызвана различными заболеваниями и состояниями. К ним относится хронический прием алкоголя, сахарный диабет 2 типа, экологическая интоксикация, «химизация» пищи и быта, неблагоприятное действие лекарств и другие факторы. Все они способствуют развитию оксидативного стресса вследствие нарушения адекватной работы антиоксидантных механизмов. Постепенно на фоне хронического негативного влияния происходит деструкция клеточных мембран, белков и ДНК, нарушается работа клетки.
Итогом длительной интоксикации является триада: перекисное окисление липидов (окислительная их деградация, происходящая под действием свободных радикалов), накопление в клетках печени жира более 5% от массы органа (стеатоз) и хроническое воспаление
Эссенциальный — значит, необходимый
Для лечения поражений печени различного происхождения широко применяются эссенциальные фосфолипиды (ЭФЛ). Их принципиальным отличием от обычных фосфолипидов является наличие дополнительной молекулы линолевой кислоты. Это позволяет ЭФЛ с легкостью восполнять дефекты клеточной мембраны, что увеличивает ее гибкость и нормализует функции. Именно наличие линолевой кислоты считается наиболее важным отличием ЭФЛ от классических фосфолипидов, например, лецитина, которое лежит в основе лечебных преимуществ эссенциальных фосфолипидов2.
Их принципиальным отличием от обычных фосфолипидов является наличие дополнительной молекулы линолевой кислоты. Это позволяет ЭФЛ с легкостью восполнять дефекты клеточной мембраны, что увеличивает ее гибкость и нормализует функции. Именно наличие линолевой кислоты считается наиболее важным отличием ЭФЛ от классических фосфолипидов, например, лецитина, которое лежит в основе лечебных преимуществ эссенциальных фосфолипидов2.
В каком-то смысле назначение ЭФЛ можно назвать мембранной терапией, ведь их активность связана именно с клеточными стенками. Возможным же такое лечение стало благодаря соевым бобам, из которых и получают ценное вещество3.
Соевые бобы: из глубины веков до наших дней
Однолетнее растение семейства Бобовые на протяжении тысячелетий используется человеком. Упоминания о нем есть в книгах времен императора Шэн Нунг, царствовавшего в 2838 году до нашей эры1. Тогда соевые бобы считались одни из пяти «святых зерновых», без которых была невозможна жизнь на земле.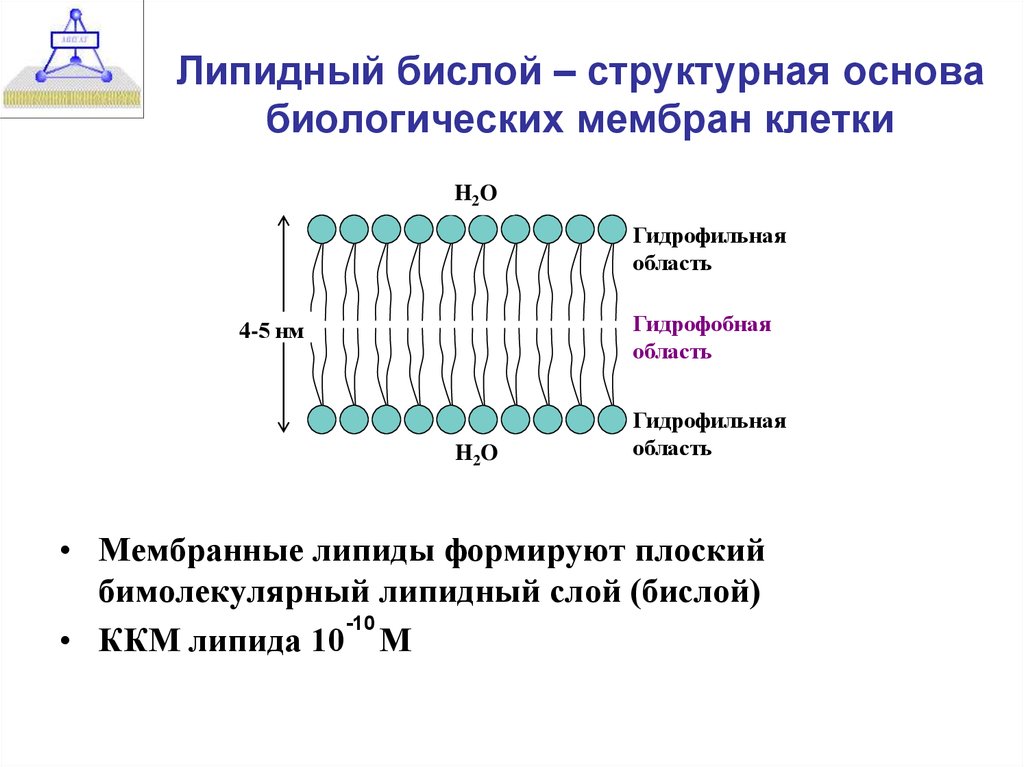
Сегодня известно около 800 видов соевых бобов. Они содержат 35 — 40% белков, 20 — 30% углеводов, 5 — 10% сопутствующих веществ (витамины, тритерпеновые сапонины, флавоноиды и т.д.), а также 12 — 18% жиров. Масла, входящие в состав бобов, на 90 — 95% состоят из глицеридов жирных кислоты, в частности, олеиновой и линолевой. В процессе переработки сырого масла удается получить 30 — 45% соевого лецитина (фосфатидилхолина), который и является «целевым продуктом», используемым в фармацевтической промышленности для создания препаратов, проявляющих гепатопротекторный эффект.
Фосфатидилхолины в действии
Получаемые из соевых бобов фосфатидилхолины представляют собой типичный липидный двойной слой, состоящий из гидрофильной «головки» и гидрофобного «хвоста» и являющийся основным структурным компонентом биологических мембран. Эссенциальные фосфолипиды легко заменяют эндогенные, то есть, «собственные» фосфолипиды организма, которые оказались по тем или иным причинам повреждены, встраиваясь в клеточную мембрану. При этом ЭФЛ могут поступать в организм как перорально, в виде твердых лекарственных форм (капсулы), так и внутривенно, с инъекционным раствором высокой степени очистки4.
При этом ЭФЛ могут поступать в организм как перорально, в виде твердых лекарственных форм (капсулы), так и внутривенно, с инъекционным раствором высокой степени очистки4.
Кстати, название «эссенциальные фосфолипиды» зарегистрировано только для препаратов, где содержится не менее 75% фосфатилхолина. Примеромлекарственного средства, содержащего ЭФЛ в высокой концентрации — Эссенциале Форте Н. В 1 капсуле Эссенциале форте Н содержится 76% фосфатидилхолина3.
На защиту мембран!
Встраивание эссенциальных фосфолипидов в поврежденные мембраны гепатоцитов обеспечивает восстановление нормальных мембранных структур, что, в свою очередь приводит к комплексному терапевтическому эффекту. Какое же действие оказывают ЭФЛ? Прежде всего, они проявляют протективные (защитные) и регенеративные свойства в отношении клеток печени1. При этом поражение печени может быть вызвано самыми различными факторами, среди которых токсические, воспалительные, аллергические, обменные и иммунологические реакции1.
Доказано, что ЭФЛ защищают гепатоциты при повреждениях, связанных с действием различных химических веществ, алкоголя, наркотических препаратов, цитостатиков, которые применяются для лечения онкологических заболеваний, ионизирующего излучения и так далее1.
ЭФЛ и полиненасыщенные жирные кислоты
Механизм действия ЭФЛ сродни действию омега 3-6-полиненасыщенных жирных кислот (ПНЖК), поскольку первые представляют собой по сути природную форму существования вторых. Омега 3-6-ПНЖК — эссенциальные жиры, снижающие риск ряда заболеваний, в том числе сердечно-сосудистых и диабета. Они не синтезируются в организме, и должны ежедневно поступать в организм в количестве 2 г омега-3 и 6 граммов омега-6 ПНЖК. Однако красные сорта рыбы, грецкие орехи, растительные масла, соевые бобы, где содержатся в большом количестве эти кислоты, высококалорийны, что ограничивает их употребление5.
Препараты, содержащие ЭФЛ, например, Эссенциале форте Н, могут широко применяться для восполнения диетического дефицита полиненасыщенных жирных кислот, не увеличивая калорийность рациона6.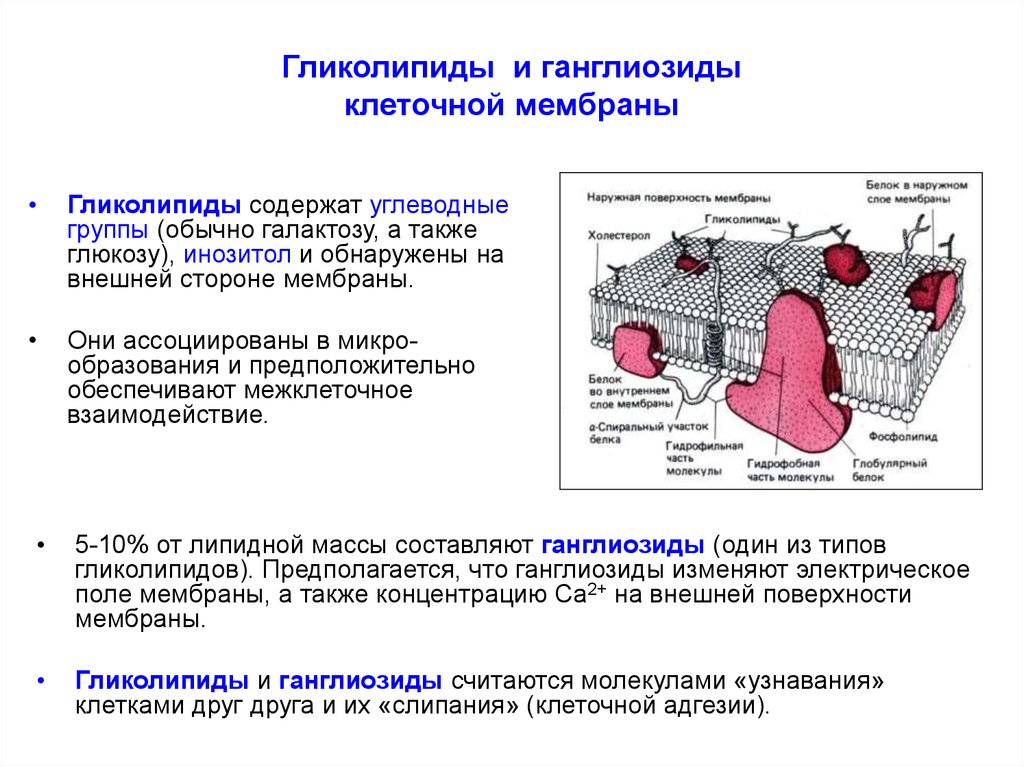 А какую важную роль они играют при заболеваниях, связанных с нарушением обмена жиров!
А какую важную роль они играют при заболеваниях, связанных с нарушением обмена жиров!
Холестерин — стоп!
Эссенциальные фосфолипиды принимают участие в транспорте холестерина в плазме и тканях, а также образовании липопротеинов высокой и низкой плотности (ЛПВП и ЛПНП) 7. Напомним, что именно с повышением уровня ЛПНП и триглицеридов и снижением содержания ЛПВП связано одно из самых опасных заболеваний — атеросклероз.
ЭФЛ обеспечивают так называемую системную мобилизацию холестерина и его утилизацию на всех этапах метаболизма за счет ряда процессов, в том числе:
- Повышение синтеза ЛПНП и мобилизация холестерина из плазмы крови
- Обеспечение захвата ЛПНП гепатоцитами
- Повышение секреции холестерина, фосфолипидов и жиров в желчь, что, соответственно, снижает их накопление в печени.8
В состав желчи входят желчные кислоты (около 70%) и ЭФЛ (фосфатидилхолин, составляет 22% желчи)9. У здоровых людей ЭФЛ обеспечивают растворимость холестерина. Если же соотношение желчных кислот и ЭФЛ нарушается, кристаллы холестерина могут выпадать в осадок, вследствие чего развивается желчнокаменная болезнь (ЖКБ).
У здоровых людей ЭФЛ обеспечивают растворимость холестерина. Если же соотношение желчных кислот и ЭФЛ нарушается, кристаллы холестерина могут выпадать в осадок, вследствие чего развивается желчнокаменная болезнь (ЖКБ).
Камни в желчном пузыре: легче предотвратить, чем лечить
Как известно, до 90% желчных камней являются преимущественно холестериновыми, состоящими как минимум на 70% из холестерина10. Увеличение выброса в желчь холестерина, приводящее к камнеобразованию, может происходить вследствие несбалансированности рациона и его насыщения животными жирами. Важным фактором риска ЖКБ считается и экологическое загрязнение, приводящее к хронической интоксикации организма и, как следствие, увеличению потребности в антиоксидантах и ЭФЛ, необходимых для связывания токсических веществ. Если запасы ЭФЛ и антиоксидантов не пополняются, функция клеточных мембран нарушается, и организм начинает накапливать холестерин, чтобы сохранить структуру клеточной стенки, запуская процесс камнеобразования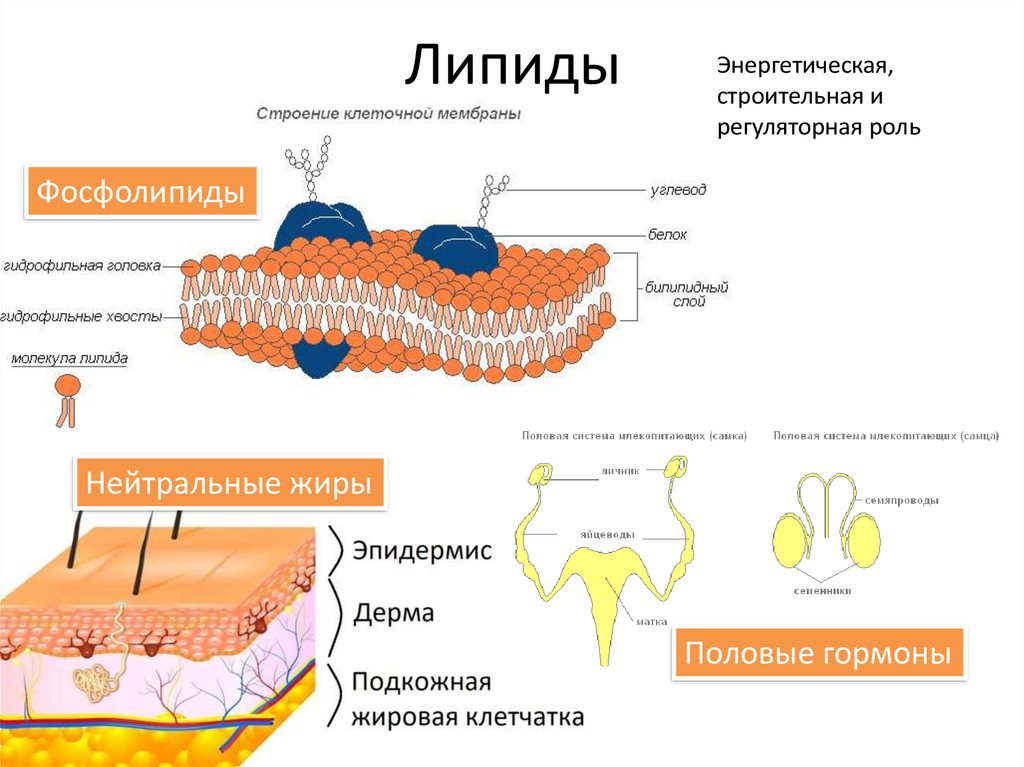
К группе повышенного риска ЖКБ относятся лица, злоупотребляющие алкоголем. Профилактическое назначение препаратов ЭФЛ тем, кто испытывает высокую нагрузку токсинами или алкоголем, компенсирует дефицит фосфолипидов и препятствует камнеобразованию12.
Неалкогольная жировая болезнь печени
Важный эффект ЭФЛ достигается благодаря их способности улучшать обмен липидов. Он особенно актуален при лечении неалкогольной жировой болезни печени (НАЖБП), которая возникает вследствие избыточного накопления жиров в органе. Необходимо отметить, что распространенность этого заболевания постоянно растет, в том числе и у детей и подростков, особенно живущих в городах6. В РФ только у пациентов общей практики распространенность НАЖБП достигает 27%6!
На фоне заболевания развивается комплекс патологических нарушений, среди которых снижение чувствительности тканей к инсулину, повышение содержания инсулина в крови. Увеличивается масса висцерального жира, что приводит к ожирению и артериальной гипертензии. У больных часто развивается сахарный диабет 2 типа и гиперлипидемия — повышение уровня холестерина и триглицеридов в крови. Люди, страдающие НАЖБП, должны контролировать калорийность рациона, минимизировать поступление транс-жиров, холестерина и увеличить потребление полиненасыщенных липидов (более 10 граммов в сутки)7. В связи с высокой калорийностью содержащих ПНЖК продуктов особое значение приобретают препараты ЭФЛ, оказывающие выраженный терапевтический эффект.
У больных часто развивается сахарный диабет 2 типа и гиперлипидемия — повышение уровня холестерина и триглицеридов в крови. Люди, страдающие НАЖБП, должны контролировать калорийность рациона, минимизировать поступление транс-жиров, холестерина и увеличить потребление полиненасыщенных липидов (более 10 граммов в сутки)7. В связи с высокой калорийностью содержащих ПНЖК продуктов особое значение приобретают препараты ЭФЛ, оказывающие выраженный терапевтический эффект.
При жировой инфильтрации гепатоцитов, которая наблюдается у больных НАЖБП, препараты, содержащие эссенциальные фосфолипиды, способствуют13 снижению стресса митохондрий клеток, обусловленного избытком жирных кислот, уменьшению выраженности воспалительного процесса и нормализации жирового обмена за счет коррекции дислипидемии14. Назначение этих препаратов позволяет улучшить липидный состав крови, показатели перекисного окисления жиров и восстановить систему антиоксидантной защиты в целом6.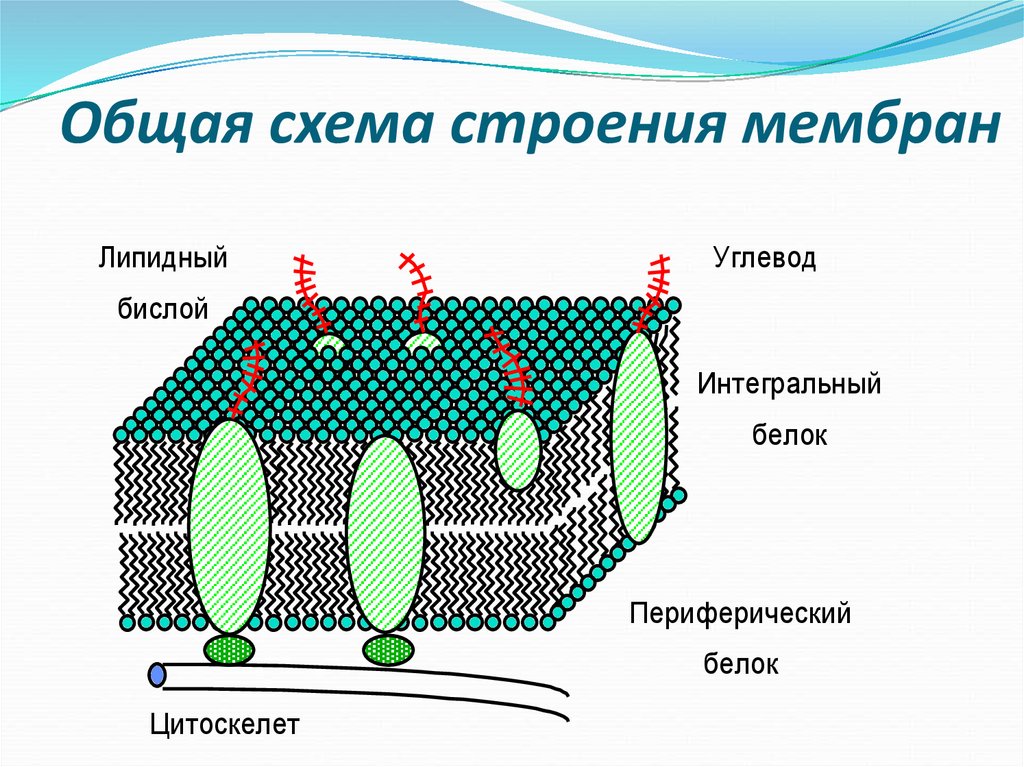
Клинически доказано, что эссенциальные фосфолипиды, например, в составе препарата Эссенциале форте Н, при НАЖБП улучшают течение и прогноз жировой инфильтрации печени, повышают чувствительность тканей к инсулину, нормализуют липидный профиль (то есть, способствуют снижению уровня «плохого» холестерина и триглицеридов) и к тому же уменьшают выраженность симптомов нарушений пищеварения.
Испытание алкоголем
Не менее важным показанием к назначению эссенциальных фосфолипидов является алкогольная болезнь печени (АБП). Высокому риску развития заболевания подвергаются люди, которые ежедневно принимают 40-80 мл чистого этанола на протяжении 4-6 лет15. Алкоголь богат «легкими» углеводными калориями, которые постепенно вызывают жировую дегенерацию внутренних органов. Кроме того, он способствует развитию нарушения кровообращения органа. При хронической алкогольной интоксикации на фоне оксидативного стресса происходит некроз гепатоцитов, развивается хронический воспалительный процесс и фиброз печени. Механизм развития последнего во многом обусловлен активацией так называемых звездчатых клеток. В норме они находятся в состоянии покоя, а при повреждении гепатоцитов «просыпаются» и становятся способными к интенсивному делению в участках воспаления16. В результате ткань печени разрастается, и в дальнейшем этот процесс часто заканчивается циррозом.
Механизм развития последнего во многом обусловлен активацией так называемых звездчатых клеток. В норме они находятся в состоянии покоя, а при повреждении гепатоцитов «просыпаются» и становятся способными к интенсивному делению в участках воспаления16. В результате ткань печени разрастается, и в дальнейшем этот процесс часто заканчивается циррозом.
Действие ЭФЛ при алкогольном поражении печени
Назначение эссенциальных фосфолипидов при алкогольном поражении печени позволяет связать активные формы алкоголя, которые образуются при поступлении высоких доз алкоголя и «запускают» механизм оксидативного стресса. Благодаря высокой биодоступности и возможности внедряться в клеточные мембраны гепатоцитов ЭФЛ способствуют удалению свободных радикалов и восстанавливают структуру клеточной стенки. Кроме того, ЭФЛ оказывают антифибротическое действие, подавляя активацию звездчатых клеток печени и останавливая патологический процесс развития фиброза17.
ЭФЛ можно назвать универсальным средством, оказывающим противовоспалительное, антифибротическое действие, а также предотвращающим гибель клеток печени18.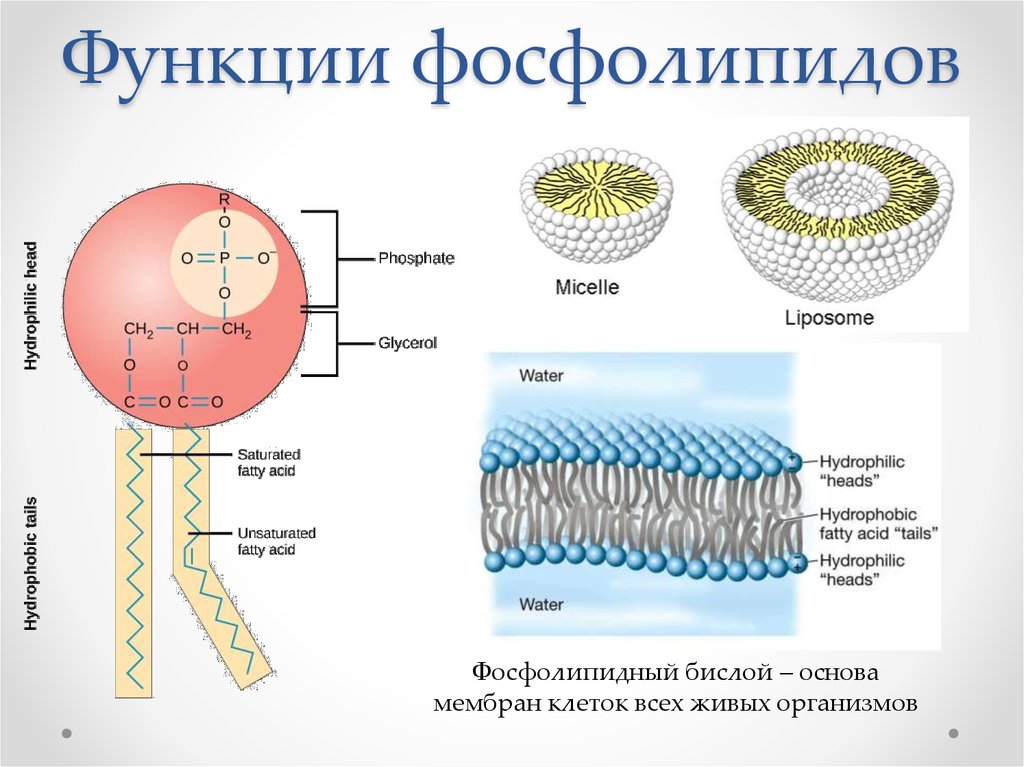 Эти возможности обеспечивают эффективность при хронических гепатитах, циррозе, жировой дистрофии печени, алкогольном гепатите и других нарушениях работы печени.
Эти возможности обеспечивают эффективность при хронических гепатитах, циррозе, жировой дистрофии печени, алкогольном гепатите и других нарушениях работы печени.
Какую функцию выполняет клеточная мембрана
Клеточная мембрана — молекулярная структура, которая состоит из липидов и белков. Главные её свойства и функции:
- отделение содержимого любой клетки от внешней среды, гарантируя её целостность;
- управление и налаживание обменом между средой и клеткой;
- внутриклеточные мембраны разбивают клетку на специальные отсеки: органеллы или компартменты.
Слово «мембрана» на латыни означает «пленка». Если говорить о клеточной мембране, то это совокупность двух пленок, которые обладают различными свойствами.
Биологическая мембрана включает в себя три вида белков:
- Периферические – расположены на поверхности пленки;
- Интегральные – целиком пронизывают мембрану;
- Полуинтегральные – одним концом проникают внутрь билипидного слоя.

Какие функции выполняет клеточная мембрана
1. Клеточная стенка — прочная оболочка клетки, которая находится снаружи от цитоплазматической мембраны. Она выполняет защитные, транспортные и структурные функции. Присутствует у многих растений, бактерий, грибов и архей.
2. Обеспечивает барьерную функцию, то есть избирательный, регулируемый, активный и пассивный обмен веществ с внешней средой.
3. Способна передавать и сохранять информации, а также принимает участие в процессе размножения.
4. Выполняет транспортную функцию, которая может через мембрану транспортировать вещества в клетку и из клетки.
5. Клеточная мембрана имеет одностороннюю проводимость. Благодаря этому, молекулы воды могут без задержек проходить через клеточную мембрану, а молекулы прочих веществ проникают выборочно.
6. С помощью клеточной мембраны происходит получение воды, кислорода и питательных веществ, а через неё удаляются продукты клеточного обмена.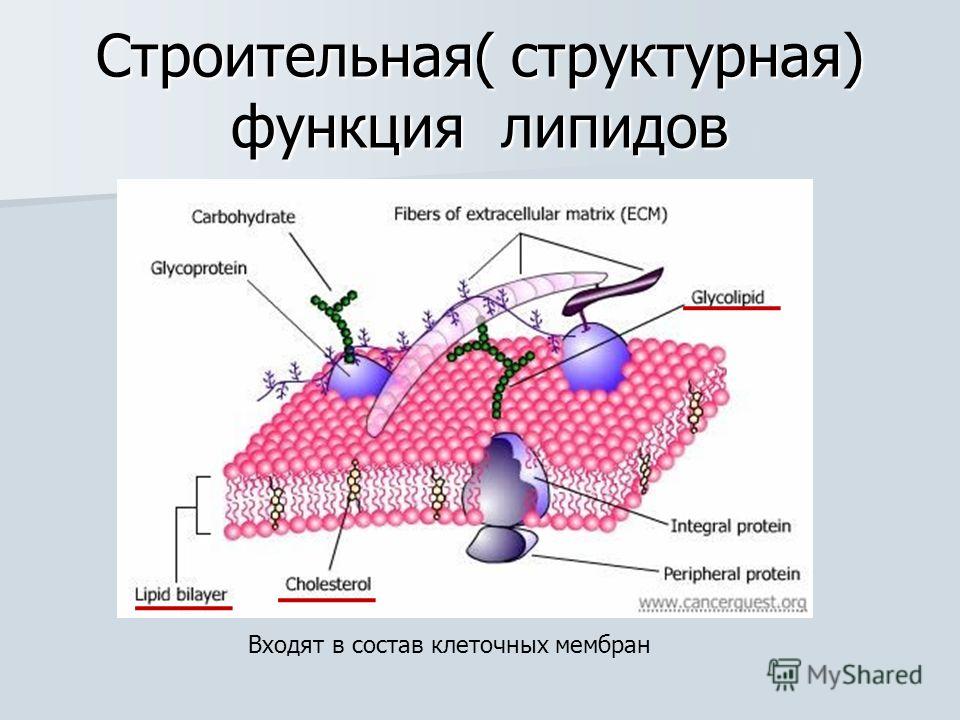
7. Выполняет клеточный обмен через мембраны, и может исполнять их с помощью 3 главных типов реакций: пиноцитоз, фагоцитоз, экзоцитоз.
8. Мембрана обеспечивает специфику межклеточных контактов.
9. В мембране присутствуют многочисленные рецепторы, которые способны воспринимать химические сигналы — медиаторы, гормоны и множество других биологических активных веществ. Так она в силах изменить метаболическую активность клетки.
10. Основные свойства и функции клеточной мембраны:
- Матричная
- Барьерная
- Транспортная
- Энергетическая
- Механическая
- Ферментативная
- Рецепторная
- Защитная
- Маркировочная
- Биопотенциальная
Какую функцию выполняет в клетке плазматическая мембрана?
- Отграничивает содержимое клетки;
- Осуществляет поступление веществ в клетку;
- Обеспечивает удаление ряда веществ из клетки.
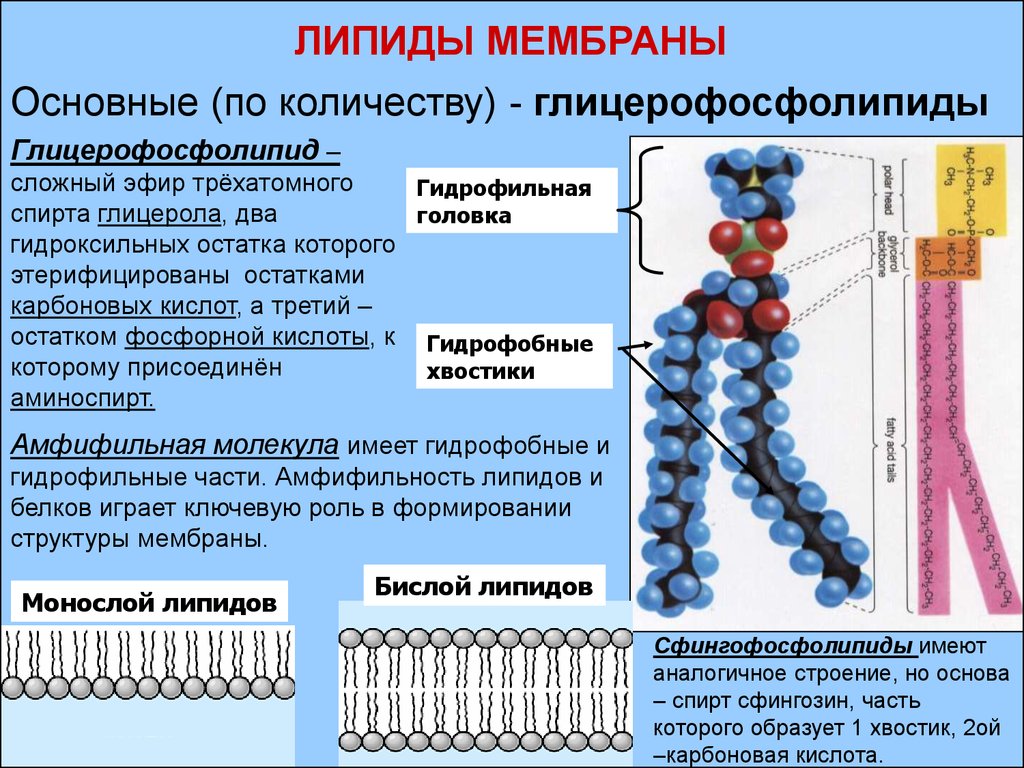
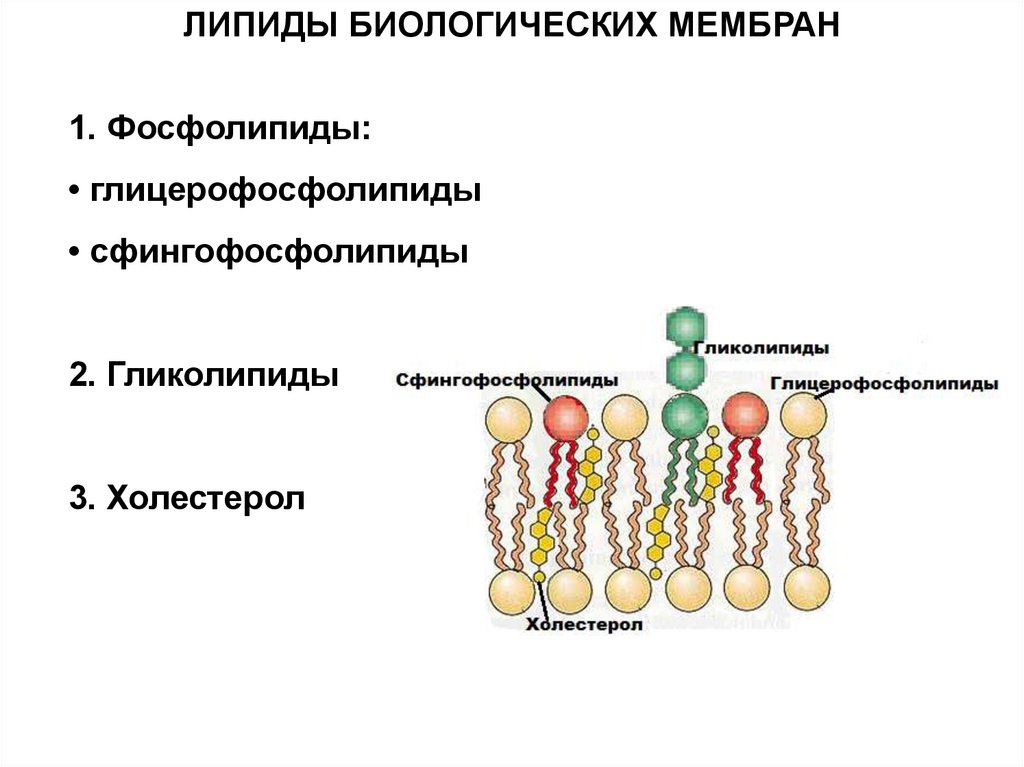
Структура мембраны клетки
- Гликолипиды;
- Фосфолипиды;
- Холестерол.

В основном мембрана клетки состоит из белков и липидов, и имеет толщину не более 11 нм. От 40 до 90% всех липидов составляют фосфолипиды. Также важно отметить гликолипиды, которые являются одним из основных компонентов мембраны.
Структура клеточной мембраны трехслойна. В центре располагается однородный жидкий билипидный слой, а белки закрывают его с двух сторон (как мозаику), отчасти проникая в толщу. Также белки необходимы для мембраны, чтобы пропускать внутрь клеток и транспортировать из них наружу особые вещества, которые не могут проникнуть через жировой слой. Например, ионы натрия и калия.
- Это интересно — Сильные, слабые кислоты и основания. Свойства
Строение клетки — видео
Мембранные липиды: где они находятся и как ведут себя
1. Sud M, et al. LMSD: база данных структуры LIPID MAPS. Нуклеиновые Кислоты Res.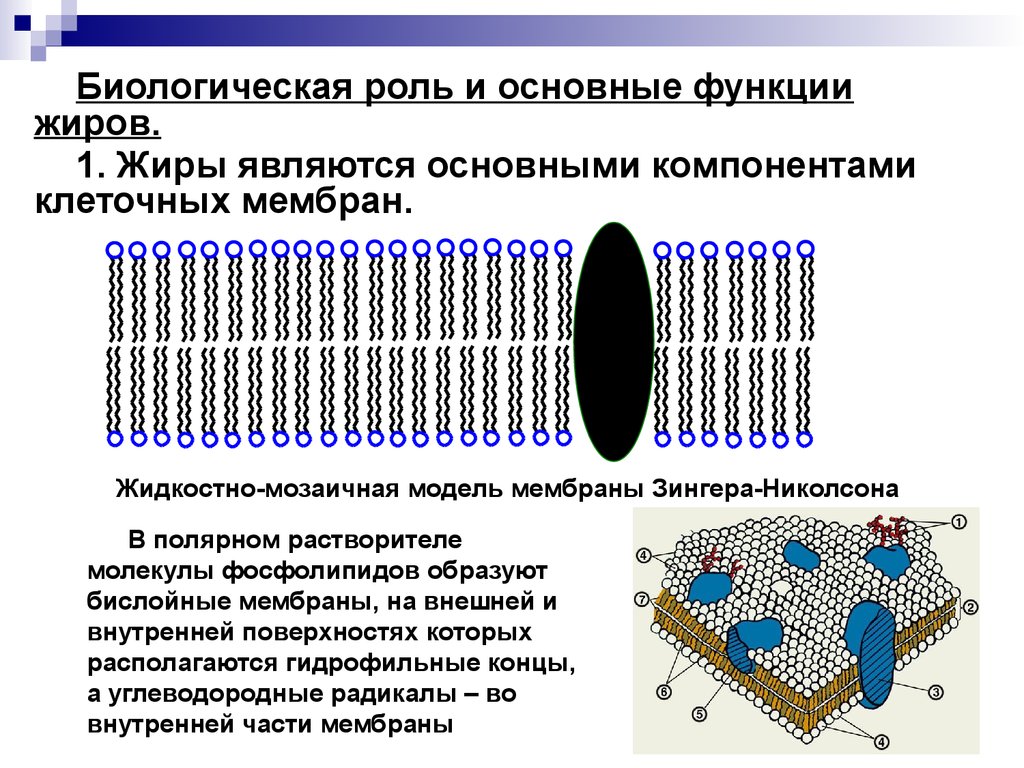 2007; 35:D527–D532. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2007; 35:D527–D532. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Feigenson GW. Фазовое поведение смесей липидов. Природа Хим Биол. 2006; 2: 560–563. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Feigenson GW. Границы фаз и биологические мембраны. Annu Rev Biophys Biomol Struct. 2007; 36: 63–77. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Марш М., Хелениус А. Вирусная запись: сезам, откройся. Клетка. 2006; 124:729–740. Исследования в области клеточной биологии, визуализация живых клеток и системная биология показывают, что многие из многочисленных и слегка различающихся путей, которые используют вирусы животных для проникновения в клетки-хозяева, требуют специфических липидов. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Ван Меер Г. Клеточная липидомика. EMBO J. 2005; 24: 3159–3165. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Марш Д. Профиль латерального давления, расстройство спонтанного искривления, а также включение и конформация белков в мембраны. Биофиз Дж. 2007;93:3884–3899. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Биофиз Дж. 2007;93:3884–3899. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Доуэн В., Богданов М. В кн.: Биохимия липидов, липопротеинов и мембран. Вэнс Д.Е., Вэнс Дж.Е., редакторы. Том. 36. Эльзевир; Амстердам: 2002. С. 1–35. [Google Scholar]
8. Ван Меер Г., Лисман В. Транспорт сфинголипидов: плоты и транслокаторы. Дж. Биол. Хим. 2002; 277:25855–25858. [PubMed] [Google Scholar]
9. Huang J, Feigenson GW. Микроскопическая модель взаимодействия максимальной растворимости холестерина в липидных бислоях. Биофиз Дж. 1999;76:2142–2157. Взаимодействия холестерина с мембранным липидом приводят к резким скачкам химического потенциала холестерина из-за гидрофобного взаимодействия, которое заставляет головные группы фосфолипидов защищать холестерин от воды, как описано здесь в зонтичной модели. [Статья бесплатно PMC] [PubMed] [Google Scholar]
10. Ali MR, Cheng KH, Huang J. Керамид переводит холестерин из упорядоченной фазы липидного бислоя в кристаллическую фазу в 1-пальмитоил-2-олеоил- sn Тройные смеси -глицеро-3-фосфохолин/холестерин/церамид. Биохимия. 2006;45:12629–12638. [PubMed] [Google Scholar]
Биохимия. 2006;45:12629–12638. [PubMed] [Google Scholar]
11. Meyer zu Heringdorf D, Jakobs KH. Лизофосфолипидные рецепторы: передача сигналов, фармакология и регуляция метаболизма лизофосфолипидов. Биохим Биофиз Акта. 2007; 1768: 923–940. [PubMed] [Google Scholar]
12. Фернандис А.З., Венк М.Р. Мембранные липиды как сигнальные молекулы. Карр Опин Липидол. 2007; 18: 121–128. [PubMed] [Google Scholar]
13. Колесник Р., Ханнун Ю.А. Церамиды и апоптоз. Тенденции биохимических наук. 1999; 24: 224–225. [PubMed] [Академия Google]
14. Теппер А.Д., и соавт. Гидролиз сфингомиелина до церамида во время фазы выполнения апоптоза является результатом скремблирования фосфолипидов и изменяет морфологию клеточной поверхности. Джей Селл Биол. 2000; 150: 155–164. [Статья бесплатно PMC] [PubMed] [Google Scholar]
15. Megha Sawatzki P, Kolter T, Bittman R, London E. Влияние церамида N -ацильной цепи и структуры полярной головной группы на свойства упорядоченных липидных доменов ( липидные рафты) Biochim Biophys Acta. 2007;1768:2205–2212. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2007;1768:2205–2212. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Белл Р.М., Баллас Л.М., Коулман Р.А. Топогенез липидов. J липидный рез. 1981; 22: 391–403. [PubMed] [Google Scholar]
17. Sprong H, et al. UDP-галактоза:церамидгалактозилтрансфераза представляет собой интегральный мембранный белок класса I эндоплазматического ретикулума. Дж. Биол. Хим. 1998; 273:25880–25888. [PubMed] [Google Scholar]
18. Rusinol AE, Cui Z, Chen MH, Vance JE. Уникальная мембранная фракция, ассоциированная с митохондриями, из печени крысы обладает высокой способностью к синтезу липидов и содержит секреторные белки пре-Гольджи, включая формирующиеся липопротеины. Дж. Биол. Хим. 1994;269:27494–27502. Предоставляет доказательства стабильных физических ассоциаций между ER и митохондриями, а также идентифицирует биохимические свойства этого компартмента, которые отличаются от отдельных органелл. [PubMed] [Google Scholar]
19. Pichler H, et al. Подфракция эндоплазматического ретикулума дрожжей связана с плазматической мембраной и обладает высокой способностью синтезировать липиды. Евр Дж Биохим. 2001; 268: 2351–2361. [PubMed] [Google Scholar]
Евр Дж Биохим. 2001; 268: 2351–2361. [PubMed] [Google Scholar]
20. Futerman AH, Riezman H. Все тонкости синтеза сфинголипидов. Тенденции клеточной биологии. 2005; 15: 312–318. [PubMed] [Академия Google]
21. Хеннеберри А.Л., Райт М.М., Макмастер К.Р. Основные участки клеточного синтеза фосфолипидов и молекулярные детерминанты специфичности жирных кислот и головных групп липидов. Мол Биол Селл. 2002; 13:3148–3161. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Voelker DR. Восполнение пробелов в транспорте фосфолипидов. Тенденции биохимических наук. 2005; 30: 396–404. Обобщает биохимические и генетические элементы невезикулярного транспорта фосфолипидов с особым акцентом на процессы транспорта PtdSer в дрожжах. [PubMed] [Академия Google]
23. Ди Паоло Г., Де Камилли П. Фосфоинозитиды в клеточной регуляции и динамике мембран. Природа. 2006; 443: 651–657. [PubMed] [Google Scholar]
24. Geta Tafesse F, et al. Обе сфингомиелинсинтазы SMS1 и SMS2 необходимы для гомеостаза сфингомиелина и роста клеток HeLa человека.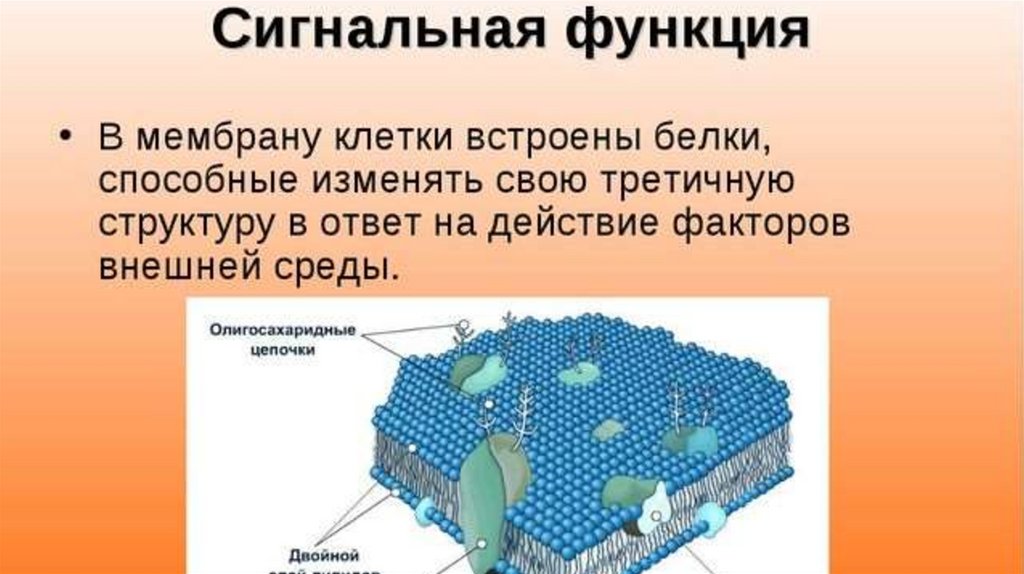 Дж. Биол. Хим. 2007; 282:17537–17547. [PubMed] [Google Scholar]
Дж. Биол. Хим. 2007; 282:17537–17547. [PubMed] [Google Scholar]
25. Li Z, et al. Ингибирование сфингомиелинсинтазы (СМС) влияет на внутриклеточное накопление сфингомиелина и организацию липидов плазматической мембраны. Биохим Биофиз Акта. 2007; 1771: 1186–119.4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Kobayashi T, et al. Разделение и характеристика доменов поздних эндосомальных мембран. Дж. Биол. Хим. 2002; 277:32157–32164. [PubMed] [Google Scholar]
27. Matsuo H, et al. Роль LBPA и Alix в формировании мультивезикулярных липосом и организации эндосом. Наука. 2004; 303: 531–534. [PubMed] [Google Scholar]
28. Колтер Т., Сандхофф К. Принципы переваривания лизосомальной мембраны: стимуляция деградации сфинголипидов белками-активаторами сфинголипидов и анионными лизосомальными липидами. Annu Rev Cell Dev Biol. 2005; 21:81–103. [PubMed] [Академия Google]
29. Вэнс Д.Э., Вэнс Дж.Э. Биохимия липидов, липопротеидов и мембран. Эльзевир; Амстердам: 2002.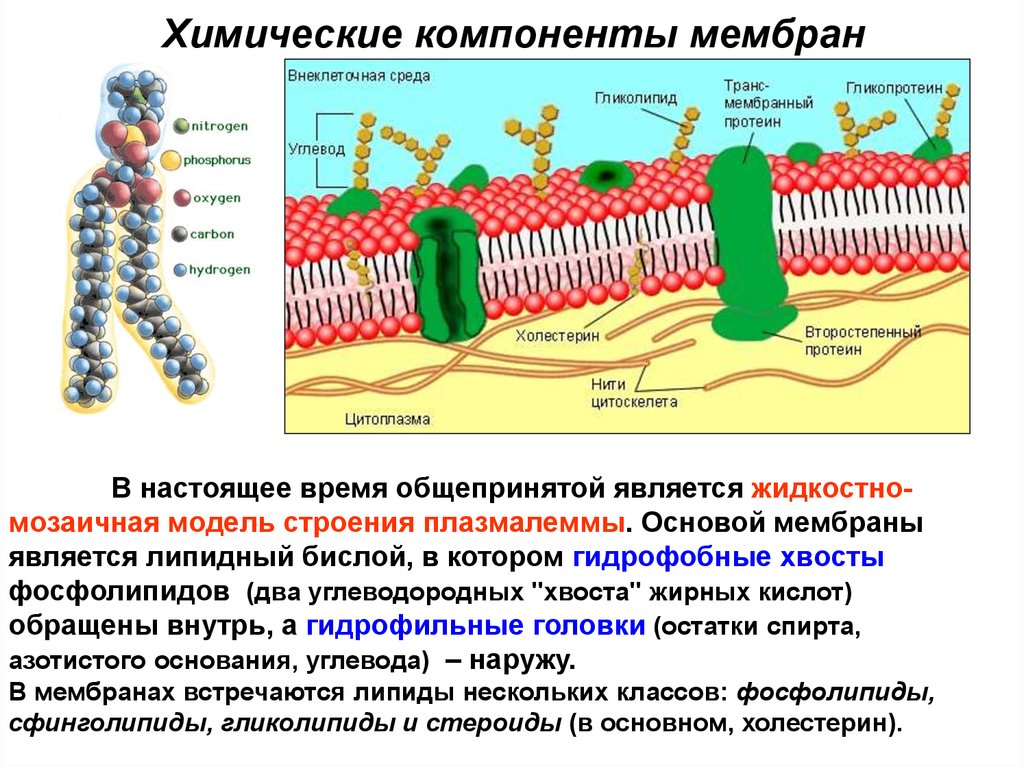 [Google Scholar]
[Google Scholar]
30. Nagle CA, et al. Печеночная гиперэкспрессия глицерол- sn -3-фосфатацилтрансферазы 1 у крыс вызывает резистентность к инсулину. Дж. Биол. Хим. 2007; 282:14807–14815. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Choi JY, Wu WI, Voelker DR. Фосфатидилсериндекарбоксилазы как генетические и биохимические инструменты для изучения трафика фосфолипидов. Анальная биохимия. 2005; 347: 165–175. [PubMed] [Академия Google]
32. Даум Г. Липиды митохондрий. Биохим Биофиз Акта. 1985; 822:1–42. [PubMed] [Google Scholar]
33. Strauss JF, Kishida T, Christenson LK, Fujimoto T, Hiroi H. Белки домена START и внутриклеточный перенос холестерина в стероидогенных клетках. Мол Селл Эндокринол. 2003; 202: 59–65. [PubMed] [Google Scholar]
34. Devaux PF, Morris R. Трансмембранная асимметрия и латеральные домены в биологических мембранах. Трафик. 2004; 5: 241–246. [PubMed] [Академия Google]
35. Далек Д.Л. Фосфолипидные флиппазы. Дж. Биол. Хим. 2007; 282:821–825. [PubMed] [Google Scholar]
Дж. Биол. Хим. 2007; 282:821–825. [PubMed] [Google Scholar]
36. Поморски Т., Менон А.К. Липидные флиппазы и их биологические функции. Cell Mol Life Sci. 2006;63:2908–2921. [PubMed] [Google Scholar]
37. Anglin TC, Liu J, Conboy JC. Легкий липидный флип-флоп в фосфолипидном бислое, индуцированный грамицидином А, измеренный с помощью колебательной спектроскопии суммарной частоты. Биофиз Дж. 2007; 92: L01–L03. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Пападопулос А. и соавт. Активность флиппаз выявляется с немечеными липидами по изменению формы гигантских однослойных везикул. Дж. Биол. Хим. 2007; 282:15559–15568. [PubMed] [Google Scholar]
39. López-Montero I, et al. Быстрое трансбислойное перемещение церамидов в фосфолипидных везикулах и эритроцитах человека. Дж. Биол. Хим. 2005; 280:25811–25819. [PubMed] [Google Scholar]
40. Ganong BR, Bell RM. Трансмембранное перемещение фосфатидилглицериновых и диацилглицеролсульфгидрильных аналогов.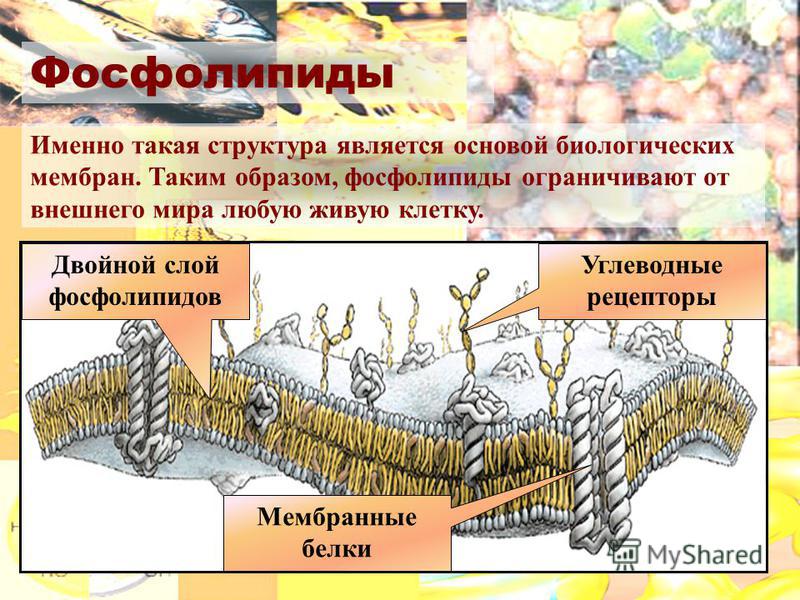 Биохимия. 1984;23:4977–4983. [PubMed] [Google Scholar]
Биохимия. 1984;23:4977–4983. [PubMed] [Google Scholar]
41. Bai J, Pagano RE. Измерение спонтанного переноса и трансбислойного движения BODIPY-меченых липидов в липидных везикулах. Биохимия. 1997; 36:8840–8848. [PubMed] [Google Scholar]
42. Steck TL, Ye J, Lange Y. Исследование движения холестерина мембраны эритроцитов с помощью циклодекстрина. Биофиз Дж. 2002; 83: 2118–2125. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Cullis PR, et al. Влияние градиентов рН на трансбислойный транспорт лекарств, липидов, пептидов и ионов металлов в большие однослойные везикулы. Биохим Биофиз Акта. 1997;1331:187–211. [PubMed] [Google Scholar]
44. Кол М.А., де Крун А.И., Киллиан Дж.А., де Круифф Б. Трансбислойное движение фосфолипидов в биогенных мембранах. Биохимия. 2004;43:2673–2681. Обобщены данные и гипотезы, поддерживающие общую систему неселективного трансбислойного перемещения липидов в ЭР эукариот и в цитоплазматических мембранах бактерий. [PubMed] [Google Scholar]
45. Helenius J, et al. Для транслокации связанных с липидами олигосахаридов через мембрану ER требуется белок Rft1. Природа. 2002; 415:447–450. [PubMed] [Академия Google]
Helenius J, et al. Для транслокации связанных с липидами олигосахаридов через мембрану ER требуется белок Rft1. Природа. 2002; 415:447–450. [PubMed] [Академия Google]
46. Alaimo C, et al. Два различных, но взаимозаменяемых механизма переворачивания олигосахаридов, связанных с липидами. EMBO J. 2006; 25: 967–976. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Graham TR. Флиппазы и транспорт белков, опосредованный везикулами. Тенденции клеточной биологии. 2004; 14: 670–677. Суммирует важные взаимосвязи между транспортом везикулярных белков и трансбислойным транспортом фосфолипидов с помощью АТФаз Р-типа. [PubMed] [Google Scholar]
48. Pomorski T, et al. Родственные Drs2p АТФазы Р-типа Dnf1p и Dnf2p необходимы для транслокации фосфолипидов через плазматическую мембрану дрожжей и играют роль в эндоцитозе. Мол Биол Селл. 2003; 14:1240–1254. Важная статья, определяющая участие АТФаз Р-типа плазматической мембраны дрожжей в трансбислойном перемещении аминоглицерофосфолипидов и их взаимодействие с эндоцитарными процессами. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Riekhof WR, Voelker DR. Поглощение и использование лизофосфатидилэтаноламина Saccharomyces cerevisiae . Дж. Биол. Хим. 2006; 281:36588–36596. [PubMed] [Google Scholar]
50. Riekhof WR, et al. Метаболизм лизофосфатидилхолина у Saccharomyces cerevisiae . Роль АТФаз Р-типа в транспорте и ацилтрансфераз широкой специфичности в ацилировании. Дж. Биол. Хим. 21 октября 2007 г. doi: 10.1074/jbc.M706718200. [PubMed] [CrossRef] [Академия Google]
51. Натараджан П., Ван Дж., Хуа З., Грэм Т.Р. Активность аминофосфолипидной транслоказы, связанной с Drs2p, в мембранах Гольджи дрожжей и связь с функцией in vivo . Proc Natl Acad Sci USA. 2004; 101:10614–10619. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Alder-Baerens N, Lisman Q, Luong L, Pomorski T, Holthuis JC. Потеря P4 ATPases Drs2p и Dnf3p нарушает транспорт аминофосфолипидов и асимметрию в секреторных везикулах пост-Гольджи дрожжей.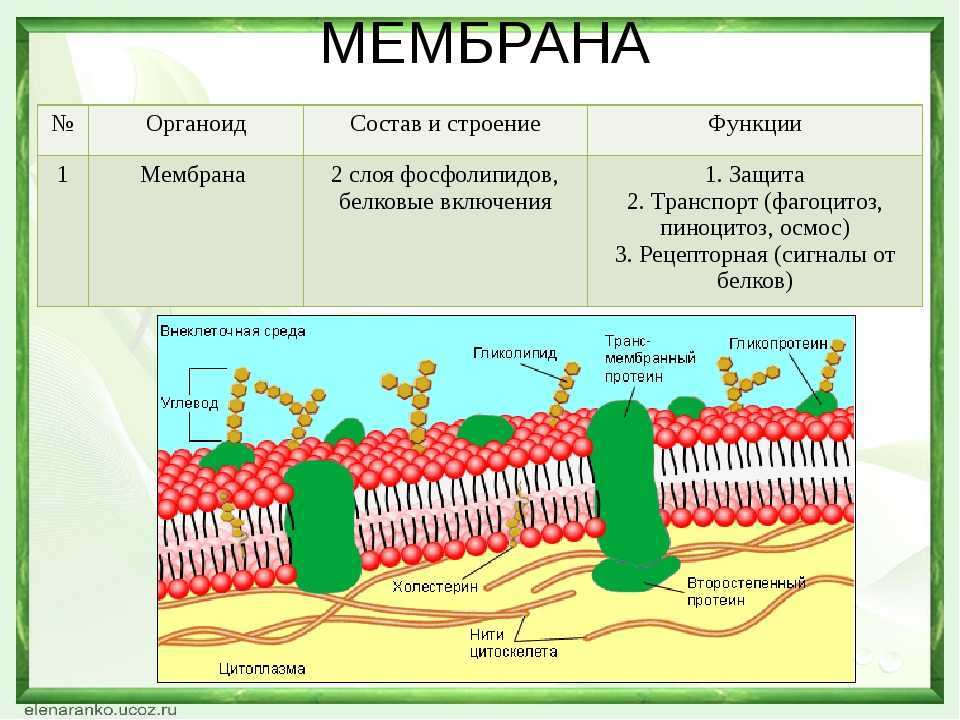 Мол Биол Селл. 2006; 17: 1632–1642. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мол Биол Селл. 2006; 17: 1632–1642. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Wang X, et al. C. elegans митохондриальный фактор WAH-1 способствует экстернализации фосфатидилсерина в апоптотических клетках посредством фосфолипидной скрамблазы SCRM-1. Природа Клетка Биол. 2007; 9: 541–549. [PubMed] [Google Scholar]
54. Züllig S, et al. Аминофосфолипидная транслоказа ТАТ-1 способствует воздействию фосфатидилсерина во время апоптоза C. elegans . Карр Биол. 2007; 17: 994–999. [PubMed] [Google Scholar]
55. van Meer G, Simons K. Функция плотных контактов в поддержании различий в составе липидов между апикальными и базолатеральными доменами клеточной поверхности клеток MDCK. EMBO J. 1986;5:1455–1464. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Young WW, Jr, Lutz MS, Blackburn W. A Эндогенные гликосфинголипиды перемещаются к поверхности клетки со скоростью, соответствующей оценкам объемного потока. Дж. Биол. Хим. 1992; 267:12011–12015. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
57. Baumann NA, et al. Транспорт вновь синтезированного стерола к обогащенной стеролами плазматической мембране происходит посредством невезикулярного уравновешивания. Биохимия. 2005; 44: 5816–5826. [PubMed] [Google Scholar]
58. Simons K, van Meer G. Сортировка липидов в эпителиальных клетках. Биохимия. 1988;27:6197–6202. [PubMed] [Google Scholar]
59. Halter D, et al. Пре- и пост-Гольджи транслокация глюкозилцерамида в синтезе гликосфинголипидов. Джей Селл Биол. 2007; 179: 101–115. Предполагается, что поздний белок Гольджи FAPP2 транспортирует GlcCer, предназначенный для сложного синтеза гликолипидов, обратно в ER, тогда как транслокация GlcCer на клеточную поверхность зависит от протонного градиента. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Smith DC, et al. Связь шига-подобного токсина с устойчивыми к детергентам мембранами модулируется глюкозилцерамидом и является важным требованием эндоплазматического ретикулума для цитотоксического эффекта. Мол Биол Селл. 2006; 17: 1375–1387. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мол Биол Селл. 2006; 17: 1375–1387. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Sharma DK, et al. Гликосфинголипиды, интернализированные через эндоцитоз, связанный с кавеолами, быстро сливаются с клатриновым путем в ранних эндосомах и образуют микродомены для повторного использования. Дж. Биол. Хим. 2003; 278:7564–7572. Демонстрирует неравномерное распределение флуоресцентных фосфолипидов внутри отдельных эндосом. [PubMed] [Google Scholar]
62. Wang TY, Silvius JR. Различные сфинголипиды демонстрируют дифференциальное разделение на домены, богатые сфинголипидами / холестерином, в липидных бислоях. Биофиз Дж. 2000;79: 1478–1489. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Singh RD, et al. Ингибирование захвата кавеол, инфекции SV40 и передачи сигналов β1-интегрина с помощью неприродного стереоизомера гликосфинголипидов. Джей Селл Биол. 2007; 176: 895–901. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Sleight RG, Pagano RE. Быстрое появление вновь синтезированного фосфатидилэтаноламина на плазматической мембране. Дж. Биол. Хим. 1983; 258:9050–9058. [PubMed] [Google Scholar]
Дж. Биол. Хим. 1983; 258:9050–9058. [PubMed] [Google Scholar]
65. Каплан М.Р., Симони Р.Д. Внутриклеточный транспорт фосфатидилхолина к плазматической мембране. Джей Селл Биол. 1985;101:441–445. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Voelker DR. Характеристика синтеза и транслокации фосфатидилсерина в пермеабилизированных клетках животных. Дж. Биол. Хим. 1990; 265:14340–14346. [PubMed] [Google Scholar]
67. Vance JE, Aasman EJ, Szarka R. Брефельдин A не ингибирует перемещение фосфатидилэтаноламина из мест его синтеза на клеточную поверхность. Дж. Биол. Хим. 1991; 266:8241–8247. [PubMed] [Google Scholar]
68. Wu WI, Voelker DR. Характеристика транспорта фосфатидилсерина к локусу фосфатидилсериндекарбоксилазы 2 у пермеабилизированных дрожжей. Дж. Биол. Хим. 2001; 276:7114–7121. [PubMed] [Академия Google]
69. Шумахер М.М., Чой Ю.Ю., Фелькер Д.Р. Транспорт фосфатидилсерина в митохондрии регулируется убиквитинированием. Дж. Биол. Хим. 2002; 277:51033–51042. [PubMed] [Google Scholar]
2002; 277:51033–51042. [PubMed] [Google Scholar]
70. Papadopoulos V, et al. Белок-транслокатор (18 кДа): новая номенклатура бензодиазепиновых рецепторов периферического типа, основанная на его структуре и молекулярной функции. Trends Pharmacol Sci. 2006; 27: 402–409. Обобщаются основные белковые компоненты, участвующие в невезикулярном импорте холестерина в митохондрии клеток, участвующих в синтезе стероидных гормонов. [PubMed] [Академия Google]
71. Hanada K, et al. Молекулярный механизм невезикулярной транспортировки церамида. Природа. 2003; 426: 803–809. Важная статья, определяющая генетические и биохимические механизмы невезикулярного транспорта церамида между ER и аппаратом Гольджи. [PubMed] [Google Scholar]
72. Warnock DE, Lutz MS, Blackburn WA, Young WW, Jr, Baenziger J. U. Транспорт вновь синтезированного глюкозилцерамида к плазматической мембране по пути, отличному от Гольджи. Proc Natl Acad Sci USA. 1994; 91: 2708–2712. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Троттер П.Дж., Ву В.И., Педретти Дж., Йейтс Р., Фолькер Д.Р. Генетический скрининг мутантов транспорта аминофосфолипидов идентифицирует фосфатидилинозитол-4-киназу, STT4p, как важный компонент метаболизма фосфатидилсерина. Дж. Биол. Хим. 1998; 273:13189–13196. [PubMed] [Google Scholar]
Троттер П.Дж., Ву В.И., Педретти Дж., Йейтс Р., Фолькер Д.Р. Генетический скрининг мутантов транспорта аминофосфолипидов идентифицирует фосфатидилинозитол-4-киназу, STT4p, как важный компонент метаболизма фосфатидилсерина. Дж. Биол. Хим. 1998; 273:13189–13196. [PubMed] [Google Scholar]
74. Wu WI, Voelker DR. Восстановление транспорта фосфатидилсерина от химически определенных донорских мембран к фосфатидилсериндекарбоксилазе 2 вовлекает в этот процесс специфические липидные домены. Дж. Биол. Хим. 2004;279: 6635–6642. [PubMed] [Google Scholar]
75. Raychaudhuri S, Im YJ, Hurley JH, Prinz WA. Для перемещения невезикулярных стеролов от плазматической мембраны к ER необходимы белки, связанные с оксистерол-связывающими белками, и фосфоинозитиды. Джей Селл Биол. 2006; 173:107–119. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. D’Angelo G, et al. Синтез гликосфинголипидов требует переноса глюкозилцерамида через FAPP2. Природа. 2007; 449: 62–67. Показано, что FAPP2, белок, который связан с образованием транспортных носителей от Golgi к плазматической мембране, по-видимому, является белком-переносчиком GlcCer, играющим ключевую роль в комплексном синтезе GSL. [PubMed] [Академия Google]
[PubMed] [Академия Google]
77. Awai K, Xu C, Tamot B, Benning C. Связывающий фосфатидную кислоту белок мембраны внутренней оболочки хлоропластов, участвующий в переносе липидов. Proc Natl Acad Sci USA. 2006; 103:10817–10822. Определяет компоненты транспорта и межмембранного распознавания для перемещения фосфолипидов между внешней и внутренней мембранами хлоропластов. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Тефсен Б., Гертсен Дж., Беккерс Ф., Томмассен Дж., де Кок Х. Транспорт липополисахаридов к наружной мембране бактерий в сферопластах. Дж. Биол. Хим. 2005; 280:4504–4509. [PubMed] [Google Scholar]
79. Mousley CJ, Tyeryar KR, Vincent-Pope P, Bankaitis VA. Сверхсемейство Sec14 и регуляторный интерфейс между метаболизмом фосфолипидов и переносом через мембраны. Биохим Биофиз Акта. 2007; 1771: 727–736. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Литвак В., Дахан Н., Рамачандран С., Сабанай Х., Лев С. Поддержание уровня диацилглицерола в аппарате Гольджи белком Nir2 имеет решающее значение для секреторной функции Гольджи. . Природа Клетка Биол. 2005; 7: 225–234. [PubMed] [Академия Google]
. Природа Клетка Биол. 2005; 7: 225–234. [PubMed] [Академия Google]
81. Черномордик Л., Козлов М.М., Циммерберг Дж. Липиды при слиянии биологических мембран. J Membr Biol. 1995; 146:1–14. [PubMed] [Google Scholar]
82. Шемеш Т., Луини А., Малхотра В., Бургер К.Н., Козлов М.М. Предварительное сужение трубчатых носителей Гольджи, вызванное локальным метаболизмом липидов: теоретическая модель. Биофиз Дж. 2003; 85: 3813–3827. [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Gennis RB. Молекулярная структура и функции биомембран. Спрингер Верлаг; Нью-Йорк: 1989. [Google Scholar]
84. Takamori S, et al. Молекулярная анатомия транспортной органеллы. Клетка. 2006; 127:831–846. Тщательная реконструкция синаптических везикул показывает, что холестерин и фосфолипиды (молярное соотношение 0,8) покрывают ~70% поверхности, в то время как трансмембранные спирали покрывают 20% с соотношением липидов/белков 0,75 (вес/вес). [PubMed] [Google Scholar]
85. Дитрих С.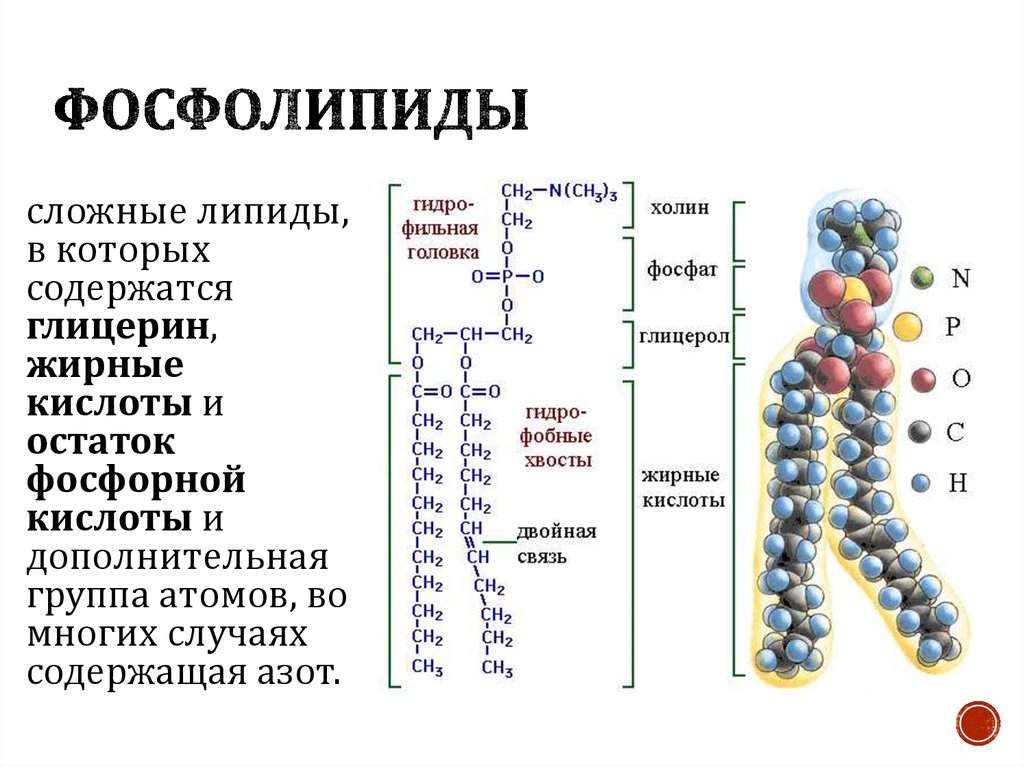 , Воловик З.Н., Леви М., Томпсон Н.Л., Якобсон К. Разделение аналогов Thy-1, GM1 и поперечно-сшитых фосфолипидов на липидные рафты, восстановленные в поддерживаемых модельных мембранных монослоях. Proc Natl Acad Sci USA. 2001;98:10642–10647. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Воловик З.Н., Леви М., Томпсон Н.Л., Якобсон К. Разделение аналогов Thy-1, GM1 и поперечно-сшитых фосфолипидов на липидные рафты, восстановленные в поддерживаемых модельных мембранных монослоях. Proc Natl Acad Sci USA. 2001;98:10642–10647. [Бесплатная статья PMC] [PubMed] [Google Scholar]
86. Morse SA. Базальты и фазовые диаграммы. Спрингер-Верлаг; Нью-Йорк: 1980. [Google Scholar]
87. Партон Р.Г. Ультраструктурная локализация ганглиозидов: GM1 концентрируется в кавеолах. J Гистохим Цитохим. 1994; 42: 155–166. [PubMed] [Google Scholar]
88. Kusumi A, et al. Сдвиг парадигмы концепции плазматической мембраны от двумерной континуальной жидкости к разделенной жидкости: высокоскоростное отслеживание мембранных молекул одной молекулой. Annu Rev Biophys Biomol Struct. 2005; 34: 351–378. Липиды и белки биологических мембран разделены на области размером несколько десятков нанометров, которые имеют различные молекулярные компоненты и свойства. [PubMed] [Академия Google]
89. Lagerholm BC, Weinreb GE, Jacobson K, Thompson NL. Обнаружение микродоменов в интактных клеточных мембранах. Annu Rev Phys Chem. 2005; 56: 309–336. [PubMed] [Google Scholar]
Lagerholm BC, Weinreb GE, Jacobson K, Thompson NL. Обнаружение микродоменов в интактных клеточных мембранах. Annu Rev Phys Chem. 2005; 56: 309–336. [PubMed] [Google Scholar]
90. Feigenson GW, Buboltz JT. Тройная фазовая диаграмма дипальмитоил-ПК/дилауроил-ПК/холестерин: образование наноскопических доменов, управляемое холестерином. Биофиз Дж. 2001; 80: 2775–2788. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Медер Д., Морено М.Дж., Веркаде П., Ваз В.Л., Саймонс К. Сосуществование фаз и связность в апикальной мембране поляризованных эпителиальных клеток. Proc Natl Acad Sci USA. 2006;103:329–334. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Кусуми А., Кояма-Хонда И., Судзуки К. Молекулярная динамика и взаимодействия для создания стабилизированных плотов, индуцированных стимуляцией, из небольших нестабильных стационарных плотов. Трафик. 2004; 5: 213–230. [PubMed] [Google Scholar]
93. Bollinger CR, Teichgraber V, Gulbins E. Обогащенные церамидами мембранные домены. Биохим Биофиз Акта. 2005; 1746: 284–294. [PubMed] [Google Scholar]
Биохим Биофиз Акта. 2005; 1746: 284–294. [PubMed] [Google Scholar]
94. Roux A, et al. Роль кривизны и фазового перехода в сортировке липидов и делении мембранных канальцев. EMBO J. 2005; 24: 1537–1545. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Chiantia S, Kahya N, Ries J, Schwille P. Влияние церамида на домены, упорядоченные в жидкости, исследовано с помощью одновременной АСМ и FCS. Биофиз Дж. 2006; 90: 4500–4508. [Статья бесплатно PMC] [PubMed] [Google Scholar]
96. Sot J, Bagatolli LA, Goni FM, Alonso A. Устойчивые к детергентам, обогащенные церамидом домены в бислоях сфингомиелина/керамида. Биофиз Дж. 2006; 90: 903–914. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Анишкин А., Сухарев С., Коломбини М. Поиск молекулярного расположения трансмембранных церамидных каналов. Биофиз Дж. 2006;90: 2414–2426. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Дитрих С., Ян Б., Фудзивара Т., Кусуми А., Якобсон К. Связь липидных рафтов с переходными зонами удержания, обнаруженная путем отслеживания одиночных частиц. Биофиз Дж. 2002; 82: 274–284. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Биофиз Дж. 2002; 82: 274–284. [Бесплатная статья PMC] [PubMed] [Google Scholar]
99. Sengupta P, Baird B, Holowka D. Липидные плоты, разделение фаз жидкость/жидкость и их отношение к структуре и функции плазматической мембраны. Semin Cell Dev Biol. 2007; 18: 583–590. [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Диббл А.Р., Фейгенсон Г.В. Обнаружение сосуществующих жидких фаз фосфолипидов путем равновесного связывания Ca 2+ : сосуществование фазы Lα с низким содержанием пептидов и богатой пептидами HII в дисперсиях грамицидина A’/фосфолипида. Биохимия. 1994; 33:12945–12953. [PubMed] [Google Scholar]
101. Lewis RN, et al. Исследования минимальной гидрофобности α-спиральных пептидов, необходимой для поддержания стабильной трансмембранной ассоциации с фосфолипидными бислойными мембранами. Биохимия. 2007;46:1042–1054. [Бесплатная статья PMC] [PubMed] [Google Scholar]
102. Якобсон К., Моуритсен О.Г., Андерсон Р.Г. Липидные плоты: на перекрестке между клеточной биологией и физикой.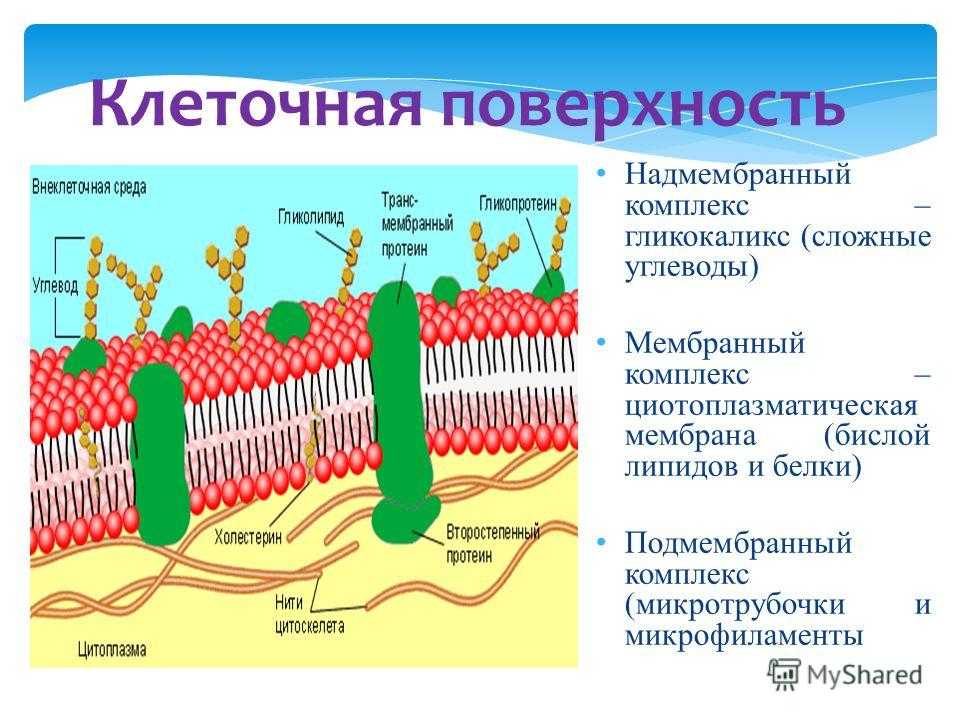 Природа Клетка Биол. 2007; 9: 7–14. Предлагает модель, согласно которой трансмембранные спирали покрывают 15% поверхности и физически контактируют с 30% мембранных липидов, называемых липидами оболочки. Получив сигнал, белки контролируют фазовое поведение, объединяя свою оболочку с аналогичными липидными оболочками других белков. [PubMed] [Google Scholar]
Природа Клетка Биол. 2007; 9: 7–14. Предлагает модель, согласно которой трансмембранные спирали покрывают 15% поверхности и физически контактируют с 30% мембранных липидов, называемых липидами оболочки. Получив сигнал, белки контролируют фазовое поведение, объединяя свою оболочку с аналогичными липидными оболочками других белков. [PubMed] [Google Scholar]
103. Shogomori H, et al. Пальмитоилирование и взаимодействия внутриклеточных доменов способствуют нацеливанию рафта на линкер для активации Т-клеток. Дж. Биол. Хим. 2005;280:18931–18942. [PubMed] [Google Scholar]
104. Браун Д.А. Липидные рафты, устойчивые к детергентам мембраны и сигналы нацеливания рафтов. Физиология. 2006; 21: 430–439. Использование устойчивости к детергентам для изучения свойств биологических мембран дает косвенную информацию о предпочтениях белковой и липидной фаз, но не дает моментального снимка фактического фазового поведения. [PubMed] [Google Scholar]
105. Epand RM. Холестерин и взаимодействие белков с мембранными доменами.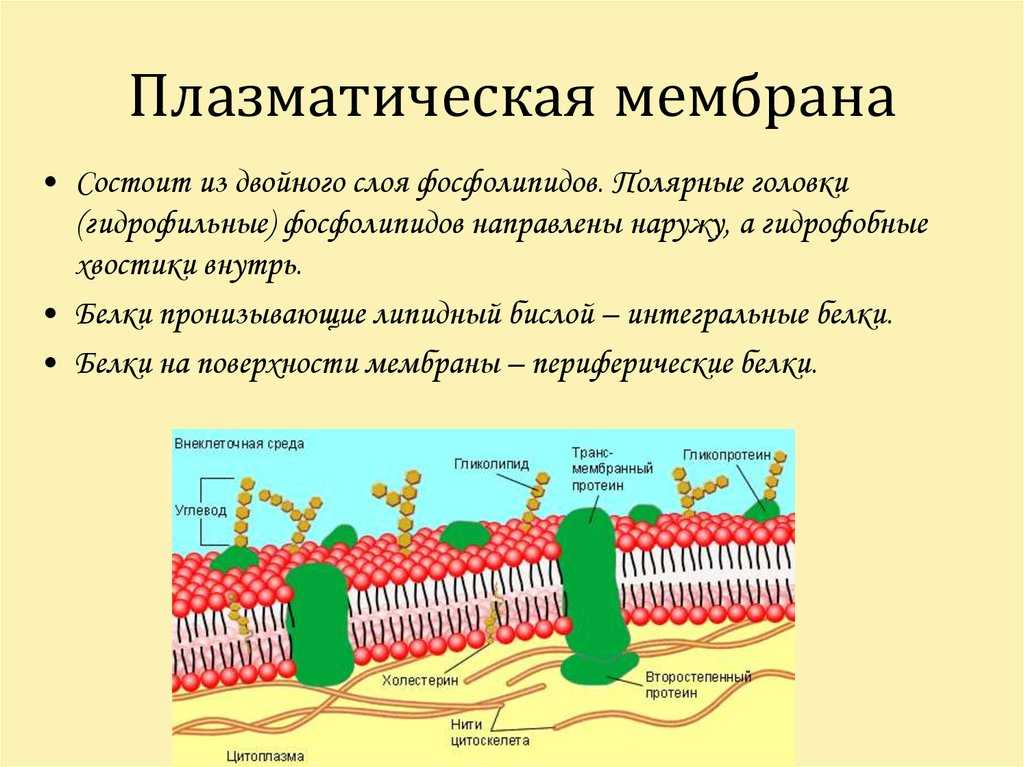 Прог Липид Рез. 2006;45:279–294. [PubMed] [Google Scholar]
Прог Липид Рез. 2006;45:279–294. [PubMed] [Google Scholar]
106. Хэнкок Дж. Ф. Липидные плоты: спорные только с упрощенной точки зрения. Nature Rev Mol Cell Biol. 2006; 7: 456–462. Критическое обсуждение липидных рафтов с акцентом на то, что белок-белковые взаимодействия вносят основной вклад в стабильность доменов на основе липидов и что белки и специфические липиды, такие как холестерин, могут накапливаться на границах доменов и влиять на них. [Бесплатная статья PMC] [PubMed] [Google Scholar]
107. London E, Feigenson GW. Тушение флуоресценции в модельных мембранах. 2 Определение локального липидного окружения аденозинтрифосфатазы кальция из саркоплазматического ретикулума. Биохимия. 1981;20:1939–1948. [PubMed] [Google Scholar]
108. Кэффри М., Фейгенсон Г.В. Тушение флуоресценции в модельных мембранах. 3 Взаимосвязь между активностью фермента аденозинтрифосфатазы кальция и сродством белка к фосфатидилхолинам с различными характеристиками ацильной цепи. Биохимия. 1981; 20:1949–1961. [PubMed] [Google Scholar]
1981; 20:1949–1961. [PubMed] [Google Scholar]
109. Эсманн М., Марш Д. Липидно-белковые взаимодействия с Na, K-АТФазой. Хим. физ. липиды. 2006; 141:94–104. [PubMed] [Академия Google]
110. Soubias O, Teague WE, Gawrish K. Доказательства специфичности взаимодействий липид-родопсин. Дж. Биол. Хим. 2006; 281:33233–33241. [PubMed] [Google Scholar]
111. Андерсен О.С., Кеппе Р.Е., Толщина 2-го бислоя и функция мембранного белка: энергетическая перспектива. Annu Rev Biophys Biomol Struct. 2007; 36: 107–130. [PubMed] [Google Scholar]
112. Sharma P, et al. Наноразмерная организация нескольких GPI-заякоренных белков в мембранах живых клеток. Клетка. 2004; 116: 577–589.. [PubMed] [Google Scholar]
113. Recktenwald DJ, McConnell HM. Фазовые равновесия в бинарных смесях фосфатидилхолина и холестерина. Биохимия. 1981; 20:4505–4510. [PubMed] [Google Scholar]
114. Wang TY, Silvius JR. Холестерин не вызывает сегрегацию жидкостно-упорядоченных доменов в бислоях, моделирующих внутренний листок плазматической мембраны. Биофиз Дж. 2001; 81: 2762–2773. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Биофиз Дж. 2001; 81: 2762–2773. [Бесплатная статья PMC] [PubMed] [Google Scholar]
115. Kiessling V, Crane JM, Tamm LK. Трансбислойные эффекты плотообразных липидных доменов в асимметричных плоских бислоях, измеренные путем отслеживания одиночных молекул. Биофиз Дж. 2006;91:3313–3326. [Бесплатная статья PMC] [PubMed] [Google Scholar]
116. van Meer G, Halter D, Sprong H, Somerharju P, Egmond MR. Транспортеры липидов ABC: экструдеры, флиппазы или активаторы без хлопков? ФЭБС лат. 2006; 580:1171–1177. [PubMed] [Google Scholar]
117. Витч С.Л., Келлер С.Л. Разделение жидких фаз в гигантских везикулах тройных смесей фосфолипидов и холестерина. Биофиз Дж. 2003; 85: 3074–3083. [PMC бесплатная статья] [PubMed] [Google Scholar]
118. Витч С.Л., Полозов И.В., Гавриш К., Келлер С.Л. Жидкие домены в везикулах исследованы методами ЯМР и флуоресцентной микроскопии. Биофиз Дж. 2004; 86:2910–2922. [Бесплатная статья PMC] [PubMed] [Google Scholar]
119. Wassall SR, et al.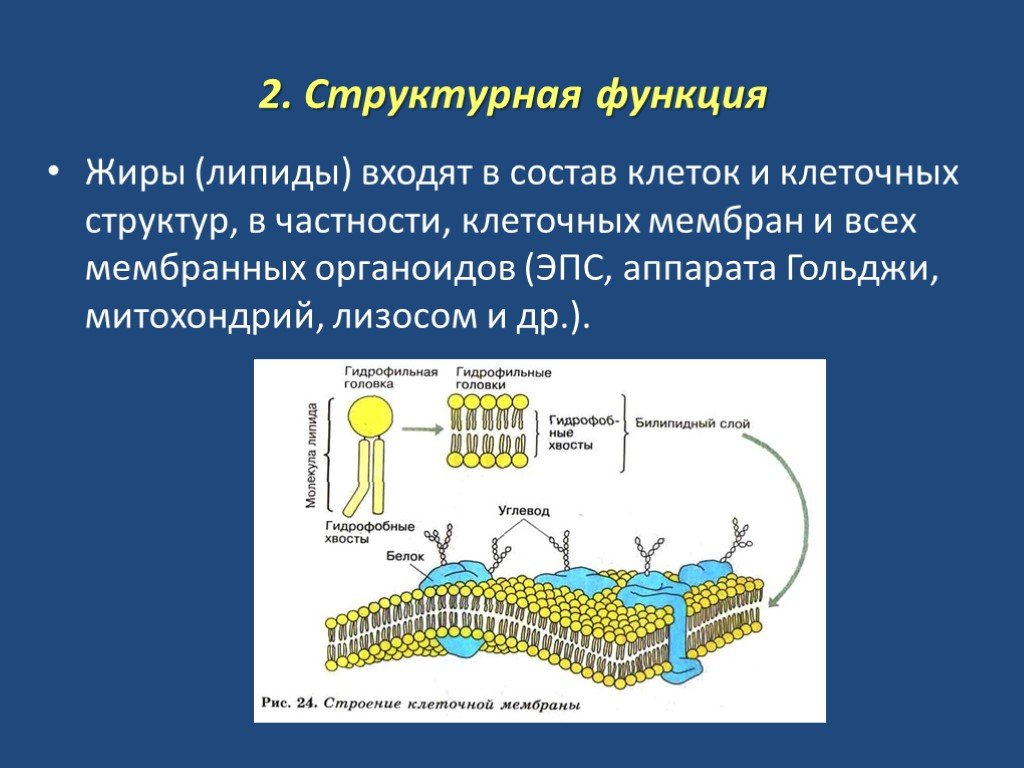 Порядок из беспорядка, связывающий холестерин с хаотическими липидами. Роль полиненасыщенных липидов в формировании мембранных рафтов. Хим. физ. липиды. 2004; 132:79–88. [PubMed] [Google Scholar]
Порядок из беспорядка, связывающий холестерин с хаотическими липидами. Роль полиненасыщенных липидов в формировании мембранных рафтов. Хим. физ. липиды. 2004; 132:79–88. [PubMed] [Google Scholar]
120. Витч С.Л., Гавриш К., Келлер С.Л. Разрыв смешиваемости с замкнутым контуром и количественные связи в тройных мембранах, содержащих дифитаноил PC. Биофиз Дж. 2006; 90: 4428–4436. [Бесплатная статья PMC] [PubMed] [Google Scholar]
121. Бахт О., Патхак П., Лондон Э. Влияние структуры липидов, способствующей образованию неупорядоченных доменов, на стабильность холестеринсодержащих упорядоченных доменов (липидных рафтов): идентификация множественных механизмов стабилизации рафтов. Биофиз Дж. 2007; 93: 4307–4318. Полиненасыщенные ацильные цепи мембранных липидов могут эффективно управлять образованием мембранных рафтов из-за особенно плохой упаковки холестерином. [Бесплатная статья PMC] [PubMed] [Google Scholar]
122. Kucerka N, Tristram-Nagle S, Nagle JF. Более пристальный взгляд на структуру полностью гидратированных бислоев DPPC в жидкой фазе.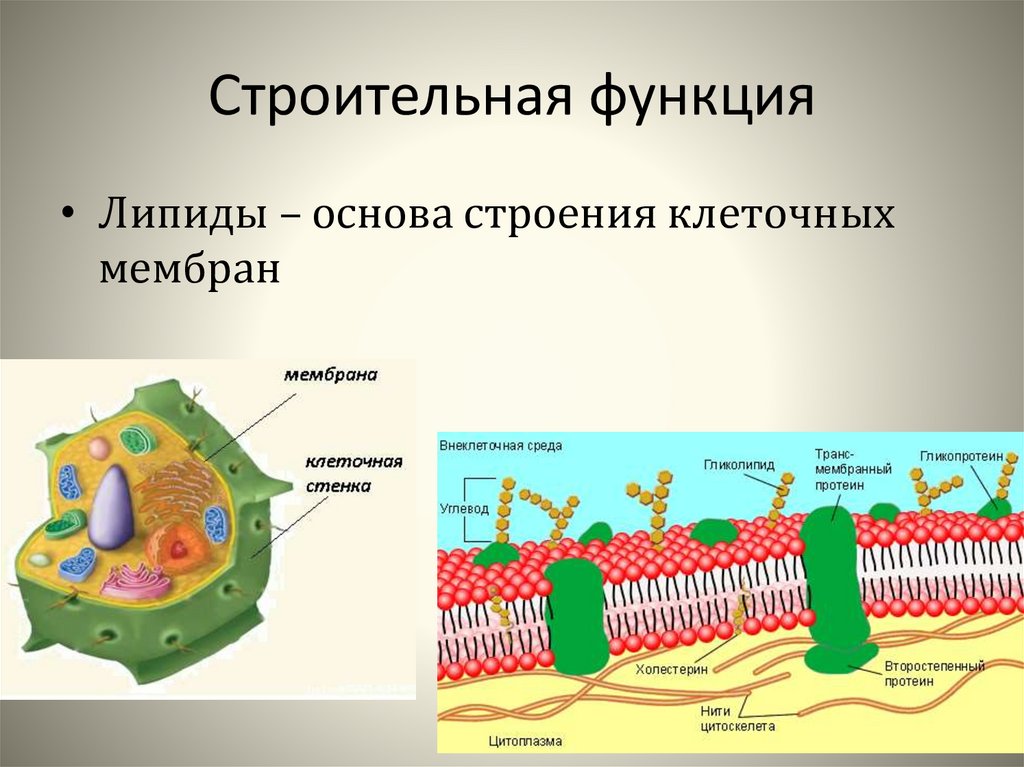 Биофиз Дж. 2006;90:L83–L85. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Биофиз Дж. 2006;90:L83–L85. [Бесплатная статья PMC] [PubMed] [Google Scholar]
123. Liu K, Hua Z, Nepute JA, Graham TR. Р4-АТФазы дрожжей Drs2p и Dnf1p являются важными грузами эндоцитарного пути NPFXD/Sla1p. Мол Биол Селл. 2007; 18: 487–500. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Cell | Определение, типы, функции, схема, деление, теория и факты
животная клетка
Посмотреть все СМИ
- Ключевые люди:
- Торбьорн Оскар Касперссон Даниэль Мазия Фред Х. Гейдж Линн Маргулис Ральф М. Штейнман
- Похожие темы:
- стволовая клетка салфетка жировая клетка восстановление ДНК мембрана
Просмотреть весь связанный контент →
Популярные вопросы
Что такое клетка?
Клетка представляет собой массу цитоплазмы, которая снаружи связана клеточной мембраной. Обычно микроскопические по размеру клетки являются мельчайшими структурными единицами живой материи и составляют все живое.
Что такое клеточная теория?
Клеточная теория утверждает, что клетка является фундаментальной структурной и функциональной единицей живой материи. В 1839 году немецкий физиолог Теодор Шванн и немецкий ботаник Маттиас Шлейден провозгласили, что клетки являются «элементарными частицами организмов» как растений, так и животных, и признали, что одни организмы одноклеточные, а другие многоклеточные. Эта теория ознаменовала большой концептуальный прорыв в биологии и привела к возобновлению внимания к жизненным процессам, происходящим в клетках.
Что делают клеточные мембраны?
Клеточная мембрана окружает каждую живую клетку и отделяет клетку от окружающей среды.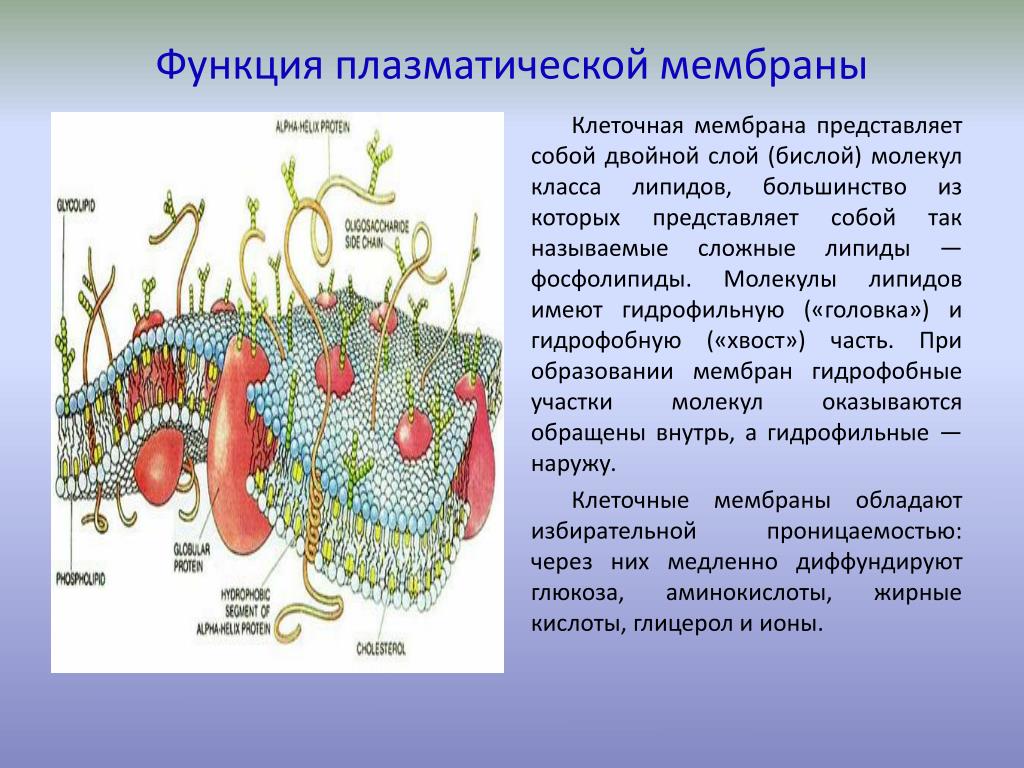 Он служит барьером для удержания содержимого клетки внутри и проникновения нежелательных веществ. Он также функционирует как ворота для активного и пассивного перемещения основных питательных веществ в клетку и выхода из нее отходов. Определенные белки в клеточной мембране участвуют в межклеточных коммуникациях и помогают клетке реагировать на изменения в окружающей среде.
Он служит барьером для удержания содержимого клетки внутри и проникновения нежелательных веществ. Он также функционирует как ворота для активного и пассивного перемещения основных питательных веществ в клетку и выхода из нее отходов. Определенные белки в клеточной мембране участвуют в межклеточных коммуникациях и помогают клетке реагировать на изменения в окружающей среде.
клетка , в биологии основная связанная с мембраной единица, содержащая основные молекулы жизни и из которой состоят все живые существа. Отдельная клетка часто сама по себе является целым организмом, таким как бактерия или дрожжи. Другие клетки приобретают специализированные функции по мере своего созревания. Эти клетки взаимодействуют с другими специализированными клетками и становятся строительными блоками больших многоклеточных организмов, таких как люди и другие животные. Хотя клетки намного больше атомов, они все же очень малы. Самые маленькие известные клетки представляют собой группу крошечных бактерий, называемых микоплазмами; некоторые из этих одноклеточных организмов представляют собой сферы размером всего 0,2 мкм в диаметре (1 мкм = примерно 0,000039дюйм) с общей массой 10 -14 граммов, что равно массе 8 000 000 000 атомов водорода.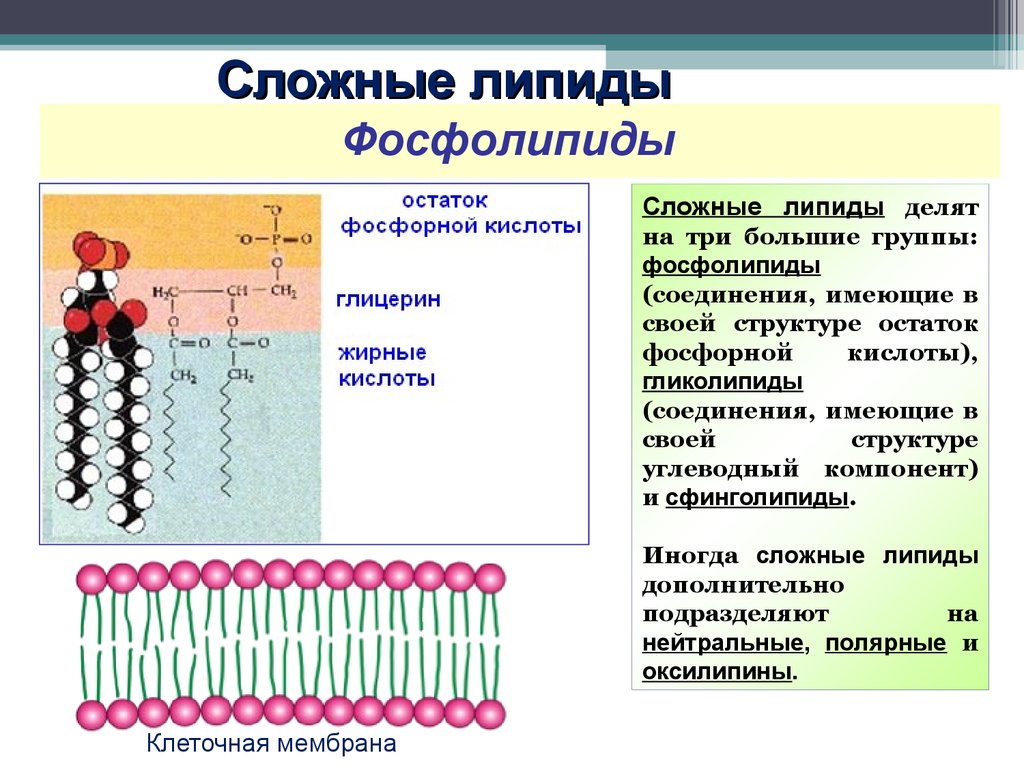 Клетки человека обычно имеют массу в 400 000 раз больше, чем масса одной микоплазменной бактерии, но даже человеческие клетки имеют диаметр всего около 20 мкм. Чтобы покрыть головку булавки, потребовался бы лист примерно из 10 000 человеческих клеток, а каждый человеческий организм состоит из более чем 30 000 000 000 000 клеток.
Клетки человека обычно имеют массу в 400 000 раз больше, чем масса одной микоплазменной бактерии, но даже человеческие клетки имеют диаметр всего около 20 мкм. Чтобы покрыть головку булавки, потребовался бы лист примерно из 10 000 человеческих клеток, а каждый человеческий организм состоит из более чем 30 000 000 000 000 клеток.
сходства и различия клеток
Посмотреть все видео к этой статье В этой статье клетка обсуждается как отдельная единица, так и составляющая часть более крупного организма. Как индивидуальная единица, клетка способна усваивать свои собственные питательные вещества, синтезировать многие типы молекул, обеспечивать свою собственную энергию и воспроизводить себя, чтобы производить последующие поколения. Его можно рассматривать как закрытый сосуд, внутри которого одновременно протекают бесчисленные химические реакции. Эти реакции находятся под очень точным контролем, так что они способствуют жизни и размножению клетки. В многоклеточном организме клетки становятся специализированными для выполнения различных функций в процессе дифференцировки. Для этого каждая клетка поддерживает постоянную связь со своими соседями. Получая питательные вещества из окружающей среды и выбрасывая в нее отходы, она прикрепляется к другим клеткам и сотрудничает с ними. Кооперативные сборки подобных клеток образуют ткани, а кооперация между тканями, в свою очередь, образует органы, выполняющие функции, необходимые для поддержания жизни организма.
Для этого каждая клетка поддерживает постоянную связь со своими соседями. Получая питательные вещества из окружающей среды и выбрасывая в нее отходы, она прикрепляется к другим клеткам и сотрудничает с ними. Кооперативные сборки подобных клеток образуют ткани, а кооперация между тканями, в свою очередь, образует органы, выполняющие функции, необходимые для поддержания жизни организма.
Рассмотрим, как одноклеточный организм содержит необходимые структуры для питания, роста и размножения
Просмотреть все видео к этой статьеОсобое внимание в этой статье уделяется животным клеткам с некоторым обсуждением процессов синтеза энергии и внеклеточных компоненты, присущие растениям. (Для подробного обсуждения биохимии растительных клеток см. см. фотосинтез. Для полного рассмотрения генетических событий в клеточном ядре см. см. наследственность.)
Брюс М. Альбертс
Природа и функции клеток
Клетка окружена плазматической мембраной, которая образует селективный барьер, который позволяет питательным веществам проникать и выходить отходам.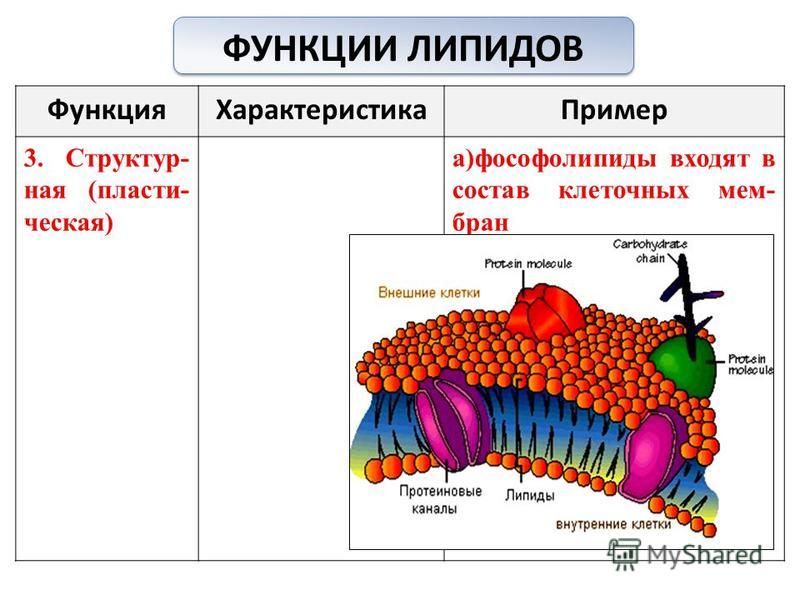 Внутренняя часть клетки организована в виде множества специализированных отделений или органелл, каждое из которых окружено отдельной мембраной. Одна главная органелла, ядро, содержит генетическую информацию, необходимую для роста и размножения клеток. Каждая клетка содержит только одно ядро, тогда как другие типы органелл присутствуют во множественных экземплярах в клеточном содержимом или цитоплазме. Органеллы включают митохондрии, которые отвечают за энергетические обмены, необходимые для выживания клеток; лизосомы, которые переваривают нежелательные вещества внутри клетки; и эндоплазматический ретикулум и аппарат Гольджи, которые играют важную роль во внутренней организации клетки, синтезируя выбранные молекулы, а затем обрабатывая, сортируя и направляя их в нужное место. Кроме того, растительные клетки содержат хлоропласты, отвечающие за фотосинтез, при котором энергия солнечного света используется для преобразования молекул углекислого газа (CO 2 ) и воду (H 2 O) в углеводы.
Внутренняя часть клетки организована в виде множества специализированных отделений или органелл, каждое из которых окружено отдельной мембраной. Одна главная органелла, ядро, содержит генетическую информацию, необходимую для роста и размножения клеток. Каждая клетка содержит только одно ядро, тогда как другие типы органелл присутствуют во множественных экземплярах в клеточном содержимом или цитоплазме. Органеллы включают митохондрии, которые отвечают за энергетические обмены, необходимые для выживания клеток; лизосомы, которые переваривают нежелательные вещества внутри клетки; и эндоплазматический ретикулум и аппарат Гольджи, которые играют важную роль во внутренней организации клетки, синтезируя выбранные молекулы, а затем обрабатывая, сортируя и направляя их в нужное место. Кроме того, растительные клетки содержат хлоропласты, отвечающие за фотосинтез, при котором энергия солнечного света используется для преобразования молекул углекислого газа (CO 2 ) и воду (H 2 O) в углеводы. Между всеми этими органеллами находится пространство в цитоплазме, называемое цитозолем. Цитозоль содержит организованный каркас волокнистых молекул, составляющих цитоскелет, который придает клетке форму, позволяет органеллам двигаться внутри клетки и обеспечивает механизм, с помощью которого может двигаться сама клетка. Цитозоль также содержит более 10 000 различных видов молекул, которые участвуют в клеточном биосинтезе — процессе образования больших биологических молекул из малых.
Между всеми этими органеллами находится пространство в цитоплазме, называемое цитозолем. Цитозоль содержит организованный каркас волокнистых молекул, составляющих цитоскелет, который придает клетке форму, позволяет органеллам двигаться внутри клетки и обеспечивает механизм, с помощью которого может двигаться сама клетка. Цитозоль также содержит более 10 000 различных видов молекул, которые участвуют в клеточном биосинтезе — процессе образования больших биологических молекул из малых.
Викторина «Британника»
Викторина «Части клетки»
Специализированные органеллы характерны для клеток организмов, известных как эукариоты. Напротив, клетки организмов, известных как прокариоты, не содержат органелл и обычно меньше эукариотических клеток. Однако все клетки имеют сильное сходство в биохимических функциях.
Молекулы клеток
Понять, как клеточные мембраны регулируют потребление пищи и отходы и как клеточные стенки обеспечивают защиту
Посмотреть все видео к этой статье Клетки содержат особый набор молекул, окруженных мембраной.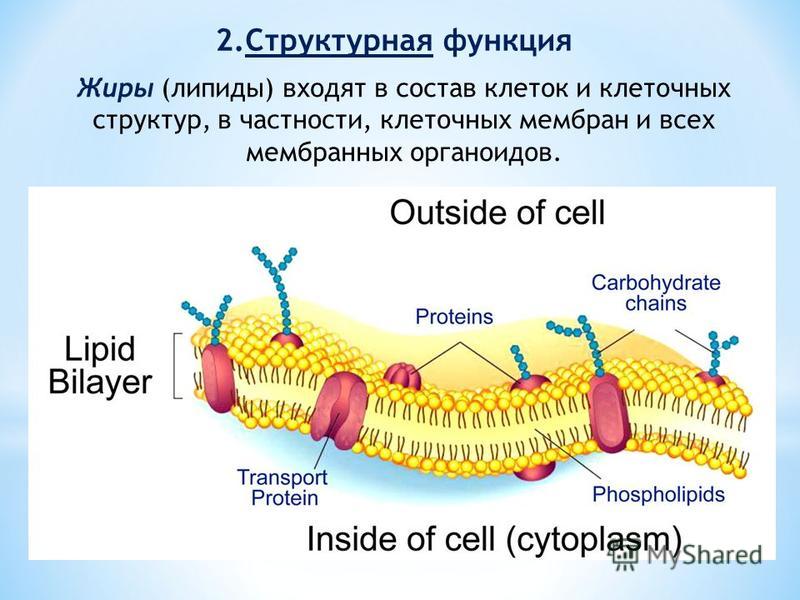 Эти молекулы дают клеткам возможность расти и размножаться. Общий процесс клеточного размножения происходит в два этапа: рост клеток и деление клеток. Во время роста клетка поглощает определенные молекулы из своего окружения, избирательно перенося их через свою клеточную мембрану. Оказавшись внутри клетки, эти молекулы подвергаются действию узкоспециализированных, больших, искусно свернутых молекул, называемых ферментами. Ферменты действуют как катализаторы, связываясь с проглоченными молекулами и регулируя скорость их химического изменения. Эти химические изменения делают молекулы более полезными для клетки. В отличие от проглоченных молекул, катализаторы сами по себе не изменяются химически во время реакции, что позволяет одному катализатору регулировать конкретную химическую реакцию во многих молекулах.
Эти молекулы дают клеткам возможность расти и размножаться. Общий процесс клеточного размножения происходит в два этапа: рост клеток и деление клеток. Во время роста клетка поглощает определенные молекулы из своего окружения, избирательно перенося их через свою клеточную мембрану. Оказавшись внутри клетки, эти молекулы подвергаются действию узкоспециализированных, больших, искусно свернутых молекул, называемых ферментами. Ферменты действуют как катализаторы, связываясь с проглоченными молекулами и регулируя скорость их химического изменения. Эти химические изменения делают молекулы более полезными для клетки. В отличие от проглоченных молекул, катализаторы сами по себе не изменяются химически во время реакции, что позволяет одному катализатору регулировать конкретную химическую реакцию во многих молекулах.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Биологические катализаторы создают цепочки реакций. Другими словами, молекула, химически преобразованная одним катализатором, служит исходным материалом или субстратом для второго катализатора и так далее.


Leave A Comment