Что такое митохондрия? — Мэлсмон
Клетка – это сложная система, живущая по своим законам и правилам. Организация клетки сложна и многогранна: для правильного функционирования органеллы – составляющие клетки – должны находиться в гармонии, при этом каждая должна выполнять свою уникальную функцию своевременно и полноценно. И только одна структура – митохондрия – имеет целый ряд специфических задач. Многофункциональность и уникальность митохондрии стала причиной возникновения теории ее бактериального происхождения.
Митохондрия, о существовании которой узнали в середине XIX века, на протяжении практически 150 лет считалась исключительно энергетической станцией клетки. Действительно, основной функцией митохондрии является преобразование питательных веществ в полезную энергию с использованием молекул кислорода – синтез молекул АТФ. Этот процесс генерирования энергии внутри клетки известен как клеточное дыхание. Организм использует энергию АТФ, расходуя ее на проведение нервного сигнала, мышечное сокращение, образование тепла, синтез нужных клеточных компонентов, уничтожение ненужных веществ и пр.
Около 600 млн лет назад в клетку так называемых гетеротрофов внедряется бактерия, которая умеет утилизировать кислород. Есть точка зрения, что появление внутри клетки нового типа бактерий было вызвано постоянным увеличением в атмосфере Земли кислорода, начавшим поступать из мирового океана в атмосферу около 2,4 млрд лет назад. Высокая окислительная способность кислорода представляла опасность для внутриклеточных органических и неорганических элементов, и появляются бактерии, уничтожающие кислород в присутствии ионов водорода с образованием воды. Таким образом внутри клетки содержание кислорода уменьшается, а с ним и уменьшается вероятность нежелательного окисления клеточных компонентов, что, наверно, полезно для клетки.
Хотя митохондрия была первоначально идентифицирована как ключевая органелла, по существу необходимая для выработки энергии и окислительного метаболизма, существует немало свидетельств того, что митохондрии тесно вовлечены в регуляцию жизненно важных клеточных процессов, таких как запрограммированная гибель и рост клеток. Открытие митохондриальных «формирующих белков» (Dynamin-related protein (Drp), mitofusins (Mfn) и т.д.) показало, что митохондрии являются высокодинамичными органеллами, постоянно меняющими морфологию в результате процессов деления и слияния.
Открытие митохондриальных «формирующих белков» (Dynamin-related protein (Drp), mitofusins (Mfn) и т.д.) показало, что митохондрии являются высокодинамичными органеллами, постоянно меняющими морфологию в результате процессов деления и слияния.
Еще одной уникальной особенностью митохондрии является наличие собственной ДНК (митохондриальная ДНК), причем наследуется она только от матери.
В зависимости от энергетической потребности каждой клетки, содержание в ней митохондрий может варьироваться от одной-двух до нескольких тысяч штук. Как известно, самыми энергопотребляемыми клетками являются клетки мышц, сердца, печени, почек и мозга. Соответственно, содержание в них митохондрий является максимальным.
На основе статьи: Митохондрии помнят, что они были бактериями. Журнал «Коммерсантъ Наука» №5 от 28.07.2017, стр. 25. Дмитрий Зоров, доктор биологических наук, МГУ им. М.В. Ломоносова
Что влияет на функционирование митохондрии?С возрастом функции митохондрий прогрессивно ухудшаются. Митохондрии теряют свою дыхательную активность, накапливаются повреждения в их митохондриальной ДНК, и образуется чрезмерное количество активных форм кислорода (свободные радикалы). Между 30 и 70 годами, в среднем, функция митохондрий ухудшается на 25-30%.
Митохондрии теряют свою дыхательную активность, накапливаются повреждения в их митохондриальной ДНК, и образуется чрезмерное количество активных форм кислорода (свободные радикалы). Между 30 и 70 годами, в среднем, функция митохондрий ухудшается на 25-30%.
Что же является причиной нарушений функционирования митохондрий? Ответ, как всегда, лежит на поверхности: митохондриальная дисфункция является причиной самой жизни.
Наследственность, солнечная активность, загрязненный воздух больших городов, неправильное и несбалансированное питание, вредные привычки, гиподинамия, стресс – все это в совокупности и по-отдельности приводит к тому, что страдают самые маленькие, но при это столь важные, составляющие нашего тела – митохондрии.
Безусловно, старение неизбежно. Но наш биологический возраст может сильно отличаться от хронологического, причем митохондрии имеют много общего с биологическим старением. По данным недавних исследований, темпы биологического старения могут сильно отличаться у разных людей.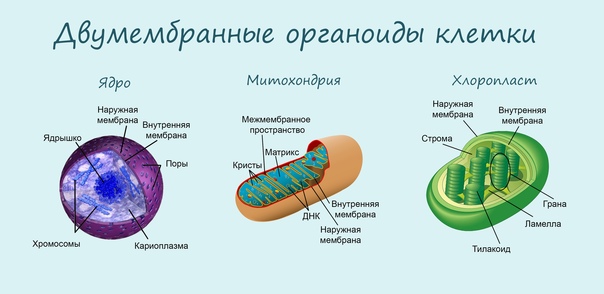 Исследователи измерили более десятка различных биомаркеров, таких как длина теломера, повреждение ДНК, холестерин ЛПНП, метаболизм глюкозы и чувствительность к инсулину, в трех точках жизни людей: в возрасте 22, 32 и 38 лет.
Исследователи измерили более десятка различных биомаркеров, таких как длина теломера, повреждение ДНК, холестерин ЛПНП, метаболизм глюкозы и чувствительность к инсулину, в трех точках жизни людей: в возрасте 22, 32 и 38 лет.
«Мы обнаружили, что кто-то в возрасте 38 лет биологически мог выглядеть на 10 лет моложе или старше, судя по биологическим маркерам. Несмотря на одинаковый возраст, биологическое старение происходит совершенно разными темпами. Интересно, что когда этих людей сфотографировали и показали их фотографии прохожим с просьбой угадать хронологический возраст изображенных людей, то люди угадывали биологический, а не хронологической возраст».
Таким образом, возраст, на который нас воспринимают окружающие, напрямую соответствует биологическим биомаркерам, которые в значительной степени обусловлены здоровьем митохондрий. Поэтому, хотя старения и не избежать, поддержание собственных митохондрий в здоровом состоянии позволяет в значительной степени управлять процессом старения.
Насколько важна клеточная энергия и функция митохондрий?
Низкий уровень энергии = Возможные генетические ошибки (Болезнь клетки)
Нормальный уровень энергии = Правильный синтез генов и белков (Здоровая клетка)
Митохондриальная дисфункция вовлечена практически во все заболеванияВ последний десятилетия во всем мире активно изучается вопрос связи митохондриальной активности и возрастассоциированных заболеваний. Как оказалось, митохондрии оказывают непосредственное влияние на работу всего организма в целом:
- Нейродегенартивные заболевания
- Исследователи клиники Майо, использующие генетические мышиные модели, обнаружили, что митохондрии в клетках головного мозга перестают нормально функционировать уже на ранних стадиях заболевания Альцгеймера (1). Помимо этого, растущее количество исследований подтверждает связь между болезнью Альцгеймера и диабетом II типа. Пациенты с сахарным диабетом II типа имеют значительно повышенный риск развития болезни Альцгеймера и наоборот (2).
 Недавние результаты генетических исследований показывают, что дефектный контроль качества митохондрий может играть важную роль в развитии болезни Паркинсона (10).
Недавние результаты генетических исследований показывают, что дефектный контроль качества митохондрий может играть важную роль в развитии болезни Паркинсона (10).
- Исследователи клиники Майо, использующие генетические мышиные модели, обнаружили, что митохондрии в клетках головного мозга перестают нормально функционировать уже на ранних стадиях заболевания Альцгеймера (1). Помимо этого, растущее количество исследований подтверждает связь между болезнью Альцгеймера и диабетом II типа. Пациенты с сахарным диабетом II типа имеют значительно повышенный риск развития болезни Альцгеймера и наоборот (2).
- Развитие онкологических заболеваний
- Митохондрии играют важную роль в питании клеток, генерируя АТФ. Они также являются основным источником генерирования активных форм кислорода (АФК), которые играют регулирующую роль в процессе жизни и естественной гибели клеток. Мутации в митохондриальной ДНК и нарушение регуляции митохондриального метаболизма часто описываются в опухолях человека. Хотя роль окислительного стресса как следствия мутаций митохондриальной ДНК была доказана достаточно давно, причинная роль митохондрий в прогрессировании опухоли была продемонстрирована только недавно. (3)
- Синдром хронической усталости
- Синдром хронической усталости (или миалгический энцефаломиелит) является физиологическим состоянием, при котором пациент чувствует высокий уровень усталости без очевидной причины.

- Синдром хронической усталости (или миалгический энцефаломиелит) является физиологическим состоянием, при котором пациент чувствует высокий уровень усталости без очевидной причины.
- Диабет
- Исследования предоставили доказательства митохондриальной дисфункции в скелетных мышцах пациентов с диабетом II и преддиабетического типа, главным образом из-за более низкого содержания митохондрий (митохондриальный биогенез) (2, 8).
- Заболевания сердца и сосудистой системы
- Сердечная недостаточность является одной из главных проблем общественного здравоохранения, и в настоящее время нет профилактического лечения. Существующая терапия обеспечивает симптоматическое облегчение, но не может обратить вспять молекулярные изменения, которые происходят в кардиомиоцитах. Механизмы сердечной недостаточности являются сложными и множественными, но одним из критических факторов развития этого заболевания является митохондриальная дисфункция.

- Сердечная недостаточность является одной из главных проблем общественного здравоохранения, и в настоящее время нет профилактического лечения. Существующая терапия обеспечивает симптоматическое облегчение, но не может обратить вспять молекулярные изменения, которые происходят в кардиомиоцитах. Механизмы сердечной недостаточности являются сложными и множественными, но одним из критических факторов развития этого заболевания является митохондриальная дисфункция.
- Mitochondrial dysfunction is a trigger of Alzheimer’s disease pathophysiology. Paula I. Moreira, Cristina Carvalho, Xiongwei Zhu, Mark A. Smith, George Perry; Volume 1802, Issue 1, January 2010, Pages 2-10
- Inflammation, defective insulin signaling, and mitochondrial dysfunction as common molecular denominators connecting type 2 diabetes to Alzheimer disease. De Felice FG, Ferreira ST; Diabetes. 2014 Jul;63(7):2262-72. doi: 10.2337/db13-1954. Epub 2014 Jun 15.
- Mitochondrial dysfunction and cancer metastasis. Chen EI. J Bioenerg Biomembr. 2012 Dec;44(6):619-22. doi: 10.1007/s10863-012-9465-9.
- Mitochondrial dysfunction and the pathophysiology of Myalgic Encephalomyelitis/Chronic Fatigue Syndrome (ME/CFS). Booth NE, Myhill S, McLaren-Howard J. Int J Clin Exp Med. 2012;5(3):208-20. Epub 2012 Jun 15.
- Targeting mitochondrial dysfunction in the treatment of Myalgic Encephalomyelitis/Chronic Fatigue Syndrome (ME/CFS) — a clinical audit.
 Myhill S, Booth NE, McLaren-Howard J. Int J Clin Exp Med. 2013;6(1):1-15. Epub 2012 Nov 20.
Myhill S, Booth NE, McLaren-Howard J. Int J Clin Exp Med. 2013;6(1):1-15. Epub 2012 Nov 20. - Patients with chronic fatigue syndrome performed worse than controls in a controlled repeated exercise study despite a normal oxidative phosphorylation capacity. Vermeulen RC, Kurk RM, Visser FC, Sluiter W, Scholte HR. J Transl Med. 2010 Oct 11;8:93. doi: 10.1186/1479-5876-8-93.
- Chronic fatigue syndrome and mitochondrial dysfunction. Sarah Myhill, Norman E. Booth, John McLaren-Howard. Int J Clin Exp Med. 2009; 2(1): 1–16. Published online 2009 Jan 15.
- Mitochondrial dysfunction in type 2 diabetes and obesity. Højlund K, Mogensen M, Sahlin K, Beck-Nielsen H. Endocrinol Metab Clin North Am. 2008 Sep;37(3):713-31, x. doi: 10.1016/j.ecl.2008.06.006.
- Mitochondria as a therapeutic target in heart failure. Bayeva M, Gheorghiade M, Ardehali H. J Am Coll Cardiol. 2013 Feb 12;61(6):599-610. doi: 10.1016/j.jacc.2012.08.1021. Epub 2012 Dec 5.

- Mitochondrial quality control and Parkinson’s disease: a pathway unfolds. de Castro IP, Martins LM, Loh SH. Mol Neurobiol. 2011 Apr;43(2):80-6. doi: 10.1007/s12035-010-8150-4. Epub 2010 Dec 1.
Учитывая то, что здоровье митохондрии в конечном счете сказывается на здоровье всего организма в целом, первые признаки нарушения работы митохондрий могут быть весьма разнообразны.
Общее состояние
Дефицит энергии в первую очередь отражается на нашем общем самочувствии. Это быстрая утомляемость – нам чаще нужна передышка при выполнении привычных дел. Непроходящее чувство слабости даже после выпитого кофе. Повышенная тревога и раздражительность, нарушенный сон. Последствия всего этого отражаются на нашем внешнем виде. Кожа становится уставшей, тусклой и истончённая. Лицо приобретает сероватый цвет, видны круги под глазами, появляются раздражения кожи. Постепенно ухудшается здоровье, мы чаще начинаем болеть, особенно в хронической форме.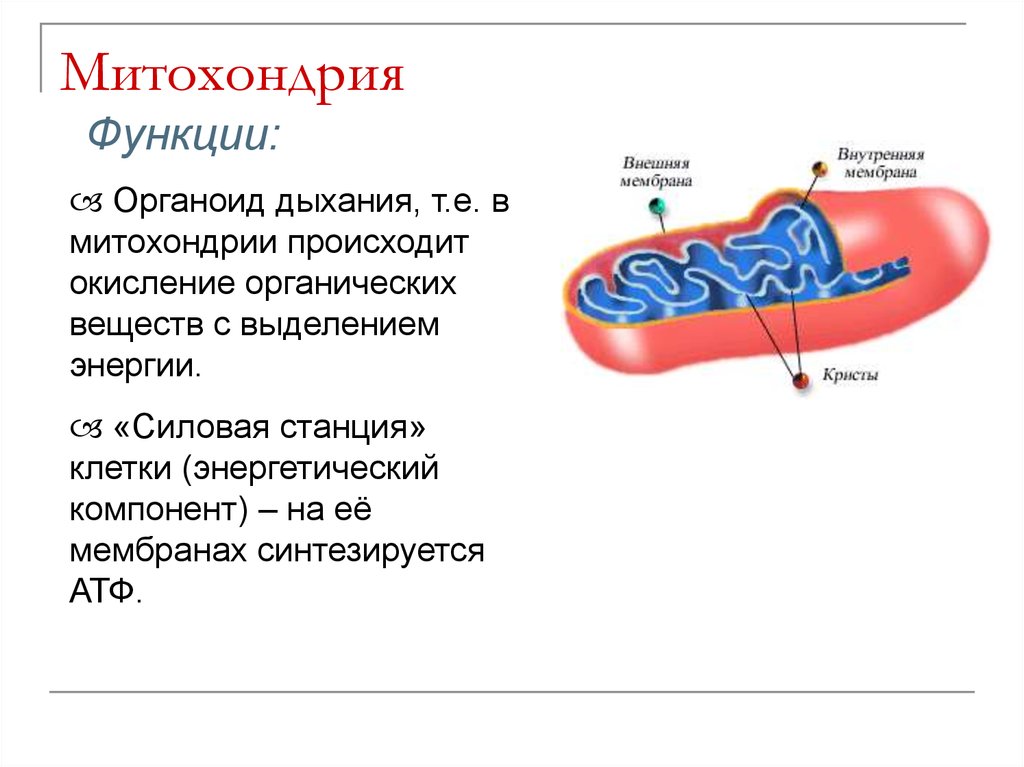 Всё заметнее признаки старения – тело стареет быстрее.
Всё заметнее признаки старения – тело стареет быстрее.
Здоровый образ жизни
Синдром энергодефицита отражается на нашей физической активности. Посещения спортивного зала становится сопряжено с сильным переутомлением. Подходы к снарядам занимают больше времени и требуют больше усилий. Восстановление энергии происходит медленно, порой не ощущается вовсе.
Клеточный энергодефицит также приводит к низкой усвояемости питательных веществ. Это драматически влияет на эффективность выбранной диеты. Неспособность эффективно усваивать необходимые химические элементы приводит к сложным последствиям для нашего организма.
Интимная жизнь
Клеточный энергодефицит приводит к снижению либидо – ослабевает сексуальное влечение. Мы уделяем меньше внимания партнёру, получаем меньше удовольствия от интимной близости. У женщин, хронический энергодефицит способствует преждевременному наступлению менопаузы и климакса с соответствующим симптомокомплексом.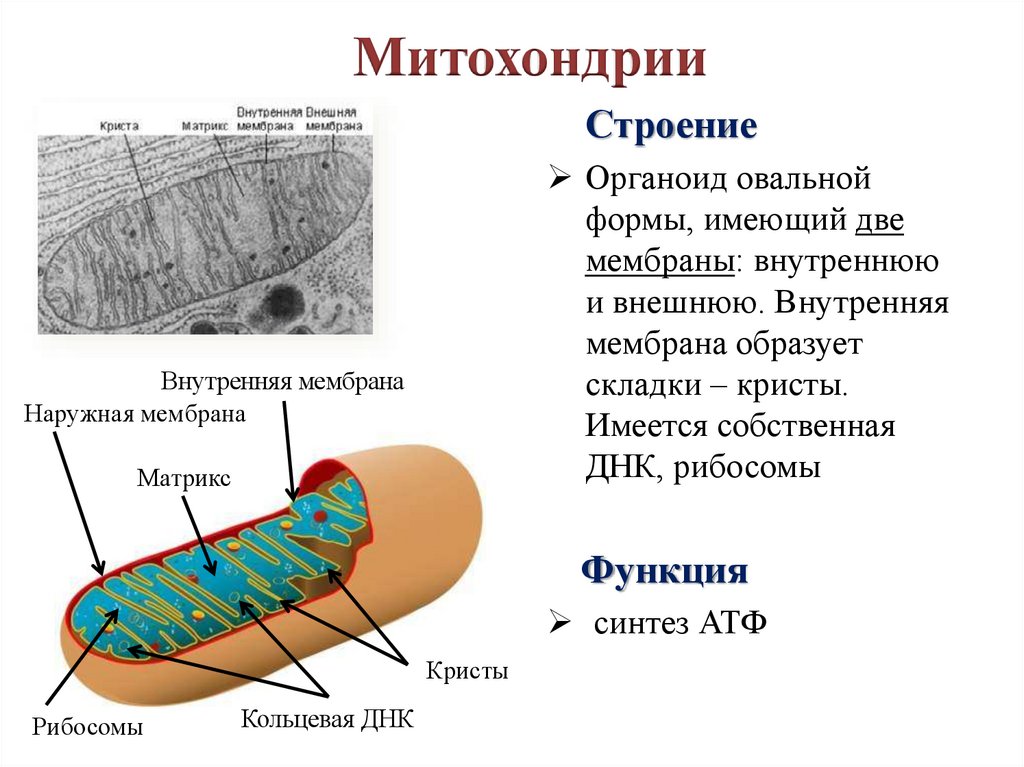
Поскольку митохондриальная функция лежит в основе всего, что происходит в организме, то оптимизация митохондриальной функции, и предотвращение нарушения функции митохондрий путем получения всех необходимых питательных веществ и прекурсоров, необходимых митохондриям, чрезвычайно важна для здоровья и профилактики заболеваний.
Мэлсмон – метаболическая таргетированная терапия (МТТ)Более 50 лет назад большинство научных и медицинских терапевтических подходов были сосредоточены на клеточном метаболизме. С появлением генетики на терапевтической стадии доминировал сдвиг в сторону геномики, а затем и протеомики (белковых профилей).
Подход к применению продуктов или соединений, которые увеличивают или поддерживают митохондриальную функцию, тем самым борясь с метаболической дисфункцией, получил название
Плацентарный препарат Мэлсмон – гордость японской фармацевтики. Он эффективно борется с митохондриальной дисфункцией и восстанавливает клеточный запас энергии. Разработанный ещё в 50-х годах прошлого столетия он включён в национальную программу обязательного медицинского обслуживания Японии и используется в составе множества современных протоколов лечения. Сегодня Мэлсмон активно применяется в программах долголетия, где помогает сохранить здоровье, молодость и красоту.
Разработанный ещё в 50-х годах прошлого столетия он включён в национальную программу обязательного медицинского обслуживания Японии и используется в составе множества современных протоколов лечения. Сегодня Мэлсмон активно применяется в программах долголетия, где помогает сохранить здоровье, молодость и красоту.
Мэлсмон – плацентарный препарат системного действия, направленного на нормализацию работы митохондрии. Восстановление энергетического запаса клетки позволяет эффективно бороться со всеми признаками синдрома клеточного энергодефицита.
Достоверно установлено, что Мэлсмон положительно влияет на общее самочувствие:
- снижает утомляемость, придаёт сил, повышает работоспособность
- стабилизирует эмоциональное состояние, понижая уровень тревоги и раздражительности
- улучшает качество сна.
Безусловно, это положительно отражается и на внешнем виде: лицо приобретает здоровый цвет, исчезают признаки усталости, снижается воспаление, повышается упругость, кожа «сияет» изнутри и выглядит моложе.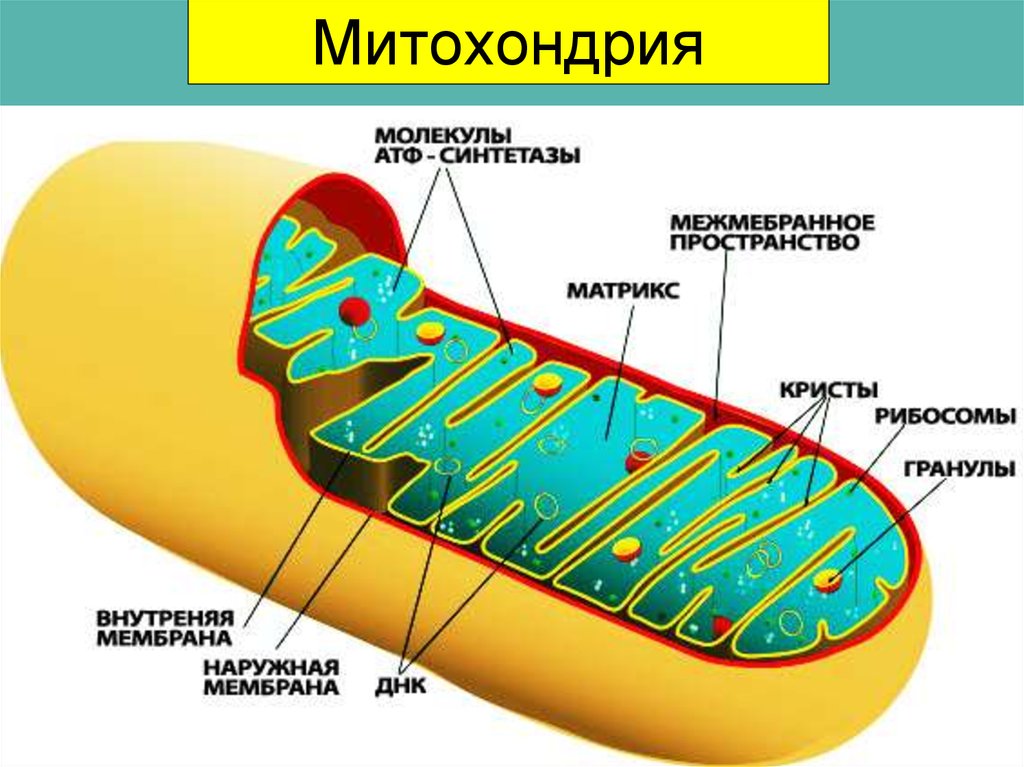
К уникальным особенностям препарата Мэлсмон относятся:
- Безопасность класса А. Проверка биоматериала осуществляется тремя независимыми лабораториями.
- Высокий уровень очистки. Не содержит гормонов, витаминов и факторов роста.
- 100% биодоступность. Препарат мгновенно включаются в метаболические процессы.
Безопасность Мэлсмон
Отсутствие в препарате биогенных стимуляторов обуславливает его безопасность, возможность длительного применения, возможность применения у пациентов с сопутствующей патологией.
Мэлсмон не вступает в лекарственное взаимодействие
Может назначаться в сочетании с другими препаратами, в том числе в сочетании с менопаузальной гормональной терапией. По результатам многолетней практики применения, МЭЛСМОН не дает побочных эффектов на фоне своей высокой эффективности.
Факты
Доказанная повышение митохондриальной активности
Динамика митохондриальной активности лимфоцитов при инкубировании крови с препаратом Мэлсмон.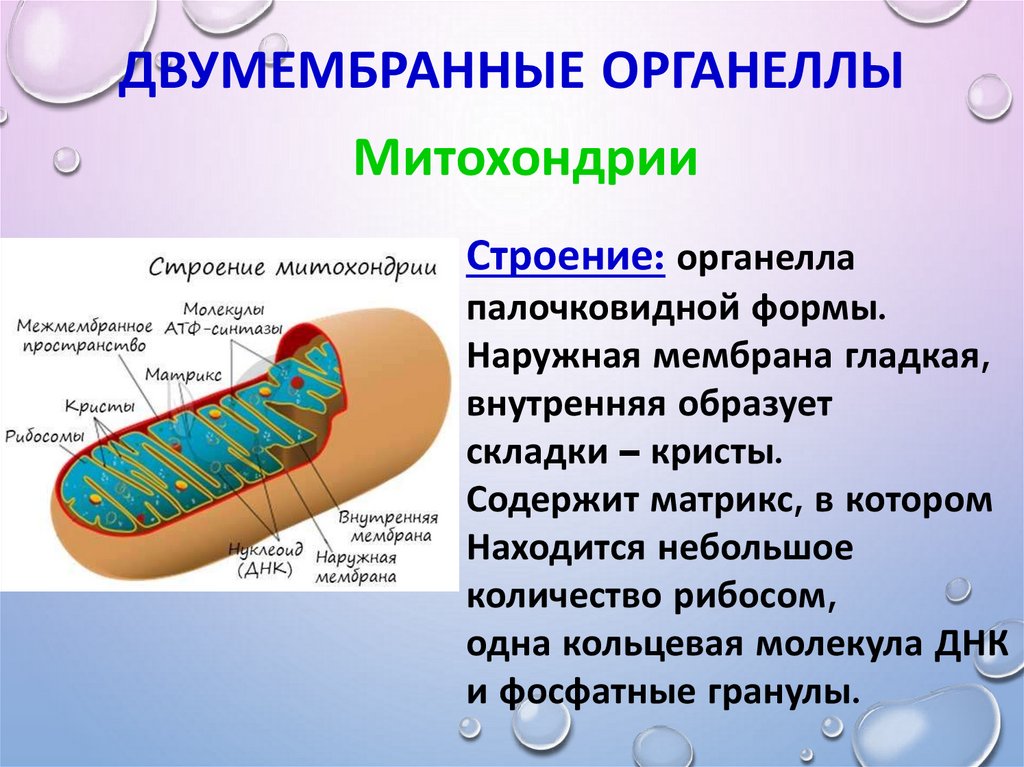
Оригинальность лекарственного препарата Мэлсмон
Комапния Melsmon Pharmaceutical Co., Ltd гарантирует безопасность и качество только оригинального лекарственного препарата МЭЛСМОН.
Использование поддельного или контрафактного препарата гидролизата плаценты человека для подкожного применения опасно для здоровья и жизни человека. Влечёт за собой риски: отсутствие ожидаемых эффектов терапии, непредсказуемые побочные эффекты, риск инфицирования вирусами.
Для России препарат МЭЛСМОН производится в оригинальной упаковке с защитной пломбой. Информация на упаковке и ампулах, инструкция – только на русском языке, без иероглифов. Упаковки по 10 и 50 ампул.
Каждая ампула имеет отрывной стикер с информацией о серии и сроке годности препарата.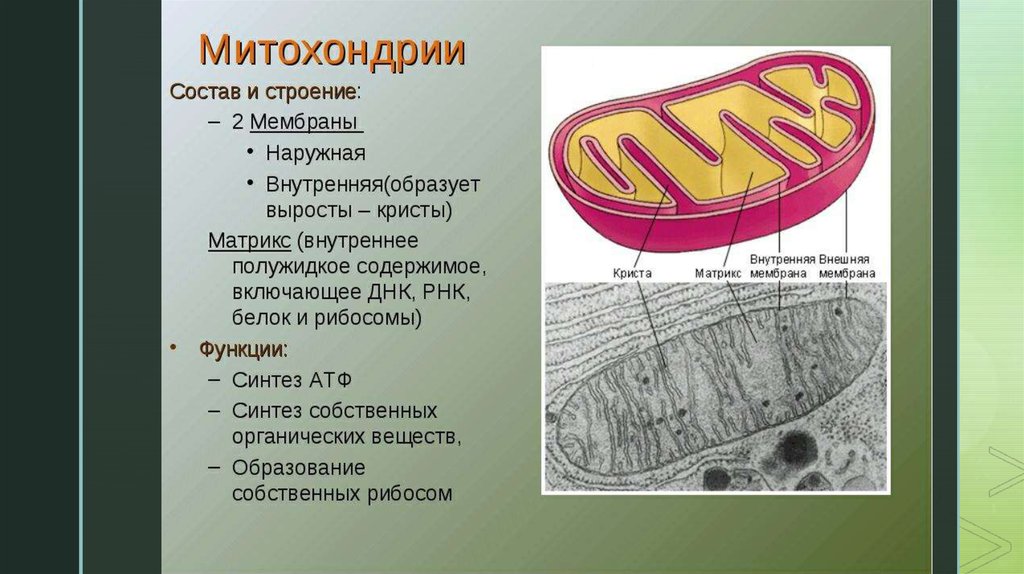
Митохондрии помнят, что они были бактериями – Наука – Коммерсантъ
22K 8 мин. …
Внутреннюю организацию клетки животных и растений можно сравнить с коммуной, где все равны и каждый выполняет одну, очень специфическую роль, создавая сбалансированный ансамбль. И вот только одна структура, митохондрия, может похвастаться множественностью внутриклеточных функций, которые определяют ее уникальность и обособленность, граничащие с некоторой самодостаточностью.
До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует
Эту структуру открыли в середине XIX века, и в течение 150 лет почти все считали, что ее единственная функция — быть энергетической машиной клетки. Грубо говоря, организм получает питательные вещества, которые после определенной деградации доходят до митохондрии и дальше происходит окислительная деградация питательных веществ, сопряженная с запасанием энергии в виде богатой энергией фосфорной связи в молекуле АТФ. Организм повсеместно использует энергию АТФ, расходуя ее на проведение нервного сигнала, мышечное сокращение, образование тепла, синтез нужных клеточных компонентов, уничтожение ненужных веществ и пр. В сутки в организме человека генерируется АТФ, весом равная весу самого человека, и в основном это заслуга митохондрий. До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует.
До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует.
Постулат доминирующей в клетке энергетической функции митохондрии как-то оставлял в тени уже давно высказанную и всеми поддерживаемую теорию бактериального происхождения митохондрий. В простой трактовке она выглядит так: около 600 млн лет назад в клетку т. н. гетеротрофов внедряется бактерия, которая умеет утилизировать кислород. Есть точка зрения, что появление внутри клетки нового типа бактерий было вызвано постоянным увеличением в атмосфере Земли кислорода, начавшим поступать из мирового океана в атмосферу около 2,4 млрд лет назад. Высокая окислительная способность кислорода представляла опасность для внутриклеточных органических и неорганических элементов, и появляются бактерии, уничтожающие кислород в присутствии ионов водорода с образованием воды. Таким образом внутри клетки содержание кислорода уменьшается, а с ним и уменьшается вероятность нежелательного окисления клеточных компонентов, что, наверно, полезно для клетки.
Однако попадание в ядерную клетку бактерий давало им и ряд преимуществ, в частности, оно дало им эволюционную нишу с ограниченным объемом и окруженную мембраной. Можно было обеспечить больший запас различных веществ, которые можно «складировать» не внутри ограниченного собственного объема, а снаружи, но в пределах своей «собственности», где они не будут разворованы другими организмами. Это соображение подтверждается в условиях, когда клетка вдруг перестает получать кислород и питательные вещества (например, при прекращении кровотока в участок ткани, что происходит при инфарктах и инсультах). Митохондрия в этих условиях уже не может быть энергетической машиной клетки (производить АТФ без кислорода трудно) и превращается в паразита — она начинает поглощать АТФ для того, чтобы обеспечить генерацию разницы мембранных потенциалов на своей мембране и поддержать свои собственные процессы. Для чего это нужно митохондрии — пока не понятно, но полуавтономный статус митохондрии в клетке тут проявляется особенно заметно — подобное поведение в кризисных условиях выглядит довольно эгоистичным.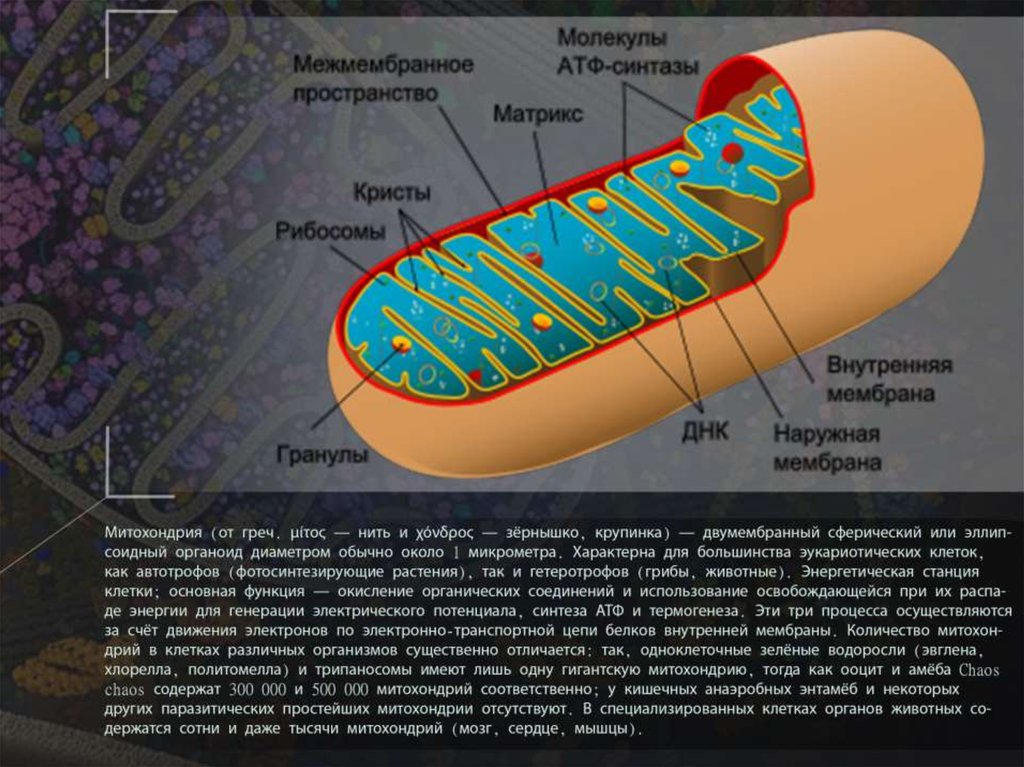 Не для того ли она производит АТФ в количествах, превышающих нужды клетки, чтобы обеспечить себе «подушку безопасности» в условиях кризиса?
Не для того ли она производит АТФ в количествах, превышающих нужды клетки, чтобы обеспечить себе «подушку безопасности» в условиях кризиса?
Попадание бактерий во внутриклеточную нишу обеспечивало и защиту от внешних врагов (а основные враги для бактерии — вирусы, то есть фаги). При этом было позволено выпускать сигнальные защитные вещества в ограниченный внутриклеточный объем; когда же бактерии существовали в «океане», выпуск таких сигнальных веществ был нерациональным — они немедленного разбавлялись в нем. Жизнь внутриклеточных бактерий в этой нише дала определенные преимущества: бактерии производят энергию и организуют в своей мембране белок, который выбрасывает в цитоплазму клетки синтезированный АТФ, чем клетка и пользуется. В итоге вроде бы наступает баланс: клетка дает митохондрии питательные субстраты, митохондрия дает клетке энергию,— что укрепляет теорию симбиотического взаимоотношения бактерий (они уже становятся митохондриями) с остальными частями клетки. Основными аргументами, подкрепляющими бактериальное происхождение митохондрий, является большое сходство химического состава бактерий и митохондрий и сходство элементов биоэнергетики.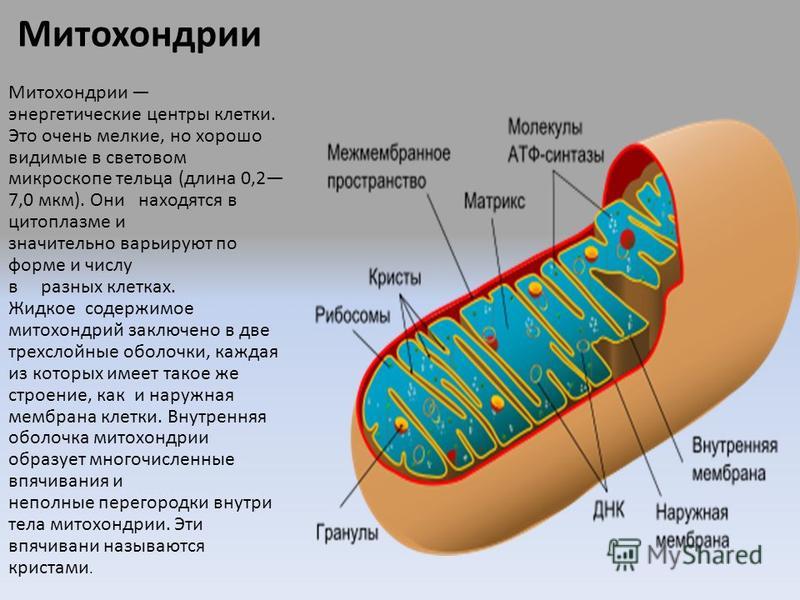 Одним из родоначальников эндосимбиотической теории происхождения митохондрий можно считать русского ботаника Константина Мережковского, который в конце XIX — начале ХХ века предположил, что хлоропласты (структуры растительных клеток, отвечающие за фотосинтез) имеют бактериальное происхождение. Позже аналогичное предположение было сделано и для митохондрий.
Одним из родоначальников эндосимбиотической теории происхождения митохондрий можно считать русского ботаника Константина Мережковского, который в конце XIX — начале ХХ века предположил, что хлоропласты (структуры растительных клеток, отвечающие за фотосинтез) имеют бактериальное происхождение. Позже аналогичное предположение было сделано и для митохондрий.
Из сказанного видно, что понятие симбиоза и некоторого «эгоистического» поведения митохондрий довольно размыто. Да и идеалистическая картина симбиоза была «омрачена» в самом конце ХХ века открытием, что митохондрии, выпуская сигнальные молекулы, отдающие приказ на уничтожение клетки, отвечают за ее гибель. То есть вроде бы все по пословице «сколько волка ни корми…». Однако надо взглянуть на ситуацию с другой стороны. Нужна ли клеточная смерть организму? Да, но не для всех клеток. Это обязательный процесс для тех клеток, которые постоянно делятся — иначе будет разрастание ткани, которое может быть нежелательным. Принципиально это и для предотвращения и лечения различного опухолеобразования. А вот для тех клеток, которые не очень умеют делиться, например, для нейронов или кардиомиоцитов, смерть не полезна. Если же рассматривать этот вопрос с позиции самих митохондрий, это выглядит как почти неприкрытый шантаж: или ты обеспечиваешь меня всем, что я хочу, или я убью тебя. С позиции же организма, все хорошо, когда митохондрия убивает неправильную клетку, и плохо, если убивает хорошую и нужную.
А вот для тех клеток, которые не очень умеют делиться, например, для нейронов или кардиомиоцитов, смерть не полезна. Если же рассматривать этот вопрос с позиции самих митохондрий, это выглядит как почти неприкрытый шантаж: или ты обеспечиваешь меня всем, что я хочу, или я убью тебя. С позиции же организма, все хорошо, когда митохондрия убивает неправильную клетку, и плохо, если убивает хорошую и нужную.
Основными аргументами, подкрепляющими бактериальное происхождение митохондрий, является большое сходство химического состава бактерий и митохондрий и сходство элементов биоэнергетики
Приведенные выше рассуждения — это явный конфликт эволюционной стратегии и человеческой логики, пытающейся оценить ситуацию с позиции субъекта, внутри которого живут существа, способные из друзей превратиться во врагов. Этот конфликт не мешает исследователям понимать, что митохондрия, хоть она и «помнит», что была бактерией, активно участвует в функционировании клетки; важная роль митохондрий объясняет необходимость предоставления им привилегий. В определенных условиях они превращаются в источник наследуемых или приобретенных заболеваний — в частности, тех, которыми занимается митохондриальная медицина. Таких заболеваний — очень тяжелых и почти не поддающихся лечению — больше сотни. Да и помимо них есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий. Существуют теории митохондриального происхождения рака, болезни Паркинсона, Альцгеймера и других — с весьма достойным научным подтверждением.
В определенных условиях они превращаются в источник наследуемых или приобретенных заболеваний — в частности, тех, которыми занимается митохондриальная медицина. Таких заболеваний — очень тяжелых и почти не поддающихся лечению — больше сотни. Да и помимо них есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий. Существуют теории митохондриального происхождения рака, болезни Паркинсона, Альцгеймера и других — с весьма достойным научным подтверждением.
Сегодня выяснилось, что большинство болезней сопровождается сбоем в работе внутриклеточной машины проверки качества митохондрий, своеобразного ОТК, отбраковывающего плохие митохондрии и отправляющего их на внутриклеточное переваривание (митофагию). Сбой возникает, например, при старении организма, и ОТК пропускает неправильные митохондрии. В результате в клетке начинают сосуществовать хорошие и плохие митохондрии. Когда же доля плохих превышает некоторый порог, наступает т. н. «фенотипическое проявление» болезни, которая до сих пор носила невидимый, латентный характер.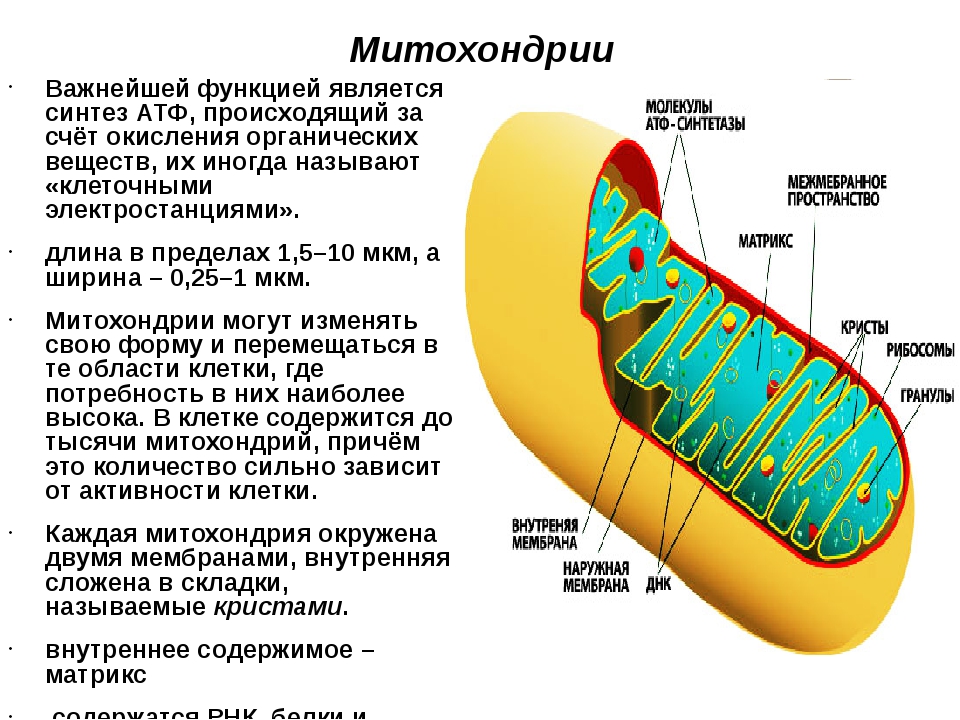
Можно сделать два вывода. Во-первых, без митохондрий ядерные клетки существовать не могут. Во-вторых, чтобы защитить клетку от поражения (чем бы оно ни было вызвано: химией, физикой или просто временем), надо «договориться» с митохондриями, то есть обеспечить им «достойное» существование. Это означает не только постоянную подпитку их активности за счет доставки питательных субстратов и кислорода, но и предоставление им своеобразной медицинской страховки, которая при необходимости обеспечит восстановление их структуры и функций и/или правильную утилизацию поврежденных митохондрий. Отсутствие утилизации поврежденных митохондриальных структур может привести к «заражению» здоровых структур, что непременно повлечет за собой заболевание.
Сейчас трансплантация органов стала вполне рутинной процедурой, хотя все еще сложной и дорогостоящей. Развивается и клеточная терапия, то есть пересадка стволовых клеток. А вот о возможности пересадки здоровых митохондрий говорить только начинают. Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка. Недавно для лечения последствий инсульта головного мозга оказалось достаточным обеспечить должное функционирование митохондрий почек. То есть налицо «разговоры» (по-английски это звучит более научно — cross-talk) между органами, и почка со своими митохондриями помогает восстановлению головного мозга.
Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка. Недавно для лечения последствий инсульта головного мозга оказалось достаточным обеспечить должное функционирование митохондрий почек. То есть налицо «разговоры» (по-английски это звучит более научно — cross-talk) между органами, и почка со своими митохондриями помогает восстановлению головного мозга.
На каком языке «общаются» органы, еще предстоит выяснить,— пока предполагают химический язык общения. Хорошая и здоровая почка со своими здоровыми митохондриями вырабатывает и посылает в кровь эритропоэтин (тот самый, приемом которого увлекались спортсмены и который не только стимулирует выработку эритроцитов, но и мобилизует общий метаболизм, что повышает выносливость). Эритропоэтин обладает сильными нейрозащитными свойствами. Стоит повредить почку, скажем, неумеренным приемом антибиотиков (антибиотики убивают и митохондрии, потому что они — бывшие бактерии), и последствия инсульта головного мозга становятся более драматическими. Так на базе фундаментальных открытий начинает просматриваться стратегия лечения болезней.
Так на базе фундаментальных открытий начинает просматриваться стратегия лечения болезней.
Есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий
Возьмем, к примеру, сепсис — бактериальную инфекцию, одну из ведущих причин человеческой смертности. Сейчас уже можно — правда, пока шепотом — говорить и о «митохондриальном сепсисе», когда в кровь попадают компоненты митохондрий. Это не менее опасно, чем бактериальный сепсис, так как приводит к гиперактивации иммунного ответа (так называемый синдром системного воспаления, SIRS) и возможной гибели организма.
Как уже было упомянуто, естественными врагами бактерий являются вирусы. Это также верно и для митохондрий. Недавно открытая бактериальная система защиты от вирусов CRISPR (clustered regularly interspaced short palindromic repeats), имеющая все признаки элементарно организованной иммунной системы, заставила задуматься: нет ли иммунной системы у митохондрий? У бактерий эта иммунная система устроена следующим образом: в бактериальном геноме (структурно очень похожем на митохондриальный) располагаются своего рода библиотеки, или антивирусные базы данных — куски генов тех вирусов, с которыми эта бактерия когда-либо встречалась. При считывании информации с этих участков синтезируются так называемые малые РНК. Эти РНК связываются с внедрившимися в бактерию вирусными нуклеиновыми кислотами, а затем такой комплекс расщепляется внутрибактериальными ферментами с нейтрализацией вируса. В чистом виде подобных структур в митохондриальном геноме обнаружено не было, кроме одного-единственного случая, описанного еще на заре исследования CRISPR-системы. Однако мы обнаружили отдельные случаи включения вирусных последовательностей в митохондриальный геном (вирусов гепатита B и гриппа), хотя и довольно редкие для того, чтобы говорить о системе. С другой стороны, наибольшее количество различных структур в геноме мы обнаружили в митохондриях растений, чей геном в разы больше митохондриального генома животных. Это особенно любопытно, учитывая, что растения в целом гораздо больше полагаются на противовирусную защиту на основе интерферирующих РНК, чем животные, поскольку не обладают особыми иммунными клетками, свободно перемещающимися по организму в кровотоке.
При считывании информации с этих участков синтезируются так называемые малые РНК. Эти РНК связываются с внедрившимися в бактерию вирусными нуклеиновыми кислотами, а затем такой комплекс расщепляется внутрибактериальными ферментами с нейтрализацией вируса. В чистом виде подобных структур в митохондриальном геноме обнаружено не было, кроме одного-единственного случая, описанного еще на заре исследования CRISPR-системы. Однако мы обнаружили отдельные случаи включения вирусных последовательностей в митохондриальный геном (вирусов гепатита B и гриппа), хотя и довольно редкие для того, чтобы говорить о системе. С другой стороны, наибольшее количество различных структур в геноме мы обнаружили в митохондриях растений, чей геном в разы больше митохондриального генома животных. Это особенно любопытно, учитывая, что растения в целом гораздо больше полагаются на противовирусную защиту на основе интерферирующих РНК, чем животные, поскольку не обладают особыми иммунными клетками, свободно перемещающимися по организму в кровотоке.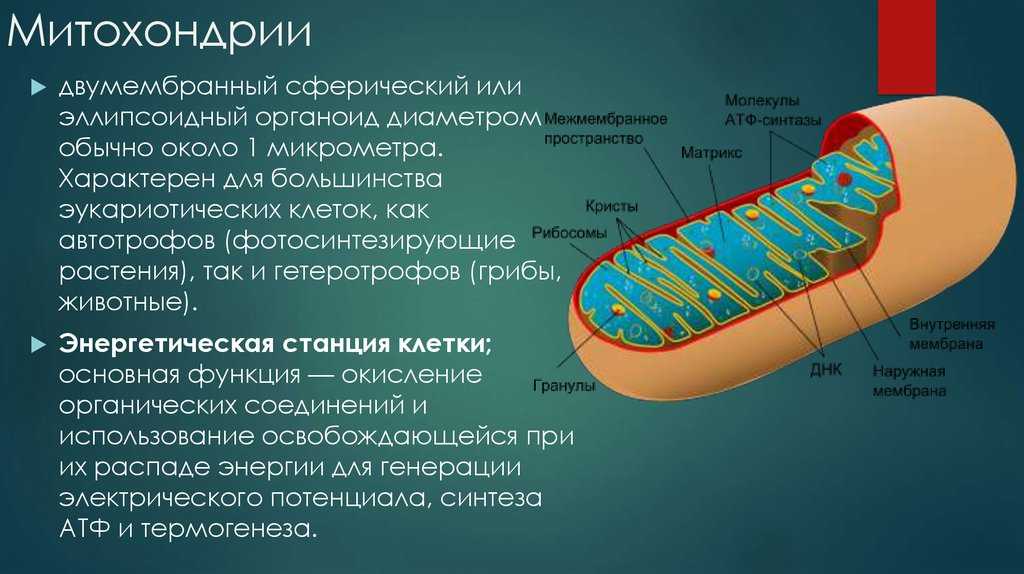 Кроме того, не стоит забывать, что митохондрии делегируют значительную часть функций клетке, включая передачу части своего генетического материала в клеточное ядро, оставляя себе только «контрольный пакет акций», обеспечивающий их контроль над ключевыми функциями. Вполне возможно, что подобные клеточные библиотеки также были переданы в ядро — явление передачи малых РНК из цитоплазмы внутрь митохондрий известно. А значит, среди них могут быть и иммунные РНК. С другой стороны, возможно, что митохондрии полностью передали функции защиты клетке, довольствуясь возможностью убить клетку, которая их плохо защищает.
Кроме того, не стоит забывать, что митохондрии делегируют значительную часть функций клетке, включая передачу части своего генетического материала в клеточное ядро, оставляя себе только «контрольный пакет акций», обеспечивающий их контроль над ключевыми функциями. Вполне возможно, что подобные клеточные библиотеки также были переданы в ядро — явление передачи малых РНК из цитоплазмы внутрь митохондрий известно. А значит, среди них могут быть и иммунные РНК. С другой стороны, возможно, что митохондрии полностью передали функции защиты клетке, довольствуясь возможностью убить клетку, которая их плохо защищает.
Приняв тезис «митохондрии помнят, что они были бактериями», мы можем поменять многое в стратегии базового научного мышления и практической медицинской деятельности, так или иначе связанных с митохондриями. А учитывая количество функций, выполняемых митохондриями в клетке, это большая часть всех биомедицинских задач: от рака до нейродегенеративных заболеваний.
Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка
Часто достаточно вылечить митохондрии — и вылечится клетка
Дмитрий Зоров, доктор биологических наук, МГУ им. М.В. Ломоносова
Роль митохондриальной функции и клеточной биоэнергетики в старении и заболеваниях
1. Балабан Р.С., Немото С., Финкель Т. Митохондрии, оксиданты и старение. Клетка. 2005; 120:483–95. [PubMed] [Google Scholar]
2. Ларссон Н.Г. Соматические мутации митохондриальной ДНК при старении млекопитающих. Анну Рев Биохим. 2010; 79: 683–706. [PubMed] [Google Scholar]
3. Тацута Т., Лангер Т. Контроль качества митохондрий: защита от нейродегенерации и старения. EMBO J. 2008; 27: 306–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Бейкер Б.М., Хейнс К.М. Контроль качества митохондриальных белков в процессе биогенеза и старения. Тенденции биохимических наук. 2011; 36: 254–61. [PubMed] [Google Scholar]
5. Rolfe DFS, Brown GC. Использование клеточной энергии и молекулярное происхождение стандартной скорости метаболизма у млекопитающих. Physiol Rev. 1997; 77:731–58. [PubMed] [Google Scholar]
Physiol Rev. 1997; 77:731–58. [PubMed] [Google Scholar]
6. Дивакаруни А.С., Brand MD. Регуляция и физиология митохондриальной утечки протонов. Физиология (Bethesda) 2011; 26: 192–205. [PubMed] [Академия Google]
7. Хонг С., Виктория Д., Крофтс А.Р. Межмономерный перенос электронов слишком медленный, чтобы конкурировать с оборотом мономеров в комплексе bc 1 . Биохим Биофиз Акта. 2012; 1817: 1053–62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Yamashita T, Voth GA. Представление о механизме транспорта протонов в цитохром-с-оксидазе. J Am Chem Soc. 2012; 134:1147–52. [PMC бесплатная статья] [PubMed] [Google Scholar]
9. Ефремов Р.Г., Сазанов Л.А. Механизм сопряжения дыхательного комплекса I – структурно-эволюционная перспектива. Биохим Биофиз Акта. 2012; 1817: 1785–9.5. [PubMed] [Google Scholar]
10. Baker LA, Watt IN, Runswick MJ, et al. Расположение субъединиц в интактной митохондриальной АТФ-синтазе млекопитающих, определенное с помощью крио-ЭМ.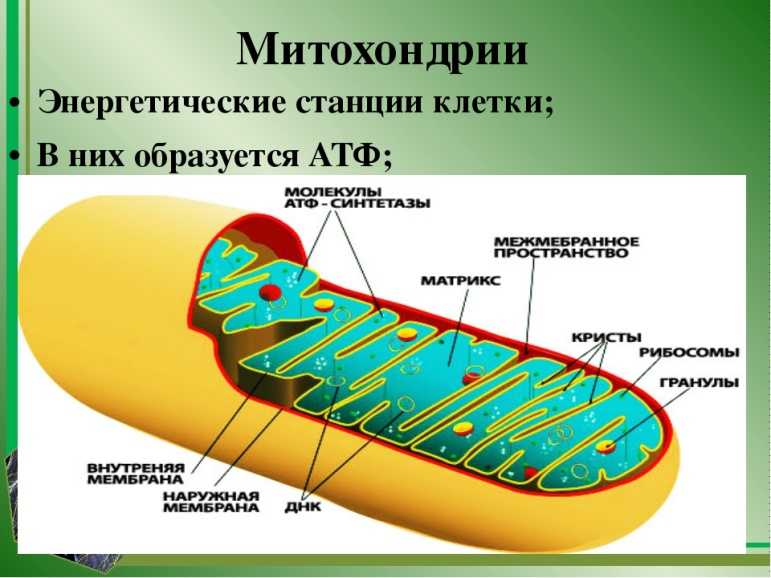 Proc Natl Acad Sci USA. 2012;109:11675–80. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci USA. 2012;109:11675–80. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Palmieri F, Pierri CL. Митохондриальный транспорт метаболитов. Очерки биохим. 2010;47:37–52. [PubMed] [Google Scholar]
12. Rizzuto R, De Stefani D, Raffaello A, et al. Митохондрии как сенсоры и регуляторы передачи сигналов кальция. Nat Rev Mol Cell Biol. 2012; 13: 566–78. [PubMed] [Академия Google]
13. Yin F, Sancheti H, Cadenas E. Подавление никотинамиднуклеотидтрансгидрогеназы нарушает клеточный окислительно-восстановительный гомеостаз и энергетический обмен в клетках PC12. Биохим Биофиз Акта. 2012; 1817: 401–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Нельсон Д.Л., Кокс М.М. Ленингер Принципы биохимии. 5. Нью-Йорк: WH Freeman; 2008. [Google Scholar]
15. Muller M, Mentel M, Van Hellemond JJ, et al. Биохимия и эволюция анаэробного энергетического обмена у эукариот. Microbiol Mol Biol Rev. 2012;76:444–95. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Kroemer G, Galluzzi L, Brenner C. Проницаемость митохондриальной мембраны при гибели клеток. Physiol Rev. 2007; 87: 99–163. [PubMed] [Google Scholar]
Kroemer G, Galluzzi L, Brenner C. Проницаемость митохондриальной мембраны при гибели клеток. Physiol Rev. 2007; 87: 99–163. [PubMed] [Google Scholar]
17. Martinou JC, Youle RJ. Митохондрии в апоптозе: члены семейства Bcl-2 и митохондриальная динамика. Ячейка Дев. 2011;21:92–101. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Estaquier J, Vallette F, Vayssiere JL, et al. Митохондриальные пути апоптоза. Adv Exp Med Biol. 2012;942:157–83. [PubMed] [Google Scholar]
19. Huttemann M, Helling S, Sanderson TH, et al. Регуляция митохондриального дыхания и апоптоза посредством клеточной передачи сигналов: цитохром-с-оксидаза и цитохром-с при ишемическом/реперфузионном повреждении и воспалении. Биохим Биофиз Акта. 2012; 1817: 598–609. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Smith MA, Schnellmann RG. Кальпаины, митохондрии и апоптоз. Кардиовасц Рез. 2012;96:32–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Харман Д. Биологические часы: митохондрии? J Am Geriatr Soc. 1972; 20: 145–147. [PubMed] [Google Scholar]
1972; 20: 145–147. [PubMed] [Google Scholar]
22. Бекман К.Б., Эймс Б.Н. Свободнорадикальная теория старения созревает. Physiol Rev. 1998; 78: 547–81. [PubMed] [Google Scholar]
23. Finkel T, Holbrook NJ. Оксиданты, окислительный стресс и биология старения. Природа. 2000; 408: 239–47. [PubMed] [Google Scholar]
24. Голден Т.Р., Хинерфельд Д.А., Мелов С. Окислительный стресс и старение: вне корреляции. Стареющая клетка. 2002; 1:117–23. [PubMed] [Академия Google]
25. Schriner SE, Linford NJ, Martin GM, et al. Увеличение продолжительности жизни мышей за счет сверхэкспрессии каталазы, нацеленной на митохондрии. Наука. 2005; 308:1909–11. [PubMed] [Google Scholar]
26. Леб Л.А., Уоллес Д.К., Мартин Г.М. Митохондриальная теория старения и ее связь с повреждением активных форм кислорода и соматическими мутациями мтДНК. Proc Natl Acad Sci USA. 2005; 102:18769–70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Muller FL, Lustgarten MS, Jang Y, et al. Тенденции в теориях окислительного старения. Свободный Радик Биол Мед. 2007; 43: 477–503. [PubMed] [Академия Google]
Тенденции в теориях окислительного старения. Свободный Радик Биол Мед. 2007; 43: 477–503. [PubMed] [Академия Google]
28. Ван Реммен Х., Джонс Д.П. Современные мысли о роли митохондрий и свободных радикалов в биологии старения. J Gerontol A Biol Sci Med Sci. 2009;64:171–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Lee HY, Choi CS, Birkenfeld AL, et al. Направленная экспрессия каталазы в митохондриях предотвращает возрастное снижение функции митохондрий и резистентность к инсулину. Клеточный метаб. 2010;12:668–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Speakman JR, Selman C. Теория повреждения свободными радикалами: накопление доказательств простой связи окислительного стресса со старением и продолжительностью жизни. Биоэссе. 2011; 33: 255–9. [PubMed] [Google Scholar]
31. Dai DF, Chen T, Johnson SC, et al. Старение сердца: от молекулярных механизмов до значения для здоровья и болезней человека. Антиоксидный окислительно-восстановительный сигнал. 2012;16:1492–526. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2012;16:1492–526. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Massaad CA, Pautler RG, Klann E. Митохондриальный супероксид: ключевой игрок в болезни Альцгеймера. Старение (Олбани, штат Нью-Йорк) 2009; 1: 758–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Massaad CA, Washington TM, Pautler RG, et al. Сверхэкспрессия SOD-2 снижает супероксид гиппокампа и предотвращает дефицит памяти в мышиной модели болезни Альцгеймера. Proc Natl Acad Sci USA. 2009 г.;106:13576–81. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Song Y, Du Y, Prabhu SD, et al. Диабетическая кардиомиопатия у мышей OVE26 демонстрирует продукцию митохондриальных АФК и расхождение между сократительной способностью in vivo и in vitro . Преподобный Диабет Стад. 2007; 4: 159–68. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Murphy E, Steenbergen C. Механизмы, лежащие в основе острой защиты от ишемически-реперфузионного повреждения сердца.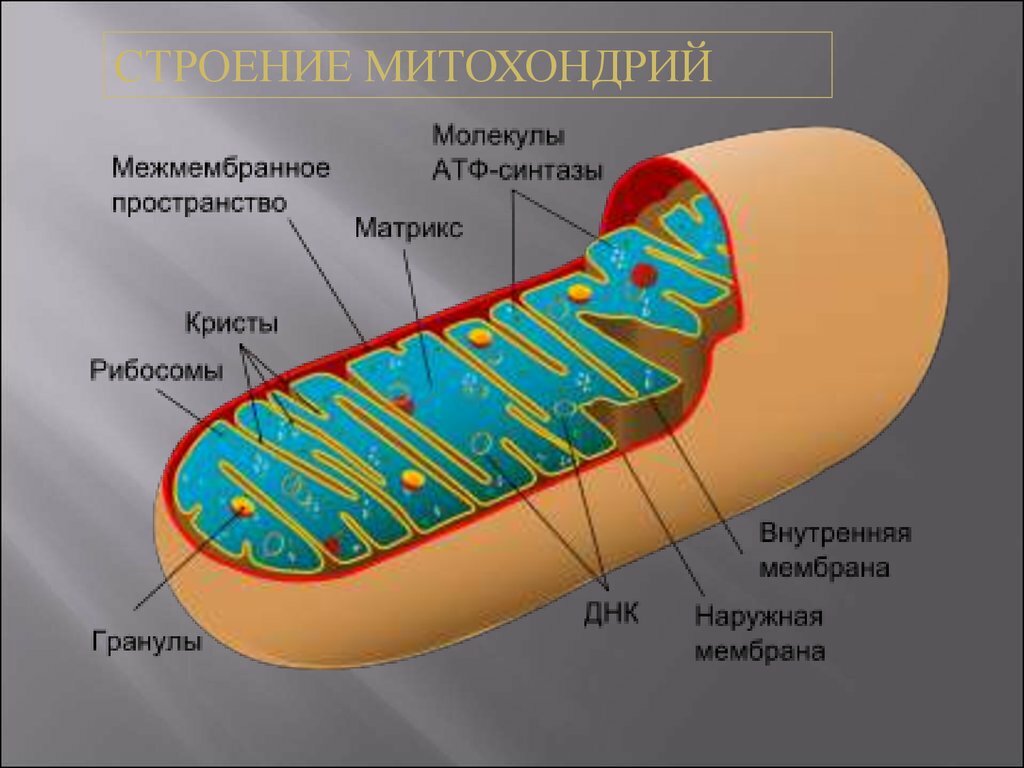 Physiol Rev. 2008; 88: 581– 609. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Physiol Rev. 2008; 88: 581– 609. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Аон М.А., Кортасса С., О’Рурк Б. Оптимизированный окислительно-восстановительный баланс АФК: объединяющая гипотеза. Биохим Биофиз Акта. 2010; 1797: 865–77. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Weinberg F, Hamanaka R, Wheaton WW, et al. Митохондриальный метаболизм и генерация АФК необходимы для Kras-опосредованной онкогенности. Proc Natl Acad Sci USA. 2010; 107:8788–93. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Ladiges W, Wanagat J, Preston B, et al. Митохондриальный взгляд на старение, активные формы кислорода и метастатический рак. Стареющая клетка. 2010;9: 462–5. [PubMed] [Google Scholar]
39. Loschen G, Flohe L, Chance B. Дыхательная цепь связана H 2 O 2 в митохондриях сердца голубя. ФЭБС лат. 1971; 18: 261–4. [PubMed] [Google Scholar]
40. Боверис А., Шанс Б. Митохондриальное образование перекиси водорода.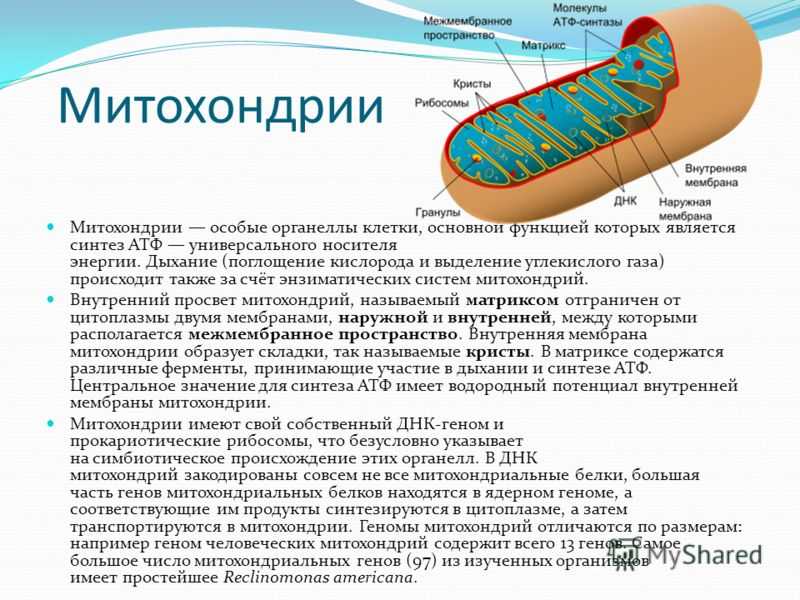 Общие свойства и действие гипербарического кислорода. Биохим Дж. 1973; 134:707–16. [PMC free article] [PubMed] [Google Scholar]
Общие свойства и действие гипербарического кислорода. Биохим Дж. 1973; 134:707–16. [PMC free article] [PubMed] [Google Scholar]
41. McCord JM, Fridovich I. Биология и патология кислородных радикалов. Энн Интерн Мед. 1978;89:122–7. [PubMed] [Google Scholar]
42. Brand MD, Affourtit C, Esteves TC, et al. Митохондриальный супероксид: производство, биологические эффекты и активация разобщающих белков. Свободный Радик Биол Мед. 2004; 37: 755–67. [PubMed] [Google Scholar]
43. Андреев А.Ю., Кушнарева Ю.Е., Старков А.А. Митохондриальный метаболизм активных форм кислорода. Биохимия (Москва) 2005;70:200–14. [PubMed] [Google Scholar]
44. Мерфи, член парламента. Как митохондрии производят активные формы кислорода. Биохим Дж. 2009 г.;417:1–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Brand MD. Сайты и топология продукции митохондриального супероксида. Опыт Геронтол. 2010;45:466–72. [бесплатная статья PMC] [PubMed] [Google Scholar]
46. Гривенникова В.Г., Кареева А.В., Виноградов А.Д. Каковы источники продукции перекиси водорода митохондриями сердца? Биохим Биофиз Акта. 2010; 1797: 939–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гривенникова В.Г., Кареева А.В., Виноградов А.Д. Каковы источники продукции перекиси водорода митохондриями сердца? Биохим Биофиз Акта. 2010; 1797: 939–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Орр А.Л., Куинлан С.Л., Перевощикова И.В., Brand MD. Уточненный анализ продукции супероксида митохондриальной sn-глицерол-3-фосфатдегидрогеназой. Дж. Биол. Хим. 2012;287:42921–35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Quinlan CL, Treberg JR, Perevoshchikova IV, et al. Собственные скорости продукции супероксида из нескольких мест в изолированных митохондриях, измеренные с использованием эндогенных репортеров. Свободный Радик Биол Мед. 2012; 53:1807–17. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Miwa S, Brand MD. Топология продукции супероксида комплексом III и глицерол-3-фосфатдегидрогеназой в митохондриях дрозофилы . Биохим Биофиз Акта. 2005;1709: 214–9. [PubMed] [Google Scholar]
50. St-Pierre J, Buckingham JA, Roebuck SJ, et al. Топология продукции супероксида из разных участков митохондриальной цепи переноса электронов. Дж. Биол. Хим. 2002; 277:44784–90. [PubMed] [Google Scholar]
Топология продукции супероксида из разных участков митохондриальной цепи переноса электронов. Дж. Биол. Хим. 2002; 277:44784–90. [PubMed] [Google Scholar]
51. Кузнецов А.В., Майборода О., Кунц Д. и соавт. Функциональная визуализация митохондрий в пермеабилизированных сапонинами мышечных волокнах мышей. Джей Селл Биол. 1998; 140:1091–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Huang S, Heikal AA, Webb WW. Двухфотонная флуоресцентная спектроскопия и микроскопия НАД(Ф)Н и флавопротеина. Биофиз Дж. 2002; 82: 2811–25. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Чорват Д., мл., Киршнерова Дж., Кагалинец М. и соавт. Спектральное разделение компонентов автофлуоресценции флавина в кардиомиоцитах. Биофиз Дж. 2005; 89: L55–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Sommer N, Pak O, Schorner S, et al. Окислительно-восстановительные состояния митохондриального цитохрома и дыхание при остром кислородном зондировании легких. Eur Respir J. 2010; 36:1056–66. [PubMed] [Google Scholar]
2010; 36:1056–66. [PubMed] [Google Scholar]
55. Буник В.И., Сиверс С. Инактивация комплексов 2-оксокислоты дегидрогеназы при образовании внутренних радикалов. Евр Дж Биохим. 2002;269: 5004–15. [PubMed] [Google Scholar]
56. Треттер Л., Адам-Визи В. Генерация активных форм кислорода в реакции, катализируемой альфа-кетоглутаратдегидрогеназой. Дж. Нейроски. 2004; 24:7771–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Старков А.А., Фискум Г., Чинопулос С. и соавт. Митохондриальный комплекс альфа-кетоглутаратдегидрогеназы генерирует активные формы кислорода. Дж. Нейроски. 2004; 24:7779–88. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Кареева А.В., Гривенникова В.Г., Чеккини Г. и соавт. Молекулярная идентификация фермента, ответственного за митохондриальное НАДН-поддерживаемое аммоний-зависимое производство перекиси водорода. ФЭБС лат. 2010; 585:385–9. [PMC бесплатная статья] [PubMed] [Google Scholar]
59. Quinlan CL, Orr AL, Perevoshchikova IV, et al.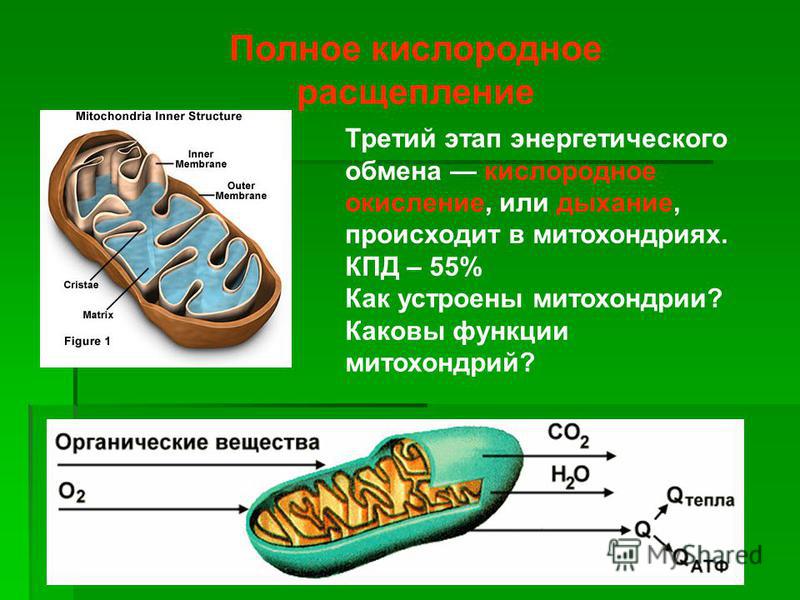 Митохондриальный комплекс II может генерировать активные формы кислорода с высокой скоростью как в прямой, так и в обратной реакциях. Дж. Биол. Хим. 2012; 287:27255–64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Митохондриальный комплекс II может генерировать активные формы кислорода с высокой скоростью как в прямой, так и в обратной реакциях. Дж. Биол. Хим. 2012; 287:27255–64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Drahota Z, Chowdhury SK, Floryk D, et al. Глицерофосфатзависимая продукция перекиси водорода митохондриями бурой жировой ткани и ее активация феррицианидом. J Биоэнергетическая биомембрана. 2002; 34:105–13. [PubMed] [Академия Google]
61. Hansford RG, Hogue BA, Mildaziene V. Зависимость образования H 2 O 2 митохондриями сердца крысы от доступности субстрата и возраста донора. J Биоэнергетическая биомембрана. 1997; 29: 89–95. [PubMed] [Google Scholar]
62. Lambert AJ, Brand MD. Ингибиторы сайта связывания хинона обеспечивают быструю продукцию супероксида из митохондриального NADH: — убихиноноксидоредуктазы (комплекс I) J Biol Chem. 2004; 279:39414–20. [PubMed] [Google Scholar]
63. Lambert AJ, Brand MD. Продукция супероксида НАДН:убихиноноксидоредуктазой (комплекс I) зависит от градиента рН на внутренней мембране митохондрий. Биохим Дж. 2004;382:511–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Биохим Дж. 2004;382:511–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Quinlan CL, Gerencser AA, Treberg JR, et al. Механизм продукции супероксида ингибируемым антимицином митохондриальным Q-циклом. Дж. Биол. Хим. 2011; 286:31361–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Treberg JR, Quinlan CL, Brand MD. Выход перекиси водорода из мышечных митохондрий занижает выработку матриксного супероксида — коррекция с использованием истощения глутатиона. FEBS J. 2010; 277: 2766–78. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Митохондрии: форма, функция и болезнь
Митохондрии часто называют электростанциями клетки. Они помогают превратить энергию, которую мы получаем из пищи, в энергию, которую клетка может использовать. Но митохондрии — это нечто большее, чем производство энергии.
Присутствующие почти во всех типах клеток человека митохондрии жизненно важны для нашего выживания. Они производят большую часть нашего аденозинтрифосфата (АТФ), энергетической валюты клетки.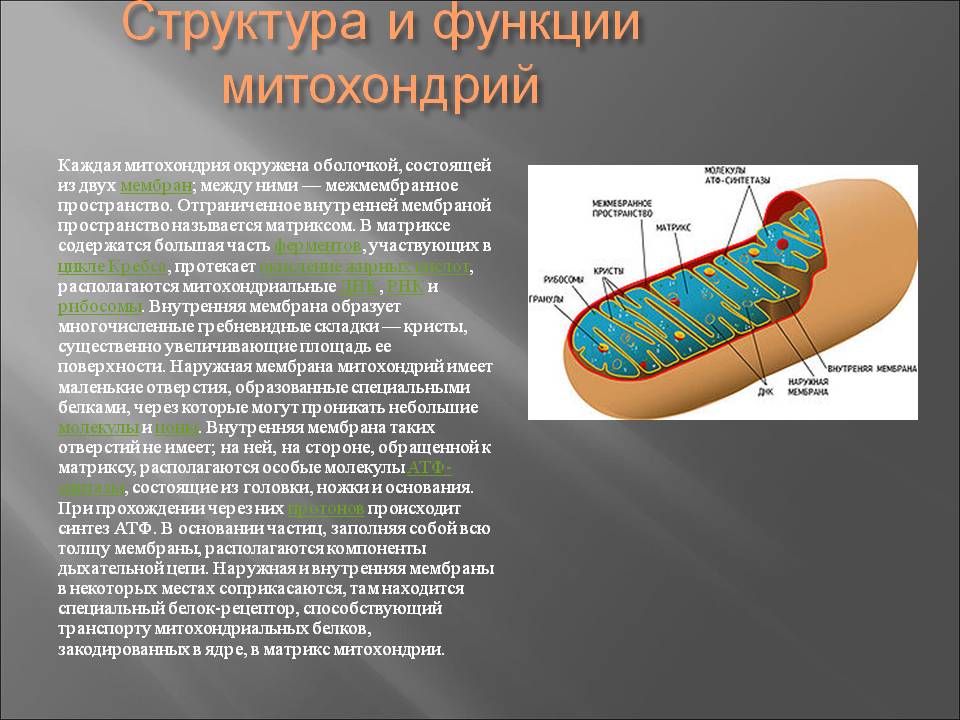
Митохондрии также участвуют в других задачах, таких как передача сигналов между клетками и гибель клеток, также известная как апоптоз.
В этой статье мы рассмотрим, как работают митохондрии, как они выглядят, и объясним, что происходит, когда они перестают правильно выполнять свою работу.
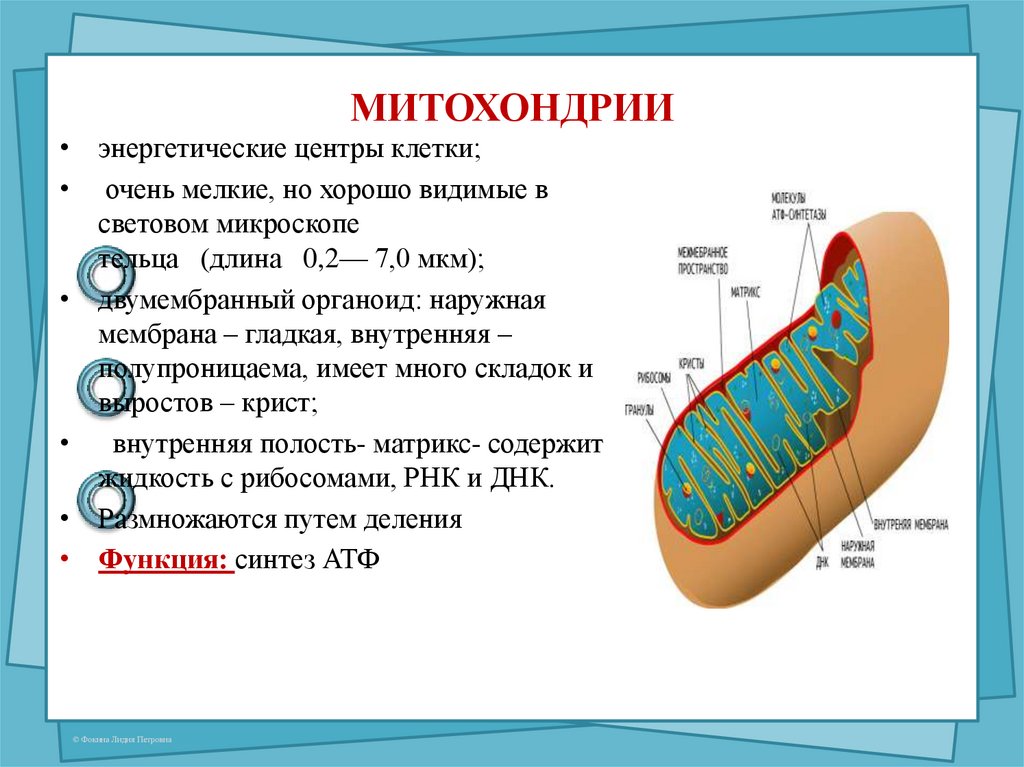
Митохондрии маленькие, часто от 0,75 до 3 микрометров, и не видны под микроскопом, если их не окрасить.
В отличие от других органелл (миниатюрных органов внутри клетки) они имеют две мембраны, внешнюю и внутреннюю. Каждая мембрана выполняет разные функции.
Митохондрии разделены на различные компартменты или регионы, каждый из которых выполняет определенные функции.
Некоторые из основных областей включают:
Внешняя мембрана: Небольшие молекулы могут свободно проходить через внешнюю мембрану. Эта внешняя часть включает белки, называемые поринами, которые образуют каналы, позволяющие белкам пересекаться. Внешняя мембрана также содержит ряд ферментов с широким спектром функций.
Межмембранное пространство: Это область между внутренней и внешней мембранами.
Внутренняя мембрана: Эта мембрана содержит белки, которые выполняют несколько функций. Поскольку во внутренней мембране нет поринов, она непроницаема для большинства молекул. Молекулы могут пересекать внутреннюю мембрану только в специальных мембранных переносчиках. Внутренняя мембрана — это место, где создается большая часть АТФ.
Cristae: Это складки внутренней мембраны. Они увеличивают площадь поверхности мембраны, тем самым увеличивая пространство, доступное для химических реакций.
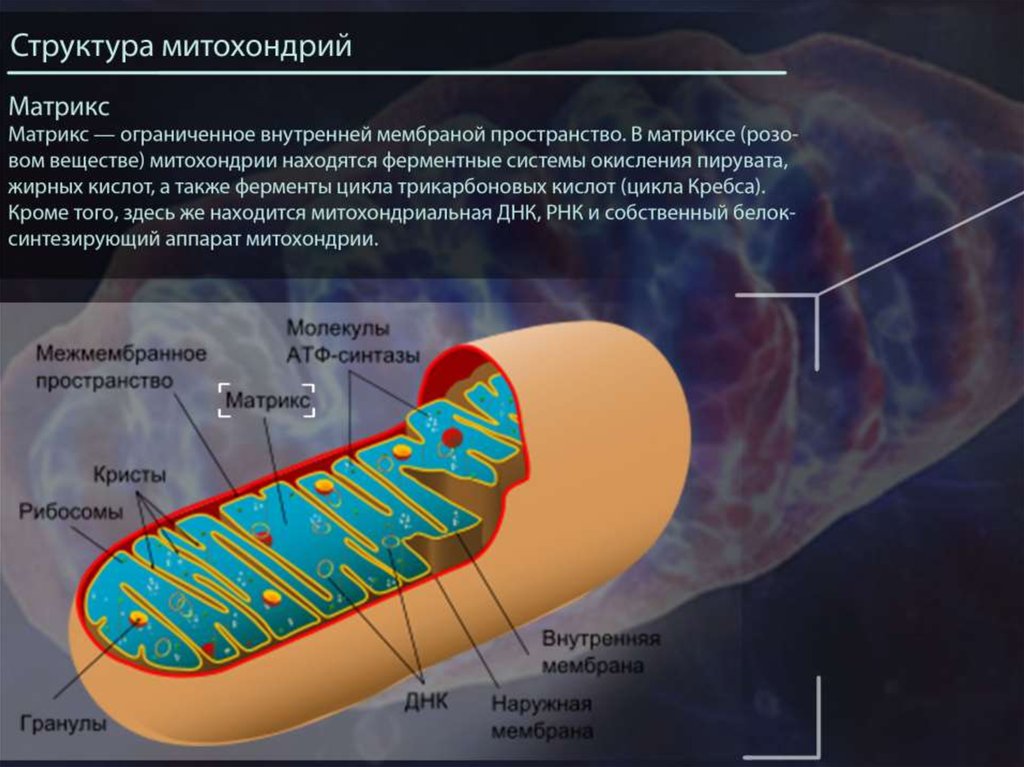
Матрица: Это пространство внутри внутренней мембраны. Содержит сотни ферментов, играет важную роль в производстве АТФ. Здесь находится митохондриальная ДНК (см. ниже).
Разные типы клеток имеют разное количество митохондрий. Например, в зрелых эритроцитах их вообще нет, тогда как в клетках печени их может быть более 2000. Клетки с высоким спросом на энергию, как правило, имеют большее количество митохондрий. Около 40 процентов цитоплазмы клеток сердечной мышцы занимают митохондрии.
Клетки с высоким спросом на энергию, как правило, имеют большее количество митохондрий. Около 40 процентов цитоплазмы клеток сердечной мышцы занимают митохондрии.
Хотя митохондрии часто изображают в виде органелл овальной формы, они постоянно делятся (деление) и соединяются друг с другом (слияние). Итак, на самом деле эти органеллы связаны между собой постоянно меняющимися сетями.
Кроме того, в сперматозоидах митохондрии спиралевидны в средней части и обеспечивают энергию для движения хвоста.
Хотя большая часть нашей ДНК содержится в ядре каждой клетки, митохондрии имеют свой собственный набор ДНК. Интересно, что митохондриальная ДНК (мтДНК) больше похожа на бактериальную ДНК.
МтДНК содержит инструкции для ряда белков и другого вспомогательного клеточного оборудования в 37 генах.
Геном человека, хранящийся в ядрах наших клеток, содержит около 3,3 миллиарда пар оснований, тогда как мтДНК состоит из менее чем 17 000.
Во время размножения половина ДНК ребенка поступает от отца, а половина — от матери. Однако ребенок всегда получает свою мтДНК от матери. Из-за этого мтДНК оказалась очень полезной для отслеживания генетических линий.
Однако ребенок всегда получает свою мтДНК от матери. Из-за этого мтДНК оказалась очень полезной для отслеживания генетических линий.
Например, анализ мтДНК показал, что люди могли появиться в Африке относительно недавно, около 200 000 лет назад, от общего предка, известного как митохондриальная Ева.
Поделиться на PinterestМитохондрии играют важную роль в ряде процессов.
Хотя самой известной ролью митохондрий является производство энергии, они выполняют и другие важные задачи.
На самом деле, только около 3 процентов генов необходимы митохондриям для включения в оборудование для производства энергии. Подавляющее большинство задействовано в других работах, специфичных для типа клеток, в котором они обнаружены.
Ниже мы рассмотрим несколько ролей митохондрий:
Производство энергии
АТФ, сложное органическое химическое вещество, присутствующее во всех формах жизни, часто называют молекулярной единицей валюты, потому что она приводит в действие метаболические процессы. Большая часть АТФ производится в митохондриях посредством серии реакций, известных как цикл лимонной кислоты или цикл Кребса.
Большая часть АТФ производится в митохондриях посредством серии реакций, известных как цикл лимонной кислоты или цикл Кребса.
Производство энергии в основном происходит в складках или кристах внутренней мембраны.
Митохондрии преобразуют химическую энергию пищи, которую мы едим, в форму энергии, которую может использовать клетка. Этот процесс называется окислительным фосфорилированием.
Цикл Кребса производит химическое вещество под названием НАДН. НАДН используется ферментами, встроенными в кристы, для производства АТФ. В молекулах АТФ энергия запасается в виде химических связей. Когда эти химические связи разорваны, можно использовать энергию.
Гибель клеток
Гибель клеток, также называемая апоптозом, является неотъемлемой частью жизни. Когда клетки стареют или разрушаются, они очищаются и разрушаются. Митохондрии помогают решить, какие клетки разрушаются.
Митохондрии выделяют цитохром С, который активирует каспазу, один из главных ферментов, участвующих в разрушении клеток во время апоптоза.
Поскольку некоторые заболевания, такие как рак, связаны с нарушением нормального апоптоза, считается, что митохондрии играют определенную роль в заболевании.
Запас кальция
Кальций жизненно важен для ряда клеточных процессов. Например, высвобождение кальция обратно в клетку может инициировать высвобождение нейротрансмиттера из нервной клетки или гормонов из эндокринных клеток. Кальций также необходим для мышечной функции, оплодотворения и свертывания крови, среди прочего.
Поскольку кальций очень важен, клетка жестко его регулирует. Митохондрии играют в этом определенную роль, быстро поглощая ионы кальция и удерживая их до тех пор, пока они не потребуются.
Другие роли кальция в клетке включают регулирование клеточного метаболизма, синтеза стероидов и передачу сигналов гормонов.
Производство тепла
Когда нам холодно, мы дрожим, чтобы согреться. Но тело также может генерировать тепло другими способами, одним из которых является использование ткани, называемой бурым жиром.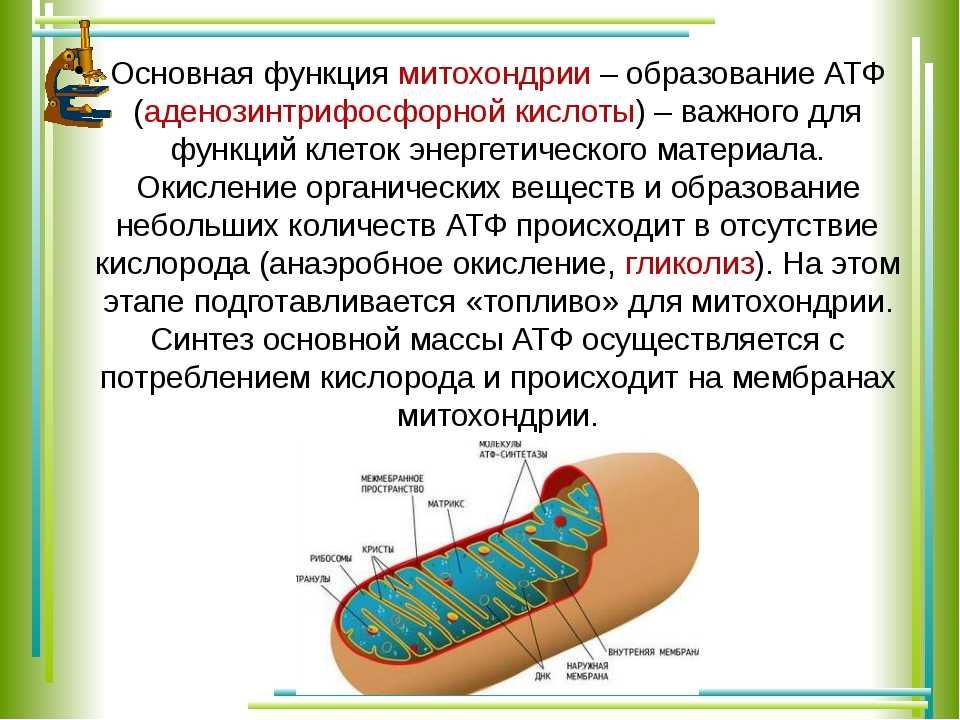
Во время процесса, называемого утечкой протонов, митохондрии могут выделять тепло. Это известно как термогенез без дрожи. Самый высокий уровень бурого жира обнаруживается у младенцев, когда мы более восприимчивы к холоду, и его уровень медленно снижается с возрастом.
Поделиться на PinterestЕсли митохондрии не функционируют должным образом, это может вызвать ряд медицинских проблем.
ДНК в митохондриях более восприимчива к повреждениям, чем остальная часть генома.
Это связано с тем, что во время синтеза АТФ образуются свободные радикалы, которые могут повредить ДНК.
Кроме того, в митохондриях отсутствуют те же защитные механизмы, что и в ядре клетки.
Однако большинство митохондриальных заболеваний вызвано мутациями в ядерной ДНК, которые влияют на продукты, попадающие в митохондрии. Эти мутации могут быть как наследственными, так и спонтанными.
Когда митохондрии перестают функционировать, клетка, в которой они находятся, испытывает недостаток энергии. Таким образом, в зависимости от типа клетки симптомы могут сильно различаться. Как правило, клетки, которым требуется наибольшее количество энергии, такие как клетки сердечной мышцы и нервы, больше всего страдают от дефектных митохондрий.
Таким образом, в зависимости от типа клетки симптомы могут сильно различаться. Как правило, клетки, которым требуется наибольшее количество энергии, такие как клетки сердечной мышцы и нервы, больше всего страдают от дефектных митохондрий.
Следующий отрывок взят из Объединенного фонда митохондриальных заболеваний:
«Поскольку митохондрии выполняют так много различных функций в разных тканях, существуют буквально сотни различных митохондриальных заболеваний. […] Из-за сложного взаимодействия между сотнями генов и клеток, которые должны взаимодействовать, чтобы обеспечить бесперебойную работу нашего метаболического механизма, отличительной чертой митохондриальных заболеваний является то, что идентичные мутации мтДНК могут не вызывать идентичные заболевания».
Болезни, вызывающие разные симптомы, но вызванные одной и той же мутацией, называются генокопиями.
И наоборот, заболевания с одинаковыми симптомами, но вызванные мутациями в разных генах, называются фенокопиями. Примером фенокопии является синдром Ли, который может быть вызван несколькими различными мутациями.
Примером фенокопии является синдром Ли, который может быть вызван несколькими различными мутациями.
Хотя симптомы митохондриального заболевания сильно различаются, они могут включать:
- потерю мышечной координации и слабость
- проблемы со зрением или слухом
- трудности с обучением
- болезни сердца, печени или почек
- желудочно-кишечные проблемы
- неврологические проблемы, включая деменцию
- Болезнь Паркинсона
- Болезнь Альцгеймера
- Биполярное расстройство
- Шизофрения
- Синдром хронической усталости
- Болезнь Гентингтона
- Диабет
- Аутизм
За последние годы исследователи изучили связь между дисфункцией митохондрий и старением. Существует ряд теорий старения, и митохондриальная свободнорадикальная теория старения стала популярной за последнее десятилетие или около того.
Теория состоит в том, что активные формы кислорода (АФК) вырабатываются в митохондриях как побочный продукт производства энергии.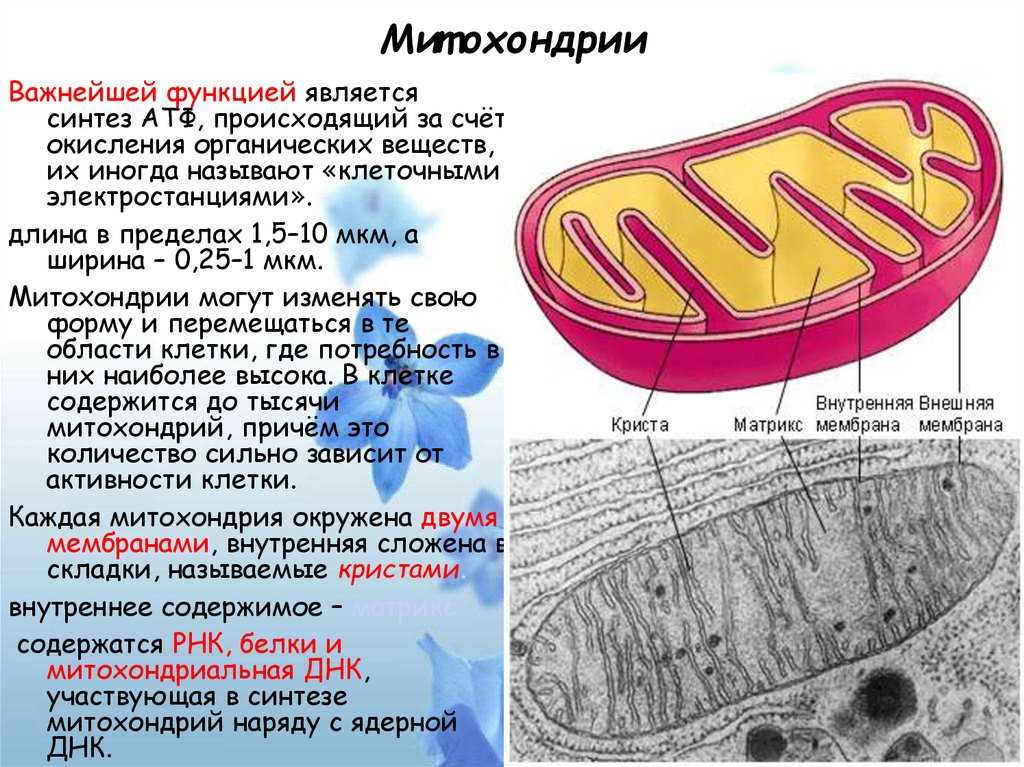

 Недавние результаты генетических исследований показывают, что дефектный контроль качества митохондрий может играть важную роль в развитии болезни Паркинсона (10).
Недавние результаты генетических исследований показывают, что дефектный контроль качества митохондрий может играть важную роль в развитии болезни Паркинсона (10).
 Myhill S, Booth NE, McLaren-Howard J. Int J Clin Exp Med. 2013;6(1):1-15. Epub 2012 Nov 20.
Myhill S, Booth NE, McLaren-Howard J. Int J Clin Exp Med. 2013;6(1):1-15. Epub 2012 Nov 20.
Leave A Comment