Как найти объём выделившегося газа 🚩 Естественные науки
Вам понадобится
- — таблица Менделеева;
- — ручка;
- — бумага для записей.
Инструкция
К примеру, вам требуется найти объем выделившегося водорода в результате реакции ортофосфорной кислоты и карбоната натрия. Самое главное для решения – правильно составить уравнение реакций. Если вы сомневаетесь, как реагируют данные в вашей задаче вещества, посмотрите в справочной литературе свойства химических веществ, участвующих в реакции.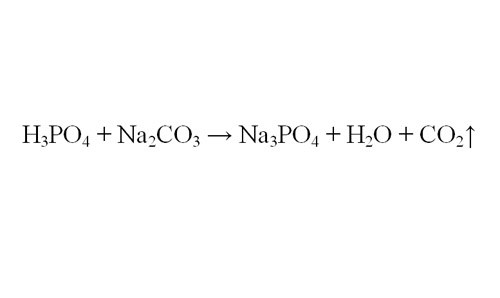
Расставьте коэффициенты в уравнении, чтобы число атомов элементов в левой и правой части уравнения совпадали. Теперь вы видите, в каком соотношении реагируют вещества. По известному количеству любого из них вы можете определить количество молей выделившегося газа. Например, если в реакцию вступило 4 моля ортофосфорной кислоты, получится 6 молей углекислого газа.
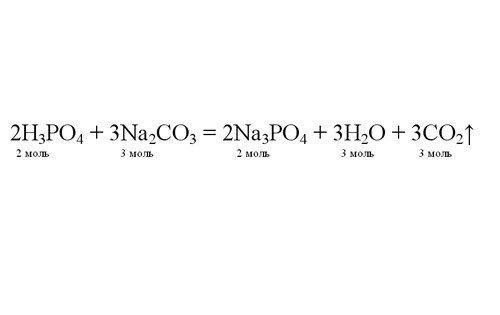
Зная количество молей газа, найдите его объем. По закону Авогадро 1 моль любого газа в нормальных условиях занимает 22,4 литра объема. Объем 6 молей газа будет равен: 6*22,4 = 134,4 литра.
Если в условии не дано количество реагента или продукта реакции, найдите из его других данных. При известной массе одного из веществ вы вычислите его количество молей по формуле: v = m/M, где v – количество вещества, моль; m – масса вещества, г; M – молярная масса вещества, г/моль. Молярную массу вы получите, сложив атомные веса элементов, составляющих вещество, из таблицы Менделеева. Например, молярная масса h4PO4: М = 3*1+31+16*4 = 98 г/моль.
Массу или количество нетрудно рассчитать из концентрации вещества, если известен объем раствора. Из молярности определите количество молей растворенного вещества по уравнению: v = V*Cм, где V – объем раствора, л; См – молярная концентрация, моль/л. Нормальность раствора связана с молярностью выражением: Сн = z*Cм, г моль-экв/л, где z – эквивалент реагента, количество протонов водорода, которое он может принять или отдать. Например, эквивалент h4PO4 – 3.
Также массу растворенного вещества вы можете найти из титра раствора: m = T*V, где Т – титр раствора, г/л; V – объем раствора. Или из плотности: m = p*V, где р – плотность раствора, г/мл.
Определение объема выделившегося газа | Задачи 6
Задача 6.
Определите объем газа (н.у.), который получится, если 8 г алюминия поместить в 200 г 8% -ного раствора соляной кислоты. Найдите массу раствора после реакции.
Дано:
Определение избытка-недостатка
Задача 6.
Определите объем газа (н.у.), который получится, если 8 г алюминия поместить в 200 г 8% -ного раствора соляной кислоты. Найдите массу раствора после реакции.
Дано:
масса алюминия: m(А1) = 8 г;
масса соляной кислоты: mр-ра(НС1) = 200 г;
массовая доля хлороводорода в соляной кислоте: (НС1) = 8% .
Найти:
объем выделившегося газа;
массу раствора после реакции.
Решение:
2А1 + 6НС1 — 2А1С13 + ЗН2↑
Сначала необходимо определить, какое вещество будет в недостатке. По нему можно рассчитать объем выделившегося водорода. Алгоритм вычисления массы конечного раствора
зависит от того, какое вещество окажется в избытке, поэтому отразить эту часть решения заранее невозможно. Алгоритм вычисления массы конечного раствора зависит от того, какое
вещество окажется в избытке. В большинстве задач на определение избытка-недостатка при растворении металла в растворе в недостатке оказывается именно металл. В этом случае
масса конечного раствора определяется очень просто:
mкон. р-ра = т(Ме) + mисх. р-ра – mгаза.
Если же металл окажется в избытке, то его излишек не будет входить в состав конечного раствора, а опустится на дно сосуда.
Поэтому отразить весь алгоритм решения заранее невозможно.
Схематично алгоритм первой части решения будет иметь вид:
1. Определяем массу НС1 в 200 г 8% -ного исходного раствора.
2. Определяем количество веществ НС1 и А1.
3. Выберем за основу алюминий, и определим по уравнению реакции количество вещества НС1, которое необходимо для полного растворения всего (0,296 моль) алюминия.
Составляем пропорцию:
на 0,296 моль А1 должно расходоваться х моль НС1 (по условию)
на 2 моль А1 полностью расходуется 6 моль НС1 (но уравнению)
НС1 должно расходоваться на 0,296 моль А1.
4 .Определим, какое вещество дано в недостатке.
Таблица
n(НС1) необходимо
n(НС1) дано по условию
0,888моль > 0,438 моль
В реакции участвует меньше НС1, чем необходимо для полного растворения А1, следовательно, НС1 дано в недостатке. В процессе реакции НС1 израсходуется полностью, а А1 расходуется не весь и часть его останется после реакции.
5. Рассчитаем по уравнению реакции объем (н.у.) выделившегося водорода. Для расчета используем НС1, т.к. это вещество взято в недостатке.
Составляем пропорцию:
0,438 моль НС1 дают х л Н2 (по условию)
6 моль НС1 дают 67,2 л Н2 (по уравнению)
выделится в процессе реакции.
6. Определим массу выделившегося Н2 по алгоритму:
7. Определяем массу раствора после реакции.
mкон. р-ра = m(HCl)р-ра + m(Al)растворившегося
При определении массы конечного раствора нужно учитывать, что алюминий находился в избытке, и часть его осталась после реакции в неизменном виде. Не прореагировавший алюминий, очевидно, не входит в состав раствора и будет находиться на дне. Поэтому нам придется определить массу растворившегося А1. Это можно сделать по уравнению реакции, используя данные по НС1.
Составляем пропорцию:
х т А1 растворяются в 0,438 моль НС1 (по условию)
54 г А1 растворяются в 6 моль НС1 (по уравнению)
Теперь возможно определить массу конечного раствора:
mкон. р-ра = 200 + 3,95 – 0,44 = 203,51 г.
Ответ:
Определение объема образовавшегося углекислого газа
Задача 7.
Определите объем выделившегося газа при взаимодействии 20,0 г карбоната кальция с избытком азотной кислоты.
Решение:
Несмотря на то, что в условии говориться об избытке азотной кислоты, данная задача не относится к типу «на определение избытка-недостатка». В условии указана масса только одного из участников реакции (СаСО3). Указание на избыток другого участника (НNO3) показывает, что карбонат кальция расходуется полностью и объем выделившегося газа необходимо считать именно по СаСО3.
Определим объем образовавшегося углекислого газа из пропорции:
100 г А1 дают 22,4 л СО2 (по уравнению)
Ответ: V(CO2) = 4,
Задачи на избыток-недостаток:
1. Определение избытка-недостатка
2 . Алгоритм определения избытка-недостатка
Как найти объём выделившегося газа
В учебном курсе химии часто встречаются задачи, в которых требуется вычислить объем газа, выделившегося в результате химической реакции. Почти все задачи такого типа можно решить по следующему алгоритму. Вам понадобится
Вам понадобитсяК примеру, вам требуется найти объем выделившегося водорода в результате реакции ортофосфорной кислоты и карбоната натрия. Самое главное для решения – правильно составить уравнение реакций. Если вы сомневаетесь, как реагируют данные в вашей задаче вещества, посмотрите в справочной литературе свойства химических веществ, участвующих в реакции.
Расставьте коэффициенты в уравнении, чтобы число атомов элементов в левой и правой части уравнения совпадали. Теперь вы видите, в каком соотношении реагируют вещества. По известному количеству любого из них вы можете определить количество молей выделившегося газа. Например, если в реакцию вступило 4 моля ортофосфорной кислоты, получится 6 молей углекислого газа.
Зная количество молей газа, найдите его объем. По закону Авогадро 1 моль любого газа в нормальных условиях занимает 22,4 литра объема. Объем 6 молей газа будет равен: 6*22,4 = 134,4 литра.
Если в условиине дано количество реагента или продукта реакции, найдите из его других данных. При известной массе одного из веществ вы вычислите его количество молей по формуле: v = m/M, где v – количество вещества, моль; m – масса вещества, г; M – молярная масса вещества, г/моль. Молярную массу вы получите, сложив атомные веса элементов, составляющих вещество, из таблицы Менделеева. Например, молярная масса h4PO4: М = 3*1+31+16*4 = 98 г/моль.
Массу или количество нетрудно рассчитать из концентрации вещества, если известен объем раствора. Из молярности определите количество молей растворенного вещества по уравнению: v = V*Cм, где V – объем раствора, л; См – молярная концентрация, моль/л.Нормальность раствора связана с молярностью выражением: Сн = z*Cм, г моль-экв/л, где z – эквивалент реагента, количество протонов водорода, которое он может принять или отдать. Например, эквивалент h4PO4 – 3.
Также массу растворенного вещества вы можете найти из титра раствора: m = T*V, где Т – титр раствора, г/л; V – объем раствора. Или из плотности: m = p*V, где р – плотность раствора, г/мл.
Как найти объем газа?
Прежде чем решать задачи, следует занть формулы и правила того, как найти объем газа. Следует вспомнить закон Авогадро. А сам объем газа можно вычислить при помощи нескольких формул, выбрав из них подходящую. При подборе необходимой формулы, большое значение имеют условия среды, в частности температура и давление.
Закон Авогадро
В нем говорится, что при одинаковом давлении и одинаковой температуре, в одних и тех же объемах разных газов, будет содержаться одинаковое число молекул. Количество молекул газа, содержащихся в одном моле, это есть число Авогадро. Из этого закона следует, что: 1 Кмоль (киломоль) идеального газа, причем любого, при одинаковом давлении и температуре (760 мм рт.ст. и t = 0*С) всегда занимает один объем = 22,4136 м3.
Как определить объем газа
- Формулу V=n*Vm чаще всего можно встретить в задачах. Здесь объем газа в литрах — V, Vm – объем газа молярный (л/моль), который при нормальных условиях = 22,4 л/моль, а n – количество вещества в молях. Когда в условиях нет количества вещества, но при этом есть масса вещества, тогда поступаем таким образом: n=m/M. Здесь М – г/моль (молярная масса вещества), а масса вещества в граммах — m. В таблице Менделеева она написана под каждым элементом, как его атомная масса. Сложим все массы и получим искомую.
- Итак, как рассчитать объем газа. Вот задача: в соляной кислоте растворить 10 г алюминия. Вопрос: сколько водорода может выделиться при н. у.? Уравнение реакции выглядит так: 2Al+6HCl(изб.)=2AlCl3+3h3. В самом начале находим алюминий (количество), вступивший в реакцию по формуле: n(Al)=m(Al)/M(Al). Массу алюминия (молярную) возьмем из таблицы Менделеева M(Al)=27г/моль. Подставим: n(Al)=10/27=0,37моль. Из химического уравнения видно, 3 моли водорода образовались при растворении 2-х молей алюминия. Следует рассчитать, а сколько же водорода выделится из 0,4 моли алюминия: n(h3)=3*0,37/2=0,56моль. Подставим данные в формулу и найдем объем этого газа. V=n*Vm=0,56*22,4=12,54л.
Объем — выделившийся газ — Большая Энциклопедия Нефти и Газа, статья, страница 1
Объем — выделившийся газ
Cтраница 1
Объем выделившегося газа не совпадает с объемом растворившегося, наблюдается гистерезис. Чем больше t, тем при более высоком давлении начинается выделение пузырьков. Это указывает на то, что в условиях капилляра необходимо достаточно большое время на образование и формирование пузырька в жидкости. [2]
Объемы выделившихся газов измеряют в газовой бюретке, производя отсчет в течение всего опыта. Это позволяет рассчитать количество электричества за любые промежутки времени. [4]
Объем выделившихся газов превышает объем вискозы в десятки раз, что приводит к очень большим пересыщениям. [5]
Объемы выделившихся газов измеряют в газовой бюретке, производя отсчет в течение всего опыта. Это позволяет рассчитать количество электричества за любые промежутки времени. [6]
Почему объем выделившегося газа в одной бюретке в два раза меньше, чем в другой. [10]
Замеряют объем выделившегося газа и массу дегазированной нефти. Вычисляют газосодержание — отношение объема выделившегося газа к массе нефти. Далее определяют компонентный состав газа ( % мол. [11]
Измерение объема выделившегося газа
По объему выделившегося газа вычисляют содержание влаги в образце. [13]
Измеряя порознь объемы выделившихся газов, можно определить процент доломита и избыточного кальцита в породе. [14]
V — объем выделившегося газа; р — навеска вещества. [15]
Страницы: 1 2 3 4
Задачи на расчеты по уравнениям химических реакций и тепловой эффект.
Задание №1
Рассчитайте массу оксида (в граммах), образовавшегося при сгорании 2,4 г металлического магния. Ответ округлите до целых.
РешениеЗадание №2
Рассчитайте объем газа (в литрах), образующегося при взаимодействии 6,72 л хлора (н.у.) с необходимым количеством водорода. Ответ округлите до сотых.
РешениеЗадание №3
Какую массу нитрата свинца (II) (в граммах) можно получить при взаимодействии с избытком азотной кислоты оксида свинца (II) массой 11,15 г? Ответ округлите до сотых.
РешениеЗадание №4
Рассчитайте объем газовой смеси (н.у.), полученной при полном разложении 15 л аммиака. Ответ укажите в литрах и округлите до целых.
РешениеЗадание №5
При сгорании навески серы выделилось 8,96 л сернистого газа (н.у.). Вычислите массу серы, которую взяли для реакции. Ответ округлите до десятых.
РешениеЗадание №6
При прокаливании образца мела выделилось 3,36 л углекислого газа (н. у.). Вычислите массу образовавшегося оксида кальция (в граммах). Ответ округлите до десятых.
РешениеЗадание №7
Рассчитайте массу цинка (в граммах), необходимую для получения 162 г его оксида. Ответ округлите до целых.
РешениеЗадание №8
Вычислите объем газов (н.у.), необходимый для получения 13,5 г воды из простых веществ. Ответ укажите в литрах и округлите с точностью до десятых.
РешениеЗадание №9
Определите массу хлорида алюминия (в граммах), которую можно получить из 33,6 л газообразного хлора (н. у.). Ответ округлите до десятых.
РешениеЗадание №10
Какую массу чистой серной кислоты (в граммах) необходимо затратить для получения 100 г сульфата железа (III) из оксида железа (III)? Ответ округлите до десятых.
РешениеЗадание №11
Какой объем оксида азота (II) можно получить при каталитическом окислении 15,6 л аммиака кислородом (н.у.)? Ответ укажите в литрах и округлите до десятых.
РешениеЗадание №12
Какую массу фосфата калия (в граммах) можно получить из 120 г фосфорной кислоты и избытка гидроксида калия. Ответ округлите до десятых.
РешениеЗадание №13
Рассчитайте объем сероводорода (н.у.), необходимый для получения 31 г сульфида натрия по реакции с гидроксидом натрия. Ответ укажите в литрах с точностью до десятых.
РешениеЗадание №14
Вычислите массу поташа (в граммах), которая при взаимодействии с избытком азотной кислоты даст 20,16 л углекислого газа (н.у.). Ответ округлите до десятых.
РешениеЗадание №15
Какой объем угарного газа (в литрах) (н. у.) можно получить при неполном сгорании 14 г углерода? Ответ округлите до целых.
РешениеЗадание №16
Какую массу гидроксида алюминия можно получить из 50 г сульфата алюминия при его обменной реакции с достаточным количеством раствора гидроксида натрия? Ответ округлите до десятых.
РешениеЗадание №17
Вычислите массу негашеной извести (в граммах), которая может прореагировать с 10 г воды. Ответ округлите до целых.
РешениеЗадание №18
Рассчитайте объем 15%-ного раствора карбоната натрия (плотность 1,1 г/мл), из которого при взаимодействии с избытком соляной кислоты можно получить 22,4 л (н. у.) углекислого газа. Ответ укажите в миллилитрах и округлите до целых.
РешениеЗадание №19
Рассчитайте массовую долю серной кислоты в растворе (плотность 1,35 г/см3), если известно, что 30 мл такого раствора могут полностью прореагировать с 5 г карбоната кальция. Ответ укажите в процентах и округлите с точностью до десятых.
РешениеЗадание №20
Вычислите массу углекислого газа (в граммах), полученного при взаимодействии 121 мл 15%-ного раствора азотной кислоты (плотность 1,16 г/мл) с необходимым количеством карбоната магния. Ответ округлите до десятых.
РешениеЗадание №21
Определите объем водорода (при н.у.), который можно получить при взаимодействии избытка цинкового порошка со 100 мл 10%-ного раствора соляной кислоты (плотность 1,05 г/мл). Ответ укажите в литрах и округлите с точностью до десятых.
РешениеЗадание №22
Вычислите массу гидроксида железа (III), которую можно получить при взаимодействии 2,5 мл 20%-ного раствора бромида железа (III) (плотность 1,38 г/см3) и избытка водного раствора гидроксида натрия. Ответ укажите в граммах и округлите до сотых.
РешениеЗадание №23
Какой объем газообразного аммиака (в литрах) может прореагировать с 650 мл 10%-ного раствора бромоводородной кислоты (плотность 1,14 г/мл)? Ответ округлите до десятых.
РешениеЗадание №24
Определите массу серной кислоты, которая необходима для полной нейтрализации 100 мл 20%-ного раствора гидроксида бария (плотность 1,17 г/мл)? Ответ округлите до десятых.
РешениеЗадание №25
Рассчитайте массу сероводорода, которую можно получить из 13 мл 5%-ного раствора сульфида калия (плотность 1,06 г/мл) и избытка соляной кислоты. Ответ округлите до десятых.
РешениеЗадание №26
Какую массу фосфида магния (в граммах) можно получить из 240 мг металла и 217 мг фосфора? Ответ округлите до сотых.
РешениеЗадание №27
Какой объем аммиака (в литрах) можно получить из 3 г водорода и 11,2 л азота (н. у.)? Ответ округлите до десятых.
РешениеЗадание №28
Рассчитайте объем углекислого газа (в литрах), который можно получить из 12 л кислорода и 14 л угарного газа (н. у.). Ответ округлите до целых.
РешениеЗадание №29
Вычислите массу нитрата аммония (в граммах), которую можно получить из 20 л (н. у.) аммиака и 31,5 г азотной кислоты. Ответ округлите до целых.
РешениеЗадание №30
Определите объем сернистого газа (в литрах), который можно получить из 16 г серы и 8 г кислорода. Ответ округлите до десятых.
РешениеЗадание №31
Какой суммарный объем газов (н. у.) можно получить при взаимодействии 15 г углерода и 16 г серы с избытком кислорода? Ответ округлите до десятых.
РешениеЗадание №32
Какую массу оксида серы (VI) можно получить при взаимодействии 30 л сернистого газа и 30 л кислорода (н. у.)? Ответ укажите в граммах и округлите с точностью до целых.
РешениеЗадание №33
Вычислите массу оксида алюминия, который можно получить из 13,5 г алюминия и 13,5 г кислорода. Ответ округлите до десятых.
РешениеЗадание №34
Определите массовую долю соли в растворе, полученном при смешении 150 г 15%-ного раствора гидроксида натрия и 250 г 10%-ного раствора плавиковой кислоты. Ответ округлите до десятых процента.
РешениеЗадание №35
Рассчитайте массовую долю кислоты в растворе, полученном при смешении 8,5 г 10%-ного раствора аммиака и 40,5 г 50%-ного раствора бромоводородной кислоты. Ответ округлите до десятых процента.
РешениеЗадание №36
Вычислите массовую долю карбоната калия в растворе, полученном при смешении 100 г 2%-ного раствора гидрокарбоната калия и 100 г 20%-ного раствора гидроксида калия. Ответ укажите в процентах и с точностью до сотых.
РешениеЗадание №37
Рассчитайте массовую долю хлороводорода в растворе, полученном при смешении 250 г 10%-ного раствора хлороводорода и 1,7 г нитрата серебра. Ответ округлите до десятых процента.
РешениеЗадание №38
Образец карбоната бария массой 15 г, содержащий 5% инертных примесей, растворили в избытке раствора соляной кислоты. Вычислите объем выделившегося газа. Ответ округлите до десятых.
РешениеЗадание №39
Смесь песка и поваренной соли массой 20 г внесли в 90 мл воды. Доля растворенного вещества в образовавшемся растворе составила 10%. Определите массу песка в исходной смеси. Ответ округлите до целых.
РешениеЗадание №40
Смесь цинка и песка массой 10 г смешали с избытком раствора йодоводородной кислоты, в результате чего образовался газ объемом 3,36 л (н. у.). Определите массовую долю цинка в исходной смеси. Ответ укажите в процентах округлите до десятых процента.
РешениеЗадание №41
Газообразную смесь хлороводорода и кислорода объемом 11,2 л (н. у.) пропустили через необходимый для полной нейтрализации объем раствора гидроксида натрия. После упаривания раствора масса остатка составила 11,7 г. Определите объем кислорода в исходной смеси. Ответ округлите до сотых.
РешениеЗадание №42
При прокаливании алюминиевой стружки массой 54 г в токе кислорода образовалось 96 г оксида. Определите выход реакции. Ответ округлите до целых процентов.
РешениеЗадание №43
Термическое разложение навески карбоната кальция массой 50 г прошло с выходом 95%. Рассчитайте массу воды, которая может прореагировать с полученным твердым остатком. Ответ округлите до сотых.
РешениеЗадание №44
Горение углерода происходит согласно термохимическому уравнению
C(графит) + O2(г) → CO2(г) + 393,5 кДж
Рассчитайте количество энергии, которое выделится при сгорании 6 г углерода. Ответ округлите до сотых.
РешениеЗадание №45
Горение алюминия происходит согласно термохимическому уравнению
4Al(тв) + 3O2(г) → 2Al2O3(тв) + 3352 кДж
Рассчитайте количество энергии, которое выделится при сгорании 13,5 г алюминия. Ответ округлите до целых.
РешениеЗадание №46
Обжиг сульфида свинца (II) происходит согласно термохимическому уравнению
2PbS(тв) + 3O2(г) → 2PbO(тв) + 2SO2(г) + 832 кДж
Рассчитайте массу навески сульфида свинца (II), если в процессе выделилось 70 кДж энергии. Ответ округлите до десятых.
РешениеЗадание №47
Обжиг сульфида алюминия происходит согласно термохимическому уравнению
2Al2S3(тв) + 9O2(г) → 2Al2O3(тв) + 6SO2(г) + 3864 кДж
Рассчитайте массу навески сульфида алюминия, если в процессе выделилось 90 кДж энергии. Ответ округлите до целых.
РешениеЗадание №48
Обжиг пирита происходит в соответствии с термохимическим уравнением
4FeS2(тв) + 11O2(г) → 2Fe2O3(тв) + 8SO2(г) + 3367 кДж
Рассчитайте массу навески пирита, если в процессе выделилось 110 кДж энергии. Ответ округлите до десятых.
РешениеЗадание №49
Разложение нитрата серебра происходит согласно термохимическому уравнению
2AgNO3(тв) → 2Ag(тв) + 2NO2(г) + O2(г) – 316 кДж
Сколько энергии нужно затратить для получения 8,96 л кислорода по данной реакции? Ответ округлите до десятых.
РешениеЗадание №50
Взаимодействие сернистого газа с сероводородом описывается следующей реакцией
SO2(г) + 2H2S(г) → 3S(ромб) + 2H2O(г) + Q
При образовании 8 г серы выделилось 12 кДж энергии. Установите тепловой эффект реакции Q. Ответ округлите до целых.
РешениеЗадание №51
Взаимодействие сернистого газа с кислородом описывается следующей реакцией
2SO2(г) + O2(г) → 2SO3(г) + Q
При образовании 16 г оксида серы (VI) выделилось 28,4 кДж энергии. Установите тепловой эффект реакции Q. Ответ округлите до целых.
РешениеЗадание №52
Взаимодействие магния с азотом описывается следующей реакцией
3Mg(тв) + N2(г) → Mg3N2(тв) + Q
При поглощении 11,2 л азота выделилось 230 кДж энергии. Установите тепловой эффект реакции Q. Ответ округлите до целых.
РешениеЗадание №53
Реакция серы с железом происходит согласно термохимическому уравнению
Fe(тв) + S(ромб) → FeS(тв) + Q
Рассчитайте тепловой эффект реакции Q, если при образовании 40 г сульфида железа (II) выделяется 45,5 кДж энергии. Ответ округлите до целых.
РешениеЗадание №54
Реакция серы с фтором происходит согласно термохимическому уравнению
S(ромб) + 3F2(г) → SF6(г) + Q
Рассчитайте тепловой эффект реакции Q, если при образовании 50 г фторида серы (VI) выделяется 413 кДж энергии. Ответ округлите до целых.
РешениеЗадание №55
Разложение карбоната кальция происходит согласно термохимическому уравнению
CaCO3(тв) → CaO(тв) + CO2(г) – 178 кДж
Сколько энергии нужно затратить для получения 28 г оксида кальция по данной реакции? Ответ округлите до целых.
РешениеЗадание №56
Разложение карбоната свинца происходит согласно термохимическому уравнению
PbCO3(тв) → PbO(тв) + CO2(г) – 87 кДж
Сколько энергии нужно затратить для получения 112 л углекислого газа по данной реакции? Ответ округлите до целых.
РешениеЗадание №57
Разложение карбоната стронция происходит согласно термохимическому уравнению
SrCO3(тв) → SrO(тв) + CO2(г) – 241 кДж
Сколько энергии нужно затратить для получения 104 г оксида стронция по данной реакции? Ответ округлите до целых.
РешениеЗадание №58
Образование оксида азота (II) происходит согласно термохимическому уравнению
N2(г) + O2(г) → 2NO(г) – 180 кДж
Сколько энергии нужно затратить для получения 15 г оксида азота (II) по данной реакции? Ответ округлите до целых.
РешениеЗадание №59
Разложение гидроксида меди (II) происходит согласно термохимическому уравнению
Cu(OH)2(тв) → CuO(тв) + H2O(г) – 46 кДж
Сколько энергии нужно затратить для разложения 9,8 г исходного вещества по данной реакции? Ответ округлите до десятых.
РешениеКак рассчитать расход бензина за 7 быстрых шагов
Поскольку стоимость бензина колеблется от высокой до астрономической, многих водителей очень беспокоит расход топлива, который расходуется на их автомобиль. С помощью этих простых шагов довольно просто рассчитать средний расход топлива вашего автомобиля.
7 шагов для расчета пробега на бензине
1
Узнайте вместимость бензобака вашего бензобака. Эту информацию можно найти в руководстве по эксплуатации вашего автомобиля.Емкость бензобака большинства транспортных средств варьируется от десяти галлонов для небольших компактных автомобилей до сорока галлонов для больших грузовиков или внедорожников.
2
Заполните. Заполните бензобак вашего автомобиля на полную мощность. Большинство бензонасосов имеют механизм, который останавливает подачу бензина, когда бак полон. Когда вы включаете машину, убедитесь, что указатель бензобака показывает, что ваш бак полностью заполнен.
Стрелка обычно проходит за отметку максимума, если ваш бак полон3
Когда вы посмотрите на бензонасос, чтобы узнать, сколько денег вам нужно заплатить за свой бензин, обратите внимание на показание количества галлонов, которые вы приобрели.Должно быть указано точное количество купленных вами галлонов с точностью до сотой доли галлона. Это число должно быть близко к общей емкости бензобака, указанной в инструкции по эксплуатации. Запишите эту сумму. Если бензонасос, который вы использовали для заправки, не имеет этой функции, вы можете разделить общую сумму покупки бензина на цену за галлон.
4
Установите счетчик пройденного пути. Обычно он находится на приборной панели и устанавливается нажатием кнопки, расположенной где-то вокруг спидометра или датчика оборотов.Обязательно выполните этот шаг, как только заправляете бензобак и перед тем, как начать движение.
Кнопка обычно черная и цилиндрическая, в большинстве случаев требуется более длительное нажатие, пока вы не увидите все нули5
Управляйте автомобилем как обычно.
6
Управляйте автомобилем до тех пор, пока не загорится газовый индикатор, указывающий вам, что вам нужно пополнить бак. На этом этапе обратите внимание на показания одометра для поездки, которую вы установили при наполнении бака.
7
Пора немного математики. Разделите общее количество миль, которое вы проехали на этом топливном баке, на количество галлонов бензина, которое вы купили при заправке бензобака вашего автомобиля. Решением этой проблемы будет среднее количество миль на галлон бензина, которое получает ваш автомобиль. Вот короткое видео, чтобы убедиться, что ваши расчеты верны.
Многие водители используют определенные стратегии вождения, чтобы сократить расход топлива на своем автомобиле, например, более медленное ускорение и более низкие скорости.Зная среднее количество миль на галлон вашего автомобиля, вы также сможете более точно планировать расходы на бензин.
Залейте. Заполните бензобак вашего автомобиля на полную мощность. Большинство бензонасосов имеют механизм, который останавливает подачу бензина, когда бак полон. Когда вы включаете машину, убедитесь, что указатель бензобака показывает, что ваш бак полностью заполнен.
» } }, { «@type»: «HowToStep», «position»: «3», «name»: «Обратите внимание на количество купленных галлонов.», «itemListOrder»: «http://schema.org/ItemListOrderAscending», «ItemListElement»: { «@type»: «HowToDirection», «text»: «Когда вы посмотрите на бензонасос, чтобы узнать, сколько денег вам нужно заплатить за бензин, обратите внимание на количество купленных вами галлонов. Должно быть точное значение того, сколько галлонов вы купили на сотая галлона. Это число должно быть близко к общей емкости бензобака, указанной в руководстве пользователя. Запишите это количество. Если бензонасос, который вы использовали для заправки, не имеет этой функции, вы можете разделить общее количество покупки бензина по цене за галлон.» } }, { «@type»: «HowToStep», «position»: «4», «name»: «Установить счетчик пройденного пути.», «itemListOrder»: «http://schema.org/ItemListOrderAscending», «ItemListElement»: { «@type»: «HowToDirection», «text»: «Установите одометр. Обычно он находится на приборной панели и настраивается нажатием кнопки, расположенной где-то вокруг спидометра или датчика оборотов. Обязательно выполните этот шаг, как только вы заправите свой бак бензином и прежде чем вы начнете водить машину «. } }, { «@type»: «HowToStep», «position»: «5», «name»: «Управляй своей машиной.», «itemListOrder»: «http://schema.org/ItemListOrderAscending», «ItemListElement»: { «@type»: «HowToDirection», «text»: «Водите машину как обычно». } }, { «@type»: «HowToStep», «position»: «6», «name»: «Обратите внимание на одометр, когда загорится газовая лампа.», «itemListOrder»: «http://schema.org/ItemListOrderAscending», «ItemListElement»: { «@type»: «HowToDirection», «text»: «Управляйте автомобилем до тех пор, пока не загорится индикатор бензина, чтобы указать вам, что вам нужно пополнить бак. На этом этапе обратите внимание на показания одометра для поездки, которую вы установили при заправке бака.» } }, { «@type»: «HowToStep», «position»: «7», «name»: «Рассчитайте свой расход бензина.», «itemListOrder»: «http://schema.org/ItemListOrderAscending», «ItemListElement»: { «@type»: «HowToDirection», «text»: «Время для некоторой математики. Разделите общее количество миль, которое вы проехали на этом топливном баке, на количество галлонов бензина, которые вы купили при заправке бензобака вашего автомобиля. Решением этой проблемы будет среднее миль на галлон бензина, который получает ваш автомобиль. Вот короткое видео, чтобы убедиться, что ваши расчеты верны.» } } ] }
.Что такое газ, лимит газа и цена на газ в сети Ethereum?
Сеть Ethereum, в отличие от сети Биткойн, содержит не только одноименную криптовалюту, но также имеет лимит газа и газа. Последний позволяет пользователям не только оплачивать транзакции, но и запускать смарт-контракты и DApps, а также хранить данные в блокчейне.
Платформа второй по величине в мире криптовалюты по рыночной капитализации Ethereum была запущена в июле 2015 года Виталиком Бутериным.Цель платформы — предоставить разработчикам открытую распределенную сеть для запуска собственных децентрализованных приложений (DApps) и смарт-контрактов. Если сеть Биткойн играет роль одноранговой платежной системы, то Ethereum предназначен для выполнения программного кода с использованием децентрализованной виртуальной машины (EVM).
Эфир — это внутренняя криптовалюта, которая добывается для поддержки сети, и, в отличие от других криптовалют, его роль не ограничивается платежами.Одна монета эфира делится на Finney, Szabo, Gwei, Mwei, Kwei и Wei, где Wei — самая маленькая единица эфира. Разработчики дали такие названия номиналам эфира в честь известных личностей, внесших значительный вклад в развитие криптовалюты. Один ETH равен тысяче Finney, одному миллиону Szabo, миллиарду Gwei и квинтиллиону Wei.

Комиссия, полученная майнером, взимается за выполнение любых транзакций и действий в блокчейне Ethereum.Сетевые майнеры подтверждают транзакции и решают, какие из них войдут в новый блок сети. Комиссия за транзакцию рассчитывается в газе и оплачивается в эфире . Таким образом, газ является «топливом» сети Ethereum, которое используется для проведения транзакций, выполнения смарт-контрактов и запуска DApps, а также для оплаты хранения данных.
Газ состоит из двух компонентов: лимита и цены. Таким образом, работу сети Ethereum обеспечивают:
Ether (ETH) — собственная криптовалюта сети Ethereum, вторая по рыночной капитализации на рынке криптовалют.
Газ — это единица расчета, которая указывает комиссию за конкретное действие или транзакцию.
Лимит газа — это максимальное количество газа, которое пользователь готов заплатить за выполнение этого действия или подтверждение транзакции (минимум 21 000).
Цена газа (цена газа) — это количество Gwei, которое пользователь готов потратить на каждую единицу газа.
Отправитель устанавливает лимит и цену на газ для каждой транзакции.Чтобы самостоятельно рассчитать общую стоимость комиссии за транзакцию в эфире, необходимо умножить лимит газа на его цену. Например, если лимит газа составляет 50 000 единиц, а цена на газ составляет 20 Gwei, это означает, что отправитель готов потратить 0,001 эфира на выполнение транзакции.
Чем выше цену на газ, которую отправитель готов заплатить, тем важнее транзакция в сети Ethereum, поскольку вознаграждение майнера будет выше.Этот вариант подходит тем, кто участвует в предпродаже токенов популярного ICO и хочет увеличить шансы включения своей транзакции в следующий блок. Однако, устанавливая низкую цену на газ, отправитель экономит свои собственные средства, например, при переводе средств с одного кошелька на другой.
После завершения транзакции весь неиспользованный Газ возвращается на счет отправителя. Если сумма указанного лимита газа слишком мала, то транзакция считается недействительной и будет отклонена в связи с ошибкой «Нет газа», а газ, потраченный на расчеты, не будет возвращен на счет.Стоит иметь в виду, что отправитель всегда платит майнерам за оценки, независимо от того, проходит транзакция или нет. Обработка транзакции из MyEtherWallet будет выглядеть так:
Чтобы рассчитать количество эфира, лимит газа и время подтверждения в ETH или долларах США, существует онлайн-сервис под названием ETH Gas Station. Цена на газ Oracle, основываясь на информации о последних транзакциях, рассчитывает цену на газ и время, необходимое для выполнения расчетов майнерами.На сегодняшний день для подтверждения транзакций для 1 Gwei требуется около 30 минут, а для 40 Gwei — около 1-2 минут.
.Калькулятор стоимости топлива
Этот калькулятор может оценить стоимость топлива в зависимости от расстояния поездки, топливной экономичности автомобиля и цены на газ с использованием различных единиц измерения.

Калькулятор пробега RelatedGas | Калькулятор пробега
Цена на бензин может повышаться или понижаться, но для большинства водителей это всегда большие расходы. По данным Американской автомобильной ассоциации, средний американский водитель тратит около 3000 долларов в год на бензин. Некоторые из практических способов снизить стоимость топлива перечислены ниже.
На общественном транспорте
Ходьба или езда на велосипеде не требует расхода топлива и, следовательно, не увеличивает затраты на топливо. В большинстве случаев общественный транспорт, альтернативный автомобилям, такой как автобусы, поезда и троллейбусы, являются жизнеспособными вариантами снижения стоимости топлива. Из-за коммунального характера совместного использования поездок затраты на топливо при эксплуатации общественного транспорта, как правило, меньше, чем затраты на топливо, связанные с каждым человеком, управляющим собственным транспортным средством. В некоторых местах общественный транспорт бесплатный.Учет затрат, связанных с владением или арендой автомобиля, создает еще больший стимул для использования других видов транспорта.
Автобаз
Совместное использование автомобилей, также известное как совместное использование автомобилей, совместное использование автомобилей — это договоренность между двумя или более людьми, которые путешествуют в один пункт назначения на одном автомобиле. Хотя более тяжелый автомобиль потребляет немного больше топлива, он обычно намного эффективнее, чем два человека, ведущие разные машины в один и тот же пункт назначения.
Используйте более экономичный автомобиль
Вождение автомобиля меньшего размера имеет большое значение — стоимость топлива для маленького седана составляет примерно половину, чем для очень большого внедорожника.Точно так же двигайтесь с менее мощным двигателем, чем вам нужно. Не платите за восьмицилиндровый двигатель, если четыре цилиндра работают нормально. Если вы не перевозите тяжелые грузы на регулярной основе, дополнительные расходы на двигатель большего размера приводят к увеличению расходов на бензин.
Тюнинг двигателя
Правильно настроенный двигатель увеличивает мощность и может значительно повысить топливную экономичность. Но тюнинг автомобильного двигателя часто делается на увеличение мощности — это не способ экономии топлива. Убедитесь, что тюнер получает сообщение.
Ремонт автомобиля, который заметно расстроен или не прошел тест на выбросы, может улучшить его расход топлива в среднем на 4 процента — эта сумма будет варьироваться в зависимости от характера ремонта.
Устранение серьезной проблемы технического обслуживания, такой как неисправный кислородный датчик, может увеличить пробег на 40 процентов.
Размещение украшений и эффектов земли, аэродинамических комплектов и аэродинамических пленок, таких как спойлеры на крышке палубы, может улучшить ваше самочувствие, но они также увеличивают лобовое сопротивление автомобиля и заставляют его потреблять больше топлива.Такие аксессуары не улучшают управляемость, хотя могут хорошо смотреться на вашем автомобиле. Также разместите знаки или груз на крыше таким образом, чтобы объект наклонялся вперед. Это уменьшит фронтальную площадь объекта, вызовет меньшее сопротивление и приведет к меньшему расходу топлива.
Регулировка шин
Убедитесь, что шины накачаны до нужного уровня. Правильно накачанные шины могут снизить расход топлива до 3 процентов. Ваши шины также теряют примерно 1 фунт / дюйм2 в месяц, а когда шины холодные (например,г., зимой) их давление будет уменьшаться из-за теплового сжатия воздуха. Рекомендуется проверять шины не реже одного раза в месяц, желательно раз в неделю. Правильно накачанные шины также помогут избежать неравномерного износа протектора.
Заправочные станции не всегда имеют для этого точное оборудование. Иногда на заправочных станциях используются автоматические воздушные компрессоры, которые останавливаются на заданном уровне. Чтобы убедиться, что вы накачиваете до нужного уровня, дважды проверьте давление с помощью собственного манометра.
Рекомендуемое давление накачивания для холодных шин; добавьте примерно на 3 фунта / кв.дюйм больше, если шины были в эксплуатации некоторое время. Накачивайте до давления, рекомендованного производителем автомобиля, а не до уровня, указанного на шине.
Используйте подходящее моторное масло
Расход топлива увеличится на 1-2 процента, если вы будете использовать моторное масло рекомендованного производителем сорта. Например, использование моторного масла 10W-30 в двигателе, предназначенном для использования 5W-30, может значительно сократить расход топлива.Использование 5W-30 в двигателе, разработанном для 5W-20, может снизить расход топлива на 1–2 процента. Кроме того, обратите внимание на моторное масло с надписью «Энергосбережение» на символе характеристик API, чтобы убедиться, что оно содержит присадки, снижающие трение.
Тщательно спланируйте поездку
Нет более очевидного способа сэкономить газ, чем проехать меньшее расстояние.
Тщательно спланируйте свой маршрут. С помощью современных GPS-планировщиков маршрутов легко рассчитать прямой маршрут с наименьшим количеством остановок и объездов.Также можно судить, на каком маршруте будет меньше всего загруженности. По возможности выбирайте шоссе, а не местные маршруты или городские улицы — постоянная скорость максимизирует топливную эффективность.
Когда едете по городу, постарайтесь припарковаться в центре города, а затем переходить от одной встречи к другой или пользоваться общественным транспортом. Рваная езда по городу с частыми остановками ужасно сказывается на расходе топлива. Это также экономит высокий уровень газа, который используется при парковке и выезде на стоянку.
Факторы, определяющие цену топлива
Государственное вмешательство
Правительства могут вмешиваться в рынок бензина (называемого в некоторых частях мира бензином) путем налогообложения, что может привести к повышению цен для потребителей внутри или за пределами государственной территории.Точно так же некоторые отрасли могут получать финансовую поддержку от государства для развития коммерческого предприятия (субсидия). , Как правило, субсидируемые продукты или услуги могут продаваться по более низким ценам.
Финансовые рынки
Мировая цена на нефть постоянно колеблется. Ключевыми котируемыми видами нефти являются марки Brent и West Texas Intermediate (WTI) в долларах США за баррель. Розничная цена на топливо тесно связана с колебаниями мировых цен на нефть.
Политика
Политические элементы, такие как структура, режим, персонал и события, могут влиять на стоимость топлива.Например, смена политического лидера, который не верит в изменение климата, на того, кто верит, может иметь меньше шансов субсидировать или снижать стоимость топлива для потребителей. Политические отношения между странами также являются фактором; нации могут вести войну за ресурсы или создавать союзы для торговли, и то и другое может повлиять на стоимость топлива.
Географический район
В некоторых географических регионах или странах мира много нефти, в то время как в других нет ни капли.Региональные потребители, находящиеся в непосредственной близости от крупных запасов нефти, с большей вероятностью будут иметь более низкие затраты на топливо из-за легкости доступа. В районах, не имеющих собственных запасов нефти и изолированных от остального мира (например, на островах в Тихом океане), топливо может оказаться относительно дорогим.
Стихийное бедствие или погода
Землетрясения, цунами, ураганы, крупные наводнения и другие подобные природные явления могут повлиять на производство, производство и логистику бензина, что, возможно, может повлиять на цены на топливо.Например, снежная буря может закрыть определенные дороги, не позволяя транспортировать ресурсы и увеличивая расходы на топливо в этих областях. Ураганы или землетрясения могут нанести ущерб нефтеперерабатывающим заводам, внезапно остановив производство, что также может в конечном итоге привести к увеличению стоимости топлива.
,Как вещества в следовых количествах могут вызывать серьезные последствия
Что говорит наука …
Небольшие количества очень активных веществ могут вызвать сильные эффекты.
CO 2 составляет 390 частей на миллион (0,039%) * атмосферы, как такое небольшое количество может иметь значение? Сказать, что CO 2 — это «только следовые газы» , все равно что сказать, что мышьяк «всего лишь» — это следовые примеси воды.Небольшие количества очень активных веществ могут вызвать сильные эффекты.
Некоторые примеры важных небольших сумм:
- Он не водил машину в нетрезвом виде, у него просто было следов алкоголя в крови; 800 частей на миллион (0,08%) — это предел во всех 50 штатах США, а в большинстве других стран пределы ниже).
- Ирландия не важна; это всего 660 промилле (0,066%) населения мира.
- Эта таблетка ибупрофена не принесет вам никакой пользы; это всего 3 промилле вашего веса (200 мг на 60 кг человека).
- Земля — это ничтожно , это всего лишь 3 ppm массы Солнечной системы.
- Ваши дети могут пить эту воду, она содержит только следовых количеств мышьяка (0,01 ppm — это предел ВОЗ и Агентства по охране окружающей среды США).
- Озон — это только a след. газ: 0,1 ppm — это предел воздействия, установленный Национальным институтом безопасности и гигиены труда США.Всемирная организация здравоохранения (ВОЗ) рекомендует предел озона 0,051 ppm.
- Несколько частей на миллион чернил могут сделать ведро с водой синим. Цвет обусловлен поглощением желтого / красного цветов солнечного света, оставляя синий цвет. В два раза больше чернил обеспечивает более насыщенный цвет, хотя общее количество по-прежнему составляет всего след относительно воды.
«Следы» СО 2
Хотя процентное соотношение — это удобный способ говорить о количестве газа в атмосфере, оно показывает только его количество по отношению ко всему остальному; процент не дает абсолютной суммы.
Например, у вас проблемы с дыханием на вершине Эвереста, хотя атмосфера все еще содержит 21% кислорода, как и на уровне моря. Процент не важен, вам нужно определенное количество молекул кислорода при каждом вдохе, независимо от того, насколько они разбавлены инертными газами. На высоте 8000 м вся атмосфера разбавлена.
Общее количество молекул CO 2 над нашими головами в атмосфере более важно, чем их процентное содержание в атмосфере.Если бы количество инертного газообразного азота (N 2 ) в атмосфере было сокращено вдвое, тогда процентное содержание CO 2 подскочило бы (примерно до 600 ppm; 0,06%) без изменения абсолютного количества. CO 2 и никакого существенного изменения в энергетическом балансе Земли. Добавление в атмосферу огромного количества молекул CO 2 , поглощающих энергию, не сильно меняет его процентное число, только потому, что оно добавляется к огромному инертному фону N 2 .
Мы знаем, что количество CO 2 в атмосфере увеличилось, потому что мы его измерили. Мы знаем, что климат стал теплее, исходя из текущих и исторических данных. Связь между увеличением количества парниковых газов и повышением температуры очевидна: так же, как чернила делают воду более окрашенной, CO 2 делает атмосферу более поглощающей. Дополнительный CO 2 в нашей атмосфере улавливает энергию, которая в противном случае могла бы уйти в космос. Измеренное глобальное потепление точно соответствует количеству энергии, удерживаемой парниковыми газами, добавляемыми в атмосферу.
Удвоение следа молекулы CO 2 с 280 ppm до 560 ppm по-прежнему остается следом , но, как и в случае мышьяка, разница между небольшим следом и большим следом фатальна.
* Чтобы преобразовать ppm в процент, разделите на 10,000.
Фотография: http://www.photographyblogger.net/15-cool-pictures-of-ink-in-water/
Основное опровержение, написанное Сарой
Обновление, июль 2015 г. :
Вот соответствующая лекция-видео от Denial101x — Осмысление климатологии Отказ
Последнее обновление: 8 июля 2015 г., автор: MichaelK.Смотреть архив
,
Leave A Comment