Иод
К содержанию
Ио́д (тривиальное (общеупотребительное) название — йод; от др.-греч. ἰώδης — «фиалковый (фиолетовый)») — элемент 17-й группы перйодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), пятого перйода, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество йод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I2).
История
йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент. Название и обозначение Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰώδης, ιώο-ειδης (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой.
Физические свойства
йод при обычных условиях — твердое чёрно-серое вещество с металлическим блеском и специфическим запахом. Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. йод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары йода кристаллизуются, минуя жидкое состояние.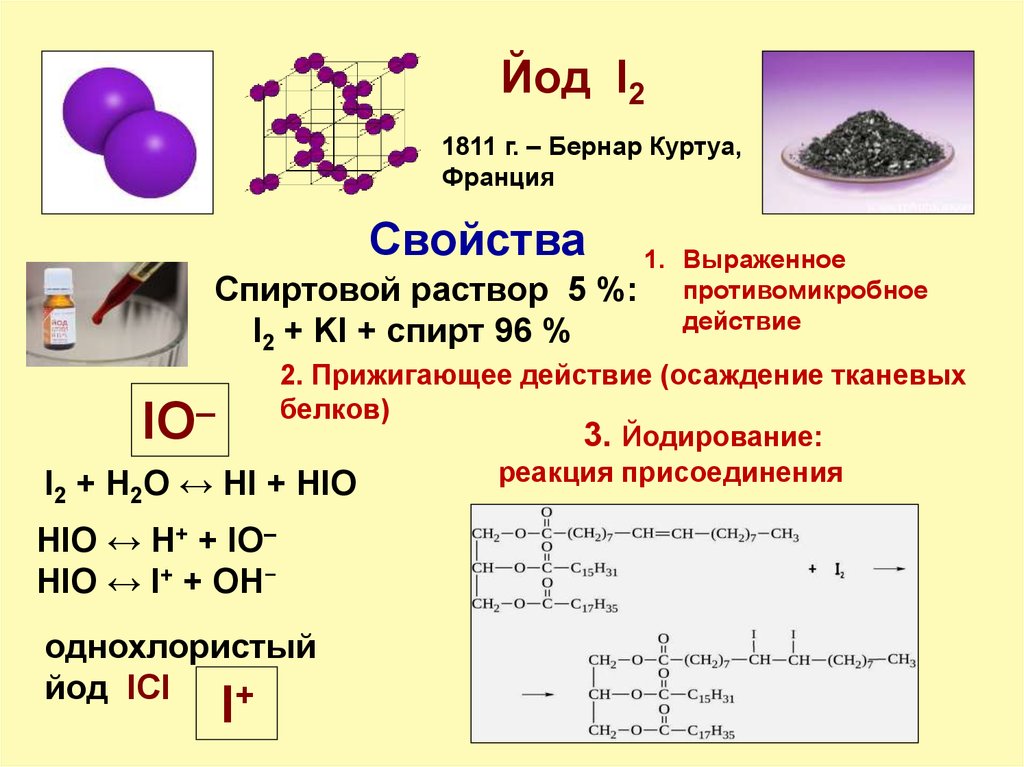
Химические свойства
йод относится к группе галогенов. Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4). Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром. 1. С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды: Hg + I2 = HgI2 2. С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород: I2 + H2 = 2HI 3. Атомарный йод — окислитель, менее сильный, чем хлор и бром. Сероводород H2S , Na2S2O3 и другие восстановители восстанавливают его до иона I
 99
99Источник: Википедия
Другие заметки по химии
Полезная информация?
Йод
| Иод | |
|---|---|
| Атомный номер | 53 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
126,90447 а. е. м. (г/моль) |
| Радиус атома | n/a пм |
|
Энергия ионизации (первый электрон) |
1 008,3 (10,45) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p5 |
| Химические свойства | |
| Ковалентный радиус | 133 пм |
| Радиус иона | (+7e) 50 (-1e) 220 пм |
|
Электроотрицательность (по Полингу) |
2,66 |
| Электродный потенциал | 0 |
| Степени окисления | 7, 5, 3, 1, -1 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,93 г/см³ |
| Молярная теплоёмкость | 54,44[1]Дж/(K·моль) |
| Теплопроводность | (0,45) Вт/(м·K) |
| Температура плавления | 386,7 K |
| Теплота плавления | 15,52 (I-I) кДж/моль |
| Температура кипения | 457,5 K |
| Теплота испарения | 41,95 (I-I) кДж/моль |
| Молярный объём | 25,7 см³/моль |
| Структура решётки | орторомбическая |
| Параметры решётки | 7,720 Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| I | 53 |
| 126,90447 | |
|
|
|
| Иод | |
Иод, йод (от др. -греч. ιώδης, iodes — «фиолетовый») — элемент главной подгруппы седьмой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество иод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I
-греч. ιώδης, iodes — «фиолетовый») — элемент главной подгруппы седьмой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество иод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I
В медицине и биологии данное вещество обычно называют йодом (например «раствор йода»), в таблице Менделеева и химической литературе употребляется название иод.
История
Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Символ элемента J был заменен на I относительно недавно, в 50-х годах XX века.
Нахождение в природе
В большом количестве находится в виде иодидов в морской воде.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, что намного удорожает производство йода из такого сырья.
Физические свойства
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Химические свойства
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды:
- Hg + I2 = HgI2
- С водородом иод реагирует только при нагревании и не полностью, образуя йодистый водород:
- I2 + H2 = 2HI
- Элементный иод — окислитель, менее сильный, чем хлор и бром. Сероводород H2S , Na2S2O3 и другие восстановители восстанавливают его до иона I—:
- I2 + H2S = S + 2HI
- При растворении в воде иод частично реагирует с ней:
- I2 + H2O = HI + HIO
Применение
Медицина
5%-ный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС («Синий йод» — Йодинол, Йокс, Бетадин) являются более мягкими антисептиками.
Продукты присоединения йода к крахмалу, другим ВМС («Синий йод» — Йодинол, Йокс, Бетадин) являются более мягкими антисептиками.
Широко используется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в основном мало обосновано, и нередко сопровождается различными рекламными заявлениями.
См. также
- Зелёнка
- Фукорцин
Производство аккумуляторов
Иод используется в качестве положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза и промышленность).
Радиоэлектронная промышленность
В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления иода
Мировое потребление иода в 2005 составило 25,5 тыс. тонн.
Важность для человека
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму) Так же при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, слабеет память и интеллект, нервозность и раздражительность. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Биологическая роль
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1% иода. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12-20 мг иода, суточная потребность в иоде составляет около 0,2 мг (200 мкг). Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
Токсичность
Иод — токсичное вещество. Смертельная доза 2-3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день воспаляются почки, появляется кровь в моче. Если не лечить через 2-3 дня могут отказать почки и наступить миокардит. Без лечения наступает летальный исход.
Если не лечить через 2-3 дня могут отказать почки и наступить миокардит. Без лечения наступает летальный исход.
- Тиреоидит
Йод | химический элемент | Британика
йод
Смотреть все СМИ
- Ключевые люди:
- Бернар Куртуа Жозеф-Луи Гей-Люссак сэр Хамфри Дэви Жан-Батист-Андре Дюма Виктор Мейер
- Похожие темы:
- химический элемент галоген дефицит йода йод-131
См. все связанные материалы →
йод (I) , химический элемент, член группы галогенов или группа 17 (группа VIIa) периодической таблицы.
2-8012 -18-7 или (Kr)5 s 2 4 d 10 5 p 5 6| атомный номер | 53 | |
|---|---|---|
| атомный вес | 126,90443 температура плавления3 | 113,5 °C (236 °F) |
| точка кипения | 184 ° С (363 °F) | |
| удельный вес | 4,93 при 20 °C (68 °F) | |
| степени окисления | −1, +1, +3, +5, +7 | |
| электронная конфигурация |
 Этот пар конденсировался в черное кристаллическое вещество, которое он назвал «веществом X». В 1813 г. английский химик сэр Хамфри Дэви, проезжавший через Париж по пути в Италию, признал вещество X элементом, аналогичным хлору; он предложил имя йод от греческого слова ioeides , «фиолетового цвета».
Этот пар конденсировался в черное кристаллическое вещество, которое он назвал «веществом X». В 1813 г. английский химик сэр Хамфри Дэви, проезжавший через Париж по пути в Италию, признал вещество X элементом, аналогичным хлору; он предложил имя йод от греческого слова ioeides , «фиолетового цвета».Наличие и распространение
Йод никогда не встречается в природе в несоединенном виде, и его концентрация недостаточна для образования самостоятельных минералов. Он присутствует в морской воде, но умеренно, в виде йодид-иона I — , в количестве примерно 50 мг на метрическую тонну (0,0016 унции на тонну) морской воды. Он также образуется в морских водорослях, устрицах и печени трески. Йодат натрия (NaIO 3 ) содержится в сырой чилийской селитре (нитрат натрия, NaNO 3 ). Организм человека содержит йод в составе соединения тироксина, который вырабатывается в щитовидной железе.
Единственным встречающимся в природе изотопом йода является стабильный йод-127. Исключительно полезным радиоактивным изотопом является йод-131, период полураспада которого составляет восемь дней. Он используется в медицине для наблюдения за работой щитовидной железы, для лечения зоба и рака щитовидной железы, для локализации опухолей головного мозга и печени. Он также используется в исследованиях для отслеживания хода соединений в метаболизме. Несколько соединений йода используются в качестве контрастных веществ в диагностической радиологии. В водном растворе даже незначительное количество йода в присутствии крахмала дает сине-черную окраску.
Исключительно полезным радиоактивным изотопом является йод-131, период полураспада которого составляет восемь дней. Он используется в медицине для наблюдения за работой щитовидной железы, для лечения зоба и рака щитовидной железы, для локализации опухолей головного мозга и печени. Он также используется в исследованиях для отслеживания хода соединений в метаболизме. Несколько соединений йода используются в качестве контрастных веществ в диагностической радиологии. В водном растворе даже незначительное количество йода в присутствии крахмала дает сине-черную окраску.
Britannica Quiz
Периодическая таблица элементов
Интригующий элемент Йод | Периодическая таблица
Йод — неметаллический твердый элемент периодической таблицы, относящийся к семейству галогенов. Этот элемент делает смелое заявление своим темным, блестящим, серо-сине-черным цветом. Это самый тяжелый из стабильных галогенов, очень летучий, легко образующий фиолетовый пар, который легко увидеть. Это важный минерал для здоровья человека, который добавляют в соль в большинстве регионов мира. Этот привлекательный элемент обязательно вызовет интерес.
Это важный минерал для здоровья человека, который добавляют в соль в большинстве регионов мира. Этот привлекательный элемент обязательно вызовет интерес.
Интересные факты о йоде
- Название йода происходит от греческого слова «ioeides», что означает «фиалка».
- Как и висмут, йод играет решающую роль в фармацевтической промышленности. Атомы галогена иногда включают в свинцовые препараты, которые являются отправной точкой для разработки лекарств. В результате получается липофильный препарат, то есть он плохо растворяется в воде и неполярен. Неполярные препараты способны легко транспортироваться через липидные мембраны и ткани. Добавление галогенов улучшает это свойство.
- В океане содержится больше йода, чем в земной коре. Морские водоросли, в частности, содержат высокие концентрации элемента.
- Единственным встречающимся в природе изотопом йода является йод-127. В отличие от чистого йода, он существует сам по себе в природе. Другие изотопы созданы человеком.

- Йод-131 является важным радиоактивным изотопом. Он имеет высокий период полураспада — восемь дней. Его применяют в медицине для регулирования работы щитовидной железы, лечения зоба, лечения рака щитовидной железы и обнаружения опухолей.
- Йод-129 переходит из радиоактивной формы в нерадиоактивную в течение миллионов лет. Другие радиоактивные изотопы переходят в нерадиоактивную форму всего за несколько секунд или дней.
- С 1994 по 2000 год мировое производство йода увеличилось с 13 726 тонн до 18 993 тонн.
Йод в периодической таблице
Йод с атомным символом I представляет собой неметалл, который находится в 17-й группе периодической таблицы, галогенах. Элемент йод расположен ниже брома, выше астата, справа от теллура и слева от ксенона. Его водная химия похожа на бром.
Йод имеет электроотрицательность 2,66. Атом йода имеет электронную конфигурацию [Kr] 4d 10 5s 2 5p 5 , или 1s 2 2s 2 2p 909071 2 3п 6 3д 10 4s 2 4p 6 4d 10 5s 2 5p 5
Йод по сравнению с другими галогенами
хлор, бром и астат. Все галогены очень электроотрицательны и очень реакционноспособны. Однако по сравнению с членами своего семейства йод относительно менее реактивен. Тем не менее, он обладает наибольшей восстановительной силой и легко получает электроны от других атомов. Из семейства галогенов йод наименее растворим в воде, его растворимость составляет 0,03 грамма на 100 граммов воды. Однако он противоположно реагирует на водные растворы йодида, где он хорошо растворим. В частности, этот элемент хорошо реагирует с растворами, содержащими йодид калия (KI + I 2 → КИ 3 ). KI уменьшает давление паров и разбавляет йод, чтобы сделать его более безопасным.
Все галогены очень электроотрицательны и очень реакционноспособны. Однако по сравнению с членами своего семейства йод относительно менее реактивен. Тем не менее, он обладает наибольшей восстановительной силой и легко получает электроны от других атомов. Из семейства галогенов йод наименее растворим в воде, его растворимость составляет 0,03 грамма на 100 граммов воды. Однако он противоположно реагирует на водные растворы йодида, где он хорошо растворим. В частности, этот элемент хорошо реагирует с растворами, содержащими йодид калия (KI + I 2 → КИ 3 ). KI уменьшает давление паров и разбавляет йод, чтобы сделать его более безопасным.
Йод в природе
Из семейства галогенов йод является наименее распространенным. В природе чистый йод никогда не бывает один. Вместо этого он существует в виде соединений. Кроме земной коры этот элемент есть в морской воде. Кроме того, тироксин, секрет щитовидной железы человека, содержит йод.
Йодные возгоны: правда или вымысел?
Йод в нескольких различных состояниях имеет фиолетовый цвет Что такое сублимация ? Обычно, когда твердое тело испаряется, оно сначала должно расплавиться и превратиться в жидкость. Когда твердое вещество возгоняется, оно сразу превращается в пар, полностью минуя жидкую фазу. Это эндотермический переход, который происходит только тогда, когда температура и давление ниже тройного нуля. Для йода тройная точка составляет 113,5°C при 12,1 кПа. Многие считают, что в этих условиях твердый йод возгоняется в газ. Однако это неправильно .
Когда твердое вещество возгоняется, оно сразу превращается в пар, полностью минуя жидкую фазу. Это эндотермический переход, который происходит только тогда, когда температура и давление ниже тройного нуля. Для йода тройная точка составляет 113,5°C при 12,1 кПа. Многие считают, что в этих условиях твердый йод возгоняется в газ. Однако это неправильно .
Существует большое заблуждение о том, что йод не может быть жидким, идея, что даже некоторые учебники грешат обучением. При нормальном давлении и диапазоне температур примерно от 113,6°C до 184,4°C (от 236,48°F до 363,9°C).2˚F), йод существует в виде жидкости. Этому заблуждению способствуют два фактора: во-первых, йод очень летуч. Это позволяет легко объяснить, как твердый йод может просто испаряться. Во-вторых, жидкое состояние йода трудно увидеть; Интенсивный фиолетовый цвет облака пара полностью перекрывает жидкость.
Как показано на диаграмме, — это точка, в которой одновременно существуют жидкое и парообразное состояния. Тщательно контролируя температуру, чтобы она была чуть выше точки плавления, можно наглядно увидеть процесс плавления йода.
Тщательно контролируя температуру, чтобы она была чуть выше точки плавления, можно наглядно увидеть процесс плавления йода.
Вот короткое видео, демонстрирующее жидкое состояние йода:
Применение йода в современном мире
Небольшие количества минералов йода необходимы для производства жизненно важных гормонов щитовидной железы. Эти гормоны играют важную роль в организме человека и участвуют в контроле частоты сердечных сокращений, пищеварения, сокращения мышц и клеточного метаболизма. Таким образом, это важный элемент в индустрии разработки лекарств. Более того, в поваренную соль иногда добавляют йод. Это не только обеспечивает включение йода в рацион людей, но и помогает предотвратить зоб. Это заболевание, при котором щитовидная железа увеличивается и вырабатывает либо дефицит, либо избыток тиреоидных гормонов.
Элементарный йод может служить антисептиком. Как уже говорилось, йод и йодид калия (узнайте, что еще реагирует с йодидом калия здесь) образуют трийодид KI 3 . Растворы, содержащие йодид калия в спирте, убивают микробы, находящиеся на внешних ранах. Такие соединения, как йодоформ (CHI 3 ), также являются антисептиками.
Растворы, содержащие йодид калия в спирте, убивают микробы, находящиеся на внешних ранах. Такие соединения, как йодоформ (CHI 3 ), также являются антисептиками.
Многие могут быть знакомы с раствором Люголя. Этот водный раствор почти гарантированно есть в любой биологической лаборатории. Этот фиолетовый раствор помогает ученым обнаружить присутствие крахмала в веществе, так как раствор становится темно-синим.
История йода
Бернар Куртуа случайно открыл йод в 1811 году, извлекая хлорид калия из золы морских водорослей. После удаления соединения он добавил серную кислоту, чтобы лучше переработать золу морских водорослей. Однако он добавил слишком много, создав облако пара фиолетового цвета. Этот газ сконденсировался в кристаллы, которые химик сэр Хамфри Дэви позже идентифицировал как твердый йод в 1813 году. Реагирует с водой с образованием гипоиодита (OI – ). Ион гипойодита нестабилен, и его трудно получить, так как он встречается только в растворе. Элемент также реагирует с горячей азотной кислотой и горячей щелочью с образованием йодной кислоты и йодата соответственно. Йодная кислота действует как вяжущее средство и кристаллизуется при охлаждении. Йодат — это то, что добавляют в поваренную соль. Каким бы реакционноспособным ни был йод, на него не влияют кислород или азот в воздухе.
Элемент также реагирует с горячей азотной кислотой и горячей щелочью с образованием йодной кислоты и йодата соответственно. Йодная кислота действует как вяжущее средство и кристаллизуется при охлаждении. Йодат — это то, что добавляют в поваренную соль. Каким бы реакционноспособным ни был йод, на него не влияют кислород или азот в воздухе.
Кроме того, йод легко возгоняется, то есть его твердое состояние испаряется при нагревании. При испарении образуется красивое темно-фиолетовое облако. Хотя это облако заманчиво смотреть, крайне важно избегать вдыхания, так как оно вызовет раздражение.
Реакция йодных часов
Реакция йодных часов весьма эффектна. В этом явлении два бесцветных раствора объединяются в другой прозрачный раствор. Затем почти спонтанно он становится темно-синим. Это очень загадочно. В этой реакции сильный окислитель взаимодействует с сильным восстановителем. Примером может служить йодат калия (KIO 3 ), сильный окислитель, реагирующий с бисульфитом натрия (NaHSO 3 ), сильным восстановителем. Это образует йод.
Это образует йод.
Если говорить более подробно, начнем с раствора йодата калия и крахмала. Анионы бисульфита натрия восстанавливают йодат калия в этом растворе. При этом образуются анионы йода I – , которые реагируют с йодатом калия с образованием раствора йода. Затем этот новый раствор реагирует с йодом и образует анионы трийодида I 3 – . Затем анионы бисульфита будут действовать на анионы трийодида, что превращает их обратно в анионы йодида. Когда этот процесс завершается, оставшиеся анионы трийодида вступают в реакцию с молекулами крахмала, что мгновенно приводит к очаровательному темно-синему цвету.
Откуда это имя? В зависимости от концентрации исходных материалов, прозрачный раствор станет синим через некоторое время, отсюда и название «часовая» реакция. Чем выше концентрация, тем быстрее будет скорость реакции. Во-вторых, скорость реакции увеличивается с повышением температуры. Наконец, добавление катализатора также ускорит реакцию.
Соединения йода
Трийодид азота = БЕДСТВИЕ
Когда йод реагирует с аммиаком, образуется твердое вещество, называемое трийодид азота. Этот черный порошок представляет собой очень непостоянное неорганическое соединение. Когда кристаллы трийодида азота влажные, они стабильны. В сухом виде кристаллы опасны — они чувствительны к прикосновению и становятся взрывоопасными. В то время как маленькому взрыву не хватает силы, чтобы нанести большой ущерб, большой взрыв, безусловно, нанесет. Держитесь подальше от сухого трийодида азота!
Красочные йодиды
Йодиды, в которых йод находится в отрицательной степени окисления, часто имеют белый цвет, но могут иметь различные цвета. Иодид серебра имеет более тусклый светло-желтый цвет, а йодид свинца выглядит как красивые пластинки желтого золота, как вы можете видеть в эксперименте с золотым дождем. Иодид ртути (II) и йодид олова (IV) имеют красивый оранжево-красный цвет.
Иодид ртути (II) и йодид олова (IV) имеют красивый оранжево-красный цвет.
Синтез йода Элемент
Способ получения йода заключается в объединении иона йода с более сильным окислителем. Например, бром является более сильным окислителем, чем йод. Объединение двух ионов йода с водным раствором Br2 дает I 2 и два иона брома ( 2 I – + Br 2 → I 2 + 2 Br – 0 ) простой способ приготовления A йода, стоит смешать раствор калия йода с соляной кислотой и перекисью водорода. Йод выпадает в осадок и легко удаляется фильтрованием.
Степени окисления йода
Элементарный йод нейтрален и имеет степень окисления 0. Однако, когда он присутствует в соединении, йод может иметь разные степени окисления и считается сильнокислотным оксидом. В его соединениях наиболее распространена степень окисления -1, которая наблюдается у йодида I 9.0071 – . Это также видно в состояниях +7, +5, +3 и +1.
Оксианионы
Оксианион представляет собой многоатомный ион, содержащий кислород. Четыре наиболее распространенных оксианиона йода — это гипойодит, IO — ; йодит, IO 2 ; йодат, IO 3 – ; и периодат, IO 4 – . Соответственно, они имеют степени окисления +1, +3, +5 и +7.
Гипойодиты являются сопряженным основанием йодноватистой кислоты, так как они образуются в результате депротонирования йодноватистой кислоты. Этот одновалентный анион часто используется в качестве реагента для реакций прямого окисления.
Йодиды очень нестабильны и никогда не выделяются. В основном они используются в качестве промежуточного продукта при синтезе йодата из йодида.
Йодаты представляют собой сопряженные основания йодной кислоты. Их использует реакция йодных часов.
Периодаты являются сопряженным основанием йодной кислоты, так как являются продуктами депротонирования йодной кислоты. Они обычно используются в реакциях окисления, которые расщепляют связи между вицинальными атомами углерода и незамещенными гидроксильными или аминогруппами.


Leave A Comment