Все страницы — Юнионпедия
Все страницы — ЮнионпедияНовый! Скачать Юнионпедия на вашем Android™ устройстве!
Свободно
Более быстрый доступ, чем браузер!
Все страницы · Предыдущая (Фёдоровка (Ставровский сельский совет)) · Следующий (Фториды азота)
Из:
| Фтор-18 | Фтор-19 | Фторсурьмяная кислота |
| Фторсульфит калия | Фторсульфонат свинца(II) | Фторсульфонат рубидия |
| Фторсульфоновая кислота | Фторсилан | Фторсодержащие органические соединения |
| Фторурацил | Фторуглероды | Фторуксусная кислота |
| Фтортрихлоргерман | Фтортрихлорметан | Фторфеназин |
| Фторфеназин-деканоат | Фторфеназина деканоат | Фторхинолон |
| Фторхинолоны | Фторафур | Фторацизин |
| Фторгерман | Фтордихлорсилан | |
| Фтордезоксиглюкоза | Фториcтый уран | Фтористый селен |
| Фтористый хромил | Фтористый алюминий | Фтористый бром |
| Фтористый бензоил | Фтористый винилиден | Фтористый водород |
| Фтористый гольмий | Фтористый калий | Фтористый литий |
| Фтористый протактиний | Фтористоводородная кислота | Фторирование |
| Фторирование воды | Фторид | Фторид сурьмы(III) |
| Фторид сурьмы(V) | Фторид стронция | Фторид самария(II) |
| Фторид самария(III) | Фторид свинца(II) | Фторид свинца(IV) |
| Фторид скандия | Фторид скандия(III) | Фторид серы (VI) |
| Фторид серы(VI) | Фторид серебра | Фторид серебра (I) |
| Фторид серебра(I) | Фторид серебра(II) | Фторид селена(IV) |
| Фторид селена(VI) | Фторид урана | Фторид урана (IV) |
| Фторид урана (VI) | Фторид урана(III) | Фторид урана(IV) |
| Фторид урана(V) | Фторид урана(VI) | Фторид урана-трикалия |
| Фторид урана-дикалия | Фторид урана-калия | Фторид триурана-калия |
| Фторид триазота | Фторид таллия(I) | |
| Фторид тантала(V) | Фторид титана(II) | Фторид титана(III) |
| Фторид титана(IV) | Фторид тория-дикалия | Фторид тория-калия |
| Фторид тория-пентакалия | Фторид тетрабутиламмония | Фторид технеция(VI) |
| Фторид теллура(IV) | Фторид фосфора | Фторид фосфора (III) |
| Фторид фосфора(III) | Фторид фосфора(V) | Фторид циркония |
| Фторид циркония(II) | Фторид циркония(III) | Фторид циркония(IV) |
| Фторид циркония-трикалия | Фторид цинка | Фторид цинка-калия |
| Фторид церия(III) | Фторид цезия | Фторид хрома(II) |
| Фторид хрома(III) | Фторид хрома(IV) | Фторид хрома(V) |
| Фторид хлора | Фторид хлора (I) | Фторид хлора (III) |
| Фторид хлора (V) | Фторид хлора(I) | Фторид хлора(III) |
| Фторид хлора(V) | Фторид рутения(III) | Фторид рутения(V) |
| Фторид рутения(VI) | Фторид рубидия | Фторид ртути(I) |
| Фторид ртути(II) | Фторид радия | Фторид родия(III) |
| Фторид родия(IV) | Фторид родия(V) | Фторид родия(VI) |
| Фторид рения(IV) | Фторид рения(V) | Фторид рения(VI) |
| Фторид рения(VII) | Фторид азота (III) | Фторид азота(III) |
| Фторид актиния | Фторид актиния (III) | Фторид актиния(III) |
| Фторид алюминия | Фторид аммония | Фторид брома |
| Фторид брома (I) | Фторид брома (III) | Фторид брома (V) |
| Фторид брома(I) | Фторид брома(III) | Фторид брома(V) |
| Фторид бария | Фторид бора | Фторид бериллия |
| Фторид ванадия(II) | Фторид ванадия(III) | Фторид ванадия(IV) |
| Фторид ванадия(V) | Фторид висмута(III) | Фторид висмута(V) |
| Фторид водорода | Фторид вольфрама(IV) | Фторид вольфрама(V) |
| Фторид вольфрама(VI) | Фторид гафния(IV) | Фторид гадолиния(III) |
| Фторид галлия | Фторид галлия(III) | Фторид гольмия |
| Фторид гольмия(III) | Фторид германия(II) | Фторид германия(IV) |
| Фторид германия-цезия | Фторид гексаурана-калия | Фторид гексатория-калия |
| Фторид диспрозия(III) | Фторид диурана-калия | Фторид дитория-калия |
| Фторид диртути(2+) | Фторид диплутония(IV)-калия | Фторид дейтерия |
| Фторид железа(II) | Фторид железа(III) | |
| Фторид золота | Фторид золота(I,III) | Фторид золота(III) |
| Фторид золота(V) | Фторид иттрия | Фторид иттрия(III) |
| Фторид иттербия(II) | Фторид иттербия(III) | Фторид иридия(III) |
| Фторид иридия(IV) | Фторид иридия(V) | Фторид иридия(VI) |
| Фторид индия(III) | Фторид иода (I) | Фторид иода (V) |
| Фторид иода (VII) | Фторид иода(I) | Фторид иода(V) |
| Фторид иода(VII) | Фторид йода | Фторид ксенона (II) |
| Фторид ксенона (IV) | Фторид ксенона (VI) | Фторид ксенона(II) |
| Фторид ксенона(IV) | Фторид ксенона(VI) | Фторид криптона (II) |
| Фторид криптона (IV) | Фторид криптона(II) | Фторид криптона(IV) |
| Фторид кремния(II) | Фторид кадмия | Фторид кадмия(II) |
| Фторид кальция | Фторид калия | Фторид кислорода |
| Фторид кислорода (II) | Фторид кислорода(II) | Фторид кобальта |
| Фторид кобальта(II) | Фторид кобальта(III) | Фторид лютеция |
| Фторид лютеция(III) | Фторид лантана(III) | Фторид лития |
| Фторид мышьяка(III) | Фторид мышьяка(V) | Фторид марганца(II) |
| Фторид марганца(III) | Фторид марганца(IV) | Фторид магния |
| Фторид магния-калия | Фторид молибдена(III) | Фторид молибдена(V) |
| Фторид молибдена(VI) | Фторид меди (II) | Фторид меди(I) |
| Фторид меди(II) | Фторид натрия | Фторид нитрила |
| Фторид нитрозила | Фторид нитроила | Фторид никеля |
| Фторид никеля(II) | Фторид никеля-калия | Фторид ниобия(III) |
| Фторид ниобия(IV) | Фторид неодима | |
| Фторид неодима(III) | Фторид нептуния(III) | Фторид нептуния(IV) |
| Фторид нептуния(IV)-калия | Фторид нептуния(V) | Фторид нептуния(VI) |
| Фторид нептунила | Фторид осмия(IV) | Фторид осмия(V) |
| Фторид осмия(VI) | Фторид осмия(VII) | Фторид осмия(VIII) |
| Фторид олова | Фторид олова(II) | Фторид олова(IV) |
| Фторид празеодима(III) | Фторид празеодима(IV) | Фторид протактиния |
| Фторид протактиния(IV) | Фторид протактиния(V) | Фторид палладия(II) |
| Фторид палладия(II,IV) | Фторид палладия(III) | Фторид палладия(IV) |
| Фторид плутония(III) | Фторид плутония(IV) | Фторид плутония(IV)-рубидия |
| Фторид плутония(IV)-калия | Фторид плутония(IV)-лития | Фторид плутония(IV)-натрия |
| Фторид плутония(VI) | Фторид плутонила | Фторид платины |
| Фторид платины(II) | Фторид платины(IV) | Фторид платины(V) |
| Фторид платины(VI) | Фторид европия(II) | Фторид европия(III) |
| Фторид-три(ортофосфат) кальция | Фторид-трихлорид кремния | Фторид-трибромид кремния |
| Фторид-триизоцианат кремния | Фторид-трииодид кремния | Фторид-триоксид брома |
| Фторид-триоксид иода | Фторид-фосфат кальция | Фторид-хлорид сульфурила |
| Фторид-хлорид свинца(II) | Фторид-хлорид пиросульфурила | Фторид-хлорид-бромид-иодид кремния |
| Фторид-хлорид-дибромид кремния | Фторид-бромид сульфурила | Фторид-гептаоксид трипротактиния |
| Фторид-диоксид брома | Фторид-диоксид иода | Фторид-диоксид протактиния |
| Фторид-оксид актиния | Фторид-оксид актиния(III) | Фторидхлорид олова(II) |
| Фториды | Фториды (значения) | Фториды серебра |
100 ballov.
 kz образовательный портал для подготовки к ЕНТ и КТА
kz образовательный портал для подготовки к ЕНТ и КТА
Хотите купить новую квартиру и уже нашли несколько подходящих под ваш бюджет вариантов? Не забудьте добавить к стоимости жилья ряд дополнительных расходов, которые вам придется оплатить при покупке недвижимости в Казахстане. Квартиры в Астане и квартиры в Алматы можно посмотреть на korter.kz, где с помощью фильтров можно максимально точно подобрать желаемые варианты.
Что оплачивает покупатель?Договор купли-продажи недвижимости включает в себя ряд обязательных платежей, независимо от того, где было куплено жилье — на вторичном рынке или в новостройке. Определенную часть расходов должен погасить покупатель. Сумма платежей рассчитывается в зависимости от особенностей сделки и может достигать значительных размеров, поэтому важно перед покупкой подсчитать все расходы.
Дополнительные платежи покупателя при оформлении права собственности:
- услуги нотариуса;
- оплата госпошлины за регистрацию.

Нотариальное оформление договора купли-продажи не является обязательной процедурой, но специалисты рынка недвижимости советуют не пренебрегать услугами нотариуса. Нотариус проверяет стороны сделки, контролирует процесс заключения договора и выступает гарантом безопасности.
Нотариальные услуги имеют фиксированную стоимость. Средняя стоимость нотариального оформления объекта недвижимости в 2023 году составляет 12 МРП, т.е. около 37000 тг. Следует обращать внимание на то, что сумма платы зависит от того, кто является участниками сделки. Если сделка заключается с близким родственником – сумма уменьшается, если с юридическим лицом – увеличивается.
Как правило, участники сделки делят расходы на оформление поровну. Однако, лучше заранее согласовать этот момент с продавцом недвижимости.
Прямые сделки также предусматривают дополнительные расходы, например, оформление задатка.
Регистрация прав на имуществоПри покупке недвижимости покупатель обязуется оплатить государственную пошлину за регистрацию своих прав на имущество в ЦОН.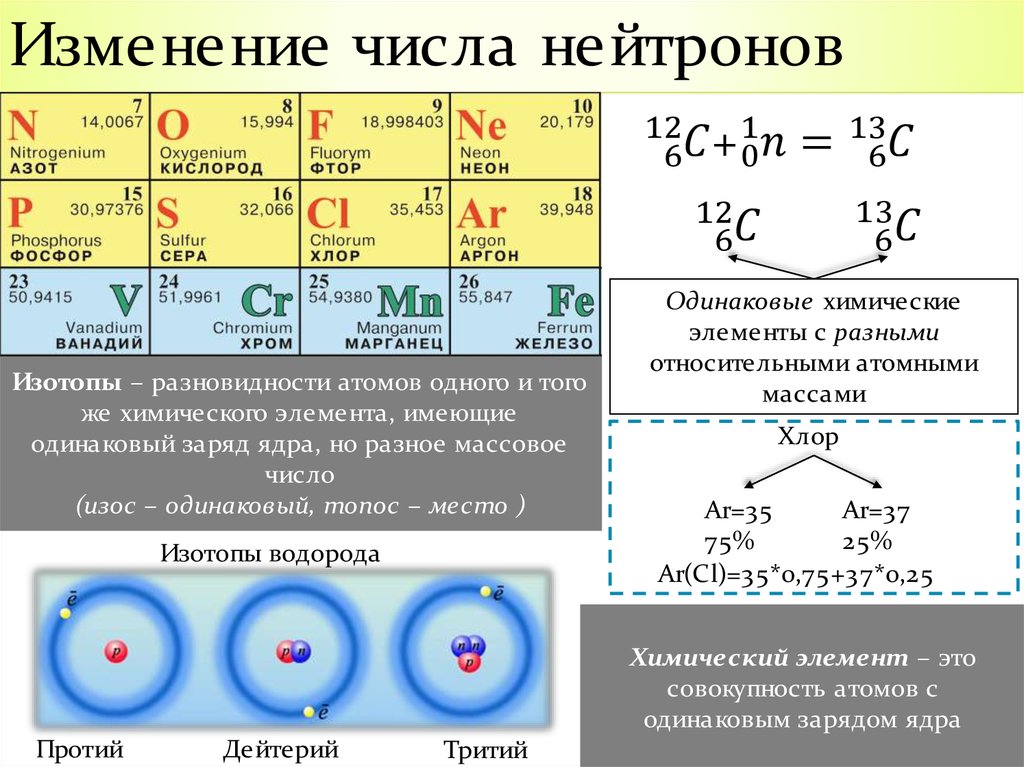 Процедура оформления занимает до 3 рабочих дней. Стоимость данной услуги — 1 073,7 тг.
Процедура оформления занимает до 3 рабочих дней. Стоимость данной услуги — 1 073,7 тг.
Покупатель может заказать услугу ускоренной регистрации права собственности. Процесс внесения информации в реестр займет 1 день. Стоимость ускоренной регистрации — 5000 тг.
Дополнительные расходыЗачастую дополнительных трат требуют услуги опытных специалистов: риелторов, оценщиков, юристов. Однако в зависимости от типа сделки могут появиться и другие дополнительные издержки:
- Ипотечный налог. Если вы покупаете квартиру в ипотеку, вы должны совершить платеж, размер которого зависит от условий кредитования, налоговых вычетов и т.д.
- Банковские услуги. Плата за совершение операций, использование банковской ячейки, аренда сейфа, страховка и т.д.
- Увеличение фактической площади. Это относится к покупке квартиры в новостройке. Когда конечная площадь жилья превышает предусмотренную проектом.
- Оплата коммунальных. Управляющая компания жилого комплекса может взимать оплату своих услуги наперед.

Следовательно, в понятие конечной стоимости жилья входит не только цена квадратных метров, но ряд дополнительных расходов, сумма которых может составлять около 10% стоимости самого объекта.
Фтор | Использование, свойства и факты
фтор
Посмотреть все СМИ
- Ключевые люди:
- Анри Муассан Эдмон Фреми
- Похожие темы:
- химический элемент галоген флюороз
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
фтор (F) , наиболее реакционноспособный химический элемент и самый легкий из галогенных элементов, или группа 17 (группа VIIa) периодической таблицы. Его химическую активность можно объяснить чрезвычайной способностью притягивать электроны (это самый электроотрицательный элемент) и малым размером его атомов.

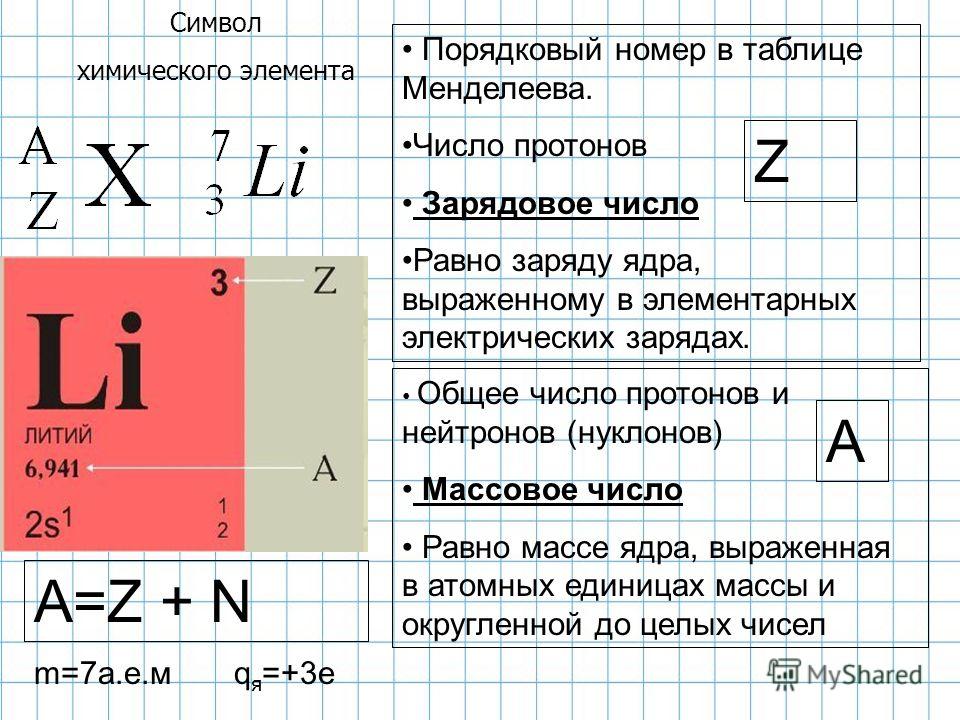

 F)
F)
 Минерал впоследствии оказался источником элемента, который получил соответствующее название фтор. Бесцветные прозрачные кристаллы плавикового шпата при освещении приобретают голубоватый оттенок, и это свойство, соответственно, известно как флуоресценция.
Минерал впоследствии оказался источником элемента, который получил соответствующее название фтор. Бесцветные прозрачные кристаллы плавикового шпата при освещении приобретают голубоватый оттенок, и это свойство, соответственно, известно как флуоресценция.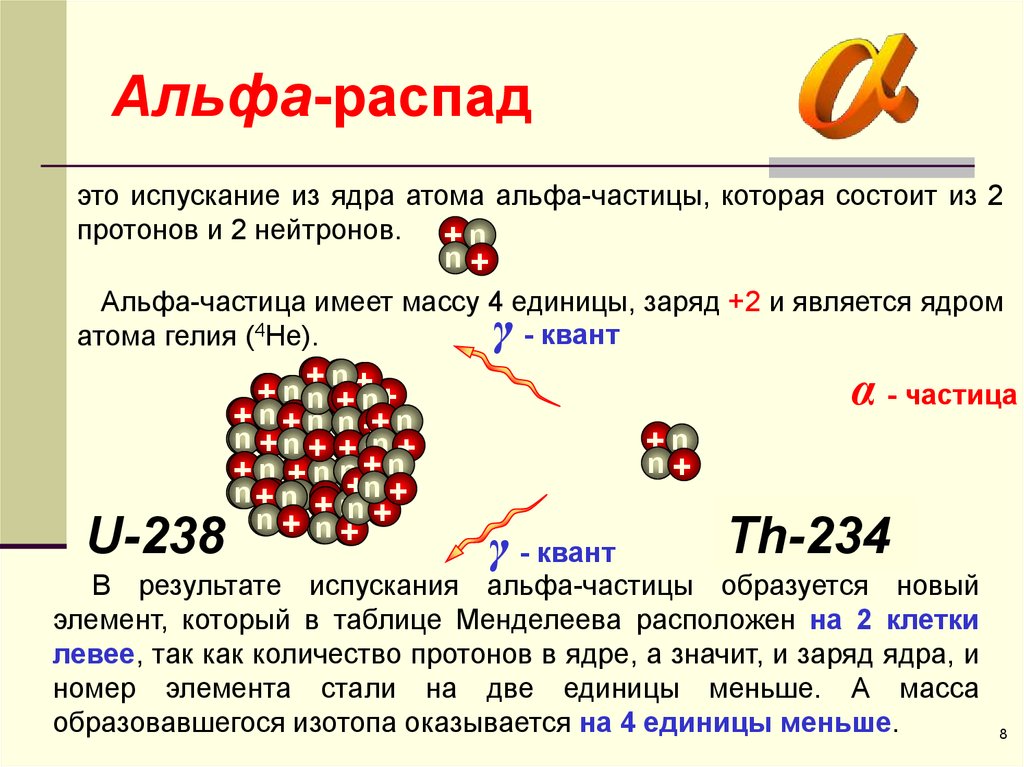
 Фтор — самый сильный окислитель. Следовательно, никакое другое вещество не способно окислить фторид-анион до свободного элемента, и по этой причине этот элемент не встречается в природе в свободном состоянии. Более 150 лет ни один химический метод не позволял получить этот элемент, успех достигался только с помощью электролитических методов. Однако в 1986 Американский химик Карл О. Крист сообщил о первом химическом получении фтора, где «химическое получение» означает метод, в котором не используются такие методы, как электролиз, фотолиз и разряд, или не используется сам фтор в синтезе любого из исходных материалов. Он использовал K 2 MnF 6 и пентафторид сурьмы (SbF 5 ), оба из которых могут быть легко получены из растворов HF.
Фтор — самый сильный окислитель. Следовательно, никакое другое вещество не способно окислить фторид-анион до свободного элемента, и по этой причине этот элемент не встречается в природе в свободном состоянии. Более 150 лет ни один химический метод не позволял получить этот элемент, успех достигался только с помощью электролитических методов. Однако в 1986 Американский химик Карл О. Крист сообщил о первом химическом получении фтора, где «химическое получение» означает метод, в котором не используются такие методы, как электролиз, фотолиз и разряд, или не используется сам фтор в синтезе любого из исходных материалов. Он использовал K 2 MnF 6 и пентафторид сурьмы (SbF 5 ), оба из которых могут быть легко получены из растворов HF.
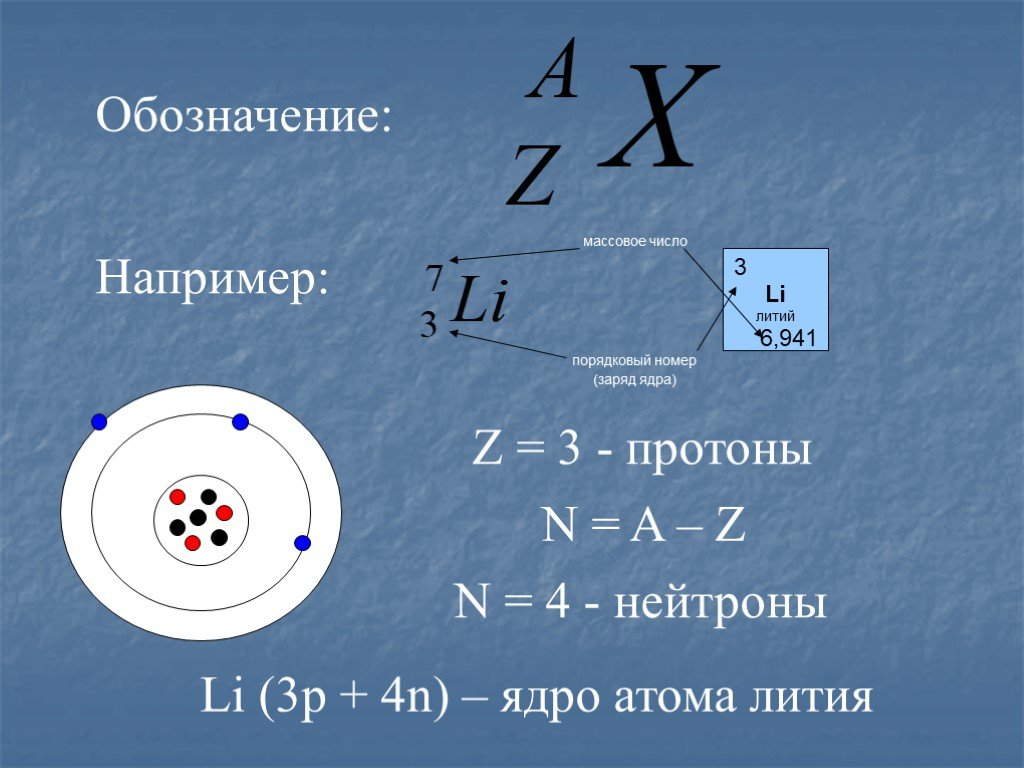
 «Протоны с самой высокой энергией внутри этих изотопов могут туннелировать через кулоновский барьер и ускользать».
«Протоны с самой высокой энергией внутри этих изотопов могут туннелировать через кулоновский барьер и ускользать».
Leave A Comment