Что такое Алкены (олефины, этиленовые углеводороды)
108056
Простейшим алкеном является этилен
Алкены (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие 1 двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации и имеют валентный угол 120°.
Простейшим алкеном является этилен (C2H4).
По номенклатуре IUPAC:
- названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»;
- положение двойной связи указывается арабской цифрой.

Углеводородные радикалы, образованные от алкенов имеют суффикс «-енил».
Тривиальные названия: CH2=CH- «винил», CH2=CH-CH2— «аллил».
Алкены, число атомов углерода в которых больше 2х, (т. е. кроме этилена) имеют изомеры.
Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная.
Например, единственным изомером пропена является циклопропан (C3H6) по межклассовой изомерии.
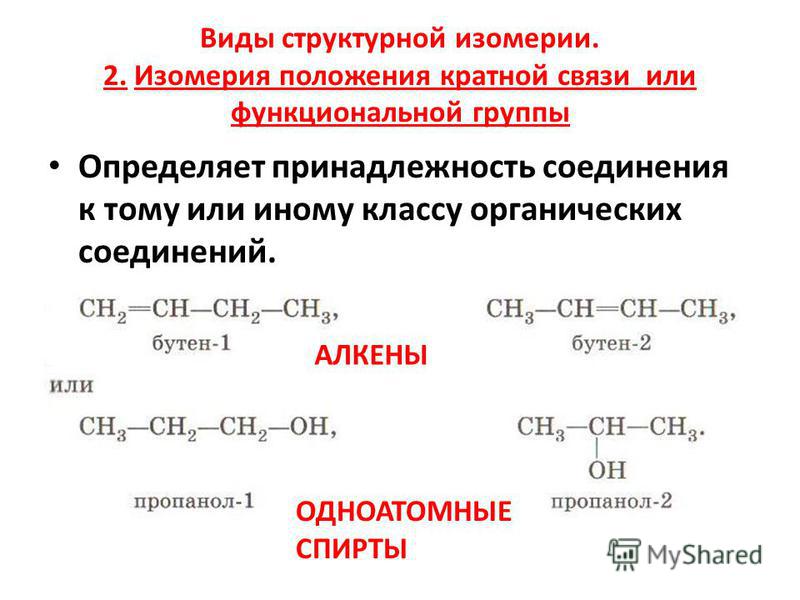
Начиная с бутена, существуют изомеры по положению двойной связи (бутен-1 и бутен-2), по углеродному скелету (изобутилен или метилпропен) и геометрические изомеры (цис-бутен-2 и транс-бутен-2).
Алкены химически активны.
Их химические свойства во многом определяются наличием двойной связи.
Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения.
Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
Особенностью алкенов являются также реакции циклоприсоединения и метатезиса.
Алкены легко вступают в реакции окисления, гидрируются сильными восстановителями или водородом под действием катализаторов до алканов, а также способны к аллильному радикальному замещению.
Алкены являются важнейшим химическим сырьем.
Промышленное использование этилена
Этилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана, уксусного альдегида и уксусной кислоты.
Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла.
Мировое производство этилена составляет порядка 100 млн т/год (по данным на 2005 г: 107 млн т).
Промышленное использование пропилена
Пропилен в промышленности применяется в основном для синтеза полипропилена (62% всего выпускаемого объема).
Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид.
В настоящее время мировые мощности по выпуску пропилена составляют около 70 млн т/год.
По прогнозам специалистов, потребность в пропилене в ближайшем будущем будет существенно превышать объемы его производства, причем, ожидается, что к 2010 г. объем его мирового выпуска достигнет 90 млн т/год.
Промышленное использование прочих алкенов
Бутилены применяют для производства бутадиена, изопрена, полиизобутилена, бутилкаучука, метилэтилкетона и пр.
Изобутилен — сырье для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ.
Его сополимеры с бутенами применяют как присадки к маслам и герметики.
Высшие алкены С10-С18 применяют при синтезе ПАВ, а также для получения высших спиртов.
#Алкены #олефины #этиленовые углеводороды
Последние новости
Межклассовая изомерия – примеры
4.3
Средняя оценка: 4.3
Всего получено оценок: 274.
4.3
Средняя оценка: 4.3
Всего получено оценок: 274.
Один из видов структурной изомерии является межклассовая изомерия. В этом случае образуются изомеры между двумя классами органических веществ.
Изомерия
Вещества, сходные по содержанию и количеству атомов, но разные по структурному или пространственному строению, называются изомерами. Выделяют
- структурная;
- пространственная.
Структурная изомерия может происходить:
- по углеродному скелету
- по положению групп, связей или заместителей.

В некоторых случаях при перемещении функциональной группы образуется вещество другого класса. В этом случае говорят о межклассовой изомерии, которая также является структурной изомерией. Например, при перемещении гидроксильной группы из этанола (CH3-CH2-OH) образуется диметиловый эфир (CH
Пространственная изомерия показывает, как располагаются атомы углеродной цепочки в пространстве, и бывает двух видов:
- оптическая или зеркальная;
- геометрическая или цис-транс-изомерия.
При оптической изомерии образуются молекулы, будто являющиеся зеркальным отражением друг друга. Цис-транс-изомеры различаются положением заместителей по отношению к плоскости, делящей молекулу пополам. Если по одну сторону находятся одинаковые радикалы, такие изомеры называются цис-изомерами. Если одинаковые радикалы лежат по разным сторонам плоскости, они называются транс-изомерами.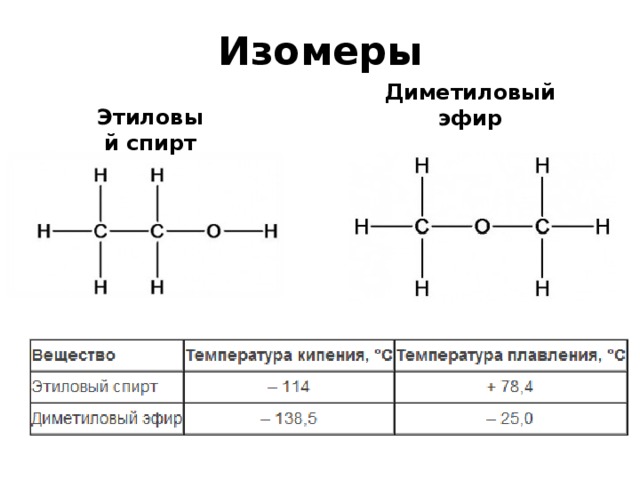
Чем длиннее цепь, тем больше изомеров может образовывать вещество.
Межклассовые изомеры
При перемещении в углеродном скелете функциональной группы образуется новое вещество, которое относится к другому классу органических соединений. При этом у изомеров абсолютно одинаковые общие формулы.
В таблице наглядно показано, между какими классами веществ образуется изомерия, а также приведены примеры межклассовой изомерии.
Классы, образующие изомерию | Общая формула | Примеры |
Алкены и циклоалканы | CnH2n | Бутен-1 (CH2=CH-CH2-CH3) и циклобутан (C4H8) |
Алкадиены и алкины | CnH2n-2 | Бутадиен-1,3 (CH2=CH-CH=CH2) и бутин-1 (CH≡C-CH2-CH3) |
Одноатомные спирты и простые эфиры | CnH2n+2O | Бутанол-1 (CH3-CH2-CH2-CH2OH) и метилпропиловый эфир (CH3-O-CH |
Альдегиды и кетоны | CnH2nO | Бутаналь (CH3-CH2-CH2-COH) и бутанон-2 (CH2-CO-CH2-CH2-CH3) |
Карбоновые кислоты и сложные эфиры | CnH2nO2 | Бутановая кислота (CH3-CH2-CH2-COOH) и пропилформиат (COOH-CH2-CH2-CH3) |
Нитросоединения и аминокислоты | CnH2n+1NO2 | Нитробутан (CH3-CH2 |
Среди всех классов органических веществ алканы не образуют межклассовую изомерию.
Что мы узнали?
Некоторые классы органических веществ могут образовывать межклассовую изомерию при перемещении функциональной группы. Межклассовая изомерия является разновидностью структурной изомерии. Классы, образующие межклассовые изомеры: алкены с циклоалканами, алкадиены с алкинами, одноатомные спирты с простыми эфирами, альдегиды с кетонами, карбоновые кислоты со сложными эфирами, нитросоединения с аминокислотами.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 274.
А какая ваша оценка?
Что из следующего является изомером этанола?A. МетанолБ. Диметиловый эфир С. Диэтиловый эфир Д.
 Этиленгликоль
ЭтиленгликольПодсказка: Чтобы ответить на этот вопрос, мы должны знать, что изомеры — это молекулы, которые имеют одинаковую молекулярную формулу, но имеют различное расположение атомов в пространстве. Итак, мы должны найти тот вариант, который имеет ту же молекулярную формулу, что и этанол.
Пошаговый ответ:
Мы должны знать, что этанол — это простой спирт с химической формулой ${{C}_{2}}{{H}_{6}}O$ или ${{C}_{ 2}}{{H}_{5}}OH$ (этильная группа, связанная с гидроксильной группой) и часто наблюдается как ${{C}_{2}}{{H}_{6}}O $. Этанол — летучая легковоспламеняющаяся бесцветная жидкость со слабым характерным запахом. Это психоактивное вещество и основной активный ингредиент алкогольных напитков.
Выше представлена структура этанола.
Итак, согласно определению изомера, это молекулы, которые имеют одинаковую молекулярную формулу, но имеют различное расположение атомов в пространстве. Вокруг всех одинарных углерод-углеродных связей происходит совершенно свободное вращение. Если бы перед вами была модель молекулы, вам пришлось бы разобрать ее на части и перестроить, если вы хотите получить изомер этой молекулы. Если вы можете создать совершенно другую молекулу, просто вращая одинарные связи, это не будет другой — это все та же молекула.
Вокруг всех одинарных углерод-углеродных связей происходит совершенно свободное вращение. Если бы перед вами была модель молекулы, вам пришлось бы разобрать ее на части и перестроить, если вы хотите получить изомер этой молекулы. Если вы можете создать совершенно другую молекулу, просто вращая одинарные связи, это не будет другой — это все та же молекула.
Итак, мы должны найти тот вариант, который имеет ту же структуру, что и этанол.
Выбрав первый вариант, мы получим метанол. Метанол имеет химическую формулу $C{{H}_{3}}OH$. А его структурная формула будет следующей:
Приведенная выше структура не похожа на изомер этанола.
Теперь берем второй вариант диметилового эфира. Тогда мы должны знать, что это органическое соединение с формулой $C{{H}_{3}}OC{{H}_{3}}$, упрощенной до ${{C}_{2}}{ {H}_{6}}O$. То же самое и с этанолом.
Этот диметил выглядит как структурный изомер этанола. Теперь мы должны быстро взглянуть на структуры двух других опций.
Третий вариант – диэтиловый эфир. Он имеет формулу ${{\left({{C}_{2}}{{H}_{5}} \right)}_{2}}O$.
Этот вариант не похож ни на какой изомер этанола.
Вариант D — этиленгликоль. Это органическое соединение с формулой ${{\left(C{{H}_{2}}OH \right)}_{2}}$.
Этот вариант тоже не похож на изомерную структуру этанола.
Из приведенного выше обсуждения и наблюдения за каждым вариантом мы пришли к выводу, что ответом на этот вопрос является вариант B. Диметиловый эфир и этанол являются функциональными изомерами. В функциональных изомерах ключевые группы атомов расположены определенным образом. Лучший пример — этот вопрос. В этом вопросе как диметиловый эфир соединения, так и этанол имеют молекулярную формулу ${{C}_{2}}{{H}_{6}}O$.
Примечание: мы должны знать разницу между этанолом и диметиловым эфиром. Ключевое различие между этанолом и диметиловым эфиром заключается в том, что этанол представляет собой бесцветную жидкость при комнатной температуре, которая имеет высокую летучесть, тогда как диметиловый эфир представляет собой бесцветный газ при комнатной температуре.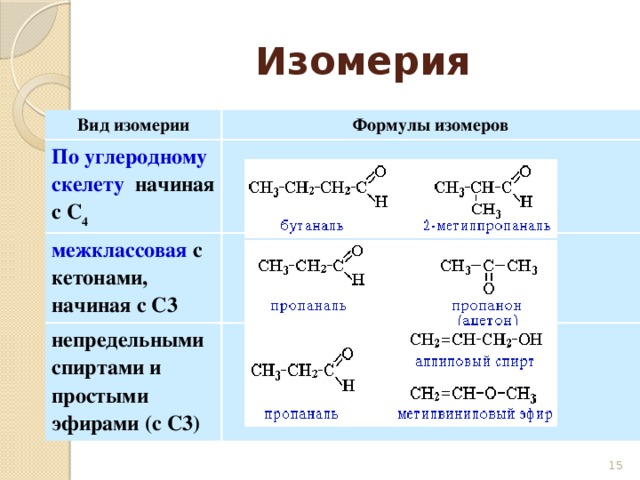 Следует отметить, что этанол легко воспламеняется; таким образом, он также используется в качестве топлива. Кроме того, это очень летучее соединение. Следует отметить, что диметиловый эфир является неполярным соединением. Это означает, что диметиловый эфир не имеет полярности. Это связано с его симметричной молекулярной структурой. Поэтому он является хорошим растворителем для неполярных соединений. Однако он химически неактивен по сравнению с другими органическими соединениями.
Следует отметить, что этанол легко воспламеняется; таким образом, он также используется в качестве топлива. Кроме того, это очень летучее соединение. Следует отметить, что диметиловый эфир является неполярным соединением. Это означает, что диметиловый эфир не имеет полярности. Это связано с его симметричной молекулярной структурой. Поэтому он является хорошим растворителем для неполярных соединений. Однако он химически неактивен по сравнению с другими органическими соединениями.
Конституциональные изомеры — Репетитор по органической химии
Конституциональные изомеры — это молекулы, которые имеют одинаковую молекулярную формулу, но имеют различное соединение атомов в молекулах. Будет лучше, если я проиллюстрирую идею конституциональных изомеров примером. Предположим, у нас есть молекула с молекулярной формулой C 2 H 6 O. Построение структур Льюиса для этой молекулы показывает две возможности для соединений атомов:
Две молекулы выше, этанол (этиловый спирт) и диметил эфир, являются примером конституциональных изомеров. Они оба имеют точно такие же атомы в одинаковых соотношениях в молекуле. Однако связи между этими атомами или, другими словами, строение молекулы другое. В отношении конституциональных изомеров важно понимать, что это разные молекулы и, следовательно, они обладают разными свойствами. Вы будете встречать примеры конституциональных изомеров много раз в своем курсе, поэтому очень важно уметь их замечать.
Они оба имеют точно такие же атомы в одинаковых соотношениях в молекуле. Однако связи между этими атомами или, другими словами, строение молекулы другое. В отношении конституциональных изомеров важно понимать, что это разные молекулы и, следовательно, они обладают разными свойствами. Вы будете встречать примеры конституциональных изомеров много раз в своем курсе, поэтому очень важно уметь их замечать.
Индекс дефицита водорода (HDI)
или
Степень ненасыщенности (DU)
Оба этих термина относятся к одному и тому же. Точный термин, который будет использовать ваш преподаватель, будет зависеть от его личных предпочтений или выбора книги. Хотя HDI обычно не вводят, пока мы не изучим спектроскопию, я считаю, что это очень мощный инструмент, который нужно изучить в начале семестра. И, честно говоря, я немного озадачен, почему здесь этому практически не учат. В любом случае, вернемся к HDI и почему это так круто.
ИЧР является полезным инструментом для оценки структурных мотивов в молекуле. По сути, каждая степень ненасыщенности или единица HDI соответствует либо π-связи, либо циклическому мотиву в молекуле. Напомним, что двойные и тройные связи имеют π-связи. Более «правильным» определением HDI является количество эквивалентов H 2 , необходимое для насыщения молекулы, чтобы иметь только структуру одинарных связей с открытой цепью. Что, если вы спросите меня, звучит уродливо, так что я никогда не буду повторять это снова. 🤣
По сути, каждая степень ненасыщенности или единица HDI соответствует либо π-связи, либо циклическому мотиву в молекуле. Напомним, что двойные и тройные связи имеют π-связи. Более «правильным» определением HDI является количество эквивалентов H 2 , необходимое для насыщения молекулы, чтобы иметь только структуру одинарных связей с открытой цепью. Что, если вы спросите меня, звучит уродливо, так что я никогда не буду повторять это снова. 🤣
Давайте рассмотрим несколько примеров и посмотрим, как молекулярные особенности соотносятся с единицами HDI:
Сочетание циклов и двойных или тройных связей в вашей молекуле даст вам значение ИЧР. Но как это полезно для конституциональных изомеров? Что ж, поскольку конституциональные изомеры имеют одинаковую молекулярную формулу, они также будут иметь одинаковые индексы HDI! Таким образом, если вы знаете ИРЧП для молекулы, вы можете автоматически нарисовать различные конституциональные изомеры с правильными структурными мотивами. Итак, есть ли способ рассчитать ИРЧП только по молекулярной формуле? Там точно есть!
Итак, есть ли способ рассчитать ИРЧП только по молекулярной формуле? Там точно есть!
Расчет ИЧР по молекулярной формуле
Для расчета ИЧР мы используем очень простую формулу. Возможно, вы захотите запомнить его, так как он очень полезен, особенно если вы пытаетесь нарисовать конституциональные изомеры для множества различных молекул.
Формула, которую я здесь показываю, имеет несколько различных форм. Так что, если ваш инструктор или учебник используют другой, не волнуйтесь, все они дают одинаковый результат. Мне лично нравится этот, так что я буду придерживаться его. Давайте рассмотрим несколько примеров, используя эту формулу:
Как видите, чем выше ИЧР, тем больше возможностей вы можете получить для структурных мотивов в вашей молекуле. Так что, хотя это мощный инструмент, это не формула «мгновенного ответа», особенно когда речь идет о более сложных молекулах.
Как подходить к проблемам, используя формулу HDI
Итак, когда вам нужно придумать возможные конституциональные изомеры для молекулы, первое, на что вы хотите обратить внимание, это молекулярная формула.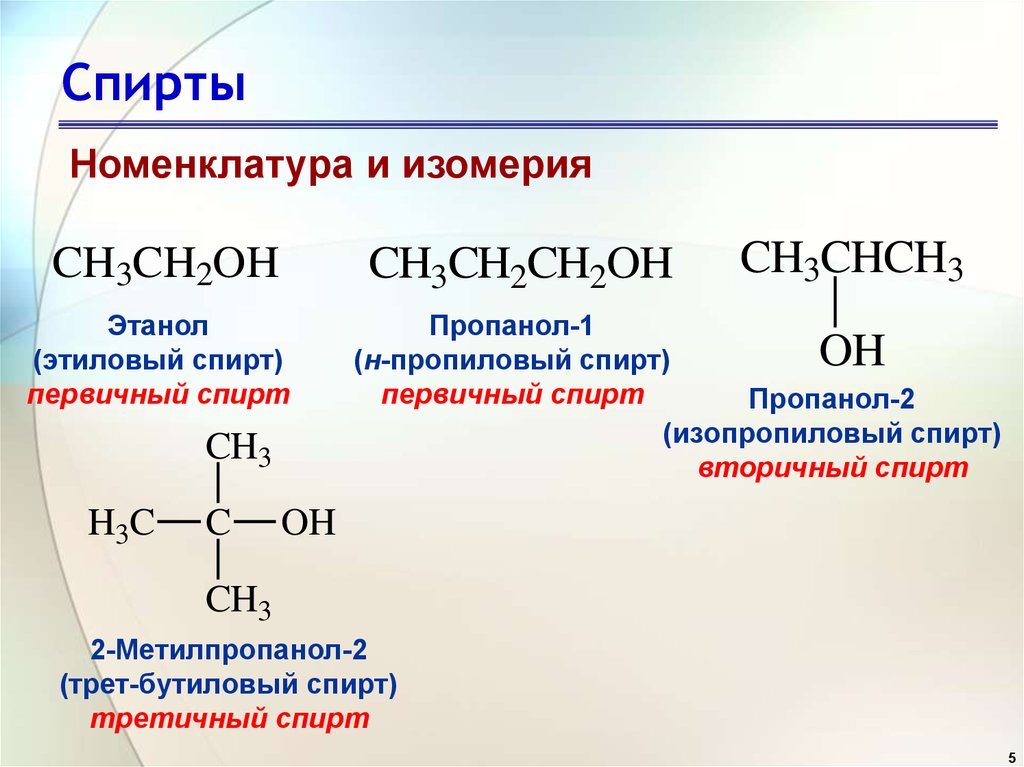 Оттуда мы получим HDI и получим некоторое представление о том, какие структурные особенности искать в нашей молекуле.
Оттуда мы получим HDI и получим некоторое представление о том, какие структурные особенности искать в нашей молекуле.
Давайте придумаем все возможные конституциональные изомеры для молекулы с молекулярной формулой C 3 H 6 O.
Шаг 1: Рассчитаем ИРЧП по молекулярной формуле
Основываясь на нашем ИРЧП, мы знаем, что это молекула должна содержать двойную связь или цикл. Но не эти две вместе, поскольку ИЧР = 1.
Шаг 2: Нарисуйте возможные конституциональные изомеры, начиная с линейных (самых простых) молекул
Во-первых, я всегда использую возможные линейные структуры для моих конституциональных изомеров.
Чтобы было проще, предлагаю вам придумать ядро конструкции, а затем добавить необходимое количество водородов. Будьте осторожны, не добавляйте много и соблюдайте закономерности связывания, которые мы обычно наблюдаем в органических молекулах!
После того, как мы закончили с линейными молекулами, пришло время посмотреть, сможем ли мы сделать ответвления в сторону от атомов ядра, которые у нас есть:
И, наконец, мы можем посмотреть, есть ли какие-либо циклические структуры, которые мы можем поместить вместе:
Используя этот простой подход, мы можем быстро и эффективно пройтись по возможностям с очень низкой вероятностью пропуска каких-либо структур.



Leave A Comment