Реакции жиров
Cвойства и химические реакции
Смешанные по составу жиры, входящие в состав живых организмов, называют липидами. Липиды плохо растворимы в воде, но хорошо растворяются в большинстве органических растворителей – эфире, хлороформе, ацетоне. Фосфолипиды плохо растворимы в ацетоне. Липиды обладают способностью взаимного растворения, и при выделении жиров из растительного или животного сырья получают продукт, называемый «сырым жиром». Жиры плохо проводят тепло и электричество. Жировые вещества обладают низким поверхностным натяжением.
В жирах, маслах и восках растительного и животного происхождения содержатся жирные кислоты — алифатические одноосновные карбоновые кислоты с открытой цепью. Жирные кислоты подвержены реакции этерификации (с образованием сложных эфиров) и характерным кислотным реакциям. Ненасыщенные жирные кислоты вступают в реакции присоединения — например, реакция гидрирования при производстве маргарина.
При комнатной температуре жирные кислоты подвергаются реакциям автоокисления и прогоркания. Прогоркание сопровождается появлением неприятного запаха и вкуса вследствие образования низкомолекулярных карбонильных соединений. Продуктами реакций прогоркания и автоокисления также служат углеводороды, кетоны, альдегиды и небольшое количество эпоксидов и спиртов [9].
Реакцию автоокисления жирных кислот ускоряют тяжелые металлы, а замедляют хелатирующие агенты — такие, как лимонная или аскорбиновая кислоты.
Свойства жирных кислот вступать в реакции с металлами играют важную роль в инженерной практике. Перед очисткой сточные воды, загрязненные жировыми веществами, необходимо подвергать нейтрализации. Очистные сооружения из черной стали в условиях агрессивной среды быстро приходят в негодность, поэтому для очистки жирных стоков используют такие материалы как нержавеющая сталь или стеклопластик.
Биохимические процессы трансформации
Сброс многокомпонентных сточных вод, содержащих жиры, представляет серьезную экологическую проблему для многих водоемов. Загрязнение водоемов зачастую носит систематический характер и служит причиной возникновения опасных природных ситуаций.
Процессы естественного самоочищения водоемов от жировых веществ способны протекать только в теплое время года. Окисление жиров начинается с середины или конца весны (в зависимости от местности, где расположен водоем). Водные бактерии запускают процессы естественного окисления жиров в условиях повышенной температуры воды, поступления солнечной радиации и свободного поступления кислорода через водо-воздушную поверхность, освобожденную от ледового покрова. Однако именно в теплый период года к ранее накопленным загрязнителям поступают дополнительные стоки талых и ливневых вод, содержащие новые порции жировых веществ.
Окисление органических веществ в аэробных условиях происходит с выделением углекислого газа и воды. В анаэробных условиях почти вся органика, и жиры в том числе, разрушается с образованием углекислоты, воды, водорода, жирных кислот и других веществ. Следующая фаза биотрансформации — распад жирных кислот до метана и углекислоты. Впоследствии из водорода и углекислоты также образуется метан.
Жиры являются природными биополимерами, поэтому их распад начинается с гидролиза. Микроорганизмы, имеющие ферменты-гидролазы, проводят первичное расщепление жиров. Продукты гидролиза перерабатываются гидролитиками и другими кислотогенными микроорганизмами с образованием водорода и жирных кислот — уксусной, пропионовой, масляной.
Гидролиз и образование кислот объединяют в кислотогенную фазу. При накоплении жирных кислот в растворе понижается pH среды, а по достижении pH меньше 6 наблюдается подавление конечной метаногенной фазы.
Липиды – онлайн-тренажер для подготовки к ЕНТ, итоговой аттестации и ВОУД
Липиды – так называют жиры и жироподобные вещества (липоиды). Различают растительные жиры, имеющие при комнатной температуре жидкую консистенцию, и животные – твердую.
Различают растительные жиры, имеющие при комнатной температуре жидкую консистенцию, и животные – твердую.
Липиды входят в состав всех плазматических мембран. Они выполняют в клетке энергетическую роль, активно участвуют в процессах метаболизма и размножения клетки.
Липиды – сложные эфиры жирных кислот и глицерина. Состоят из атомов водорода, кислорода и углерода. Они не растворимы в воде, но хорошо растворимы в органических растворителях (эфире, хлороформе, бензине). Содержатся во всех клетках животных и растений.
Содержание липидов в клетках составляет 5-15% сухой массы, но в жировой ткани может иногда достигать 90%.
Виды липидов: жиры, воски, фосфолипиды, стеролы (стероиды).
Функции липидов:• запасающая – жиры накапливаются в клетках позвоночных животных;
• энергетическая – треть энергии, потребляемой клетками позвоночных животных в состоянии покоя, образуется в результате окисления жиров, которые используются и как источник воды;
• защитная – подкожный жировой слой защищает организм от механических повреждений;
• теплоизоляционная – подкожный жир помогает сохранить тепло;
• электроизоляционная – миелин, выделяемый клетками Шванна, изолирует некоторые нейроны, что во много раз ускоряет передачу нервных импульсов;
• питательная
• смазывающая – воски покрывают кожу, шерсть, перья животных и предохраняют их от воды; восковым налетом покрыты листья многих растений; воск используется пчелами в строительстве сот;
• гормональная – гормон надпочечников кортизон и половые гормоны имеют липидную природу, их молекулы не содержат жирных кислот.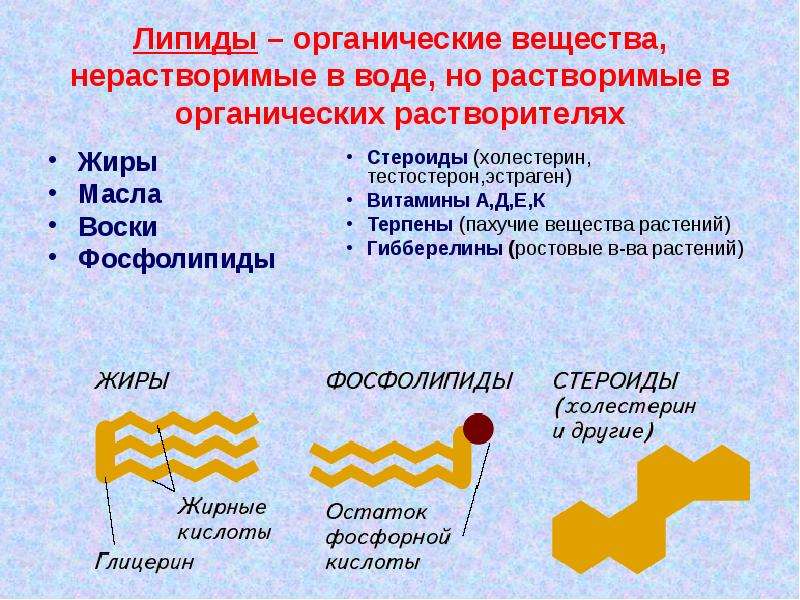
- Каталитическая функция связана с жирорастворимыми витаминами.
- Источник метаболической воды – одним из продуктов окисления жиров является вода. Эта метаболическая вода очень важна для обитателей пустынь.
- Запасы жира повышают плавучесть водных животных.
Биология клетки/Часть 1. Клетка как она есть/2/13 — Викиучебник
Липиды — группа органических соединений, хорошо растворимых в неполярных органических растворителях (бензол, ацетон, хлороформ) и практически нерастворимых в воде.
C точки зрения современной органической химии это определение является неточным. Во-первых, такое определение вместо четкой характеристики класса химических соединений говорит лишь о физических свойствах. Во-вторых, в настоящее время известно достаточное количество соединений, нерастворимых в неполярных растворителях или же, наоборот, хорошо растворимых в воде, которые, тем не менее, относят к липидам. В современной органической химии определение термина «липиды» основано на биосинтетическом родстве данных соединений — к липидам относят жирные кислоты и их производные [1].
Жиры, или триглицериды — природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот.
Наряду с углеводами и белками, жиры — один из главных компонентов клеток животных, растений и микроорганизмов.
Жидкие жиры растительного происхождения обычно называют маслами [3].
Состав жиров отвечает общей формуле:
CH2-O-C(O)-R¹ | CH-О-C(O)-R2 | CH2-O-C(O)-R³,
где R¹, R2 и R³ — радикалы (иногда — различных) жирных кислот.
Как правило, в состав масел входят преимущественно ненасыщенные жирные кислоты (имеющие одну или несколько двойных связей между атомами углерода), а в состав твердых жиров — насыщенные. В составе природных жиров и масел преобладают жирные кислоты с 16-18 атомами углерода в цепи.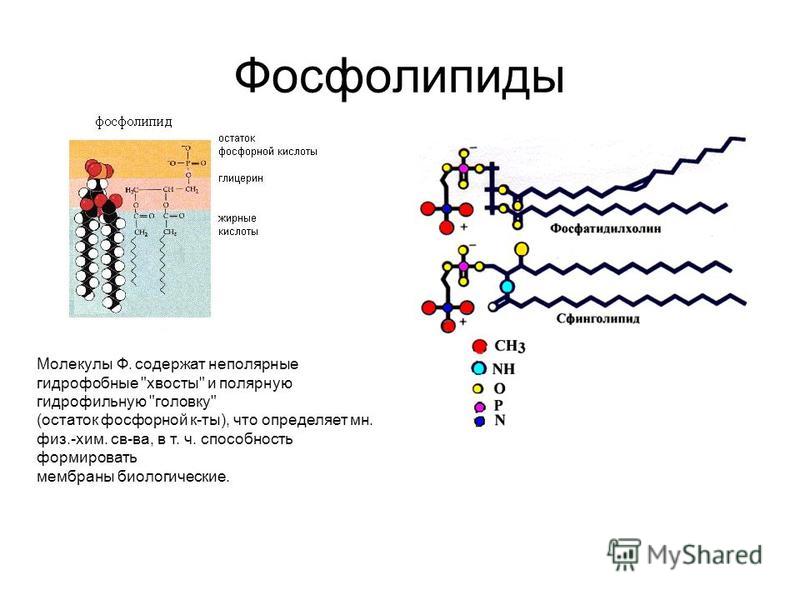
Функции жиров
Главная функция жиров в животном (и отчасти — растительном) мире — запасающая. При полном окислении 1 г жира (до углекислого газа и воды) выделяется около 9 ккал энергии. (1 ккал = 1000 кал; калория (кал, cal) — внесистемная единица количества работы и энергии, равная количеству теплоты, необходимому для нагревания 1 мл воды на 1 °C при стандартном атмосферном давлении 101,325 кПа; 1 ккал = 4,19 кДж). При окислении (в организме) 1 г белков или углеводов выделяется только около 4 ккал/г.
- Вопрос 1
- Почему практически все животные используют жир в качестве основного запасного вещества практически во всех клетках и тканях, кроме яйцеклеток, а растения, как правило, запасают крахмал и только в семенах многие из них используют жиры? Подумайте, с чем связаны исключения; это поможет вам ответить на основной вопрос.
При окислении жира выделяется так называемая «метаболическая» вода, так что запасы жира отчасти служат и запасами воды.
У самых разных водных организмов — от одноклеточных диатомовых водорослей до гигантских акул — жир служит «поплавком», уменьшая среднюю плотность тела. Плотность животных жиров составляет около 0,91-0,95 г/см³. Плотность костной ткани позвоночных близка к 1,7-1.8 г/см³, а средняя плотность большинства других тканей близка к 1 г/см³. Понятно, что жира нужно довольно много, чтобы «уравновесить» тяжелый скелет.
- Вопрос 2
- Плотность воздуха примерно в 600 раз меньше плотности воды, и некоторые организмы используют воздушные пузыри как поплавки (например, у многих рыб есть плавательный пузырь). В чём состоят возможные преимущества жирового «поплавка» по сравнению с воздушным?
- Теплоизоляция (у теплокровных)
Часто жир служит теплоизоляцией для теплокровных животных. Особенно это важно для таких животных, как киты или тюлени, много времени проводящих в холодной воде. У них подкожный слой жира особенно толстый.
- Вопрос 3
- Почему тюлени имеют более толстый слой подкожного жира, чем, например, волк или белый медведь? Ведь они бывают активны при температуре ниже −30оС, а температура воды, в которой живут тюлени, всегда выше 0оС.

- Вопрос 4
- У некоторых животных жир запасается не под кожей, а в определенных органах (на определенных участках тела). Что это за животные? Как эта особенность связана с их образом жизни?
- Механическая защита
Толстый подкожный слой жира — довольно надежная защита внутренних органов от механических повреждений при ударах.
Фосфатидилхолин― один из самых распространенных фосфолипидов клеточных мембранФосфолипиды похожи на нейтральные жиры тем, что в их состав тоже входят остатки глицерина и жирных кислот. Но фосфолипиды отличаются от нейтральных жиров тем, что в состав фосфолипидов входят только два остатка жирной кислоты. Третья эфирная связь образуется между глицерином и остатком фосфорной кислоты (фосфатом), к которому присоединена группа атомов, разная у различных фосфолипидов (радикал), содержащая обычно положительно заряженный атом азота (см.рис.).
Эта часть молекулы фосфолипидов («голова») гидрофильна, а состоящие из жирных кислот «хвосты» гидрофобны. Таким образом, фосфолипиды — типичные амфифильные вещества (см. Взаимодействие фосфолипидов с водой).
Таким образом, фосфолипиды — типичные амфифильные вещества (см. Взаимодействие фосфолипидов с водой).
Другие группы липидов[править]
Насыщенные одноосновные жирные кислоты
В природных жирах и восках наиболее часто встречаются насыщенные одноосновные кислоты нормального строения, имеющие общую формулу СпН2п02.
Физические свойства насыщенных жирных кислот зависят от их молекулярной массы. Так, температура кипения жирных кислот возрастает с увеличением молекулярной массы.
При кипении под атмосферным давлением насыщенные жирные кислоты начиная с каприновой разлагаются.
При атмосферном давлении высокомолекулярные жирные кислоты перегоняются только с перегретым водяным паром, а низкомолекулярные (до каприновой включительно) перегоняются без разложения с водяным паром при температуре 100 °С. По этому признаку насыщенные кислоты подразделяются на летучие и нелетучие.
Температура плавления жирных кислот возрастает с повышением молекулярной массы. Температура плавления бинарных смесей жирных кислот обычно бывает более низкой по сравнению с температурой плавления одного или даже обоих компонентов.
Жирные кислоты образуют эвтектические смеси, т. е. сплавы, имеющие постоянную температуру плавления, компоненты которых не могут быть разделены даже повторной кристаллизацией. Примером может служить сплав из 47,5%-ной стеариновой кислоты и 52,5%-ной пальмитиновой кислоты. Он дает эвтектическую смесь с постоянной температурой плавления 54,8 °С (ниже температуры плавления каждого из составляющих компонентов).
Температура застывания насыщенных жирных кислот несколько ниже температуры их плавления вследствие переохлаждения или образования полиморфных форм.
Растворимость в воде с возрастанием молекулярной массы уменьшается, а начиная с дауриновой кислоты, все более высокомолекулярные кислоты в воде практически нерастворимы. По растворимости в воде кислоты делят на растворимые и нерастворимые, однако такое деление весьма условно.
Насыщенные жирные кислоты растворимы почти во всех органических растворителях — диэтиловом эфире, петролейном эфире, ацетоне, хлороформе и др. В холодном спирте высокомолекулярные насыщенные кислоты растворяются плохо, но при нагревании их растворимость значительно увеличивается. Растворимость насыщенных кислот в органических растворителях падает с увеличением молекулярной массы и возрастает с повышением температуры. Плотность насыщенных жирных кислот уменьшается с увеличением молекулярной массы. У первой кислоты этого гомологического ряда с четным числом углеродных атомов — уксусной С2Н402 — плотность при 20 °С равна 1049 кг/м3, а все последующие кислоты легче воды. Такая зависимость объясняется различным процентным содержанием кислорода в молекуле кислоты. У низкомолекулярных кислот процентное содержание кислорода в молекуле выше, чем у высокомолекулярных.
Насыщенные кислоты довольно устойчивы к действию различных реагентов — окислителей, галогенов и др.
Показатель преломления насыщенных жирных кислот возрастает с увеличением молекулярной массы.
В строении насыщенных жирных кислот имеется следующая закономерность: в подавляющем большинстве все кислоты, входящие в состав природных жиров, содержат четное число углеродных атомов.
Рассмотрим характеристики отдельных представителей насыщенных (предельных) жирных кислот.
Масляная кислота [СН3(СН2)2СООН] — бесцветная жидкость с кислым, неприятным запахом, входит в состав масла из коровьего молока (2-4%) в виде разнокислотных триглицеридов. В прогорклом масле некоторое количество ее находится в свободном состоянии.
Капроновая кислота [СН3(СН2)4СООН] — бесцветная маслянистая жидкость с резким неприятным запахом, входит в состав кокосового, коровьего, пальмового и других масел.
Каприловая кислота [СН3(СН2)6СООН] — бесцветная маслянистая жидкость с неприятным запахом, застывающая при температуре 16,3 °С, легко перегоняется с водяным паром, входит в состав кокосового, коровьего, пальмового и других масел.
Каприновая кислота [СН3(СН2)8СООН] — белое кристаллическое вещество при комнатной температуре, почти нерастворима в воде, находится в коровьем, кокосовом, пальмовом и некоторых других маслах, а также в небольшом количестве в спермацетовом жире.
Лауриновая кислота [СН3(СН2)10СООН] — твердое кристаллическое вещество, застывающее в виде игл, с температурой плавления 43,6 °С. При нормальном давлении не перегоняется без разложения. В воде при температуре 20 °С практически не растворяется. Содержится в значительном количестве в кокосовом (44,0-52,0%) масле и спермацетовом жире, а также в молочных жирах.
Миристиновая кислота [СН3(СН2)12СООН] — кристаллическое вещество с температурой плавления 53,9
оС, кристаллизуется в виде тонких листочков. В воде при температуре 20 °С она почти нерастворима, малорастворима в холодных спирте и эфире, но хорошо растворяется при температуре кипения этих растворителей. Присутствует во многих животных жирах и растительных маслах. В большом количестве содержится в пальмовом, кокосовом и мускатном маслах,
Присутствует во многих животных жирах и растительных маслах. В большом количестве содержится в пальмовом, кокосовом и мускатном маслах,
в молочных жирах — 8-12%, примерно столько же в спермацетовом жире, в небольших количествах — в льняном масле.
Пальмитиновая кислота [СН3(СН2)14СООН] — белое кристаллическое вещество с температурой плавления 63,1 °С, нерастворимое в воде. При нормальном давлении без пара перегоняется с разложением, Содержится почти во всех жирах как животного, так и растительного происхождения: в пальмовом масле 32-40%, в хлопковом — 20-24%, в соевом — 2,5-6%, в подсолнечном — 3-4%. В говяжьем сале содержится 20-30% пальмитиновой кислоты, а в кашалотовом жире — до 8%.
Стеариновая кислота [СН3(СН2),6СООН] — блестящие белые, жирные на ощупь чешуйки без запаха и вкуса, плавящиеся при 0,5 °С. Она является одной из самых распространенных в природе кислот и входит в состав почти всех жиров, особенно твердых. В говяжьем сале содержится 24-25% стеариновой кислоты, в костном жире — 19-21%, конском — до 7%, свином — 7-15%, хлопковом масле — 2%, соевом — 4,5-7,0%, подсолнечном — 2-3%.
В говяжьем сале содержится 24-25% стеариновой кислоты, в костном жире — 19-21%, конском — до 7%, свином — 7-15%, хлопковом масле — 2%, соевом — 4,5-7,0%, подсолнечном — 2-3%.
Арахиновая кислота [СН3(СН2)18СООН] — кристаллическое вещество с температурой плавления 75,3 °С, кристаллизуется в форме небольших блестящих листочков, плохо растворяется в холодном спирте, но хорошо — в горячем. Кислота содержится в арахисовом масле (2,3-4,9%), в меньшем количестве присутствует в маслах: льняном, сурепном, какао, коровьем и др.
Бегеновая кислота [СН3(СН2)20СООН] — кристаллизуется в форме игл с температурой плавления 79,9 °С. Содержится в очень небольших количествах в арахисовом, кукурузном, рапсовом и в некоторых других жирах. Кроме того, бегеновая кислота получается при гидрогенизации ненасыщенной эруковой кислоты, выделенной из горчичного или рапсового масла.
Лигноцериновая кислота [СН3(СН2)22СООН] — кристаллизуется из горячего спирта в виде шелковистых хлопьев с температурой плавления 84,2 °С. Находится в арахисовом масле (до 5%), в буковом дегте и в небольших количествах как составная часть в некоторых липидах.
Находится в арахисовом масле (до 5%), в буковом дегте и в небольших количествах как составная часть в некоторых липидах.
Церотиновая кислота [СН3(СН2)24СООН] — встречается в восках как в свободном состоянии, так и в виде сложных эфиров, входит в состав пчелиного воска и шерстяного жира, температура плавления 87,7 °С.
Монтановая кислота [СН3(СН2)26СООН] — содержится в восках, температура плавления 90 °С.
Изучение физико-химических свойств водорастворимых ПАВ полученных из жирных кислот хлопкового соапстока
АННОТАЦИЯ
С ростом мирового производства расширяются сферы применения их продуктов. В связи с этим, предъявляют новые требования к их качеству и переработке отходов. Охрана экологии Ферганского региона требует сокращения образования на промышленных предприятиях твердых отходов в том числе отработанных замасленных и парафинированных глинистых адсорбентов и их захоронения на загородных свалках. Нами разработан способ регенерации отработанных замасленных и парафинированных адсорбентов путем их обработки ПАВ-содержащим водным раствором, себестоимость которого в основном зависит от цены последних. путем омыления сырых жирных кислот хлопкового соапстока сперва сульфитом натрия, далее триэтаноламином (ТЭА) получили жидкую моющую основу для создаваемой композиции ПАВ.
Нами разработан способ регенерации отработанных замасленных и парафинированных адсорбентов путем их обработки ПАВ-содержащим водным раствором, себестоимость которого в основном зависит от цены последних. путем омыления сырых жирных кислот хлопкового соапстока сперва сульфитом натрия, далее триэтаноламином (ТЭА) получили жидкую моющую основу для создаваемой композиции ПАВ.
Физико-химические показатели полученных ПАВ анализировали стандартными методами. Основные физико-химические показатели полученной основы композиции ПАВ представлены в таблице. Создан ряд композиций ПАВ существенно состоящие из местного сырья. Для повышения эффективность действия ПАВ в состав композиции вводятся силикат натрия, сульфит натрия, соду кальцинированную, натрий хлор и сульфат аммония.
Таким образом, проведенные исследования и полученные результаты позволяют рекомендовать полученные композиции ПАВ для регенерации отработанных замасленных и парафинированных глинистых адсорбентов.
ABSTRACT
With the growth of world production, the scope of application of their products is expanding.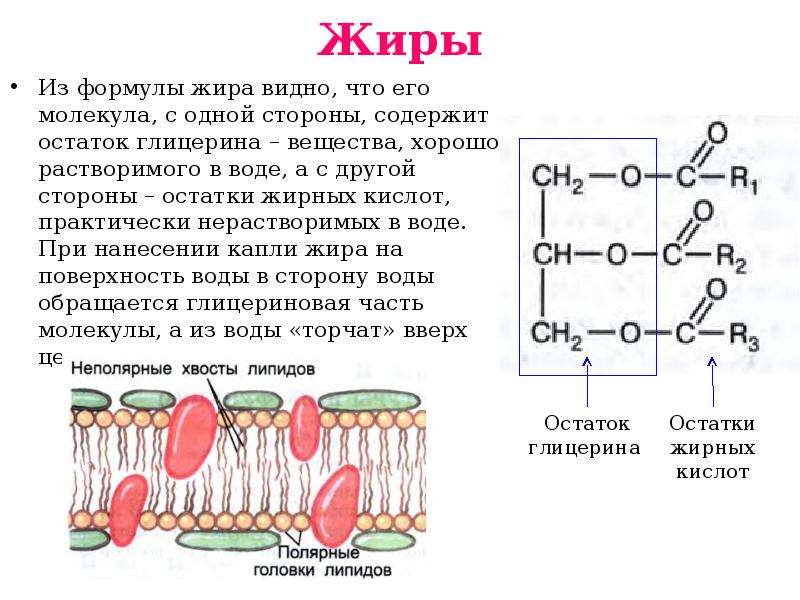 In this regard, they impose new requirements on their quality and waste management. The environmental protection of the Ferghana region requires a reduction in solid waste generation at industrial enterprises. The number of waste oily and waxed clay adsorbents and their disposal in country landfills. We have developed a method for the regeneration of spent oily and waxed adsorbents by treating them with a surfactant-containing aqueous solution, the cost of which mainly depends on the price of the latter. By saponification of crude cotton soap fatty acids, first with sodium sulfite, then with triethanolamine (TEA), a liquid detergent base was created for the surfactant composition being created. Physico-chemical parameters of the obtained surfactants were analyzed by standard methods. The main physico-chemical parameters of the obtained basis of the surfactant composition are presented in the table. A number of surfactant compositions have been created essentially consisting of local raw materials.
In this regard, they impose new requirements on their quality and waste management. The environmental protection of the Ferghana region requires a reduction in solid waste generation at industrial enterprises. The number of waste oily and waxed clay adsorbents and their disposal in country landfills. We have developed a method for the regeneration of spent oily and waxed adsorbents by treating them with a surfactant-containing aqueous solution, the cost of which mainly depends on the price of the latter. By saponification of crude cotton soap fatty acids, first with sodium sulfite, then with triethanolamine (TEA), a liquid detergent base was created for the surfactant composition being created. Physico-chemical parameters of the obtained surfactants were analyzed by standard methods. The main physico-chemical parameters of the obtained basis of the surfactant composition are presented in the table. A number of surfactant compositions have been created essentially consisting of local raw materials. To increase the effectiveness of surfactants, sodium silicate, sodium sulfite, soda ash, sodium chlorine and ammonium sulfate are introduced into the composition.
To increase the effectiveness of surfactants, sodium silicate, sodium sulfite, soda ash, sodium chlorine and ammonium sulfate are introduced into the composition.
Thus, the studies and the results obtained allow us to recommend the obtained surfactant compositions for the regeneration of used oily and waxed clay adsorbents.
Ключевые слова: глинистых адсорбент, парафинированных адсорбент, триэтаноламин (ТЭА).
Keywords: clay adsorbent, waxed adsorbents, triethanolamine (TEA).
Охрана экологии Ферганского региона требует сокращения образования на промышленных предприятиях твердых отходов в том числе отработанных замасленных и парафинированных глинистых адсорбентов и их захоронения на загородных свалках.
Нами разработан способ регенерации отработанных замасленных и парафинированных адсорбентов путем их обработки ПАВ-содержащим водным раствором, себестоимость которого в основном зависит от цены последних.
Известно что, сегодня эффективные ПАВ завозятся на предприятия в основном из зарубежа по дорогой цене.
Следовательно, создание и применение композиций водорастворимых ПАВ из местного сырья считается актуальной и экономически важной задачей.
В этом аспекте, жирные кислоты хлопкового соапстока считаются дешевым сырьем для получения ПАВ т.к. в Узбекистане их производство освоено на 18 крупных масло -жировых предприятиях.
Обработка сырых (или дистиллированных) жирных кислот щелочными реагентами позволит получить их соли, которые хорошо растворяются в воде [1]. Однако, моющая, пенообразующая, смачивающая и другие коллоидно-физические свойства таких растворов не всегда удовлетворяют требования потребителей, что обусловлено составом и содержанием обрабатываемого материала.
Отработанные замасленные и парафинированные глины считаются многокомпонентными высокодисперсными материалами, а их регенерация водным растворителем требует применения специальных композиций ПАВ, преимущественно полученных из местных компонентов.
Путем омыления сырых жирных кислот хлопкового соапстока сперва сульфитом натрия, далее триэтаноламином (ТЭА) получена жидкая моющая основа для создаваемой композиции ПАВ [4].
Физико-химические показатели полученных ПАВ анализировали стандартными методами [6].
В таблице 1 представлены основные физико-химические показатели полученной основы композиции ПАВ.
Таблица 1.
Физико-химические показатели моющей основы, полученной из сырых жирных кислот хлопкового соапстока
|
Наименование показателей |
При массовой доле жирных кислот хлопкового соапстока, % |
||
|
30 |
40 |
50 |
|
|
1. |
Мазеобразная |
||
|
2. Цвет |
светло-коричневый |
коричневый |
темно-коричневый |
|
3.Массовая доля, % -свободный едкой щелочи -свободный углекислый соды -примесей, нерастворимых в Воде |
0,25 0,8 0,3 |
0,14 0,9 0,4 |
0,12 1,0 0,5 |
|
4. |
200 |
250 |
300 |
Из табл. 1 видно, что с увеличением массовой доли жирных кислот цвет основы ПАВ темнеет, увеличиваются массовая доля свободной углекислой соды и примесей, нерастворимых в воде. При этом также повышается первоначальный объем пены (от 200 мл до 300 мл). Причем с увеличением массовой доли жирных кислот в получаемой основе снижается содержание свободной едкой щелочи от 0,15 до 0,12%.
На практике для повышения эффективности действия ПАВ чаще используют их композиции т.к. последние по своим коллоидно-химическим свойствам превосходят индивидуальные моющие основы.
Учитывая это, создан ряд композиций ПАВ существенно состоящие из местного сырья.
Состав и содержания разрабатываемых композицией ПАВ представлены в таблице 2
Таблица 2.
Составы и содержания разрабатываемых композиций ПАВ
|
Наименование компонентов композиции ПАВ |
Композиция ПАВ, масс, % |
|||
|
№1 |
№2 |
№3 |
№4 |
|
|
1.Основа ПАВ из СЖК хлопкового соапстока |
20 |
20 |
25 |
25 |
|
2. |
2,5 |
3,0 |
2,5 |
3,0 |
|
3.Сульфат натрия |
4,5 |
5,0 |
4,0 |
4,5 |
|
4. Сода кальцинированная |
2,0 |
2,0 |
3,0 |
3,0 |
|
5. |
0,2 |
0,3 |
0,3 |
0,4 |
|
6.Сульфат аммония |
0,2 |
0,3 |
0,4 |
0,5 |
|
7.Вода |
ост |
Ост |
Ост |
ост |
Примечание: Композиции ПАВ №1 и 2 предназначены для обезпарафинированния отработанных глинистых адсорбентов. Композиции ПАВ №3 и 4 для обезмасливания отработанных глинистых адсорбентов.
Композиции ПАВ №3 и 4 для обезмасливания отработанных глинистых адсорбентов.
Из табл. 2 видно, что для повышения эффективность действия ПАВ в состав композиции вводятся силикат натрия, сульфит натрия, соду кальцинированную, натрий хлор и сульфат аммония.
В таблице 3 представлены коллоидно-химические показатели водных растворов из подобранных полученных композиций ПАВ.
Таблица 3.
Коллодино-химические показатели водных растворов подобранных ПАВ
|
Номер ПАВ |
рН 1%-ного водного раствора |
Удельный вес, г/см3 |
Пенообразую-щая способность, мл |
Устойчи- вость к расплавинию |
Моющая способность, усл. |
|
Синтетичес -кий ПАВ (контроль) |
9,5 |
1,02 |
145 |
Уст |
112 |
|
№1 |
9,0 |
1,05 |
150 |
Уст |
114 |
|
№2 |
9,2 |
1,07 |
165 |
Уст |
116 |
|
№3 |
9,7 |
1,09 |
175 |
Уст |
120 |
|
№4 |
9,9 |
1,06 |
180 |
Уст |
222 |
Из табл. 3 видно, что предлагаемые композиции ПАВ превосходят известный ПАВ по пенообразующей, моющей способностям и др.
3 видно, что предлагаемые композиции ПАВ превосходят известный ПАВ по пенообразующей, моющей способностям и др.
Таким образом, проведенные исследования и полученные результаты позволяют рекомендовать полученные композиции ПАВ для регенерации отработанных замасленных и парафинированных глинистых адсорбентов.
Список литературы:
1. Абрамзон А.А. Поверхностно-активные вещества. Справочник, Л.: Химия, 1979-376 С.
2. Мамадалиева С.В. Зависимость показателей очищаемого парафина от размера гранул применяемого адсорбента // Universum: Химия и биология: электрон. научн. журн. 2019. № 11(65). URL: http://7universum.com/ru/nature/archive/item/8079 (дата обращения: 20.11.2019).
3. Рахмонов О.К., Мамадалиева С.В. Механизм воздействия ультразвука на парафин при его очистке композицией адсорбентов из местных глин // Universum: Химия и биология: электрон. научн. журн. 2019. № 11(65). URL: http://7universum.com/ru/nature/archive/item/8109 (дата обращения: 20. 11.2019).
11.2019).
4. Ребиндер П.А. Поверхностно-активные вещества и их применение в химической и нефтяной промышленности. Киев. Наука думка 1971-4С.
5. Паронян В.Х., Принь В.Т. Технология синтетических моющих средств. М.: Химия,1984-224 С.
6. Товбина. И.М. Справочник по мыловарному производству М.: Пищевая промышленность, 1974-518 С.
СВОЙСТВА МЫЛА
Производство мыла
Строение мыла. Развернутая формула строения натриевых и калиевых мыл показывает, что они состоят из двух неравных частей. Левая — их длинная часть — состоит из углеводородных групп, вокруг которых нет электрического поля; правая же—-короткая часть (—COONa или —COOK), содержащая карбоксильную группу, создает вокруг себя электрическое поле. Ниже приведена развернутая структурная формула строения натриевого, мыла стеариновой кислоты:
Ннн нн ннн нн нн ннн нн
М I I I I I I I I I I I I I I I X°Ns ннн НН нннннннннннн
Аналогичное строение имеют мыла других жирных кислот.
Левая часть молекулы мыла называется неполярной (не несет электрического заряда), правая — полярной (несет электрический заряд). Каждая из этих частей характеризуется своими свойствами.
Полярные вещества хорошо растворяются в воде и различных водных растворах; неполярные вещества в воде нерастворимы, но хорошо растворяются в жирах, маслах и других неполярных веществах, в том числе и в воздухе. Особенности строения мыла обусловливают его многие свойства, в том числе моющее действие.
Растворимость мыла. Мыла щелочных металлов хорошо растворяются в воде: калиевые мыла растворяются быстрее, чем натриевые. Мыла низкомолекулярных жирных кислот растворяются легче высокомолекулярных; в присутствии мыл из низкомолекулярных кислот улучшается растворимость высокомолекулярных. При одинаковом числе углеродных атомов в молекуле мыла ненасыщенных жирных кислот растворяются лучше мыл из насыщенных кислот. С повышением температуры растворимость всех мыл увеличивается.
Диссоциация — обратимое разложение молекул на более простые молекулы, атомы, атомные группы или ионы. Принято считать, что в сильно разбавленных растворах мыло находится в состоянии истинного раствора. При этом часть его диссоциирует (распадается) электролитически, давая катион металла и анион жирной кислоты по уравнению
Принято считать, что в сильно разбавленных растворах мыло находится в состоянии истинного раствора. При этом часть его диссоциирует (распадается) электролитически, давая катион металла и анион жирной кислоты по уравнению
RCOONa RCOO~ + Na+.
Степень диссоциации мыла можно изменять. Если из раствора удалять один из ионов или понижать концентрацию их, то диссоциация будет продолжаться и все новые молекулы вещества будут
Распадаться на ионы. Наоборот, если повысить концентрацию раствора мыла или ввести в этот раствор некоторое количество вещества, например едкой щелочи или поваренной соли, дающего ионы сильного основания, то диссоциация будет снижаться.
Г и д р о л и з — реакция обменного разложения между различными веществами и водой. Мыло как соль сильного основания и слабой кислоты в водном растворе подвергается гидролизу, т. е. взаимодействует с водой, распадаясь на жирную кислоту и свободную щелочь по уравнению
ЯСОСЖа + Н20 ИСООН + №ОН.
Гидролиз мыльных растворов увеличивается с понижением концентрации растворов, повышением молекулярной массы жирных кислот и повышением температуры раствора. Мыла ненасыщенных кислот гидролизуются несколько меньше, чем насыщенных. Мыла смоляных кислот подвергаются гидролизу сильнее, чем мыла жирных кислот.
Мыла ненасыщенных кислот гидролизуются несколько меньше, чем насыщенных. Мыла смоляных кислот подвергаются гидролизу сильнее, чем мыла жирных кислот.
Образующиеся в результате гидролиза молекулы жирных кислот могут взаимодействовать с негидролизованным мылом, образуя кислые мыла по уравнению
ЯСООН + ИСОСЖа ИСООН • КСООМа.
Получающиеся при этом кислые мыла насыщенных высокомолекулярных жирных кислот в разбавленных мыльных растворах и в воде нерастворимы, они представляют собой тонкодисперсные взвеси (суспензии). Кислые мыла ненасыщенных жирных кислот при повышенной температуре в мыльных растворах частично растворяются.
Ассоциация молекул — соединение нескольких молекул одного и того же вещества в одну частицу. В более концентрированных мыльных растворах молекулы мыла начинают ассоциироваться (соединяться), образуя сначала пары молекул, связанные межмолекулярным притяжением групп —СОО№, а затем — более крупные ассоциаты, называемые мицеллами.
Таким образом, в зависимости от концентрации мыльного раствора в нем может находиться значительное количество разных компонентов: растворенные в воде недиссоциированные молекулы мыла, ассоциированные молекулы мыла (мицеллы), диссоциированные молекулы мыла — анионы и катионы, ассоциированные анионы, кислые мыла.
Между этими компонентами устанавливается равновесие, которое зависит от природы жира, концентрации раствора, температуры, наличия других электролитов и т. д.
Способность мыльных растворов к диссоциации, гидролизу и ассоциации обусловливает их сложный химический состав. Сложный состав мыльных растворов определяет их свойства, благодаря которым они отнесены к коллоидным электролитам, т. е. к таким водным растворам, которые ведут себя как электролиты (проводят электрический ток) и наряду с этим обладают некоторыми свойствами коллоидов.
Моющее действие мыла. Как известно, главное свойство всех видов мыла заключается в их способности образовывать водные растворы, которые отмывают различные загрязнения на коже, волосах, разных тканях, на стекле, металле, дереве и на других предметах. Эти водные растворы способны отделять загрязнения •от поверхности, переводить их в раствор и удерживать в нем, не давая обратно оседать на очищаемую поверхность. Моющее действие мыльных растворов сопровождается довольно сложными •физико-химическими процессами, которые обусловлены строением мыла.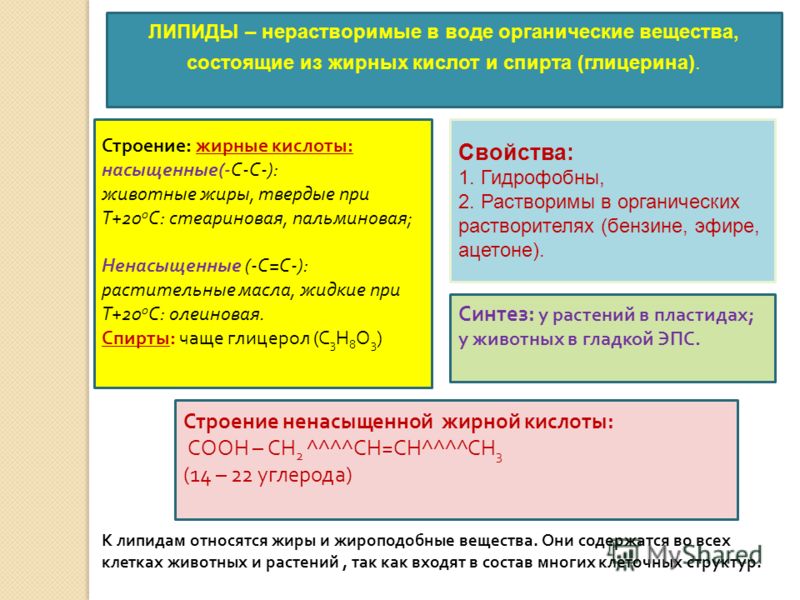
Одним из важных свойств этих растворов является их способность понижать поверхностное натяжение на границе с жирами, твердыми телами, воздухом и другими не смешивающимися с водой веществами. По этому признаку раствор мыла в воде относят к поверхностно-активным веществам. Чем выше поверхностная .активность водных растворов мыла, тем больше они понижают натяжение в поверхностном слое, тем выше моющее действие мыла.
Как уже известно, молекула мыла состоит из двух неравных частей — полярной и неполярной. При растворении в воде мыло своей полярной карбоксильной группой погружается в водный раствор, в то время как неполярная углеводородная группа из воды выталкивается. Если в водный раствор мыла попадает капелька жира, масла или другого неполярного вещества, то углеводородная часть растворится в нем, в то время как карбоксил застревает в воде.
Таким образом, мыло связывает водный раствор с нерастворимыми в нем жировыми и жироподобными веществами. Это можно себе представить так, что молекула мыла является булавкой, шляпка которой находится в водном растворе, а острие—-в капельке масла. Так как в растворе находится большое количество молекул мыла, то они образуют вокруг капельки жира сплошной «частокол» в виде довольно прочной упругой пленки, удерживающей капельку в водном растворе. Схематично этот процесс показан на рис. 2.
Так как в растворе находится большое количество молекул мыла, то они образуют вокруг капельки жира сплошной «частокол» в виде довольно прочной упругой пленки, удерживающей капельку в водном растворе. Схематично этот процесс показан на рис. 2.
Благодаря своей высокой поверхностной активности водные растворы мыла хорошо растекаются по поверхности ткани, погруженной в мыльную воду, и хорошо ею впитываются. При этом молекулы мыла обычно погружаются в ткань своей длинной углеводородной частью, а короткая часть — карбоксил как бы «торчит» наружу. В это время между тканью и прилипшими к ней загрязнениями образуются тончайшие пленочки, которые ослабляют силы сцепления ткани с загрязнениями и облегчают отрыв загрязнений от ткани.
Схематично процесс смачивания ткани, отрыв загрязнений с поверхности и удерживание их в водном растворе мыла представлен на рис. 3.
Пена, образующаяся в моющем растворе, облегчает удерживание отмываемых загрязнений, которые прилипают к поверхности тончайших мыльных пленок, окружающих воздушные пузырьки. Наличие пены является также показателем того, что в моющем растворе еще имеется некоторый запас неизрасходованного мыла.
Наличие пены является также показателем того, что в моющем растворе еще имеется некоторый запас неизрасходованного мыла.
Рис. 2. Схема удерживания капелек жира в мыльном растворе: / — капельки жира; 2 — молекулы растворенного мыла (мелкими кружками обозначены водорастворимые карбоксилы, черточками — жирорастворимая углеводородная часть). |
Рис. 3. Схематичное изображение моющего процесса:
I—молекулы мыла адсорбируются на твердой грязевой частице и отмываемой поверхности; //—молекулы мыла отделяют грязевую частицу от отмываемой поверхности; Ш — твердая грязевая частица в моющем растворе; А — молекулы мыла адсорбируются на поверхности твердой грязевой частицы; Б — молекулы мыла, адсорбируясь на поверхности жидкой грязевой частицы, своими концами вторгаются внутрь грязевой частицы.
Моющая способность мыла проявляется при сравнительно низких концентрациях его водных растворов (порядка 0,1—0,2% в пересчете на жирные кислоты). На результат моющего действия существенное влияние оказывают следующие факторы: состав жирных кислот, из которых сварено мыло, характер очищаемой поверхности и интенсивность загрязнения, температура при мытье, жесткость воды, характер механического воздействия на очищаемую поверхность и др.
Недостатки мыла. Отличительной особенностью мыла является его сравнительная универсальность при мытье, стирке и чистке.
К его потребительским недостаткам следует отнести чувствительность к качеству воды. В жесткой воде жировое мыло плохо моет, образует липкий осадок. Расход его на мытье и стирку увеличивается. Вредное действие солей жесткости не ограничивается только перерасходом мыла. Если на ткани остаются кальциевые или магниевые мыла, то она быстрее изнашивается ввиду ускорения окисления ее кислородом воздуха. Выстиранная
В жёсткой воде ткань становится грубой, менее эластичной, поры ее забиваются и хуже пропускают воздух, краски становятся блеклыми, и в конечном счете свойства ткани резко снижаются. При мытье головы мылом в жесткой воде волосы склеиваются.
При мытье головы мылом в жесткой воде волосы склеиваются.
Для борьбы с отрицательным действием солей жесткости воды рекомендуется их предварительно удалять. Для этого воду можно умягчить, применяя специальные порошки, содержащие фосфорные соли, кальцинированную соду, силикат натрия и некоторые другие добавки.
Недостатком жирового мыла является и то, что при растворении его в воде выделяется (в результате гидролиза) некоторое незначительное количество свободной едкой щелочи. Щелочь безвредна для хлопчатобумажных и льняных тканей, но не допускается при стирке шелковых, шерстяных и многих синтетических тканей.
Несмотря на имеющиеся недостатки, мыло является весьма эффективным и универсальным видом моющих средств, особенно для ухода за телом и в ряде других случаев.
Ремонтные работы с применением электрической или газовой сварки, или открытого огня производят только после письменного разрешения технического руководства и в присутствии назначенного им ответственного лица.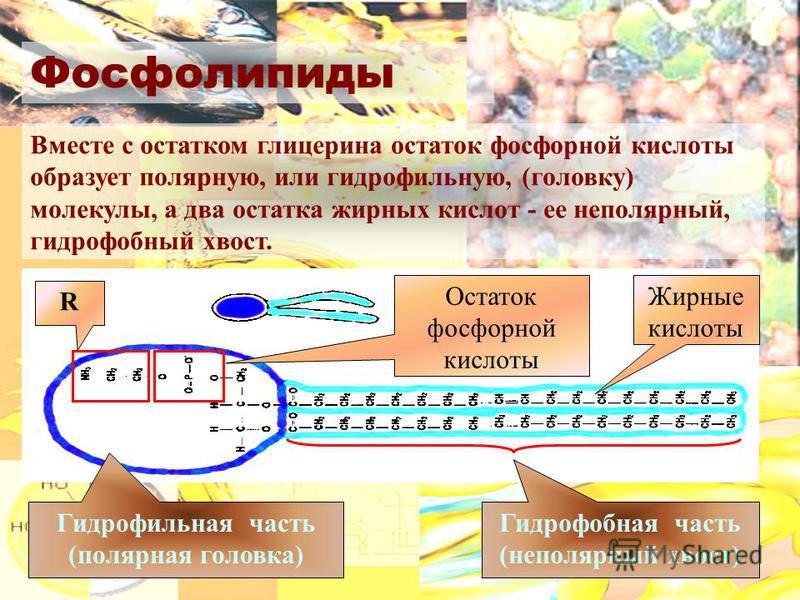 Аппаратура и технологические резервуары и …
Аппаратура и технологические резервуары и …
Соответственно с повышением уровня механизации и автоматизации процессов мыловаренного производства расширяются профилактические мероприятия против поражения обслуживающего персонала электрическим током. Действие электрического тока заключается в повреждении нервных тканей человеческого организма, что …
Содержание помещений. Первое условие безопасности на производстве— чистота и порядок у рабочего места. Жиры, масла и особенно мыло, попадая на пол, делают поверхность его скользкой. Поэтому пол должен быть всегда …
Мыловарение / Мыло с Вашим логотипом — лучший подарок!
Первым моющим средством, разумеется, была обыкновенная вода.
Правда, в безводных местностях использовали просто-напросто песок: оттирали им пятна.
Но когда одна вода не помогала, в ход шли другие средства: бычья желчь и мозговые кости, разложившаяся моча и свежий помет, яичные желтки и кипящее молоко, мед и пивные дрожжи, теплые отруби и бобовая мука, селитра и гуммиарабик, опилки, зола и прочее, прочее. .. Неправда ли, похоже на колдовской рецепт?
.. Неправда ли, похоже на колдовской рецепт?
Итак, императорскую тогу топтали ногами в чане с водой и желчью.
Однако, чаще использовали разложившуюся мочу животных, содержащую уреаты и аммиак, в присутствии которой вода пенилась. Во многих странах для стирки применяли корни, кору или плоды растений типа мыльнянки. Они содержат жидкость, которая пенится в воде благодаря наличию в ней до 10% сапонинов — моющих веществ природного происхождения. В отварах мыльнянки стирали шелка. При этом ткань не разрушалась и не линяла. На Антильских островах и в наше время используют для стирки кору белого орехового дерева. Почти по всей Европе вдоль ручьев и рек, в низинах и канавах растет дикая разновидность обыкновенной мыльнянки. Этой травой стирали и в бедных хижинах, и в богатых усадьбах. Уличную грязь (в которой недостатка не было) смывали так: сначала одежду опускали в горячий раствор бычьей желчи, а затем полоскали в ключевой воде. Высохший костюм посыпали мелким чистым песком, били палками, терли щетками.
Еще одно признанное средство — смесь древесных опилок, воды и гуммиарабика. И, конечно же, многие столетия стирали с помощью поташа, соды или древесной золы. Для этого в бочку с нагретой до кипения водой клали белье, а затем насыпали соду или опускали мешочек с золой и все тщательно перемешивали.
Самое раннее описание мыловарения было обнаружено учеными на шумерских табличках, датируемых 2500 годом до н.э. Судя по этим записям, мыло изготавливалось путем смеси воды и древесной золы, которую кипятили и в последствии растапливали в ней жир, получая тем самым мыльный раствор. Но, к сожалению, свидетельств применения данного раствора в шумерские времена не сохранилось.
Легенда гласит, что само слово soap (мыло) произошло от названия горы Сапо в древнем Риме, где совершались жертвоприношения богам. (У римлян мыло называлось sapo. Из этого слова позднее у англичан образовалось soap, у французов — savon, у итальянцев — sapone.) Животный жир, выделяющийся при сжигании жертвы, скапливался и смешивался с древесной золой костра. Поученная масса смывалась дождем в глинистый грунт берега реки Тибр, где жители стирали белье и, естественно, наблюдательность человека не упустила того факта, что благодаря этой смеси одежда отстирывалась гораздо легче. Поэтому долгое время изобретение мыла приписывалось именно римлянам. Именно в Риме мыловарение приобрело широкое распространение и выделилось в отдельную ремесленную отрасль. Так при раскопках Помпеи археологами была раскопана мыловарня, где найдены готовые куски мыла.
Поученная масса смывалась дождем в глинистый грунт берега реки Тибр, где жители стирали белье и, естественно, наблюдательность человека не упустила того факта, что благодаря этой смеси одежда отстирывалась гораздо легче. Поэтому долгое время изобретение мыла приписывалось именно римлянам. Именно в Риме мыловарение приобрело широкое распространение и выделилось в отдельную ремесленную отрасль. Так при раскопках Помпеи археологами была раскопана мыловарня, где найдены готовые куски мыла.
О мыловарении упоминает также римский писатель и ученый Плиний Старший в своем основном трактате «Естественная история» в тридцати семи томах. Данный источник представляет собой энциклопедию естественных знаний античности, и упоминание в нем мыловарения однозначно говорит о том, что к тому времени его продукт стал неотъемлемой частью жизни римского населения. Плиний писал о способах приготовления мыла путем омыления жиров. При этом изготавливалось как твердое, так и мягкое мыло, получаемое с использованием соды и древесной золы (поташа).
Твердое мыло отличалось своей жесткостью и использовалось исключительно для стирки, в то время как мягкое мыло использовалось в косметических целях, в том числе и для укладки волос.
После падения Римской империи и с началом так называемого темного времени в Европе, чистота и личная гигиена отошли на второй план, поэтому производство мыла пошло на спад, но рецепты не были утеряны и небольшие кустарные мастерские продолжали дело мастеров древности.
В Западной Европе ремесло мыловарения окончательно сформировалось только к концу XVII века. Немаловажную роль в развитии мыловарения сыграл географический фактор. Ингредиенты для приготовления мыла варьировались в зависимости от региона. На севере при варке мыла применялся животный жир, а на юге использовалось оливковое масло, благодаря которому мыло получалось превосходного качества.
Об изготовлении мыла в средние века имеются лишь скудные сведения. Вероятно, арабы в VII веке н. э. узнали способ обработки мыльного раствора гашеной известью и таким образом стали изготавливать твердое мыло. От арабов искусство мыловарения проникло в Испанию. Здесь научились делать твердое красивое мыло из оливкового масла и золы морских растений. Повсюду на Средиземноморье, где выращивали масличные растения, стало процветать мыловарение. Центрами были Аликанте, Карфаген, Севилья, Савона, Венеция, Генуя, а с XVI века также Марсель и Неаполь, благодаря наличию на близлежащей территории сырьевых источников, то есть оливкового масла и соды. Масло, получаемое после первых двух прессовок, употреблялось в пищу, а после третьей использовалось для приготовления мыла. С этого времени мыло начало все более широко применяться в качестве моющего средства.
От арабов искусство мыловарения проникло в Испанию. Здесь научились делать твердое красивое мыло из оливкового масла и золы морских растений. Повсюду на Средиземноморье, где выращивали масличные растения, стало процветать мыловарение. Центрами были Аликанте, Карфаген, Севилья, Савона, Венеция, Генуя, а с XVI века также Марсель и Неаполь, благодаря наличию на близлежащей территории сырьевых источников, то есть оливкового масла и соды. Масло, получаемое после первых двух прессовок, употреблялось в пищу, а после третьей использовалось для приготовления мыла. С этого времени мыло начало все более широко применяться в качестве моющего средства.
Во дворцах знати эпохи Ренессанса стали уделять большое внимание чистоте, но еще большее — приятному запаху. Существовала мода на запахи, поэтому изготовление душистых веществ и мыла в те времена находилось под влиянием модных веяний из Парижа. Еще бы! Где же найти ароматические вещества, как не на юге Франции с его обилием цветов, которые издавна здесь выращивали. Иногда мыло служило подарком. Крестоносцы в XII веке привозили знаменитые мыльные шарики из Дамаска и приносили в дар своим возлюбленным. В XV и XVI веках рыцари и купцы привозили пахнущие шарики из Венеции. На них были вытиснены лилии, еловые шишки, полумесяцы — первые, если можно так сказать, торговые знаки.
Во времена Каролингов искусство мыловарения было широко распространено. Управляющим и арендаторам в Аквитании (Юго-Западная Франция) было указано при наборе батраков следить за тем, чтобы среди них были люди, умеющие варить мыло. Любящий роскошь французский король Людовик XIV лично интересовался производством туалетного мыла. Гольберт, его министр финансов, «выписал» из Генуи специалистов по мыловарению. Возникла новая промышленность, оказавшаяся вскоре под защитой французского государства, которой предписывалось использовать только душистые масла из Прованса. Марсель стал метрополией производства такого ценного мыла.
Лишь с конца XIV века марсельское мыло уступило свое место в международной торговле венецианскому. Так же мыловарение активно развивалось в Италии, Греции и Испании. В XV веке в Италии, в Севоне, начали впервые выпускать твердое мыло промышленным путем. При этом жиры соединялись не с золой, а с природной кальцинированной содой. Это значительно снижало себестоимость мыла, а, следовательно, перевело мыловарение его из разряда ремесленного производства в мануфактурное. Начиная с XIV века, мыловарни стали появляться и в Германии. Для варки мыла использовали говяжье, баранье, свиное, лошадиное сало, костяной, китовый и рыбий жир, отходы жиров различных производств. Добавляли и растительные масла — льняное, хлопковое, оливковое.
С мылом связаны разнообразные перлы истории, основанные на серьезности отношения к ремеслу мыловарения. В 1399 году в Англии король Генрих IV основал орден, особой привилегией членов которого считалось… мытье в бане с мылом. В этой стране долгое время под страхом смерти члену гильдии мыловаров запрещалось ночевать под одной крышей с мастерами других ремесел — дабы не выдать тайну. Во второй половине XVII века во Франции был издан королевский указ, разрешающий варку мыла только в летнее время и только из золы и оливкового масла.
История мыловарения в России уходит своими корнями в допетровскую эпоху. В античные времена использовали специальные глины, способные сорбировать грязь и пыль с одежды. Кстати, название Сапун-горы под Севастополем означает «мыльная гора». Глину, добываемую на этой горе, использовали для мытья тела и стирки одежды. Главным центром мыловарения был город Шуя, на его гербе даже изображен кусок мыла. Но русские умельцы быстро научились изготавливать мыло из поташа и животных жиров. Таким образом, в каждом доме было налажено производства этого столь необходимого в быту продукта. Ширилось число мелких мыловаренных мастерских, тем более что Россия располагала всеми необходимыми для этого ресурсами, и в первую очередь древесиной, так как в основе поташа лежала именно зола.
Поташ стал одним из основных продуктов экспорта, что привело к массовой вырубке лесов. К началу царствования Петра I остро встал вопрос о поиске более дешевого заменителя поташа. Проблема была решена в 1685 году, когда французский химик Николас Лебман смог получить из поваренной соли соду. Этот отличный щелочной материал вытеснил поташ.
В связи с особыми экономическими условиями, первые мыловаренные фабрики стали появляться в России лишь в XVIII веке. В Москве на тот момент было известно две: в Новинской и Пресненской частях. К 1853 году в Московской губернии их число выросло до восьми. Потребителями мыловаренных заводов стали многочисленные суконные, ситценабивные и красильные фабрики.
Несмотря на то что в конце эпохи средневековья в разных странах существовала довольно развитая мыловаренная промышленность, химическая сущность процессов, конечно, была не ясна. Лишь на рубеже XVIII и XIX вв. была выяснена химическая природа жиров и внесена ясность в реакцию их омыления. В 1779 г. шведский химик Шееле показал, что при взаимодействии оливкового масла с оксидом свинца и водой образуется сладкое и растворимое в воде вещество. Решающий шаг на пути изучения химической природы жиров был сделан французским химиком Шеврелем. Он открыл стеариновую, пальмитиновую и олеиновую кислоты, как продукты разложения жиров при их омылении водой и щелочами. Сладкое вещество, полученное Шееле, было Шеврелем названо глицерином. Сорок лет спустя Бертло установил природу глицерина и объяснил химическое строение жиров. Глицерин – трехатомный спирт. Жиры – сложные эфиры глицерина (глицериды) тяжелых одноосновных карбоновых кислот, преимущественно пальмитиновой Ch4(Ch3)14COOH, стеариновой Ch4(Ch3)16COOH и олеиновой Ch4(Ch3)7CH = CH(Ch3)7COOH.
В состав различных жиров входят в различных соотношениях пальмитиновая, стеариновая, олеиновая и другие кислоты. В растительных (жидких) жирах преобладают непредельные кислоты (содержащие этиленовые связи), а в животных (твердых) – предельные кислоты, т.е. не содержащие двойных связей. Потребности в твердых животных жирах большие, чем в растительных. Поэтому жидкие растительные жиры переводят в твердые каталитической гидрогенизацией. В этом процессе остатки непредельных кислот в глицеридах превращаются (присоединением водорода) в остатки предельных кислот.
Именно так получают кулинарные жиры, масло для обжаривания, салатное масло, а также жиры, идущие на производство маргарина. Гидрированные жиры называют саломаслами (сало из масла).
Важно то, что среди остатков различных кислот в глицеридах (жирах) присутствует остаток линолевой кислоты Ch4(Ch3)4CH = CHCh3Ch3CH = CH(Ch3)7COOH. В отличие от других эта кислота не синтезируется в организме человека, а вводится только с пищей. В настоящее время существует утвердившееся мнение, что линолевая кислота необходима для предотвращения атеросклероза – распространенной болезни, служащей одной из главных причин потери трудоспособности и преждевременной смерти. Необходимо отметить, что линолевая кислота непредельная, а значит, она входит в состав главным образом растительных жиров.
В быту, не говоря о промышленности, мойке подвергают разные предметы и объекты. Загрязняющие вещества бывают самые разнообразные, но чаще всего они малорастворимы или нерастворимы в воде. Такие вещества, как правило, являются гидрофобными, поскольку водой не смачиваются и с водой не взаимодействуют. Поэтому нужны и различные моющие средства.
Если попытаться дать определение, то мытьем можно назвать очистку загрязненной поверхности жидкостью, содержащей моющее вещество или систему моющих веществ. В качестве жидкости в быту используют главным образом воду. Хорошая моющая система должна выполнять двойную функцию: удалять загрязнение с очищаемой поверхности и переводить его в водный раствор. Значит, моющее средство также должно обладать двойной функцией: способностью взаимодействовать с загрязняющим веществом и переводить его в воду или водный раствор. Следовательно, молекула моющего вещества должна иметь гидрофобную и гидрофильную части. Фобос – по-гречески означает страх, боязнь. Значит, гидрофобность означает боящийся, избегающий воду. Филео – по-гречески – люблю, а гидрофильность – любящий, удерживающий воду. Гидрофобная часть молекулы моющего вещества обладает способностью взаимодействовать с поверхностью гидрофобного загрязняющего вещества. Гидрофильная часть моющего вещества взаимодействует с водой, проникает в воду и увлекает с собой частицу загрязняющего вещества, присоединенную к гидрофобному концу.
Таким образом, моющие вещества должны обладать способностью адсорбироваться на пограничной поверхности, т.е. обладать поверхностной активностью. Их называют поверхностно-активными веществами (ПАВ).
Соли тяжелых карбоновых кислот, например Ch4(Ch3)14COONa, являются типичными поверхностно-активными веществами. Они содержат гидрофильную часть (в данном случае – карбоксильную группу) и гидрофобную часть (углеводородный радикал).
Животные жиры – древнее и весьма ценное сырье мыловаренной промышленности. Они содержат до 40% (насыщенных) жирных кислот. Искусственные, т.е. синтетические, жирные кислоты получают из парафина нефти каталитическим окислением кислородом воздуха.
Молекула парафина при окислении разрывается в разных местах и потому получается смесь кислот, которые разделяются на фракции. При производстве мыла используют две фракции: C10–C16 и C17–C20. В хозяйственное мыло синтетические кислоты вводят в количестве 35…40%. Для производства мыла также применяют нафтеновые кислоты, выделяемые при очистке нефтепродуктов (бензина, керосина и др.). С этой целью нефтепродукты обрабатывают раствором гидроксида натрия и получают водный раствор натриевых солей нафтеновых кислот (монокарбоновые кислоты ряда циклопентана и циклогексана). Этот раствор упаривают и обрабатывают поваренной солью, в результате чего на поверхность раствора всплывает мазеобразная масса темного цвета – мылонафт. Для очистки мылонафт обрабатывают серной кислотой, т.е. вытесняют из солей сами нафтеновые кислоты. Этот нерастворимый в воде продукт называют асидолом или асидол-мылонафтом. Непосредственно из асидола можно изготавливать только жидкое или, в крайнем случае, мягкое мыло. Оно имеет нефтяной запах, но зато обладает бактерицидными свойствами.
В производстве мыла давно используют канифоль, которую получают при переработке живицы хвойных деревьев. Канифоль состоит из смеси смоляных кислот, содержащих в цепи около 20 углеродных атомов. В рецептуру хозяйственного мыла обычно вводят 12…15% канифоли от массы жирных кислот, а в рецептуру туалетных мыл – не более 10%. Введение канифоли в больших количествах делает мыло мягким и липким.
Процесс производства мыла состоит из химической и механической стадий. На первой стадии (варка мыла) получают водный раствор солей натрия (реже калия) жирных кислот или их заменителей (нафтеновых, смоляных). На второй стадии проводят механическую обработку этих солей – охлаждение, сушку, смешивание с различными добавками, отделку и упаковку.
Варку мыла заканчивают обработкой мыльного раствора (мыльного клея) избытком щелочи (NaOH) или раствором NaCl. В результате этого на поверхность раствора всплывает концентрированный слой мыла, называемый ядром. Полученное таким образом мыло называют ядровым, а процесс его выделения из раствора – отсолкой или высаливанием. При высаливании происходит повышение концентрации мыла и его очистка от белковых, красящих и механических примесей – так получают хозяйственное мыло.
Если мыло варилось из животных или растительных жиров, то из раствора после отделения ядра выделяют образующийся в результате омыления глицерин. Он находит широкое и разнообразное применение: в производстве взрывчатых веществ (тринитроглицерина) и полимерных смол; в качестве умягчителя тканей и кожи; для парфюмерных, косметических и медицинских препаратов; при производстве кондитерских изделий и ликеров. Последним он придает вязкую консистенцию.
Для получения особо чистого и светлого мыла его очищают (шлифуют) переведением снова в раствор кипячением с горячей водой и повторным высаливанием. В результате шлифования мыло приобретает большую однородность, низкую вязкость и надлежащую пластичность. Для изготовления туалетного мыла в очищенном ядровом мыле снижают содержание воды от 30 до 12%. Затем в него вводят парфюмерные отдушки, отбеливатели типа TiO2, красители и др. Хорошие сорта туалетного мыла содержат до 50% мыла, полученного из импортного кокосового или пальмового масла. Кокосовое масло хорошо растворяется в холодной воде и характеризуется высоким пенообразованием. Иногда туалетное мыло содержит до 10% свободных жирных кислот. Самое дорогое туалетное мыло целиком изготавливают из кокосового масла.
Для улучшения некоторых характеристик хозяйственного мыла (иногда и туалетного), а также для удешевления в него вводят наполнители. К ним относятся некоторые натриевые соли (Na2CO3, Na2B4O7, Na5P3O10, жидкое стекло), которые при растворении в воде приводят к подщелачиванию, клеи (казеин, казеиновый студень), углеводы (крахмал). Клеи и крахмал способствуют пенообразованию мыльного раствора и стойкости пены, однако моющей способностью не обладают. Для получения паст в жидкое хозяйственное мыло вводят тонкоизмельченный песок, толченый кирпич, жирные глины. Они способствуют механической очистке. Такие мыла применяют для чистки кухонной посуды, некрашеной мебели, полов и т.д.
Особое место среди наполнителей занимает сапонин, получаемый выщелачиванием некоторых растений и прежде всего мыльного корня. Он хорошо растворяется в воде и его растворы сильно пенятся. Поэтому сапонин используют для улучшения пенообразования и применяют для дорогих сортов мыл.
Следует отметить, что замена натрия на калий приводит к изменению консистенции мыла. Из твердого оно становится мягким или мазеобразным.
Ионы кальция и магния образуют с анионами тяжелых карбоновых кислот малорастворимые соли. Поэтому при стирке белья в жесткой воде, содержащей эти ионы, расход мыла повышается на 25…30%. Малорастворимые соли кальция и магния оседают на ткани, забивают поры и потому делают ткань грубой, менее эластичной, с плохой воздухо- и влагопроницаемостью. Такие ткани приобретают сероватый оттенок, а окраска становится блеклой. Кроме того, осевшие на ткани известковые мыла приводят к снижению ее прочности. Это происходит потому, что анионы ненасыщенных карбоновых кислот при сушке тканей окисляются кислородом воздуха с образованием веществ пероксидного характера. Они же окисляют целлюлозу, из которой состоят ткани. Для устранения вредных последствий жесткой воды в мыла вводят натрийтрифосфат Na5P3O10. Анион P3O510– связывает ионы Ca2+ и Mg2+ в прочные, но растворимые в воде соединения. По существу они играют роль умягчителя воды. С этой же целью натрийтрифосфат и другие полифосфатные анионы добавляют и в стиральные порошки.
Кроме использования мыла в качестве моющего средства оно широко применяется при отделке тканей, в производстве косметических средств, для изготовления полировочных составов и водоэмульсионных красок. Имеется и не столь безобидное его применение. Алюминиевое мыло (алюминиевые соли смеси жирных и нафтеновых кислот) применяют в США для получения некоторых видов напалма – самовоспламеняющегося состава, используемого в огнеметах и зажигательных авиабомбах. Само слово напалм происходит от начальных слогов нафтеновой и пальмитиновой кислот. Состав напалма довольно простой – это бензин, загущенный алюминиевым мылом.
В настоящее время химическая промышленность выпускает большое количество различных синтетических моющих средств (стиральных порошков). Наибольшее практическое значение имеют соединения, содержащие насыщенную углеводородную цепь из 10…15 атомов углерода, так или иначе связанную с сульфатной или сульфонатной группой.
Производство синтетических моющих средств основано на дешевой сырьевой базе, а точнее на продуктах переработки нефти и газа. Они, как правило, не образуют малорастворимых в воде солей кальция и магния.
Следовательно, многие из синтетических моющих средств одинаково хорошо моют как в мягкой, так и в жесткой воде. Некоторые средства пригодны даже для стирки в морской воде. Синтетические моющие средства действуют не только в горячей воде, как это характерно для хозяйственного мыла, но и в воде при сравнительно низких температурах, что важно при стирке тканей из искусственных волокон. Наконец, концентрация синтетических моющих веществ даже в мягкой воде может быть гораздо ниже, чем мыла, полученного из жиров. Синтетические моющие средства обычно представляют довольно сложную композицию, поскольку в них входят различные добавки: оптические отбеливатели, химические отбеливатели, ферменты, пенообразователи, смягчители.
Мы рады предложить вам производство мыла с вашим логотипом.
У нас вы можете заказать всевозможные варианты крем-мыла и жидкого мыла. Производство детского мыла строго регламентируется положением о Государственной регистрации продукции. Мы строго следуем всем параметрам в производстве любого вида нашей продукции.
В данной статье использованы материалы с ресурсов:
http://ru.wikipedia.org/
http://n-t.ru/ri/kk/hm10.htm, Ю. Кукушкин, к.х.н., «Химия вокруг нас»
http://www.soapmaker.ru
http://www.xumuk.ru/encyklopedia/2335.html
Липиды
Липиды — это семейство соединений, разнообразие которых также стало возможным благодаря построению сложных молекул из нескольких единиц более простых молекул, и мы снова видим характерные кольца и цепи.
Полярные и неполярные молекулы
Вы, вероятно, слышали выражение «масло и вода не смешиваются», и вы наблюдали, как заправка для салатов, состоящая из уксуса (который является водным, т.е. в основном вода) и масла, разделяется, когда его оставляют стоять.Эта несовместимость связана с тем, что молекулы воды полярны, а масло неполярно. Вода — полярная молекула, потому что отрицательно заряженные электроны, вращающиеся вокруг ядер атомов, не распределены равномерно. Атом кислорода имеет гораздо большую массу, чем два атома водорода, и, следовательно, электроны проводят больше времени рядом с атомом кислорода. В результате конец молекулы воды, где расположен кислород, имеет относительно отрицательный заряд, тогда как конец с атомами водорода относительно положительно заряжен.Положительные концы молекулы воды притягиваются к отрицательным концам соседних молекул воды, как показано на рисунке ниже, и это позволяет молекулам воды объединяться. Вы также могли видеть капли воды на лобовом стекле автомобиля в результате этого явления.
Источник: http://www.personal.psu.edu/staff/m/b/mbt102/bisci4online/chemistry/chemistry3.htm
Липиды, то есть жирные молекулы, с другой стороны, неполярны, что означает, что распределение заряда равномерно, и молекулы не имеют положительных и отрицательно заряженных концов.. Неполярные молекулы плохо растворяются в полярных растворах, таких как вода; на самом деле полярные и неполярные молекулы имеют тенденцию отталкиваться друг от друга так же, как масло и вода не смешиваются и отделяются друг от друга, даже если их сильно встряхнуть в попытке смешать их. Это различие между полярными и неполярными молекулами имеет важные последствия для живых существ, которые состоят как из полярных, так и из неполярных молекул. В следующих разделах будет показано, насколько это важно.
жирных кислот
Жирные кислоты представляют собой цепочечные молекулы, которые являются важными компонентами нескольких типов липидов. На рисунках ниже показаны две разные молекулы жирных кислот. Каждый из них имеет характерную карбоксильную группу (-COOH), присоединенную к углеродной цепи с атомами водорода, присоединенными к углеродной цепи. Следует отметить две вещи. Во-первых, углеводородная цепь очень неполярна и поэтому плохо растворяется в воде. Однако углеводородные цепи легко связываются друг с другом.Во-вторых, обратите внимание, что из ненасыщенной жирной кислоты удалены два атома водорода, и это позволяет образовать двойную связь, то есть более прочную связь между двумя атомами углерода. Также обратите внимание, что двойная связь имеет тенденцию к изгибу или перегибу жирной кислоты. На рисунке справа показаны две другие распространенные жирные кислоты: стеариновая кислота, которая представляет собой прямую 18-углеродную цепь без двойных связей, и олеиновая кислота, которая представляет собой 18-углеродную цепь с одинарной двойной связью, которая вызывает изгиб углерода. цепь.
Триглицериды
Молекула жира — это тип липида, который состоит из трех молекул жирных кислот, связанных с трехуглеродным глицериновым остовом, как показано справа. Три жирные кислоты могут отличаться друг от друга. Поскольку углеводородные цепи очень неполярны, жиры не растворяются в воде; вместо этого молекулы жира имеют тенденцию сливаться друг с другом. Поскольку молекула жира состоит из 3 жирных кислот, связанных с молекулой глицерина, их также называют тригилцеридами.
Фосфолипиды
Фосфолипиды составляют еще один важный класс липидов. Они похожи на тригилцериды тем, что имеют глицериновую основу, но есть только две жирные кислоты, связанные с глицерином. Третий углерод глицеринового остова присоединен к фосфатной группе (атом фосфора, связанный с четырьмя атомами кислорода), а фосфатная группа присоединена к основной молекуле холина, серина или этаноламина.Часть фосфолипида с фосфатом и основанием на самом деле очень полярна и имеет тенденцию отклоняться от двух жирных кислот. Это придает молекулам фосфолипидов форму шпильки. Головка шпильки очень полярна и поэтому любит ассоциироваться с водой (она гидрофильна), в то время как две цепи жирных кислот («хвосты») очень неполярны и, как правило, избегают воды (гидрофобны) и связываются с другими углеводородные цепи.
Фосфолипиды можно описать как amphipathic («amphi» означает «оба»), потому что они имеют двойную природу (частично полярную и частично неполярную).Эта характеристика заставляет фосфолипиды самоассоциироваться в большие макромолекулярные комплексы в водной (водной) среде.
Холестерин
Холестерин также является важным компонентом мембран животных (мембраны растений имеют похожий, но отличный от других «стерин» в мембранах). Это липид, поскольку он почти полностью состоит из углерода и водорода, но он отличается от жирных кислот, жиров и фосфолипидов тем, что расположен в виде ряда колец. Кольца состоят из 5 или 6 атомов углерода, связанных вместе.Атомы углерода на вершинах гексагонального и пентагонального колец имеют присоединенные к ним атомы водорода. Кольцеобразные структуры довольно жесткие, но есть еще углеводородный хвост, который несколько гибкий. Вся конструкция чем-то напоминает навороченный коршун с хвостом.
Холестерин очень неполярен, за исключением гидроксильной группы, присоединенной к первому кольцу. Следовательно, в мембране животной клетки полярная гидроксильная группа прилипает к водной среде (внеклеточной или внутриклеточной воде), а остальная часть молекулы холестерина, неполярная, находится среди неполярных жирных кислотных хвостов. фосфолипиды.На изображении ниже изображен участок клеточной мембраны с водой снаружи и внутри. Полярные головные группы фосфолипидов представлены красным, а их неполярные жирные кислотные хвосты показаны зигзагообразными линиями, отходящими от полярной головной группы. Как мы видим более подробно, клеточные мембраны состоят из бислоя фосфолипидов с другими молекулами, вставленными в бислой. На этой иллюстрации показаны пять молекул холестерина (черные структуры с четырьмя соединенными кольцами), вставленные в липидный бислой.Большая часть молекулы холестерина неполярна и поэтому связана с неполярными жирнокислотными хвостами фосфолипидов. Однако гидроксильная группа (-ОН) холестерина несет отрицательный заряд и поэтому ассоциируется с полярным окружением воды либо внутри клетки, либо снаружи.
вернуться наверх | предыдущая страница | следующая страница
22.1: Липиды — Химия LibreTexts
Липиды представляют собой большую и разнообразную группу встречающихся в природе органических соединений, которые связаны своей растворимостью в неполярных органических растворителях (например,грамм. эфир, хлороформ, ацетон и бензол) и общая нерастворимость в воде. Как будет показано в следующих разделах, существует большое структурное разнообразие липидов. Вы можете щелкнуть по теме, указанной ниже, или перейти от страницы к странице.
Жирные кислоты
Общей чертой этих липидов является то, что все они представляют собой сложные эфиры жирных кислот со средней и длинной цепью. Гидролиз, катализируемый кислотой или основанием, дает компонентную жирную кислоту, некоторые примеры которой приведены в следующей таблице, вместе со спиртовым компонентом липида.Эти длинноцепочечные карбоновые кислоты обычно называют их общими названиями, которые в большинстве случаев отражают их источники. Природные жирные кислоты могут быть насыщенными или ненасыщенными, и, как показывают следующие данные, насыщенные кислоты имеют более высокие температуры плавления, чем ненасыщенные кислоты соответствующего размера. Все двойные связи в ненасыщенных соединениях, перечисленных справа, являются цис (или Z).
| |||||||||||||||||||||
| ||||||||||||||||||||
Более высокие температуры плавления насыщенных жирных кислот отражают однородную стержнеобразную форму их молекул.Цис-двойная связь (и) в ненасыщенных жирных кислотах вносит излом в их форму, что затрудняет объединение их молекул в стабильную повторяющуюся матрицу или кристаллическую решетку. Изомер олеиновой кислоты с транс-двойной связью, известный как элаидиновая кислота, имеет линейную форму и температуру плавления 45 ºC (на 32 ºC выше, чем его цис-изомер). Формы стеариновой и олеиновой кислот показаны на моделях ниже. Вы можете изучить модели этих соединений, щелкнув изображение желаемой модели .
стеариновая кислота | олеиновая кислота |
|---|
Две полиненасыщенные жирные кислоты, линолевая и линоленовая, в их отсутствие в составе человека обозначаются как «незаменимые» диета связана с проблемами со здоровьем, такими как шелушение кожи, задержка роста и повышенное обезвоживание. Эти кислоты также являются предшественниками простагландинов, семейства физиологически сильных липидов, присутствующих в незначительных количествах в большинстве тканей организма.
Из-за своей повышенной кислотности карбоновые кислоты реагируют с основаниями с образованием ионных солей, как показано в следующих уравнениях. В случае гидроксидов щелочных металлов и простых аминов (или аммиака) образующиеся соли имеют ярко выраженный ионный характер и обычно растворимы в воде. Тяжелые металлы, такие как серебро, ртуть и свинец, образуют соли, имеющие более ковалентный характер (3-й пример), и растворимость в воде снижается, особенно для кислот, состоящих из четырех или более атомов углерода.
| RCO 2 H | + | NaHCO 3 | RCO 2 (-) Na (+) + CO 2 + H 2 O | |
| RCO 2 H | + | (CH 3 ) 3 N: | RCO 2 (-) (CH 3 ) 3 NH (+ ) | |
| RCO 2 H | + | AgOH | RCO 2 δ (-) Ag δ (+) + H 2 O |
Необычные жирные кислоты : Природа создала удивительное разнообразие производных жирных кислот.Чтобы увидеть некоторые из этих соединений, щелкните здесь.
Мыла и детергенты
Карбоновые кислоты и соли с алкильными цепями длиной более восьми атомов углерода демонстрируют необычное поведение в воде из-за присутствия как гидрофильных (CO 2 ), так и гидрофобных (алкильных) участков в одной и той же молекуле. Такие молекулы называют амфифильными (греч. Amphi = обе) или амфифильными .
Жирные кислоты, состоящие из десяти или более атомов углерода, почти не растворяются в воде и из-за своей более низкой плотности плавают на поверхности при смешивании с водой.В отличие от парафина или других алканов, которые имеют тенденцию образовывать лужу на поверхности воды, эти жирные кислоты равномерно распределяются по протяженной поверхности воды, в конечном итоге образуя мономолекулярный слой, в котором полярные карбоксильные группы связаны водородными связями на границе раздела с водой, а углеводородные цепи выровнены вместе вдали от воды. Это поведение показано на диаграмме справа. Вещества, которые накапливаются на поверхности воды и изменяют свойства поверхности, называются поверхностно-активными веществами .
Соли щелочных металлов и жирных кислот более растворимы в воде, чем сами кислоты, и амфифильный характер этих веществ также делает их сильными поверхностно-активными веществами. Наиболее распространенными примерами таких составов являются мыла и моющие средства, четыре из которых показаны ниже. Обратите внимание, что каждая из этих молекул имеет неполярную углеводородную цепь, «хвост» и полярную (часто ионную) «головную группу». Использование таких соединений в качестве чистящих средств облегчается их поверхностно-активным характером, который снижает поверхностное натяжение воды, позволяя ей проникать и смачивать различные материалы.
Очень небольшие количества этих поверхностно-активных веществ растворяются в воде, давая беспорядочную дисперсию растворенных молекул. Однако при увеличении концентрации происходит любопытное изменение. Молекулы поверхностно-активного вещества обратимо собираются в полимолекулярные агрегаты, называемые мицеллами . Собирая гидрофобные цепи вместе в центре мицеллы, разрушение структуры водородных связей жидкой воды сводится к минимуму, и полярные головные группы распространяются в окружающую воду, где они участвуют в водородных связях.Эти мицеллы часто имеют сферическую форму, но могут также принимать цилиндрические и разветвленные формы, как показано справа. Здесь группа полярных голов обозначена синим кружком, а неполярный хвост — зигзагообразной черной линией.Анимированное изображение мицеллообразования представлено ниже. Обратите внимание на коричневатый материал в центре трехмерного рисунка слева. Это иллюстрирует второй важный фактор, способствующий использованию этих амфифилов в качестве чистящих средств. Мицеллы способны инкапсулировать неполярные вещества, такие как жир, в своем гидрофобном центре и, таким образом, солюбилизировать его, поэтому он удаляется с водой для стирки.Поскольку мицеллы анионных амфифилов имеют отрицательно заряженную поверхность, они отталкиваются друг от друга, и неполярная грязь эффективно эмульгируется. Подводя итог, можно сказать, что присутствие мыла или детергента в воде облегчает смачивание всех частей очищаемого объекта и удаляет нерастворимую в воде грязь за счет включения в мицеллы . Если анимация остановилась, ее можно перезапустить, щелкнув по ней.
Самым старым амфифильным чистящим средством, известным людям, является мыло.Мыло производится путем катализируемого основанием гидролиза (омыления) животного жира (см. Ниже). Прежде чем гидроксид натрия стал коммерчески доступным, использовали кипящий раствор карбоната калия, выщелоченного из древесной золы. Затем мягкие калиевые мыла были преобразованы в более твердые натриевые мыла путем промывания солевым раствором. Важность мыла для человеческой цивилизации задокументирована историей, но были признаны некоторые проблемы, связанные с его использованием. Одна из них вызвана слабой кислотностью (pK a ca.4.9) жирных кислот. Растворы мыл щелочных металлов являются слабощелочными (pH от 8 до 9) из-за гидролиза. Если pH мыльного раствора понижается из-за кислых примесей, нерастворимые жирные кислоты выпадают в осадок и образуют пену. Вторая проблема вызвана наличием солей кальция и магния в водопроводной воде (жесткая вода). Эти двухвалентные катионы вызывают агрегацию мицелл, которые затем осаждаются в виде грязной пены.
Эти проблемы были решены разработкой синтетических амфифилов, называемых детергентами (или синдетами).При использовании более сильной кислоты для группы полярных голов водные растворы амфифила менее чувствительны к изменениям pH. Также сульфонатные функции, используемые практически для всех анионных детергентов, придают большую растворимость мицеллам, содержащим щелочноземельные катионы, присутствующие в жесткой воде. Вариации на тему амфифилов привели к развитию других классов, таких как катионные и неионные детергенты, показанные выше. Катионные детергенты часто проявляют бактерицидные свойства, а их способность изменять поверхностный pH сделала их полезными в качестве смягчителей тканей и кондиционеров для волос.Эти универсальные химические «инструменты» кардинально изменили рынок чистящих средств для дома и личной гигиены за последние пятьдесят лет.
Жиры и масла
Триэфиры жирных кислот с глицерином (1,2,3-тригидроксипропан) составляют класс липидов, известных как жиры и масла. Эти триглицеридов (или триацилглицерины) содержатся как в растениях, так и в животных, и составляют одну из основных пищевых групп нашего рациона. Триглицериды, которые являются твердыми или полутвердыми при комнатной температуре, классифицируются как жиры и встречаются преимущественно у животных.Те триглицериды, которые являются жидкими, называются маслами и происходят в основном из растений, хотя триглицериды из рыбы также в основном представляют собой масла. Некоторые примеры состава триглицеридов из различных источников приведены в следующей таблице.
Насыщенные кислоты (%) | Ненасыщенные кислоты (%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Источник | C 10 и менее | C 12 лауриновая | 14 C 16 пальмитиновый | C 18 стеариновый | C 18 олеиновый | C 18 линолевая | C 180ненасыщенный 980 Масло | 15 | 2 | 11 | 30 | 9 | 27 | 4 | 1 | лярд | — | — | 1 | 1 | 1 27 | 15 | 48 | 6 | 2 | человек fa т | — | 1 | 3 | 25 | 8 | 46 | 10 | 3 | сельдевое масло | — | — | 7 | 12 | 1 | 2 | 1 | 2 | 20 | 52 | Растительные масла кокосовое | — | 50 | 18 | 8 | 2 | 6 | 1 | — | кукуруза — | — | 1 | 10 | 3 | 50 | 34 | — | оливковый | — | — | — | 7 | 2 | 85 | 5 | — | ладонь | — | — | 2 | 41 | 5 | 43901 05 | 7 | — | арахис | — | — | — | 8 | 3 | 56 | 26 | 7 | сафлоровый | — | — | — | — | 3 | 3 | 19 | 76 | — | | ||||||||||
Как можно было ожидать, исходя из свойств жирных кислот, жиры имеют преобладание над насыщенными жирными кислотами, а масла в основном состоят из ненасыщенных кислот.Таким образом, температуры плавления триглицеридов отражают их состав, как показано в следующих примерах. Природные смешанные триглицериды имеют несколько более низкие температуры плавления, температура плавления сала составляет около 30 ° C, тогда как оливковое масло плавится около -6 ° C.Поскольку жиры ценятся над маслами для некоторых жителей Северной Европы и Северной Америки, растительные масла подвергаются интенсивной переработке в твердые триглицериды (например, Crisco) путем частичного гидрирования их ненасыщенных компонентов. Некоторые из оставшихся двойных связей изомеризуются (в транс) в этой операции.Эти насыщенные и трансжирные глицериды в рационе связаны с долгосрочными проблемами со здоровьем, такими как атеросклероз.
Триглицериды, имеющие три идентичные ацильные цепи, такие как тристеарин и триолеин (см. Выше), называются «простыми», а те, которые состоят из различных ацильных цепей, называются «смешанными». Если ацильные цепи в концевых гидроксильных группах (1 и 3) глицерина различны, центральный углерод становится хиральным центром, и необходимо распознавать энантиомерные конфигурации.
Гидрирование растительных масел для производства полутвердых продуктов имело непредвиденные последствия. Хотя гидрирование придает желательные свойства, такие как растекаемость, текстура, «ощущение во рту» и увеличенный срок хранения, естественно жидким растительным маслам, оно создает некоторые серьезные проблемы для здоровья. Это происходит, когда цис-двойные связи в цепях жирных кислот не полностью насыщаются в процессе гидрирования. Катализаторы, используемые для добавления водорода, изомеризуют оставшиеся двойные связи до их транс-конфигурации.Эти неестественные транс-жиры , по-видимому, связаны с увеличением сердечных заболеваний, раком, диабетом и ожирением, а также с иммунным ответом и репродуктивными проблемами. |
Воски
Воски представляют собой сложные эфиры жирных кислот с одноатомными спиртами с длинной цепью (одна гидроксильная группа). Природные воски часто представляют собой смеси таких сложных эфиров и могут также содержать углеводороды. Формулы трех хорошо известных восков приведены ниже, причем фрагмент карбоновой кислоты окрашен в красный цвет, а спирт — в синий цвет.
спермацет | пчелиный воск | карнубский воск | ||
|---|---|---|---|---|
CH 3 (CH 2 ) 14 — CO 2997 ) 15 CH 3 | CH 3 (CH 2 ) 24 CO 2 — (CH 2 ) 29 CH 3 | CH 3 (CH 2 ) 30 CO 2 — (CH 2 ) 33 CH 3 |
Воски широко распространены в природе.Листья и плоды многих растений имеют восковой налет, который может защитить их от обезвоживания и мелких хищников. Перья птиц и мех некоторых животных имеют похожие покрытия, которые служат водоотталкивающими средствами. Карнубский воск ценится за прочность и водостойкость.
Фосфолипиды
Фосфолипиды являются основными составляющими клеточных мембран. Они напоминают триглицериды тем, что представляют собой сложноэфирные или амидные производные глицерина или сфингозина с жирными кислотами и фосфорной кислотой.Фосфатный фрагмент полученной фосфатидной кислоты дополнительно этерифицируется этаноламином, холином или серином в самом фосфолипиде. На следующей диаграмме показаны структуры некоторых из этих компонентов. Щелчок по диаграмме изменит ее, чтобы отобразить структуры для двух репрезентативных фосфолипидов. Обратите внимание, что компоненты жирных кислот (R&R ‘) могут быть насыщенными или ненасыщенными.
Чтобы увидеть модель фосфолипида, щелкните здесь .
Как ионные амфифилы, фосфолипиды агрегируют или самоорганизуются при смешивании с водой, но иначе, чем мыла и детергенты.Из-за двух боковых алкильных цепей, присутствующих в фосфолипидах, и необычных смешанных зарядов в их головных группах образование мицелл неблагоприятно по сравнению с двухслойной структурой. Если фосфолипид размазать по небольшому отверстию в тонком куске пластика, погруженного в воду, в отверстии создается стабильный плоский бислой из молекул фосфолипидов. Как показано на следующей диаграмме, полярные головные группы на гранях бислоя контактируют с водой, а гидрофобные алкильные цепи образуют неполярную внутреннюю часть.Молекулы фосфолипидов могут перемещаться в своей половине бислоя, но существует значительный энергетический барьер, предотвращающий миграцию на другую сторону бислоя. Чтобы увидеть увеличенный сегмент бислоя фосфолипидов, щелкните здесь .
Эта двухслойная мембранная структура также встречается в агрегатных структурах, называемых липосомами . Липосомы представляют собой микроскопические везикулы, состоящие из водного ядра, заключенного в один или несколько слоев фосфолипидов. Они образуются, когда фосфолипиды энергично смешивают с водой.В отличие от мицелл, липосомы имеют как внутреннюю, так и внешнюю водную поверхность.
Клетка может считаться очень сложной липосомой. Двухслойная мембрана, которая отделяет клетку изнутри от окружающих жидкостей, в основном состоит из фосфолипидов, но включает в себя многие другие компоненты, такие как холестерин, которые способствуют ее структурной целостности. Белковые каналы, которые позволяют транспортировать различные виды химических веществ в клетку и из клетки, также являются важными компонентами клеточных мембран.Очень красивое динамическое отображение канала грамицидина было создано совместными усилиями ученых из Канады, Франции, Испании и США, и его можно изучить, нажав здесь.
Внутри клетки есть множество структур (органелл), которые проводят химические операции, жизненно важные для существования клетки. Молекулы, прикрепленные к поверхности клеток, служат для идентификации конкретных клеток и облегчения взаимодействия с внешними химическими объектами. Сфингомиелины также являются липидами мембран.Они являются основным компонентом миелиновой оболочки, окружающей нервные волокна. Рассеянный склероз — разрушительное заболевание, при котором миелиновая оболочка теряется, вызывая в конечном итоге паралич.
Простагландины Тромбоксаны и лейкотриены
Члены этой группы структурно родственных природных гормонов обладают необычайным спектром биологических эффектов. Они могут снизить секрецию желудка, стимулировать сокращения матки, снизить кровяное давление, влиять на свертывание крови и вызывать аллергические реакции, подобные астме.Поскольку их происхождение в тканях организма связано с метаболизмом незаменимой жирной кислоты арахадоновой кислоты (5,8,11,14-эйкозатетраеновая кислота), они классифицируются как эйкозаноидов . Многие свойства обычного лекарственного препарата аспирин являются результатом его воздействия на каскад реакций, связанных с этими гормонами.
Метаболические пути, с помощью которых арахидоновая кислота превращается в различные эйкозаноиды, сложны и здесь не рассматриваются. Ниже приводится приблизительный набросок некоторых происходящих преобразований.Полезно рассматривать арахадоновую кислоту в спиральной конформации, показанной в заштрихованной рамке.
Лейкотриен А является предшественником других производных лейкотриена по реакциям раскрытия эпоксида. Простагландины получили систематические названия, отражающие их структуру. Первоначально образованный пероксид PGH 2 является обычным промежуточным продуктом для других простагландинов, а также тромбоксанов, таких как TXA 2 . Чтобы увидеть модель простагландина PGE 2 Щелкните здесь .
Терпены
Соединения, классифицируемые как терпены, составляют, возможно, самый большой и разнообразный класс натуральных продуктов. Большинство этих соединений содержится только в растениях, но некоторые из более крупных и сложных терпенов (например, сквален и ланостерин) встречаются у животных. Известны терпены, включающие в себя большинство общих функциональных групп, поэтому это не дает полезного средства классификации. Напротив, окончательной характеристикой является количество и структурная организация атомов углерода.Терпены можно рассматривать как состоящие из изопреновых (точнее, изопентановых) звеньев, эмпирическая особенность, известная как правило изопрена . По этой причине терпены обычно имеют 5n атомов углерода (n — целое число) и подразделяются следующим образом:
Классификация | Изопреновые единицы | Атомы углерода | ||
|---|---|---|---|---|
монотерпены |
| C 10 | ||
сесквитерпены | 3 | C 15 | ||
дитерпены | 10 4 | 10 4 | 5 | C 25 |
тритерпены | 6 | C 30 |
Сам изопрен, выделяемый углеводородом C 5 H 8 , газообразный листья различных растений как естественный побочный продукт метаболизм растений.После метана это наиболее распространенное летучее органическое соединение, содержащееся в атмосфере. Примеры терпенов C 10 и выше, представляющих четыре наиболее распространенных класса, показаны на следующей диаграмме. Первоначальный показ — монотерпены; терпены большего размера будут показаны при нажатии кнопки « Toggle Structures » под диаграммой. Большинство терпенов можно структурно разделить на изопентановые сегменты. Чтобы увидеть, как это делается, щелкните непосредственно на структурах на схеме.
Изопентановые звенья в большинстве этих терпенов легко различимы и обозначены заштрихованными областями. В случае монотерпеновой камфары элементы перекрываются до такой степени, что их легче различить по окраске углеродных цепей. То же самое и с альфа-пиненом. В случае тритерпенового ланостерина мы видим интересное отклонение от правила изопрена. Это соединение из тридцати атомов углерода, несомненно, является терпеном, и можно идентифицировать четыре из шести звеньев изопентана.Однако десять атомов углерода в центре молекулы нельзя разрезать таким образом. Существуют доказательства того, что две метильные группы, обведенные пурпурным и голубым кружками, переместились из своих первоначальных местоположений изопреноидов (отмеченных маленькими кружками того же цвета) на свое нынешнее местоположение. Эта перестройка описана в разделе биосинтеза. Подобные перегруппировки алкильных групп объясняют другие терпены, которые не строго следуют правилу изопрена.
Чтобы увидеть модель монотерпеновой камфоры, щелкните здесь .
Также были идентифицированы полимерные изопреноидные углеводороды. Каучук, несомненно, является самым известным и наиболее широко используемым составом такого типа. Он встречается в виде коллоидной суспензии, называемой латексом, у ряда растений, от одуванчика до каучукового дерева ( Hevea brasiliensis ). Каучук представляет собой полиен и демонстрирует все ожидаемые реакции функции C = C. Бром, хлористый водород и водород все добавляют со стехиометрией один молярный эквивалент на единицу изопрена.При озонолизе каучука образуется смесь левулиновой кислоты (CH 3 COCH 2 CH 2 CO 2 H) и соответствующего альдегида. При пиролизе каучука образуется диен-изопрен вместе с другими продуктами.
Все двойные связи в каучуке имеют конфигурацию Z , которая заставляет эту макромолекулу принимать изогнутую или спиральную форму. Это отражается на физических свойствах резины. Несмотря на свой высокий молекулярный вес (около миллиона), неочищенный латексный каучук представляет собой мягкое, липкое, эластичное вещество.Химическая модификация этого материала является нормой для коммерческого использования. Гуттаперча (структура выше) представляет собой встречающийся в природе E -изомер каучука. Здесь углеводородные цепи принимают однородную зигзагообразную или стержнеобразную форму, которая дает более твердое и прочное вещество. Использование гуттаперчи включает электрическую изоляцию и покрытие мячей для гольфа.
Чтобы увидеть модель резиновой цепи, щелкните здесь .
Стероиды
Важный класс липидов, называемый стероидами , на самом деле является метаболическими производными терпенов, но их обычно рассматривают как отдельную группу.Стероиды можно распознать по их тетрациклическому каркасу, состоящему из трех конденсированных шестичленных и одного пятичленного кольца, как показано на диаграмме справа. Четыре кольца обозначены буквами A, B, C и D, как уже отмечалось, а необычная нумерация атомов углерода в кольце (показанная красным) является результатом более раннего неправильного сопоставления структуры. Заместители, обозначенные R, часто являются алкильными группами, но также могут иметь функциональные группы. Группа R при слиянии кольца A: B чаще всего представляет собой метил или водород, а при слиянии C: D — обычно метил.Заместитель у C-17 значительно варьируется и обычно больше, чем метил, если он не является функциональной группой. Наиболее распространенное расположение функциональных групп — это C-3, C-4, C-7, C-11, C-12 и C-17. Кольцо А иногда бывает ароматическим. Поскольку ряд тетрациклических тритерпенов также имеют эту тетрациклическую структуру, ее нельзя рассматривать как уникальный идентификатор.
Стероиды широко распространены у животных, где они связаны с рядом физиологических процессов. Примеры некоторых важных стероидов показаны на следующей диаграмме.Различные виды стероидов будут отображены при нажатии кнопки « Toggle Structures » под диаграммой. Норэтиндрон — синтетический стероид, все другие примеры встречаются в природе. Обычная стратегия в фармацевтической химии состоит в том, чтобы взять природное соединение, имеющее определенные желаемые биологические свойства вместе с нежелательными побочными эффектами, и изменить его структуру для улучшения желаемых характеристик и уменьшения нежелательных. Иногда это достигается методом проб и ошибок.
Общая стероидная структура, изображенная выше, имеет семь хиральных стереоцентров (атомы углерода 5, 8, 9, 10, 13, 14 и 17), что означает, что она может иметь до 128 стереоизомеров. За исключением C-5, натуральные стероиды обычно имеют одну общую конфигурацию. Это показано на последнем из включенных дисплеев вместе с предпочтительными формами колец.
Химические исследования стероидов были очень важны для нашего нынешнего понимания конфигураций и конформаций шестичленных колец.Группы заместителей в разных участках тетрациклического скелета будут иметь аксиальную или экваториальную ориентацию, которая фиксируется из-за жесткой структуры трансконденсированных колец. Эта фиксированная ориентация влияет на химическую реактивность, в основном из-за большего пространственного затруднения аксиальных групп по сравнению с их экваториальными изомерами. Таким образом, экваториальная гидроксильная группа этерифицируется быстрее, чем ее аксиальный изомер.
Чтобы увидеть модель стероидного холестерина, щелкните здесь.
Поучительно изучить простую бициклическую систему в качестве модели конденсированных колец стероидной молекулы.Декалин, сокращение от декагидронафталина, существует в виде цис- и транс-изомеров на кольцевых атомах углерода слияния. Плоские представления этих изомеров нарисованы вверху следующей диаграммы, а соответствующие конформационные формулы показаны внизу. Нумерация атомов углерода в кольце соответствует правилам IUPAC и отличается от необычной нумерации, используемой для стероидов. Для целей обсуждения левое кольцо обозначено буквой A (синего цвета), а правое кольцо B (красного цвета). На конформационных чертежах кольцо слияния и угловатые атомы водорода черные.
Транс-изомер описать проще всего, потому что слияние колец A и B создает жесткую, примерно плоскую структуру, состоящую из двух конформаций кресел. Каждое кресло соединено с другим экваториальными связями, в результате чего угловые атомы водорода (H a ) осевые по отношению к обоим кольцам. Обратите внимание на то, что связи, направленные над плоскостью двух колец, чередуются от осевых к экваториальным и обратно, если мы обходим кольца от C-1 до C-10 в числовом порядке. Связи, направленные ниже колец, также дополняют друг друга.
Конформационные описания цис-декалина усложняются тем фактом, что возможны два энергетически эквивалентных слияния циклогексанов стула, и они находятся в быстром равновесии, когда кольца переключаются с одной конформации стула на другую. В каждой из этих конформаций кресел кольца соединены одной осевой и одной экваториальной связью, и вся структура изогнута при слиянии колец. В конформере слева красное кольцо (B) присоединено к синему кольцу (A) аксиальной связью с C-1 и экваториальной связью с C-6 (эти термины относятся к заместителям кольца A).В конформере справа углеродная связь с C-1 экваториальная, а связь с C-6 аксиальная. Каждый из угловых атомов водорода (H ae или H ea ) ориентирован аксиально по отношению к одному из колец и экваториально по отношению к другому. Это соотношение меняется на противоположное, когда двойное перевороты кольца превращает один цис-конформер в другой.
Цис-декалин менее стабилен, чем транс-декалин, примерно на 2,7 ккал / моль (по данным теплоты сгорания и теплоты изомеризации). Это происходит из-за стерического скопления (препятствия) аксиальных водородов в вогнутой области обоих цис-конформеров, что можно увидеть на дисплее модели, активируемом следующей кнопкой.Эта разница примерно в три раза больше энергии конформера гош-бутана по сравнению с его анти-конформером. Действительно, в каждой из конформаций цис-декалина могут быть идентифицированы три гош-бутановых взаимодействия, что будет показано при нажатии на приведенную выше конформационную диаграмму. Эти грубые взаимодействия также показаны в модели.
Чтобы увидеть модели цис- и транс-декалина, щелкните здесь.
Стероиды, в которых кольца A и B слиты с цис-соединением, такие как пример справа, не обладают такой конформационной подвижностью, которую демонстрирует цис-декалин.Слияние кольца C с кольцом B в транс-конфигурации предотвращает конформационный переворот кольца B в другую форму кресла. Если бы это произошло, кольцо C пришлось бы прикрепить к кольцу B двумя смежными осевыми связями, расположенными на 180º друг от друга. Это слишком большое расстояние, чтобы его могли преодолеть четыре атома углерода, составляющие кольцо C. Следовательно, молекула стероида заблокирована в конформации «все кресло», показанной здесь. Конечно, все эти стероиды и декалины могут иметь одно или несколько шестичленных колец в конформации лодочки.Однако высокая энергия конформеров лодок по сравнению со стульями может сделать такие структуры второстепенными компонентами в общем ансамбле конформаций, доступных для этих молекул.
Жирорастворимые витамины
Основные пищевые вещества, называемые витаминами , обычно классифицируются как «водорастворимые» или «жирорастворимые». Водорастворимые витамины, такие как витамин С, быстро выводятся из организма, и их диетические уровни должны быть относительно высокими. Рекомендуемая суточная доза витамина С составляет 100 мг, а от 2 до 3 г многие люди принимают без побочных эффектов.Жирорастворимые витамины, показанные на диаграмме ниже, не так легко выводятся и могут накапливаться до токсичных уровней при употреблении в большом количестве. Рекомендуемая суточная норма потребления этих витаминов:
Витамин A 800 мкг (верхний предел около 3000 мкг)
Витамин D от 5 до 10 мкг (верхний предел около 2000 мкг)
Витамин E 15 мг (верхний предел около 1 г)
Витамин К 110 мкг (верхний предел не указан)
Из этих данных ясно, что витамины A и D, хотя и необходимы для хорошего здоровья в надлежащих количествах, могут быть очень токсичными.Например, витамин D используется в качестве крысиного яда, и в том же весе он более чем в 100 раз ядовитее цианида натрия.
Из структур, показанных здесь, должно быть ясно, что эти соединения имеют более чем растворимую связь с липидами. Витамины А — это терпен, а витамины Е и К имеют длинные терпеновые цепи, присоединенные к ароматической части. Структуру витамина D можно описать как стероид, в котором кольцо B разрезано, а остальные три кольца остаются неизменными.Предшественники витаминов A и D были идентифицированы как тетратерпен-бета-каротин и стероидный эргостерин соответственно. Структуры для них будут отображены при нажатии на диаграмму витаминов выше .
Биосинтез
Сложные органические соединения, обнаруженные в живых организмах на этой планете, происходят из фотосинтеза, эндотермической восстановительной конденсации углекислого газа, требующей световой энергии и пигмента хлорофилла.
x CO 2 + x H 2 O + энергия C x H 2x O x + x O 2 |
Продуктами фотосинтеза являются: класс соединений, называемых углеводами, наиболее распространенным и важным из которых является глюкоза (C 6 H 12 O 6 ).Последующие реакции вызывают окислительное расщепление глюкозы до пировиноградной кислоты (CH 3 COCO 2 H), которая, в свою очередь, преобразуется в двухуглеродный строительный блок, ацетат. Множество описанных здесь липидных структур построено из ацетата путем ферментативных реакций, которые во многих отношениях соответствуют реакциям, используемым химиками для лабораторного синтеза подобных соединений. Однако важным ограничением является то, что реагенты и условия должны быть совместимы с водной средой, нейтральным pH и умеренными температурами, обнаруженными в живых клетках.Следовательно, в реакциях конденсации, алкилирования, окисления и восстановления, которые осуществляют биосинтез липидов, не будут использоваться очень сильные основания, алкилгалогениды, хроматные окислители или восстановители гидридов металлов, которые используются в лабораторной работе.
1. Конденсация
Конденсация Клайзена этилацетата (или других ацетатных эфиров) дает ацетоацетатный эфир, как показано верхним уравнением на следующей диаграмме. Восстановление, дегидратация и дальнейшее восстановление этого продукта приведет к получению сложного эфира масляной кислоты, при этом общий эффект заключается в удлинении ацетатного исходного материала на два атома углерода.В принципе, повторение этой последовательности привело бы к кислотам с более длинной цепью, состоящим из четного числа атомов углерода. Поскольку большинство обычных природных жирных кислот имеют четное число атомов углерода, это привлекательная гипотеза для их биосинтеза.
Природное решение для проведения конденсации типа Клейзена в живой клетке показано в нижнем уравнении диаграммы. Тиоэфиры более активны в качестве акцепторных реагентов, чем обычные сложные эфиры, и предварительное преобразование ацетата в малонат увеличивает донорную реактивность этого вещества.Тиоловая часть сложного тиоэфира обычно представляет собой белок какого-либо вида, с эффективным переносом ацетила, происходящим посредством ацетилкофермента А. В зависимости от задействованных ферментов продукт конденсации может быть восстановлен, а затем удлинен, чтобы образовать жирные кислоты (как показано), или удлиняется за счет дальнейшей конденсации до поликетоновых промежуточных продуктов, которые являются предшественниками множества природных фенольных соединений. Щелкните диаграмму, чтобы увидеть примеры конденсации поликетонов.
Стадии восстановления (обозначенные [H] в уравнениях) и промежуточные дегидратации, необходимые для синтеза жирных кислот, требуют уникальных коферментов и фосфорилирующих реагентов.Пиридиновое кольцо никотинамидадениндинуклеотида (НАД) и его 2′-фосфатное производное (НАДФ) действуют как акцепторы гидридов, а соответствующие восстановленные частицы (НАДН и НАДФН) как доноры гидридов. Частичные структуры этих важных окислительно-восстановительных реагентов показаны справа. Полные структуры можно увидеть, щелкнув частичные формулы.
Как отмечалось ранее, гидроксильная группа является плохой анионной уходящей группой (гидроксид-анион является сильным основанием). Фосфорилирование превращает гидроксильную группу в сложный эфир фосфата (PO 4 ) или пирофосфата (P 2 O 7 ), что делает ее намного лучше уходящей группой (pK a s при pH около 7: 7.2 и 6,6 соответственно). Основными биологическими реагентами фосфорилирования являются фосфатные производные аденозина (соединение рибозы). Самым сильным из них является трифосфатный АТФ, дифосфат и монофосфат менее эффективны. Формулы для этих соединений можно увидеть, щелкнув здесь
Полный процесс синтеза жирных кислот для пальмитиновой кислоты, CH 3 (CH 2 ) 14 CO 2 H, суммирован в следующем уравнении:
8 CH 3 CO-CoA + 14 NADPH + 14 H (+) + 7 ATP + H 2 O CH 3 (CH 2 ) 14 CO 2 H + 8 CoA + 14 NADP (+) + 7 ADP + 7 H 2 PO 4 (-) |
2.Алкилирование
Разветвленные цепные и циклические структуры терпенов и стероидов построены последовательными реакциями алкилирования ненасыщенных изопентилпирофосфатных звеньев. Как изображено на следующей диаграмме, эти 5-углеродные реагенты получают из трех ацетатных звеньев путем альдолоподобного добавления малонатного промежуточного соединения к ацетоацетату. Селективный гидролиз и восстановление дает ключевой промежуточный продукт, называемый мевалоновой кислотой . Затем при фосфорилировании и удалении мевалоновой кислоты образуется изопентенилпирофосфат, который находится в равновесии с его изомером с двойной связью, диметилаллилпирофосфатом.Аллильная пирофосфатная группа в последнем соединении вступает в реакцию с ферментативно катализируемыми реакциями алкилирования, такими как та, что показана в зеленой рамке. Это подтверждает эмпирическое правило изопрена.
Простейший способ объединения изопентановых звеньев называется «голова к хвосту». Эта комбинация отображается в зеленом поле, и эти термины дополнительно определены в верхнем уравнении, которое появится выше при нажатии кнопки « Toggle examples ».Также наблюдается соединение изопентановых звеньев, не связанное «голова к хвосту», как в конструкции хризантемовой кислоты, показанной во втором уравнении. Второй щелчок по диаграмме отображает серию катионоподобных циклизаций и перегруппировок, известных как гипотеза Сторка-Эшенмозера, которые были идентифицированы при биосинтезе тритерпенового ланостерина. Ланостерин является предшественником биосинтеза стероидов. Это происходит путем метаболического удаления трех метильных групп и разрушения боковой цепи.
3. Альтернативный синтез изопреноидов
В течение многих лет путь мевалоновой кислоты к изопентенилпирофосфату считался эксклюзивным путем биосинтеза. Недавно была идентифицирована альтернативная последовательность реакций, начиная с пировиноградной кислоты и глицеральдегид-3-фосфата (нижние уравнения на следующей диаграмме). Помечая селективные атомы углерода (окрашены в красный цвет), эти отдельные пути легко различить. Новый путь DXP (1-дезоксиксилулозо-5-фосфат) широко распространен в микроорганизмах и терпенах хлоропластов.Перегруппировка до 2-метилэритритол-4-фосфата представляет собой необычное преобразование.
Почему мыло легко удаляет жиры с металлических и стеклянных изделий, но не с пластика? Tom
Прежде всего — это правильное наблюдение, ведь такая проблема действительно существует: мыть пластиковую посуду от жира, в отличие от стеклянных, более утомительно и часто требует нескольких циклов мытья. На самом деле, даже нескольких таких стирок может быть недостаточно, чтобы избавить пластик от ощущения «жирности», как будто он все еще покрыт тонким слоем жира.
Чтобы понять, почему это происходит, нужно понимать, как работают мыла (или детергенты / поверхностно-активные вещества). Вообще говоря, мыло удаляет грязь и жиры, делая их растворимыми в воде.
Для растворения материала он должен обладать определенными химическими свойствами с растворителем, особенно в отношении его полярности (разделение электрического заряда): полярные соединения имеют тенденцию растворяться в полярных растворителях (например, обычная поваренная соль, которая является высокополярным соединением. состоит из ионов или заряженных атомов, хорошо растворяется в воде, которая также очень полярна).Верно и обратное: неполярные соединения растворяются в неполярных растворителях (например, косметика для лица, которая содержит в основном неполярные органические соединения, которые не растворяются в воде, но хорошо растворяются в жидком парафине, который представляет собой смесь неполярных веществ). -полярные соединения (так что с помощью жидкого парафина очень легко удалить макияж). Для получения дополнительной информации по этой теме обратитесь к разделу «Что определяет растворимость материалов?».
Вода и масло очень различаются по полярности и поэтому не растворяются друг в друге.Мыло — уникальные соединения, потому что молекулы мыла содержат небольшой полярный конец (известный как полярная голова) и длинный неполярный хвост:
Из-за двух различных частей молекулы молекула мыла растворима в воде и в то же время может растворять жиры. Жиры притягиваются к неполярной хвостовой части мыла, в то время как полярная голова заставляет весь комплекс (молекулы мыла + жира) растворяться в воде.
Очистка пластика от жиров — намного более сложная задача для мыла, поскольку пластики химически похожи на жиры.Основное отличие состоит в том, что жиры содержат цепочки из примерно 20 атомов углерода, связанных друг с другом, тогда как в пластмассах эти цепи длиннее. Как и в принципе растворимости, подобные молекулы имеют сильные силы притяжения между собой. Это приводит к своего рода перетягиванию каната между мылом и пластиком, когда пластик пытается удержать жиры, а мыло пытается растворить его в воде. Вот почему для удаления жира из пластика требуется гораздо больше усилий, чем для удаления жира из стекла или металла.Стекло, которое покрыто полярными оксидами кремния, и металлическая поверхность образуют гораздо более слабые силы притяжения с жирами.
Справа: похожие молекулярные структуры мыла, жира и пластика (мыло и пластик конкурируют за жир). Слева: соревнование по перетягиванию каната в ВМС США (из Википедия ).
Кстати, тефлоновое покрытие было разработано по правилам химии, описанным выше. Тефлон, или общее название политетрафторэтилен, химически отличается как от воды, так и от масла.Он покрыт химически инертными атомами фтора, поэтому к нему почти ничего не прилипает.
Доктор Ави Сайг
Институт естественных наук Дэвидсона
Научный институт Вейцмана
Примечание для читателя
Если вы находите эти объяснения недостаточно ясными или у вас есть дополнительные вопросы по этой теме, напишите об этом на нашем форуме, и мы ответим на ваши комментарии. Ваши предложения и конструктивная критика всегда приветствуются.
Мыло
Введение:
Мыло представляет собой смесь натриевых солей различных природных жирные кислоты. Пузырьки воздуха, добавленные в расплавленное мыло, уменьшатся плотность мыла, поэтому оно будет плавать в воде. Если соль жирных кислот содержит калий, а не натрий, более мягкая пена это результат.
Мыло получают в результате реакции омыления или основного гидролиза. жира или масла.В настоящее время карбонат натрия или гидроксид натрия используется для нейтрализации жирной кислоты и превращения ее в соль.
Общая общая реакция гидролиза:
жир + NaOH —> глицерин + натриевая соль жирной кислоты
Хотя реакция показана как одностадийная, она это фактически два шага. Чистый эффект, поскольку сложноэфирные связи сломаны. Глицерин снова превращается в спирт (добавление зеленых H).Часть жирных кислот превращается в соль из-за наличия основного раствора NaOH. в карбоксильная группа, один кислород (красный) теперь имеет отрицательный заряд, который привлекает положительный ион натрия.
Типы мыла: Тип жирной кислоты и длина углеродная цепь определяет уникальные свойства различных мыло. Сала или животные жиры дают в первую очередь стеарат натрия (18 углерода) очень твердое, нерастворимое мыло.Жирные кислоты с более длинными цепи еще более нерастворимы. На самом деле стеарат цинка используется в тальке, потому что он водоотталкивающий.
Кокосовое масло является источником лауриновой кислоты (12 атомов углерода), которая может быть преобразован в лаурат натрия. Это мыло очень растворимое и легко пенится даже в морской воде.
Жирные кислоты, содержащие всего 10 атомов углерода или меньше, не используются в мыло, потому что оно раздражает кожу и имеет неприятный запах.
Глава 4. Липиды и жирные кислоты
Глава 4. Липиды и жирные кислоты1. ВВЕДЕНИЕ
2. СОСТАВ ЖИРНЫХ КИСЛОТ РЫБЫ
3. ЛИПИДНЫЙ СОСТАВ ТЕЛА И ТРЕБОВАНИЯ К ПИЩЕВЫМ ЛИПИДАМ
4. ПОЛИНЕНАСЫЩЕННЫЕ ТРЕБОВАНИЯ РЫБЫ В ЖИРНЫХ КИСЛОТАХ
5. ВАЖНЕЙШИЕ ПОТРЕБНОСТИ РЫБЫ В ЖИРНЫХ КИСЛОТАХ
6. МЕТАБОЛИЗМ ЖИРНЫХ КИСЛОТ В РЫБЕ
7.ОТРИЦАТЕЛЬНЫЙ АСПЕКТЫ ЛИПИДОВ В ПИТАНИИ РЫБ
8. ССЫЛКИ
J. E. Halver
Вашингтонский университет
Сиэтл, Вашингтон
Липиды — это общие названия, присвоенные группе жирорастворимых соединений, обнаруживаемых в тканях растений и животных: и широко классифицируются как: а) жиры, б) фосфолипиды, в) сфингомиелины, г) воски и д) стерины. .
Жиры представляют собой сложные эфиры жирных кислот глицерина и являются основными запасами энергии животных.Они используются для долгосрочной потребности в энергии в периоды интенсивных тренировок или в периоды недостаточного питания и потребления энергии. Рыбы обладают уникальной способностью легко усваивать эти соединения и, как следствие, могут существовать в течение длительных периодов времени в условиях отсутствия пищи. Типичный пример — это многие недели миграции лососей, возвращающихся вверх по течению на нерест; накопленные липидные отложения сжигаются в качестве топлива, позволяя процессам организма продолжаться во время напряженного путешествия.
Фосфолипиды представляют собой сложные эфиры жирных кислот и фосфатидной кислоты. Это основные липиды, составляющие клеточные мембраны, позволяющие поверхностям мембран быть гидрофобными или гидрофильными в зависимости от ориентации липидных соединений во внутри- или внеклеточном пространстве.
Сфингомиелины представляют собой сложные эфиры жирных кислот сфингозина и присутствуют в соединениях головного мозга и нервной ткани.
Воски представляют собой сложные эфиры жирных кислот и длинноцепочечных спиртов.Эти соединения могут метаболизироваться с получением энергии и придавать физические и химические характеристики за счет накопленных липидов некоторых растений и некоторых соединений животного происхождения.
Стерины представляют собой полициклические длинноцепочечные спирты и действуют как компоненты нескольких гормональных систем, особенно при половом созревании и физиологических функциях, связанных с полом.
Жирные кислоты могут существовать в виде компонентов с прямой или разветвленной цепью; многие рыбные жиры содержат многочисленные ненасыщенные двойные связи в структурах жирных кислот.Краткое обозначение облигации. жирные кислоты будут использоваться повсюду, где число w определяет положение первой двойной связи, считая от метильного конца. Линоленовая кислота будет написана 18: 3w 3. Первое число определяет количество атомов углерода; второе число — количество двойных связей; и последнее число, положение двойных связей.
Было опубликовано много обзоров по кормлению рыб, которые содержат информацию о потребностях в липидах. Большая часть работы по изучению потребностей рыб в липидах была проведена с лососевыми.Радужная форель имеет потребность в незаменимых жирных кислотах (EFA) для линоленовой кислоты серии w 3 1 , а не для линоленовой кислоты или w 6, как того требует большинство млекопитающих. Основной упор на потребности в липидах был сделан на EFA и энергетической ценности липидов.
2.1 Влияние окружающей среды
2.2 Влияние диеты
2.3 Сезонные колебания
2.1 Влияние окружающей среды
2.1.1 Соленость
На различие жирнокислотного состава морской и пресноводной рыбы отмечали несколько авторов.Некоторые примеры структуры жирных кислот приведены в таблице 1. Хотя эти рыбные липиды содержат больше жирных кислот w 3, ясно, что пресноводная рыба имеет более высокие уровни жирных кислот w 6, чем морские виды. Среднее соотношение w 6 / w 3 составляет 0,37 и 0,16 для пресноводных и морских рыб соответственно. Рыба в целом содержит больше w 3, чем w 6 полиненасыщенных жирных кислот (ПНЖК) и должна иметь более высокие диетические потребности в w 3 ПНЖК; таким образом, потребность морской рыбы в w 3 ПНЖК в ОЖК может быть выше, чем у пресноводных рыб.
Таблица 1 — Сравнение содержания жирных кислот общего липида из цельной рыбы или мяса пресноводных и морских видов 1/
Такое же различие в соотношении w 6 / w 3 между пресной и морской водой наблюдается, когда некоторые виды рыб мигрируют из океанов в ручьи или наоборот. Соотношение ПНЖК сладкой корюшки ( Plecoglosus altivelis ) резко меняется всего за один месяц по мере их миграции из моря в пресноводную реку.Аналогичное, но обратное изменение происходит у лосося масу ( Oncorhynchus masu ), когда они мигрируют из пресной воды в морскую. Даже в пределах одного и того же вида рыб соленость воды, кажется, вызывает резкое изменение структуры жирных кислот.
Разница между морской и пресноводной рыбой может быть связана просто с различиями в содержании жирных кислот в рационе или может быть связана с особыми потребностями рыб, связанными с физиологической адаптацией к окружающей среде.Фосфолипиды обычно считаются структурными или функциональными липидами, которые в значительной степени включены в мембранную структуру клеточных и субклеточных частиц. Триглицериды чаще представляют собой запасные липиды и в большей степени отражают жирнокислотный состав рациона, чем фосфолипиды. В Таблице 2 представлены составы жирных кислот триглицеридной и фосфолипидной фракций липидов рыб. Можно видеть, что влияние изменения окружающей среды на состав жирных кислот фосфолипида так же велико в случае лосося и значительно больше в случае сладкой корюшки, чем на состав триглицеридов.Радужная форель в рационе, содержащем кукурузное масло с высоким содержанием w 6 и низким содержанием w 6 ПНЖК, показала более высокую смертность и снижение роста в морской воде, чем в пресной воде, в течение двенадцатинедельного периода кормления.
2.1.2 Температура
Есть несколько других факторов, помимо солености воды, которые влияют на состав жирных кислот и особенно ПНЖК рыбы. В таблицах 1 и 2 можно увидеть, что лососевые, даже в пресной воде, имеют тенденцию иметь более высокое общее содержание ПНЖК с длиной углеродной цепи 20 и 22 и более низкое отношение w 6 / w 3, чем у других рыб.Лососевые — в основном холодноводные рыбы. Жирные кислоты ряда морских животных из умеренных и арктических вод демонстрируют некоторые существенные различия в общей структуре; к сожалению, анализ включал жирные кислоты более 20: 1. Есть ряд других экспериментов, демонстрирующих влияние температуры окружающей среды на жирнокислотный состав водных животных. Общая тенденция к увеличению содержания длинноцепочечных ПНЖК при более низких температурах очевидна. Отношение w 6 / w 3 уменьшается с понижением температуры (таблица 3).Если тенденции в составе жирных кислот можно рассматривать как ключ к пониманию потребностей рыбы в ОДВ, требование w 3 будет выше для рыбы, выращенной при более низких температурах. Рыбы, выращенные в более теплых водах, такие как карп, канальный сом и тилапия, могут лучше справиться со смесью жирных кислот w 6 и w 3.
2.2 Влияние диеты
Некоторые из составов жирных кислот, перечисленных в таблице 3, могут серьезно зависеть от пищевых липидов. Комаров и гуппи кормили гранулами форели, которые имели соотношение w 6 / w 3, равное 2.75. Сома кормили рационом с добавлением либо говяжьего жира, либо масла менхадена с соотношением w 6 / w 3 18,13 и 0,15 соответственно. Эти рыбы были способны изменять диетическое соотношение w 6 / w 3 в пользу включения жирных кислот w 3 в липиды мяса даже при самой высокой температуре. Коммерчески доступные гранулы форели часто содержат мало w 3 ПНЖК и много w 6 жирных кислот. Важно не игнорировать влияние липидного состава рациона на состав жирных кислот рыб, получавших искусственные корма.Из данных в таблице 3 ясно, что соотношение вес 6 / вес 3 липидов рыб в значительной степени зависит от соотношения вес 6 / вес 3 пищевых липидов. Когда в рационе очень высокое содержание жирных кислот w 6, содержащихся в животном сале или растительных маслах, рыба имеет тенденцию изменять соотношение включенных ПНЖК в пользу жирных кислот w 3. Когда диетическое масло представляет собой рыбий жир с высоким содержанием жирных кислот до 3, соотношение липидов, содержащихся в рыбе, мало изменяется. Это еще одно свидетельство того, что рыба нуждается в w 3 ПНЖК в ОЖК.
Таблица 2 Изменения жирнокислотного состава липидов рыб по мере их миграции из морской воды в свежую и наоборот 1/
Таблица 3 Влияние температуры окружающей среды на жир Кислотный состав липидов рыб 1/
2.3 Сезонное изменение
Часто сообщается о сезонных изменениях в составе жирных кислот у видов рыб.Наблюдаются сезонные изменения общего липидного и йодного числа сельдевых масел. Йодное число или степень ненасыщенности масла была минимальной в апреле и максимальной в июне. Сильное увеличение ненасыщенности соответствовало началу кормления весной. Отсутствие газожидкостного хроматографа (ГЖХ) в то время не позволяло идентифицировать изменения в отдельных жирных кислотах.
Содержание липидов в плоти и внутренних органах сардины Sardinops melanosticta варьируется от 3.С 9 до 10,77 процента и с 10,9 до 38,3 процента соответственно. Жирные кислоты, представляющие основной интерес с точки зрения метаболизма EFA, — это 20: 4w 6, 20: 5w 3 и 22: 6w 3. Наблюдались значительные различия во всех этих жирных кислотах как в нейтральных, так и в полярных липидах обеих тканей. В мясе соотношение 20: 4 w 6 было постоянно выше в нейтральном липиде, чем в полярном липиде. Общее соотношение 20: 5w 3 плюс 22: 6w 3 было постоянно выше в полярном липиде, чем в нейтральном липиде. Таким образом, несмотря на значительные колебания содержания жирных кислот, вызванные изменениями в диете и температуре в течение сезона, наблюдалось последовательное предпочтительное включение ПНЖК серии w 3 в полярную или фосфолипидную фракцию липидов.
Один из лучших ключей к разгадке потребностей вида в ОДВ может быть получен из состава жирных кислот липидов, включенных в потомство или яйцо. Акт воспроизводства или нереста также оказывает значительное влияние на сезонные колебания липидов у рыб. Состав жирных кислот липидов рыбных яиц, вероятно, различен для каждого вида и содержит повышенные уровни 16: 0, 20: 4 w 6, 20: 5 w 3 и 22: 6 w 3 по сравнению с липидами печени той же самки рыб (Ackman , 1967).
Повышенные уровни 16: 0, 20: 5w 3 и 22: 6 w 3 и пониженные 18: 1 в яичниках наблюдались по сравнению с мезентериальным жиром тихоокеанской сардины, получавшей естественную диету копепод. Жирные кислоты в крови сардин, получавших естественный рацион, были аналогичны жирным кислотам яичников. Когда сардины скармливали форелевым кормом, и кровь, и мезентериальный жир реагировали на диету повышением 18: 2w 6 и уменьшением 20: 5w 3 и 22: 6w 3. Влияние диеты на содержание жирных кислот в яичниках было значительно меньше. так как были сохранены относительно высокие уровни 20: 5w 3 и 22: 6w 3.
Липиды яичников сладкой корюшки показывают увеличение на 16: 0 и снижение ПНЖК, особенно фосфолипидов, по сравнению с липидами из мяса рыбы, пойманной в то же время года. Отношение w 6 / w 3 яичника было ниже, чем у липидов плоти, 0,21 и 0,17 для яичника по сравнению с 0,31 и 0,20 для триглицеридов и фосфолипидов мяса, соответственно.
Выводимость яиц карпа, получавшего несколько различных составов кормов, значительно снижается, если соотношение липидов яиц 22: 6w 3 составляет менее 10 процентов.Кроме того, состав жирных кислот в мышцах, плазме и эритроцитах более подвержен влиянию пищевых липидов, чем составы яиц.
Требования по ОДВ для ряда видов рыб были изучены в исследованиях питания. Сами рыбы дали убедительные доказательства предпочтения ОНЖК по типам жирных кислот, которые они включают в свои липиды. Рыба, как правило, имеет тенденцию использовать w 3 по сравнению с w 6. Это особенно наблюдается, когда пищевые липиды с высоким содержанием w 6, так как рыба имеет тенденцию изменять соотношение w 6 / w 3 в сторону жирных кислот w 3 в ткани. липиды.Липиды яйца должны удовлетворять потребность эмбриона в EFA до тех пор, пока он не сможет питаться. Данные по составу жирных кислот предполагают, что потребность в w 3 выше в морской воде, чем в пресной, и выше в холодной воде, чем в теплой.
Подробная информация о потребностях в липидах с пищей для многих видов рыб все еще отсутствует, но имеется много информации о составе жирных кислот рыбьего жира. Информация о липидном составе рыбы может быть использована, чтобы сделать некоторые предположения о пищевых потребностях в липидах.Линоленовая кислота (18: 3w 3) приводила к некоторому щадящему действию и стимулированию роста у крыс, а жирные кислоты w 6 EFA предотвращали все симптомы дефицита EFA. Исследования с гомеотермными наземными животными показали, что жирные кислоты серии w 6 являются «незаменимыми жирными кислотами», в то время как серия w 3 считается несущественной или оказывает лишь частичное сдерживающее действие на дефицит EFA. Было показано, что серия жирных кислот w6 является незаменимой для достаточного количества видов животных, поэтому стало принято считать, что это незаменимые жирные кислоты для всех животных.
Многие полагали, что рыбе также требуется 6 жирных кислот. Многие исследователи начали с добавления в рацион рыб растительных масел, таких как кукурузное, арахисовое или подсолнечное масло, которые были богаты линолевой кислотой. Основным симптомом, наблюдаемым во время развития дефицита EFA в обезжиренных диетах чавычи, была выраженная депигментация, которую можно предотвратить добавлением 1% трилинолеина, но не 0,1% линоленовой кислоты.
Хотя жирные кислоты w 6 считаются незаменимыми, одной из общих характеристик рыбьего жира является низкий уровень жирных кислот серии w 6 и более высокий уровень жирных кислот типа w 3.Имеются данные о том, что полиненасыщенные жирные кислоты (PUPA) серии w 3, которые присутствуют в относительно больших концентрациях в рыбьем жире, играют роль незаменимых жирных кислот для рыбы.
Когда тестовая диета, содержащая 13% кукурузного масла и 2% рыбьего жира, давалась радужной форели, последующее исключение рыбьего жира из рациона замедляло рост и приводило к некоторой дегенерации почек, что могло быть связано с отсутствием достаточного количества w 3 ПНЖК, присутствующие в значительных количествах в рыбьем жире (McLaren et al ., 1947). Пищевой рыбий жир превосходит кукурузное масло в стимулировании роста радужной форели (Salmo gairdneri) и желтохвостой ( Seriola guingueradiata ). Диетическая линоленовая кислота или этиллиноленат (18: 3 w 3) дает положительную реакцию роста радужной форели, что может быть связано с диетической потребностью в жирных кислотах w 3.
5.1 Радужная форель
5.2 Канальный сом
5.3 Карп
5.4 Угорь
5.5 Камбала
5.6 Турбот
5.7 Красноморский лещ
5.8 Другие виды
Одна из наиболее широко распространенных теорий, объясняющих присутствие таких высоких уровней жирных кислот 20: 5w 3 и 22: 6w 3 в рыбьем жире, связана с влиянием ненасыщенности на температуру плавления липида. Большая степень ненасыщенности жирных кислот в фосфолипидах рыб обеспечивает гибкость клеточной мембраны при более низких температурах. Структура w 3 допускает большую степень ненасыщенности, чем w 6 или w 9.Эта теория согласуется с тем фактом, что холодноводная рыба имеет более высокую потребность в питательных веществах в жирных кислотах w 3, в то время как потребность в EFA некоторых теплокровных рыб может быть удовлетворена смесью w 6 плюс w 3.
5.1 Радужная форель
Радужная форель, холодноводная рыба, требует в рационе w 3 жирных кислот в качестве НЖК. Требование ОДВ в рационе может составлять 1 процент 18: 3w 3. Включение 18: 2w 6 в рацион может привести к некоторому улучшению роста и конверсии корма по сравнению с рационами с дефицитом EFA; однако жирные кислоты w 6 не предотвращают некоторые симптомы дефицита EFA, такие как «шоковый синдром».Хотя очевидно, что радужная форель требует w 3 жирных кислот, еще предстоит окончательно доказать, является ли необходимый уровень содержания w 6 жирной кислоты в рационе.
Во всех вышеупомянутых исследованиях с радужной форелью диетические 18: 2w 6 или 18: 3w 3 были легко преобразованы в ПНЖК C-20 и C-22 той же серии, а 18: 3w 3 или 22: 6w 3 имели аналогичные Значение EFA для радужной форели. Либо 20: 5w 3, либо 22: 6 w 3 превосходит 18: 3w 3 по значению EFA для радужной форели, а первые две жирные кислоты в комбинации превосходят любую по отдельности.Это согласуется с данными для млекопитающих, где 20: 4w 6 имеет более высокое значение EFA, чем 18: 2w 6. Превосходная питательная ценность C-20 и C-22 углерода w 3-PUFA дополнительно подтверждается превосходным стимулирующим рост действием диетический рыбий жир, такой как масло печени минтая и масло лосося для радужной форели.
5.2 Канальный сом
Одной из самых важных теплопроводных рыб в Северной Америке является канальный сом (Ictalurus punctatus) . Количественная потребность сома в ОДВ еще не определена.Однако есть убедительные доказательства того, что потребность в w 3 не так высока, как у радужной форели. Анализ жирных кислот липидов сома, приобретенного на пяти перерабатывающих предприятиях, показал очень низкие уровни 20: 4w 6, 20: 5w 3 и 22: 6w 3; 0,8 — 5,5, 0,2 — 1,3 и 0,6 — 6,1 процента от общего количества жирных кислот соответственно. Было показано, что кукурузное масло, добавленное к полуочищенному рациону на основе казеина, первоначально приводило к положительной реакции роста и экономии белка, но позже наблюдалось подавление роста.Явные репрессивные эффекты кукурузного масла могут быть связаны с его содержанием 18: 2 w 6, поскольку 20: 5 w 3 и 22: 6 w 3, присутствующие в масле менхадена, не оказывали видимого вредного воздействия. Эффект подавления роста 18: 2w 6 был также отмечен, когда 3 процента кукурузного масла было добавлено к 3 процентам говяжьего жира и 3 процентам масла менхадена. Подавление роста, вызванное ненасыщенными жирными кислотами, не ограничивается жирными кислотами. Льняное масло (с высоким содержанием 18: 3w 3) в рационе сома приводило к подавлению роста, аналогичному тому, которое вызывается кукурузным маслом, по сравнению с диетическим говяжьим жиром, оливковым маслом и маслом менхадена.
5.3 Обыкновенный карп
Картина для другой теплопроводной рыбы, карпа (Cyprinus carpio) намного яснее, чем для канального сома. У этой рыбы есть потребность в EFA как в жирных кислотах w 3, так и в w 6. Наилучшие прибавки в весе и конверсия корма были получены у рыб, получающих рацион, содержащий как 1 процент 18: 2 w 6, так и 1 процент 18: 3 w 3. У карпа 20: 5 w 3 и 22: 6 w 3 составляли 0,5 процента рациона. превосходят 1 процент 18: 3u3.Карп, получавший обезжиренную диету или диету с дефицитом EFA, содержал высокие уровни липидов 20: 3w 9, особенно фосфолипидов.
5.4 Угорь
Угорь ( Anguilla japonica ), еще одна теплопроводная рыба, нуждается в жирных кислотах w 3 и w 6. Кукурузное масло (с высоким содержанием w 6) и жир печени трески (с высоким содержанием w 3) в смеси 2: 1 наиболее благоприятны для роста угрей. Угрю требуется w 6 и w 3 в той же пропорции, что и карпу, но в меньшем количестве в рационе; а именно 0.5 процентов каждого, а не 1,0 процента каждой ПНЖК.
5.5 Камбала
В камбалах истощаются как w 3, так и w 6 ПНЖК при обезжиренной диете. Добавление к рациону 12: 0 и 14: 0 приводит к синтезу насыщенных и моноеновых жирных кислот с длиной цепи до С18; однако о повышенных уровнях 20: 3w 9 у форели и млекопитающих у камбалы не сообщалось. Камбала, получавшая пищу 18: 2w 6 и 18: 3w 3, не будет производить значительных количеств 20: 4w 6, 20: 5w 3 или 22: 6w 3.
5.6 Турбот
Рост камбалы (Scophthalmus matimus) намного лучше при использовании w 3 ПНЖК, чем при использовании w 6 или насыщенных жиров (гидрогенизированное кокосовое масло) в рационе. Палтус также, по-видимому, не может преобразовать диетическое 18: 2w 6 в 20: 4w 6 при кормлении кукурузным маслом или преобразовать эндогенное 18: 1w 9 в 20: 3w 9 при кормлении диетой с дефицитом EFA. Хотя он, по-видимому, требует EFA для жирных кислот w 3, таких как присутствующие в масле печени трески, 18: 3w 3 этому требованию не удовлетворяет.Удлинение цепи и обесцвечивание 18: lw 9, 18: 2 w 6 или 18: 3w 3 оказалось очень ограниченным (3-15 процентов) у камбалы по сравнению с радужной форелью, где 70 процентов от 18: 3w. 3 был преобразован в 22: 6w 3. Требуемый уровень длинноцепочечных жирных кислот w 3 для палтуса составляет не менее 0,8% от рациона.
5.7 Красноморский лещ
Красный морской лещ (Chrysophyrys major) растет лучше, когда пищевые липиды имеют морское происхождение (остаточное масло минтая), а не растительное масло (например, кукурузное масло).Требование EFA красного морского леща не удовлетворяется ни линолевой кислотой кукурузного масла, ни добавками линолената. Было показано, что смесь 20: 5w 3 и 22: 6w 3, добавленная к диете с кукурузным маслом, эффективна для улучшения роста и состояния этих рыб. Таким образом, даже в теплой воде морской рыбе, похоже, требуется не только 3 жирных кислоты, но и 0) 3 жирных кислоты с длиной углеродной цепи от 20 до 22. Постулируется прямая корреляция между эффективностью корма и уровнем липидов красного морского леща 18: 1.
5,8 Прочие виды
Среди морских рыб, обитающих в теплой воде, кефаль и глазное дно обладают способностью образовывать цепочки, удлиняться и обесцвечивать 18: 2w 6 или 18: 3w 3 ПНЖК. Однако этот процесс тормозится в глазном дне за счет высоких уровней (около 5 процентов) этих ПНЖК 18: 2 w 6 или 18: 3 w 3 в рационе.
Похоже, что высокие уровни 18-углеродных w 6 или w 3 жирных кислот ингибируют синтез и метаболизм 18: lw 9. Интересно отметить, что канальный сом, который также демонстрирует отрицательную реакцию роста на диетическое 18: 2w 6 или 18: 3w 3, содержит очень высокие уровни 18: 1 липидов в организме.Включение в рацион 18: 2w 6 или 18: 3w 3 снижает уровень 18: 1 жирных кислот в липидах организма. Подобное снижение также наблюдалось в фосфолипидах печени морского леща при добавлении в рацион любой из ПНЖК.
Конкурентное ингибирование удлинения цепи и десатурации членов одной серии жирных кислот для членов другой серии хорошо установлено, причем w 3> w 6> w 9 является обычным порядком активности для ингибирования.
Пути метаболизма жирных кислот были рассмотрены Мидом и Каямой (1967).Рыба способна синтезировать из ацетата насыщенные жирные кислоты с четной цепью, как показано на рисунке 1. Исследования с использованием радиоизотопных индикаторов показали, что рыба может преобразовывать 16: 0 в моноен w 7 и 18: 0 к моноену w 9. Моноены w 5, w 11 и w 3 предложены на основе идентификации этих изомеров в моноенах сельдевого масла.
Рыба не может синтезировать жирные кислоты ряда w 6 и u 3, если в рационе не присутствует предшественник с такой структурой w.Рыба способна обесцвечивать и удлинять жирные кислоты серий w 9, w 6 или w 3, как показано на фиг. 1. Существует конкурентное ингибирование десатурации жирных кислот одной серии за счет удлинения членами другой серии. Жирные кислоты w 3 являются наиболее сильными ингибиторами, а w 9 — наименее. Как отмечалось ранее, способность к удлинению и обесцвечиванию жирных кислот не одинакова у всех видов рыб. Палтус был способен обесцвечивать и удлинять только 3-15 процентов 18: 1w 9, 18: 2w 6 или 18: 3 w 3 при введении жирной кислоты, меченной C 14 ; у радужной форели 70 процентов метки из 18: 3w 3 (C 14 ) было найдено в 22: 6 w 3.
Незаменимые жирные кислоты не уникальны по своей способности поставлять энергию. Β-окисление жирных кислот у рыб в основном такое же, как у млекопитающих. Все EFA, насыщенные и моноеновые жирные кислоты в равной степени используются рыбой для производства энергии.
Рис. 1 Блок-схема механизмов синтеза жирных кислот в рыбе — Насыщенные и моноеновые жирные кислоты (адаптировано из Castell, 1979)
Рис. 1 Блок-схема механизмов синтеза жирных кислот в рыбе — Полиненасыщенные жирные кислоты (Адаптировано из Castell, 1979)
Повышенная скорость набухания митохондрий печени наблюдается в рационах питания радужной форели с дефицитом жирных кислот w 3.Возможно, что EFA играет важную роль в проницаемости, а также в пластичности мембран. Роль жирных кислот w 3 в проницаемости мембран может быть одним из факторов, объясняющих различия в содержании этого семейства жирных кислот у пресноводных и морских рыб.
Митохондрии рыб с высоким уровнем w 3 ПНЖК и очень низким уровнем w 6 жирных кислот очень похожи на митохондрии млекопитающих в отношении содержания цитохрома, b-окисления жирных кислот, функционирования цикла трикарбоновых кислот, транспорта электронов, и окислительное фосфорилирование.W 3 ПНЖК могут играть ту же роль в рыбе, что и жирные кислоты w 6 у крыс. EFA играют еще одну роль в митохондриях. Помимо их важности в структуре мембраны, EFA важны в некоторых ферментных системах.
Ненасыщенные жирные кислоты играют важную роль в транспортировке других липидов. Неоднократно было показано, что кормление ПНЖК снижает уровень холестерина у животных с уровнем липидов и холестерина в крови выше нормы. Рыбий жир более эффективен в снижении уровня холестерина, чем большинство пищевых липидов.Основная часть жирных кислот, всасываемых через слизистую оболочку кишечника, транспортируется в виде белково-липидных комплексов, стабилизированных фосфолипидами. Низкая температура тела у рыб, вероятно, приводит к большему значению ненасыщенности в транспорте липидов, чем у гомеотермных животных.
Потребность рыбы в ПНЖК серии w 3 создает проблемы с хранением кормов. Эти типы жирных кислот очень неустойчивы к окислению. Продукты окисления липидов могут вступать в реакцию с другими питательными веществами, такими как белки, витамины и т. Д., а также снижение доступных диетических уровней или продуктов окисления может быть токсичным. Было продемонстрировано влияние окисленных липидов на пищевые белки, ферменты и аминокислоты.
Использование окисленного масла менхадена в рационе свиней и крыс вызывало снижение аппетита, замедление роста, желтовато-коричневую пигментацию жировых отложений и снижение уровней гемоглобина и гематокрита. Негативные эффекты окисленного рыбьего жира были устранены добавлением в рацион альфа-токоферола ацетата или этоксиохина.
Использование растительных масел в рыбных рационах в 1950-х и 1960-х годах частично могло быть связано с их большей стабильностью в приготовленных диетах. Было продемонстрировано, что прогорклая сельдь и мука хека в кормах для рыб вызывают темную окраску, анемию, летаргию, коричнево-желтую пигментированную печень, аномалии почек и небольшие жаберные булавы у чавычи. Симптомы можно облегчить, добавив альфа-токоферол в рацион, содержащий прогорклую рыбную муку. Добавление витамина Е предотвратит токсические или отрицательные эффекты добавления 5% сильно окисленного лососевого масла в рацион радужной форели.Такой же щадящий эффект альфа-токоферола можно применить и к корму для прогорклого карпа.
Положительная питательная ценность жирных кислот w 3 в липидах рыб для кормов для рыб может стать отрицательным фактором, если при приготовлении и хранении кормов не будут приняты соответствующие меры. В корма следует использовать только свежие масла с низким содержанием пероксидов. Ингредиенты рыбных кормов, такие как рыбная мука, должны быть защищены от окисления. Уровень витамина Е, добавляемого в рацион, следует увеличивать по мере увеличения уровня ПНЖК.Готовые корма по возможности следует хранить в герметичных контейнерах при пониженных температурах с минимальным воздействием УФ-излучения и других факторов, ускоряющих скорость окисления липидов. Не следует игнорировать проблемы прогорклости или антиокисления липидов в кормах для рыб.
Ackman, R.G., 1967 Характеристики жирнокислотного состава и биохимии некоторых жиров и липидов пресноводных рыб в сравнении с жирами и липидами морских животных. Comp.Biochem.Physiol., 22: 907-22
Кастелл, Дж.Д., 1979 г. Обзор потребностей рыб в липидах. В Технология кормления и кормления рыб для рыб, под редакцией Дж. Э. Халвера и К. Труса. Труды Всемирного симпозиума, спонсируемого и поддерживаемого EIFAC / FAO / ICES / IUNS, Гамбург, 20-23 июня 1978 г. Schr.Bundesforschungsanst.Fisch., Hamb., (14/15) vol.1: 59-84
Коуи, К. Б. и Дж. Р. Сарджент, 1972 Кормление рыб. Adv.Mar.Biol ., 10: 383-492,
Коуи, С.Б. и Дж.Р. Сарджент, 1977 Липидное питание рыб. Comp.Biochem.Physiol. (B Comp.Biochem .) 57: 269-73
Макларен, Б.А. 1947 г. et al ., Питание радужной форели. 1. Исследования витаминной потребности. Арх-Биохим . 19: 169-78
Мид, Дж. Ф. и М. Каяма, 1967 Липидный обмен у рыб. В Рыбий жир, под редакцией М.Э. Стэнсби. Вестпорт, Коннектикут, Avi Publ. Co., стр. 289-99.
Национальный исследовательский совет, Подкомитет 1973 года по питанию рыб, потребности в питательных веществах форели, лосося и сома.Вашингтон, округ Колумбия, Национальная академия наук, (Потребности домашних животных в питательных веществах), 11:57 стр.
Национальный исследовательский совет, Подкомитет по тепловодным рыбам 1977 года, Потребности теплопроводных рыб в питательных веществах. Вашингтон, округ Колумбия, Национальная академия наук, (Потребности домашних животных в питательных веществах), 78 стр.
Зиннхубер Р.О., 1969 Роль жиров. В Рыба в исследованиях, под редакцией О.В. Ньюхаус и Дж. Э. Халвер, Нью-Йорк, Academic Press, стр. 245-61.
Фосфолипид: определение, структура, функции | Биологический словарь
Определение фосфолипидов
Фосфолипид — это тип липидной молекулы, которая является основным компонентом клеточной мембраны.Липиды — это молекулы, которые включают, среди прочего, жиры, воски и некоторые витамины. Каждый фосфолипид состоит из двух жирных кислот, фосфатной группы и молекулы глицерина. Когда многие фосфолипиды выстраиваются в линию, они образуют двойной слой, характерный для всех клеточных мембран.
Структура фосфолипида
Фосфолипид состоит из двух хвостов жирных кислот и головки фосфатной группы. Жирные кислоты — это длинные цепи, которые в основном состоят из водорода и углерода, а фосфатные группы состоят из молекулы фосфора с четырьмя присоединенными молекулами кислорода.Эти два компонента фосфолипида связаны третьей молекулой, глицерином.
Фосфолипиды способны образовывать клеточные мембраны, потому что головка фосфатной группы является гидрофильной (водолюбивой), в то время как хвосты жирных кислот гидрофобны (ненавидят воду). Благодаря этим свойствам они автоматически выстраиваются в воде определенным образом и образуют клеточные мембраны. Чтобы сформировать мембраны, фосфолипиды выстраиваются рядом друг с другом так, чтобы их головы находились снаружи клетки, а хвосты — внутри.Второй слой фосфолипидов также образуется с головками, обращенными внутрь клетки, и хвостами, обращенными в сторону. Таким образом образуется двойной слой с головками фосфатных групп снаружи и хвостами жирных кислот внутри. Этот двойной слой, называемый липидным бислоем, образует основную часть клеточной мембраны. Ядерная оболочка, мембрана, окружающая ядро клетки, также состоит из фосфолипидов, расположенных в липидном бислое, как и мембрана митохондрий, часть клетки, вырабатывающая энергию.
На этом рисунке изображен липидный бислой и структура фосфолипида:
Функции фосфолипидов
Как компоненты мембраны, фосфолипиды избирательно проницаемы (также называемые полупроницаемыми), что означает, что только определенные молекулы могут проходить через них. войти или выйти из ячейки. Молекулы, растворяющиеся в жире, могут легко проходить сквозь него, а молекулы, растворяющиеся в воде, — нет. Кислород, углекислый газ и мочевина — это некоторые молекулы, которые могут легко проходить через клеточную мембрану.Большие молекулы, такие как глюкоза или ионы, такие как натрий и калий, не могут легко проходить через них. Это помогает поддерживать правильную работу содержимого ячейки и отделяет внутреннюю часть ячейки от окружающей среды.
Фосфолипиды могут расщепляться в клетке и использоваться для получения энергии. Их также можно разделить на более мелкие молекулы, называемые хемокинами, которые регулируют различные виды деятельности клетки, такие как выработка определенных белков и миграция клеток в различные области тела.Кроме того, они обнаруживаются в таких областях, как легкие и суставы, где они помогают смазывать клетки.
В фармацевтике фосфолипиды используются как часть систем доставки лекарств, которые являются системами, которые помогают транспортировать лекарство по всему телу к той области, на которую оно должно воздействовать. Они обладают высокой биодоступностью, а это означает, что они легко усваиваются организмом. Валиум — это пример лекарства, в котором используется система доставки лекарств на основе фосфолипидов.
В пищевой промышленности фосфолипиды могут действовать как эмульгаторы, которые представляют собой вещества, диспергирующие капли масла в воде, так что масло и вода не образуют отдельных слоев.Например, яичные желтки содержат фосфолипиды и используются в майонезе, чтобы предотвратить его расслоение. Фосфолипиды в высоких концентрациях содержатся во многих других источниках животного и растительного происхождения, таких как соевые бобы, подсолнечник, семена хлопка, кукуруза и даже мозг коровы.
- Липид — класс молекул, в который, помимо других молекул, входят жиры, воски и некоторые витамины.
- Гидрофильная — молекула, «любящая воду»; он притягивается к молекулам воды и обычно может растворяться в воде.
- Гидрофобный — молекула, «ненавидящая воду»; его не привлекает вода, но он обычно растворяется в маслах или жирах.
- Липидный бислой — двойной слой фосфолипидов, который составляет клеточную мембрану и другие мембраны, такие как ядерная оболочка и внешняя часть митохондрий.
Тест
1. Что НЕ является компонентом фосфолипида?
A. Глицерин
B. Жирные кислоты
C. Дезоксирибоза
D. Фосфатная группа
Ответ на вопрос № 1
C правильный. Каждый фосфолипид состоит из головки фосфатной группы и двух хвостов жирных кислот, которые связаны молекулой глицерина. Дезоксирибоза не входит в состав фосфолипидов; это 5-углеродный сахар, содержащийся в ДНК.
2. Какая молекула гидрофобна?
A. Жирная кислота
B. Фосфатная группа
C. Глюкоза
D. Карбоксилатная группа
Ответ на вопрос № 2
правильный. Жирные кислоты гидрофобны; их не привлекает вода. Они являются частью фосфолипидов, которая остается внутри липидного бислоя, который естественным образом образуется, когда фосфолипиды находятся в водянистом растворе. 3. Каковы функции фосфолипидов?
A. Является частью системы доставки лекарств в некоторых фармацевтических препаратах
B. Регулирует клеточную активность, например миграцию клеток
C. Формирование клеточной мембраны и мембран других органелл в клетке
D. Все вышеперечисленное
Ответ на вопрос № 3
D правильный. Фосфолипиды выполняют в организме все эти функции.
Повышение перевариваемости жиров с помощью эмульгаторов
Энергия является основным компонентом затрат в рационах для высокопроизводительных животных. Из-за плотности энергии жиры и масла являются важными источниками энергии в рецептуре кормов.Повышение энергоэффективности этого сырья представляет большой интерес с экономической точки зрения. Пищевые эмульгаторы могут использоваться для улучшения усвояемости жиров и, таким образом, повышения энергоэффективности. Обсуждаются последствия с точки зрения затрат на корм и более устойчивого животноводства.
Марк Роверс, Orffa / Excentials, Нидерланды
Термины жир, масло или липид относятся к триглицеридам нескольких профилей жирных кислот.Жирные кислоты, которые не связаны с другими органическими компонентами, такими как глицерин, представляют собой так называемые свободные жирные кислоты. Липиды являются основным источником энергии для животных и имеют самую высокую калорийность среди всех питательных веществ. Количество энергии, которое животное может получить из пищевых жиров, зависит от их усвояемости. На рисунке 1 показано переваривание жира в организме. Чем выше усвояемость, тем больше доступной энергии. Усвояемость жира животными зависит от различных характеристик жира и абсолютного количества жира, добавляемого в рацион.Такие факторы, как возраст животных, также влияют на усвояемость. У молодых птиц низкий уровень производства естественной липазы и низкий уровень продукции желчных солей. К счастью, ограниченное переваривание жиров можно улучшить, добавив в рацион эмульгаторы.
Переваривание жиров происходит в несколько этапов.
Сначала большие жировые шарики эмульгируются в водянистой среде кишечника за счет перистальтического движения. Обычно жир и вода не смешиваются, поэтому соли желчных кислот участвуют в этом процессе смешивания в качестве натурального эмульгатора.Капельки жира меньшего размера образуются для увеличения поверхности контакта фермента липазы. Этот фермент вырабатывается поджелудочной железой и расщепляет жир. Жиры и масла представляют собой сложные эфиры трех жирных кислот и глицерина. Жирные кислоты высвобождаются (гидролизуются) из глицерина липазой. В результате образуются две жирные кислоты и моноглицерид. Следующий этап — образование мицелл. Мицеллы представляют собой водорастворимые агрегаты липидных молекул, содержащие как полярные, так и неполярные группы. Молекулы сгруппированы в мицеллах таким образом, что полярные группы находятся снаружи в контакте с водной фазой, а неполярные части образуют внутреннее липидное ядро мицелл.Соли желчных кислот и моноглицериды в качестве эмульгаторов способствуют образованию мицелл. Когда мицеллы вступают в контакт с мембраной микроворсинок, они разрушаются, и жирные кислоты могут абсорбироваться липофильной клеточной мембраной.
Пищевые эмульгаторы
Желчные соли — природные эмульгаторы. Моноглицериды, образующиеся после гидролиза жира, также действуют как эмульгаторы. Тем не менее, способность этих натуральных эмульгаторов может препятствовать усвоению жиров.У молодых животных производство солей желчных кислот ограничено, поэтому усвояемость жиров преждевременна на раннем этапе жизни. С другой стороны, характеристики диетического жира могут ограничивать усвояемость. Смеси жирных кислот с большим количеством свободных жирных кислот не образуют моноглицеридов и, следовательно, имеют более низкую эмульгирующую способность. Длинноцепочечные ненасыщенные жирные кислоты и моноглицериды быстро образуют мицеллы, тогда как насыщенные жирные кислоты имеют более низкую способность образовывать мицеллы из-за низкой полярности.Эти характеристики жира объясняют разницу в усвояемости. В целом, насыщенные жирные кислоты, в основном содержащиеся в животном жире, перевариваются труднее, чем ненасыщенные жирные кислоты, например, в растительном жире. Высокий уровень свободных жирных кислот также ограничивает усвояемость. Экзогенные пищевые эмульгаторы могут способствовать усвояемости. Очевидно, что положительный эффект от добавления таких эмульгаторов более выражен для жиров с низкой усвояемостью, чем для жиров с очень высокой степенью усвояемости. Эффект также будет более выраженным при более высоком уровне добавленного жира.Тем не менее, положительные эффекты наблюдаются даже при использовании жиров с высоким содержанием усвояемых веществ.
HLB balance
Эмульгатор — это молекула с водорастворимой (гидрофильной) частью и жирорастворимой (липофильной) частью. Комбинация этих двух характеристик в одной молекуле придает ей уникальное свойство, заключающееся в том, что эмульгатор может растворяться как в жире, так и в воде, и может способствовать смешиванию двух фракций. Коммерчески доступны различные типы эмульгаторов. При выборе эмульгатора гидрофильно-липофильный баланс (ГЛБ) является ключевым показателем, показывающим, насколько продукт растворим в жире или воде, в диапазоне от 0 до 20 (, рис. 2, ).Чем ниже HLB, тем более липофильным или жирорастворимым становится эмульгатор. С другой стороны, чем выше HLB, тем более водорастворимым или гидрофильным будет эмульгатор. В идеале эмульгатор должен быть растворим в непрерывной фазе, как гласит правило Бэнкрофта. Когда небольшое количество воды смешивается с богатой жирами средой, рекомендуется более низкий ГЛБ (жирорастворимый). Если небольшое количество жира смешивается с водной средой, рекомендуется использовать эмульгатор с более высоким HLB (водорастворимый).В случае пищевого эмульгатора в водянистую среду кишечника добавляется ограниченное количество жира. Поскольку птицы потребляют в 1,5–2 раза больше воды, чем корма, а корм содержит лишь небольшое количество жира, количество воды намного превышает количество жира в кишечнике. В этом случае больше подходит высокий HLB.
Испытания с рационами для бройлеров
Было проведено несколько экспериментов, чтобы продемонстрировать влияние эмульгаторов на перевариваемость жира у бройлеров.В первом эксперименте к рациону были добавлены четыре различных питательных эмульгатора с относительно высокими значениями HLB (дозировка 250 г / т). Все четыре эмульгатора повысили усвояемость жиров и энергии, что привело к повышению ценности AMEn в рационе. Эмульгатор B (Excective Energy Plus) имел самую высокую усвояемость жиров и прирост энергии на 137 ккал (, рис. 3 ). Во втором эксперименте проверялось, можно ли составить диету с более низким содержанием энергии и компенсировать это с помощью эффективного эмульгатора.Сравнивались две диеты с разным составом жиров: одна с обычным составом жиров, а другая с высоким уровнем насыщенных жирных кислот и свободных жирных кислот. Диеты с пониженной энергетикой и добавлением эмульгатора выполняются на том же уровне, что и контрольные диеты. Это указывает на то, что добавление эффективного эмульгатора способно компенсировать снижение содержания энергии на 5,3% (, рис. 4, ).
Экономия энергии и затрат
Добавление в рацион эффективного эмульгатора может компенсировать снижение калорийности рациона.Что это означает для фермеров на практике? Если диета может быть составлена с более низким содержанием энергии, это означает меньшее добавление дорогих жиров и масел и, как следствие, более низкую себестоимость. Влияние на себестоимость зависит от пищевых ограничений в формуле и от цен на сырье, а также от региональных различий и колебаний во времени. Чтобы понять величину эффекта, типичный рацион бройлеров Северной Европы был составлен с разными уровнями энергии. За счет снижения основной диеты с 3100 до 3000 ккал содержание масел и жиров было ограничено, что привело к снижению затрат более чем на 10 евро за тонну (, рис. 5, ).
.

 Внешний вид и консистенция
Внешний вид и консистенция Первоначальный объем пены, мл
Первоначальный объем пены, мл Силикат натрия
Силикат натрия Натрий хлор
Натрий хлор ед.
ед.
Leave A Comment