S8 какая связь в химии?
Ответы (1)
VirabovK
12.04.2023
S8 — это молекула серы, которая состоит из восьми атомов серы, связанных между собой ковалентной связью. Ковалентная связь образуется между атомами, когда они делят электроны для образования пары электронов, которая связывает их вместе. В молекуле S8 каждый атом серы имеет две пары электронов, которые он делит с другими атомами серы, чтобы образовать молекулу. Молекула S8 обладает высокой устойчивостью и используется в различных промышленных процессах, таких как производство каучука, технической серы и других химических соединений.
Популярные вопросы в категории химия
Cep6ep
10.04.2023
Как из нитрата алюминия получить гидроксид алюминия?
TommyMadness
14.04.2023
Как из ацетата натрия получить уксусную кислоту?
Annete
14.04.2023
Сколько углерода содержится в стали технология 7?
usd
10. 04.2023
04.2023
Naoh co2 какая реакция?
Planet
14.04.2023
Kh3po2 какая соль?
NightDance
13.04.2023
Основные и кислотные оксиды как отличить?
KriStinT
14.04.2023
Как из метана получить спирт?
trefoil
14.04.2023
Сколько валентных электронов у кислорода?
Led
13.04.2023
Na2o как получить?
padonok666
14.04.2023
Как получить 1 3 5 триметилбензол?
Vengr
11.04.2023
Сколько лимонной кислоты в лимонном соке?
Smile555
10.04.2023
В каком периоде находится каждый из элементов?
uzkiyglaz
12.04.2023
S8 какая связь в химии?
Yalta
14. 04.2023
04.2023
Как из бутана получить метилпропан?
ArnoldFirst
13.04.2023
Сколько неспаренных электронов у углерода?
sherbet
12.04.2023
KiMak
14.04.2023
Как открыть хлорид натрия?
deeen2006
14.04.2023
Как получить hno3 из no2 уравнение реакции?
mafita
14.04.2023
Как определить соленость?
SobakkA
11.04.2023
Как из пропионата калия получить бутан?
Новые вопросы в категории химия
osnova1986
10.04.2023
Как из ca oh 2 получить caco3?
Simona
11.04.2023
Какая химическая связь o2?
Elia12345
11.04.2023
Al oh 3 какой осадок?
daler-
12. 04.2023
04.2023
Как определить формулу высшего оксида?
TRUEONEONTHERUN
12.04.2023
Как получить диэтиловый эфир из этанола?
NeFeRtItI-
12.04.2023
Как отличить кислотный оксид от основного?
SobakkA
11.04.2023
Как из пропионата калия получить бутан?
mercurial
13.04.2023
Milashka89
13.04.2023
Какой запах у серы?
Ivan-Frost
10.04.2023
Как получить k2co3?
volvo
12.04.2023
Ph4 какая химическая связь?
Innarichi
13.04.2023
Caco3 какой класс веществ?
artur274
12.04.2023
Из каких малых органических соединений состоят белки?
KiMak
14. 04.2023
04.2023
Как открыть хлорид натрия?
LESIK-V
11.04.2023
Как приготовить 15 процентный раствор?
neprikosaemaj18
11.04.2023
h3so4 метилоранж какой цвет?
matorio
12.04.2023
Как отстирать акварельную краску с одежды?
Ep2s
14.04.2023
Как получить бром?
alcovision
14.04.2023
Сколько молекул содержится в 100 г воды?
Led
13.04.2023
Какова масса 50 молей углекислого газа co2?
ковалентная (полярная и неполярная), ионная, металлическая.
Задание № 3
Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Химическая связь – это вид межатомных взаимодействий в молекулах, ионах, кри- сталлах, приводящий к понижению общей энергии системы. При всем многообразии химических связей их природа едина и носит электростатический характер.
При всем многообразии химических связей их природа едина и носит электростатический характер.
Основные виды хим. связи (по распределению электронной плотности между взаимодействующими атомами):Различают ионную, ковалентную и металлическую связь, водородная.
Ковалентная и ионная связи являются базовыми типами связи.
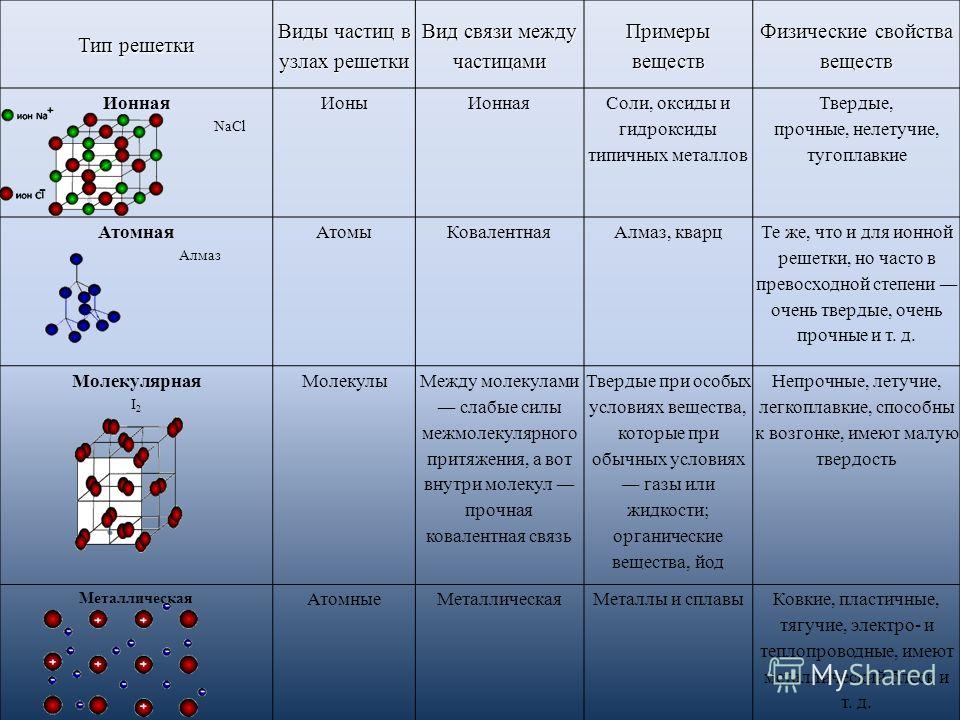
Ионная связь
металл + неметалл
+
–
Na + 11 ) 2 ) 8 )
Cl + 17 ) 2 ) 8 )
1
7
8
Электростатическое притяжение
Cl —
Na +
ионы
Свойства ионной связи
ненаправленная,
так как электромагнитное поле распространяется во все стороны
+
–
ненасыщаемая,
притянется столько ионов, сколько уместится
–
–
+
–
Поэтому все вещества с ионной связью имеют немолекулярное строение
Кристаллическая решетка
Ковалентная связь
неметалл + неметалл
Cl + 17 ) 2 ) 8 ) 7
Химическая связь, образованная посредством общих электронных пар, называется ковалентной.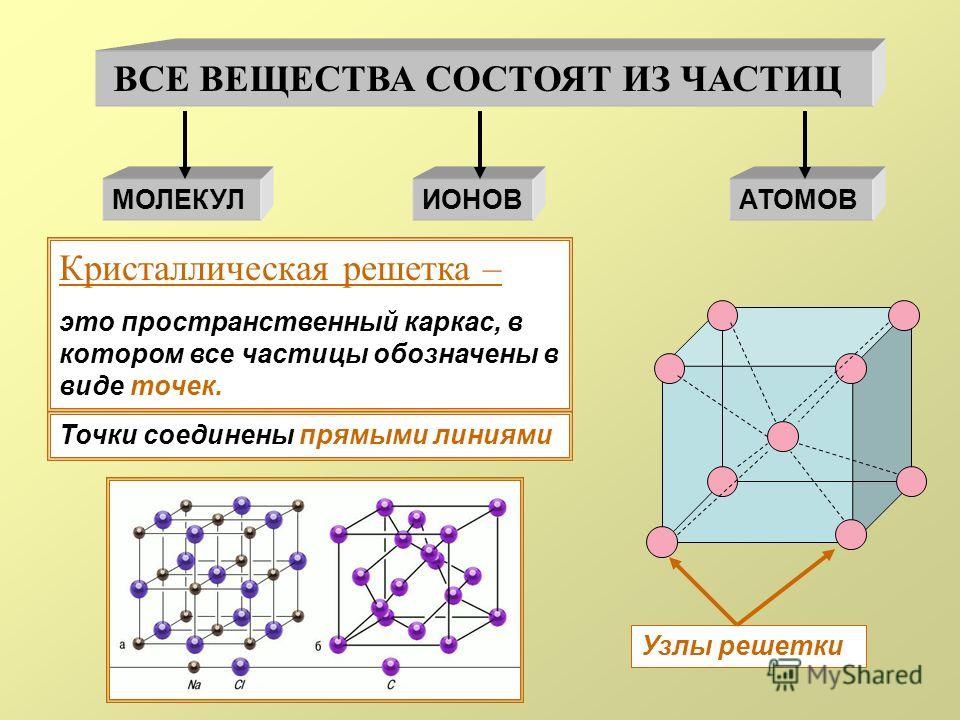
Сl
Сl
Ковалентная неполярная связь
δ-
δ+
Н
Сl
Ковалентная полярная связь
Ковалентная связь может быть образована несколькими парами электронов
N
N
N N
Количество связей у атома равно количеству электронов, которых не достает у атома до октета.
Свойства ковалентной связи
направленная,
атомы должны расположиться определенным образом.
104˚
Н
О
Н
насыщаемая,
связывает два атома,
«третий – лишний»
Н:Н
Способы изображения ковалентной связи
электронно-графические схемы
электронные схемы
перекрывание орбиталей
структурные формулы
Н-H
Н 2
Н : Н
s-s
H
НF
Н-F
Н : F
F
s-p
F 2
F : F
F-F
F
p-p
F
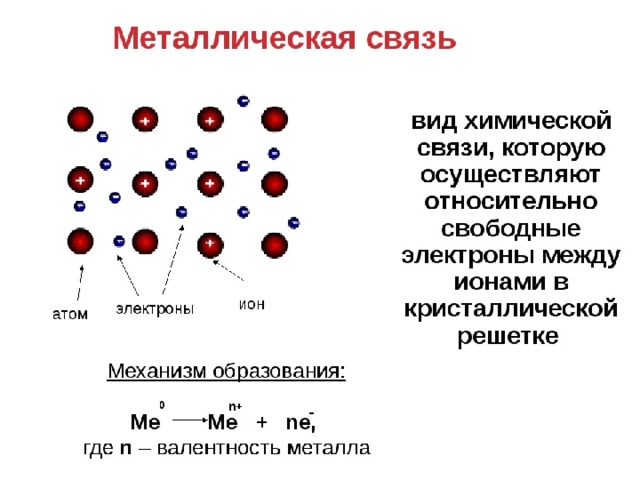
ион-атомы
+
+
+
+
свободные электроны
+
+
+
+
+
+
+
+
+
+
+
Металлическая связь
Как определить вид связи в веществе?
Определите природу химических элементов
если
металл и неметалл
только металл
только неметаллы
связь ионная
связь металлическая
связь ковалентная
если
ЭО элементов одинакова
ЭО элементов различна
связь ковалентная полярная
связь ковалентная неполярная
Определите вид связи в следующих веществах:
Н 2 , Na, NaF, H 2 S, NH 3 , O 2 , Zn, CaS, Mg 3 N 2 , CH 4 , Al, F 2 .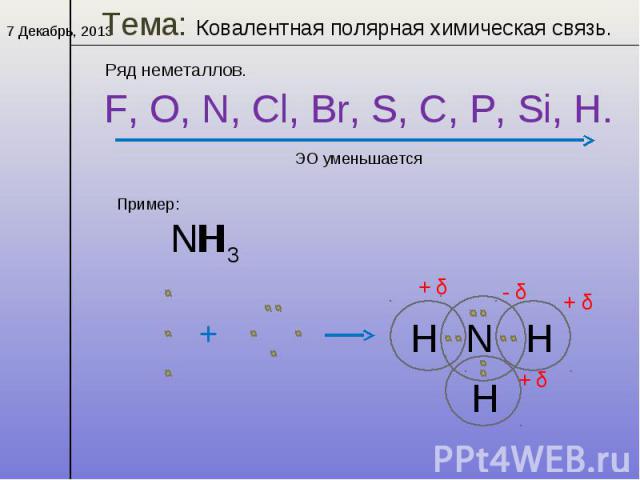
Водородная связь – электростатическое притяжение между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом О, N или F другой молекулы (или другого фрагмента молекулы).
+
—
+
+
+
+
—
+
—
+
—
+
+
+
—
+
—
+
1. Какой вид химической связи в молекуле фтороводорода?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
2. Какой вид химической связи в молекуле бромоводорода?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
3. Какой вид химической связи в молекуле оксида серы(IV)?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
4. Какой вид химической связи в молекуле хлорида фосфора(III)?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
5. Какой вид химической связи в молекуле кислорода?
Какой вид химической связи в молекуле кислорода?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
6. Какой вид химической связи в молекуле азота?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
7. Какой вид химической связи в молекуле хлора?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
8. В молекуле фтора химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
9. Химическая связь в хлориде кальция
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
10. Химическая связь в сульфиде калия
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
11. Химическая связь в оксиде лития
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
12. Химическая связь во фториде калия
Химическая связь во фториде калия
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
13. Какое из указанных веществ имеет металлическую связь?
- CaF2 2) S 3) Zn 4) K2O
14. Какое из указанных веществ имеет металлическую связь?
- Na2S 2) CаO 3) Mg 4) h3
15. Какое из указанных веществ имеет металлическую связь?
- BaO 2) B 3) Cu 4) Cl2
16. Какое из указанных веществ имеет металлическую связь?
- Na2O 2) BaS 3) Bе 4) N2
17. Ионной связью соединены частицы, образовавшиеся из атомов
1) углерода и хлора
2) водорода и серы
3) кислорода и фосфора
4) кальция и фтора
18. Ионная связь не характерна для соединения, образованного атомами
1) натрия и хлора
2) бария и серы
3) кальция и фтора
4) водорода и хлора
19. Веществами с ковалентной полярной и ионной связью являются, соответственно,
1) вода и алюминий
2) сероводород и бром
3) бромоводород и вода
4) вода и фторид магния
20. Веществами с ковалентной неполярной и металлической связью являются соответственно
Веществами с ковалентной неполярной и металлической связью являются соответственно
1) h3 и S
2) SO2 и Na
3) CaCl2 и CO
4) N2 и Pb
21. Ковалентная неполярная связь характерна для
- HBr 2) KBr 3) Br2 4) CaBr2
22. Веществом с ковалентной полярной связью является
- KF 2) PCl3 3) O2 4) CaO
23. Ковалентная неполярная связь характерна для
1) хлорида натрия
2) хлороводорода
3) хлорида фосфора(III)
4) хлора
24. Веществом с металлической связью является
1) барий
2) оксид бария
3) гидроксид бария
4) хлорид бария
25. Ионная связь характерна для
1) сероводорода
2) фтороводорода
3) фторида натрия
4) оксида серы(VI)
26. В оксиде лития химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) металлическая
4) Ионная
27. Веществом с ионной связью является каждое из веществ:
1) Nh4, N2
2) CaCl2, Na2O
3) Cu, CaF2
4) CuO, N2O5
28. Веществом с ковалентной неполярной связью является
Веществом с ковалентной неполярной связью является
1) бром
2) сероводород
3) углекислый газ
4) Фтороводород
29. Такой же вид химической связи, как и в молекуле h3S, характерен для
- SiO2 2) K2O 3) BaS 4) Na2S
30. Одинаковый вид химической связи имеют
1) Fe и Fe2O3
2) h3 и CаO
3) P2O5 и Na2O
4) CaO и LiBr
31. Ковалентная полярная связь характерна для
- CaO 2) HI 3) h3 4) MgO
32. Веществом с ионной связью является
1) иодоводород
2) бромид кальция
3) оксид углерода(II)
4) метан
33. Веществом с ковалентной полярной связью является
- Na 2) KF 3) P4 4) HF
34. В молекуле аммиака химическая связь
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
35. Веществом с ионной связью является
- Ca 2) N2O 3) KCl 4) HCl
36. Веществом с ионной связью является
Веществом с ионной связью является
1) оксид кремния
2) оксид натрия
3) оксид углерода(IV)
4) оксид углерода(II)
37. Хлор образует ковалентную полярную связь с
- калием 2) барием 3) водородом 4) кальцием
38. Ковалентная неполярная связь характерна для
1) Аммиака 2) воды 3) фтора 4) калия
39. В сероводороде химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) Водородная
40. Ковалентную неполярную связь имеет
1) хлор
2) хлороводород
3) оксид хлора(I)
4) хлорид кальция
41. Какой вид химической связи в оксиде бария?
1) ионная
2) Металлическая
3) ковалентная полярная
4) ковалентная неполярная
42. Какой вид химической связи в сульфиде натрия?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
43. Какой вид химической связи имеет белый фосфор?
Какой вид химической связи имеет белый фосфор?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
44. Ковалентную полярную связь имеет каждое из двух веществ
1) сероводород и хлор
2) оксид натрия и оксид хлора(VII)
3) оксид кремния и аммиак
4) хлорида лития и кислород
45. Металлические свойства кальция выражены слабее, чем металлические свойства
- магния 2) алюминия 3) бария 4) кремния
46. Ковалентную полярную связь имеет
1) натрий
2) оксид бария
3) фтороводород
4) сульфид натрия
47. Такой же вид химической связи, как и в молекуле HBr, характерен для
- PCl3 2) KCl 3) MgCl2 4) CaCl2
48. Ковалентную неполярную связь имеет
1) аммиак
2) сероводород
3) белый фосфор
4) Алюминий
49. Какой вид химической связи в оксиде фосфора(V) и оксиде лития?
1) в обоих веществах ковалентная неполярная
2) в обоих веществах ковалентная полярная
3) ковалентная неполярная и ионная
4) ковалентная полярная и ионная
50. Одинаковый вид химической связи имеет сера и
Одинаковый вид химической связи имеет сера и
1) кислород
2) магний
3) сульфид магния
4) оксид магния
51. Ковалентная неполярная связь образуется между атомом хлора и атомом
1) калия 2) водорода 3) хлора 4) углерода
52. Какой вид химической связи характерен для меди?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
53. Какой вид химической связи в сероводороде и оксиде серы(IV)?
1) ковалентная неполярная и ковалентная полярная
2) в обоих веществах ковалентная полярная
3) в обоих веществах ковалентная неполярная
4) ионная и ковалентная полярная
54. Ковалентную неполярную связь имеет
- Сероводород
2) сульфид калия
3) оксид серы(IV)
4) ромбическая сера
55. В соединении натрия с фтором химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) металлическая
56. Одинаковый вид химической связи имеет хлорид бария и
Одинаковый вид химической связи имеет хлорид бария и
1) хлор
2) оксид натрия
3) барий
4) оксид хлора(I)
57. Одинаковый вид химической связи имеют аммиак и
1) фторид кальция
2) оксид кальция
3) цинк
4) оксид кремния
58. Ионная связь характерна для каждого из двух веществ:
1) хлорид калия и хлороводород
2) хлорид натрия и оксид углерода(IV)
3) оксид лития и хлор
4) хлорид бария и оксид натрия
59. Веществами с ионной и ковалентной неполярной связью являются соответственно
1) водород и хлор
2) хлорид натрия и хлор
3) вода и магний
4) хлорид меди(II) и хлороводород
60. Ионную связь имеет
1) азот
2) аммиак
3) оксид азота(IV)
4) хлорид кальция
61. Какой вид химической связи в оксиде хлора(VII)?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
62. Ковалентная полярная связь образуется между атомами
Ковалентная полярная связь образуется между атомами
1) натрия и брома
2) серы и кислорода
3) водорода
4) калия и хлора
63. Какой вид химической связи в молекуле азота?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
64. Ковалентную полярную связь имеет каждое из двух веществ
1) CO и P4
2) Nh4 и SO2
3) O3 и Br2
4) CCl4 и K2O
65. Какой(-ие) вид(-ы) связи имеются в молекуле серной кислоты?
1) ковалентная полярная и ионная
2) ковалентная полярная и ковалентная неполярная
3) только ковалентная полярная
4) только ионная
66. Такой же вид химической связи, как и для фторида кальция, характерен для
1) хлора
2) магния
3) оксида серы(IV)
4) сульфида натрия
67. Для какого из веществ характерна ионная связь?
- Н2S 2) K2S 3) SO2 4) S8
68. Какое из указанных веществ имеет ионную связь?
1) HCl 2) Cl2 3) NaCl 4) CO2
69. Химическая связь в бромиде натрия
Химическая связь в бромиде натрия
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
70. Какой вид химической связи в молекуле аммиака?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
71. Химическая связь в хлориде калия
1) ковалентная полярная
2) ковалентная неполярная
3) Металлическая
4) ионная
72. Химическая связь в бромоводороде
1) металлическая
2) ионная
3) ковалентная полярная
4) ковалентная неполярная
73. Ковалентная неполярная связь образуется между атомами
1) азота и водорода
2) серы и кислорода
3) алюминия
4) Фосфора
74. Одинаковый вид химической связи имеют хлороводород и
1) калий
2) хлорид натрия
3) вода
4) оксид бария
75. Веществом с ковалентной неполярной связью является
1) азот
2) оксид азота(II)
3) кальций
4) оксид кальция
76. Химическая связь в хлороводороде
Химическая связь в хлороводороде
1) ковалентная неполярная
2) ионная
3) ковалентная полярная
4) металлическая
77. Металлическая связь характерна для
- 2) 3) 4)
Br2 Na2S Na CO2
78. Ковалентной неполярной является химическая связь в соединении
1) CCl4 2) Na2O 3) Fe 4) F2
79. Веществом с металлической связью является
1) оксид калия
2) хлорид натрия
3) аммиак
4) Цинк
80. Какой вид химической связи характерен для вещества, формула которого P4?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
81. Какой вид химической связи в молекуле бромоводорода?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
82. Какой вид химической связи в молекуле хлороводорода?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
83. Какое из указанных веществ имеет ковалентную полярную связь?
Какое из указанных веществ имеет ковалентную полярную связь?
1) NaCl
2) h3S
3) h3
4) CaCl2
84. Какое из указанных веществ имеет ковалентную полярную связь?
- NaCl 2) h3S 3) h3 4) CaCl2
85. Ионная связь образуется между
1) фосфором и серой
2) кислородом и водородом
3) бромом и бромом
4) хлором и натрием
86. Ковалентную неполярную связь имеет каждое из двух веществ
1) C60 и S8 2) Na и h3S 3) I2 и Ba 4) CO и KCl
87. Веществом с ковалентной неполярной связью является
1) кальций
2) вода
3) хлороводород
4) Фтор
88. Для какого из веществ характерна ковалентная полярная связь?
- MgO 2) Br2 3) NO 4) Al
89. В соединении серы с водородом химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) Металлическая
90. Для какого из веществ характерна металлическая связь?
- Na2O 2) I2 3) h3S 4) Ca
91. Ионной является химическая связь в соединении
Ионной является химическая связь в соединении
- HBr
2) P2O5
3) BaCl2
4) CO2
92. Для какого из веществ характерна ковалентная неполярная связь?
- Cl2 2) KF 3) CO 4) Cu
93 . Какое из указанных веществ имеет ковалентную неполярную связь?
1) O2 2) Na 3) KCl 4) h3S
94. Ковалентная неполярная связь между атомами характерна для молекулы
1) хлора
2) сероводорода
3) углекислого газа
4) Аммиака
95. Одинаковый вид химической связи имеют оксид кальция и
1) кальций
2) оксид азота(II)
3) хлорид бария
4) Сероводород
96. В каком веществе ковалентная полярная связь?
1) HCl 2) KCl 3) K2O 4) O2
97. Ковалентная полярная связь образуется между атомами
1) натрия и брома
2) серы и кислорода
3) водорода и водорода
4) калия и хлора
98. Для какого из веществ характерна ковалентная полярная связь?
- Nh4 2) CaCl2 3) Li2O 4) N2
99. Какой вид химической связи характерен для вещества, формула которого К2О?
Какой вид химической связи характерен для вещества, формула которого К2О?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
100. Какой вид химической связи характерен для вещества, формула которого Nh4?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
101. Одинаковый вид химической связи в веществах, формулы которых
1) Cu и CuCl2
2) HCl и Cl2O7
3) O2 и CaO
4) Na2S и SO2
102. Какой вид химической связи в молекуле аммиака?
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) Металлическая
103. Ковалентная полярная связь характерна для вещества, формула которого
- KCl
2) Nh4
3) O2
4) Na
104. Одинаковый вид химической связи имеют
1) кальций и хлорид лития
2) сульфид калия и оксид азота(I)
3) водород и кремний
4) хлороводород и оксид бария
105. Веществом с ионной связью является
Веществом с ионной связью является
1) оксид серы(VI)
2) водород
3) магний
4) фторид натрия
106. Веществом с ковалентной полярной связью является
1) иодид лития
2) алюминий
3) оксид азота(II)
4) Азот
107. Какой вид химической связи в сульфиде калия?
1) ионная связь
2) ковалентная полярная связь
3) ковалентная неполярная связь
4) металлическая связь
108. Химическая связь в молекуле кислорода
1) ковалентная полярная
2) ковалентная неполярная
3) металлическая
4) ионная
109 . Такой же вид химической связи, как и для молекулы кислорода, характерен для
1) серы
2) натрия
3) оксида кальция
4) хлорида лития
110. Какой вид химической связи в оксиде кальция?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
111. Ковалентную неполярную связь имеет каждое из двух веществ:
1) вода и хлор
2) натрий и сероводород
3) иод и фосфор
4) хлорид бария и сера
112. Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно
Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) кислород и водород
2) вода и хлороводород
3) вода и водород
4) вода и хлорид натрия
113. Ковалентная полярная связь образуется между атомами
1) лития и кислорода
2) серы и натрия
3) хлора и водорода
4) магния и фтора
114. Какой вид химической связи характерен для вещества, формула которого Na2S?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
115. Какое из указанных веществ имеет ионную химическую связь?
1) оксид кремния
2) бромид калия
3) магний
4) Сероводород
116. Для какого из веществ характерна ковалентная неполярная связь?
1) K 2) Si 3) CO 4) CaO
117. Одинаковый вид химической связи имеют сероводород и
1) оксид кальция
2) магний
3) хлорид кальция
4) Аммиак
118. Вещество с ионным типом связи
Вещество с ионным типом связи
1) SO3
2) Nh4
3) Ca
4) CaO
119. Веществом с ионной связью является
1) хлороводород
2) хлорид кальция
3) хлор
4) хлорная кислота
120. Веществом с ионной связью является
1) оксид серы (IV)
2) оксид бария
3) сероводород
4) аммиак
121. Химическая связь в молекулах серы S8
1) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) Металлическая
122. Химическая связь в молекуле углекислого газа
1) ионная
2) ковалентная неполярная
3) ковалентная полярная
4) Металлическая
123. Ковалентная полярная связь образуется между атомами
1) фтора и фтора
2) натрия и кислорода
3) калия и хлора
4) серы и фтора
124. Химическая связь в молекуле оксида азота(IV)
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
125.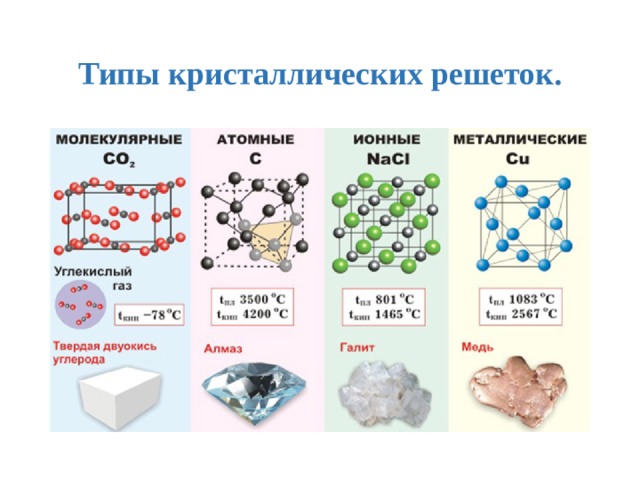 Веществом с ковалентной неполярной связью является
Веществом с ковалентной неполярной связью является
1) h3S
2) S8
3) Na
4) CuO
126. Химическая связь в молекуле P4
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) Водородная
127. Ковалентную связь имеет каждое из двух веществ ряда:
- P2O5 и O2
2) CaC2 и CO
3) P4 и NaF
4) CuO и N2O5
128. Ионная связь образуется между атомами
1) брома и фтора
2) кислорода и водорода
3) хлора и натрия
4) натрия и калия
129. Веществом с ковалентной неполярной связью является
1) аммиак
2) алмаз
3) оксид углерода (IV)
4) Сероводород
130. Химическая связь в оксиде кальция
1) металлическая
2) ионная
3) ковалентная полярная
4) ковалентная неполярная
131. Ковалентная полярная связь реализуется в веществе
1) h3
2) K2O
3) SO3
4) Hg
132.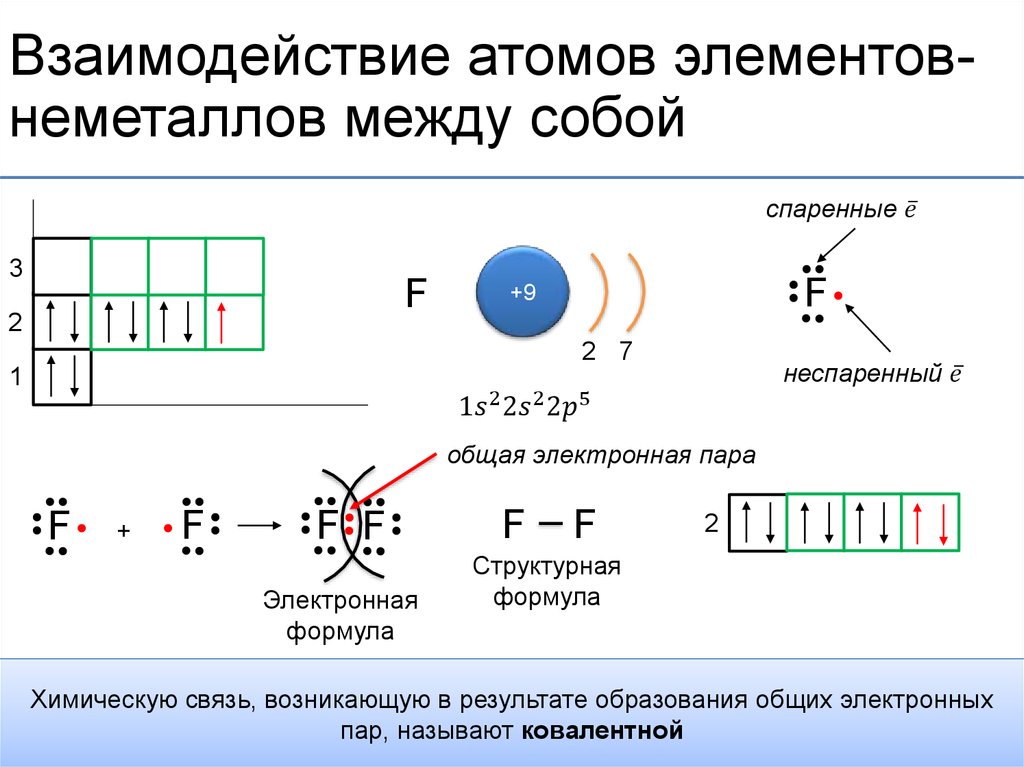 Вид химической связи в молекуле О2 такой же, как и в
Вид химической связи в молекуле О2 такой же, как и в
- Nh4
2) K2O
3) Br2
4) h3O
133. Тип химической связи в молекуле h3S такой же, как и в
1) Ch5
2) O2
3) MgO
4) CaCl2
134. Какой тип химической связи в молекуле I2?
1) металлическая
2) ковалентная полярная
3) ковалентная неполярная
4) Ионная
135. Химическая связь в молекуле CO
1) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) Водородная
136. Химическая связь в молекуле HCl
1) водородная
2) ковалентная неполярная
3) ковалентная полярная
4) ионная
137. Химическая связь в молекуле Nh4
- ковалентная неполярная
2) ковалентная полярная
3) ионная
4) Водородная
138. Ковалентная неполярная связь реализуется в веществе:
1) NaH
2) h3O
3) CO2
4) С (алмаз)
139.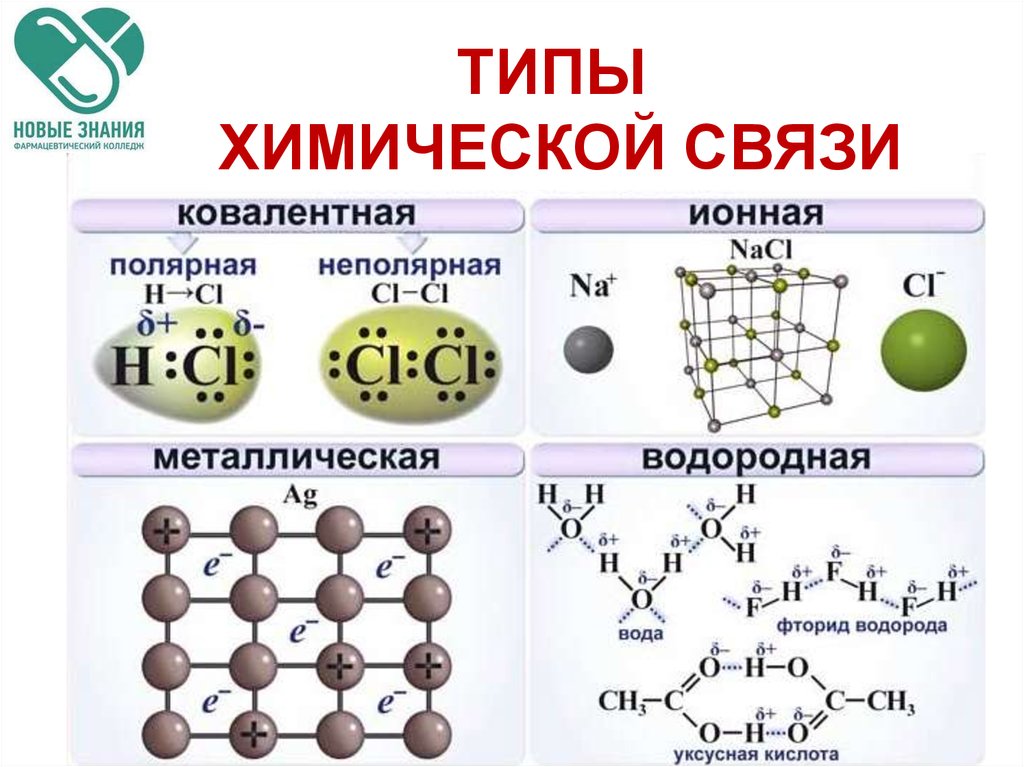 Химическая связь в P4
Химическая связь в P4
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
140. Веществом с ионной связью является
1) азотная кислота
2) азот
3) нитрат натрия
4) оксид азота (IV)
Молекула серы ${{\text{S}}_{\text{8}}}$ может быть представлена как:A.Кубическая структураB.Сферическая структураC.Тетраэдрическая структураD.W-образная кольцевая структура
Дата последнего обновления: 12 апреля 2023
•
Общее представление: 276,6K
•
Просмотры сегодня: 6,49K
Ответ
Проверено
276.6K+ Views
Hint: $ {{\ Text {S}} {S {S}} {S}} {S}}} {S}} {S}} {S}}} {\text{8}}}$ состоит из восьми молекул серы, связанных друг с другом одинарной ковалентной связью, где каждая сера имеет ковалентность 2 и степень окисления, равную нулю, и образует замкнутую структуру в форме короны или кольцевую структуру.
Полный пошаговый ответ:
Теперь давайте рассмотрим эту молекулу серы более детально:
— Всем вам важно знать, что ${{\text{S}}_{\ text{8}}}$ Октасера — это неорганическое химическое вещество. Он желтого цвета, без запаха и вкуса. Это самый распространенный аллотроп серы.
— Молекула серы ${{\text{S}}_{\text{8}}}$ принимает конформацию в форме короны, которая иногда также известна как W-образная кольцевая структура, в которой каждая сера связана друг с другом. с одинарной ковалентной связью, как показано на следующей диаграмме:
Следовательно, правильный ответ – Вариант (D)
Дополнительная информация: Как вы все знаете, сера является неметаллом, имеющим атомный номер 16 и атомный вес 32 ед. В настоящее время сера имеет 30 хорошо охарактеризованных изотопов. И ни один другой элемент не образует твердых аллотропов больше, чем сера. Из всех этих аллотропов серы ромбическая сера является наиболее стабильной формой серы при комнатной температуре.
Примечание:
Мы упоминали термин аллотроп в нашем обсуждении, так что стоит знать о нем. Существует свойство, называемое аллотропией, которое является свойством химических элементов существовать более чем в одной форме, которые отличаются друг от друга с точки зрения физических состояний, и эти различные формы элементов известны как его аллотропы.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий класс электродного потенциала 12 химия JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 химия JEE_Main
Какой элемент обладает наибольшим атомным радиусом A класс 11 химия JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Фосфин получают из следующей руды A Химический класс кальция 12 JEE_Main
Тенденции сомнений
Почему «октасера» является наиболее стабильной формой серы? – Журнал молодых ученых
Рисунок 1: Молекула серы
Резюме:
Периодическая таблица состоит из 118 открытых элементов.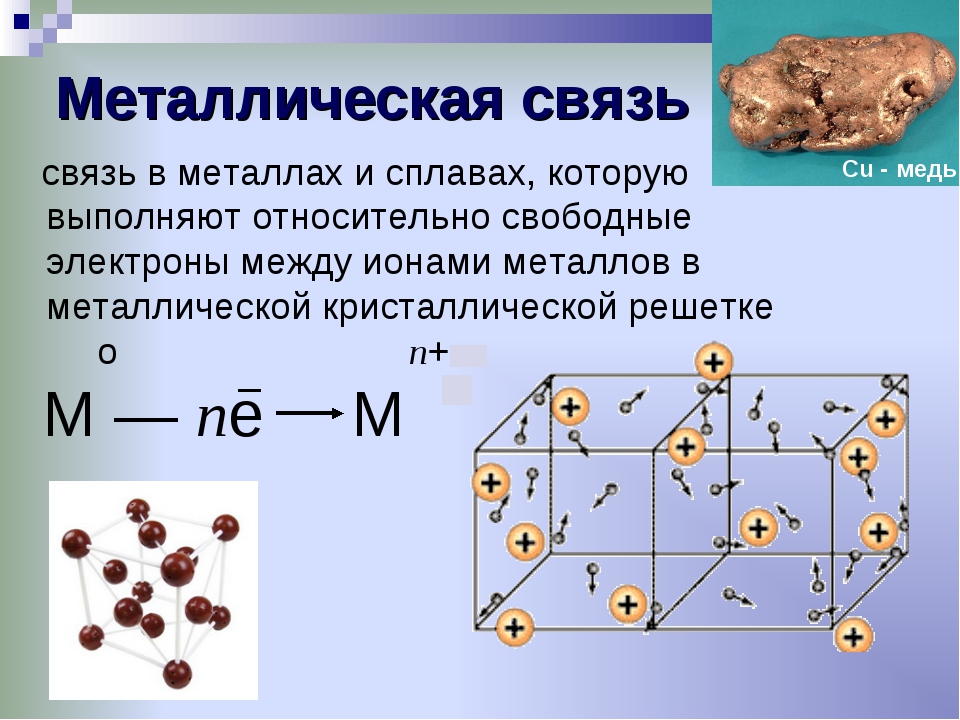 Каждый из них обладает уникальными свойствами, отличающими его от другого. Однако элементы могут быть отнесены к разным категориям на основе некоторых конкретных критериев. Одним из наиболее распространенных способов классификации элементов является металлы, неметаллы и металлоиды.
Каждый из них обладает уникальными свойствами, отличающими его от другого. Однако элементы могут быть отнесены к разным категориям на основе некоторых конкретных критериев. Одним из наиболее распространенных способов классификации элементов является металлы, неметаллы и металлоиды.
Сера занимает уникальное положение в периодической таблице, как и другие элементы. Одним из самых интригующих свойств серы является то, что при комнатной температуре и условиях нормального давления (RTP) она существует в виде элементарной молекулы, состоящей из 8 атомов. Спрашивается, почему в нормальных условиях она не может существовать в виде молекулы, состоящей из 2,3 и даже более 8 атомов, тогда как кислород, имеющий ту же валентность, что и сера, существует преимущественно в виде двухатомной элементарной молекулы.
Важно отметить, что сера имеет множество других структурных форм с точки зрения количества или расположения атомов. Они менее распространены и обнаруживаются в более суровых условиях температуры и давления. Тем не менее, Цель этой статьи состоит в том, чтобы определить причину существования серы в октаатомной форме при РТП.
Тем не менее, Цель этой статьи состоит в том, чтобы определить причину существования серы в октаатомной форме при РТП.
Поляризуемость, катенация, Лондонские дисперсионные силы, энергия связи, правило двойной связи, теория VSEPR H 2 ), кислород (O 2 , O 3 ), хлор (Cl 2 ), азот (N 2 ) и сера (S 8 ).
Наиболее распространенная форма серы (α-сера, термодинамически стабильная) представляет собой орторомбический полиморф S 8 , имеющий структуру «короны». Сера имеет более 30 аллотропных форм, включая дисульфур. Кольца серы из 6, 7, 9–15, 18 и 20 атомов известны, но менее стабильны. Что определяет стабильность S 8 ?
Обсуждение: «Размер атома представляет собой среднее расстояние от ядра до границы окружающего облака электронов». [1] Его также называют атомным радиусом.
Тенденции размеров атомов, наблюдаемые в периодической таблице, связаны с тремя факторами:
- Количество протонов (ядерный заряд) в ядре
- Количество энергетических уровней, содержащих электроны
- Количество валентных электронов [2]
Сера имеет 16 протонов, 3 энергетических уровня и 6 электронов на внешнем энергетическом уровне, что дает ей электронную конфигурацию 1s² 2s², 2p⁶, 3s², 3p⁴. Анализируя положение серы и тенденции в периодической таблице, мы можем с уверенностью предсказать, что сера имеет небольшую атомный размер по сравнению с большинством элементов периодической таблицы.
Рисунок 2: Периодическая таблица элементов: размер атома (источник: sciencenotes.org)
Можно заметить, что размер атома в целом уменьшается по периодам и увеличивается по группам стол.
Однако по сравнению с кислородом , который имеет ту же валентность [1] , что и сера, атомный размер серы относительно велик. Это приводит к тому, что она ведет себя иначе, чем кислород, поскольку размер атома, как мы узнали, прямо или косвенно влияет на различные другие свойства серы и образование ее связей. Например, меньший размер атома означает большую электроотрицательность. Следовательно, электроотрицательность серы больше, чем у большинства элементов периодической таблицы.
Это приводит к тому, что она ведет себя иначе, чем кислород, поскольку размер атома, как мы узнали, прямо или косвенно влияет на различные другие свойства серы и образование ее связей. Например, меньший размер атома означает большую электроотрицательность. Следовательно, электроотрицательность серы больше, чем у большинства элементов периодической таблицы.
Элемент | Атомный Номер | Эмпирический атомный радиус (в пм) | Расчетный атомный радиус (в личку) | Радиус Ван-дер-Ваальса | Ковалентный (одинарная связь) радиус |
|---|---|---|---|---|---|
Сера | 16 | 100 | 88 | 180 | 102 |
Кислород | 8 | 60 | 48 | 152 | 73 |
Рис. 3: Атомные радиусы серы и кислорода (источник: webelements.com)
3: Атомные радиусы серы и кислорода (источник: webelements.com)
Электроотрицательность является мерой относительной склонности атома притягивать общую пару электронов в ковалентной связи. Фтор (наиболее электроотрицательный элемент) имеет значение 3,98, а франций (наименее электроотрицательный элемент в теории) имеет электроотрицательность 0,7 по шкале Полинга [2] . [3] Электроотрицательность серы 2,58, кислорода 3,44. [4][5] Очевидно, что кислород более электроотрицателен, чем сера. Это означает, что при ковалентной связи с серой кислород будет притягивать к себе электроны сильнее, чем сера. Он приобретет частичный отрицательный заряд.
Когда атомный номер увеличивается, количество электронов также увеличивается, чтобы поддерживать нейтральность атома. Но увеличится ли количество энергетических уровней, зависит от того, «насколько» увеличилось количество электронов. Например, если К-оболочка содержит 2 электрона, добавление 1 электрона приведет к добавлению еще одного энергетического уровня, то есть L-оболочки. Если атомный номер Z=3, то добавление электрона не приведет к добавлению энергетического уровня. Это произойдет только тогда, когда добавится еще по крайней мере 8 электронов. В общем
Если атомный номер Z=3, то добавление электрона не приведет к добавлению энергетического уровня. Это произойдет только тогда, когда добавится еще по крайней мере 8 электронов. В общем
количество электронов, которое нужно добавить, чтобы добавить другую оболочку = (максимальное количество электронов, которое может удерживать текущая валентная оболочка) – (количество электронов, которые в настоящее время удерживает валентная оболочка) + 1
Вот иллюстрация того, как атомный номер и экранирование определяют эффективный заряд ядра:
За счет этого уменьшается размер атома. Но вниз по группе в периодической таблице эффективный заряд ядра почти не меняется. Однако добавление оболочки каждый раз приводит к увеличению атомного радиуса.
Следовательно, как правило, по мере того, как элементы становятся больше, эффективный ядерный заряд валентных электронов уменьшается из-за экранирования, обеспечиваемого электронами внутренней оболочки. Таким образом, валентные электроны могут двигаться более свободно. Удобный атомный размер серы и наличие большего количества (то есть 6) валентных электронов позволяют односвязным атомам серы связываться и поляризоваться легче по сравнению со многими другими элементами. Это утверждение дополнительно объясняется в обсуждениях поляризуемости и катенации в статье.
Удобный атомный размер серы и наличие большего количества (то есть 6) валентных электронов позволяют односвязным атомам серы связываться и поляризоваться легче по сравнению со многими другими элементами. Это утверждение дополнительно объясняется в обсуждениях поляризуемости и катенации в статье.
Поскольку кислород имеет меньший атомный размер, в случае образования одинарных связей молекул кислорода больше межэлектронных отталкиваний из-за большего количества неподеленных пар электронов. Следовательно, двухатомный кислород, в котором атомы кислорода имеют две общие пары электронов (т. Е. Молекула с двойной связью), более распространен. Но в случае одинарных серных связей отталкивание между неподеленными парами электронов не очень велико, поскольку размер увеличился.
Бонд Энергия — это мера прочности химической связи, которая определяется путем измерения количества тепла (или энтальпии), необходимого для расщепления моля молекул на составляющие их отдельные атомы.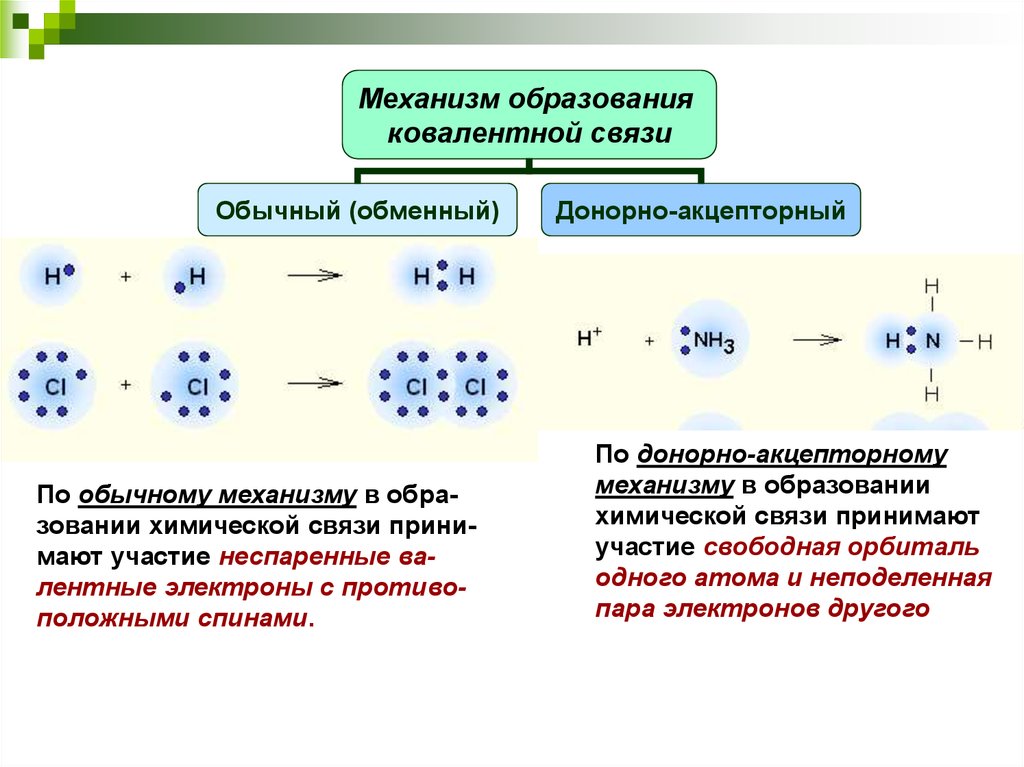 [6]
[6]
Энергия связи S-S составляет около 215 кДж/моль, а энергия связи О-О составляет около 140 кДж/моль. [7] Таким образом, одинарные атомы серы связаны более прочно по сравнению с одинарными атомами кислорода. Но одинарная связь между двумя атомами серы не удовлетворяет валентности обоих атомов. Следовательно, образуется более длинная цепочка атомов серы, и сера имеет гораздо большую склонность к катенированию [3] по сравнению с кислородом.
Углерод имеет электроотрицательность 2,55 по шкале Полинга, а сера 2,58. [4] Таким образом, их электроотрицательность очень близка. Но их атомный размер и валентность различаются. Углерод намного меньше и имеет только 4 валентных электрона. Оба эти фактора размера и четырехвалентности позволяют углероду проявлять наивысшую степень катенации. Кроме того, энергия связи СС составляет около 345 кДж/моль [7] (больше, чем у серы, что делает связи СС сильнее). Это делает длинные цепи углерода очень стабильными. Следовательно, цепи серы намного меньше по сравнению с углеродом, чтобы поддерживать стабильность.
Следовательно, цепи серы намного меньше по сравнению с углеродом, чтобы поддерживать стабильность.
Учитывая нормальные условия температуры и давления , сера кажется наиболее стабильной в форме «ромбической» октасеры, хотя другие аллотропы также существуют в относительно гораздо меньшем количестве. Например, при 95,3 °С (368,45 К) α-сера (ромбическая октасера) превращается в β-серу (моноклинную). [8]
При очень высоких температурах цепи серы рвутся с образованием более мелких молекул, таких как S 2 , которые преобладают в этих условиях. Итак, мы видим, что условия окружающей среды сильно влияют на образование связей между элементами. Рис. 5. Переход серы из ромбической формы в моноциклическую (источник: thechemistrysite) между атомами элементов с большей разницей в их электроотрицательностях. Атомы одних и тех же элементов имеют одинаковую электроотрицательность, поэтому атомы серы равны 9.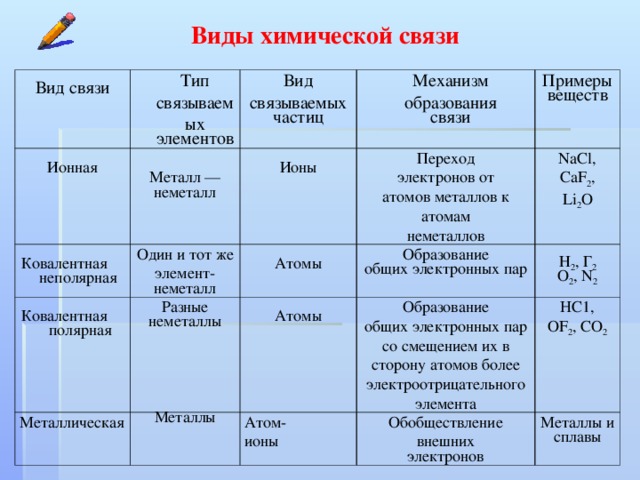 0078 ковалентно, и неионно, связаны с (электроны общие) с образованием молекул серы.
0078 ковалентно, и неионно, связаны с (электроны общие) с образованием молекул серы.
Рисунок 6: Разница в электроотрицательности между связывающими атомами (источник: chem.libretexts.org)
одни и те же элементы. Причина в том, что в таком случае молекула не поляризована и имеет общее равномерное распределение электронов между составляющими атомами. Однако иногда образуются мгновенные или мгновенные диполи. Это происходит за счет образования электронно-плотной области в одной молекуле, которая индуцирует диполи в других молекулах. Эти диполи притягиваются друг к другу, и сила между ними известна как лондонская дисперсионная сила. Лондонские дисперсионные силы сильнее в тех молекулах, которые представляют собой не компактные, а более длинные цепочки элементов. Это дополнительный фактор в случае таких молекул, как S8, что приводит к более сильным связям между ними. 9Рисунок 7: Электростатическое притяжение (Источник: chem.ucla.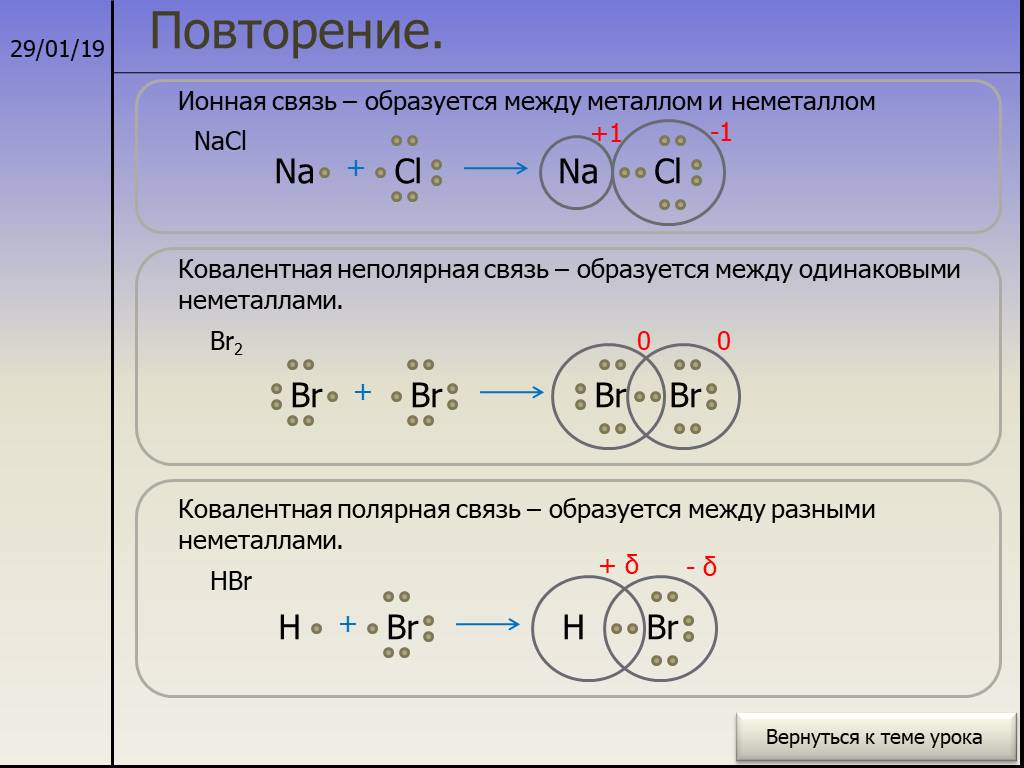 edu) . [9]
edu) . [9]
Чем больше расстояние электронов от ядра, тем меньше влияние заряда ядра на распределение электронов. [10] Это означает, что электроны могут свободно двигаться. Это позволяет больше искажений в распределение электронов или, скажем, большая изменчивость электронной плотности, и поляризуемость атома увеличивается. Это, в свою очередь, влияет на поляризуемость молекулы/соединения, частью которого является атом. Обратите внимание, что поскольку составляющие атомы больше, молекула также будет больше.
Сера при комнатной температуре «цепляется» с образованием восьмиатомной молекулы. Но почему?
Катетерация — это способность элементов к самосвязыванию. Большее сцепление означает образование более крупных молекул, что приводит к большей поляризуемости, что, в свою очередь, увеличивает вероятность образования мгновенных диполей. Это увеличивает силу межмолекулярные силы , здесь лондонские силы дисперсии между молекулами серы. Чем сильнее проявление дисперсионных сил, тем короче расстояние между двумя соответствующими молекулами. Это означает, что молекулы более прочно связаны друг с другом, поскольку для разрыва химической связи [4] между ними потребуется больше энергии. Хорошей аналогией для объяснения того, почему это происходит, была бы гравитационная сила между двумя точечными массами. Сила увеличивается по мере уменьшения расстояния между двумя объектами и наоборот. Объекты теперь испытывают большее притяжение друг к другу.
Чем сильнее проявление дисперсионных сил, тем короче расстояние между двумя соответствующими молекулами. Это означает, что молекулы более прочно связаны друг с другом, поскольку для разрыва химической связи [4] между ними потребуется больше энергии. Хорошей аналогией для объяснения того, почему это происходит, была бы гравитационная сила между двумя точечными массами. Сила увеличивается по мере уменьшения расстояния между двумя объектами и наоборот. Объекты теперь испытывают большее притяжение друг к другу.
Уменьшение длины связи [5] между двумя атомами (здесь атомы, составляющие молекулу) также выступает вторичным фактором, способствующим уменьшению межмолекулярного пространства между молекулами. Изменение кинетических энергий частиц (атомов, ионов, молекул) пропорционально вызывает изменение количества столкновений между частицами и, как следствие, изменение расстояния между ними. В сущности, расстояние между двумя молекулами, их энергия диссоциации связи и их кинетическая энергия определяют состояние вещества, состоящего из таких молекул.
Теперь, когда межмолекулярное пространство уменьшается, агрегация молекул (то есть вещества) увеличивает шансы быть твердым при комнатной температуре и условиях нормального давления. С другой стороны, если межмолекулярное пространство увеличивается, вещество с большей вероятностью будет находиться в жидком или газообразном состояниях. Точное состояние зависит от рассматриваемого вещества и его свойств.
Как было замечено, в окружающей среде сера из-за ее свойств, которые обсуждались, преимущественно содержится в в твердом состоянии , тогда как большинство неметаллов и молекул, связанных лондонскими дисперсионными силами, находятся в газообразном состоянии.
Как сказано в «Новых связях элемента-углерода (pp)π» Питера Ютци,
«Правило двойной связи утверждает, что химические элементы с главным квантовым числом [6] больше чем 2 (например, элементы периода 3 и ниже) не образуют кратных связей (например, двойных связей и тройных связей) друг с другом или с другими элементами. Двойные связи, если они существуют, слабы из-за слабых пи-связей в результате плохого перекрытия орбиталей… Примером может служить быстрая полимеризация, происходящая при конденсации дисеры, тяжелого аналога О 2 ». [12]
Двойные связи, если они существуют, слабы из-за слабых пи-связей в результате плохого перекрытия орбиталей… Примером может служить быстрая полимеризация, происходящая при конденсации дисеры, тяжелого аналога О 2 ». [12]
Сера, как мы знаем, является элементом 3 Периода. Таким образом, это правило объясняет стабильную природу октасеры вместо дисеры.
Ковалентная связь между двумя атомами образуется, когда их орбитали перекрываются и между ними образуются электронные пары. Степень перекрытия задействованных орбиталей является важным фактором, определяющим прочность ковалентной связи. Орбитали, которые больше перекрываются, структурируют более прочные связи, чем те, которые имеют меньшее перекрытие орбиталей. [13]
Мы уже обсуждали, что атомный размер серы больше, чем атомы кислорода и углерода. Поскольку атомный радиус больше, расстояние между двумя атомами серы также больше, что приводит к очень плохому перекрытию пи-орбиталей.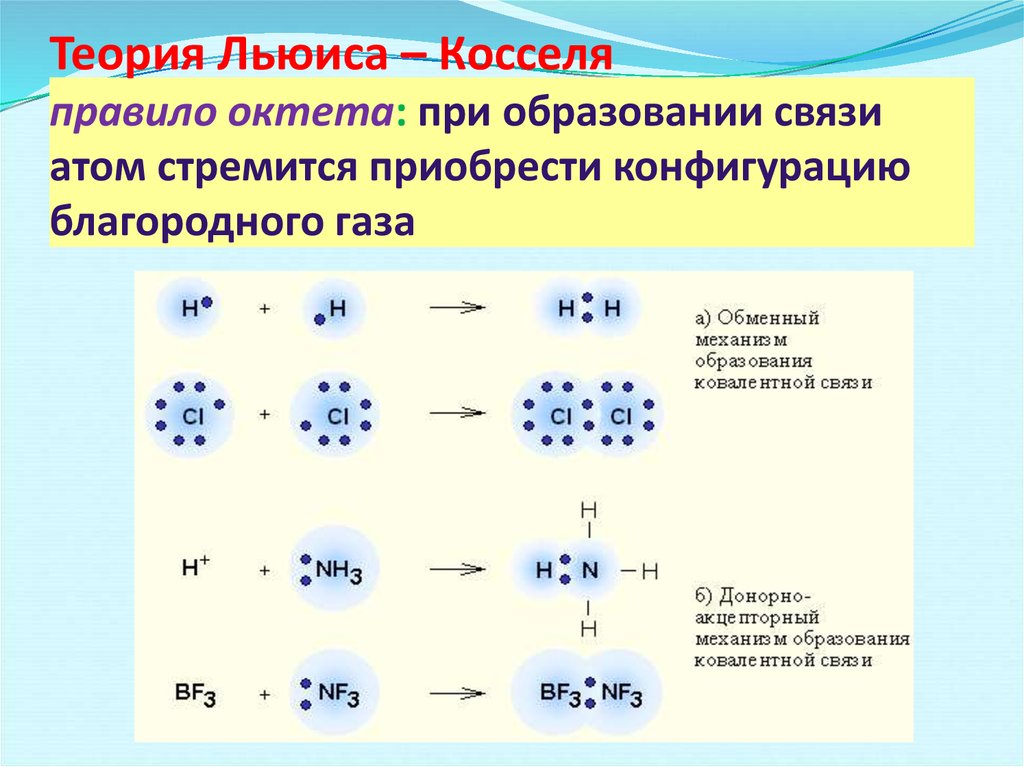
Основное предположение теории VSEPR [7] заключается в том, что каждый атом в молекуле стремится достичь геометрии, которая минимизирует отталкивание между валентными электронами этого атома. [14] Атомы серы, как видно на рисунке 7, содержат две неподеленные пары. Расположение восьми атомов серы в коронной структуре сводит к минимуму межэлектронные отталкивания между неподеленными парами, тем самым увеличивая стабильность молекулы.
Рисунок 8: Структура короны октасеры. Каждый атом серы имеет 2 неподеленные пары электронов.
Заключение: На протяжении всего обсуждения сера описывалась в сравнении с двумя элементами – кислородом и углеродом. Поскольку сера имеет ту же валентность, что и кислород, предполагается, что она имеет аналогичные свойства образования связи. Но эта идея далека от реальности. Множество факторов, многие из которых пока неизвестны, играют существенную роль в образовании молекул.
Очень немногие элементы (C, S, B, P, Si) способны проявлять цепную связь. Склонность углерода к цепочке намного превосходит любой элемент периодической таблицы. Энергия связи S-S ниже, чем у C-C, и, следовательно, тенденция катенации также ниже. Другие факторы включают больший размер серы и большую длину связи. Энергия связи SS больше, чем энергия связи O-O, что позволяет связывать больше кислорода. Кислород гораздо более стабилен, когда он образует двойную связь, чем одинарную. Энергия связи О-О составляет около 140 кДж/моль, а энергия связи О=О составляет около 49 кДж/моль.8кДж/моль. Но энергия связи S-S составляет около 215 кДж/моль, тогда как энергия связи S=S составляет около 425 кДж/моль. [15] Но дисера (S=S) редко встречается при комнатной температуре. Он легко подвергается фотодиссоциации в течение примерно 7,5 минут на солнечном свете. [16] Нестабильность дисульфура обычно описывается в связи с правилом двойной связи.
Энергия связи S-S в S 8 составляет около 226 кДж/моль.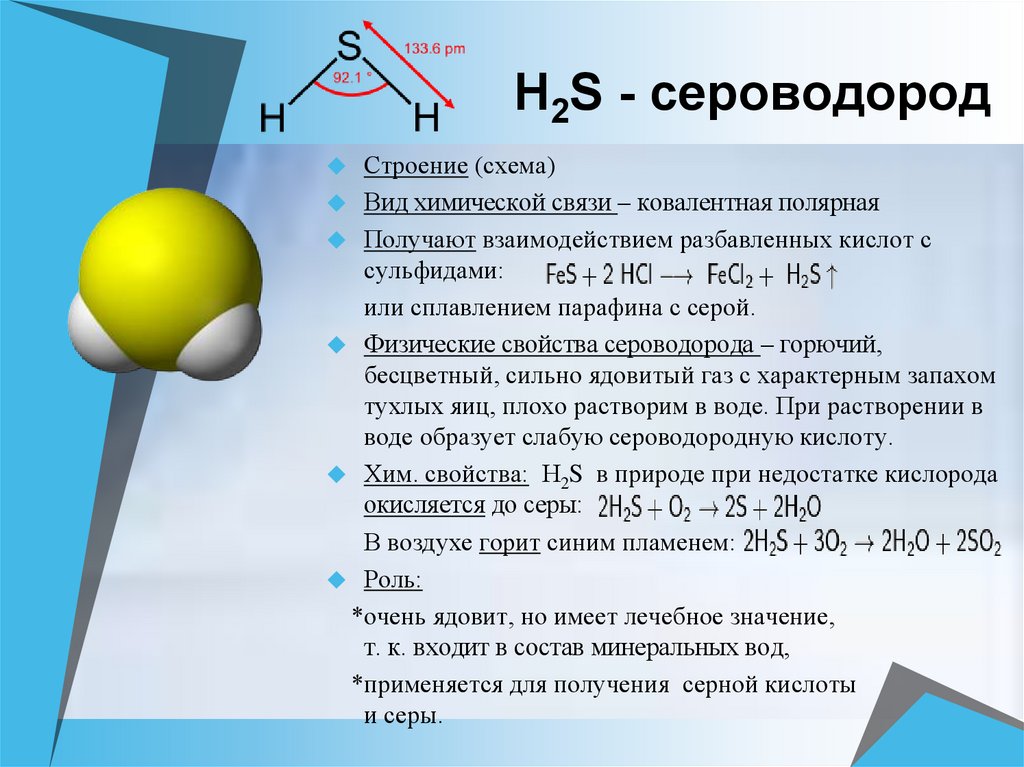 В основном он находится в твердом состоянии. Размер октасеры и структура короны обеспечивают большую поляризуемость и большую силу дисперсионных сил. Следовательно, молекула более стабильна.
В основном он находится в твердом состоянии. Размер октасеры и структура короны обеспечивают большую поляризуемость и большую силу дисперсионных сил. Следовательно, молекула более стабильна.
Атомный номер и другие факторы определяют размер атома. Они определяют электроотрицательность элемента, которая определяет тип внутримолекулярных сил, существующих между атомами, в свою очередь влияющих на характер межмолекулярных сил между молекулами. Эти и многие другие свойства определяют физические и химические свойства молекул. Все эти свойства взаимосвязаны и одно свойство зависит от другого.
Обсуждаемые условия и свойства являются факторами равновесия для стабильной серы (как вещества) в твердом состоянии, состоящем в основном из S 8 молекул при комнатной температуре и нормальном давлении.
Ссылки:- Дэвид Уайли и Ким Танос. «Атомный размер». Люмен Обучение . По состоянию на апрель 2021 г. https://courses.lumenlearning.
 com/introchem/chapter/atomic-size/
com/introchem/chapter/atomic-size/ - Ниру Хосла и Муруган Пал. «Периодические тенденции в атомном размере». СК-12 . Последнее изменение: 2 августа 2014 г. По состоянию на апрель 2021 г. https://www.ck12.org/book/ck-12-chemistry-second-edition/r18/section/9.2
- «Электроотрицательность». Школа Труро в Корнуолле . Последнее изменение: 16 августа 2020 г. По состоянию на апрель 2021 г.
https://chem.libretexts.org/@go/page/1496.
- «сера: электроотрицательность». Веб-элементы . По состоянию на апрель 2021 г. https://www.webelements.com/sulphur/electronegativity.html
- «Кислород: электроотрицательность». Веб-элементы. По состоянию на апрель 2021 г. https://www.webelements.com/oxygen/eectronegativity.html
- Дэвид Уайли и Ким Танос. «Энергия Бонда». Люмен Обучение . По состоянию на апрель 2021 г. https://courses.lumenlearning.com/introchem/chapter/bond-energy/
- «Сила связи и энергия».
 химических либретекстов (2019). Последнее изменение: 6 июня 2019 г. По состоянию на март 2021 г.
химических либретекстов (2019). Последнее изменение: 6 июня 2019 г. По состоянию на март 2021 г.
https://chem.libretexts.org/@go/page/98643.
- Гринвуд и Норман Н., Эрншоу, Алан. «Химия элементов (2-е изд.)». Баттерворт-Хайнеманн (1997). ISBN 0080379419. По состоянию на апрель 2021 г. .
- К. Чо. «Энциклопедия физики конденсированного состояния». Elsevier Academic Press (2005). По состоянию на апрель 2021 г.
https://www.sciencedirect.com/topics/engineering/polarizability
- «Поляризуемость». (2020). Последнее изменение: 16 августа 2020 г. По состоянию на март 2021 г. https://chem.libretexts.org/@go/page/1663.
- Размер укуса BBC. нд «Химическая формула – валентность». bbc.co.uk . По состоянию на апрель 2021 г. https://www.bbc.co.uk/bitesize/guides/zqrxsbk/revision/2.
- Юци и Питер. «Новый элемент-углерод (p-p)π связи». Angewandte Chemie International Edition на английском языке (1975).
 14 (4): 232–245. doi: 10.1002/anie.197502321. По состоянию на апрель 2021 г.
14 (4): 232–245. doi: 10.1002/anie.197502321. По состоянию на апрель 2021 г. - ОпенСтакс. нд Химия . По состоянию на 26 июня 2021 г.
https://opentextbc.ca/chemistry/chapter/8-1-valence-bond-theory/.
- Университет Пердью. нд «Теория отталкивания электронных пар валентной оболочки (VSEPR)». chemed.chem.purdue.edu . По состоянию на 14 июня 2021 г. https://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html.
- т.л. Коттрелл, «Сила химических связей», 2-е изд. Баттервортс , Лондон. 1958 год; Б. деБ. Дарвент, «Серия справочных данных по национальным стандартам», Национальное бюро стандартов, , № 31, Вашингтон, округ Колумбия, 1970; С.В. Benson, J. Chem. образования, 42, 502 (1965). По состоянию на июнь 2021 г.
http://www.wiredchemist.com/chemistry/data/bond_energies_lengths.html
- Ахерн, М. Ф.; Шлейхер, Д.Г.; Фельдман, П. Д. 1983. «Открытие S2 в комете IRAS-Araki-Alcock 1983d».
 Астрофизический журнал . 274 : L99. По состоянию на июнь 2021 г.
Астрофизический журнал . 274 : L99. По состоянию на июнь 2021 г.
Рисунок 1: Octasulphur
Иллюстрация создана автором самостоятельно.
Рисунок 2: Периодическая таблица элементов: размер атома
Тодд Хелменстайн, 2014 г.
https://sciencenotes.org/wp-content/uploads/2014/11/PeriodicTable_AtomicRadius.pdf
Рисунок 3: Атомные радиусы серы и кислорода:
Данные приведены на http://www. webelements.com/ из этих источников:
Атомный радиус (эмпирический):
JC Slater.1964. \»Атомные радиусы в кристаллах\». J. Chem. физ. 41: 3199. Бибкод: 1964JChPh..41.3199S. дои: 10.1063/1.1725697.
Атомный радиус (расчетный):
E. Клементи; Д.Л.Раймонди; В.П. Рейнхардт. 1967. «Константы атомного экранирования из функций SCF. II. Атомы с числом электронов от 37 до 86». J. Chem. физ. 47: 1300. Бибкод: 1967JChPh..47.1300C. дои: 10.1063/1.1712084.
Chem. физ. 47: 1300. Бибкод: 1967JChPh..47.1300C. дои: 10.1063/1.1712084.
Ван-дер-Ваальс радиус:
А. Бонди. 1964. «Ван-дер-Ваальсовы объемы и радиусы». J. Phys. Химия . 68: 441. doi: 10.1021/j100785a001.
М. Мантина; AC Чемберлин; Р. Валеро; Си Джей Крамер; Д.Г. Трухлар (2009). \»Согласованные радиусы Ван-дер-Ваальса для всей основной группы\». J. Phys. хим. А. 113 (19): 5806–12. Бибкод: 2009JPCA..113.5806M. дои: 10.1021/jp8111556. PMC 3658832. PMID 19382751.
Ковалентные радиусы (одинарная связь):
R.T. Сандерсон. 1962. «Химическая периодичность». Нью-Йорк, США: Рейнхольд.
Л.Э. Саттон. изд.1965. \»Приложение 1956–1959 гг., Спецвыпуск № 18\». Таблица межатомных расстояний и конфигурации в молекулах и ионах. Лондон, Великобритания: Химическое общество.
Дж. Э. Хьюи; Э.А. Кейтер и Р. Л. Кейтер. 1993. «Неорганическая химия: принципы строения и реакционной способности» (4-е изд.). Нью-Йорк, США: HarperCollins . ISBN 0-06-042995-X.
ISBN 0-06-042995-X.
В.В. Портерфилд. 1984. «Неорганическая химия, единый подход». Рединг, Массачусетс, США: Addison Wesley Publishing Co . ISBN 0-201-05660-7.
утра Джеймс и М.П. Господин. 1992. Химические и физические данные Макмиллана. Макмиллан . ISBN 0-333-51167-0.
Рисунок 4: Эффективный ядерный заряд
Иллюстрация создана автором самостоятельно.
Рисунок 5: Переход серы из ромбической формы в моноциклическую 6: Разница электроотрицательностей между связывающими атомами
CNX_Chem_07_02_DeltaEN.jpg
Рисунок 7: Электростатическое притяжение
0003
Рисунок 8: Структура короны из октасеры
https://mycbseguide.com/questions/25946/
Валентность — это комбинирующая способность элемента. Это зависит от количества валентных (то есть внешней оболочки) электронов. [11] ↑
Шкала Полинга является наиболее часто используемым методом измерения электроотрицательности.
 ↑
↑Катетерация — это способность элементов к самосвязыванию для образования более длинных цепей. ↑
Связь — это просто термин, используемый для обозначения связи или взаимодействия между двумя частицами. ↑
Длина связи определяется как расстояние между центрами двух ковалентно связанных атомов. По мере того, как связь становится прочнее, энергия связи увеличивается, а длина связи уменьшается. ↑
Число, которое Нильс Бор ввел для определения различных энергетических уровней дискретных орбит в своей модели атома. ↑
- Теория отталкивания электронных пар валентной оболочки
используется для предсказания формы молекулы на основе электронных пар, окружающих атомы молекулы. ↑
Об авторе
Амна Джавед учится в 10-м классе в Индии. Она проявляет большой интерес к науке, математике и искусству и хочет получить знания, сопровождаемые мудростью, насколько это возможно, в ее жизни.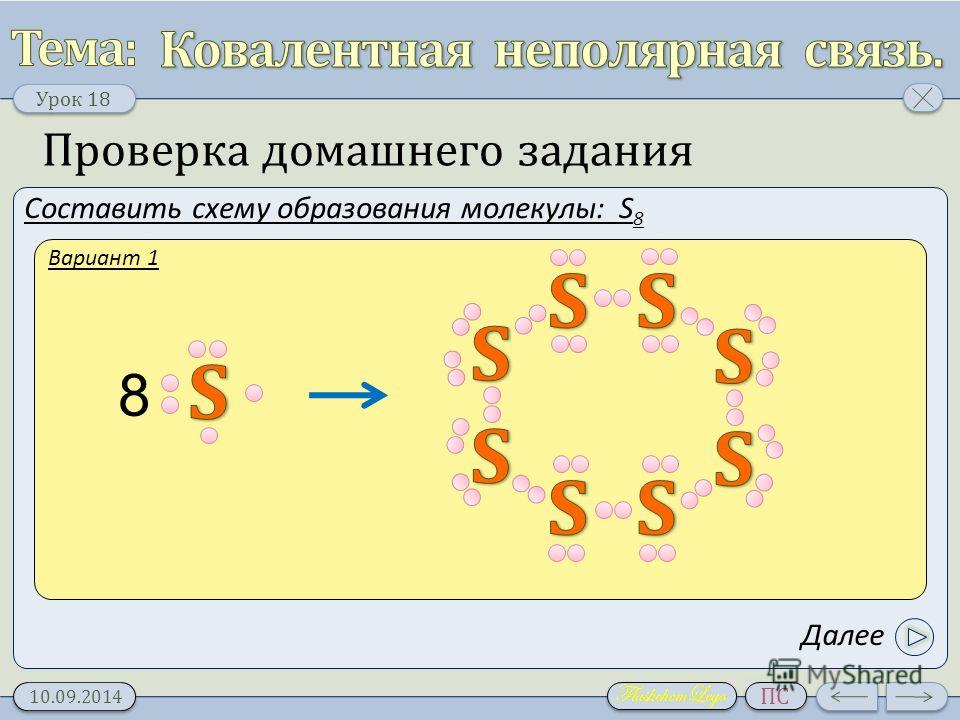

 com/introchem/chapter/atomic-size/
com/introchem/chapter/atomic-size/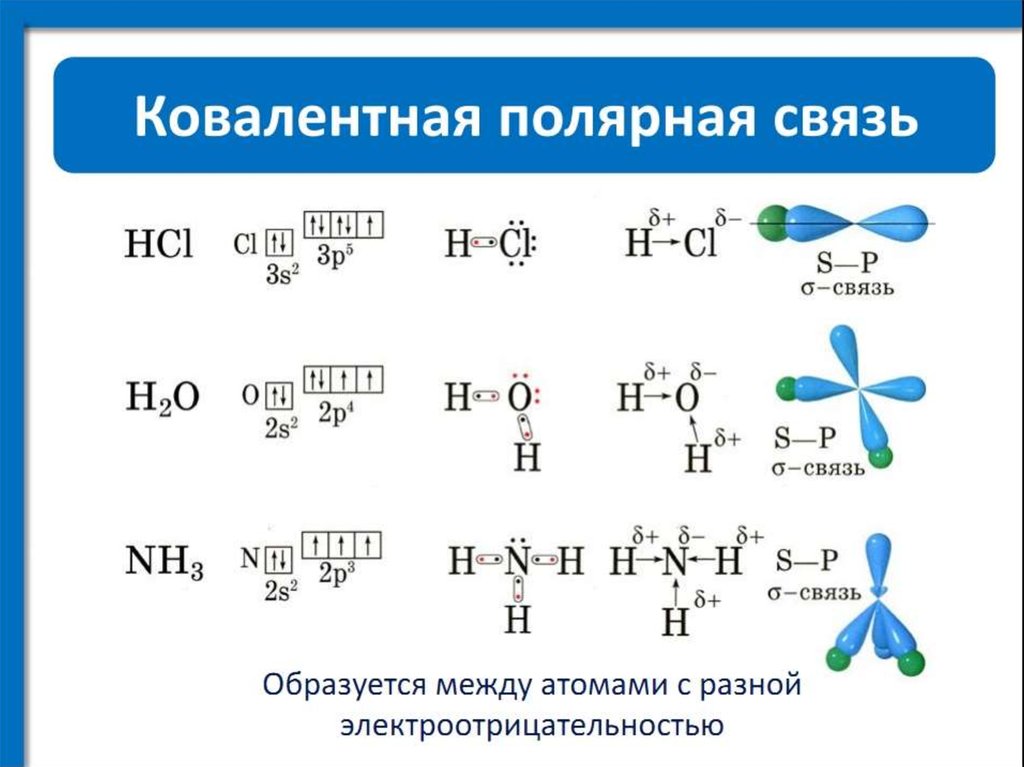 химических либретекстов (2019). Последнее изменение: 6 июня 2019 г. По состоянию на март 2021 г.
химических либретекстов (2019). Последнее изменение: 6 июня 2019 г. По состоянию на март 2021 г. 14 (4): 232–245. doi: 10.1002/anie.197502321. По состоянию на апрель 2021 г.
14 (4): 232–245. doi: 10.1002/anie.197502321. По состоянию на апрель 2021 г. Астрофизический журнал . 274 : L99. По состоянию на июнь 2021 г.
Астрофизический журнал . 274 : L99. По состоянию на июнь 2021 г.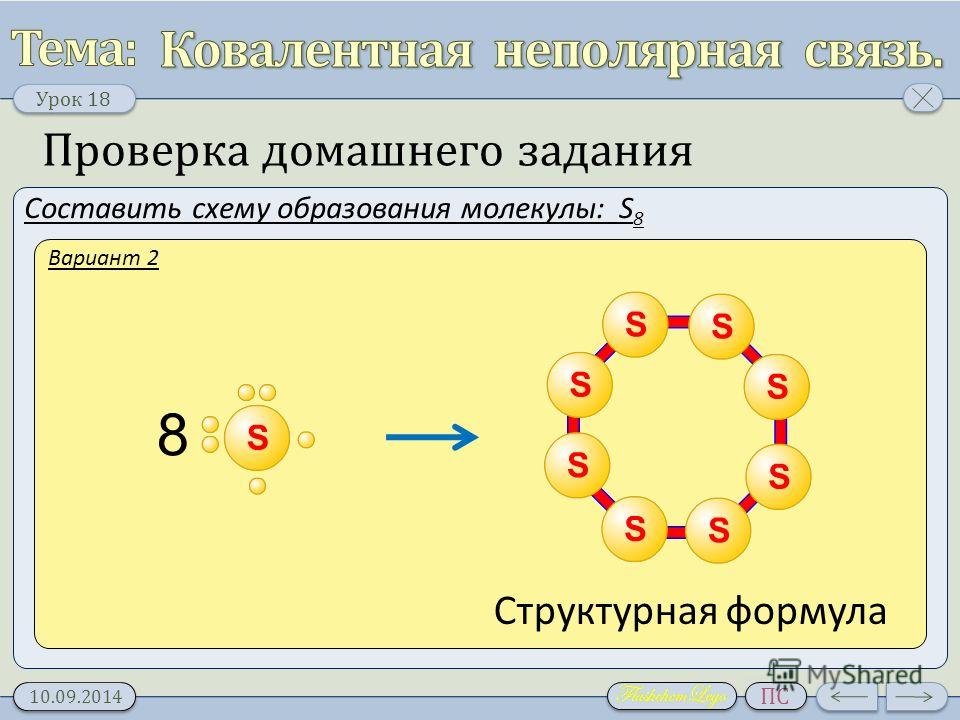 ↑
↑
Leave A Comment