Сероводород. Что это такое? Формула, соединения и примеры
Поможем понять и полюбить химию
Начать учиться
Чтобы сдать ОГЭ в 9‑м классе, нужно знать, что такое сероводород, и помнить его химические свойства. Давайте узнаем, что это за вещество, как его получают и в какие реакции оно вступает.
Сероводород — это молекулярное соединение с ковалентной полярной связью. По-другому это вещество называется сернистым водородом или сульфидом водорода. Химическая формула сероводорода — H2S.
Строение и физические свойства сероводорода
Сероводород — это бесцветный газ с характерным запахом тухлых яиц, сладкий на вкус, тяжелее воздуха. Малорастворим в воде, хорошо растворим в спирте. На воздухе легко воспламеняется. Очень ядовит.
Вдыхание паров сероводорода даже в малых количествах может привести к тяжелому отравлению. Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа.
Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа.
Противоядия при отравлении сероводородом — вещества-окислители. При слабом отравлении необходимо выйти на свежий воздух, то есть повысить концентрацию вдыхаемого кислорода. В случае более сильного отравления полезно очень осторожно вдохнуть пары хлора.
Состав H2S представлен двумя элементами-неметаллами, атомы которых связаны ковалентной полярной связью. Молекула этого газа имеет угловое строение, этим она схожа с молекулой воды, но по сравнению с водой в молекуле сероводорода слабые водородные связи. Связи S—H образуют валентный угол, равный 92,1о, как показано на структурной формуле сероводорода.
Знание физических свойств сульфида водорода может спасти кому-то жизнь, и это не единственное применение химической теории на практике. На курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart ученики не только разбирают задания экзамена, но и учатся применять полученные знания в реальной жизни.
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Способы получения сероводорода
Сероводород встречается в природе в вулканических газах и водах минеральных источников. Также он образуется в результате разложения белков погибших животных и растений, при гниении пищевых отбросов.
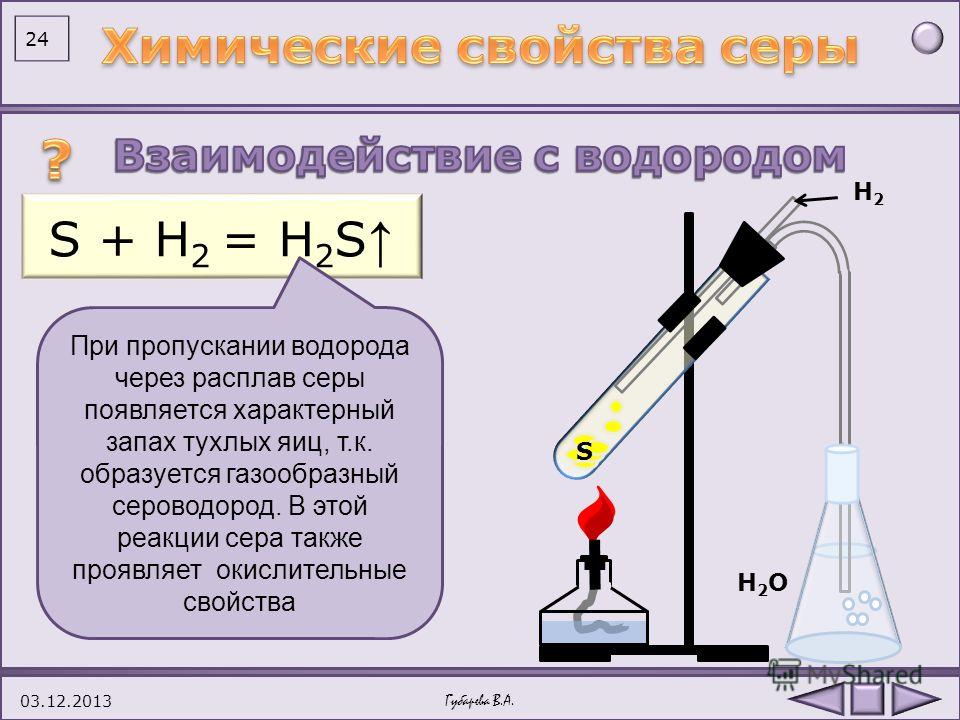
При высокой температуре сера взаимодействует с водородом, в результате образуется газ — сероводород:
H2 + S → H2S.
Практический способ получения сероводорода — действие разбавленных кислот на сульфиды:
FeS (тв) + 2HCl (разб) → H2S + FeCl2.
Полный гидролиз, в результате которого выделяется газ и выпадает осадок:
Al2S3 + 6H2O → 3H2S + 2Al(OH)3.

Сероводород можно получить путем нагревания смеси парафина и серы:
С20H42 + 21S → 21H2S + 20C.
Действие концентрированной серной кислоты на щелочные и щелочноземельные металлы:
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S + 4H2O.
Химические свойства сероводорода
Горение
На воздухе сероводород горит голубым пламенем. Процесс может протекать в двух направлениях:
2H2S + 3O2 → 2SO2 + 2H2O.
Если внести в пламя сероводорода холодный предмет, например фарфоровую чашку, температура пламени значительно снизится и сероводород окислится до свободной серы, оседающей на чашке в виде желтого налета:
2H2S + O2 → 2S + 2H2O.

Растворимость в воде
Сероводород растворим в воде. Его раствор называют сероводородной водой
Сероводородная кислота — это слабая кислота, она диссоциирует ступенчато, в основном диссоциация протекает по первой ступени:
H2S ⇄ H+ + HS−.
HS− ⇄ H+ + S2−.
Свойства кислот
Так как раствор сероводорода является кислотой, то для него характерны свойства кислот:
изменение цвета индикатора — лакмус становится розовым в растворе сероводорода;
взаимодействие с активными металлами:
H2S + Mg → MgS + H2;
раствор сероводорода реагирует с основными оксидами:
H2S + BaO → BaS + H2O;
взаимодействие со щелочами:
H2S + NaOH → NaHS + H2O;
H2S + 2NaOH → Na2S + 2H
сероводородная кислота может вступать в реакции обмена с солями, если одним из продуктов реакции будет нерастворимый сульфид:
H2S + CuCl2 → CuS↓ + 2HCl.

Взаимодействие с аммиаком
Раствор сероводородной кислоты взаимодействует с аммиаком:
H2S + 2NH3 → (NH4)2S.
Окисление металлов
Сероводород может окислять малоактивные металлы в присутствии кислорода:
4Ag + 2H2
Реакции с галогенами
Сероводород вступает в реакции с галогенами:
H2S + Cl2 → S + 2HCl.
Качественные реакции
Качественная реакция на сероводород — бумага, смоченная раствором нитрата свинца (II), чернеет в присутствии сероводорода:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3.
Восстановительные свойства
В молекуле сероводорода сера имеет низшую степень окисления, следовательно, сероводород проявляет свойства сильного восстановителя.
в реакции с бромной водой наблюдается обесцвечивание раствора:
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr;
окисление сероводорода подкисленным раствором перманганата калия:
5H2S + 2KMnO4 + 3H2SO4 → 5S + K
сероводород в кислой среде реагирует с дихроматом калия:
3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S + 7H2O;
взаимодействие с кислотами-окислителями (HNO3, H2SO4):
3H2S + 8HNO3 (разб) → 3H2SO4 + 8NO + 4H2O;
H2S + 8HNO3 (конц)
H2S + H2SO4 (конц) → S + SO2 + 2H2O.

Вопросы для самопроверки
Охарактеризуйте физические свойства сульфида водорода.
Перечислите свойства сероводородной кислоты. От чего зависит образование сульфидов и гидросульфидов?
Схеме превращений S−2 → S+4 соответствует уравнение:
2H2S + O2 → S + 2H2O
H2SO3 + H2O2 → H2SO4 + H2O
PbS + 4H2O2 → PbSO4 + 4H2O
2H2S + 3O2 → 2SO2 + 2H2O
Составьте уравнения четырех реакций, которые могут протекать между NaOH, H2S, CuCl2.

Верны ли следующие суждения?
А. Сероводород при взаимодействии со щелочами образует два вида солей: средние и кислые.
Б. Сероводород — восстановитель.
Верно только А
Верно только Б
Оба верны
Оба неверны
Татьяна Сосновцева
К предыдущей статье
231.8K
Валентность
К следующей статье
Химия углерода
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Сжигание серы, сероводорода, серной кислоты
English(int. )
Deutsch
English(USA)
English
Español
Français
Italiano
Português
日本語
简体中文
)
Deutsch
English(USA)
English
Español
Français
Italiano
Português
日本語
简体中文
Изготовление, сборка, тестирование и испытание технологических горелок для сжигания серы, сероводорода и серной кислоты
производится на заводах в Швейцарии, Германии, Франции, Турции, США, Японии и Кореи
Компания в России Интех ГмбХ / LLC Intech GmbH на рынке инжиниринговых услуг с 1997 года, официальный дистрибьютор различных производителей промышленного оборудования, предлагает Вашему вниманию технологические горелки для сжигания серы, сероводорода и серной кислоты.
Описание
1. Сжигание серы
Расход серы до 45 т/час, концентрация серы SO2 более 18%. Мощность горелки 15 МВт. Обеспечено свободное стабильное пламя без стабилизатора благодаря наличию ультразвукового распылителя-форсунки.
Серная горелка с двумя подогреваемыми фланцевыми трубками, тремя газовыми фланцевыми трубками и дополнительным демпфером для воздуха для горения для газового обогрева
2. Сжигание отработанной серной кислоты
Сжигание отработанной серной кислоты
Отработанная серная кислота комбинируется с:
- серой
- горючим газом
- с серой и газом
- со сжиганием газа, не подвергшегося сероочистке, или со сжиганием h3S
Горелка для серы в фланцевыми трубками и тремя газовыми фланцевыми трубками для отработанной серной кислоты. Газовые фланцевые трубки установлены симметрично вокруг горелки на передней плите камеры сгорания.
Стабильное свободное пламя без стабилизатора пламени на выпускном отверстии горелки благодаря высоко турбулентному ультразвуковому распылителю-форсунке.
3 Сжигание сероводорода (h3S)
Горелки могут использоваться в качестве топливных горелок-комбинаций с:
маслом в качестве поддерживающего или пускового топлива горючим газом в качестве поддерживающего или пускового топлива серой, сжигаемой вместе с h3S-газом или сжигание h3S-газа при впрыскивании отработанной серной кислоты в камеру сгорания сжигание вместе с сернистым газом, подача через переднюю панель камеры сгорания и/или через горелку
Горелка для сжигания газа h3S
4. Камеры сгорания сероводорода
Камеры сгорания сероводорода
Камера сжигания h3S
Различные камеры сгорания
Стабильное свободное пламя без стабилизатора пламени на выпускном отверстии горелки благодаря высоко турбулентному ультразвуковому распылителю-форсунке
5. Атомайзер для сжигания твердого шлама
Рабочая среда: различные твердые отходы. Температура горения: 1200 °С
Производительность: от 0,1 до 7 м3/час
Персонал компании Интех ГмбХ (Intech GmbH) готовы ответить на любые технические вопросы по поставляемому компанией промышленным горелкам для сжигания серы, сероводорода и серной кислоты.
Подогревающие печи конвекционного типа
Линии утилизации автомобильных покрышек для получения резиновой крошки
Печи для производства извести
Сероводород | Департамент здравоохранения штата Вашингтон
Что такое сероводород?
Сероводород представляет собой бесцветный легковоспламеняющийся газ с запахом тухлых яиц при низких концентрациях в воздухе. Он широко известен как канализационный газ, вонючая влага и навозный газ. При высоких концентрациях он имеет тошнотворный сладкий запах. При очень высоких уровнях человек может потерять способность ощущать запах газа и перестать осознавать его присутствие. Это состояние, известное как обонятельная усталость, также может возникать, когда люди подвергались воздействию сероводорода в течение длительного периода времени. Сероводород тяжелее воздуха, поэтому он может накапливаться в низинах и закрытых помещениях.
Он широко известен как канализационный газ, вонючая влага и навозный газ. При высоких концентрациях он имеет тошнотворный сладкий запах. При очень высоких уровнях человек может потерять способность ощущать запах газа и перестать осознавать его присутствие. Это состояние, известное как обонятельная усталость, также может возникать, когда люди подвергались воздействию сероводорода в течение длительного периода времени. Сероводород тяжелее воздуха, поэтому он может накапливаться в низинах и закрытых помещениях.
В окружающей среде сероводород образуется в результате бактериального распада или разложения мертвых растений и животных, особенно при недостатке кислорода. Встречается в неочищенном природном газе и нефти, вулканических газах, месторождениях серы, горячих источниках и болотах. Пляжи с большим количеством разлагающихся морских водорослей и илистые отмели с захваченным органическим материалом под отложениями могут выделять сероводород. Сероводород также встречается в природе в организме человека и вырабатывается человеческими и животными отходами.
Сероводород используется при получении других химических соединений серы и может быть побочным продуктом промышленной деятельности, такой как целлюлозно-бумажные комбинаты, производство вискозы, пищевая промышленность, кожевенные и меховые заводы, а также нефтеперерабатывающие заводы. Химическая формула сероводорода H 2 S.
Как я могу подвергаться воздействию сероводорода?
- Вдыхание загрязненного воздуха, содержащего сероводород.
- Люди, проживающие рядом с очистными сооружениями, газовыми и нефтяными буровыми установками, фермами с хранилищами навоза или помещениями для содержания скота или свалками, могут подвергаться воздействию более высоких уровней сероводорода.
- Рабочие, занимающиеся бурением и переработкой нефти и природного газа, очисткой сточных вод, текстильным производством из вискозы, кожевенными заводами, свалками и фермами с ямами для хранения навоза, могут подвергаться воздействию более высоких уровней сероводорода.

- Илистые отмели с органическим материалом, лишенным кислорода в отложениях, обычно могут давать низкие уровни сероводорода. Береговая линия со значительным количеством разлагающегося органического материала, такого как морские водоросли, вызвала проблемы с сероводородом на пляжах.
- Сероводород мало растворим (может растворяться) в воде и содержится в геотермальных источниках и некоторых болотах. Муниципальная питьевая вода или колодезная вода, хотя и редко встречается в Вашингтоне, могут содержать сероводород.
- Небольшое количество сероводорода вырабатывается бактериями во рту и желудочно-кишечном тракте. Некоторые продукты содержат большое количество серы, особенно растения семейства луковых, особенно чеснок.
Как сероводород может повлиять на мое здоровье?
Сероводород является одновременно раздражителем и химическим удушающим средством (он заменяет кислород, поэтому его недостаточно для дыхания). Некоторые люди могут обнаружить его в очень низких концентрациях, в то время как другие могут не чувствовать его запаха. Некоторые люди имеют большую чувствительность к потенциальным эффектам, чем другие. Низкие концентрации могут раздражать глаза, нос, горло и дыхательную систему. Астматики могут испытывать трудности с дыханием. Умеренные концентрации могут вызвать более сильное раздражение глаз и дыхательных путей, головную боль, головокружение, тошноту и рвоту. Кратковременное воздействие высоких концентраций сероводорода может вызвать потерю сознания, кому и, возможно, смерть.
Некоторые люди имеют большую чувствительность к потенциальным эффектам, чем другие. Низкие концентрации могут раздражать глаза, нос, горло и дыхательную систему. Астматики могут испытывать трудности с дыханием. Умеренные концентрации могут вызвать более сильное раздражение глаз и дыхательных путей, головную боль, головокружение, тошноту и рвоту. Кратковременное воздействие высоких концентраций сероводорода может вызвать потерю сознания, кому и, возможно, смерть.
В большинстве случаев человек, подвергшийся воздействию сероводорода, полностью выздоравливает в течение от нескольких часов до нескольких недель — это зависит от индивидуальных особенностей и уровня воздействия. У некоторых людей были постоянные или долгосрочные эффекты, такие как головные боли, плохая концентрация внимания, плохая память и плохая координация. Длительное воздействие сероводорода в малых дозах может привести к усталости, потере аппетита, головным болям, раздражительности, ухудшению памяти и головокружению.
Дополнительная информация
Источник содержания: Программа экологической токсикологии
Опасность газа h3S
Что такое газ h3S?
Газ h3S представляет собой химическое соединение, обозначающее сероводород, карбонилсульфидный газ. Это бесцветный газ, который обычно известен своим отчетливым запахом тухлых яиц. Газ h3S также часто называют канализационным газом, кислым газом, вонючей влагой или сероводородной кислотой. Газ h3S чрезвычайно ядовит для человека, вызывает коррозию и легко воспламеняется. При горении газ h3S выделяет другой смертоносный газ: диоксид серы, симптомы и последствия которого схожи с воздействием газа h3S. К сожалению, год за годом рабочие случайно подвергаются воздействию газа h3S, многие из которых страдают от пагубных последствий, поскольку небезопасное количество может убить рабочего менее чем за 10 секунд.
Где его найти?
Газ h3S растворим в воде и масле. Он может высвобождаться в любое время, когда вещество нагревается или сбрасывается давление. Он содержится в сырой нефти, природном газе, некоторых минеральных породах и горячих источниках. Поэтому бурение и добыча сырой нефти и природного газа создают выбросы сероводорода. Он также может присутствовать, когда бактерии в органических материалах или отходах человека/животных разлагаются в отсутствие кислорода. К отраслям промышленности, производящим наибольшее количество газа H3S, относятся очистка сточных вод, кожевенные заводы, бумажные фабрики, производство клея и красителей, горнодобывающая промышленность, строительство, бурение и переработка природного газа.
Он содержится в сырой нефти, природном газе, некоторых минеральных породах и горячих источниках. Поэтому бурение и добыча сырой нефти и природного газа создают выбросы сероводорода. Он также может присутствовать, когда бактерии в органических материалах или отходах человека/животных разлагаются в отсутствие кислорода. К отраслям промышленности, производящим наибольшее количество газа H3S, относятся очистка сточных вод, кожевенные заводы, бумажные фабрики, производство клея и красителей, горнодобывающая промышленность, строительство, бурение и переработка природного газа.
Сам по себе газ тяжелее воздуха и поэтому имеет тенденцию скапливаться в замкнутых, низких пространствах. Области с плохой вентиляцией, такие как канализационные трубы, навозные ямы или подвалы, скорее всего, являются местами, где может собираться и задерживаться газ H3S. Другие условия, в которых газообразный сероводород может представлять опасность, включают расщепление древесины на целлюлозу, работу в болотах или на свалках, а также при добыче полезных ископаемых, где присутствуют минеральные породы.
Симптомы и предупреждающие сигналы для газа h3S
Газ h3S может быть смертельным даже в самых малых количествах, а значительные концентрации газа часто убивают обоняние жертвы. Следовательно, отчетливый «запах яиц» не следует использовать в качестве меры того, сколько присутствует газообразного сероводорода. Рабочий может оказаться в фатальной ситуации за считанные секунды. Если присутствует низкий уровень газа h3S, могут возникнуть болезненность глаз, проблемы с дыханием, кашель, насморк, головная боль, спутанность сознания, тошнота или дезориентация. Газ h3S настолько смертоносен из-за небольшого количества, которое способно убить рабочего. Таким образом, не следует легкомысленно относиться к любым симптомам, которые могут быть вызваны даже самым низким уровнем газообразного сероводорода.
Какие опасности и риски связаны с воздействием газа h3S?
Газ h3S считается раздражающим и удушающим химическим веществом. Это любое вещество, которое препятствует поступлению кислорода из нашего кровотока в наши клетки или препятствует клеточному дыханию, даже если в непосредственной близости имеется достаточное количество кислорода. Другими словами, газ h3S может эффективно мешать рабочему дышать, когда легкие поглощают газ. В зависимости от присутствующего уровня работник обычно замечает раздражение глаз, насморк и кашель. Если уровни увеличиваются, последствия становятся все более серьезными, и начинают проявляться побочные эффекты, упомянутые ранее, такие как головокружение и тошнота до смерти в течение нескольких секунд.
Другими словами, газ h3S может эффективно мешать рабочему дышать, когда легкие поглощают газ. В зависимости от присутствующего уровня работник обычно замечает раздражение глаз, насморк и кашель. Если уровни увеличиваются, последствия становятся все более серьезными, и начинают проявляться побочные эффекты, упомянутые ранее, такие как головокружение и тошнота до смерти в течение нескольких секунд.
По данным Управления по охране труда и технике безопасности, h3S является одной из основных причин смерти от вдыхания газа на рабочем месте в Соединенных Штатах. По данным Бюро статистики труда, сероводород стал причиной смерти 60 рабочих в период с 2001 по 2010 год. Концентрации выше 1000 частей на миллион вызывают немедленный коллапс с остановкой дыхания, даже после вдыхания одного вдоха — смерть может наступить в течение одного-четырех часов после воздействия.
Одинокие рабочие и газ h3S
Кто подвергается риску воздействия газа h3S?
Одинокие работники, которые с наибольшей вероятностью могут подвергаться воздействию опасного уровня газа h3S, включают в себя тех сотрудников, которым приходится работать в небольших или замкнутых помещениях с плохой вентиляцией, например, в нефтяной и газовой промышленности. Но кроме того, строитель, входящий, например, в дренажную канаву, может сразу же столкнуться с h3S и не иметь возможности вовремя среагировать. Работники, работающие с любыми источниками воспламенения, также подвержены риску из-за легковоспламеняющейся природы h3S. Кроме того, газ чрезвычайно взрывоопасен и может взорваться рядом с сигаретами, трубками или даже спичками. Окружающая среда, в которой есть «неподвижный воздух», также опасна. В любом месте, где не допускается свободный поток свежего воздуха, может образоваться скопление газа, которое может очень быстро увеличиться до уровня токсичности. Наконец, наибольшему риску подвергаются сотрудники, которые не осведомлены о предупреждающих признаках присутствия газа H3S. Это может включать любых работников во всех отраслях промышленности. Протоколы должны в первую очередь информировать работников о важности респираторного устройства при осмотре места утечки h3S или спасении коллеги. Знание предупреждающих сигналов, симптомов, побочных эффектов и протоколов может спасти вашу жизнь и жизнь ваших коллег.
Но кроме того, строитель, входящий, например, в дренажную канаву, может сразу же столкнуться с h3S и не иметь возможности вовремя среагировать. Работники, работающие с любыми источниками воспламенения, также подвержены риску из-за легковоспламеняющейся природы h3S. Кроме того, газ чрезвычайно взрывоопасен и может взорваться рядом с сигаретами, трубками или даже спичками. Окружающая среда, в которой есть «неподвижный воздух», также опасна. В любом месте, где не допускается свободный поток свежего воздуха, может образоваться скопление газа, которое может очень быстро увеличиться до уровня токсичности. Наконец, наибольшему риску подвергаются сотрудники, которые не осведомлены о предупреждающих признаках присутствия газа H3S. Это может включать любых работников во всех отраслях промышленности. Протоколы должны в первую очередь информировать работников о важности респираторного устройства при осмотре места утечки h3S или спасении коллеги. Знание предупреждающих сигналов, симптомов, побочных эффектов и протоколов может спасти вашу жизнь и жизнь ваших коллег.
Каковы долгосрочные последствия воздействия сероводорода на здоровье рабочего?
Продолжительное вдыхание газа h3S может привести к серьезному поражению центральной нервной системы человека, при высокой концентрации человек может потерять сознание, кому, судороги и даже умереть. Кратковременное воздействие газа h3S может вызвать головную боль, тошноту и раздражение глаз и кожи.
Как быстро газ h3S может вас убить? К воздействию h3S нельзя относиться легкомысленно. Всего через пять минут рабочий рискует пошатнуться и упасть. Через 30 минут у них серьезно пострадают глаза. Всего через 30–60 минут они могли умереть. Согласно исследованию Annals of Saudi Medicine, «h3S приводит к немедленному летальному исходу, когда концентрация превышает 500-1000 частей на миллион (ppm), но воздействие более низких концентраций, таких как 10-500 ppm, может вызвать различные респираторные симптомы, которые варьируются от ринита до острая дыхательная недостаточность. h3S также может поражать несколько органов, вызывая временные или постоянные нарушения в нервной, сердечно-сосудистой, почечной, печеночной и гематологической системах».
h3S также может поражать несколько органов, вызывая временные или постоянные нарушения в нервной, сердечно-сосудистой, почечной, печеночной и гематологической системах».
Итак, что можно сделать, чтобы защитить ваших одиноких работников от этой невидимой угрозы? Вы можете предпринять ряд превентивных мер, например:
Предоставить респираторы и средства индивидуальной защиты (СИЗ).
Предоставить автоматизированную систему регистрации, например, приложение для обеспечения безопасности одинокого работника
Вся электроника должна быть заключена в искробезопасный корпус
Монтаж взрывозащищенных и коррозионностойких систем приточно-вытяжной вентиляции.
Обучите свою команду опасностям и средствам контроля, включая симптомы воздействия h3S и протоколы, которым необходимо следовать в случае воздействия.

Разработать и отработать аварийно-спасательные процедуры.
Оборудование для обнаружения опасного газа
Оборудование для обнаружения h3S включает в себя устройства, которые обнаруживают и предупреждают работника о небезопасном качестве воздуха с помощью звуковой и вибрационной сигнализации.
Многие доступные устройства обнаруживают несколько газов и могут обнаруживать ряд вредных газов и паров во время выполнения работы. Они варьируются в цене от сотен до тысяч долларов, в зависимости от потребностей безопасности вашего рабочего места. Также доступны одноразовые или необслуживаемые детекторы газа, не требующие замены датчика или батареи.
Благодаря достижениям в области технологий оборудование и инструменты для обнаружения h3S становятся все меньше и компактнее, что позволяет большему количеству работников-одиночек переносить эти устройства в отдаленные районы и труднодоступные места.
Другие источники опасности на рабочем месте
Опасности существуют на каждом рабочем месте, но как узнать, какие из них могут нанести наибольший вред работникам? Выявив опасности на своем рабочем месте, вы будете лучше подготовлены к их контролю или устранению, а также к предотвращению несчастных случаев, травм, порчи имущества и простоев.






Leave A Comment