Гексан: способы получения и химические свойства
Гексан C6H14 – это предельный углеводород, содержащий шесть атомов углерода в углеродной цепи. Бесцветная жидкость с характерным запахом, нерастворим в воде и не смешивается с ней.
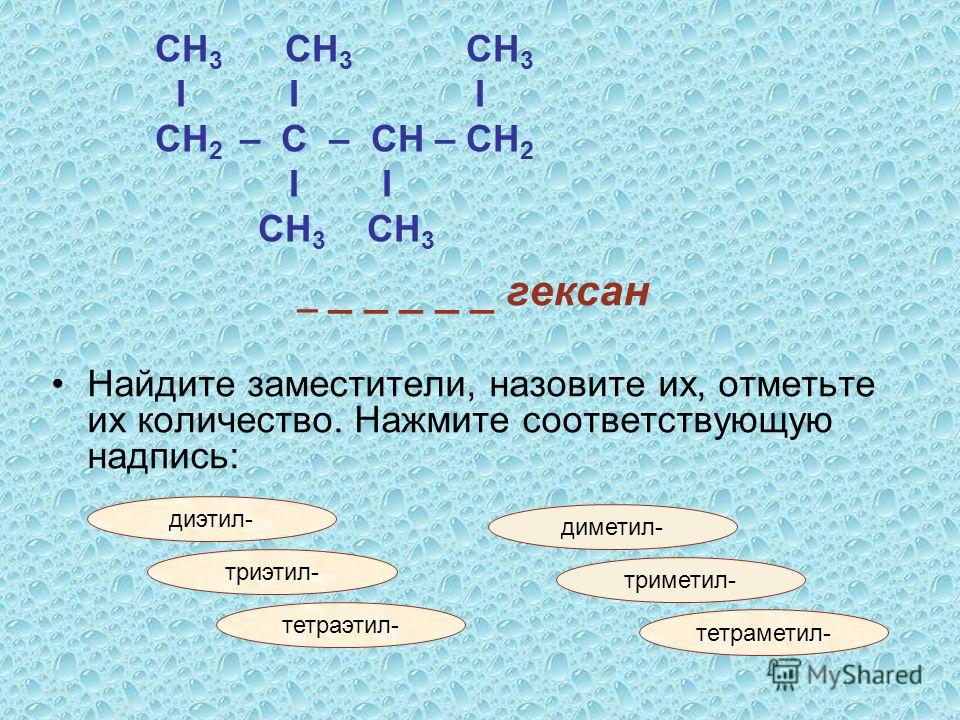
CH3-CH2-CH2-CH2-CH2-CH3
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению.
| Например, в молекуле гексана C6H14 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение. |
Структурная изомерия
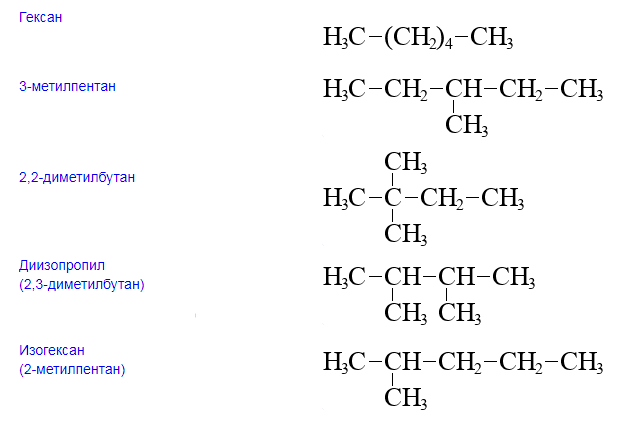
Для гексана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Для углеводородов состава С6Н14 существуют пять изомеров углеродного скелета: н-гексан, 2-метилпентан, 3 -метилпентан, 2,2-диметилбутан, 2,3-диметилбутан |
| Гексан | 2-Метилпентан |
| CH3-CH2-CH2-CH2-CH2-CH3 | CH3-CH(CH3)-CH2-CH2-CH3 |
Для пентана не характерна пространственная изомерия.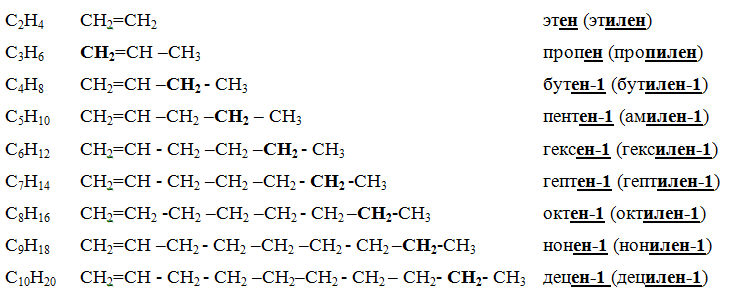
Гексан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для гексана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для гексана характерны радикальные реакции.
Гексан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. ГалогенированиеГексан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании гексана образуется смесь хлорпроизводных.
| Например, при хлорировании гексана образуются 1-хлоргексан, 2-хлоргексан и 3-хлоргексан: CH3-CH2-CH2-CH2-CH2-CH3 + Cl2 → CH3-CH2-CH2-CH2-CH2-CH2Cl + HCl CH3-CH2-CH2-CH2-CH2-CH3 + Cl2 → CH3-CH2-CH2-CH2-CHCl-CH3 + HCl CH3-CH2-CH2 |
Бромирование протекает более медленно и избирательно.
Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом. С третичный–Н > С вторичный–Н > С первичный–Н |
CH3-CH2-CH2-CH2-CH2-CH3 + Br2 → CH3-CH2-CH2-CH2-CHBr-CH3 + HBr CH3-CH2-CH2-CH2-CH2-CH3 + Br2 → CH3-CH2-CHBr-CH2-CH2-CH3 + HBr |
1.2. Нитрование гексана
Гексан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в гексане замещается на нитрогруппу NO
| Например. При нитровании гексана образуются преимущественно 2-нитрогексан и 3-нитрогексан: |
CH3-CH2-CH2-CH2-CH2-CH3 + HNO3 → CH3-CH2-CH2-CH2-CHNO2-CH3 + H2O
CH3-CH2-CH2-CH2-CH2-CH3 + HNO3 → CH3-CH2-CHNO2-CH2-CH2-CH3 + H2O
2.
 Дегидрирование гексана
Дегидрирование гексана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
3. Крекинг
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.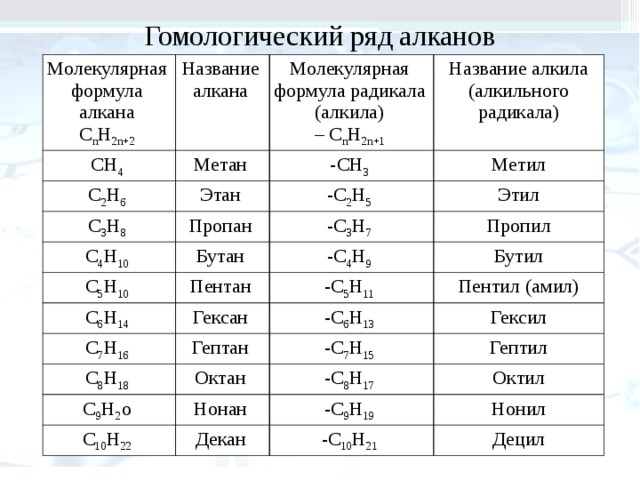
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
| Например, при крекинге н-гексана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды. |
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
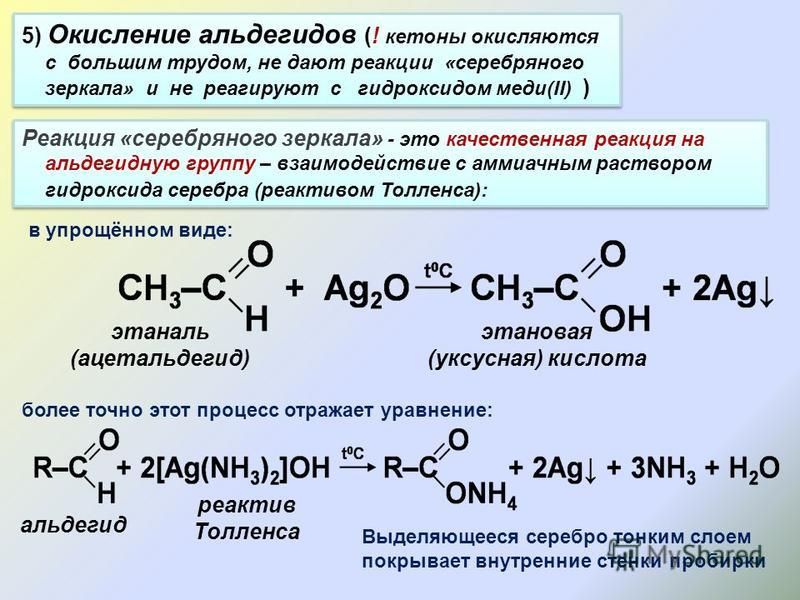
4. Окисление гексана
Гексан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
Полное окисление – горение
Гексан горит с образованием углекислого газа и воды. Реакция горения гексана сопровождается выделением большого количества теплоты.
2C6H14 + 19O2 → 12CO2 + 14H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении гексана в недостатке кислорода может образоваться угарный газ СО или сажа С.
5. Изомеризация гексана
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
| Например, н-гексан под действием катализатора хлорида алюминия и при нагревании образует 2-метилпентан, 3-метилпентан и другие изомеры.
|
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов.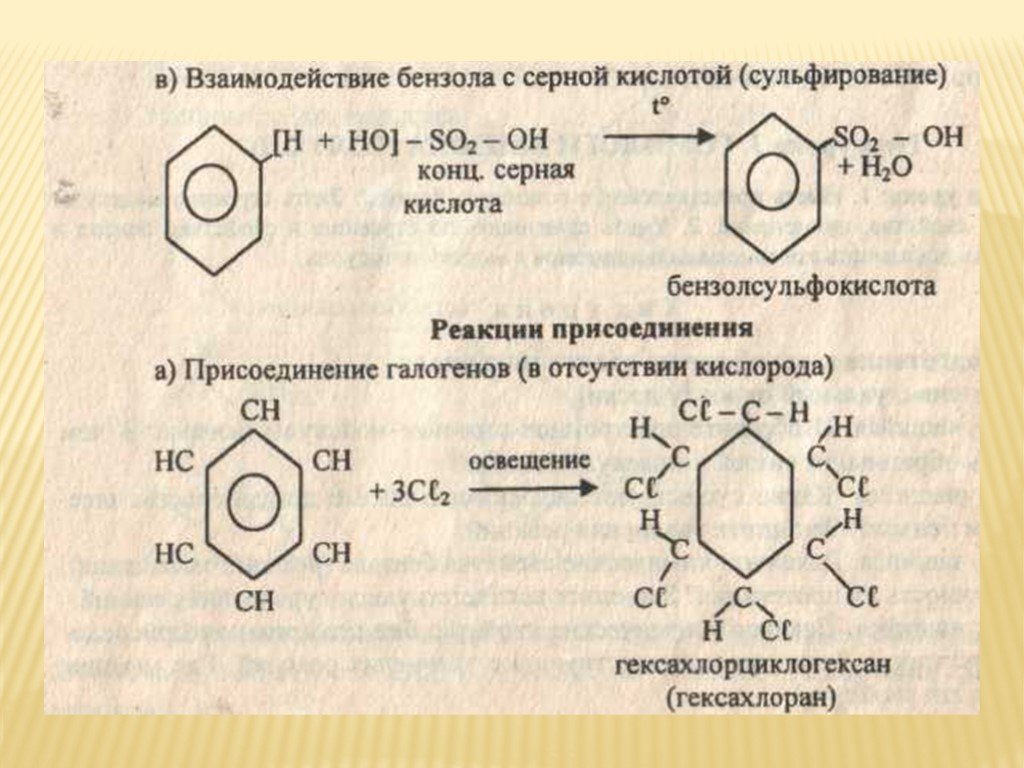 При этом происходит удвоение углеродного скелета.
При этом происходит удвоение углеродного скелета.
Реакция больше подходит для получения симметричных алканов.
Гексан можно получить из 1-хлорпропана и натрия:
2CH3-CH2-CH2-Cl + 2Na → CH3-CH2-CH2-CH2-CH2-CH3 + 2NaCl
2. Гидрирование алкенов и алкинов
Гексан можно получить из гексена или гексина:
При гидрировании гексена-1, гексена-2 или гексена-3 образуется гексан:
CH2=CH-CH2-CH2-CH2-CH3 + H2 → CH3-CH2-CH2-CH2-CH3
CH3-CH=CH-CH2-CH2-CH3 + H2 → CH3-CH2-CH2-CH2-CH3
При полном гидрировании гексина-1, гексина-2 или гексина-3 также образуется гексан:
CH≡C-CH2-CH2-CH2-CH3 + 2H2 → CH3-CH2-CH2-CH2-CH3
CH3-C≡C-CH2-CH2-CH3 + 2H2 → CH3-CH2-CH2-CH2-CH3
3.
 Синтез Фишера-Тропша
Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (3n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
Из угарного газа и водорода можно получить гексан:
6CO + 13H2 = C6H14 + 6H2O
4. Получение гексана в промышленности
В промышленности гексан получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Понравилось это:
Нравится Загрузка…
404 Cтраница не найдена
Мы используем файлы cookies для улучшения работы сайта МГТУ и большего удобства его использования. Более подробную информацию об использовании файлов cookies можно найти здесь. Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
The Hexane Molecule
To View the Hexane Molecule in 3D —>>in 3D with Jsmol
Hexane is an alkane hydrocarbon with the chemical formula CH 3 (CH 2 ) 4 СН 3 . Приставка «гекс» относится к его шести атомам углерода, а «ан»
окончание указывает на то, что его атомы углерода соединены одиночными
облигации. Изомеры гексана в основном нереакционноспособны и часто
используется в качестве инертного растворителя в органических реакциях, потому что они
очень неполярны. Они также являются общими составляющими бензина.
и клеи, используемые для обуви, кожаных изделий и кровли. Кроме того,
он используется в растворителях для извлечения масел для приготовления пищи и в качестве
чистящее средство для обувного, мебельного и текстильного производства.
Приставка «гекс» относится к его шести атомам углерода, а «ан»
окончание указывает на то, что его атомы углерода соединены одиночными
облигации. Изомеры гексана в основном нереакционноспособны и часто
используется в качестве инертного растворителя в органических реакциях, потому что они
очень неполярны. Они также являются общими составляющими бензина.
и клеи, используемые для обуви, кожаных изделий и кровли. Кроме того,
он используется в растворителях для извлечения масел для приготовления пищи и в качестве
чистящее средство для обувного, мебельного и текстильного производства.
Производство
Гексан получают путем переработки сырой нефти. Точный состав фракции во многом зависит от источника нефти (сырая или риформинг) и ограничений переработки. Промышленный продукт (обычно около 50% по массе изомера с прямой цепью) представляет собой фракцию, кипящую при 65-70°С.
Токсичность
Острая токсичность гексана относительно низка, хотя он является мягким анестетиком. Вдыхание высоких концентраций вызывает сначала состояние легкой эйфории, за которым следует сонливость с головными болями и тошнотой.
Хроническая интоксикация гексаном наблюдалась у лиц, злоупотребляющих рекреационными растворителями, а также у рабочих в обувном производстве, реставрации мебели и автомобилестроении. Начальными симптомами являются покалывание и судороги в руках и ногах, за которыми следует общая мышечная слабость. В тяжелых случаях наблюдается атрофия скелетных мышц, потеря координации и проблемы со зрением.
Аналогичные симптомы наблюдаются на животных моделях. Они связаны с дегенерацией периферической нервной системы (и, в конечном счете, центральной нервной системы), начиная с дистальных частей более длинных и широких нервных аксонов. Токсичность связана не с самим гексаном, а с одним из его метаболитов, гексан-2,5-дионом. Считается, что это реагирует с аминогруппой боковой цепи остатков лизина в белках, вызывая перекрестное связывание и потерю функции белка.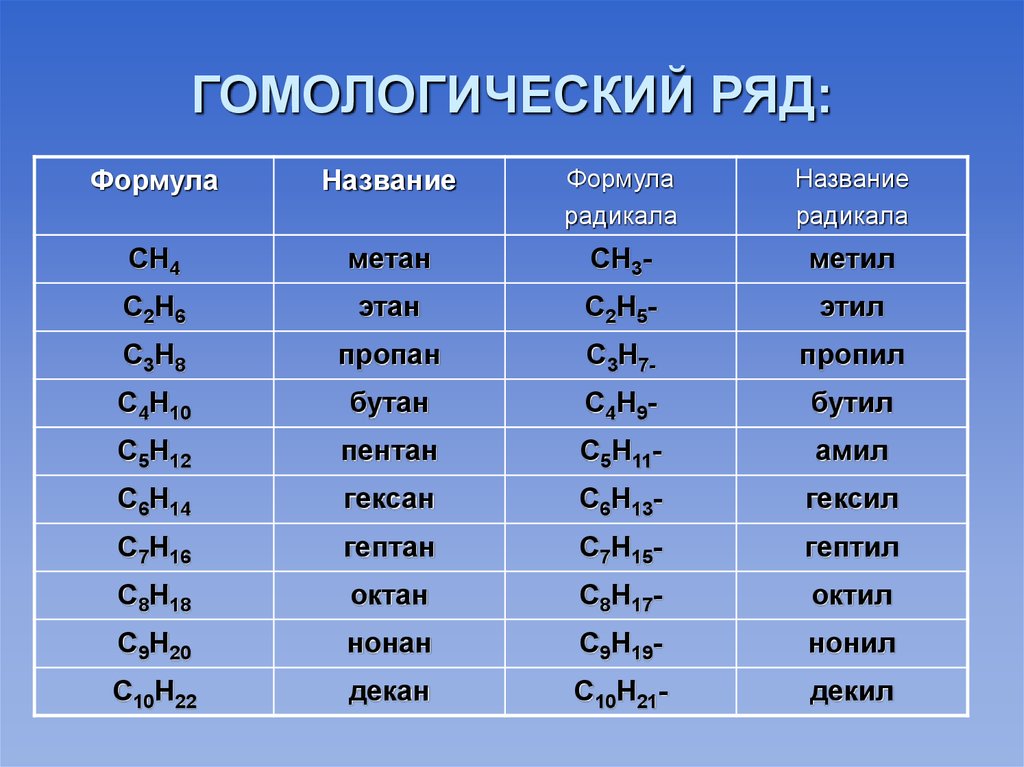
Последствия отравления гексаном у людей неясны. В 1994 году н-гексан был включен в список химических веществ в Реестре токсичных выбросов (TRI). Во второй половине 20-го и начале 21-го веков ряд взрывов был приписан сжиганию газообразного гексана. . В 2001 году Агентство по охране окружающей среды США издало правила контроля выбросов газообразного гексана из-за его потенциальных канцерогенных свойств и экологических проблем.
Использование
В промышленности гексаны используются в рецептурах клеев для обуви, изделий из кожи и кровли. Они также используются для извлечения кулинарных масел (таких как масло канолы или соевое масло) из семян, для очистки и обезжиривания различных предметов и в текстильном производстве. Он обычно используется при экстракции соевого масла в пищевых продуктах в Соединенных Штатах, и это загрязняющее вещество, потенциально присутствующее во всех пищевых продуктах из сои, использующих этот метод, который, как спорно, не регулируется FDA.
Типичное лабораторное использование гексанов для извлечения масляных и жировых загрязнителей из воды и почвы для анализа. Поскольку гексан не может быть легко депротонирован, его используют в лаборатории для реакций с очень сильными основаниями, таких как получение литийорганических соединений. Например, бутиллитий обычно поставляется в виде раствора в гексане.
Гексаны обычно используются в хроматографии в качестве неполярного растворителя. Высшие алканы, присутствующие в гексанах в виде примесей, имеют такое же время удерживания, как и растворитель, а это означает, что фракции, содержащие гексан, также будут содержать эти примеси. В препаративной хроматографии концентрация большого объема гексанов может привести к тому, что образец будет заметно загрязнен алканами. Это может привести к получению твердого соединения в виде масла, а алканы могут помешать анализу.
Во многих областях применения (особенно в фармацевтике) использование н-гексана прекращается из-за его долгосрочной токсичности.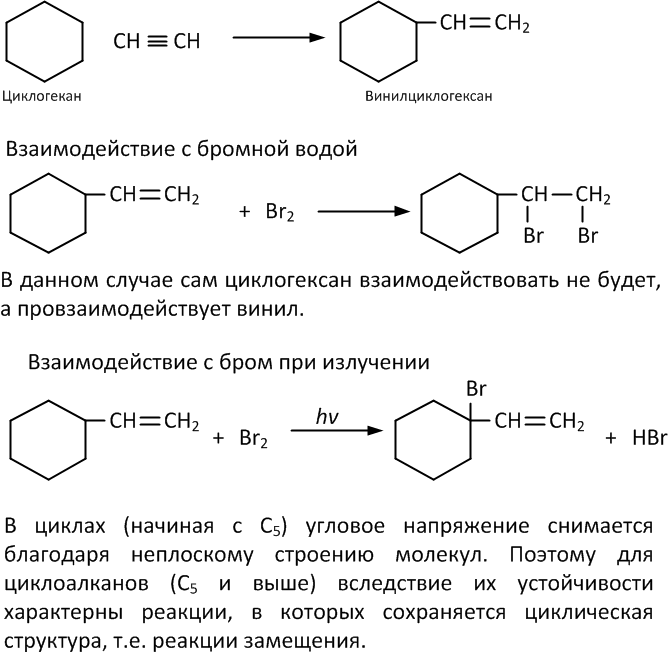 Его часто заменяют н-гептаном, который не образует токсичного метаболита гексан-2,5-диона.
Его часто заменяют н-гептаном, который не образует токсичного метаболита гексан-2,5-диона.
См. также:
Метан Этанол Этан Метанол Бутан Декан Гексан Октан Пропан
Ссылки
1- «н-гексан – сводка соединений». ПабХим Компаунд. США: Национальный центр биотехнологической информации.
2-CDC – Карманный справочник NIOSH по опасным химическим веществам. www.cdc.gov.
Решения: Подобно Растворимости Подобно Растворимости и Межмолекулярным Силам
Существуют различные способы включить эту демонстрацию в презентацию растворов для инструкторов.
Вариант А: при добавлении гексана к водному раствору перманганата калия он остается в виде прозрачного слоя поверх водного раствора. Когда к раствору йода в гексане добавляют воду, она остается в виде прозрачного слоя под раствором гексана.
Вариант B: Добавьте твердый KMnO 4 в пробирку с водой. KMnO 4 растворяется в воде, придавая пурпурный цвет. Добавьте твердый KMnO 4 в пробирку, содержащую гексан. KMnO 4 не растворяется в гексане. Добавьте твердое вещество I 2 в пробирку с водой. I 2 не растворяется в воде. Добавьте твердое вещество I 2 в пробирку, содержащую гексан. I 2 растворяется в гексане, придавая пурпурный цвет. В пробирку, содержащую гексан (верхний слой) и воду (нижний слой), добавьте твердое вещество I 2 . I 2 растворяется в верхнем слое гексана, придавая пурпурный цвет. В пробирку, содержащую гексан (верхний слой) и воду (нижний слой), добавьте твердый KMnO 4 . Студенты были удивлены и впечатлены, наблюдая, как твердый KMnO 4 сразу проходит через верхний слой гексана, а затем сразу же растворяется в нижнем слое воды.
Студенты были удивлены и впечатлены, наблюдая, как твердый KMnO 4 сразу проходит через верхний слой гексана, а затем сразу же растворяется в нижнем слое воды.
Перед выполнением демонстрации учащиеся должны классифицировать типы веществ, задействованных в демонстрации, как полярные, неполярные или ионные. Студенты должны определить межмолекулярные силы в чистых веществах.
Substance | Classification: Polar, non-polar or ionic | Primary IMFs in the Substance | |
hexane (C 6 H 14 ) | |||
Вода | |||
| 0002 potassium permanganate (KMnO 4 ) |
|
| |
iodine (I 2 ) |
|
|
Students should predict whether or not раствор будет образовываться до смешивания растворенного вещества с растворителем. После демонстрации учащиеся должны определить тип первичной силы межмолекулярного притяжения, присутствующей в растворе (взаимодействие растворенного вещества и растворителя).
После демонстрации учащиеся должны определить тип первичной силы межмолекулярного притяжения, присутствующей в растворе (взаимодействие растворенного вещества и растворителя).
| Mixture | Primary IMF (in the solution | Prediction (soluble or not soluble) | Observation (soluble or not soluble) |
Hexane + water | |||
Hexane + KMnO 4 | |||
Hexane +I 2 | |||
Water + KMnO 4 | |||
Water + I 2 |
Примечания к учебному плану
Эта демонстрация обычно выполняется при обсуждении образования растворов с участием межмолекулярных сил и растворимости.
Учебные цели
1. Определить основные типы IMF в решениях и их относительную силу.
2. Примените правило «подобное растворяет подобное» с идентичностью IMF, чтобы определить, будут ли два вещества образовывать раствор. Предсказать относительную растворимость веществ.
Время выполнения
Для этого проекта требуется один день выполнения.
Обсуждение
Если сосредоточить обсуждение образования растворов на межмолекулярных силах и ∆ H смешивание , обязательно подчеркните три типа взаимодействий, связанных с образованием растворов: растворитель-растворитель, растворенное вещество-растворенное вещество и растворенное вещество-растворитель. Перед выполнением демонстрации учащиеся должны классифицировать типы веществ, задействованных в демонстрации, как полярные, неполярные или ионные. Студенты должны определить межмолекулярные силы в чистых веществах. Перед смешиванием растворенного вещества с растворителем учащиеся должны предсказать, будет ли образовываться раствор.
Неполярные растворенные вещества, такие как I 2 , не растворяются в полярных растворителях, таких как вода, потому что I 2 , обладая только лондонскими дисперсионными силами, не могут конкурировать с сильным притяжением молекул полярного растворителя друг к другу. . Таким образом, ни гексан, ни йод не растворяются в воде.
Полярные и ионные растворенные вещества не растворяются в неполярных растворителях, потому что они притягиваются друг к другу сильнее, чем к молекулам неполярного растворителя. Таким образом, ни вода, ни перманганат калия не растворяются в гексане. Йод является неполярной молекулой, потому что связь йод-йод представляет собой чисто ковалентную связь. Разница в электроотрицательности между двумя атомами йода равна нулю. В твердом I 2 , I 2 молекулы притягиваются к другим молекулам I 2 путем образования временных частично положительных и частично отрицательных областей вокруг молекулы и притягиваются к временным частично положительным и частично отрицательным областям вокруг других I 2 молекул, т. е. лондоновские дисперсионные силы.
е. лондоновские дисперсионные силы.
Гексан неполярен, поскольку разница электроотрицательностей между атомами водорода и углерода очень мала, ∆ EN = 0,4 и ∆ EN между углеродом и атомами углерода равно нулю. Молекулы жидкого гексана удерживаются вместе лондонскими дисперсионными силами.
Вода является полярной молекулой, поскольку разность электроотрицательностей между атомами водорода и кислорода средняя, 0,9. Водород, связанный с атомом кислорода, приобретает частичный положительный заряд, потому что кислород, будучи более электроотрицательным, оттягивает электронную плотность от водорода. Этот частичный положительный заряд притягивается к частичному отрицательному заряду атома кислорода соседней молекулы воды. Вода способна образовывать водородные связи между молекулами воды. Водородные связи представляют собой относительно сильную межмолекулярную силу притяжения.
Перманганат калия представляет собой ионное соединение (ион-ион).
После демонстрации учащиеся должны определить тип первичной межмолекулярной силы притяжения, присутствующей в растворе (взаимодействие растворенного вещества и растворителя).
Перманганат калия разделяется на катионы и анионы при смешивании с полярным растворителем, таким как вода. В процессе растворения молекулы воды окружают катионы и анионы с помощью ионно-дипольных ИМП.
Материалы
- 4 колбы Эрленмейера вместимостью 500 мл, содержащие чистый гексан, йод, растворенный в гексане, чистую воду и перманганат калия, растворенный в воде
- 2 делительные воронки объемом 1 л, установленные на кольцевых штативах количества растворителей и растворенных веществ)
- маркируют шесть пробирок: вода, вода, гексан, гексан, гексан — вода, гексан — вода.
- Soild I 2 ; твердый KMnO 4
- Держатель для пробирок и белый фон
Процедура
- На демонстрацию отведите около 10 минут.

- Для этого проекта требуется один день выполнения заказа.
- Убедитесь, что запорные краны на делительных воронках закрыты.
- С помощью воронки налейте фиолетовый водный раствор перманганата калия в одну из делительных воронок.
- Налейте пурпурный раствор йода/гексана в другую делительную воронку.
- Налейте чистый гексан в воронку, содержащую водный раствор перманганата калия.
- Налейте чистую воду в воронку, содержащую раствор йода/гексана.
- Поместите стеклянные пробки в делительные воронки и встряхните их. Вентилируйте их, чтобы предотвратить нарастание давления паров гексана. Убедитесь, что воронка не направлена ни на кого, когда вы выпускаете воздух. Слои снова отделятся.
Меры предосторожности
- Гексан очень летуч и легко воспламеняется. Не выполняйте эту демонстрацию вблизи возможного источника возгорания. Держите под рукой огнетушитель.
- Йод является окислителем и вызывает коррозию.


 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав
Leave A Comment