Неметаллы: простые вещества — свойства неметаллов, история открытия — химия 9 класс
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается.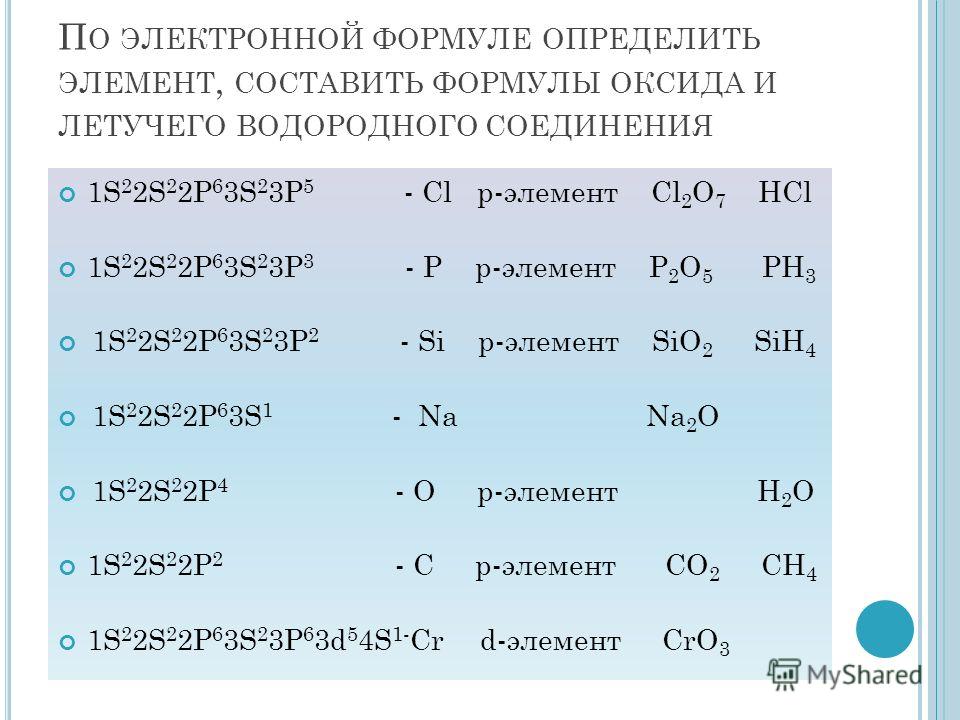
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.
Химия. Базовый уровень. 10 класс. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Простота и доступность изложения курса органической химии , большое количество иллюстраций , а также разнообразные вопросы упражнения и задачи способствуют успешному усвоению учебного материала. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
КупитьФизические свойства неметаллов.
 Аллотропия
АллотропияЕсли смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь
- Молекулярные:
- Летучие, газообразные, бесцветные кислород, водород.
- Газообразные, окрашенные хлор, азот, фтор.
- Единственный жидкий представитель — темно-красный бром.
- Твердые, но хрупкие вещества с невысокой температурой плавления — кристаллы йода, серы, белого фосфора.
- Немолекулярные:
- Твердые вещества с высокой температурой плавления — кремний, графит, алмаз и красный фосфор.
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
- Реакции с металлами.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Са + O2 = СаO2
Na + Сl2 = Na+Сl2
- Реакции с водородом
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
Cl2 + H2 = 2HCl
С + 2Н2 = СН4
- Реакции с кислородом.
S + O2 = SO2
P + 5O2 = 2P2O5
Что ещё почитать?
ОГЭ по химии — 2019: расписание, критерии оценивания, типы заданий
Биография Д.И. Менделеева. Интересные факты из жизни великого химика
Интересные факты из жизни великого химика
Карбоновые кислоты
Массовая доля вещества
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
- они проводят тепло и электрический ток;
- благодаря пластичности и ковкости им можно придать любую форму;
- для всех веществ характерна металлическая кристаллическая решетка.
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
Попытки открытия фтора стоили исследователям не только здоровья, но и жизни. Деви, братья Кнокс, Гей-Люссак — это неполный список жертв науки, что потеряли здоровье в попытках выделить фтор из плавикового шпата. Лишь в 1886 году Муассан решил сложную задачу способом электролиза. И получил первый галоген, а ещё – ядовитый хлор. Во времена Первой мировой войны его использовали как оружие массового поражения.
В настоящее время открыто 22 неметаллических элемента.
#ADVERTISING_INSERT#
Свойства летучих соединений — Справочник химика 21
Свойства летучих соединенийКак изменяются свойства летучих водородных соединений, в том числе и в водных растворах, (для неметаллов). [c.89]
По-видимому, пока нельзя назвать область прикладной или аналитической химии, где свойство летучести комплексных соединений лантаноидов и актиноидов использовалось бы в широких масштабах. Это, несомненно, связано с общей недостаточной освоенностью газофазных методов и, особенно, со сравнительно слабой изученностью свойств летучих соединений /-элементов. Тем не менее в настоящее время довольно интенсивно ведутся поисковые работы в сфере применения и наметились направления, в которых просматриваются определенные перспективы практического использования подобных соединений.
Это, несомненно, связано с общей недостаточной освоенностью газофазных методов и, особенно, со сравнительно слабой изученностью свойств летучих соединений /-элементов. Тем не менее в настоящее время довольно интенсивно ведутся поисковые работы в сфере применения и наметились направления, в которых просматриваются определенные перспективы практического использования подобных соединений.
Таким образом, свойства водородных соединений неметаллов, как и свойства их гидратов окислов, зависят от зарядов и радиусов ионов. Это наглядно представлено в таблице И. Водородные соединения в ней размещены в таком же порядке, как размещены образующие их элементы в периодической системе. Рассекающие таблицы линии последовательно — слева направо — отграничивают а — гидриды металлов от летучих водородных соединений неметаллов, б — водородные соединения неметаллов с малой полярностью связей от соединений с высокой полярностью, в — водородные соединения, реагирующие с водой с образованием щелочи или с кислотами с образованием солей (Nh4 и РНз), от водородных соединений, реагирующих с водой с образованием кислот, г —слабые кислоты от сильных кислот.

С водородом азот и фосфор образуют летучие соединения с общей формулой ЭНд Nh4 — аммиак и РНд — фосфин, значительно отличающиеся по химическим свойствам. Молекулы Nh4 полярны, так как электроотрицательность азота равна 3, а водорода — 2,1. Общие электронные пары смещены к атомам азота и окислительное число азота в аммиаке равно —3. Молекулы РН3 неполярны, так как электроотрицательности фосфора и водорода одинаковы и равны 2,1.
Элементы IV—VII групп главных подгрупп образуют летучие водородные соединения. Формы и свойства этих соединений тоже изменяются периодически. Так, например, водородные соединения галогенов — фтороводород HF, хло-роводород НС1, бромоводород НВг, иодоводород HI — сходны как по форме, так и по свойствам. [c.70]
К числу наиболее важных свойств химических соединений Менделеев, как известно, относил кислотно-основные свойства. Их изучение было особенно важным в тех случаях, когда элемент не имел летучих при обычных температурах соединений. К числу таких элементов в те времена относили и РЗЭ . Но, пожалуй, самым важным инструментом Менделеева при оценке правильности сведений об атомном весе и валентности химического элемента был критерий периодичности. Он писал Здесь закон периодичности является на помощь делу как новая законность между химическими свойствами и атомным весом. Зная эквивалент и некоторые свойства элемента и его соединений, можно установить его атомный вес, признавая закон периодичности 18, с. 133]. Таким образом, Менделеев, глубоко веря в справедливость и всеобъемлющий характер периодического закона, успешно использовал для утверждения периодического закона сам этот закон. [c.84]
К числу таких элементов в те времена относили и РЗЭ . Но, пожалуй, самым важным инструментом Менделеева при оценке правильности сведений об атомном весе и валентности химического элемента был критерий периодичности. Он писал Здесь закон периодичности является на помощь делу как новая законность между химическими свойствами и атомным весом. Зная эквивалент и некоторые свойства элемента и его соединений, можно установить его атомный вес, признавая закон периодичности 18, с. 133]. Таким образом, Менделеев, глубоко веря в справедливость и всеобъемлющий характер периодического закона, успешно использовал для утверждения периодического закона сам этот закон. [c.84]
Следовательно, в периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливаются. [c.138]
ТЕРМИЧЕСКИЕ СВОЙСТВА ЛЕТУЧИХ СОЕДИНЕНИЙ [c.69]
Сопоставление результатов коррозионных испытаний, проведенных этим ускоренным методом, с результатами испытаний в условиях 100%-ной влажности в течение 9 месяцев показало, что ускоренный метод позволяет удовлетворительно оценивать защитные свойства летучих соединений [67]. [c.231]
[c.231]
Проследим сначала, как изменяются свойства летучих водородных соединений неметаллов в периодах слева направо. Так, например, рассмотрим свойства водородных соединений элементов 2-го периода — азота и фтора. Аммиак Nh4 обладает основными свойствами, а фтороводород HF — кислотными. Такими же свойствами обладают водородные соединения элементов 3-го периода — фосфин РНз и хлороводород НС1. [c.138]
Структура серии комплексов, свойства и методы получения которых идентичны комплексам карбамида, была изучена Пали-ном и Поуэллом [28]. Примером такого типа соединений является группа кристаллических комплексов, образующихся между гидрохиноном и рядом летучих соединений, к которым относятся сернистый ангидрид, сероводород, хлористый водород, метанол и др. [c.216]
Рассчитанный радиус 08 + составляет очень малую величину 0,54 А. Такого размера частица зарядом +8 создавала бы сильное поляризующее действие, что делало бы невозможным существование ионной связи. Действительно, все соединения осмия имеют ковалентные свойства металл осмий известен как один из самых тугоплавких и плотных (прочная связь металл—металл, большое число связей), а соединения его, как правило, имеют молекулярную структуру и обладают высокой летучестью, что характерно, как мы знаем, главным образом для ковалентных соединений. (Склонность осмия давать летучие соединения нашла свое отражение в названии этого элемента осмий по-гречески означает пахнущий.) [c.152]
Действительно, все соединения осмия имеют ковалентные свойства металл осмий известен как один из самых тугоплавких и плотных (прочная связь металл—металл, большое число связей), а соединения его, как правило, имеют молекулярную структуру и обладают высокой летучестью, что характерно, как мы знаем, главным образом для ковалентных соединений. (Склонность осмия давать летучие соединения нашла свое отражение в названии этого элемента осмий по-гречески означает пахнущий.) [c.152]
Рассмотренные свойства оксидов и галидов платиновых металлов необходимо учитывать-при использовании этих материалов в конструкциях, так как в окислительной среде платиновые металлы могут постепенно улетучиваться в виде своих оксидов и особенно галидов, представляющих собой непрочные и летучие соединения. В частности, для платины наиболее опасны температуры 500—600 С при более высоких температурах она более устойчива — оксиды не образуются. [c.395]
В качестве примера рассмотрим элемент индий. Для него известен был только эквивалентный вес, равный (округленно) 38,3. Атомный вес его, следовательно, мог равняться 38,3 76,6 114,9 153,2 и т. д, Летучих соединений индия известно не было. Если принять, что атомный вес индия равен 38,3, то этот элемент должен стоять в системе после хлора, т. е. на месте калия (№ 19 аргон в то время известен не был). Но индий совершенно не похож по свойствам на находящиеся в том же вертикальном ряду другие элементы следовательно, это предположение отпадает. Если принять атоМный вес равным 76,6 (как тогда и считали), то индий попадает на место селена (№ 34). Однако индий совершенно не похож на другие элементы этого вертикального ряда. Если принять следующий возможный атомный вес 114,9, то индий попадет на место № 49, т. е. окажется в одном вертикальном, столбце е алюминием (№ 31—галлий не был известен), с которым он сходен по свойствам. Следовательно, атомный вес индия должен быть равен именно 114,9. Впоследствии этот и все другие атомные веса, указанные Менделеевым, были подтверждены опытом.
Для него известен был только эквивалентный вес, равный (округленно) 38,3. Атомный вес его, следовательно, мог равняться 38,3 76,6 114,9 153,2 и т. д, Летучих соединений индия известно не было. Если принять, что атомный вес индия равен 38,3, то этот элемент должен стоять в системе после хлора, т. е. на месте калия (№ 19 аргон в то время известен не был). Но индий совершенно не похож по свойствам на находящиеся в том же вертикальном ряду другие элементы следовательно, это предположение отпадает. Если принять атоМный вес равным 76,6 (как тогда и считали), то индий попадает на место селена (№ 34). Однако индий совершенно не похож на другие элементы этого вертикального ряда. Если принять следующий возможный атомный вес 114,9, то индий попадет на место № 49, т. е. окажется в одном вертикальном, столбце е алюминием (№ 31—галлий не был известен), с которым он сходен по свойствам. Следовательно, атомный вес индия должен быть равен именно 114,9. Впоследствии этот и все другие атомные веса, указанные Менделеевым, были подтверждены опытом. Благодаря периодическому закону установление атомного веса элемента стало сводиться к возможно более точному определению его эквивалента. [c.26]
Благодаря периодическому закону установление атомного веса элемента стало сводиться к возможно более точному определению его эквивалента. [c.26]
Какие закономерности наблюдаются в изменении свойств летучих водородных соединений в периодах и группах Охарактеризуйте их сущность. [c.140]
Химические и физические свойства этого элемента изучены плохо. Астат несколько менее летуч, чем иод, и проявляет металлические свойства. В соединениях астат проявляет степени окисления — 1, -f 1, 5. [c.198]
Присутствие тех или иных химических элементов в составе анализируемого вещества можно обнаружить и не прибегая к химическим реакциям. Это можно сделать, основываясь непосредственно на данных, получаемых при изучении физических свойств исследуемого вещества. Например, летучие соединения некоторых химических элементов, внесенные в бесцветное пламя газовой горелки, окрашивают его в характерные цвета. [c.24]
Известность и применяемость элементов определяется не только распространенностью (т. е. величиной среднего их содержания в земной коре), но и свойствами. Некоторые элементы благодаря особенностям своих физико-химических свойств могут концентрироваться в определенных участках земной коры, образуя залежи (месторождения) мпнералов, их содержащих. В таких случаях добыча элементов облегчается, хотя его кларк (среднее содержание) может быть низким. Примером являются элементы, дающие легко летучие соединения уходя из раскаленных недр Земли и накапливаясь у земной поверхности, они образуют богатые месторождения. В частности, так обстоит дело со ртутью, которая, несмотря на низкую величину кларка (VI декада), давно известна человеку, широко используется и не считается редким элементом. В то же время другие элементы, имеющие примерно такой же, как ртуть, кларк, часто очень трудно доступны, редки, поскольку не образуют собственных месторождений в силу особенностей физикохимических свойств (например, редкоземельные элементы Но, Ег, Ти и т. д.). [c.241]
е. величиной среднего их содержания в земной коре), но и свойствами. Некоторые элементы благодаря особенностям своих физико-химических свойств могут концентрироваться в определенных участках земной коры, образуя залежи (месторождения) мпнералов, их содержащих. В таких случаях добыча элементов облегчается, хотя его кларк (среднее содержание) может быть низким. Примером являются элементы, дающие легко летучие соединения уходя из раскаленных недр Земли и накапливаясь у земной поверхности, они образуют богатые месторождения. В частности, так обстоит дело со ртутью, которая, несмотря на низкую величину кларка (VI декада), давно известна человеку, широко используется и не считается редким элементом. В то же время другие элементы, имеющие примерно такой же, как ртуть, кларк, часто очень трудно доступны, редки, поскольку не образуют собственных месторождений в силу особенностей физикохимических свойств (например, редкоземельные элементы Но, Ег, Ти и т. д.). [c.241]
Разнообразие состава и структуры приводит к разнообразию свойств бинарных соединений. Среди них существуют и солеобразные, и металлоподобные, и летучие, и тугоплавкие и т. п. Среди бинарных ИНДИВИДОВ переменного состава встречаются дальтониды и бертоллиды, свойства которых в пределах области гомогенности [c.48]
Среди них существуют и солеобразные, и металлоподобные, и летучие, и тугоплавкие и т. п. Среди бинарных ИНДИВИДОВ переменного состава встречаются дальтониды и бертоллиды, свойства которых в пределах области гомогенности [c.48]
Разделение циркония и гафния труднее, чем любых соседних элементов, включая лантаноиды, так как их химические свойства ближе друг к другу, чем у всех остальных пар родственных элементов (рис. 3.99). Для отделения циркония от гафния применяют дробную кристаллизацию КгХгРе и К2Н Ре, ректификацию летучих соединений (ЭСЬ. и др.), ионный обмен, селективную экстракцию, последний метод наиболее широко применяют в промышленности. [c.503]
Интересно, что косвенные экспериментальные доказательства реальности водородных связей впервые были получены сравнительным анализом некоторых физических свойств летучих гидридов. Хорошо известен факт аномально высоких температур кипения Н2О, HF, Nh4 и отчасти НС1 и h3S (рис. 134), который обусловлен ассоциацией их молекул за счет водородных связей с образованием ди-, три- и полимеров в жидкой фазе. Вода, например, имела бы температуру кипения -80, а не +100°С, если бы в жидкой фазе не было водородных связей между молекулами. Аномалия наблюдается при сравнении энтальпий испарения и температур плавления (водородная связь в твердом состоянии) обсуждаемых водородных соединений. [c.298]
Вода, например, имела бы температуру кипения -80, а не +100°С, если бы в жидкой фазе не было водородных связей между молекулами. Аномалия наблюдается при сравнении энтальпий испарения и температур плавления (водородная связь в твердом состоянии) обсуждаемых водородных соединений. [c.298]
Обращенная газовая хроматография представляет собой хроматографический метод, в котором неподвижной фазой является полимер и изучается его взаимодействие с известным летучим соединением. Пользуясь величиной такого взаимодействия и его температурной зависимостью, можно оценить как свойства чистого полимера, так и системы полимер — летучее соединение. [c.47]
Карбонилы представляют собой большей частью летучие соединения с самыми различными химическими свойствами, для которых многие проблемы, касающиеся стереохимии и валентного состояния, остаются нерешенными. Некоторые из карбонилов обладают значительной реакционной способностью и образуют множество производных, как это показано на схеме [c. 55]
55]
Как изменяются свойства летучих водородных соединений в периодах [c.439]
К настоящему времени из 88 элемектоБ таблицы Менделеева 34- могут быть отнесены к группе, для которой ректификация освоена в укрупненно лабораторном и в промышленном масштабе. Ко второй группе отнооятся около 17 элементов, для которых лабораторные или поисковые опыты показали эффективность ректификации. К третьей группе могут быть отнесены 23 элемента, для которых отсутствуют эксперимеятальные данные, но возможность применения ректификации можно предполагать на основании сведений о свойствах летучих соединений. Причем в эту группу входят 14 редкоземельных элементов. Для остальных 14 элементов возможность применения ректификационной очистки пока окончательно не установлена. [c.65]
Разнообразие состава и структуры приводит к многообразию свойств бинарных соединений. Среди них существуют и еолеобразные, и металлоподобные, и летучие, и тугоплавкие и т. п. Среди бинарных индивидов переменного состава встречаются дальтониды и бертоллиды, свойства которых в пределах области гомогенности меняются различным образом. Такая широкая вариация состава, структуры и свойств бинарных соединений затрудняет их систематику. Классификация и номенклатура бинарных соединений общеприняты. В их названиях употребляется корень латинского наименования анионообразователя с окончанием ид, например М С12 — хлорид магния, Т1С — карбид титана, ЗГе — гексафторид серы и т.п.. Так формируются классы бинарный соединений гидриды, оксиды, галогениды (фториды, хлориды, бромиды, иодиды), халькогениды (суль- [c.256]
п. Среди бинарных индивидов переменного состава встречаются дальтониды и бертоллиды, свойства которых в пределах области гомогенности меняются различным образом. Такая широкая вариация состава, структуры и свойств бинарных соединений затрудняет их систематику. Классификация и номенклатура бинарных соединений общеприняты. В их названиях употребляется корень латинского наименования анионообразователя с окончанием ид, например М С12 — хлорид магния, Т1С — карбид титана, ЗГе — гексафторид серы и т.п.. Так формируются классы бинарный соединений гидриды, оксиды, галогениды (фториды, хлориды, бромиды, иодиды), халькогениды (суль- [c.256]
Те же авторы [Hubert Р., Witzthum О. G., 1978] извлекали наиболее ценные компоненты из черного перца, мускатного ореха и стручкового перца надкритической углекислотой. Основным свойством перцев является их аромат, связанный с присутствием в них летучих соединений, а также острота. В пищевой про- [c.112]
Различные комплексные металлические соли ацетилацетона обладают характерными свойствами например, соединения меди окрашены в синий цвет и растворимы в хлороформе, соли железа имеют ярко-красную окраску, а ацетилацетонаты алюминия (т. кип. 314°) и бериллия (т. кип. 270°) представляют собой летучие, перегоняющиеся вещества. Строение этих солей, согласно К00рдинащ 0нн0му учению Вернера, мо Кно представить следующим образом [c.321]
кип. 314°) и бериллия (т. кип. 270°) представляют собой летучие, перегоняющиеся вещества. Строение этих солей, согласно К00рдинащ 0нн0му учению Вернера, мо Кно представить следующим образом [c.321]
В периодах слева направо у ионов элементов положительный заряд увеличивается. В связи с этим кислотныё свойства летучих водородных соединений элементов в водных растворах усиливаются. [c.139]
В то время как газовая хроматография является ключевым методом разделения для летучих соединений, жидкостная хроматография (ЖХ) — ее эквивалент для полярных и высокомолекулярных соединений. Однако в отличие от ГХ, ЖХ испытьшает недостаток детекторов, которые одновременно чувствительны и специфичны или хотя бы селективны (см. разд.5.2). Большинство обычно используемых детекторов либо чувствительны, но не специфичны (например, рефрактометрический или флуоресцентный детекторы) или в некоторой степени специфичны в ущерб чувствительности (например, детектирование с диодной матрицей). Это вызвало развитие гибридных ЖХ-методов, гарантирующих оба этих свойства. [c.620]
Это вызвало развитие гибридных ЖХ-методов, гарантирующих оба этих свойства. [c.620]
Применение цеолитов тина А и X, наполненных аммиаком или летучими аминами, позволяет интенсифицировать процесс вулканизации без опасности пре кде-временного структуирования на предварительных стадиях. Применение цеолитов, наполненных такими газообразными и летучими соединениями как сероводород, двуокись серы, органические перекиси позволяет производить вулканизацию каучуков в отсутствие элементарной серы. Резины, полученные с использованием наполненных цеолитов, отличаются высокими физико-механическими свойствами. [c.427]
В частности, в отличие от многих других производств количество образующихся фенольных сточных вод на коксохимических заводах не может быть уменьшено путем снижения потребления свежей технической воды. Объясняется это тем, что эти сточные воды образуются в основном за счет влаги шихты, поступающей на коксование. Последнее такхсвойствах сточных вод, которые резко отличаются от свойств природных и сточных вод других производств. Они характеризуются 1) высокой мпнерализованностью (общее солесодержание доходит до 2—4 г/л, в том числе хлоридов и сульфатов соответственно 840— 2800, 800—1300 мг/л), наличием вредных и летучих соединений (концентрация фенолов, роданидов и цианидов составляет соответственно 200—380, 150—400, 10—30 мг/л) 2) отсутствием солей временной жесткости. Более того, находящиеся в сточных водах соли аммония (не менее 800 мг/л) способны взаимодействовать с бикарбонатами технической воды и переводить последние в соли постоянной жесткости, тем самым предотвращая образование накипи. [c.318]
Они характеризуются 1) высокой мпнерализованностью (общее солесодержание доходит до 2—4 г/л, в том числе хлоридов и сульфатов соответственно 840— 2800, 800—1300 мг/л), наличием вредных и летучих соединений (концентрация фенолов, роданидов и цианидов составляет соответственно 200—380, 150—400, 10—30 мг/л) 2) отсутствием солей временной жесткости. Более того, находящиеся в сточных водах соли аммония (не менее 800 мг/л) способны взаимодействовать с бикарбонатами технической воды и переводить последние в соли постоянной жесткости, тем самым предотвращая образование накипи. [c.318]
Существуют также методы разделения изотопов, осноб ..ч-ные на различии физических свойств веществ, содержащих р. з-ные изотопы одного элемента, например. метод газовой диффузии, когда в процессе диффузии через пористую перегородку летучего соединения оно обогащается более легким изотопо.м входящего в его состав элемента. В настоящее время многие элементы получают в виде чистых изотопов в значительных количествах. Например, годовое производство тяжелой воды составляет несколько сот тонн. Тяжелая вода используется в ядерных реакторах и научных исследованиях. В больших количествах осуществляется разделение изотопов урана, нужных для ядерной энергетики. [c.21]
Например, годовое производство тяжелой воды составляет несколько сот тонн. Тяжелая вода используется в ядерных реакторах и научных исследованиях. В больших количествах осуществляется разделение изотопов урана, нужных для ядерной энергетики. [c.21]
Усиление восстановительных свойств летучих водородных соединений в подгруппах по мере увеличения порядкового номера элемента является общей закономерностью для всех главных подгрупп. Так, сероводород — намного более сильный восстановитель, чем вода. Именно вследствие его восстановительных свойств нельзя получать сероводород действием концент-рироваииой серной кислоты на сульфиды. Например, при действии этой кислоты на сульфид железа (II) образуются сернистый газ и свободная сера. Поэтому для получения сероводорода исходя пз сульфида железа (II) используют соляную кислоту [c.183]
Влияние газов на свойства слюдяного расплава. Наличие растворенных летучих соединений п газов в расплаве фторслюды обусловливает ряд его важных физико-химических свойств и явлений при кристаллизации, например а) окислительно-восстано-вительную обстановку, характеризующую формы нахождения в расплаве отдельных элементов б) вынос слюдообразующих компонентов из расплава в) изменение структуры расплава (т. е. способствует диффузии элементов, изменению вязкости, расслаиванию ИТ. д.). [c.13]
е. способствует диффузии элементов, изменению вязкости, расслаиванию ИТ. д.). [c.13]
Индол представляет собой летучее кристаллическое вещество с т. пл. 52 С с устойчивым запахом. Его свойства, о которых упоминалось в гл. 2, аналогичны свойствам ароматических соединений. Молекула индола обладает значительной энергией резонанса, но связи в пятичленном щпсле более локализованы, чем в пирроле. По основным химическим свойствам индол аналогичен пирролу. Например, он представляет собой слабое основание и наиболее устойчивый катион образуется при протонировании атома углерода. Электрофилы обычно атакуют пяти-, а не шестичленное кольцо. Наиболее важное различие между двумя циклическими системами состоит в том, что из-за сильной локализации связи в фрагменте N—С—С пятичленного кольца индола электрофильная атака идет по положению 3, а не 2. Эта особенность будет рассмотрена в разд. 6.5.4. [c.268]
Диазселканы обладают кенцерогенными свойствами, а летучие соединения, кроме того, при вдыхании их паров могут вызвать отек дыхательных путей. Поэтому работать с этими веществами надо с соблюдением всех мер предосторожности, указанных в соот-ветствувдих методиках. [c.46]
Поэтому работать с этими веществами надо с соблюдением всех мер предосторожности, указанных в соот-ветствувдих методиках. [c.46]
Персональный сайт — Открытый урок «Важнейшие классы бинарных соединений
Тема урока: «Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения».
Цель урока: разъяснить понятие бинарное соединение, сформировать понятие об оксидах и практическом значении отдельных оксидов. Познакомить с важнейшими летучими водородными соединениями и нелетучими – гидридами.
Оборудование: образцы оксидов, фильм «Вода».
План урока.
- Организационный момент.
- Изучение нового материала.
- Домашнее задание.
Ход урока.
Цель нашего урока познакомиться с важнейшими бинарными соединениями. Но сначала уясним термин бинарные: «би» — это два, мы будем говорить о соединениях, состоящих из двух элементов.
Класс разбивается на шесть групп и каждая группа получает задание на карточках, чтобы добиться поставленной цели.
1группа выясняет, что такое оксиды, их названия, агрегатное состояние и практическое задание выбрать оксиды из данного перечня веществ:
ZnCl2, h3S, CO2, CuO, Nh4, Na2O, Na3N, MnS, N2O5, Cu2O, NO
2 группа рассказывает о важнейшем жидком оксиде – воде.
Фрагмент стихотворения:
Безбрежная синь океанов и тихая заводь пруда
Струи водопада и брызги фонтана
И все это просто вода.
Сообщение учащегося на тему «Распространение воды на Земле и ее значение»
Вода — это самое распространенное вещество на Земле. Три четверти поверхности планеты покрыта морями, океанами, реками и ледниками. Вода содержится в земной коре, образуя подземные озера. Считают, что на Земле 1500 млн км3 воды. Она входит во все живое. За сутки человек использует 8 литров питьевой воды. Вода используется человеком во всех сферах его деятельности: медицине, сельском хозяйстве, металлургии, пищевой промышленности. Вода совершает круговорот в природе.
Демонстрируется фрагмент фильма «Вода».
3 группа рассказывает о газообразных оксидах: углекислом газе и угарном газе.
Углекислый газ содержится в воздухе 0,03 % по объему. Это газ без цвета и запаха, он выделяется при горении и дыхании, участвует в одном из важнейших процессов на Земле фотосинтезе. Применяется в огнетушителях, при газировании воды, в твердом виде углекислый газ называют сухой лед и он используется при хранении продуктов.
Угарный газ без цвета и запаха, очень ядовитый, образуется при неполном сгорании угля, дров, соединяется с гемоглобином в крови и человек умирает от кислородного голодания, если в помещении содержится угарный газ. Но этот газ имеет большое значение, являясь хорошим восстановителем в металлургических процессах. Являясь горючим газом, он используется в газогенераторах.
4 группа рассказывает о твердых оксидах.
Оксид кремния – речной песок. Используется в производстве стекла и цемента, а крупные его кристаллы – кварц, горный хрусталь, аметист, опал, агат, яшма – это полудрагоценные камни.
Оксид кальция –негашеная известь. Используется в строительстве для получения соды.
Оксид алюминия входит в состав глин. Мелкозернистые кристаллы его обладают большой твердостью, используется при изготовлении наждачной бумаги, а крупные окрашенные кристаллы – рубины и сапфиры.
5 группа рассказывает о летучих водородных соединениях.
На карточке задание:
1 Элементы каких групп образуют летучие водородные соединения.
2 Как найти степень окисления элементов в летучем водородном соединении.
3 Составить формулу летучего водородного соединения хлора, азота, фосфора, серы.
Сообщение о хлороводороде. Аммиак, его свойства и значение.
6 группа рассказывает о нелетучих водородных соединениях гидридах.
Задание на карточке:
1 Какие вещества называются гидридами.
2 Какую степень окисления проявляет водород в этих соединениях.
3 Химическая связь гидридов.
Заключительное слово учителя:
На сегодняшнем уроке мы изучили важнейшие бинарные соединения – оксиды и летучие водородные соединения и узнали об их значении в жизни человека.
Домашнее задание: параграф 18, упражнение 3.
Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».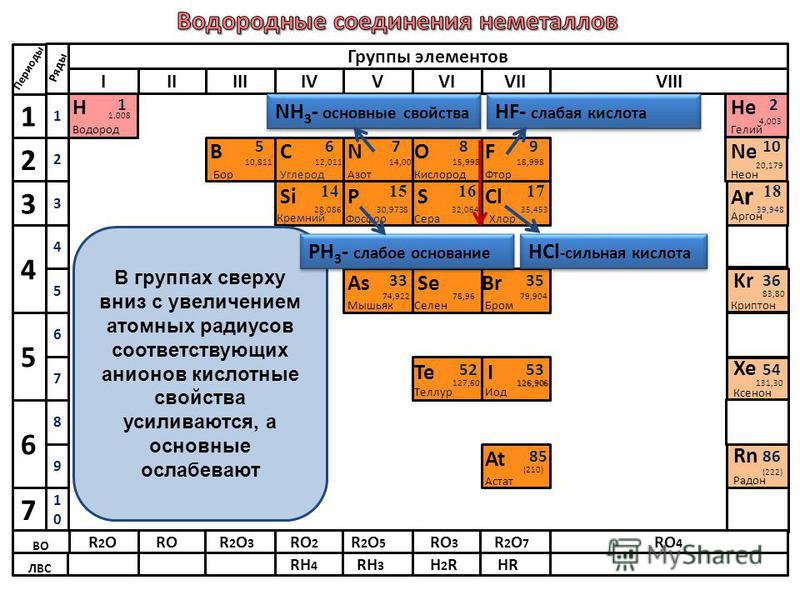
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации»,
сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г. №1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
№1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
— полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
— полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13.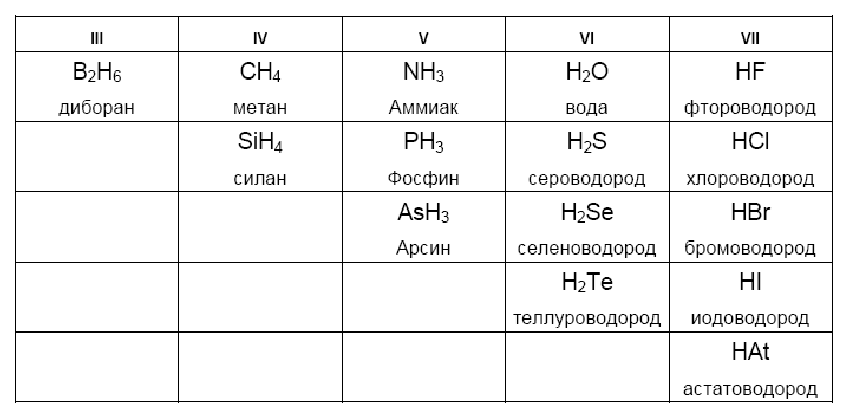 07.2016.
07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
18,5: Появление, получение и соединения водорода
Наиболее важным гидридом фосфора является фосфин, PH 3 , газообразный аналог аммиака как по формуле, так и по структуре. В отличие от аммиака, невозможно получить фосфин путем прямого объединения элементов. Есть два метода приготовления фосфина. Один из методов заключается в воздействии кислоты на ионный фосфид. Другой метод — диспропорционирование белого фосфора с горячим концентрированным основанием для получения фосфина и иона фосфита водорода:
Фосфин — бесцветный, очень ядовитый газ, который имеет запах, похожий на запах разлагающейся рыбы.Тепло легко разлагает фосфин \ ((\ ce {4Ph4} ⟶ \ ce {P4} + \ ce {6h3}) \), и соединение горит на воздухе. В основном фосфин используется в качестве фумиганта для зерна и при обработке полупроводников. Подобно аммиаку, газообразный фосфин соединяется с газообразными галогенидами водорода, образуя соединения фосфония, такие как PH 4 Cl и PH 4 I. 2 +} (водн.) + \ Ce {h3S} (g) + \ ce {2h3O} (l) \]
2 +} (водн.) + \ Ce {h3S} (g) + \ ce {2h3O} (l) \]
Сера легко окисляется в сульфидах металлов и в сероводороде, что делает сульфиды металлов и H 2 S хорошими восстановителями.2 -} \) (или в SO 2 или SO 3 при отсутствии воды):
\ [\ ce {2h3S} (g) + \ ce {O2} (g) ⟶ \ ce {2S} (s) + \ ce {2h3O} (l) \]
Этот процесс окисления приводит к удалению сероводорода, содержащегося во многих источниках природного газа. Отложения серы в вулканических регионах могут быть результатом окисления H 2 S, присутствующего в вулканических газах.
Сероводород — это слабая дипротонная кислота, которая растворяется в воде с образованием сероводородной кислоты. Кислота ионизируется в две стадии, давая ионы сероводорода HS — на первой стадии и сульфид-ионы S 2- на второй.2 -} (водн.) + \ Ce {h3O} (l) ⇌ \ ce {HS -} (aq) + \ ce {OH -} (aq) \]
\ [\ ce {HS -} (водн.) + \ Ce {h3O} (l) ⇌ \ ce {h3S} (g) + \ ce {OH -} (водн. ) \]
) \]
Галогенводородные соединения
Бинарные соединения, содержащие только водород и галоген, являются галогенидами водорода. При комнатной температуре чистые галогениды водорода HF, HCl, HBr и HI являются газами.
В общем, галогениды можно получить обычными методами, используемыми для получения других кислот. Фтор, хлор и бром непосредственно реагируют с водородом с образованием соответствующего галогенида водорода.Это коммерчески важная реакция для получения хлористого водорода и бромистого водорода.
Кислотно-основная реакция между нелетучей сильной кислотой и галогенидом металла дает галогенид водорода. Улетучивание газообразного галогенида приводит к завершению реакции. Например, обычный метод получения фтороводорода заключается в нагревании смеси фторида кальция, CaF 2 , и концентрированной серной кислоты:
.\ [\ ce {CaF2} (s) + \ ce {h3SO4} (водн.) ⟶ \ ce {CaSO4} (s) + \ ce {2HF} (g) \]
Газообразный фтористый водород также является побочным продуктом при получении фосфорных удобрений реакцией фторапатита Ca 5 (PO 4 ) 3 F с серной кислотой. Реакция концентрированной серной кислоты с хлоридной солью дает хлористый водород как в коммерческих, так и в лабораторных условиях.
Реакция концентрированной серной кислоты с хлоридной солью дает хлористый водород как в коммерческих, так и в лабораторных условиях.
В большинстве случаев предпочтительным является хлорид натрия, поскольку это наименее дорогой хлорид. Бромистый водород и йодистый водород нельзя получить с использованием серной кислоты, поскольку эта кислота является окислителем, способным окислять как бромид, так и йодид. Однако можно получить как бромистый водород, так и иодистый водород с использованием кислоты, такой как фосфорная кислота, потому что это более слабый окислитель.Например:
\ [\ ce {h4PO4} (l) + \ ce {Br -} (водн.) ⟶ \ ce {HBr} (g) + \ ce {h3PO4 -} (водн.) \]
Все галогенводороды хорошо растворяются в воде с образованием галогеноводородных кислот. За исключением фтороводорода, который имеет сильную фтористоводородную связь, они являются сильными кислотами. Реакции галогеноводородных кислот с металлами, гидроксидами, оксидами или карбонатами металлов дают соли галогенидов. Большинство хлоридных солей растворимы в воде. AgCl, PbCl 2 и Hg 2 Cl 2 являются обычно встречающимися исключениями.
Большинство хлоридных солей растворимы в воде. AgCl, PbCl 2 и Hg 2 Cl 2 являются обычно встречающимися исключениями.
Галогенид-ионы придают веществам свойства, связанные с X — ( водн. ). Более тяжелые галогенид-ионы (Cl — , Br — и I — ) могут действовать как восстановители, а более легкие галогены или другие окислители будут их окислять:
\ [\ ce {Cl2} (aq) + \ ce {2e-} ⟶ \ ce {2Cl -} (aq) \ hspace {20px} E ° = \ mathrm {1.36 \: V} \\
\ ce { Br2} (водн.) + \ Ce {2e-} ⟶ \ ce {2Br -} (aq) \ hspace {20px} E ° = \ mathrm {1.09 \: V} \\
\ ce {I2} (водн.) + \ ce {2e-} ⟶ \ ce {2I -} (aq) \ hspace {20px} E ° = \ mathrm {0.54 \: V} \]
Например, бром окисляет йод:
\ [\ ce {Br2} (водн.) + \ Ce {2HI} (водн.) ⟶ \ ce {2HBr} (водн.) + \ Ce {I2} (водн.) \ Hspace {20px} E ° = \ mathrm {0,55 \: V} \]
Плавиковая кислота уникальна по своим реакциям с песком (диоксид кремния) и со стеклом, которое представляет собой смесь силикатов:
\ [\ ce {SiO2} (s) + \ ce {4HF} (водн. ) ⟶ \ ce {SiF4} (g) + \ ce {2h3O} (l) \]
) ⟶ \ ce {SiF4} (g) + \ ce {2h3O} (l) \]
\ [\ ce {CaSiO3} (s) + \ ce {6HF} (водный) ⟶ \ ce {CaF2} (s) + \ ce {SiF4} (g) + \ ce {3h3O} (l) \]
Летучий тетрафторид кремния улетучивается в результате этих реакций.Поскольку фтористый водород разрушает стекло, он может обмораживать или травить стекло и используется для травления маркировки на термометрах, бюретках и другой стеклянной посуде.
В наибольшей степени фтористый водород используется в производстве гидрохлорфторуглеродов для хладагентов, пластмасс и пропеллентов. Вторым по величине применением является криолит Na 3 AlF 6 , который важен для производства алюминия. Кислота также важна для производства других неорганических фторидов (таких как BF 3 ), которые служат катализаторами в промышленном синтезе определенных органических соединений.
Соляная кислота относительно недорогая. Это важная и универсальная кислота в промышленности, она важна для производства хлоридов металлов, красителей, клея, глюкозы и различных других химикатов. Значительное количество также важно для активации нефтяных скважин и в качестве травильного раствора — кислоты, используемой для удаления оксидного покрытия с железа или стали, подлежащих гальванизации, лужению или эмалированию. Для сравнения, количество бромистоводородной кислоты и йодистоводородной кислоты, используемых на рынке, незначительно.
Значительное количество также важно для активации нефтяных скважин и в качестве травильного раствора — кислоты, используемой для удаления оксидного покрытия с железа или стали, подлежащих гальванизации, лужению или эмалированию. Для сравнения, количество бромистоводородной кислоты и йодистоводородной кислоты, используемых на рынке, незначительно.
Факты о цианидах
Техническая информация
Копия фактов о цианидах (техническая информация) доступна в формате Adobe Portable Document Format (PDF, 68 КБ, 4пг.)
Примечание для читателя: Этот информационный бюллетень предназначен для обеспечения общей осведомленности и просвещения по конкретному химическому веществу. Для получения информации о готовности и реагировании (например, для служб быстрого реагирования и персонала скорой медицинской помощи), пожалуйста, обратитесь к следующим ресурсам Департамента:
Что такое цианиды?
Цианиды — яды быстрого действия, которые могут быть смертельными. Впервые они были использованы в качестве химического оружия во время Первой мировой войны. Цианиды и цианидсодержащие соединения также используются в промышленности и производстве. Предполагаемые ежегодные производственные мощности США по цианиду натрия и цианистому водороду в 2004 г. составляли 286 миллионов фунтов и более 1,8 миллиардов фунтов соответственно. Низкие уровни цианидов обнаружены в живых организмах и присутствуют в сигаретном дыме, выхлопных газах транспортных средств и в таких продуктах питания, как шпинат, побеги бамбука, миндаль, бобы Лимы, фруктовые косточки и тапиока.
Впервые они были использованы в качестве химического оружия во время Первой мировой войны. Цианиды и цианидсодержащие соединения также используются в промышленности и производстве. Предполагаемые ежегодные производственные мощности США по цианиду натрия и цианистому водороду в 2004 г. составляли 286 миллионов фунтов и более 1,8 миллиардов фунтов соответственно. Низкие уровни цианидов обнаружены в живых организмах и присутствуют в сигаретном дыме, выхлопных газах транспортных средств и в таких продуктах питания, как шпинат, побеги бамбука, миндаль, бобы Лимы, фруктовые косточки и тапиока.
Некоторые химические и физические свойства цианидов, которые могут быть задействованы в промышленной аварии или террористической атаке, включают:
- Цианистый водород (AC) — это бледно-голубая или бесцветная жидкость при температуре ниже 78 ° F и бесцветный газ при более высоких температурах. Он имеет горький миндальный запах, очень летуч и легко воспламеняется при комнатной температуре.

- Цианид натрия и цианид калия — это белые порошки, которые могут иметь горький миндальный запах. В присутствии влаги любой из них может образовывать цианистый водород.
- Цианогеновые соединения могут образовывать цианиды. Хлорид цианогена (CK) — это бесцветный сжиженный газ, который тяжелее воздуха и имеет резкий, сильно раздражающий запах. Растворим в воде и органических растворителях.
Запах, связанный с цианидсодержащими соединениями, не может служить адекватным предупреждением об опасных концентрациях. От 20 до 40 процентов населения не имеют гена, необходимого для определения запаха цианида. Даже у тех, кто обладает необходимым геном, обонятельная усталость может помешать обнаружению цианида.
Как используются цианиды?
Цианиды и цианидсодержащие соединения используются в пестицидах и фумигантах, пластмассах, гальванике, фотографических проявлениях и горнодобывающей промышленности. Красильная, текстильная и фармацевтическая промышленность также используют цианиды.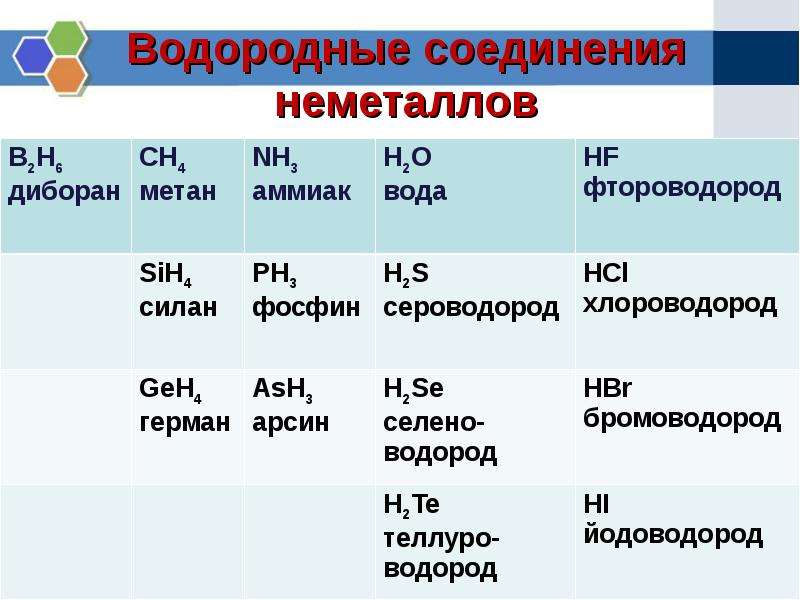 Цианоген можно использовать в качестве ракетного топлива. Исторически цианистый водород использовался в качестве боевого агента. При производстве чугуна и стали, химическом производстве и очистке сточных вод образуются цианиды. Во время хлорирования воды хлорид цианогена может образовываться на низких уровнях.
Цианоген можно использовать в качестве ракетного топлива. Исторически цианистый водород использовался в качестве боевого агента. При производстве чугуна и стали, химическом производстве и очистке сточных вод образуются цианиды. Во время хлорирования воды хлорид цианогена может образовываться на низких уровнях.
Как люди могут подвергаться воздействию цианидов?
Люди могут подвергаться воздействию низких уровней цианидов в повседневной жизни из-за пищевых продуктов, курения и других источников. Однако смертельное воздействие цианидов происходит только в результате несчастных случаев, самоубийств или убийств. Вдыхание цианистого газа, особенно в замкнутом пространстве, представляет значительный риск для здоровья. Прием пищи и напитков, содержащих цианид, также может иметь последствия для здоровья. Ограниченная доступная информация о воздействии цианидов на кожу позволяет предположить, что достаточно большие дозы вызывают последствия для здоровья, подобные вдыханию и проглатыванию.
Каков механизм действия цианида?
Цианид имеет высокое сродство к металлам, таким как кобальт и трехвалентное железо, и к сульфановым соединениям, таким как тиосульфат натрия, который содержит связь серы с серой. В больших дозах цианид быстро связывается с железом в цитохроме a 3 , предотвращая транспорт электронов в цитохроме. Это останавливает окислительное фосфорилирование и производство аденозинтрифосфата (АТФ). В результате прекращается внутриклеточная утилизация кислорода. Затем клетки вынуждены вступать в анаэробный метаболизм, создавая молочную кислоту и приводя к кислотно-щелочному дисбалансу и метаболическому ацидозу.
В малых дозах цианид может превращаться в тиоцианат с помощью печеночного фермента роданезы. Затем тиоцианат выводится с мочой. Небольшое количество цианида также может быть преобразовано в двуокись углерода, которая покидает тело при выдохе. Некоторое количество цианидов может реагировать с гидроксикобаламином с образованием витамина B 12 . Большая часть цианида покидает организм в течение одного дня.
Большая часть цианида покидает организм в течение одного дня.
Каковы конкретные признаки и симптомы воздействия цианида?
Последствия для здоровья от высоких уровней воздействия цианида могут начаться за секунды или минуты.Некоторые признаки и симптомы отравления цианидом:
- Слабость и растерянность
- Головная боль
- Тошнота
- Метаболический ацидоз
- Задыхание, похожее на удушье, но с более резким началом
- Затрудненное дыхание, остановка дыхания
- Потеря сознания
- Судороги перед смертью
- Остановка сердца
Центральная нервная система и миокард особенно чувствительны к воздействию цианида из-за их высокой потребности в кислороде.Тяжесть воздействия на здоровье зависит от пути и продолжительности воздействия, дозы и формы цианида.
Как лечится воздействие цианида?
Часто наиболее важным первым шагом в лечении воздействия цианида является перемещение пациента из точки воздействия свежего воздуха и начало дезинфекции. Для обеззараживания снимите загрязненную одежду пациента и тщательно вымойте тело и волосы пациента водой с мылом. Промойте глаза пациента большим количеством воды или физиологического раствора.После снятия загрязненной одежды запакуйте загрязненную одежду в двойной пакет, чтобы предотвратить дальнейшее воздействие.
Для обеззараживания снимите загрязненную одежду пациента и тщательно вымойте тело и волосы пациента водой с мылом. Промойте глаза пациента большим количеством воды или физиологического раствора.После снятия загрязненной одежды запакуйте загрязненную одежду в двойной пакет, чтобы предотвратить дальнейшее воздействие.
Отравление цианидом можно лечить быстрым введением кислорода и антидотами нитритом натрия и тиосульфатом натрия. Нитрит натрия, вводимый внутривенно, образует метгемоглобин, а затем притягивает связанный и несвязанный цианид от цитохрома a 3 . Это позволяет цитохрому а 3 вернуться к помощи в производстве АТФ. Если нитрит натрия недоступен, ампулы амилнитрита можно вводить путем ингаляции.Доступность источника серы обычно является ограничивающим фактором метаболизма цианида, катализируемого печеночным ферментом роданезой. Введение тиосульфата натрия обеспечивает источник серы, необходимый роданезе для ускорения превращения цианида в менее токсичный тиоцианат.
При приеме антидотов цианида существуют и другие соображения. Если пациент стал жертвой недавнего отравления дымом и у него может быть высокий уровень карбоксигемоглобина, вводите только тиосульфат натрия.Нитрит натрия может повышать выработку метгемоглобина и еще больше снижать способность переносить кислород у таких пациентов. Также важно, чтобы введение антидота было медленным и титрованным, чтобы предотвратить передозировку у пациента. Тщательная поддерживающая терапия может помочь в выздоровлении пациентов, которые не получали антидоты.
При ортостатической гипотензии, вызванной нитритом натрия, рекомендуются инфузии физиологического раствора и положение лежа на спине. Для коррекции метаболического ацидоза может потребоваться внутривенное введение бикарбоната натрия.
| Пациент | Легкая (в сознании) | Тяжелая (без сознания) | Другое лечение |
|---|---|---|---|
| Детский | Если пациент находится в сознании и у него нет других признаков или симптомов, антидоты могут не потребоваться. | Нитрит натрия 1 : 0,12 — 0,33 мл / кг, не более 10 мл 3% раствора 2 медленно Внутривенно в течение не менее 5 минут или медленнее, если развивается гипотензия и Тиосульфат натрия: | При ортостатической гипотензии, вызванной нитритом натрия, рекомендуется инфузия физиологического раствора и положение лежа на спине. Если апноэ все еще сохраняется после введения антидота, рассмотрите возможность лечения тяжелым ацидозом бикарбонатом натрия. |
| Взрослый | Если пациент находится в сознании и у него нет других признаков или симптомов, антидоты могут не потребоваться. | Нитрит натрия 1 : 10-20 мл 3% раствора 2 медленно внутривенно в течение не менее 5 минут или медленнее при развитии гипотензии и Тиосульфат натрия: | |
| |||
Любой, кто лечит зараженного человека, должен носить соответствующие средства индивидуальной защиты, чтобы избежать воздействия. Вторично респонденты могут быть заражены через кожный контакт или выделяющиеся пары, от одежды или кожи жертвы, загрязненной цианидсодержащим раствором, или от рвотных масс тех, кто подвергся воздействию цианида при приеме внутрь.Жертвы, подвергшиеся воздействию цианистого водорода только , не представляют опасности заражения для спасателей , а не .
Помогут ли лабораторные тесты в принятии решения о лечении, если кто-то подвергся воздействию цианида?
Лабораторные исследования воздействия цианида не помогут при принятии решений о неотложном лечении. Доступны медицинские тесты, но любая задержка с введением антидотов для взятия крови или сбора мочи может поставить под угрозу благополучие пациента. Не следует откладывать лечение, если присутствуют признаки и симптомы и предполагается, что произошло заражение.Диагноз отравления цианидом ставится прежде всего клинически. Лабораторные тесты могут быть полезны для наблюдения за пациентом, устранения осложнений и подтверждения воздействия. Повышенная концентрация цианида в крови и присутствие тиоцианата в моче могут подтвердить воздействие цианида. Ацидоз и повышенное содержание кислорода в венозной крови, вероятно, являются лабораторными исследованиями.
Не следует откладывать лечение, если присутствуют признаки и симптомы и предполагается, что произошло заражение.Диагноз отравления цианидом ставится прежде всего клинически. Лабораторные тесты могут быть полезны для наблюдения за пациентом, устранения осложнений и подтверждения воздействия. Повышенная концентрация цианида в крови и присутствие тиоцианата в моче могут подтвердить воздействие цианида. Ацидоз и повышенное содержание кислорода в венозной крови, вероятно, являются лабораторными исследованиями.
Как я могу получить дополнительную информацию о цианиде?
Позвоните по следующим номерам или посетите веб-сайты, указанные в разделе «Источники».
- Горячая линия общественного реагирования Центров по контролю и профилактике заболеваний (1-888-246-2675)
- Агентство регистрации токсичных веществ и заболеваний (1-888-422-8737)
- Региональный токсикологический центр (1-800-222-1222)
Источники:
Агентство регистрации токсичных веществ и заболеваний. 1997. Токсикологический профиль цианида. Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия.
1997. Токсикологический профиль цианида. Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия.
http://www.atsdr.cdc.gov/toxprofiles/tp8.html
Агентство регистрации токсичных веществ и заболеваний. 2004. Руководство по медицинскому лечению цианида водорода. Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия.
http://www.atsdr.cdc.gov/MHMI/mmg8.html
Центры по контролю и профилактике заболеваний.2004. Цианид. Готовность к чрезвычайным ситуациям и реагирование. Министерство здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия.
http://www.bt.cdc.gov/agent/cyanide/index.asp
Медицинский научно-исследовательский институт химической защиты армии США (USAMRICD). 2000. Справочник по медицинскому ведению химических травм, третье издание. Отделение медицинской помощи пострадавшим от химических травм Абердинский полигон: Абердин, штат Мэриленд.
https://ccc.apgea.army.mil/sarea/products/handbooks/MMCC/mmccthirdeditionjul2000.pdf
Этот информационный бюллетень основан на самой последней информации. Он может обновляться по мере появления новой информации.
Обновлено: сентябрь 2004 г.
Инструмент оценки методов управления воздухом
Аммиак : Аммиак — это бесцветный едкий азотсодержащий газ. Он улетучивается из твердого или жидкого материала, когда присутствует ион аммония и существуют другие физические условия. Газообразный аммиак может реагировать в атмосфере с газообразными кислыми частицами с образованием мелких частиц (аэрозоли аммония [Nh5 +]), которые представляют опасность для здоровья.Атмосферный Nh4 может осаждаться во время дождей и приводить к подкислению почвы и повышению концентрации азота в поверхностных водах, потенциально способствуя эвтрофикации.
Сероводород : Сероводород — это бесцветный едкий газ, наиболее известный своим характерным запахом тухлого яйца. При высоких концентрациях сероводород может быть токсичным (газ из силоса), и даже при низких концентрациях он вызывает раздражение дыхательных путей. Хотя сероводород не переносится на большие расстояния, на ферме он может смешиваться с другими соединениями, вызывая запах.
При высоких концентрациях сероводород может быть токсичным (газ из силоса), и даже при низких концентрациях он вызывает раздражение дыхательных путей. Хотя сероводород не переносится на большие расстояния, на ферме он может смешиваться с другими соединениями, вызывая запах.
Пыль и твердые частицы (ТЧ) : Твердые частицы или пыль различаются по размеру в зависимости от источника и образования. Основными проблемами, связанными с взвешенными в воздухе частицами, являются дымка / видимость и воздействие на здоровье. Пыль, выбрасываемая с ферм, очень сложна по размеру, физическим свойствам и составу. В целях регулирования взвешенные в воздухе твердые частицы обычно подразделяются на PM10 (аэродинамический диаметр ≤10 мкм) и PM2,5 (аэродинамический диаметр ≤2,5 мкм). Крупные частицы (2.Диаметром от 5 до 10 мкм), как правило, откладываются в верхних дыхательных путях дыхательных путей; мелкие частицы (PM2,5) могут достигать и откладываться в мельчайших дыхательных путях (альвеолах) легких. Фермы могут вносить крупные частицы напрямую через деятельность животных, приготовление кормов, вентиляционные установки животноводческих помещений и транспорт. Они также могут вносить мелкие частицы в результате вторичного процесса образования (конверсия газа в частицы; см. Раздел по аммиаку).
Фермы могут вносить крупные частицы напрямую через деятельность животных, приготовление кормов, вентиляционные установки животноводческих помещений и транспорт. Они также могут вносить мелкие частицы в результате вторичного процесса образования (конверсия газа в частицы; см. Раздел по аммиаку).
Запах : Запах от животноводческих ферм может состоять из сотен соединений (отдушек).То, как эти одоранты взаимодействуют друг с другом, определяет специфический характер запаха. Пахучие соединения, как правило, переносятся частицами пыли, и, следовательно, стратегии уменьшения запахов от животноводства часто включают стратегии уменьшения количества пыли.
Летучие органические соединения (ЛОС) : Летучие органические соединения (ЛОС) : ЛОС — это большая группа органических химикатов, которые включают атом углерода (за исключением монооксида углерода, диоксида углерода, угольной кислоты, карбидов или карбонатов металлов и карбоната аммония) и которые участвуют в фотохимических реакциях атмосферы. реакции.Некоторые из этих реакций могут приводить к повышению концентрации тропосферного озона (основного загрязнителя) на уровне земли, тем самым способствуя уровням, превышающим национальный стандарт качества окружающего воздуха. ЛОС могут иметь запах или способствовать возникновению запаха на ферме.
реакции.Некоторые из этих реакций могут приводить к повышению концентрации тропосферного озона (основного загрязнителя) на уровне земли, тем самым способствуя уровням, превышающим национальный стандарт качества окружающего воздуха. ЛОС могут иметь запах или способствовать возникновению запаха на ферме.
Парниковые газы: Парниковые газы — это те газы, которые могут поглощать и испускать тепловое излучение (или тепло), которое в противном случае было бы потеряно в космосе. Многие парниковые газы встречаются в атмосфере естественным образом, такие как водяной пар, диоксид углерода, метан, озон и закись азота, в то время как другие являются синтетическими, например хлорфторуглероды, перфторуглероды и гексафторид серы.
Примечания:
Определение, данное для аммиака, сероводорода, пыли и твердых частиц, запаха и летучих органических соединений, было адаптировано из Национального инструмента оценки качества воздуха на объектах (NAQSAT), являющегося дополнением к инструменту AMPAT.
Определение парниковых газов было адаптировано из книги «Вклады выбросов парниковых газов в животноводство и изменение климата», 2014 г. Этот проект финансировался Конкурсными грантами Инициативы сельскохозяйственных и пищевых исследований №2011-67003-30206 из Института продовольствия и сельского хозяйства USDA.
Химические свойства гексафторида урана, UF6 (Технический отчет)
Гросс, Аристид В. Химические свойства гексафторида урана, UF6 . США: Н. с., 1941.
Интернет. DOI: 10,2172 / 962915.
Гросс, Аристид В. Химические свойства гексафторида урана, UF6 . Соединенные Штаты. https://doi.org/10.2172/962915
Гросс, Аристид В. Ср.
«Химические свойства гексафторида урана, UF6». Соединенные Штаты. https://doi.org/10.2172/962915. https://www.osti.gov/servlets/purl/962915.
https://doi.org/10.2172/962915. https://www.osti.gov/servlets/purl/962915.
@article {osti_962915,
title = {Химические свойства гексафторида урана, UF6},
author = {Гросс, Аристид V},
abstractNote = {Гексафторид урана отличается тем, что является единственным стабильным газообразным соединением урана, известным до настоящего времени.Благодаря этому свойству это единственное соединение, которое можно использовать для процессов разделения изотопов, таких как диффузия, термодиффузия, разделение на центрифуге, дистилляция и других аналогичных процессов. Вот краткое описание свойств UF {sub 6}, предназначенное для читателя, который лишь случайно интересуется этим составом. UF {sub 6} - это очень реактивное соединение и очень сильный фторирующий агент. Он немедленно гидролизуется водой. В реакциях фторирования он восстанавливается до зеленого высокостабильного UF {sub 4}. Он мгновенно реагирует с водородом при комнатной температуре. Он фторирует многие металлы; натрий и ртуть разрушаются на холоде, свинец, цинк, олово и железо при нагревании; платина и золото вступают в реакцию только при температуре выше 400 ° C. В случае органических соединений, таких как спирт, эфир, бензол или толуол, происходит немедленное фторирование с образованием HF и углерода или углеродистого материала. Соединение образует бесцветные, очень летучие, красивые прозрачные кристаллы с высоким показателем преломления. Температура плавления = 69,5 {sup o}; точка кипения при 760 мм = 56.2 {sup o}; D20 {sup o} = 4,68. Кристаллы плавят воду под давлением в прозрачную бесцветную жидкость высокой плотности, но с большой подвижностью.},
Он мгновенно реагирует с водородом при комнатной температуре. Он фторирует многие металлы; натрий и ртуть разрушаются на холоде, свинец, цинк, олово и железо при нагревании; платина и золото вступают в реакцию только при температуре выше 400 ° C. В случае органических соединений, таких как спирт, эфир, бензол или толуол, происходит немедленное фторирование с образованием HF и углерода или углеродистого материала. Соединение образует бесцветные, очень летучие, красивые прозрачные кристаллы с высоким показателем преломления. Температура плавления = 69,5 {sup o}; точка кипения при 760 мм = 56.2 {sup o}; D20 {sup o} = 4,68. Кристаллы плавят воду под давлением в прозрачную бесцветную жидкость высокой плотности, но с большой подвижностью.},
doi = {10.2172 / 962915},
url = {https://www.osti.gov/biblio/962915},
journal = {},
number =,
объем =,
place = {United States},
год = {1941},
месяц = {6}
}
Волатильность жидкости — Образовательное партнерство по фармакологии алкоголя
При достаточной кинетической энергии большинство жидкостей может стать газом в процессе испарения. Будет ли жидкость испаряться или нет, зависит от химических свойств жидкости. Летучие жидкости, включая этанол, относительно легко испаряются. Ученые обычно используют точку кипения жидкости как меру летучести.
Будет ли жидкость испаряться или нет, зависит от химических свойств жидкости. Летучие жидкости, включая этанол, относительно легко испаряются. Ученые обычно используют точку кипения жидкости как меру летучести.
- Летучие жидкости имеют низкие температуры кипения.
- Жидкость с низкой температурой кипения закипит быстрее, чем жидкости с более высокой температурой кипения.
- Для разрыва межмолекулярных связей в летучей жидкости требуется гораздо меньше энергии (в виде тепла), чем у жидкостей с более высокими температурами кипения.
- Как только будет подано достаточно энергии для разрыва связей между молекулами, молекулы могут свободно расширяться и покидать поверхность жидкости в виде газа.
Химические связи способствуют нестабильности
Основные силы притяжения между молекулами жидкости называются водородными связями. Ожидается, что между молекулами летучей жидкости будет меньше водородных связей по сравнению с другими менее летучими жидкостями. При меньшем количестве водородных связей, удерживающих летучие соединения в жидком состоянии, требуется лишь минимальная энергия, чтобы разорвать связи и позволить молекулам разойтись и уйти с поверхности жидкости в виде газа.
При меньшем количестве водородных связей, удерживающих летучие соединения в жидком состоянии, требуется лишь минимальная энергия, чтобы разорвать связи и позволить молекулам разойтись и уйти с поверхности жидкости в виде газа.
Просмотрите свойства различных химических связей.
Метоксиметан имеет ту же молекулярную формулу, такое же количество электронов и примерно такую же форму и размер, как этанол. Несмотря на это сходство, структурные формулы (организация отдельных молекул в пространстве) у этанола (Ch4Ch3OH) и метоксиметана (Ch4OCh4) различаются. Это различие в конфигурации атомов внутри молекул оказывает драматическое влияние на летучесть этанола по сравнению с метоксиметаном.
Структуры показывают, почему этанол менее летуч, чем метоксиметан; этанол может образовывать три водородные связи, а метоксиметан не может образовывать ни одной. Обратите внимание, что атомы водорода в метоксиметане не могут участвовать в образовании водородных связей с соседними атомами кислорода. Атом водорода гидроксильной группы (ОН) в этаноле увеличивает потенциал образования водородных связей между соседними молекулами этанола. По сравнению с метоксиметаном этанол не такой летучий. Температура кипения 78.5 ° C для этанола значительно выше по сравнению с -24,8 ° C для метоксиметана. Этот пример иллюстрирует значение прочности связи в целом и водородной связи в частности как определяющего фактора летучести молекулы.
Атом водорода гидроксильной группы (ОН) в этаноле увеличивает потенциал образования водородных связей между соседними молекулами этанола. По сравнению с метоксиметаном этанол не такой летучий. Температура кипения 78.5 ° C для этанола значительно выше по сравнению с -24,8 ° C для метоксиметана. Этот пример иллюстрирует значение прочности связи в целом и водородной связи в частности как определяющего фактора летучести молекулы.
Переход жидкости в газ называется испарением. Обратная реакция, превращающая газ в жидкость, называется конденсацией.
- В частично заполненном контейнере частицы жидкости вылетают с поверхности и испаряют воздух над жидкостью.
- По мере того, как концентрация газа накапливается в воздухе, расстояние, разделяющее отдельные молекулы, уменьшается до тех пор, пока ван-дер-ваальсовы и водородные связи не смогут перевести кластеры молекул обратно в жидкую форму (конденсация).
- В конце концов, испарение и конденсация достигают состояния равновесия — никакие частицы не теряются, вместо этого газовая фаза постоянно переходит в жидкую фазу (представьте себе кипящую воду с закрытой крышкой).

Глоссарий по химии атмосферы
Назад Рассеяние — Процесс, при котором до 25% излучения энергия солнца отражается или рассеивается от поверхность облаками.Имеет большое значение в баланс тепла атмосферы. Большие ошибки в предполагаемом значении эта переменная может иметь важное влияние на компьютерные модели атмосфера. [Радиация и облачный процесс в Атмосфера; Liou, K.N .; 194; 1992; Oxford Press; Оксфорд.] [ Влияние человека на климат; Митчелл, Мерри; Эд. Уильямс А. Мэтьюз; 173; 1971; Колониальная пресса; Балтимор.] [Атмосферный Среда; v36; 5479-5489; 2002: DOI: http: // dx.doi.org/10.1016/S1352-2310(02)00664-7] [Физика и химия Земли, Часть B: Гидрология, Океаны и атмосфера; v26; 239-245; 2001; DOI: 10.1016 / S1464-1909 (00) 00246-X]
Барометрический Давление — Нисходящее давление в любой заданной точке
в атмосфере газов прямо над этой точкой. Среднее давление на уровне моря в мире составляет 1 013 000 дин за
сантиметр в квадрате или 760 торр. Это определяется как один
Атмосфера.[Полевой справочник по атмосфере; Дэй, Джон и
Шефер, Винсент; 347; 1981; Хоутон Миффлин; Бостон.] [Лед
Время; Левенсон, Томас; 69-70; 1989; Харпер и Роу; NY.]
[Физика и химия Земли; v27; 1387-1399; 2002: DOI: 10.1016 / S1474-7065 (02) 00076-1]
Среднее давление на уровне моря в мире составляет 1 013 000 дин за
сантиметр в квадрате или 760 торр. Это определяется как один
Атмосфера.[Полевой справочник по атмосфере; Дэй, Джон и
Шефер, Винсент; 347; 1981; Хоутон Миффлин; Бостон.] [Лед
Время; Левенсон, Томас; 69-70; 1989; Харпер и Роу; NY.]
[Физика и химия Земли; v27; 1387-1399; 2002: DOI: 10.1016 / S1474-7065 (02) 00076-1]
Пиво Закон (закон Бера-Ламберта) — для монохроматических
излучения, поглощение (A) определяется соотношением: A =
abc, где a = поглощающая способность, b = длина пути через среду,
и c = концентрация поглощающих веществ.Интенсивность
луч света, прошедший через среду, является функцией
длина пути, по которому проходит свет, и
концентрация поглощающего вещества в этой среде. [Основы
аналитической химии; Скуг, Дуглас А .; West, Donald M .;
Холлер, Джеймс Ф .; Эд. Дженнифер Бортел; п.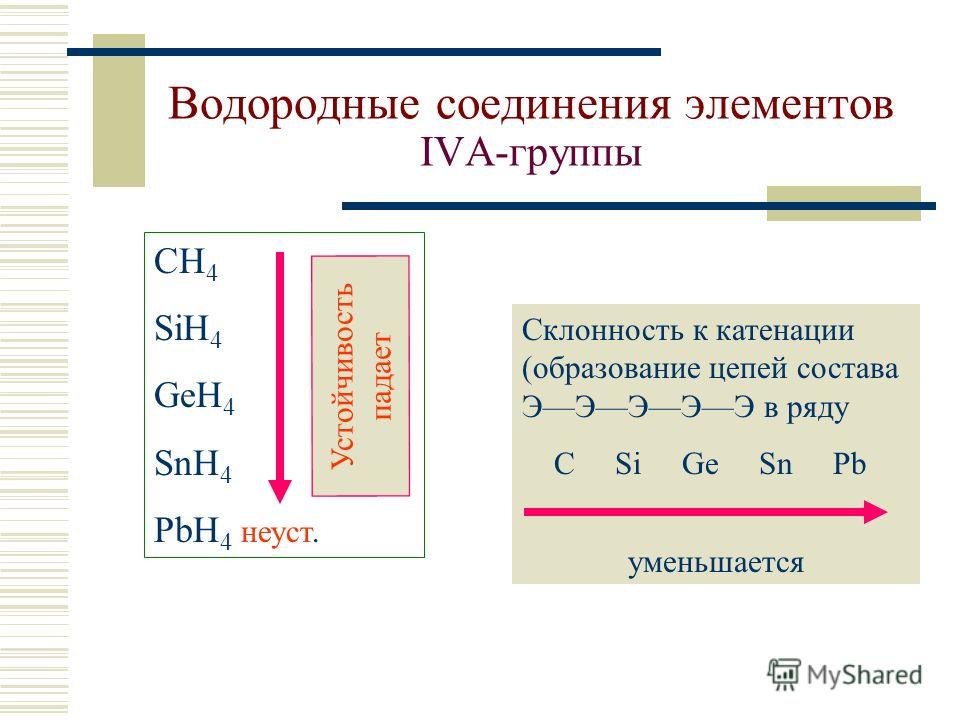 510; 1996; Сондерс
Издательство колледжа; Форт-Уэрт, Техас.] [The Gulf Publishing
Деловой и научный словарь компании; Тверь, Давид Ф .; п.58; 1974; Издательская компания «Галф»; Хьюстон, Техас.] [Физика и
Химия Земли; v27; 355-362: 2002: DOI: 10.1016 / S1474-7065 (02) 00012-8]
510; 1996; Сондерс
Издательство колледжа; Форт-Уэрт, Техас.] [The Gulf Publishing
Деловой и научный словарь компании; Тверь, Давид Ф .; п.58; 1974; Издательская компания «Галф»; Хьюстон, Техас.] [Физика и
Химия Земли; v27; 355-362: 2002: DOI: 10.1016 / S1474-7065 (02) 00012-8]
Бензол — C 6 H 6 , ароматический углеводород. Может быть
обнаруживается в воздухе несколькими способами передачи. Это
может производиться для использования с пластиком или производиться через
сжигание ископаемого топлива. Бензол также можно найти в почве.
а также некоторые районы загрязнения грунтовых вод.В городских условиях
его присутствие коррелирует с наличием NO x и
CO. Воздействие бензола связывают с лейкемией. [Журнал
Прикладная метеорология; v38; 14481462; 1999; DOI: 10.1175 / 1520-0450 (1999) 038 <1448: AAOSOG> 2.0.CO; 2]
[Атмосферная среда; v41; 554-566; 2007; DOI: 10. 1016 / j.atmosenv.2006.08.051]
1016 / j.atmosenv.2006.08.051]
Биогенный Выбросы — химические соединения, которые живут организмы, попавшие в атмосферу, обычно связанные с дыхание или брожение.Мониторинг биогенных выбросов помогает определить источник и приемник химических веществ, а также атмосферные циклы. Примеры атмосферных компонентов из биогенез — это метан, закись азота или терпены. [Экологический Приложения; v7; 46-58; 1997 г.] [Сельское и лесное хозяйство Метеорология; v149; 808-819; 2009; DOI: 10.1016 / j.agrformet.2008.11.001]
Биогеохимический Углерод — Биологическое и географическое исследование
свойства химических свойств углерода по отношению к газам
в атмосфере.Модели, изучающие это, часто включают
углекислый газ в атмосфере, карбонаты в океане, органические
углерода и растворенного неорганического углерода в попытке
определить временные характеристики углерода планеты
цикл. [Эпохи Гайи; Лавлок, Дж .; стр. 30, 34, 62; 1988;
Петух; Нью-Йорк] [Моделирование климатических систем; Салби, Марри; Эд. Кевин
Э. Тренберт; стр. 452, 489; 1992; Издательство Кембриджского университета;
Лондон.] [Глобальные и планетарные изменения; v35; 131-141; 2003 г.]
[Письма по науке о Земле и планетах; v286, 316-323: 2009; DOI: 10.1016 / j.epsl.2009.06.045]
[Эпохи Гайи; Лавлок, Дж .; стр. 30, 34, 62; 1988;
Петух; Нью-Йорк] [Моделирование климатических систем; Салби, Марри; Эд. Кевин
Э. Тренберт; стр. 452, 489; 1992; Издательство Кембриджского университета;
Лондон.] [Глобальные и планетарные изменения; v35; 131-141; 2003 г.]
[Письма по науке о Земле и планетах; v286, 316-323: 2009; DOI: 10.1016 / j.epsl.2009.06.045]
Биологический Амплификация или биоаккумуляция — Увеличение концентрация ДДТ, ПХБ и других медленно разлагаемых, жирорастворимые химические вещества в организмах при последовательно более высоких уровни. [Miller, Tyler G .; Жизнь в окружающей среде: Принципы, связи и решения, (1996) Wadsworth Publishing, Нью-Йорк.] [Биоресурсы Технологии; v98; 2178-2183; 2007 г.] [Критические обзоры в Токсикология; v34; 301-333; 2004 г.] [Обзоры микробиологии FEMS; v11; 297-316; 1993.]
Биомасса — The
полная сухая масса органического материала, обнаруженного в биосфере
или менее строго, материя в биосфере, которая содержится
в живых организмах.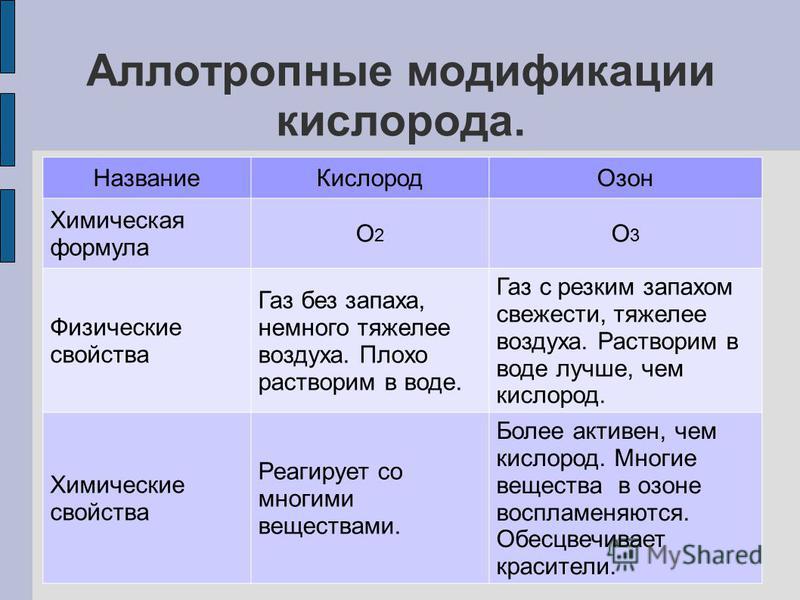 [Биология; Кэмпбелл, Нил; 1118; 1990;
Бенджамин Каммингс, Редвуд-Сити.] [Жизнь в окружающей среде;
Миллер, Тайлер; 467-470; 1994; Уодворт; Бельмонт.]
[Биология; Кэмпбелл, Нил; 1118; 1990;
Бенджамин Каммингс, Редвуд-Сити.] [Жизнь в окружающей среде;
Миллер, Тайлер; 467-470; 1994; Уодворт; Бельмонт.]
Биомасса Горение — процесс окисления живого материала. В результате этого процесса образуются атмосферные частицы, а также производство парниковых и химически активных тропосферных газов. Эти газы включают CO 2 , CO, NO x , CH 4 , CH 3 Cl вместе с добавлением черного углерода. Все эти химические соединения могут подниматься относительно высоко в атмосферу из-за конвективного разогрева огня.[Graedel, Т.Д. и Пол Крутцен. Атмосферные изменения: система Земли перспектива; 1993; Freeman Press.] [Атмосферная среда; v41; 2644-2659; 2007.] [Дистанционное зондирование окружающей среды; v107; 81-89; 2007.]
Биосфера — Объем, включающий нижнюю часть тропосферы (до
поскольку живые организмы могут летать или подниматься вверх) и поверхность
Земля, включая океаны. Этот регион по определению
охватывает все живое на Земле.Некоторые очень
важные химические вещества в атмосфере производятся в этом регионе и
перейти в атмосферу. Этот регион обменивается химикатами и
твердые частицы с атмосферой, почвами и водами
Земля. [Журнал геофизических исследований; v99; 16511-16521;
1994.] [Журнал гидрологии; v337; 258-268; 2007.] [Журнал для
Охрана природы; v15; 26-40; 2007.]
Этот регион по определению
охватывает все живое на Земле.Некоторые очень
важные химические вещества в атмосфере производятся в этом регионе и
перейти в атмосферу. Этот регион обменивается химикатами и
твердые частицы с атмосферой, почвами и водами
Земля. [Журнал геофизических исследований; v99; 16511-16521;
1994.] [Журнал гидрологии; v337; 258-268; 2007.] [Журнал для
Охрана природы; v15; 26-40; 2007.]
Черный Углерод — Выбрасывается при сжигании угля, дизельного топлива.
топливо, природный газ и биомасса и входит в состав
сажа.Черный углерод может поглощать и отражать охлаждение солнечного света
поверхности Земли, но также увеличивают солнечную энергию, поглощаемую
атмосфера, согревающая его. Считается, что эти эффекты
влияют на глобальный климат и циклы осадков. Черный углерод
усиливает эффект глобального потепления, проблемы с видимостью и
проблемы со здоровьем. [Наука; v307; 1454; 2005: DOI: 10.1126 / science.1104359]
[Технология наук об окружающей среде; v39; 1861; 2005; DOI: 10.1021 / es0493650]
[Наука; v307; 1454; 2005: DOI: 10.1126 / science.1104359]
[Технология наук об окружающей среде; v39; 1861; 2005; DOI: 10.1021 / es0493650]
Черное тело Излучение — Любое физическое тело поглощает и излучает электромагнитное излучение при его температуре выше абсолютной нуль.Закон Планка определяет лучистый поток тела на конкретная длина волны. В химии атмосферы расчет с участием излучения черного тела Земли показывает, что температура поверхности будет ниже точки замерзания воды если бы в нем не было атмосферы, которая поглотила бы часть исходящее излучение. [Физический обзор A; v45; 8471-8487; 1992; DOI: 10.1103 / PhysRevA.45.8471] [Наука; v232; 1517-1522; 1986: DOI: 10.1126 / наука.232.4757.1517]
Blue Sky — см. Видимый свет.
Болид
Удары — Астероиды или кометы, падающие на Землю; а
возможная причина серьезных изменений климата и массовых вымираний в
история Земли. [Биология; v44; 173-176; 1994.] [Природа;
v342; 139-142; 1989.] [Осадочная геология; v108; 45-90: 1997; DOI: 10.1016 / S0037-0738 (96) 00048-6]
[Биология; v44; 173-176; 1994.] [Природа;
v342; 139-142; 1989.] [Осадочная геология; v108; 45-90: 1997; DOI: 10.1016 / S0037-0738 (96) 00048-6]
Граница Слой — пораженная область тропосферы. за счет солнечного нагрева, радиоактивного охлаждения и поверхностного трения земли.Высота пограничного слоя может варьироваться от 100 м до 3 км и совпадает с высотой на какие загрязнители смешаны. Область непосредственно над пограничный слой называется свободной тропосферой. [Журнал Прикладная метеорология; v28, страницы 885-903; 1989.] [Атмосферное Среда; v37; 2193-2205; 2003; DOI: 10.1016 / S1352-2310 (03) 00157-2] [Атмосферные исследования; v75; 301-321; 2005; DOI: 10.1016 / j.atmosres.2005.01.005]
Бромхлордифторметан — [CAS # 353-59-3] Химическая формула CBrClF 2 Синонимы:
Галон 1211, фреон 12B1, хлордифторбромметан.Этот
химическое вещество принадлежит к семейству фреонов. Представлен галон 1211
в 1960-х годах в качестве эффективного газового средства пожаротушения для
применение в защите компьютерных диспетчерских пунктов,
музеи, телекоммуникационные коммутаторы и другие помещения, содержащие
очень ценные материалы. Результаты исследований, проведенных в конце
1980-е годы показали, что это вещество является химическим веществом, разрушающим озоновый слой.
Это химическое вещество стабильно в тропосфере, но фотодиссоциирует.
с образованием радикалов галогена в верхних слоях атмосферы, которые могут
каталитически разрушают стратосферный озон.[Американский журнал
Неотложная медицинская помощь; v14; 675-677; 1996.] [Атмосферное
Среда; v40; 7331-7345, 2006; DOI: 10.1016 / j.atmosenv.2006.06.041]
Представлен галон 1211
в 1960-х годах в качестве эффективного газового средства пожаротушения для
применение в защите компьютерных диспетчерских пунктов,
музеи, телекоммуникационные коммутаторы и другие помещения, содержащие
очень ценные материалы. Результаты исследований, проведенных в конце
1980-е годы показали, что это вещество является химическим веществом, разрушающим озоновый слой.
Это химическое вещество стабильно в тропосфере, но фотодиссоциирует.
с образованием радикалов галогена в верхних слоях атмосферы, которые могут
каталитически разрушают стратосферный озон.[Американский журнал
Неотложная медицинская помощь; v14; 675-677; 1996.] [Атмосферное
Среда; v40; 7331-7345, 2006; DOI: 10.1016 / j.atmosenv.2006.06.041]
Бромметан — CH 3 Br, летучее соединение с высокой скоростью смешивания
в атмосфере. Бромистый метил легко уходит в
атмосфере, где он может способствовать истощению озона в
верхняя атмосфера.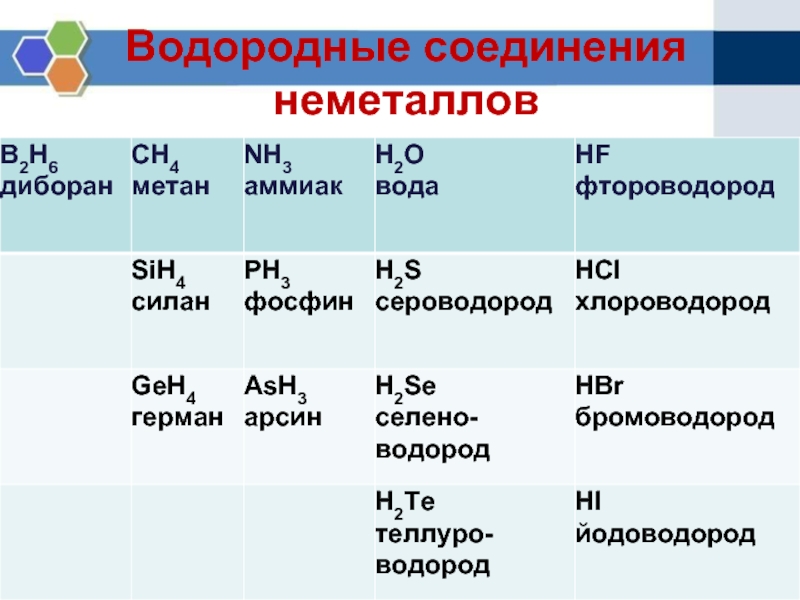 По своей реакции действует аналогично ХФУ.
с молекулами озона (O 3 ).В стратосфере с
ультрафиолетовый свет солнца как катализатор, бромистый метил расщепляется и
обменивает ион бромида на кислород из озона. Разрушая
молекулы озона в стратосфере, бромистый метил истончается
озоновый слой и пропускает больше ультрафиолетового света.
[Chemosphere; v31; 3387-3395; 1995; DOI: 10.1016 / 0045-6535 (95) 00190-J]
[Экотоксикология и экологическая безопасность; v33; 100-101;
1996; DOI: 10.1006 / eesa.1996.0011]
По своей реакции действует аналогично ХФУ.
с молекулами озона (O 3 ).В стратосфере с
ультрафиолетовый свет солнца как катализатор, бромистый метил расщепляется и
обменивает ион бромида на кислород из озона. Разрушая
молекулы озона в стратосфере, бромистый метил истончается
озоновый слой и пропускает больше ультрафиолетового света.
[Chemosphere; v31; 3387-3395; 1995; DOI: 10.1016 / 0045-6535 (95) 00190-J]
[Экотоксикология и экологическая безопасность; v33; 100-101;
1996; DOI: 10.1006 / eesa.1996.0011]
Бромтрифторметан — Также известный как галон-1301, это химическое вещество с формулой CBrF 3 является одним из самых разрушающих озоновый слой веществ, известных человеку.Это
внесен в список озоноразрушающих веществ класса I в США.
Поправки к Закону о чистом воздухе 1990 г.
обычно используется в противопожарном оборудовании, используемом вокруг чувствительных
электронное оборудование, такое как компьютерные залы, телекоммуникации
центры и авиационное оборудование. Известно, что вызывает головную боль
и бессознательное состояние у людей. [Фундаментальные и прикладные
Токсикология; v20; 231-239; 1993.] [Журнал хроматографии А;
v903; 261–265; 2000 г.]
Известно, что вызывает головную боль
и бессознательное состояние у людей. [Фундаментальные и прикладные
Токсикология; v20; 231-239; 1993.] [Журнал хроматографии А;
v903; 261–265; 2000 г.]
Броуновский Motion — Трехмерное случайное движение частицы в газе или жидкости. [Журнал химического образования; v65, 1091-1093; 1988.] [Наука об окружающей среде и технология; v25; 2031-2037; 1991.]
1,3-Бутадиен — CH 2 = CH-CH = CH 2 , производится во время нефтехимическое сжигание. Это тоже просочилось в атмосферу из хранилища нефтехимии.Типичный период полураспада в атмосфера составляет около 2 часов. Это также известный человек канцероген. [Химико-биологические взаимодействия; v166; 44-51; 2007.] [Атмосферная среда; Том 40; 7686-7695; 2006.]
Бутанал — C 4 H 8 O — Легковоспламеняющийся, коррозионный
соединение, вызывающее ожоги; альдегид бутана. Также
бесцветная жидкость, с резким запахом, которая конденсируется и
окисляется при более высокой температуре атмосферы и способствует
фотохимическому смогу.[Журнал Photochemistry Photobiology A:
v143; 169–179; 2001; DOI: 10.1016 / S1010-6030 (01) 00524-X]
[Атмосферная среда; v38; 4371-4382; 2004: DOI: 10.1016 / j.atmosenv.2004.03.035]
Также
бесцветная жидкость, с резким запахом, которая конденсируется и
окисляется при более высокой температуре атмосферы и способствует
фотохимическому смогу.[Журнал Photochemistry Photobiology A:
v143; 169–179; 2001; DOI: 10.1016 / S1010-6030 (01) 00524-X]
[Атмосферная среда; v38; 4371-4382; 2004: DOI: 10.1016 / j.atmosenv.2004.03.035]
2-бутанон — CH 3 C (= O) -CH 2 CH 2 , также известный как
метилэтилкетон, 2-бутанон является продуктом
производство красок, клея и других покрытий из-за
его растворяющая способность. Побочный продукт в выхлопе
автомобилей, 2-бутанон может легко испаряться в
Атмосфера.Он был обнаружен как в помещении, так и на улице.
Находясь на открытом воздухе, он образуется в результате фотоокисления
некоторые загрязнители воздуха, такие как бутан и другие углеводороды.
Известно, что он оказывает негативное влияние на здоровье при вдыхании в
высокие концентрации. [Таланта; v72; 539-545; 2007.]
[Наука об окружающей среде в целом; v368; 574-584; 2006.]
[Атмосферная среда; v34; 2063-2101; 2000; DOI: 10.1016 / S1352-2310 (99) 00460-4]
[Таланта; v72; 539-545; 2007.]
[Наука об окружающей среде в целом; v368; 574-584; 2006.]
[Атмосферная среда; v34; 2063-2101; 2000; DOI: 10.1016 / S1352-2310 (99) 00460-4]
трет-Бутилбензол — Химическая формула: C 10 H 14 молекулярная
вес 134.21 грамм. Это химическое вещество легко воспламеняется и
легко воспламеняется от тепла, искр или пламени. Он также менее плотный
чем вода и не растворяется в воде и представляет собой бесцветную жидкость.
Это химическое вещество представляет собой ароматический углеводород, используемый в углеводородах.
топливо. В процессах горения способствует образованию
мутагенных и канцерогенных соединений, таких как бензо (а) пирен.
[Progress Energy Combustion Science; v37; 330-350; 2011; DOI: 10.1016 / j.pecs.2010.06.004]
[Атмосфера; 23; 165-183; 2010 г.] [Экспериментальная медицина и
Биология; 459; 179–193; 1999. ]
]
Cap and Trade — для регулирования выбросов углерода — метод снижения выбросов углерода.
путем установления (годовых) нормативных лимитов на крупные промышленные CO 2 эмитенты и штрафовать их, если они превышают этот предел. Излучатели
которые могут снизить их годовые выбросы CO 2 ,
разрешено продать прав на выпуск остатка на
другие источники, которые не могут так легко уменьшить выбросы.Эти
правильные цены на торгуемые эмиссии устанавливаются рынком и, в
теория, эти сделок позволяют тем, кому нужно купить
эмиссия дает шанс сэкономить деньги на штрафах.
Постепенно нормативные пределы выбросов, , , становятся
снижается, и это со временем снижает общие выбросы. Система как это было для выбросов диоксида серы
в США с 1990-х годов и для NO x с 2003 года.Это можно сравнить с налогом на выбросы углерода. [Экономика энергетики, в печати; 2009: DOI: 10.1016 / j.eneco.2009.02.003] [Журнал экономики и управления окружающей средой; v56; 131-140, 2008; DOI: 10.1016 / j.jeem.2007.12.004]
[Экономика энергетики, в печати; 2009: DOI: 10.1016 / j.eneco.2009.02.003] [Журнал экономики и управления окружающей средой; v56; 131-140, 2008; DOI: 10.1016 / j.jeem.2007.12.004]
Углерод 14 — 14 С, изотоп углерода-12 ( 12 C). 14 С содержит еще два нейтрона, радиоактивен и используется в углеродное датирование. Хотя углерод-12 не радиоактивен, половина Срок службы 14 C составляет 5730 лет.Этот относительно короткий период полураспада позволяет соотношение углерода-12 и углерода-14 быть используется для датирования объектов, содержащих углерод, возрастом 50 000 лет до настоящего времени. [Журнал гидрологии; v430; 50-68; 2012; DOI: 10.1016 / j.jhydrol.2012.01.046]
на карбонатной основе Улавливание двуокиси углерода — двуокись углерода в
образующиеся при сгорании дымовые газы могут растворяться в
карбонатсодержащие растворы с образованием бикарбонатов, тем самым
концентрирование CO 2 для последующей секвестрации. При нагревании раствора, содержащего бикарбонат, выделяется CO 2 ,
риформинг карборбонатов, которые могут быть переработаны. Расплавленный
Технология карбонатных топливных элементов также находится в стадии разработки.
[Международный журнал контроля парниковых газов; v2; 9-20;
2008; DOI: 10.1016 / S1750-5836 (07) 00094-1]
[Международный журнал контроля парниковых газов; v9; 372-384;
2012; DOI: http: //dx.doi.org.ezproxy.shsu.edu/10.1016/j.ijggc.2012.05.002]
При нагревании раствора, содержащего бикарбонат, выделяется CO 2 ,
риформинг карборбонатов, которые могут быть переработаны. Расплавленный
Технология карбонатных топливных элементов также находится в стадии разработки.
[Международный журнал контроля парниковых газов; v2; 9-20;
2008; DOI: 10.1016 / S1750-5836 (07) 00094-1]
[Международный журнал контроля парниковых газов; v9; 372-384;
2012; DOI: http: //dx.doi.org.ezproxy.shsu.edu/10.1016/j.ijggc.2012.05.002]
Углерод Цикл — Комплекс цикл, в котором углерод циркулирует в атмосфере, океанах, и земля, которая включает растительность, почву и углерод, находится в различные формы и степени окисления на протяжении всего цикла.[Американский ученый; v78; 310-326; 1990.] [Журнал Лесное хозяйство; v88; 33-34; 1990.]
Углерод Диоксид — CO 2 , летучее соединение
состоящий из одного углерода и двух атомов кислорода. Это реагент в
фотосинтез и необходим для жизни растений, и в изобилии
атмосферу из-за антропогенного
и естественная деятельность. Это парниковый газ. Атмосферный
концентрация углекислого газа повышалась с
доиндустриальная ценность (<1800 г. н.э.) около 280 ppmv до мая 2020 уровень около 417 ppmv, измеренное в обсерватории Мауна-Лоа, Гавайи.Это
рост почти на 50%. К. Дэвид Килинг сыграл важную роль в
создание первых, высокоточных, непрерывных измерений
атмосферного углекислого газа. Непрерывный, наклонный вверх
График зависимости концентрации CO в атмосфере 2 от времени равен
одноименно известная как кривая Килинга. Данные ледяного керна из
Европейский проект по исследованию керна льда в Антарктиде показывает, что настоящее
атмосферные концентрации CO 2 и CH 4 являются самыми высокими за последние 800000 лет, как определено в
так называемый ледяной керн Dome C.
Это реагент в
фотосинтез и необходим для жизни растений, и в изобилии
атмосферу из-за антропогенного
и естественная деятельность. Это парниковый газ. Атмосферный
концентрация углекислого газа повышалась с
доиндустриальная ценность (<1800 г. н.э.) около 280 ppmv до мая 2020 уровень около 417 ppmv, измеренное в обсерватории Мауна-Лоа, Гавайи.Это
рост почти на 50%. К. Дэвид Килинг сыграл важную роль в
создание первых, высокоточных, непрерывных измерений
атмосферного углекислого газа. Непрерывный, наклонный вверх
График зависимости концентрации CO в атмосфере 2 от времени равен
одноименно известная как кривая Килинга. Данные ледяного керна из
Европейский проект по исследованию керна льда в Антарктиде показывает, что настоящее
атмосферные концентрации CO 2 и CH 4 являются самыми высокими за последние 800000 лет, как определено в
так называемый ледяной керн Dome C. [Журнал геофизических исследований;
v96; 7301-7312; 1991; DOI: 10.1029 / 90JD02713]
[Экологическая наука и технология; v28; 1565–1576; 1994; DOI: 10.1021 / es00058a006]
[CO в атмосфере 2 и 13 CO 2 обмен с земной биосферой и океанами с 1978 по
2000: наблюдения и последствия углеродного цикла; К. Д. Килинг,
С. К. Пайпер, Р. Б. Бакастоу, М. Вален, Т. П. Уорф, М. Хайманн,
и Х. А. Мейер; стр.83-113, в «История атмосферного CO 2 »
и его влияние на растения, животных и экосистемы », редакторы,
Элерингер, Дж. Р., Т. Е. Серлинг, М. Д. Диринг, Springer Verlag,
Нью-Йорк, 2005 г .; DOI:
10.1126 / science.1141038]
[Журнал геофизических исследований;
v96; 7301-7312; 1991; DOI: 10.1029 / 90JD02713]
[Экологическая наука и технология; v28; 1565–1576; 1994; DOI: 10.1021 / es00058a006]
[CO в атмосфере 2 и 13 CO 2 обмен с земной биосферой и океанами с 1978 по
2000: наблюдения и последствия углеродного цикла; К. Д. Килинг,
С. К. Пайпер, Р. Б. Бакастоу, М. Вален, Т. П. Уорф, М. Хайманн,
и Х. А. Мейер; стр.83-113, в «История атмосферного CO 2 »
и его влияние на растения, животных и экосистемы », редакторы,
Элерингер, Дж. Р., Т. Е. Серлинг, М. Д. Диринг, Springer Verlag,
Нью-Йорк, 2005 г .; DOI:
10.1126 / science.1141038]
Улавливатель диоксида углерода — См. Углерод Секвестр.
Углерод Дисульфид — CS 2 ,
соединение, используемое для производства таких продуктов, как вискоза и
целлофан. Дисульфид углерода производится естественным путем
микробная активность на болотах и в вулканическом пепле. С
сероуглерод плохо прилипает к отложениям, если он
соприкасается с почвой, он может проникать в
грунтовые воды, где они хорошо растворяются. CS 2 также может
добавить к развитию фотохимического смога, когда он реагирует с
другие органические вещества в атмосфере, такие как метан или
оксиды азота. [Аналитическая химия; v1753 -1755; 1997 г.]
[Экологическая наука и технология; v35; 2543-2547; 2001.]
Дисульфид углерода производится естественным путем
микробная активность на болотах и в вулканическом пепле. С
сероуглерод плохо прилипает к отложениям, если он
соприкасается с почвой, он может проникать в
грунтовые воды, где они хорошо растворяются. CS 2 также может
добавить к развитию фотохимического смога, когда он реагирует с
другие органические вещества в атмосфере, такие как метан или
оксиды азота. [Аналитическая химия; v1753 -1755; 1997 г.]
[Экологическая наука и технология; v35; 2543-2547; 2001.]
Углерод Монооксид — CO, а
токсичный бесцветный газ без запаха, образующийся при сжигании ископаемого топлива или
сжигание биомассы. Соединение, состоящее из одного углерода и одного
кислород. За исключением углекислого газа, это один из самых длинных
жили природные атмосферные углеродные соединения (это
формулировка предназначена для исключения хлорфторуглеродов). Недавний
изменение содержания CO в тропосфере может предвещать изменение
баланс между окислителями и восстановителями в атмосфере.[Журнал геофизических исследований; v95; 16443-16450; 1990.]
[Scientific American; v261; 82-88; 1989.]
Недавний
изменение содержания CO в тропосфере может предвещать изменение
баланс между окислителями и восстановителями в атмосфере.[Журнал геофизических исследований; v95; 16443-16450; 1990.]
[Scientific American; v261; 82-88; 1989.]
Углерод Sequestration — Метод улавливания углерода
диоксид, чтобы он не выбрасывался в атмосферу; также
называется хранением углерода. Это предлагаемый ответ на
увеличение CO 2 в атмосфере — в основном от
антропогенные источники со времен промышленной революции. Может быть
химически достигается двумя очевидными способами: двуокись углерода может быть
захвачены после сжигания ископаемого топлива в
концентрированный поток выхлопных газов или, например, углекислый газ может
генерироваться при расходе топлива / предварительном сгорании в так называемых
синтез-газ (синтез-газ) процесс, который производит молекулярный водород
и CO из сырьевого газа, богатого метаном. Эта смесь реагирует с высоким
температура пара для производства H 2 и CO 2 который захвачен. H 2 сжигается для производства энергии.
Еще сложнее собрать CO 2 из
атмосфера при атмосферных концентрациях в тропосферном воздухе. Углерод
диоксид, образующийся при сгорании углеводородов, может находиться под давлением
и закачивается в старые соляные шахты или используется в обогащенной нефти
восстановление. [Журнал Американского химического общества; v131, 57775783;
2009; DOI: 10.1021 / ja8074105]
[Энергетика, экология; v4; 444-452; 2011; DOI: 10.1039 / C0EE00213E]
[Современные функциональные материалы; v19, 38213832; 2009; DOI: 10.1002 / adfm.200
Эта смесь реагирует с высоким
температура пара для производства H 2 и CO 2 который захвачен. H 2 сжигается для производства энергии.
Еще сложнее собрать CO 2 из
атмосфера при атмосферных концентрациях в тропосферном воздухе. Углерод
диоксид, образующийся при сгорании углеводородов, может находиться под давлением
и закачивается в старые соляные шахты или используется в обогащенной нефти
восстановление. [Журнал Американского химического общества; v131, 57775783;
2009; DOI: 10.1021 / ja8074105]
[Энергетика, экология; v4; 444-452; 2011; DOI: 10.1039 / C0EE00213E]
[Современные функциональные материалы; v19, 38213832; 2009; DOI: 10.1002 / adfm.200
1] [Журнал Американского химического общества; v133; 56645667: 2011; DOI: 10.1021 / ja111411q] [Международный журнал контроля парниковых газов; v2; 9-20; 2008; DOI: 10.1016 / S1750-5836 (07) 00094-1]
Carbon Storge — см. «Связывание углерода».
«Связывание углерода».
Углерод Налог — Денежный дивиденд, согласованный с платить за выброс углекислого газа из таких источников, как сжигание ископаемого топлива и биотоплива.Он действует как центральный механизм сокращения выбросов углерода в земных Атмосфера. Это можно противопоставить ограничению и торговле. [Экологическая экономика; v66; 379-91; 2008; DOI: 10.1016 / j.ecolecon.2007.09.021] [Наука; v315; 1670; 2007; DOI: 10.1126 / science.1138299] [Наука; 304; 1429; 2004; DOI: 10.1126 / science.304.5676.1429]
Углерод Тетрахлорид — CCl 4 ,
соединение, состоящее из углерода и 4 хлора, которое
активен в разрушении озонового слоя, когда соединение расщепляется и
высвобождает атомы хлора (радикалы).Хлор реагирует с
озон создает двухатомный кислород и монооксид хлора, которые
возвращается к радикалам хлора. [Экология и
Технологии; v28; 1243-1247; 1994.] [Журнал воздухоплавания и
Ассоциация управления отходами; v41; 1579–1584; 1991.]
[Экология и
Технологии; v28; 1243-1247; 1994.] [Журнал воздухоплавания и
Ассоциация управления отходами; v41; 1579–1584; 1991.]
Углерод Тетрафторид — CF 4 , известен как фреон 14, тетрафторид углерода является стабильным, негорючим, бесцветный газ.Он поглощает свет на 8 мм (в инфракрасном диапазоне), очень стабилен, не вступает в реакцию с водой. Это соединение теоретически считается вероятным кандидатом на утепление Земля во время следующего ледникового периода. [Письма по химической физике; 2; 663-664; 1968.] [Международный журнал или масс-спектрометрия и ионная физика. 4 7 ; 159-162; 1983.]
Каменноугольный Период — Время
период между 280-345 млн лет назад геологической истории Земли.Характеризуется наступлением и таянием ледников и массивным
миграция и исчезновение видов в этот период. [Геология; v18; 809-811; 1990.] [Геология; v17; 408-411; 1989.]
[Геология; v18; 809-811; 1990.] [Геология; v17; 408-411; 1989.]
Карбонил
Сульфид — COS, газ
это очень стабильно и инертно в тропосфере, но
считается, фотолизируется с образованием окиси углерода, CO и
сера, S, в стратосфере. Через стратосферную химическую
реакции атомы серы превращаются в SO 2 и H 2 SO 4 , которые образуют сульфатный аэрозоль и
облачные ядра конденсации, но в конечном итоге оседают в
тропосферы и реагируют с образованием серной кислоты, компонента
кислотный дождь.Извержения вулканов вносят часть этого COS в
атмосфера. Основными биосферными источниками COS являются:
считается биологическим. [Аналитическая химия; v 65; страницы
976-982; 1993.] [Атмосферные химические соединения: источники,
Возникновение и биотест; Graedel, Hawkins, Claxton; стр. 513;
1986; Академическая пресса; Орландо. ] [Наука; v300;
307-310; 2003.]
] [Наука; v300;
307-310; 2003.]
Каталитический Преобразователь — Воздух устройство контроля загрязнения с помощью выхлопной системы автомобилей.В преобразователь способствует полному сгоранию любого топлива, которого не было горят в двигателе и уменьшают присутствие других вредных концентрации выбросов. Конвертер меняет несгоревшие углеводороды и окись углерода в выхлопных газах в углерод диоксид и водяной пар. Преобразователь использует химический катализ чтобы создать это изменение. [Флейшер, Пол. Экология от А до Я Диллон Press, Нью-Йорк. 1994. стр. 38.] [Катализ сегодня; v98; 345-355; 2004 г.] [Химическая инженерия Наука; v59; 5597-5605; 2004.] [Энергия Конверсия и управление; v47; 2811-2828; 2006.] [Применено Катализ B: Окружающая среда; v70; 305-313; 2007.]
Каталитический Уничтожение озона — В стратосфере антропогенный хлор, в основном из хлорфторуглеродов выделяется в виде атомарного хлора (радикал) и вовлекается в химический цикл, который разрушает стратосферный озон:
CF 2 Класс 2 + hv
—> Cl + CF 2 Класс (в этой реакции образуются радикалы хлора, а другие
атом хлора в конечном итоге также освобождается для O 3 разрушение)
каталитический цикл:
Cl + O 3 —> ClO + O 2 (хлор реагирует с озоном с образованием окиси хлора)
O 3 + hv —> O + O 2 (озон также фотолизируется с образованием атомарного кислорода)
ClO + O —> Cl + O 2 (радикалы хлора реформируются)
———————
NET: 2O 3 -> 3O 2 (результат — превращение озона в молекулярный кислород
без столкновения озона и атомарного кислорода)
Атмосферные данные недавно показали, что систематический
запрет на антропогенные хлорсодержащие соединения, ХФУ
такие как фреон-11 и фреон-12, начиная с монреальского
Протокол 1986 г.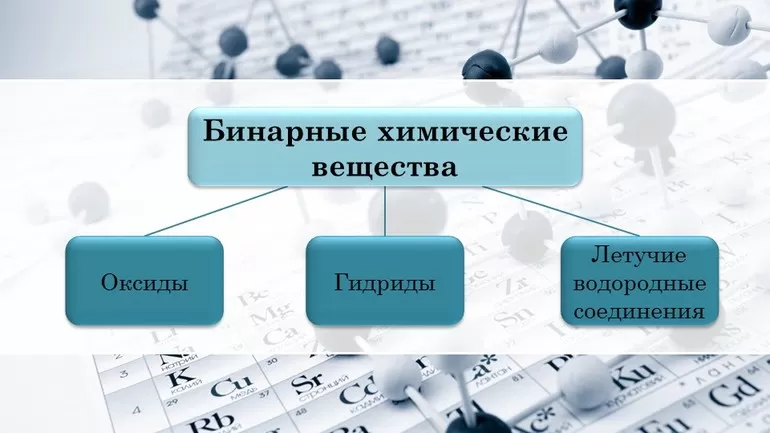 остановил деградацию стратосферных
озон, и исцеление этого важного компонента атмосферы
в процессе.И хотя по последним оценкам возврат к
стратосферные уровни до повреждения (<1979 г.), достигнутые
около 2050 г., использование дешевых систем кондиционирования (с использованием
запрещенные ХФУ или заменители ГХФУ, которые иным образом были поэтапно введены
out) в развивающихся странах, таких как Индия и Китай, может подтолкнуть
"излеченные" датируются десятилетиями. [Bradsher, K .; Нью-Йорк Таймс,
23 февраля 2007 г.] [Журнал физической химии; v100; 453-457;
1996; DOI: 10.1021 / jp952445t]
[Технология наук об окружающей среде; 20; 328-329; 1986; DOI: 10.1021 / es00146a601]
[Журнал геофизических исследований v111; D17309; 2006; DOI: 10.1029 / 2005JD006371]
остановил деградацию стратосферных
озон, и исцеление этого важного компонента атмосферы
в процессе.И хотя по последним оценкам возврат к
стратосферные уровни до повреждения (<1979 г.), достигнутые
около 2050 г., использование дешевых систем кондиционирования (с использованием
запрещенные ХФУ или заменители ГХФУ, которые иным образом были поэтапно введены
out) в развивающихся странах, таких как Индия и Китай, может подтолкнуть
"излеченные" датируются десятилетиями. [Bradsher, K .; Нью-Йорк Таймс,
23 февраля 2007 г.] [Журнал физической химии; v100; 453-457;
1996; DOI: 10.1021 / jp952445t]
[Технология наук об окружающей среде; 20; 328-329; 1986; DOI: 10.1021 / es00146a601]
[Журнал геофизических исследований v111; D17309; 2006; DOI: 10.1029 / 2005JD006371]
ХФУ — См. Хлорфторуглероды.
Chappuis Полоса поглощения озона — Длины волн
свет, поглощаемый озоном в видимой области, примерно
От 380 до 750 нм. Сравните с поглощением ультрафиолета озоном
регион, группа Хартли-Хаггинса. [Nature v261, 289; 1976.]
[Журнал химической физики; v108; 498; 1998: DOI: 10.1063 / 1.475413]
[Достижения в космических исследованиях; v34; 769-774; 2004; DOI: 10.1016 / j.asr.2003.08.058]
Сравните с поглощением ультрафиолета озоном
регион, группа Хартли-Хаггинса. [Nature v261, 289; 1976.]
[Журнал химической физики; v108; 498; 1998: DOI: 10.1063 / 1.475413]
[Достижения в космических исследованиях; v34; 769-774; 2004; DOI: 10.1016 / j.asr.2003.08.058]
Химическая промышленность Lifetime — Продолжительность жизни химического вещества
может выжить без реакции, фотолиза, диссоциации или
иначе превращаясь в другой химический вид. Высоко
у реактивных химикатов короткий срок службы. Например, если
скорость реакции целевого вида с атакующим видом составляет
очень быстро, тогда время жизни целевых видов будет
короткая.Например, реакция малых радикалов типа
гидроксильный радикал в тропосфере очень быстр со многими
общие тропосферные виды, и, следовательно, тропосферные
время жизни гидроксильного радикала измеряется секундами. [Экологическая наука и технология; v27; 1448-1452; 1993; DOI: 10.1021 / es00044a022]
[Природа; v 350; страницы 406-409; 1991; DOI: 10.1038 / 350406a0]
[Атмосферная среда; v34; 5271-5282; 2000; DOI: 10.1016 / S1352-2310 (00) 00345-9]
[Экологическая наука и технология; v27; 1448-1452; 1993; DOI: 10.1021 / es00044a022]
[Природа; v 350; страницы 406-409; 1991; DOI: 10.1038 / 350406a0]
[Атмосферная среда; v34; 5271-5282; 2000; DOI: 10.1016 / S1352-2310 (00) 00345-9]
Chloracne — Болезненное уродливое состояние, похожее на обыкновенные прыщи, вызванные воздействием высоких концентрации ПХБ (полихлорированные бифенилы).Это биологический ответ на воздействие различных видов хлорорганические соединения. [Инженерия загрязнения; v29n10; 7; 1997.] [Инженерия загрязнения; v28n9; 73; 1996 сентябрь] [Chemosphere; v60; 898-906; 2005.] [Токсикология; v229; 101-113; 2007.]
Хлор — Класс 2 ,
молекулярный хлор. В стратосфере атомный (радикальный)
хлор очень разрушителен, потому что он сильно истощает
необходим озоновый слой, защищающий землю от ультрафиолета
излучение солнца. В стратосфере Антарктики,
молекулярный хлор вместе с азотной кислотой образуются
реакция хлористого водорода и нитрата хлора — оба
стратосферные резервуары хлора. Этот процесс происходит
на полярных стратосферных облаках, которые служат реакцией
места. После образования Cl 2 испаряется в
окружающий воздух в виде азотной кислоты — также образуется в
процесс — связывается с ледяной матрицей. Cl 2 тогда
фотодиссоциирует на солнечном свете (лямбда <= 450 нм) на
радикалы хлора.Эти радикалы хлора затем каталитические
разрушить озон. [Graedel, T. E. и Crutzen, Paul J.
Атмосферные изменения, перспектива системы Земля. стр. 145-6. W.
Х. Фриман и компания, 1993.] [Наука; v292; 61-63;
2001.]
В стратосфере Антарктики,
молекулярный хлор вместе с азотной кислотой образуются
реакция хлористого водорода и нитрата хлора — оба
стратосферные резервуары хлора. Этот процесс происходит
на полярных стратосферных облаках, которые служат реакцией
места. После образования Cl 2 испаряется в
окружающий воздух в виде азотной кислоты — также образуется в
процесс — связывается с ледяной матрицей. Cl 2 тогда
фотодиссоциирует на солнечном свете (лямбда <= 450 нм) на
радикалы хлора.Эти радикалы хлора затем каталитические
разрушить озон. [Graedel, T. E. и Crutzen, Paul J.
Атмосферные изменения, перспектива системы Земля. стр. 145-6. W.
Х. Фриман и компания, 1993.] [Наука; v292; 61-63;
2001.]
Хлор Атомы — Cl,
семнадцатый элемент периодической таблицы элементов. Она имеет
атомный вес 35,453 грамма на моль.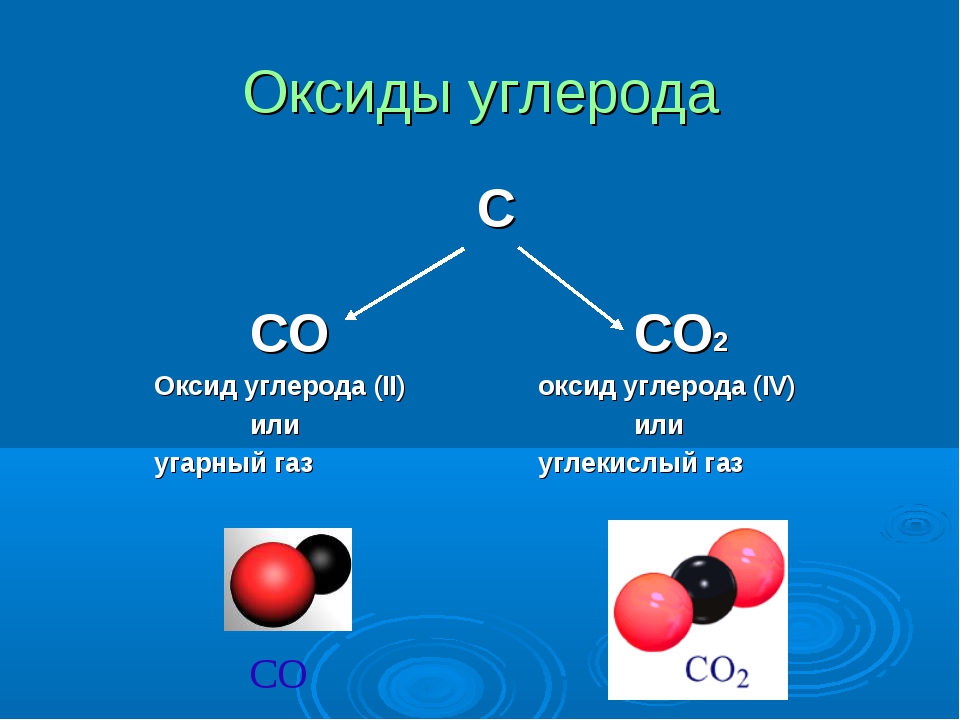 Имеет 17 протонов в
его ядро и 7 электронов во внешней оболочке, нечетное число
что делает этот нейтральный атом радикалом и очень эффективным
катализатор в реакции, которая разрушает озон в
стратосфера над Антарктидой (см. окись хлора).[Наука; v 264; страницы 32-33; 1994.] [Наука; v 262; страницы
1703–1706; 1993.]
Имеет 17 протонов в
его ядро и 7 электронов во внешней оболочке, нечетное число
что делает этот нейтральный атом радикалом и очень эффективным
катализатор в реакции, которая разрушает озон в
стратосфера над Антарктидой (см. окись хлора).[Наука; v 264; страницы 32-33; 1994.] [Наука; v 262; страницы
1703–1706; 1993.]
Хлор Диоксид — ClO 2 ,
радикал, подвергается фоторазложению в стратосфере
где продукты этой реакции реагируют с озоном. С
это фотохимическая реакция, она происходит только пока
солнце встало. Эксперименты над Антарктидой показали прямое
связь между потерей полярного озона и увеличением
химия галоидоуглерода, происходящая из антропогенных источников.Ученые в настоящее время изучают молекулярное поведение
диоксида хлора в атмосфере, чтобы понять его
роль в истощении озона более тщательно. [Саймон, Дж. Д. и
Вайда, В. Фотореактивность диоксида хлора. Наука v
268; п. 1443-1448; 1995.]
Д. и
Вайда, В. Фотореактивность диоксида хлора. Наука v
268; п. 1443-1448; 1995.]
Хлор Монооксид — ClO, а радикальные частицы (с нечетным числом электронов во внешнем оболочка), которая играет важную роль в разрушении стратосферный озон над Антарктидой.Образуется фотолизом ХФУ в стратосфере и последующее разрушение молекулы озона, эти радикалы могут действовать как катализатор в разрушение озона при этом не разрушаются сами. ClO, реагируя с атомом кислорода (присутствует от Chapman Mechanism), снова высвобождает свободный радикал хлора. Как В результате один атом Cl может разрушить тысячи молекул озона. перед секвестрированием в виде HCl или других резервуарных частиц (см. нитрат хлора).[Журнал Земного острова; v 7; стр. 18; 1992.] [Хроника высшего образования; v 38; страницы A6-A7; 1992.]
Хлор Нитрат — ClONO 2 ,
это стратосферный резервуар для хлора и
азот, два катализатора стратосферного разрушения
озона. Честно говоря, это название сбивает с толку; это
образуется в результате реакции оксида хлора и азота
диоксид (не атомы хлора с нитратом).Он реагирует с HCl при низких температурах
на поверхности полярных стратосферных облаков (ЦОП над
Антарктида и, вероятно, также в стратосфере над
Арктический). Эта обычно медленная реакция гетерогенно производит
молекулярный хлор и азотная кислота. Бывшие выбросы из
поверхность PSC и быстро фотолизируется на 450 нм или короче
длина волны света с образованием радикалов хлора, которые быстро
катализируют распад озона (см. окись хлора).[Наука; v 238; страницы 1258-1260; 1987.] [Наука; v 258;
страницы 1342-1345; 1992.]
Честно говоря, это название сбивает с толку; это
образуется в результате реакции оксида хлора и азота
диоксид (не атомы хлора с нитратом).Он реагирует с HCl при низких температурах
на поверхности полярных стратосферных облаков (ЦОП над
Антарктида и, вероятно, также в стратосфере над
Арктический). Эта обычно медленная реакция гетерогенно производит
молекулярный хлор и азотная кислота. Бывшие выбросы из
поверхность PSC и быстро фотолизируется на 450 нм или короче
длина волны света с образованием радикалов хлора, которые быстро
катализируют распад озона (см. окись хлора).[Наука; v 238; страницы 1258-1260; 1987.] [Наука; v 258;
страницы 1342-1345; 1992.]
Хлорбензол — C 6 H 5 Cl, бесцветный
жидкость, предназначенная для использования в качестве растворителя. Это быстро
испаряется на воздухе и разлагается гидроксильными радикалами
которые производятся фотохимическим способом. Газ действует как источник
ClO, который помогает в разложении стратосферного озона.
[Наука; v224; 308-321; 1954 г.] [Analytica Chimica Acta; v584;
189–195; 2007.]
Газ действует как источник
ClO, который помогает в разложении стратосферного озона.
[Наука; v224; 308-321; 1954 г.] [Analytica Chimica Acta; v584;
189–195; 2007.]
Хлордифторметан (ГХФУ-22) : CHClF 2 ,
этот химикат является промежуточной заменой старых CFC
потому что он содержит атом водорода, что делает молекулу, которая
легко подвергается воздействию гидроксильных радикалов в атмосфере,
следовательно, он имеет более короткое время жизни в атмосфере
по сравнению с заменяемыми им CFC. В США ГХФУ-22 использование уже прекращается, но прекращается в
развивающиеся страны, такие как Индия, спотыкаются, и это может привести
к более медленному восстановлению озона стратосферного озонового слоя.[Обзоры геофизики; v13; 1-35; 1975; DOI: 10.1029 / RG013i001p00001]
[Д. ДеМарто и А. Бейерлин. Новая химическая альтернатива для
Защита стратосферного озона. ] [EPA / 600 / SR-95/113,
p1-4.] [Bradsher, K .; New York Times, 23 февраля 2007 г.]
] [EPA / 600 / SR-95/113,
p1-4.] [Bradsher, K .; New York Times, 23 февраля 2007 г.]
Хлорэтан — этот искусственный ЛОС очень реактивен в Атмосфера. Это газ при комнатной температуре, и когда его выпускают, легко реагирует с окислителями, быстрее всего с гидроксильный радикал, период полураспада ~ 40 суток.Последующие продукты удаляются с помощью седиментации, осадков или дождя. Хлорэтан использовался в производстве и производстве инсектицидов, красителей и лекарств; как растворитель; и как неорганизованные выбросы со свалок. [Химия и материалы Наука, v333; 700-701; 1989.]
Хлорфторуглероды-ХФУ — Очень стабильное химическое соединение, используемое в
хладагенты, растворители и (в прошлом в U.С.) Аэрозоли, которые
высвободить хлор (важно) и фтор (менее важно)
в верхние слои атмосферы. В стратосфере ХФУ
фотолизируется (поступающим солнечным УФ) с образованием диоксида углерода, CO 2 ,
фтороводород, HF и в конечном итоге (после многократного УФ
события поглощения) радикалов хлора. Эти разновидности хлора
имеют решающее значение в разрушении озонового слоя над
Антарктида и, возможно, еще где-нибудь (см. Хлор).[Экологическая наука и технология; v 28; страницы 1619-1622;
1994.]
Эти разновидности хлора
имеют решающее значение в разрушении озонового слоя над
Антарктида и, возможно, еще где-нибудь (см. Хлор).[Экологическая наука и технология; v 28; страницы 1619-1622;
1994.]
Хлороформ — CHCl 3 , бесцветная жидкость, легко испаряющаяся в воздухе. Соединение выбрасывается в воздух прямым и косвенные источники и разрывы в нижних слоях атмосферы в диоксид углерода, фосген (дихлорид углерода) и хлористый водород. Деградация происходит в тропосфере. по реакции соединения с гидроксильными радикалами.[Spectrochimica Acta Часть A: Молекулярные и биомолекулярные Спектроскопия; v106; 231-235; 2013; DOI: 10.1016 / j.saa.2012.12.073]
Хлорметан — Бесцветный газ со сладким запахом. Когда-то он использовался как
хладагент в потребительских товарах, но больше не используется, потому что
о его токсичности. Это раздражитель центральной нервной системы, а в
высокие дозы могут вызвать паралич, судороги и кому.
Хлорметан был впервые синтезирован Пелиго в 1835 году.Его
химическая формула CH 3 Cl, и он имеет точку плавления
-97C, точка кипения -24C, и естественно производится
солнечный свет реагирует с биомассой и хлором в океанах. Это
использовался в промышленности как хладагент. Хлорметан также был
раньше производили бензин на основе свинца, но сегодня он в основном используется как
химический промежуточный продукт в производстве силикона. [Относящийся к окружающей среде
Наука и технология; v26; 815-16; 1992.] [Журнал
Химические и технические данные; v36; 485-87; 1991 г.]
Это раздражитель центральной нервной системы, а в
высокие дозы могут вызвать паралич, судороги и кому.
Хлорметан был впервые синтезирован Пелиго в 1835 году.Его
химическая формула CH 3 Cl, и он имеет точку плавления
-97C, точка кипения -24C, и естественно производится
солнечный свет реагирует с биомассой и хлором в океанах. Это
использовался в промышленности как хладагент. Хлорметан также был
раньше производили бензин на основе свинца, но сегодня он в основном используется как
химический промежуточный продукт в производстве силикона. [Относящийся к окружающей среде
Наука и технология; v26; 815-16; 1992.] [Журнал
Химические и технические данные; v36; 485-87; 1991 г.]
Cirrus Clouds — Высокие облака
которые полностью сформированы из кристаллов льда. Они появились
тонкий и тонкий и может достигать высоты 35000 футов
(10700 метров). К другим типам перистых облаков относятся:
cirrostratus и перисто-кучевые. Cirrostratus — это тонкий лист
облако, которое часто вызывает появление ореола вокруг солнца или
Луна. Перисто-кучевые облака похожи на множество маленьких пучков хлопка;
однако эти облака образуются редко.[Журнал прикладных
Метеорология. v 31, page 370, 1991.] [Журнал
Науки об атмосфере. v 46, page 2293, 1989.]
К другим типам перистых облаков относятся:
cirrostratus и перисто-кучевые. Cirrostratus — это тонкий лист
облако, которое часто вызывает появление ореола вокруг солнца или
Луна. Перисто-кучевые облака похожи на множество маленьких пучков хлопка;
однако эти облака образуются редко.[Журнал прикладных
Метеорология. v 31, page 370, 1991.] [Журнал
Науки об атмосфере. v 46, page 2293, 1989.]
Клатраты — Также называемые газовыми гидратами, образованные или с молекулами, которые переплетены в решетчатую геометрический узор. [Журнал феноменов включения и молекулярная рек. v 10, page 399, 1991.] [Химический журнал Физика. v 101, 7672, 1994.]
Чистый Закон об воздухе — Чистота
Закон о воздухе был принят в 1970 году, а затем, в ноябре 1990 года, был преобразован в
закон установил общенациональные уровни допустимого загрязнения воздуха
от автомобилей, частных лиц и промышленности. Экологический
Агентство по защите отвечает за соблюдение стандартов
и положения Закона о чистом воздухе. [Продажа, штат Нью-Джерси; Промышленное
Контроль загрязнения: проблемы и методы 2 nd Версия. 1994 Джон Вили: Нью-Йорк]
Экологический
Агентство по защите отвечает за соблюдение стандартов
и положения Закона о чистом воздухе. [Продажа, штат Нью-Джерси; Промышленное
Контроль загрязнения: проблемы и методы 2 nd Версия. 1994 Джон Вили: Нью-Йорк]
Климат — Определяется ежедневным взаимодействием погоды на протяжении многих лет. Характеристики, используемые при определении климата температура, осадки, влажность, солнечный свет и облачность, ветер и давление воздуха.Климатологи описывают климат с точки зрения средней температуры и осадков суммы. [Журнал климата. v 1, 775, 1988.] [Журнал Климат. v 1, 789, 1988.]
Облако — Конденсированный водяной пар, плавающий в воздухе. Они
может принимать разные формы из-за ветров и
содержание влаги. Они играют важную роль в мире
погоды из-за воды, которую они приносят, и из-за их
радиационные свойства по отношению к глобальному потеплению. [Химические и
Физическая метеорология. v 41, 2, 1989.] [Астрофизический
Журнал. v 333, 617, 1988.]
[Химические и
Физическая метеорология. v 41, 2, 1989.] [Астрофизический
Журнал. v 333, 617, 1988.]
Облако Конденсационные ядра (CCN) — Конденсированный водяной пар, который настолько мал, что это можно увидеть только в микроскоп. CCN на самом деле центр капли. Многие из этих ядер представляют собой крошечные соли частицы, сульфатный или нитратный аэрозоль или мелкие частицы присутствует в дыму. См. Диметилсульфид.Большинство капель измеряют от 1 / 2,500 до 1/250 дюйма (0,01 — 0,1 мм) дюйма диаметр. [Журнал прикладной метеорологии. v 32, 666, 1993.] [Журнал аэрозольной науки. в 23 супп. стр. S865, 1992.]
грубый Mode Particles — это частицы, примерно
определяется как имеющий более двух микрометров в диаметре.
Они образуются из морских брызг, вулканов, дробления или измельчения
камни, переносимая ветром почва, и составляют около 95% аэрозолей
частицы в окружающем воздухе. [Журнал геофизических исследований;
v113; D05212; DOI: 10.1029 / 2007JD009052]
[Журнал геофизических исследований;
v113; D05212; DOI: 10.1029 / 2007JD009052]
Озон в колонке — Общее количество озона, которое содержится в столб воздуха. Большая часть этого количества O 3 составляет обычно встречается в стратосфере. [Журнал геофизических Research, v 95, 13883, 1990.] [Journal of Geophysical Research, v94, 13883, 1989.]
.Конденсация — (Газообразный) водяной пар, который начинает изменяться к крошечным каплям воды (жидкое состояние) или кристаллам льда, когда воздух становится достаточно холодным.Этот процесс начинается у росы точка. Высвобождается энергия, необходимая для испарения воды, около 585 кал / г воды при 20 градусах Цельсия. [Физический Review, v 38, 5303, 1988.] [Океанография; Турман, Гарольд; 513; 1994; Макмиллан, Нью-Йорк]
Континенталь Drift — применяемый термин
к ранним теориям, подтверждающим возможность того, что
континенты движутся по поверхности Земли. [Научный
Американец.v 266, 84, 1992.] [Scientific American. v 264, 66,
1991.]
[Научный
Американец.v 266, 84, 1992.] [Scientific American. v 264, 66,
1991.]
Конвекция — Процесс, при котором в нагреваемой жидкости более теплая часть массы поднимется, а более холодные части раковина. Это также часть теории континентального дрейф, в котором циркулирующие движения материалов земной коры раздвигать континенты. [Журнал атмосферных Наук. v 46, 1540, 1989.] [Журнал атмосферы Наук.v 45, 2641, 1988.]
Кориолис Force — вымышленный источник, связанный с вращением Земли. Это приводит к отклонение всех объектов не на экваторе вправо в направление движения в северном полушарии и к уехал в южном полушарии. [Крутцен, Пол и Градел, T.E. Атмосферные изменения: перспектива системы Земля. W.H Фридман и компания, Нью-Йорк. 1993 г.стр.57.]
Криосфера — Часть Земли, состоящая из
ледяные массы и снежные отложения, которые включают континентальный лед
покровы, горные ледники, морской лед, поверхностный снежный покров и
озерный / речной лед. Изменения снежного покрова
из-за сезонных колебаний и взаимосвязаны с
атмосферная циркуляция. Уровень моря и гидрологический цикл
изменения могут повлиять на объем воды, связанной в
ледники и ледяные щиты.[Канадский географ; v36; 336-350;
1992.] [Канадский географ; v37; 86-87; 1993.]
Изменения снежного покрова
из-за сезонных колебаний и взаимосвязаны с
атмосферная циркуляция. Уровень моря и гидрологический цикл
изменения могут повлиять на объем воды, связанной в
ледники и ледяные щиты.[Канадский географ; v36; 336-350;
1992.] [Канадский географ; v37; 86-87; 1993.]
Кристаллизация — Физический или химический процесс или действие, которые приводит к формированию правильной формы, размеров и твердые формы с узором, известные как кристаллы. [Journal of Chemical Образование; v71; 694-696; 1994.] [Наука; v261; 1418-1423; 1993.]
Кучевые облака
Облака — Облака
образующиеся в тропосфере, которые вертикально образуются с
плоские основания и пушистые закругленные верхушки.Они часто были
описывается как цветная капуста по структуре. Они происходят в
высоты 500-6000 метров над землей и
чаще всего встречаются разрозненно или плотно с горкой. Они есть
формируется из-за всплывающей восходящей конвекции во время тепла,
антициклоническая летняя погода. [Природа; v363; p584-585; 1993.]
[Журнал атмосферных наук; v50; 3894-3908; 1993.]
[Журнал прикладной метеорологии; v32; 626-641; 1993.]
Они есть
формируется из-за всплывающей восходящей конвекции во время тепла,
антициклоническая летняя погода. [Природа; v363; p584-585; 1993.]
[Журнал атмосферных наук; v50; 3894-3908; 1993.]
[Журнал прикладной метеорологии; v32; 626-641; 1993.]
Цикл — В атмосфере или биосфере последовательность события в повторяющемся движении, в котором конечный результат подает обратно в исходный ввод.Примеры этого включают биогеохимические циклы, включая азот, углерод и циклы серы, в которых эти виды химически обрабатываются в газовой, твердой и растворной фазах физическими и биологическими процессы, которые изменяют свою форму, степень окисления и физическое состояние. [Жизнь в окружающей среде; Миллер, Тайлер; pg 244; 1994; Уодворт; Бельмонт.] [Химия Атмосфера и океаны; Голландия, Генрих; стр. 1-14; 1978;
Загрязнители воздуха — Земляные работы
Как участки нефтяных и газовых скважин, так и инфраструктура переработки и транспортировки выбрасывают в атмосферу загрязняющие вещества от различного оборудования и деятельности. Чтобы узнать о различных источниках этих конкретных загрязнителей, посетите страницу «Загрязнение нефтью и газом».
Чтобы узнать о различных источниках этих конкретных загрязнителей, посетите страницу «Загрязнение нефтью и газом».
Многие газы и химические вещества, связанные с разработкой нефти и природного газа, могут обнаруживаться в выбросах. Например, при отборе проб воздуха Earthworks возле предприятий по сжатию и переработке в Пенсильвании было обнаружено более 70 различных химических веществ.
На этой странице представлено общее описание наиболее распространенных загрязнителей воздуха, связанных с добычей нефти и газа. К ним относятся:
Метан (Ch5) является основным компонентом природного газа и тесно связан с изменением климата.(Природный газ обычно также содержит ценные углеводороды, такие как этан, пропан, бутан и пентаны, которые выделяются в процессе обработки.) За 20-летний период метан в 86 раз сильнее парникового газа, чем углекислый газ. При первом запуске природный газ не имеет запаха; химический метилмеркаптан добавляется позже для ароматизации газа, чтобы можно было обнаружить утечки.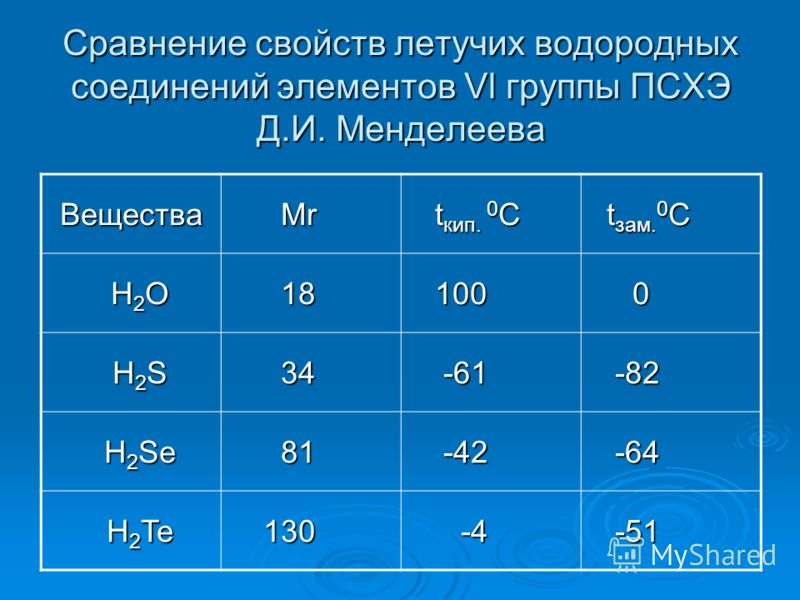
Двуокись углерода (CO2) — это основной парниковый газ, влияющий на изменение климата, а также самый стойкий в атмосфере.CO2 выделяется при сжигании ископаемого топлива, включая сжигание, производство, переработку и любую деятельность, связанную с транспортными средствами и двигателями. CO2 снижает приток кислорода для дыхания, а также может вызывать гипертонию, головные боли, головокружение, повреждение нервов, а также раздражение кожи и глаз.
Летучие органические соединения (ЛОС) — это класс многих углеродсодержащих веществ, которые легко превращаются в газы или пары и переносятся в воздух (улетучиваются). ЛОС могут объединяться с оксидами азота и солнечным светом с образованием озона на уровне земли, который может вызывать респираторные заболевания, такие как астма и снижение функции легких.
Основными ЛОС, связанными с разработкой нефти и природного газа, являются бензол, толуол, этилбензол и ксилол. Эти соединения, известные как химические вещества BTEX, связаны с воздействием на центральную нервную систему, неврологическими и репродуктивными заболеваниями. Бензол также известен как канцероген, а этилбензол и ксилол могут вызывать респираторные заболевания.
Эти соединения, известные как химические вещества BTEX, связаны с воздействием на центральную нервную систему, неврологическими и репродуктивными заболеваниями. Бензол также известен как канцероген, а этилбензол и ксилол могут вызывать респираторные заболевания.
Формальдегид — еще один ЛОС, вызывающий растущее беспокойство в нефтегазовой сфере. Формальдегид, который в первую очередь рассматривается как побочный продукт строительства и бытовой техники, также является результатом промышленных процессов сжигания.Это известный канцероген, связанный с респираторными заболеваниями и повреждением легких.
Сероводород (h3S) естественным образом встречается в некоторых нефтегазовых пластах, особенно на западе США. H 2 S может выделяться при выпуске газа, при неполном сгорании сжигаемого газа или в результате утечек из оборудования. Его часто отделяют при переработке газа.
H 2 S токсичный газ с характерным запахом тухлого яйца. При низких концентрациях он может вызвать проблемы с глазами, кожей и дыхательными путями, а в высоких концентрациях — смертельный исход. Федеральное предупреждение об опасности предупреждает работников нефтегазовой отрасли о вдыхании паров H 2 S на производственных площадках.
При низких концентрациях он может вызвать проблемы с глазами, кожей и дыхательными путями, а в высоких концентрациях — смертельный исход. Федеральное предупреждение об опасности предупреждает работников нефтегазовой отрасли о вдыхании паров H 2 S на производственных площадках.
Пять критериев загрязнителей , связанных с нефтью и газом, которые регулируются Агентством по охране окружающей среды США в соответствии с Законом о чистом воздухе, включают:
- Озон (O3) образуется, когда летучие органические соединения и оксиды азота соединяются с солнечным светом.Находящийся на земле озон также называется смогом, который может вызывать или усугублять респираторные заболевания, такие как астма и эмфизема.
Анализ воздействия на здоровье показал, что на национальном уровне озон, создаваемый нефтегазовой промышленностью, вызывает 750 000 приступов астмы в летнее время у детей и 2600 обращений в отделения неотложной помощи при астме и респираторных заболеваниях.
- Твердые частицы (PM) состоят из мелких частиц, которые взвешены в воздухе и медленно оседают на землю.Твердые частицы измеряются как PM10, которые представляют собой мелкие частицы диаметром десять микрометров или меньше, или как PM2,5 для еще более мелких мелких частиц. Наиболее распространенными источниками ТЧ от нефтегазовых операций являются пыль или почва, попадающие в воздух во время строительства площадки или объекта, движение транспорта и выхлопные газы дизельных двигателей транспортных средств и оборудования. ТЧ также могут выделяться во время операций по откачке воздуха и сжиганию на факеле.
В зависимости от размера частиц и их химического состава, вдыхание PM может вызвать респираторные и сердечно-сосудистые заболевания, а также преждевременную смерть.Подвешенные в воздухе ТЧ ухудшают видимость и общее качество воздуха.
- Окись углерода (CO) — это бесцветный горючий газ без запаха, образующийся в результате неполного сгорания топлива на основе углерода (т.
 е. нефти, природного газа, угля и древесины). CO в основном выделяется нефтегазовой промышленностью при сжигании на факелах и при эксплуатации машин и оборудования. Воздействие угарного газа на здоровье включает подавление способности крови переносить кислород, а также головные боли, головокружение и тошноту.В некоторых случаях вдыхание может привести к потере сознания и смерти.
е. нефти, природного газа, угля и древесины). CO в основном выделяется нефтегазовой промышленностью при сжигании на факелах и при эксплуатации машин и оборудования. Воздействие угарного газа на здоровье включает подавление способности крови переносить кислород, а также головные боли, головокружение и тошноту.В некоторых случаях вдыхание может привести к потере сознания и смерти. - Оксиды азота (NOx) — это группа газов, образующихся при сгорании ископаемого топлива, которая вызывает химическую реакцию между азотом (естественным образом протекающим в атмосфере) и кислородом. При добыче нефти и газа NOx образуются во время операций сжигания на факеле и при сжигании топлива для обеспечения энергией такого оборудования, как двигатели компрессоров и другое тяжелое оборудование. NOx соединяется с ЛОС в присутствии солнечного света с образованием приземного озона.Воздействие NOx на здоровье включает раздражение глаз, носа и горла, проблемы с дыханием, сердечные заболевания и повреждение легких.

- Диоксид серы (SO2) — бесцветный газ с очень сильным запахом. Он образуется в результате сжигания ископаемого топлива, содержащего серу (включая нефть, природный газ и уголь). SO2 может выделяться во время сжигания природного газа на факелах или при сжигании ископаемого топлива для обеспечения энергией насосных или компрессорных двигателей или другого оборудования и транспортных средств на нефтегазовых объектах.Заводы по переработке кислого газа также выделяют диоксид серы. Наряду с NOx, SO2 является основным источником кислотных дождей.
Воздействие SO2 на здоровье включает раздражение глаз, носа и горла, респираторные проблемы, тошноту, головные боли и головокружение. SO2 также вступает в реакцию с другими химическими веществами с образованием твердых частиц, которые могут повредить легкие и вызвать респираторные и сердечно-сосудистые проблемы и преждевременную смерть.
Для получения дополнительной информации
.


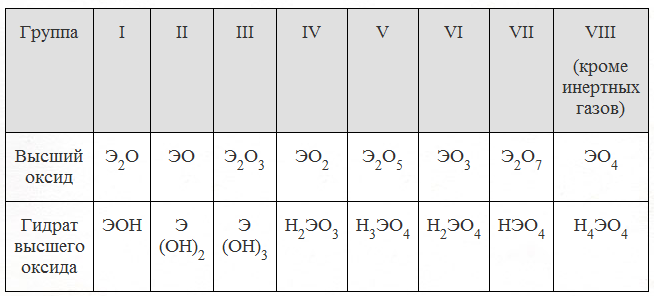 Если ни один из них не доступен, используйте только тиосульфат натрия.
Если ни один из них не доступен, используйте только тиосульфат натрия.
 е. нефти, природного газа, угля и древесины). CO в основном выделяется нефтегазовой промышленностью при сжигании на факелах и при эксплуатации машин и оборудования. Воздействие угарного газа на здоровье включает подавление способности крови переносить кислород, а также головные боли, головокружение и тошноту.В некоторых случаях вдыхание может привести к потере сознания и смерти.
е. нефти, природного газа, угля и древесины). CO в основном выделяется нефтегазовой промышленностью при сжигании на факелах и при эксплуатации машин и оборудования. Воздействие угарного газа на здоровье включает подавление способности крови переносить кислород, а также головные боли, головокружение и тошноту.В некоторых случаях вдыхание может привести к потере сознания и смерти.
Leave A Comment