Реакции ионного обмена
Дидактический материал
РЕПЕТИЦИОННЫЙ ЕГЭ ПО ХИМИИ—ДИСТАНЦИОННО, БЕСПЛАТНО
Реакции ионного обмена.
1. Газ выделяется при взаимодействии растворов
1) сульфата калия и азотной кислоты
2) хлороводородной кислоты и гидроксида калия
3) серной кислоты и сульфита калия
4) карбоната натрия и гидроксида бария
2. Нерастворимая соль образуется при взаимодействии
1) КОН (р-р) и Н3РО4(р-р)
2) HNО3 (р-р) и СuО
3) НС1 (р-р) и Mg(NO3)2 (р-р)
4) Са(ОН)2 (р-р) и СО2
3. Одновременно не могут находиться в растворе группы:
1) К+, Н+, NO3—, SO42-
2) Ва2+, Ag+, ОН-, F—
3) Н3O+, Са2+ Сl—, NO3—
4) Mg2+, Н
4. Какое молекулярное уравнение соответствует сокращенному ионному уравнению H+ + ОН— = H2O?
Какое молекулярное уравнение соответствует сокращенному ионному уравнению H+ + ОН— = H2O?
1) ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
2) H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
3) NaOH + HNO3 = NaNO3 + H2O
4) H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
5. Газ выделяется при взаимодействии растворов
1) сульфата калия и азотной кислоты
2) хлороводородной кислоты и гидроксида бария
3) азотной кислоты и сульфида натрия
4) карбоната натрия и гидроксида бария
6. Одновременно не могут находиться в растворе все ионы ряда
1) Fe3+, К+, Сl—, S042-
2) Fe3+, Na+, NO3—, SO42-
3) Са2+, Li+, NO3—, Сl—
4) Ba2+, Cu2+, OH—, F—
7. Соль и щелочь образуются при взаимодействии растворов
Соль и щелочь образуются при взаимодействии растворов
1) А1С13 и NaOH
2) К2СОз и Ва(ОН)2
3) Н
4) MgBr2 и Na3PO4
8.Нерастворимая соль образуется при сливании водных растворов
1) гидроксида калия и хлорида алюминия
2) сульфата меди(II) и сульфида калия
3) серной кислоты и гидроксида лития
4) карбоната натрия и хлороводородной кислоты
9. Осадок выпадет при взаимодействии растворов
1) Н3РO4 и КОН
2) Na2SO3 и H2SO4
3) FeCl3 и Ва(ОН)2
4) Cu(NO3)2 и MgSO4
10.Сокращенное ионное уравнение Fe
соответствует взаимодействию веществ:
1) Fe(NO3)3 и КОН
2) FeSO4 и LiOH
3) Na2S и Fe(NO)3
4) Ва(ОН)2 и FeCl3
11. При добавлении раствора гидроксида натрия к раствору неизвестной соли образовался, а затем исчез бесцветный студенистый осадок. Формула неизвестной соли
При добавлении раствора гидроксида натрия к раствору неизвестной соли образовался, а затем исчез бесцветный студенистый осадок. Формула неизвестной соли
1) А1С13 2) FeCl3 3) CuSO4 4) KNO3
12.Краткое ионное уравнение
Cu
I) Сu(ОН)2 и H2S
2) CuCl2 и Na2S
3) Cu3(P04)2 и Na2S
4) CuCl2 и H2S
13. Продуктами необратимо протекающей реакции ионного не могут быть
1) сернистый газ, вода и сульфат натрия
2) карбонат кальция и хлорид натрия
3) вода и нитрат бария
4) нитрат натрия и карбонат калия
14. При добавлении раствора гидроксида натрия к раствору неизвестной соли образовался бурый осадок. Формула неизвестной соли
1) ВаС12 2) FeCl3 3) CuSO4 4) KNO3
15. Краткое ионное уравнение
Краткое ионное уравнение
H+ + ОН— = Н2O соответствует реакции между
1) HI и КОН
2) H2S и NaOH
3) H2SiO3 и КОН
4) НС1 и Сu(ОН)2
16.Хлорид натрия может быть получен в реакции ионного обмена в растворе между
1) гидроксидом натрия и хлоридом калия
2) сульфатом натрия и хлоридом бария
3) нитратом натрия и хлоридом серебра
4) хлоридом меди(II) и нитратом натрия
17. Продуктами необратимо протекающей реакции ионного обмена не могут быть
1) вода и фосфат натрия
2) фосфат натрия и сульфат калия
3) сероводород и хлорид железа(II)
4) хлорид серебра и нитрат натрия
18. При добавлении раствора гидроксида натрия к раствору неизвестной соли образовался синий осадок. Формула неизвестной соли
1) ВаСl2 2) FeSO4 3) CuSO4 4) AgNO3
19. Краткое ионное уравнение реакции между Сu(ОН)2 и соляной кислотой
Краткое ионное уравнение реакции между Сu(ОН)2 и соляной кислотой
1) Н+ + ОН— = Н2O
2) Сu(ОН)2 +2Сl—= CuCl2 + 2OН
3) Cu2+ + 2НС1 = CuCl2 + 2Н+
4) Cu(OH)2 + 2Н+ = Сu2+ + 2Н2O
20. Практически необратимо протекает реакция межлу
1) K2SO4 и HC1
2) NaCl и CuSO4
3) Na2SO4 и КОН
4) BaCl2 и CuSO4
21. Сокращенное ионное уравнение
2H+ + CO32-=CO2 +H2O соответствует взаимодействию
1) азотной кислоты с карбонатом кальция
2) сероводородной кислоты с карбонатом калия
3) соляной кислоты с карбонатом калия
4) гидроксида кальция с оксидом углерода (IV)
22. С выпадением осадка протекает реакция между раствором гидроксида натрия и
1) CrCl2 2) Zn(OH)2 3) H2SO4 4) P2O5
23. С выделением газа протекает реакция между азотной кислотой и
С выделением газа протекает реакция между азотной кислотой и
1) Ва(ОН)2 2) Na2SO4 3) CaCO3 4) MgO
24. Сокращенному ионному уравнению
СО32– + 2Н+ = СО2 + Н2О
соответствует взаимодействие
|
1) |
Na2CO3 и H2SiO3 |
|
2) |
Na2CO3 и HCl |
|
3) |
CaCO3 и HCl |
|
4) |
CaCO3 и H2SO4 |
25. Сокращённое ионное уравнение реакции
Сокращённое ионное уравнение реакции
NH4+ + OH = NH3 + H2O
соответствует взаимодействию
|
1) |
NH4Cl и Ca(OH)2 |
|
3) |
NH3 |
|
2) |
NH4Cl и Fe(OH)2 |
|
4) |
NH4Cl и AgNO3 |
26. Сокращенное ионное уравнение реакции
Al3+ + 3OH– = Al(OH)3¯
соответствует взаимодействию
|
1) |
|
|
2) |
алюминия с водой |
|
3) |
хлорида алюминия со щелочью |
|
4) |
алюминия со щелочью |
27. Одновременно присутствовать в водном растворе могут ионы
Одновременно присутствовать в водном растворе могут ионы
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
28. Сокращенное ионное уравнение реакции
Cu2+ + 2OH– = Cu(OH)2 ¯
соответствует взаимодействию между
|
1) |
Cu(NO3)2 (р-р) и Fe(OH)3 |
|
2) |
СuO и NaOH (р-р) |
|
3) |
CuCl2(р-р) и Ca(OH)2 (р-р) |
|
4) |
CuO и H2O |
29. Сумма коэффициентов в сокращенном ионном уравнении взаимодействия 1 моль гидроксида цинка с 2 моль соляной кислоты равна
Сумма коэффициентов в сокращенном ионном уравнении взаимодействия 1 моль гидроксида цинка с 2 моль соляной кислоты равна
1) 7 2) 5 3) 6 4) 4
30. Краткое ионное уравнение
Zn2++2OH—=Zn(OH)2
соответствует взаимодействию веществ
сульфита цинка и гидроксида аммония
нитрата цинка и гидроксида алюминия
сульфида цинка и гидроксида натрия
сульфата цинка и гидроксида калия
31. Взаимодействию соляной кислоты и карбоната калия соответствует краткое ионное уравнение
2HCl + CO32- —> H2O + CO2 + 2Сl—
2H+ + CO32- —> H2O + CO2
2H+ + K2CO3 —> 2K+ + H2O + CO2
2К+ + 2Сl— —>2КС1
32. В водном растворе возможно взаимодействие между
В водном растворе возможно взаимодействие между
Na2CO3 и NaOH
Na2CO3 и KNO3
Na2CO3 и KCl
Na2CO3 и BaCl2
33. Осадок образуется при взаимодействии растворов веществ:
Zn(NO3)2 и Na2SO4
Ba(OH)2 и NaCl
KCl и AgNO3
MgCl2 и K2SO4
Ответы: 1-3, 2-4, 3-2, 4-3, 5-3, 6-4, 7-2, 8-2, 9-3, 10-1, 11-1, 12-2, 13-3, 14-2, 15-1, 16-2, 17-2, 18-3, 19-4, 20-4, 21-3, 22-1, 23-3, 24-1, 25-1, 26-1, 27-4, 28-3, 29-3, 30-4, 31-2, 32-4, 33-1
Решение экспериментальных задач по теме «Электролитическая диссоциация»
Задание №1
Посмотрите опыт как серная кислота взаимодействует с металлами — медью и цинком.
Опыт: “Взаимодействие кислот с металлами”
Ответьте на вопросы и выполните задания:
1. Почему цинк вступает в реакцию с раствором серной кислоты, а медь нет?
Почему цинк вступает в реакцию с раствором серной кислоты, а медь нет?
2. Какой газ выделяется при взаимодействии растворов кислот с металлами, стоящими в ряду активности до водорода?
3. Запишите уравнение реакции взаимодействия цинка с серной кислотой в молекулярном, полном и кратком ионном виде.
4. В реакции взаимодействия цинка с серной кислотой определите атомы, изменяющие свои степени окисления, и составьте электронный баланс, в котором укажите переход электронов. Назовите окислитель и восстановитель, процессы окисления и восстановления.
Задание №2
Опыт: “Реакции ионного обмена, идущие с выделением газа”
Ответьте на вопросы и выполните задания:
1. Какой признак реакции можно наблюдать при взаимодействии соляной кислоты с раствором карбоната натрия?
2. Какой газ выделяется в наблюдаемой реакции?
3. Является ли наблюдаемая реакция обратимой или она протекает до конца и почему?
4. Запишите уравнение реакции взаимодействия соляной кислоты с раствором карбоната натрия в молекулярном, полном и кратком ионном виде.
Запишите уравнение реакции взаимодействия соляной кислоты с раствором карбоната натрия в молекулярном, полном и кратком ионном виде.
Задание №3
Посмотрите опыт «Взаимодействие гидроксида натрия с соляной кислотой»
Опыт: “Реакция нейтрализации”
Ответьте на вопросы и выполните задания:
1. Почему в наблюдаемой реакции фенолфталеин меняет цвет два раза?
2. Является ли наблюдаемая реакция обмена обратимой или она протекает до конца? Если реакция необратима, то какой признак необратимости в наблюдаемой реакции проявляется?
3. Как называется реакция обмена между щёлочью и кислотой?
4. Запишите уравнение реакции взаимодействия соляной кислоты с раствором гидроксида натрия в молекулярном, полном и кратком ионном виде.
Задание №4
Посмотрите опыт «Качественные реакции на анионы: сульфат (SO42-), карбонат (CO32-), хлорид (Cl—), иодид (I—)»
Опыт: “Качественные реакции на анионы”
Заполните таблицу
|
Название опыта |
Уравнение реакции ионного обмена |
Качественный признак реакции |
|
1. |
Закончите реакцию в молекулярном, полном и кратком ионном виде. H2SO4 + BaCl2→ |
Укажите химическую формулу и цвет вещества — осадка |
|
2. Качественная реакция на карбонат ион |
Закончите реакцию в молекулярном, полном и кратком ионном виде. K2CO3 + HCl→ |
Укажите химическую формулу и цвет вещества — газа |
|
3. Качественная реакция на хлорид ион |
Закончите реакцию в молекулярном, полном и кратком ионном виде. NaCl + AgNO3→ |
Укажите химическую формулу и цвет вещества — осадка |
Задание №5
Посмотрите опыт «Качественные реакции на анионы: сульфат (SO 42-), карбонат (CO32-), хлорид (Cl—), иодид (I—)»
Видео: “Качественные реакции на анионы”
Заполните таблицу
|
Название опыта |
Уравнение реакции ионного обмена |
Качественный признак реакции |
|
Качественная реакция на йодид ион |
Закончите реакцию в молекулярном, полном и кратком ионном виде. KI + Pb(NO3)2 → |
Укажите химическую формулу и цвет вещества — осадка |
13.1: Процесс решения — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21784
Цели обучения
- Понять, как изменения энтальпии и энтропии влияют на образование раствора.
- Чтобы использовать величину изменений как энтальпии, так и энтропии, чтобы предсказать, будет ли данная комбинация растворенного вещества и растворителя спонтанно образовывать раствор.
Во всех растворах, газообразных, жидких или твердых, вещество, присутствующее в наибольшем количестве, является растворителем, а вещество или вещества, присутствующие в меньших количествах, являются растворенным(ыми) веществом(ами).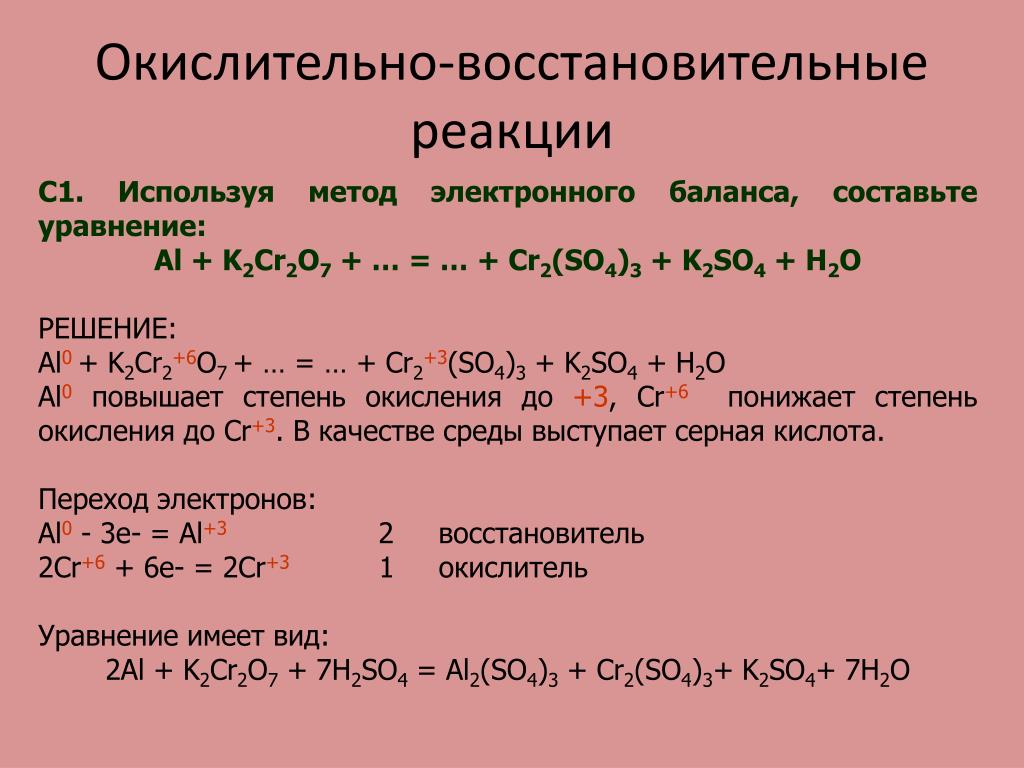 Растворенное вещество не обязательно должно находиться в том же физическом состоянии, что и растворитель, но физическое состояние растворителя обычно определяет состояние раствора. Пока растворенное вещество и растворитель объединяются, образуя гомогенный раствор, говорят, что растворенное вещество растворимо в растворителе. В таблице \(\PageIndex{1}\) перечислены некоторые распространенные примеры газообразных, жидких и твердых растворов и указаны физические состояния растворенного вещества и растворителя в каждом из них.
Растворенное вещество не обязательно должно находиться в том же физическом состоянии, что и растворитель, но физическое состояние растворителя обычно определяет состояние раствора. Пока растворенное вещество и растворитель объединяются, образуя гомогенный раствор, говорят, что растворенное вещество растворимо в растворителе. В таблице \(\PageIndex{1}\) перечислены некоторые распространенные примеры газообразных, жидких и твердых растворов и указаны физические состояния растворенного вещества и растворителя в каждом из них.
| Раствор | Растворенное вещество | Растворитель | Примеры |
|---|---|---|---|
| газ | газ | газ | воздух, природный газ |
| жидкость | газ | жидкость | сельтерская вода (\(CO_2\) газ в воде) |
| жидкость | жидкость | жидкость | напиток алкогольный (этанол в воде), бензин |
| жидкость | твердый | жидкость | чай, соленая вода |
| сплошной | газ | твердый | \(H_2\) в Pd (используется для хранения \(H_2\)) |
| сплошной | твердый | жидкость | ртуть в серебре или золоте (амальгама, часто используемая в стоматологии) |
| сплошной | твердый | твердый | сплавыи другие «твердые растворы» |
Формирование раствора 9{-}(aq) + h3(g)} \label{13.
 1.2} \]
1.2} \]При испарении раствора металлический цинк не выделяется, поэтому нельзя сказать, что металлический цинк растворим в водной соляной кислоте, поскольку он химически трансформируется при растворении. Растворение растворенного вещества в растворителе с образованием раствора не связано с химическим превращением (это физическое изменение).
Растворение растворенного вещества в растворителе с образованием раствора не связано с химическим превращением.
Вещества, образующие единую однородную фазу во всех соотношениях, называются полностью смешиваемыми друг с другом. Этанол и вода смешиваются так же, как смешиваются смеси газов. Если два вещества практически нерастворимы друг в друге, например масло и вода, они несмешиваются . Примеры газообразных растворов, которые мы уже обсуждали, включают атмосферу Земли.
Роль энтальпии в образовании растворов
Для преодоления межмолекулярных взаимодействий в растворенном веществе необходима энергия, которая может быть обеспечена только новыми взаимодействиями, возникающими в растворе, когда каждая частица растворенного вещества окружена частицами растворителя в процесс, называемый сольватацией (или гидратацией, когда растворителем является вода). Таким образом, для образования раствора должны быть нарушены все взаимодействия растворенное вещество-растворенное вещество и многие взаимодействия растворитель-растворитель. В этом разделе мы опишем роль энтальпии в этом процессе.
Таким образом, для образования раствора должны быть нарушены все взаимодействия растворенное вещество-растворенное вещество и многие взаимодействия растворитель-растворитель. В этом разделе мы опишем роль энтальпии в этом процессе.
Поскольку энтальпия является функцией состояния, мы можем использовать термохимический цикл для анализа энергетики образования раствора. Процесс происходит в три отдельных этапа, обозначенных \(ΔH_1\), \(ΔH_2\) и \(ΔH_3\) на рисунке \(\PageIndex{2}\). Общее изменение энтальпии при образовании раствора (\( \Delta H_{soln}\)) представляет собой сумму изменений энтальпии на трех стадиях:
\[ \Delta H_{soln} = \Delta H_1 + \ Delta H_2 + \Delta H_3 \label{13.1.3} \]
Когда к раствору добавляется растворитель, стадии 1 и 2 являются эндотермическими, поскольку для преодоления межмолекулярных взаимодействий в растворителе требуется энергия (\(\Delta H_1\)) и растворенного вещества (\(\Delta H_2\)). Поскольку \(ΔH\) положителен для обеих стадий 1 и 2, взаимодействия растворенного вещества и растворителя (\(\Delta H_3\)) должны быть сильнее, чем взаимодействия растворенного вещества и растворителя и растворителя, которые они заменяют, чтобы процесс растворения быть экзотермическим (\(\Delta H_{soln} < 0\)). Когда растворенное вещество представляет собой ионное твердое вещество, \(ΔH_2\) соответствует энергии решетки, которую необходимо преодолеть для образования раствора. Чем выше заряд ионов в ионном твердом теле, тем выше энергия решетки. Следовательно, твердые тела с очень высокой энергией решетки, такие как \(MgO\) (-3791 кДж/моль), как правило, нерастворимы во всех растворителях.
Когда растворенное вещество представляет собой ионное твердое вещество, \(ΔH_2\) соответствует энергии решетки, которую необходимо преодолеть для образования раствора. Чем выше заряд ионов в ионном твердом теле, тем выше энергия решетки. Следовательно, твердые тела с очень высокой энергией решетки, такие как \(MgO\) (-3791 кДж/моль), как правило, нерастворимы во всех растворителях.
 (b) Когда \(ΔH_3\) меньше по величине, чем сумма \(ΔH_1\) и \(ΔH_2\), общий процесс является эндотермическим (\(ΔH_{soln}\) > 0).
(b) Когда \(ΔH_3\) меньше по величине, чем сумма \(ΔH_1\) и \(ΔH_2\), общий процесс является эндотермическим (\(ΔH_{soln}\) > 0).Положительное значение \(ΔH_{soln}\) не означает, что раствор не образуется. Происходит ли данный процесс, в том числе образование раствора, самопроизвольно, зависит от того, понизится ли в результате этого полная энергия системы. Энтальпия является лишь одним из факторов, способствующих этому. Высокий \(ΔH_{soln}\) обычно указывает на то, что вещество плохо растворимо. Мгновенные холодные компрессы, используемые для лечения спортивных травм, например, используют большое положительное \(ΔH_{soln}\) нитрата аммония во время растворения (+25,7 кДж/моль), что приводит к температуре ниже 0°C (рис. (\PageIndex{3}\)).
Рисунок \(\PageIndex{3}\): Коммерческие холодные компрессы для лечения травм. Эти пакеты содержат твердое вещество \(NH_4NO_3\) и воду в отдельных отсеках. Когда уплотнение между отсеками нарушено, \(NH_4NO_3\) растворяется в воде. Поскольку \(ΔH_{soln}\) для \(NH_4NO_3\) намного больше нуля, тепло поглощается охлаждающим пакетом в процессе растворения, создавая локальные температуры ниже 0°C.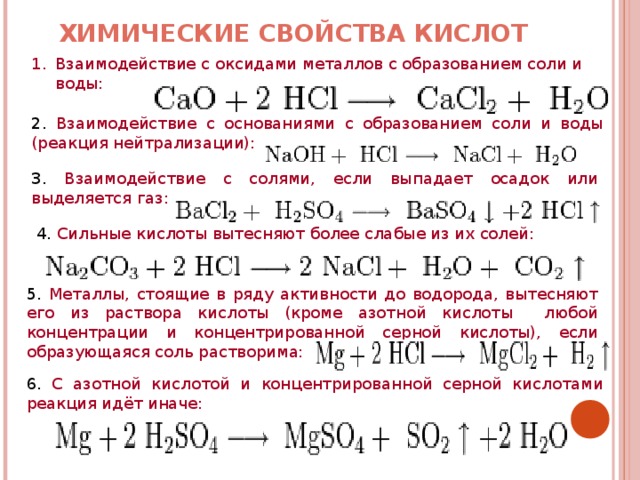
Энтропия и образование растворов
Изменение энтальпии, сопровождающее процесс, важно, поскольку процессы, высвобождающие значительное количество энергии, имеют тенденцию происходить самопроизвольно. Второе свойство любой системы, ее энтропия, также важно, чтобы помочь нам определить, происходит ли данный процесс самопроизвольно. Мы обсудим энтропию более подробно в другом месте, а пока можем констатировать, что энтропия (\(S\)) есть термодинамическое свойство всех веществ, пропорциональное степени их беспорядка. Совершенный кристалл при 0 К, атомы которого правильно расположены в идеальной решетке и неподвижны, имеет энтропию, равную нулю. Напротив, газы имеют большую положительную энтропию, потому что их молекулы сильно разупорядочены и находятся в постоянном движении с высокими скоростями.
При образовании раствора молекулы, атомы или ионы одного вида рассеиваются во втором веществе, что обычно увеличивает беспорядок и приводит к увеличению энтропии системы. Таким образом, энтропийные факторы почти всегда благоприятствуют образованию решения. Напротив, изменение энтальпии может способствовать или не способствовать образованию раствора. Дисперсионные силы Лондона, удерживающие вместе циклогексан и н-гексан в чистых жидкостях, например, имеют одинаковую природу и силу. Следовательно, \(ΔH_{soln}\) должно быть примерно равно нулю, что и наблюдается экспериментально. Однако смешивание равных количеств этих двух жидкостей дает раствор, в котором молекулы н-гексана и циклогексана равномерно распределены примерно в два раза больше первоначального объема. В этом случае движущей силой образования раствора является не отрицательное \(ΔH_{soln}\), а увеличение энтропии из-за увеличения беспорядка в смеси. Все самопроизвольные процессы с \(ΔH \ge 0\) характеризуются увеличивает энтропию . В других случаях, например при смешивании масла с водой, соли с бензином или сахара с гексаном, энтальпия растворения велика и положительна, и увеличение энтропии в результате образования раствора недостаточно для ее преодоления. Таким образом, в этих случаях раствор не образуется.
Напротив, изменение энтальпии может способствовать или не способствовать образованию раствора. Дисперсионные силы Лондона, удерживающие вместе циклогексан и н-гексан в чистых жидкостях, например, имеют одинаковую природу и силу. Следовательно, \(ΔH_{soln}\) должно быть примерно равно нулю, что и наблюдается экспериментально. Однако смешивание равных количеств этих двух жидкостей дает раствор, в котором молекулы н-гексана и циклогексана равномерно распределены примерно в два раза больше первоначального объема. В этом случае движущей силой образования раствора является не отрицательное \(ΔH_{soln}\), а увеличение энтропии из-за увеличения беспорядка в смеси. Все самопроизвольные процессы с \(ΔH \ge 0\) характеризуются увеличивает энтропию . В других случаях, например при смешивании масла с водой, соли с бензином или сахара с гексаном, энтальпия растворения велика и положительна, и увеличение энтропии в результате образования раствора недостаточно для ее преодоления. Таким образом, в этих случаях раствор не образуется.
Все самопроизвольные процессы с ΔH ≥ 0 характеризуются ростом энтропии.
В таблице \(\PageIndex{2}\) показано, как энтальпийные факторы влияют на образование раствора для четырех общих случаев. Крайний правый столбец использует относительные величины энтальпийных вкладов, чтобы предсказать, будет ли решение образовываться из каждого из четырех. Имейте в виду, что в каждом случае энтропия благоприятствует образованию решения. В двух случаях ожидается, что энтальпия растворения будет относительно небольшой и может быть как положительной, так и отрицательной. Таким образом, энтропийный вклад преобладает, и мы ожидаем, что решение будет легко сформировано. В двух других случаях ожидается, что энтальпия растворения будет большой и положительной. Энтропийный вклад, хотя и благоприятный, обычно слишком мал, чтобы преодолеть неблагоприятный энтальпийный член. Следовательно, мы ожидаем, что решение не будет формироваться легко.
| \(ΔH_1\) (разделение молекул растворителя) | \(ΔH_2\) (отделение растворенных частиц) | \(ΔH_3\) (взаимодействия растворенного вещества с растворителем) | \(ΔH_{солн}\) (\(ΔH_1\) + \(ΔH_2\) +\(ΔH_3\)) | Результат смешивания растворенного вещества и растворителя† |
|---|---|---|---|---|
| большой; положительный | большой; положительный | большой; отрицательный | маленький; положительный или отрицательный | Решениеобычно образует |
| маленький; положительный | большой; положительный | маленький; отрицательный | большой; положительный | Решениене образует |
| большой; положительный | маленький; положительный | маленький; отрицательный | большой; положительный | Решениене образует |
| маленький; положительный | маленький; положительный | маленький; отрицательный | маленький; положительный или отрицательный | Решениеобычно образует |
*\(ΔH_1\), \(ΔH_2\) и \(ΔH_3\) относятся к процессам, указанным в термохимическом цикле, показанном на рисунке \(\PageIndex{2}\). † Во всех четырех случаях энтропия возрастает. | ||||
В отличие от жидких растворов межмолекулярные взаимодействия в газах слабые (в идеальных газах считаются отсутствующими). Следовательно, смешение газов обычно является термически нейтральным процессом (\(ΔH_{soln} \приблизительно 0\)), а энтропийный фактор из-за увеличения беспорядка является доминирующим (рис. \(\PageIndex{4}\)). Следовательно, все газы легко растворяются друг в друге во всех соотношениях, образуя растворы.
Рисунок \(\PageIndex{4}\): Формирование раствора двух газов. (вверху) Чистые образцы двух разных газов находятся в разных колбах. (внизу) Когда соединительный кран открыт, диффузия заставляет два газа смешиваться вместе и образовывать раствор. Хотя \(ΔH_{soln}\) равен нулю для процесса, повышенная энтропия раствора (повышенный беспорядок) по сравнению с энтропией отдельных газов способствует растворообразованию.Пример \(\PageIndex{1}\)
Учитывая \(\ce{LiCl}\), бензойную кислоту (\(\ce{C6H5CO2H}\)) и нафталин, которые будут наиболее растворимыми и которые будут наименее растворим в воде?
Дано : три соединения
Запрошено: относительная растворимость в воде
Стратегия : Оцените относительную величину изменения энтальпии для каждой стадии процесса, показанного на рисунке 2 \(\Page }\). Затем используйте таблицу \(\PageIndex{2}\), чтобы предсказать растворимость каждого соединения в воде, и расположите их в порядке убывания растворимости.
Затем используйте таблицу \(\PageIndex{2}\), чтобы предсказать растворимость каждого соединения в воде, и расположите их в порядке убывания растворимости.
Решение:
Первое вещество, \(\ce{LiCl}\), является ионным соединением, поэтому требуется много энергии, чтобы разделить его анионы и катионы и преодолеть энергию решетки (ΔH 2 намного больше нуля в уравнении \(\ref{13.1.1}\)). Поскольку вода является полярным веществом, взаимодействия между ионами Li + и Cl — и водой должны быть благоприятными и сильными. Таким образом, мы ожидаем, что \(ΔH_3\) будет намного меньше нуля, что делает LiCl растворимым в воде. Напротив, нафталин является неполярным соединением, и только лондонские дисперсионные силы удерживают молекулы вместе в твердом состоянии. Поэтому мы ожидаем, что \(ΔH_2\) будет небольшим и положительным. Мы также ожидаем, что взаимодействие между полярными молекулами воды и неполярными молекулами нафталина будет слабым \(ΔH_3 \приблизительно 0\). Следовательно, мы не ожидаем, что нафталин будет хорошо растворим в воде, если вообще будет. Бензойная кислота имеет полярную карбоксильную группу и неполярное ароматическое кольцо. Поэтому мы ожидаем, что энергия, необходимая для разделения молекул растворенного вещества (ΔH 2 ) будет больше, чем для нафталина и меньше, чем для LiCl. Сила взаимодействия бензойной кислоты с водой также должна быть промежуточной между LiCl и нафталином. Следовательно, ожидается, что бензойная кислота будет более растворима в воде, чем нафталин, но менее растворима, чем \(\ce{LiCl}\). Таким образом, мы предсказываем, что \(\ce{LiCl}\) будет наиболее растворимым в воде, а нафталин — наименее растворимым.
Следовательно, мы не ожидаем, что нафталин будет хорошо растворим в воде, если вообще будет. Бензойная кислота имеет полярную карбоксильную группу и неполярное ароматическое кольцо. Поэтому мы ожидаем, что энергия, необходимая для разделения молекул растворенного вещества (ΔH 2 ) будет больше, чем для нафталина и меньше, чем для LiCl. Сила взаимодействия бензойной кислоты с водой также должна быть промежуточной между LiCl и нафталином. Следовательно, ожидается, что бензойная кислота будет более растворима в воде, чем нафталин, но менее растворима, чем \(\ce{LiCl}\). Таким образом, мы предсказываем, что \(\ce{LiCl}\) будет наиболее растворимым в воде, а нафталин — наименее растворимым.
Упражнение \(\PageIndex{1}\)
Принимая во внимание хлорид аммония, циклогексан и этиленгликоль (\(HOCH_2CH_2OH\)), что будет наиболее растворимым, а что наименее растворимым в бензоле?
- Ответить
Наиболее растворим циклогексан; наименее растворимым является хлорид аммония.

Резюме
Растворы представляют собой гомогенные смеси двух или более веществ, компоненты которых равномерно распределены в микроскопическом масштабе. Компонент, присутствующий в наибольшем количестве, является растворителем, а компоненты, присутствующие в меньших количествах, представляют собой растворенное вещество (растворенные вещества). Образование раствора из растворенного вещества и растворителя — это физический процесс, а не химический. Смешиваемые вещества, например газы, при смешивании образуют единую фазу во всех соотношениях. Вещества, образующие отдельные фазы, несмешиваются. Сольватация – это процесс, при котором частицы растворенного вещества окружаются молекулами растворителя. Когда растворителем является вода, процесс называется гидратацией. Общее изменение энтальпии, сопровождающее образование раствора, \(ΔH_{soln}\), представляет собой сумму изменения энтальпии нарушения межмолекулярных взаимодействий как в растворителе, так и в растворенном веществе, и изменения энтальпии образования нового растворенного вещества. – растворяющие взаимодействия. Экзотермические (\(ΔH_{soln} < 0\)) процессы способствуют образованию растворов. Кроме того, изменение энтропии, степени беспорядка системы, необходимо учитывать при прогнозировании образования решения. Увеличение энтропии (уменьшение порядка) способствует растворению.
– растворяющие взаимодействия. Экзотермические (\(ΔH_{soln} < 0\)) процессы способствуют образованию растворов. Кроме того, изменение энтропии, степени беспорядка системы, необходимо учитывать при прогнозировании образования решения. Увеличение энтропии (уменьшение порядка) способствует растворению.
13.1: Процесс решения распространяется под лицензией CC BY-NC-SA 3.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- энтальпия
- энтропия
- увлажнение
- раствор
- функция состояния
Растворимость в газах: правила, влияние и тенденции
Случалось ли это когда-нибудь с вами? Вы достаете бутылку газировки из холодильника, и как только вы ее открываете, вы едва слышите предательское «шипение» газировки. Когда вы делаете глоток, он плоский. Когда вы пытаетесь насладиться своим теперь негазированным напитком, вы думаете про себя: «Что стало причиной этого?» Ответ: растворимость в газах . В газировке «шипение» или пузырьки — это углекислый газ (CO 2 ), что и вызывает карбонизацию. Продолжайте читать, чтобы узнать о растворимости газа и о том, как сода становится плоской.
- Эта статья о растворимости газа
- Сначала мы узнаем, что означает растворимость газа и как газы растворяются в жидкости
- Затем мы узнаем, как температура влияет на растворимость на основе энергии процесса растворения
- Затем , мы узнаем, как давление влияет на растворимость, и увидим график, демонстрирующий этот эффект
- Наконец, мы подведем итог изученным нами тенденциям растворимости
Растворимость газов в жидкостях
Начнем с определения растворимости.
Растворимость — это способность вещества (называемого растворенным веществом) растворяться в растворителе . Полученное вещество называется раствором
Газы могут растворяться в жидкостях. Однако их растворимость зависит от нескольких факторов, которые мы подробно обсудим.
Итак, как же работает этот процесс? Вот простая диаграмма для объяснения:
Рис. 1 Схема процесса сольватации
1 Схема процесса сольватации
В основном частицы растворенного вещества притягиваются к частицам растворителя, и эти взаимодействия вызывают начало процесса сольватации. Растворяемое вещество и растворитель «расширяются» (т. е. частицы раздвигаются) так, что растворяемое вещество «вписывается» в этот растворитель.
Этот процесс обычно экзотермический , что означает выделение энергии/тепла. Вот как выглядит энергетическая диаграмма этого процесса:
Рис.2 Растворение газа в жидкости обычно представляет собой экзотермический процесс
В основном тепловая энергия ( энтальпия (ΔH)) выше в отдельном растворенном веществе и растворителе, поэтому при образовании раствора (который ниже в энергии) выделяется тепло. Это помогает объяснить, как температура влияет на растворимость, которую мы обсудим в следующем разделе.
Влияние температуры на растворимость газа
При повышении температуры растворимость газа снижается. Когда температура вещества повышается, оно приобретает кинетическую энергию , то есть энергию движения. Это увеличение энергии позволяет частицам газа преодолевать силы притяжения между ними и растворителем, поэтому они покидают раствор.
Когда температура вещества повышается, оно приобретает кинетическую энергию , то есть энергию движения. Это увеличение энергии позволяет частицам газа преодолевать силы притяжения между ними и растворителем, поэтому они покидают раствор.
Как я упоминал ранее, газовая сольватация обычно экзотермический процесс. Поскольку раствор существует при более низкой энергии, чем отдельное растворенное вещество и растворитель, увеличение общей энергии означает, что состояние растворенного вещества / растворителя предпочтительнее состояния раствора. Ниже приведен график, показывающий изменение растворимости различных газов в воде:
Рис.3. Тенденции растворимости газа (в воде) в зависимости от температуры, лицензия CC 4.0,
Но что делать, если процесс сольватации эндотермический ( поглощает тепло)? Обычно, когда мы обсуждаем растворимость газа, мы имеем в виду растворимость в воде (как на графике выше), которая является полярным растворителем . Однако при растворении газов в неполярных растворителях, таких как гексан (C 6 H 14 ), процесс является эндотермическим.
Однако при растворении газов в неполярных растворителях, таких как гексан (C 6 H 14 ), процесс является эндотермическим.
График, сравнивающий эти два процесса, показан ниже:
Рис. 4 – Разница в изменении энтальпии при экзотермической и эндотермической сольватации
В основном, энергия, высвобождаемая при образовании неполярного раствора (ΔH 3 ) меньше, чем энергия, выделяющаяся при наличии в растворе полярного растворителя. Это связано с тем, что взаимодействия растворенного вещества и растворителя слабее, поскольку полярные частицы обладают более сильными силами притяжения (такими как диполь-дипольная или водородная связь).
Из-за этого добавление тепла (т. е. повышение температуры) делает неполярный раствор более благоприятным, поскольку он существует на более высоком энергетическом уровне.
Влияние давления на растворимость газа
Теперь поговорим о давлении. Влияние давления на растворимость газа определяется законом Генри.
Закон Генри гласит, что количество газа, растворенного в заданном объеме жидкости (т. е. растворимость), прямо пропорционально давлению газа.
В математических терминах:
$$C_g=k_HP_g$$
Где C g — растворимость газа, k H — константа закона Генри, а P г — давление газа.
Есть два фактора, вызывающих эту связь: сжатие и равновесие .
Начнем со сжатия.
Когда давление газа увеличивается, частицы газа сжимаются. Это дает больше места для растворения большего количества частиц газа.
Один из способов думать об этом — это как надавить на одежду в контейнере или ящике, чтобы освободить место для дополнительной одежды, которую можно положить сверху.
Наш второй фактор связан с равновесием газа и жидкости.
Сначала одни частицы газа столкнутся с поверхностью жидкости и растворятся, а другие наберут достаточно энергии, чтобы покинуть жидкость. Это приводит к равновесию, при котором концентрация частиц газа в жидкости и вне ее не меняется.
Это приводит к равновесию, при котором концентрация частиц газа в жидкости и вне ее не меняется.
Рис.4-Начальное динамическое равновесие
Теперь давайте посмотрим, что происходит, когда давление увеличивается.
Рис.6-Увеличение давления вызывает сдвиг равновесия
Когда давление увеличивается, концентрация растворенного газа (т. е. нерастворенного газа) увеличивается . Это связано с тем, что количество частиц газа остается неизменным, а объем уменьшается.
Поскольку концентрация растворенного газа увеличивается, равновесие смещается, чтобы уравновесить это изменение. По сути, растворяется больше частиц газа, так что концентрация/отношение концентрации восстанавливается до равновесного уровня.
Противоположное происходит, когда вы открываете банку или бутылку газировки. Банка/бутылка находится под высоким давлением, поэтому может быть растворено больше углекислого газа (CO 2 ). Когда вы открываете его, давление уменьшается, так как объем увеличивается. Вот почему ваша газировка со временем становится плоской, поскольку растворимость CO 2 уменьшается по мере снижения давления , и CO 2 ускользает из раствора, делая соду плоской.
Вот почему ваша газировка со временем становится плоской, поскольку растворимость CO 2 уменьшается по мере снижения давления , и CO 2 ускользает из раствора, делая соду плоской.
График растворимости газа
Теперь, когда мы поняли, как давление влияет на растворимость, давайте посмотрим на график:
Рис.7 – График зависимости давления от растворимости
В зависимости от типа газа изменение давления будет более или менее значительным.
Если мы вернемся к нашему уравнению закона Генри:
$$C_g=k_HP_g$$
Константа закона Генри (k H ) объясняет эту разницу. По сути, это «константа пропорциональности», которая показывает, в какой степени давление влияет на растворимость различных газов.
Тенденции растворимости газа
Подводя итог, давайте посмотрим, какие факторы влияют на растворимость газа:
Растворимость в газе – основные выводы
. Полученное вещество называется раствором- Если процесс экзотермический (выделяется тепло), повышение температуры снижает растворимость
- Это обычно предназначено для полярных растворителей
- Если процесс составляет эндотермический (требует тепла), повышение температуры повышения растворимости
- Это обычно для неполярных растворителей


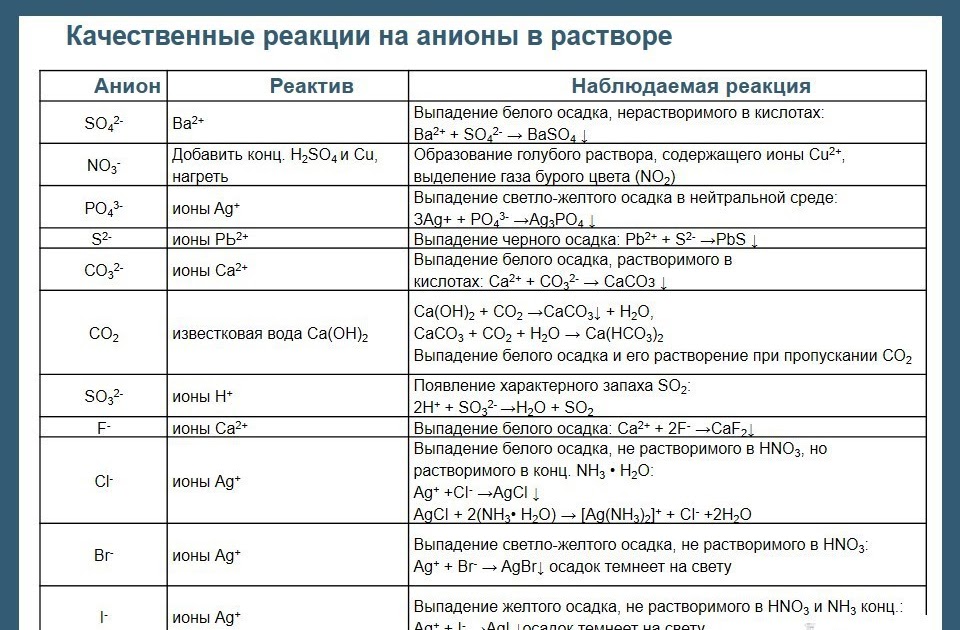
 Качественная реакция на сульфат ион
Качественная реакция на сульфат ион


Leave A Comment