Источником высокотемпературной интерфейсной сверхпроводимости оказался атомарный слой оксида меди
Законченной теории высокотемпературной сверхпроводимости до сих пор не создано. Однако достоверно известно, что все высокотемпературные сверхпроводники (ВТСП) имеют слоистую кристаллическую структуру. Это касается как наиболее изученных медьсодержащих ВТСП, так и недавно открытых их «железных» аналогов. Абсолютно все «медные» сверхпроводники содержат слои оксида меди, которые чередуются со слоями оксидов других элементов, входящих в состав данного ВТСП. При этом чем больше плоскостей CuO2 входит в элементарную ячейку вещества, тем выше критическая температура ВТСП. Ученым до конца не ясен механизм взаимосвязи между слоями оксида меди и температурой. Исследователи из Брукхейвенской национальной лаборатории (США) провели эксперименты, которые могут пролить свет на эту взаимосвязь и тем самым помочь физикам, работающим над созданием теории высокотемпературной сверхпроводимости.
Прошло 23 года с того момента, как был открыт первый ВТСП — высокотемпературный сверхпроводник (см. таблицу). За это время было накоплено большое количество экспериментальных данных и создано более 10 теоретических моделей высокотемпературной сверхпроводимости. Однако законченной теории нет до сих пор, поскольку остаются неясными некоторые важные детали возникновения данного явления. В частности, за счет чего повышается критическая температура вещества (температура перехода из нормального состояния в сверхпроводящее) по сравнению с низкотемпературным классом сверхпроводников? Физики достоверно знают лишь то, что электроны проводимости, так же как и в их низкотемпературных аналогах, объединяются в куперовские пары, и то, что все ВТСП имеют анизотропную слоистую структуру.
Чтобы построить полноценную модель высокотемпературной сверхпроводимости, необходимо, кроме всего прочего, понять, есть ли связь между кристаллической структурой и критической температурой медьсодержащих сверхпроводников? Каков механизм влияния плоскостей оксида меди на Tc? Являются ли они источником высокотемпературной сверхпроводимости? Вообще говоря, может ли единичный слой CuO2 быть сверхпроводящим? Или высокотемпературная сверхпроводимость появляется лишь тогда, когда «бутерброд» ВТСП достаточно толстый? Однозначного ответа на эти вопросы не существует, так как высокотемпературная сверхпроводимость определяется и другими факторами, но одна интересная особенность заслуживает внимания: чем больше двумерных слоев оксида меди содержит элементарная ячейка кристалла ВТСП, тем выше его критическая температура.
Между прочим, открытые в 2008 году железосодержащие сверхпроводники обладают принципиально схожей структурой, что и медные. Только слои оксида меди заменены в них плоскостями FeAs (рис. 1).
Таким образом, ученым, пытающимся построить теорию высокотемпературной сверхпроводимости, очень важно выяснить пока что загадочный для них механизм влияния плоскостей CuO2 на значение Tc. Хорошим подспорьем здесь были бы специальные эксперименты, вроде такого: возьмем какой-нибудь монокристалл «медного» ВТСП и начнем последовательно отслаивать одну оксидную плоскость за другой; будем наблюдать, как изменяется

К сожалению, чтобы проделать такой эксперимент и тем самым помочь физикам-теоретикам в разработке теории высокотемпературной сверхпроводимости, необходимо преодолеть ряд технологических проблем. Ведь очень сложно получить гладкую, без сильных шероховатостей, тонкую пленку высокотемпературного сверхпроводника. Наибольший успех в этом направлении был достигнут несколько лет назад для пленки из La
Еще одну возможность изучения воздействия плоскостей CuO2 на сверхпроводимость с большим значением Tc открывает недавно обнаруженная
 Поэтому опубликованная недавно в журнале Science статья группы ученых из Брукхейвенской национальной лаборатории во главе с Иваном Божовичем (Ivan Božović) High-Temperature Superconductivity in a Single Copper-Oxygen Plane, в которой исследуется этот феномен, может помочь с ответами на вышеприведенные вопросы.
Поэтому опубликованная недавно в журнале Science статья группы ученых из Брукхейвенской национальной лаборатории во главе с Иваном Божовичем (Ivan Božović) High-Temperature Superconductivity in a Single Copper-Oxygen Plane, в которой исследуется этот феномен, может помочь с ответами на вышеприведенные вопросы.Но прежде чем рассказать, что такое высокотемпературная интерфейсная сверхпроводимость, какие результаты получила группа Божовича и как их можно истолковать, познакомимся поближе с объектом их исследования — соединением La
Влияние допирования на свойства La
2-xSrxCuO4Напомним, что в химической формуле лантанового (и не только) ВТСП х обозначает степень допирования стронцием «базового» соединения La2CuO4, то есть х показывает, какой процент атомов лантана La заменили на атомы стронция Sr. В недопированном состоянии, без каких-либо примесей, LCO (эту аббревиатуру часто используют вместо химической формулы La2CuO4) представляет собой изолятор, который вплоть до 0 К сверхпроводником не становится. Небольшая добавка стронция существенно меняет свойства «базового» вещества. На рис. 2 приведена фазовая диаграмма, на которой обнаруживается разнообразие внутренней структуры La
Небольшая добавка стронция существенно меняет свойства «базового» вещества. На рис. 2 приведена фазовая диаграмма, на которой обнаруживается разнообразие внутренней структуры La
Небольшие пояснения к рис. 2. Сверхпроводящим соединение La2-xSrxCuO4 (сокращенно LSCO) является не для всех значений степени допирования, а только тогда, когда х принадлежит интервалу от 0,05 до 0,25. Максимум критической температуры (40 К), как это видно из графика, приходится на х = 0,15. Заметим, что создать сверхпроводимость в LCO можно не только внедрением стронция в его кристаллическую решетку, но и допированием кислородом. В этом случае химическая формула LCO выглядит так: La
На фазовой диаграмме отмечены также диапазоны степени допирования стронцием, когда LSCO проявляет свойства антиферромагнетика и спинового стекла. Антиферромагнетики — это вещества, у которых магнитные моменты соседних атомов ориентированы навстречу друг другу — антипараллельно; этим они отличаются от ферромагнетиков с одинаковой направленностью магнитных моментов. В спиновом стекле магнитные моменты не имеют какого-либо упорядочения, как это наблюдается у ферромагнетиков или антиферромагнетиков. Кроме того, эти моменты еще и как бы случайным образом и беспорядочно заморожены (как случайным образом и беспорядочно заморожены положения атомов во внутренней структуре обычного стекла) и не меняют свое направление с течением времени; см. также статью Г. А. Петраковского «Спиновые стекла» (PDF, 145 Кб) из Соросовского образовательного журнала.
Антиферромагнетики — это вещества, у которых магнитные моменты соседних атомов ориентированы навстречу друг другу — антипараллельно; этим они отличаются от ферромагнетиков с одинаковой направленностью магнитных моментов. В спиновом стекле магнитные моменты не имеют какого-либо упорядочения, как это наблюдается у ферромагнетиков или антиферромагнетиков. Кроме того, эти моменты еще и как бы случайным образом и беспорядочно заморожены (как случайным образом и беспорядочно заморожены положения атомов во внутренней структуре обычного стекла) и не меняют свое направление с течением времени; см. также статью Г. А. Петраковского «Спиновые стекла» (PDF, 145 Кб) из Соросовского образовательного журнала.
Высокотемпературная интерфейсная сверхпроводимость
Теперь можно перейти к обсуждению результатов, полученных Божовичем и его коллегами. В их распоряжении находилась уникальная по своим возможностям установка молекулярно-лучевой эпитаксии (см. галерею фотографий MBE Laboratory). Она позволяла напылять пленки с беспрецедентной точностью по толщине.
С помощью своей установки молекулярно-лучевой эпитаксии ученые напылили гетероструктуру — двухслойную пленку LSCO-LCO, нижнюю половину которой занимало допированное стронцием соединение La1,56Sr0,44CuO4, а вторую, верхнюю, половину — La2CuO4 (рис. 3). Общая толщина системы LSCO-LCO складывалась из длины 12 элементарных ячеек La2CuO4 (добавка стронция не влияет на параметры кристаллической решетки), то есть, как несложно посчитать, составляла 1,325·12 = 15,9 нм. Фактически, получился контакт металла с изолятором, причем, как видно из значения степени допирования х = 0,44, первый (и это важно!) сверхпроводником не становится.
В 2008 году, изучая похожую гетероструктуру LSCO-LCO, Иван Божович вместе с другими учеными обнаружили, что она становится сверхпроводящей при Tc = 30 К. Невероятно, но контакт двух несверхпроводящих веществ обнаруживал свойства не просто сверхпроводимости, а высокотемпературной сверхпроводимости. С легкой руки исследователей данное явление получило название интерфейсная высокотемпературная сверхпроводимость.
Обсуждаемая здесь статья в журнале Science описывает продолжение исследований ученых во главе с Божовичем. Теперь они задались целью выяснить, где зарождается сверхпроводимость в такой тонкой двухслойной пленке из несверхпроводящих материалов, причастны ли к этому плоскости оксида меди, и если да, то в какой именно плоскости оксида меди в LSCO-LCO происходит рождение сверхпроводимости. Чтобы понять, в какой по счету плоскости CuO2 появляется сверхпроводимость и появляется ли вообще, исследователи в каждой из них по очереди подменяли 3% атомов меди атомами цинка (рис. 3). После такого допирования группа Божовича измеряла Tc гетероструктуры LSCO-LCO. Идеология эксперимента очень простая. Цинк, внедренный в вещество даже в малом количестве, существенно подавляет в нем сверхпроводимость. Предварительно измерив критическую температуру пленки LCO-LSCO до ее допирования цинком, ученые смотрели как уменьшается Tc, когда атомы цинка находились в одной из 12 плоскостей оксида меди. Если критическая температура существенно не меняла своего значения, то источником сверхпроводимости является какой-то другой слой CuO2.
3). После такого допирования группа Божовича измеряла Tc гетероструктуры LSCO-LCO. Идеология эксперимента очень простая. Цинк, внедренный в вещество даже в малом количестве, существенно подавляет в нем сверхпроводимость. Предварительно измерив критическую температуру пленки LCO-LSCO до ее допирования цинком, ученые смотрели как уменьшается Tc, когда атомы цинка находились в одной из 12 плоскостей оксида меди. Если критическая температура существенно не меняла своего значения, то источником сверхпроводимости является какой-то другой слой CuO2.
В итоге оказалось, что «убийцей сверхпроводимости» оказалась вторая по номеру в слое диэлектрика La2CuO4 плоскость оксида меди (на рис. 3 она выделена желтым цветом). Трехпроцентная примесь цинка в ней приводила к уменьшению Tc гетероструктуры LSCO-LCO почти в 2 раза — приблизительно до 20 К (рис. 4).
Отсюда следует, что высокотемпературная интерфейсная сверхпроводимость рождается во второй, если отсчитывать вверх от границы контакта, элементарной ячейке LCO, а точнее, как показали эксперименты, во второй плоскости CuO2. Значит, единичный слой оксида меди всё-таки может быть сверхпроводящим.
Значит, единичный слой оксида меди всё-таки может быть сверхпроводящим.
Авторы статьи не пытаются как-то трактовать или применить плоды своих экспериментов к обычным массивным ВТСП. Они лишь честно и добросовестно провели исследовательскую работу. Тем не менее полученные результаты в высшей степени интересны. Остается надеяться, что исследования группы Божовича помогут теоретикам понять, как влияют слои оксида меди на критическую температуру «медных» ВТСП, и, возможно, приблизят их к построению теории высокотемпературной сверхпроводимости.
Источник: G. Logvenov, A. Gozar, I. Bozovic. High-Temperature Superconductivity in a Single Copper-Oxygen Plane // Science. 30 October 2009. V. 326. P. 699–702.
Юрий Ерин
ГОСТ 11120-75 Кадмия оксид. Технические условия (с Изменением N 1), ГОСТ от 10 февраля 1975 года №11120-75
ГОСТ 11120-75
Группа Л51
ОКП 26 1121 0330 00
Срок действия с 01. 03.75
03.75
до 01.07.93*
_______________________________
* Ограничение срока действия снято
по протоколу Межгосударственного Совета
по стандартизации, метрологии и сертификации
(ИУС N 2, 1993 год). — Примечание изготовителя базы данных.
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности СССР
ИСПОЛНИТЕЛИ
Г.В.Грязнов, А.С.Мунькин
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 10 февраля 1975 г. N 359
3. ВЗАМЕН ГОСТ 11120-65
4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка | Номер пункта, подпункта |
ГОСТ 83-79 | 3.8.1 |
ГОСТ 84-76 | 3. |
ГОСТ 1770-74 | 3.2.1а, 3.3.1, 3.7.1, 3.9.1 |
ГОСТ 3118-77 | 3.3.1, 3.7.1 |
ГОСТ 3760-79 | 3.7.1 |
ГОСТ 3773-72 | 3.7.1, 3.8.1 |
ГОСТ 3885-73 | 2.1, 3.1, 3.7.1, 4.1 |
ГОСТ 4160-74 | 3.8.1 |
ГОСТ 4204-77 | 3.7.1 |
ГОСТ 4212-76 | 3.7.1, 3.8.1, 3.9.1 |
ГОСТ 4233-77 | 3.8.1 |
ГОСТ 4461-77 | 3.6, 3.9.1 |
ГОСТ 5457-75 | 3. |
ГОСТ 5830-79 | 3.7.1 |
ГОСТ 6262-79 | 3.9.1 |
ГОСТ 6709-72 | 3.3.1, 3.7.1, 3.8.1, 3.9.1 |
ГОСТ 9147-80 | 3.4, 3.8.1 |
ГОСТ 10398-76 | 3.2.1 |
ГОСТ 10555-75 | 3.6 |
ГОСТ 10671.5-74 | 3.4 |
ГОСТ 10671.7-74 | 3.5 |
ГОСТ 11293-78 | 3.7.1 |
ГОСТ 19627-74 | 3.8.1 |
ГОСТ 20292-74 | 3. |
ГОСТ 24104-80 | 3.1а |
ГОСТ 25336-82 | 3.2.1а, 3.3.1, 3.4, 3.5, 3.6, 3.7.1, 3.9.1 |
ГОСТ 25664-83 | 3.8.1 |
ГОСТ 27025-86 | 3.1а |
ГОСТ 27067-86 | 3.7.1 |
ГОСТ 27068-86 | 3.8.1 |
5. Срок действия продлен до 01.07.93 Постановлением Госстандарта СССР от 26.08.87 N 3392
6. ПЕРЕИЗДАНИЕ (август 1988 г.) с Изменением N 1, утвержденным в августе 1987 г. (ИУС 12-87)
Настоящий стандарт распространяется на оксид кадмия, представляющий собой коричнево-бурый кристаллический неплавкий порошок, нерастворимый в воде, легко растворимый в минеральных кислотах, на воздухе постепенно бледнеет, поглощая углекислоту и переходя в углекислый кадмий.
Показатели технического уровня, установленные настоящим стандартом, предусмотрены для высшей категории качества.
Формула CdO.
Молекулярная масса (по международным атомным массам 1971 г.) — 128,399.
(Измененная редакция, Изм. N 1).
1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
1.1. Оксид кадмия должен быть изготовлен в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке.
1.2. По физико-химическим показателям оксид кадмия должен соответствовать нормам, указанным в табл.1.
Таблица 1
Наименование показателя | Норма | ||
Химически чистый (х.ч.) ОКП 26 1121 | Чистый для анализа (ч. | Чистый (ч.) ОКП 26 1121 0333 08 | |
1. Массовая доля оксида кадмия (CdO), %, не менее | 99,5 | 99,0 | 98,5 |
2. Массовая доля нерастворимых в соляной кислоте веществ, %, не более | 0,01 | 0,01 | 0,02 |
3. Массовая доля сульфатов (SO), %, не более | 0,002 | 0,005 | 0,01 |
4. Массовая доля хлоридов (Сl), %, не более | 0,001 | 0,001 | 0,005 |
5. | 0,0002 | 0,0005 | 0,001 |
6. Массовая доля цинка (Zn), %, не более | 0,002 | 0,002 | 0,01 |
7. Массовая доля меда (Си), %, не более | 0,00025 | 0,0005 | 0,001 |
8. Массовая доля свинца (Рb), %, не более | 0,002 | 0,005 | 0,005 |
9. | 0,01 | 0,01 | 0,02 |
Разд.1. (Измененная редакция, Изм. N 1).
2. ПРАВИЛА ПРИЕМКИ
2.1. Правила приемки — по ГОСТ 3885-73.
(Измененная редакция, Изм. N 1).
3. МЕТОДЫ АНАЛИЗА
3.1а. Общие указания по проведению испытаний — по ГОСТ 27025-86.
При выполнении операций взвешивания используют лабораторные весы по ГОСТ 24104-80* 2-го класса точности с наибольшим пределом взвешивания 200 г и 3-го класса точности с наибольшими пределами взвешивания 500 г и 1 кг.
________________
* На территории Российской Федерации действует ГОСТ 24104-2001. — Примечание изготовителя базы данных.
Допускается применение другой лабораторной посуды по точности и реактивов по качеству не ниже установленных настоящим стандартом.
(Введен дополнительно, Изм. N 1).
3.1. Пробы отбирают по ГОСТ 3885-73.
Масса средней пробы не должна быть менее 170 г.
(Измененная редакция, Изм. N 1).
3.2. Определение массовой доли оксида кадмия
3.2.1а. Аппаратура
Бюретка 1-2-50-0,1 по ГОСТ 20292-74*.
________________
* На территории Российской Федерации действуют ГОСТ 29169-91, ГОСТ 29227-91-ГОСТ 29229-91, ГОСТ 29251-91-ГОСТ 29253-91. Здесь и далее. — Примечание изготовителя базы данных.
Колба Кн-2-250-34 по ГОСТ 25336-82.
Пипетки 6-2-10, 5-2-1 по ГОСТ 20292-74.
Цилиндр 1-100 по ГОСТ 1770-74.
(Введен дополнительно, Изм. N 1).
3.2.1. Определение проводят по ГОСТ 10398-76. При этом 0,2000 г продукта помещают в коническую колбу, растворяют в 2-3 см раствора соляной кислоты с массовой долей 25%, прибавляют 100 см воды, 10 см буферного раствора 1 и 0,4 см раствора сульфарсазена или около 0,1 г индикаторной смеси эриохрома черного Т и титруют раствором ди-Nа-ЭДТА из бюретки до перехода розовой окраски раствора в лимонно-желтую или (при применении индикаторной смеси) красно-фиолетовой окраски в синюю.
3.2.2. Обработка результатов
Массовую долю оксида кадмия () в процентах вычисляют по формуле
,
где — объем раствора ди-Nа-ЭДТА концентрации точно 0,05 моль/дм, израсходованный на титрование, см;
— масса навески препарата, г;
0,00642 — масса оксида кадмия, соответствующая 1 см раствора ди-Nа-ЭДТА концентрации точно 0,05 моль/дм.
За результат анализа принимают среднее арифметическое двух параллельных определений, абсолютное значение расхождения между которыми не превышает значения допускаемого расхождения, равного 0,3%, при доверительной вероятности 0,95.
Допускается проводить определение массовой доли оксида кадмия с индикаторной смесью метилтимолового синего с добавлением 10 см раствора аммиака с массовой долей 25
%.
3.2.1, 3.2.2. (Измененная редакция, Изм. N 1).
3.3. Определение массовой доли нерастворимых в соляной кислоте веществ
3. 3.1. Аппаратура, реактивы и растворы
3.1. Аппаратура, реактивы и растворы
Стакан В-1-100 ТХС по ГОСТ 25336-82.
Тигель типа ТФ с фильтром класса ПОР 10 или ПОР 16 по ГОСТ 25336-82.
Цилиндр 1-100 по ГОСТ 1770-74.
Вода дистиллированная по ГОСТ 6709-72.
Кислота соляная по ГОСТ 3118-77, раствор с массовой долей соляной кислоты 25%.
3.3.2. Проведение анализа
10,00 г препарата помещают в стакан, смачивают водой, растворяют при нагревании на кипящей водяной бане в 40 см раствора соляной кислоты и фильтруют через фильтрующий тигель, предварительно высушенный при 105-110 °С до постоянной массы и взвешенный (результат взвешивания в граммах записывают с точностью до четвертого десятичного знака).
Остаток на фильтре промывают 100 см воды, нагретой до 60-70 °С, и сушат при 105-110 °С до постоянной массы.
Препарат считают соответствующим требованиям настоящего стандарта, если масса сухого остатка не будет превышать:
для препарата химически чистый и чистый для анализа — 1 мг,
для препарата чистый — 2 мг.
3.4. Определение массовой доли сульфатов проводят по ГОСТ 10671.5-74 визуально-нефелометрическим методом (способ 1)
При этом подготовку к анализу проводят следующим образом: 0,50 г препарата помещают в выпарительную чашку 3 (ГОСТ 9147-80), смачивают 10 см воды и растворяют при умеренном нагревании в 3 см раствора соляной кислоты с массовой долей 25%. Полученный раствор выпаривают почти досуха на кипящей водяной бане, охлаждают до температуры окружающей среды, прибавляют 26 см воды. Если раствор мутный, его фильтруют через обеззоленный фильтр «синяя лента», промытый водой, нагретой до 60-70 °С, в коническую колбу вместимостью 50 см (ГОСТ 25336-82). Далее определение проводят по ГОСТ 10671.5-74, не прибавляя раствор соляной кислоты с массовой долей 10%.
Препарат считают соответствующим требованиям настоящего стандарта, если опалесценция анализируемого раствора не будет интенсивнее опалесценции раствора сравнения, содержащего в таком же объеме:
для препарата химически чистый — 0,01 мг SO,
для препарата чистый для анализа — 0,025 мг SO,
для препарата чистый — 0,05 мг SO,
1 см раствора соляной кислоты с массовой долей 10% и те же количества реактивов.
При необходимости вводят поправку на массовую долю сульфатов в применяемом для растворения препарата объеме соляной кислоты, определяемую контрольным опытом.
3.5. Определение массовой доли хлоридов проводят по ГОСТ 10671.7-74 визуально-нефелометрическим методом
1,00 г препарата помещают в стакан вместимостью 150 см (ГОСТ 25336-82), смачивают 5 см воды и растворяют в 6 см раствора азотной кислоты, доводят объем раствора водой до 39 см, прибавляют 1 см раствора азотнокислого серебра и перемешивают.
Препарат считают соответствующим требованиям настоящего стандарта, если опалесценция анализируемого раствора не будет интенсивнее опалесценции раствора сравнения, содержащего в таком же объеме:
для препарата химически чистый — 0,01 мг Сl,
для препарата чистый для анализа — 0,01 мг Сl,
для препарата чистый — 0,05 мг Сl,
6 см раствора азотной кислоты и 1 см раствора азотнокислого серебра
.
3.6. Определение массовой доли железа проводят по ГОСТ 10555-75 сульфосалициловым методом с применением вместо раствора соляной кислоты с массовой долей 25% раствора азотной кислоты (ГОСТ 4461-77) с массовой долей 25%.
3,00 г препарата помещают в стакан вместимостью 100 см (ГОСТ 25336-82), смачивают 5 см воды и растворяют при нагревании в 15 см раствора азотной кислоты.
Далее определение проводят по ГОСТ 10555-75, прибавляя раствор аммиака в двойном объеме.
Через 10 мин в условиях построения градуированного графика фотометрируют анализируемый раствор по отношению к контрольному, содержащему в таком же объеме 15 см раствора азотной кислоты, 2 см раствора сульфосалициловой кислоты и 10 см раствора аммиака.
Препарат считают соответствующим требованиям настоящего стандарта, если масса железа не будет превышать:
для препарата химически чистый — 0,006 мг,
для препарата чистый для анализа — 0,015 мг,
для препарата чистый — 0,030 мг.
Допускается заканчивать определение визуально.
Допускается проводить определение массовой доли примеси железа роданидным методом с извлечением в спиртовой слой или спектрографическим методом.
При разногласиях в оценке массовой доли железа анализ проводят по ГОСТ 10555-75 сульфосалициловым методом фотометрически.
3.3-3.6. (Измененная редакция, Изм. N 1).
3.7. Определение массовой доли цинка
3.7.1. Аппаратура, реактивы и растворы
Полярограф ПУ-1 или любой другой, имеющий постояннотоковый режим полярографирования или потенциостат.
Воронка ВД-1-100 ХС по ГОСТ 25336-82.
Колба мерная 2-50-2 по ГОСТ 1770-74.
Пипетки 5 (6)-2-5 (10), 2-2-25, 5-2-1 (2) по ГОСТ 20292-74.
Стаканы В-1-10 ТХС или В-1 — 25 ТХС по ГОСТ 25336-82.
Цилиндр 1-25 по ГОСТ 1770-74.
Аммиак водный по ГОСТ 3760-79, раствор с массовой долей 25%.
Аммоний роданистый по ГОСТ 27067-86, х. ч., раствор с массовой долей 60%.
ч., раствор с массовой долей 60%.
Аммоний хлористый по ГОСТ 3773-72, х.ч., раствор с массовой долей 20%.
Раствор буферный, готовят следующим образом: смешивают 200 см воды, 15 см раствора аммиака и 20 см раствора хлористого аммония.
Вода дистиллированная по ГОСТ 6709-72.
Кислота серная по ГОСТ 4204-77, х.ч.
Кислота соляная по ГОСТ 3118-77, х.ч., раствор с массовой долей 25%.
Натрий сульфит 7-водный насыщенный раствор.
Желатин пищевой по ГОСТ 11293-78*, раствор с массовой долей 0,5%.
________________
* На территории Российской Федерации действует ГОСТ 11293-89. — Примечание изготовителя базы данных.
Раствор, содержащий 1 мг/см Zn; готовят по ГОСТ 4212-76.
Спирт изоамиловый по ГОСТ 5830-79, ч.д.а.
Жидкость промывная; готовят следующим образом: смешивают 200 см воды, 50 см раствора роданистого аммония и 0,5 см серной кислоты
.
3.7.2. Проведение анализа
1,00 г препарата помещают в стакан вместимостью 100 см и растворяют в 5 см раствора соляной кислоты. Раствор выпаривают почти досуха; остаток растворяют в 20 см воды и переносят в мерную колбу. Объем раствора доводят водой до метки и перемешивают.
Раствор выпаривают почти досуха; остаток растворяют в 20 см воды и переносят в мерную колбу. Объем раствора доводят водой до метки и перемешивают.
25 см полученного раствора (соответствует 0,50 г препарата) помещают в делительную воронку, добавляют 5 см раствора роданистого аммония, 0,05 см серной кислоты и 10 см изоамилового спирта. Содержимое воронки энергично встряхивают в течение 2 мин и оставляют стоять до полного расслаивания жидкостей. Нижний слой отбрасывают, а верхний слой изоамилового спирта трижды промывают промывной жидкостью (каждый раз по 10 см), встряхивая в течение 1-1,5 мин. Для реэкстракции цинка к промытому экстракту в воронку приливают 15 см буферного раствора и встряхивают в течение 2 мин. После расслаивания фаз водную фазу тщательно отделяют, переносят в стакан вместимостью 25 см и кипятят в течение 2 мин. После охлаждения раствор переносят в мерную колбу, добавляют 3 см раствора аммиака, 3 см насыщенного раствора 7-водного сульфита натрия и 0,5 см раствора желатина. Объем раствора доводят водой до метки и перемешивают (раствор А). По истечении 15 мин помещают 25 см полученного раствора А в полярографическую ячейку и полярографируют (в качестве индикаторного электрода используют ртутный капающий электрод). Потенциал полуволны цинка находится около минус 1,33 В.
Объем раствора доводят водой до метки и перемешивают (раствор А). По истечении 15 мин помещают 25 см полученного раствора А в полярографическую ячейку и полярографируют (в качестве индикаторного электрода используют ртутный капающий электрод). Потенциал полуволны цинка находится около минус 1,33 В.
К оставшимся 25 см раствора А прибавляют 0,02 мг Zn и полярографируют при тех же
условиях.
3.7.3. Обработка результатов
Массовую долю цинка () в процентах вычисляют по формуле
,
где — высота волны препарата, мм;
— высота волны препарата с добавкой цинка, мм;
— масса добавленного цинка, мг;
— масса навески препарата, мг.
За результат анализа принимают среднее арифметическое двух параллельных определений, абсолютное значение расхождения между которыми не превышает значения допускаемого расхождения, равного 0,001% для препарата химически чистый и чистый для анализа и 0,002% для препарата чистый, при доверительной вероятности 0,95.
При разногласиях в оценке массовой доли цинка анализ проводят полярографическим методом.
3.7.1-3.7.3. (Измененная редакция, Изм. N 1).
3.8. Определение массовой доли меди, свинца
3.8.1. Аппаратура, реактивы и растворы
Спектограф типа ИСП-22, ИСП-28 или ИСП-30 с трехлинзовой системой освещения щели.
Генератор дуги переменного тока типа ДГ-1 или ДГ-2.
Микрофотометр типа МФ-2 или МФ-4.
Спектропроектор с 20-кратным увеличением.
Пипетки 4 (5)-2-2 и 6 (7)-2-10 по ГОСТ 20292-74.
Чашка выпарительная по ГОСТ 9147-80.
Электроды угольные спектрально-чистые, диаметром 6 мм, верхний электрод с плоской разрядной поверхностью, нижний электрод с цилиндрическим кратером диаметром 3,2 мм, глубиной 7 мм.
До проведения анализа угли обжигают в течение 2 мин при силе тока 10 А и проверяют их в спектрах линии меди 324,754 нм и свинца 283,307 нм.
Фотопластинки спектральные типа «Панхром», светочувствительностью 100 отн. единиц.
единиц.
Аммоний хлористый по ГОСТ 3773-72.
Вода дистиллированная по ГОСТ 6709-72.
Кадмия оксид по настоящему стандарту, х.ч., не содержащий примесей меди и свинца или с минимальным их содержанием, определенным спектрографическим методом добавок.
Растворы, содержащие 1 мг/см Сu и Рb, готовят по ГОСТ 4212-76 (растворы А). Соответствующим разбавлением готовят растворы, содержащие 0,1 мг/см Сu или Рb (растворы Б).
Гидрохинон (парадиоксибензол) по ГОСТ 19627-74.
Калий бромистый по ГОСТ 4160-74.
Метол (параметиламинофенолсульфат) по ГОСТ 25664-83.
Натрий сульфит 7-водный.
Натрий серноватистокислый (натрия тиосульфат) 5-водный по ГОСТ 27068-86.
Натрий углекислый по ГОСТ 83-79 или натрий углекислый 10-водный по ГОСТ 84-76.
Натрий хлористый по ГОСТ 4233-77, раствор, содержащий 10 мг/см.
Проявитель метолгидрохиноновый, готовят из двух растворов следующим образом: раствор 1-2 г метола, 10 г гидрохинона и 104 г 7-водного сульфита натрия растворяют в воде, доводят объем водой до 1 дм, перемешивают и, если раствор мутный, фильтруют; раствор 2-16 г углекислого натрия или 40 г 10-водного углекислого натрия и 2 г бромистого калия растворяют в воде, доводят объем раствора водой до 1 дм, перемешивают и, если раствор мутный, фильтруют.
Растворы 1 и 2 смешивают в равных объемах.
Фиксаж быстродействующий, готовят следующим образом: 500 г серноватистокислого натрия и 100 г хлористого аммония растворяют в воде, доводят объем раствора водой до 2 дм, перемешивают и, если раствор мутный, фильтруют.
3.8.2. Приготовление растворов сравнения
Для приготовления каждого раствора сравнения 20,00 г оксида кадмия, не содержащего определяемых примесей или содержание примесей в котором известно, помещают в выпарительную чашку, прибавляют указанные в табл.2 объемы Сu и Рb в виде растворов А и Б, перемешивают и подсушивают под инфракрасной лампой после добавления каждой примеси. Затем прокаливают в муфельной печи при 400 °С в течение 10 мин, охлаждают, переносят в ступку из винипласта или органического стекла и тщательно перемешивают.
Таблица 2
Номер раствора сравнения | Объем раствора, см | Массовая доля примеси в пересчете на препарат, % | ||||
А | Б | |||||
Сu | Рb | Cu | Pb | Cu | Pb | |
1 | — | — | 0,5 | 4,0 | 0,00025 | 0,002 |
2 | 0,1 | 1,0 | — | — | 0,0005 | 0,005 |
3 | 0,2 | 2,0 | — | — | 0,001 | 0,01 |
При необходимости для приготовления растворов сравнения учитываются массовые доли меди и свинца в оксиде кадмия, используемом в качестве основы.
3.8.1, 3.8.2. (Измененная редакция, Изм. N 1).
3.8.3. Рекомендуемые условия анализа
Сила тока, А | 8±0,5 | |||
Напряжение, В | 200-220 | |||
Ширина щели спектрографа, мм | 0,018 | |||
Экспозиция, с | 30. | |||
3.8.4. Проведение анализа
После обжига электродов и их охлаждения в кратер нижнего электрода вносят 0,15 г анализируемого препарата и 2 капли раствора хлористого натрия. Так же поступают с растворами сравнения. Угли подсушивают под инфракрасной лампой или в сушильном шкафу. Спектры анализируемой пробы и растворов сравнения снимают на одной пластинке не менее трех раз.
3.8.5. Обработка результатов
Фотопластинку со снятыми спектрами проявляют, фиксируют, промывают в проточной воде и высушивают на воздухе. Затем проводят фотометрирование спектральных линий, измеряя почернение аналитических линий: Сu 324, 754 нм, Рb 283, 307 нм и соседнего фона, пользуясь логарифмической шкалой.
Для каждой аналитической пары вычисляют разность почернений () по формуле
,
где — почернение линии + фона;
— почернение фона.
По трем значениям разности почернений определяют среднее арифметическое ().
По значениям растворов сравнения строят градуировочный график для каждой определяемой примеси, откладывая по оси абсцисс логарифмы концентраций, а по оси ординат средние арифметические значения разности почернений ().
Массовую долю каждой примеси в анализируемой пробе находят по графику.
За результат анализа принимают среднее арифметическое результатов трех параллельных определений, абсолютное значение расхождения между наиболее отличающимися значениями которых не превышает значения допускаемого расхождения, равного указанному в табл. 3, при доверительной вероятности 0,95.
3, при доверительной вероятности 0,95.
Таблица 3
Определяемые примеси | Массовая доля примесей, % | Допускаемые расхождения, абс. % |
Свинец | От 0,001 до 0,005 | 0,001 |
Медь | До 0,0003 | 0,00006 |
Св. 0,0003 до 0,0005 | 0,0001 | |
Св. 0,0005 до 0,001 | 0,0003 |
Допускается проводить определение массовой доли меди с диэтилдитиокарбаматом натрия или диэтилдитиокарбаматом свинца, а определение массовой доли свинца допускается проводить полярографическим методом или методом с применением хромата.
При разногласиях в оценке массовых долей меди и свинца анализ проводят спектральным методом.
(Измененная редакция, Изм. N 1).
3.9. Определение массовой доли натрия, калия, кальция
3.9.1. Аппаратура, реактивы и растворы
Фотометр пламенный или спектрофотометр ИСП-51 с приставкой ФЭП-1 с соответствующим фотоумножителем и спектрофотометр «Сатурн»; допускается использование других приборов, аналогичных чувствительности и точности.
Горелка.
Распылитель.
Колба Кн-2-250-34 ТХС по ГОСТ 25336-82.
Колба мерная 2-100-2 по ГОСТ 1770-74.
Пипетка 6 (7)-2-10 по ГОСТ 20292-74.
Цилиндр 1-50 по ГОСТ 1770-74.
Ацетилен растворенный технический по ГОСТ 5457-75.
Кислота азотная по ГОСТ 4461-77.
Воздух сжатый для питания контрольно-измерительных приборов.
Вода дистиллированная по ГОСТ 6709-72, вторично перегнанная в кварцевом дистилляторе или вода деминерализованная.
Кадмий азотнокислый 4-водный по ГОСТ 6262-79.
Массовая доля примесей в азотнокислом кадмии учитывается при приготовлении растворов сравнения.
Растворы, содержащие 1 мг/см Na, K, Са, готовят по ГОСТ 4212-76.
Соответствующим разбавлением получают раствор, содержащий 0,1 мг/см натрия и калия (раствор А) и 0,1 мг/см кальция (раствор Б).
Все исходные растворы и растворы сравнения следует хранить в полиэтиленовой или кварцевой посуде.
3.9.2. Приготовление растворов сравнения
Для приготовления каждого раствора сравнения взвешивают 12,01 г азотнокислого кадмия (соответствуют 5 г препарата), не содержащего определяемых примесей или с известным их содержанием, помещают в мерную колбу, приливают 50 см воды и добавляют указанные в табл.4 объемы Na, K и Са в виде растворов А и Б.
Содержимое колб перемешивают, доводят объемы водой до метки и снова перемешивают.
Таблица 4
Номер раствора сравнения | Объем раствора, см | Масса примесей в 100 см раствора сравнения, мг | Массовая доля примесей в пересчете на препарат, % | |||||
А | Б | |||||||
Na+K | Са | Na | K | Са | Na | K | Са | |
1 | 1,0 | 2,0 | 0,1 | 0,1 | 0,2 | 0,002 | 0,002 | 0,004 |
2 | 2,5 | 2,5 | 0,25 | 0,25 | 0,25 | 0,005 | 0,005 | 0,005 |
3 | 4,0 | 5,0 | 0,40 | 0,40 | 0,50 | 0,008 | 0,008 | 0,01 |
3. 9.3. Подготовка к анализу
9.3. Подготовка к анализу
5,00 г препарата помещают в коническую колбу, приливают 15 см азотной кислоты и растворяют при нагревании. Полученный раствор упаривают до объема, добавляют 50 см воды, количественно переносят в мерную колбу, доводят объем раствора водой до метки и перемешивают.
3.9.1-3.9.3. (Измененная редакция, Изм. N 1).
3.9.4. Проведение анализа
Для анализа берут не менее двух навесок. После подготовки прибора в соответствии с прилагаемой к нему инструкцией по эксплуатации проводят фотометрирование воды, применяемой для приготовления растворов, а также анализируемых растворов и растворов сравнения в порядке возрастания содержания примеси натрия или калия, или кальция. Затем проводят фотометрирование в обратной последовательности, начиная с максимального содержания примеси, и вычисляют среднее арифметическое значение интенсивности излучения для каждого раствора. После каждого измерения распыляют воду.
При фотометрировании анализируемых растворов и растворов сравнения вносят поправку на фон, полученный при фотометрировании воды.
При работе с ацетиленом следует строго руководствоваться инструкцией по технике безопасности.
3.9.5. Обработка результатов
По полученным значениям для растворов сравнения строят градуировочный график для каждой определяемой примеси, откладывая по оси ординат значения интенсивности излучения, а по оси абсцисс — массовые доли примесей натрия, калия или кальция в процентах.
Массовую долю каждой примеси в анализируемой пробе находят по графику.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, абсолютное значение расхождения между которыми не превышает значения допускаемого расхождения, равного указанному в табл.5, при доверительной вероятности 0,95.
Препарат считают соответствующим требованиям настоящего стандарта, если суммарная массовая доля натрия, калия и кальция не будет превышать установленной нормы.
Таблица 5
Определяемые примеси | Массовая доля примесей, % | Допускаемые расхождения, абс, % |
Натрий, калий | От 0,01 до 0,02 | 0,008 |
Кальций | Св. | 0,01 |
(Измененная редакция, Изм. N 1).
4. УПАКОВКА, МАРКИРОВКА, ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ
4.1. Препарат упаковывают и маркируют в соответствии с требованиями ГОСТ 3885-73.
Вид и тип тары: 2-4, 2-1 и 2-9.
Группа фасовки III, IV, V, VI, VII (до 15 кг).
(Измененная редакция, Изм. N 1).
4.2. Препарат транспортируют всеми видами транспорта в соответствии с правилами перевозок грузов, действующими на данном виде транспорта.
4.3. Препарат хранят в закрытой таре в крытых складских помещениях.
5. ГАРАНТИИ ИЗГОТОВИТЕЛЯ
5.1. Изготовитель гарантирует соответствие оксида кадмия требованиям настоящего стандарта при соблюдении условий транспортирования и хранения.
5.2. Гарантийный срок хранения препарата — 3 года со дня изготовления.
Разд.5. (Измененная редакция, Изм. N 1).
6. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
6.1. Все соединения кадмия ядовиты при вдыхании их в любом виде (пыль, туман, дым, пар) и при приеме внутрь.
6.2. Оксид кадмия при попадании в организм вызывает раздражение слизистых оболочек носа, глотки и глубоких дыхательных путей, головную боль, головокружение, тошноту. Затем развивает трахеит, бронхиолит с приступами болезненного судорожного кашля, отек легких, эмфизему с признаками кислородной недостаточности. При хроническом отравлении поражаются желудочно-кишечный тракт, почки, печень.
6.3. Работу с оксидом кадмия производить под тягой при работающей вытяжной вентиляции в респираторе марки Ф-45, Ф-46, резиновых перчатках, спецодежде и переднике.
6.4. Кадмий и его неорганические соединения — вещества первого класса опасности. Предельно допустимая концентрация кадмия и его неорганических соединений в воздухе рабочей зоны 0,1/0,01 мг/м (в знаменателе указана среднесменная ПДК). ПДК кадмия в воде хозяйственно-питьевого и культурно-бытового назначения — 0,001 мг/дм.
ПДК кадмия в воде хозяйственно-питьевого и культурно-бытового назначения — 0,001 мг/дм.
(Измененная редакция, Изм. N 1).
Электронный текст документа
подготовлен АО «Кодекс» и сверен по:
официальное издание
М.: Издательство стандартов, 1988
Итоговая контрольная работа для 9 класса по химии
Итоговая контрольная работа
Вариант 1
1. В ряду элементов О S Sе Те уменьшаются
1) радиусы атомов 3) неметаллические свойства
2) металлические свойства 4) число электронов на внешнем слое
2. Оксиду S(VI) соответствует кислота
1) H2SO42) H2S 3) H2SO34) K2SO4
3. Среди металлов Au, Hg, W, Na, Cu, Zn самым тугоплавким является
Среди металлов Au, Hg, W, Na, Cu, Zn самым тугоплавким является
1) медь 2) натрий 3) золото 4) вольфрам
4. Вещества с молекулярной кристаллической решеткой
1) натрий и кислород 3)вода и кислород
2) водород и хлорид калия 4) графит и углекислый газ
5. Для взаимодействия 1 моль алюминия с соляной кислотой потребуется ___ моль кислоты
1) 1 2) 2 3) 3 4) 4
6. Формула высшего оксида элемента, имеющего строение электронной оболочки 2,8,7
1) P2O32) SO33) Сl2O74) Al2O3
7. Ряд Zn(OH)2 , Н2СО3, NaOH соответственно представляет гидроксиды
1) основный, кислотный, амфотерный
2) основный, амфотерный, кислотный
3) амфотерный, кислотный, основный
4) кислотный, основный, амфотерный
8. Реакция водорода с оксидом меди (II) относится к реакциям
Реакция водорода с оксидом меди (II) относится к реакциям
1) соединения 2) обмена 3) замещения 4) разложения
9. Наиболее энергично реагирует с водой
1) калий 2) литий 3) натрий 4) рубидий
10. Сумма коэффициентов в сокращённом ионном уравнении
Cu(OH)2 + HCl равна
1) 4 2) 5 3) 6 4) 8
11.Какой атом имеет такое же строение внешнего слоя как и ион Na+ ?
В ответе укажите русское название элемента, в именительном падеже.
12. И с соляной кислотой и с гидроксидом натрия будут взаимодействовать
1) KOH 2) H3PO43) Be(OH)24) SO35) ZnO 6) Al2O3
Ответ запишите в виде последовательности цифр.
13. Дополните предложение. Продуктами взаимодействия калия с водой являются гидроксид калия и _______________.
14. Восстановительными свойствами обладают
1) Na 02) Fe 3+ 3) Cu 04) F05) Ba2+
Ответ запишите в виде последовательности цифр.
15. Окислительно-восстановительными реакциями являются
1) 2Al(OH)3 Al2O3 + 3H2O
2) Fe2O3 + 3C 2Fе + 3CO
3) 2Na + H2 2NaH
4) LiOH + HCl LiCl + H2O
5) Zn + FeSO4 Fe + ZnSO4
Ответ запишите в виде последовательности цифр.
16. Объём водорода (н.у.), образовавшийся при взаимодействии 26 г цинка с раствором серной кислоты, составляет ______ л. В бланк ответа запишите число с точностью до сотых.
Итоговая контрольная работа
Вариант 2
1. В ряду элементов Si P S Cl увеличиваются
В ряду элементов Si P S Cl увеличиваются
1) радиусы атомов 3) неметаллические свойства
2) металлические свойства 4) число энергетических уровней
2. Оксиду N(III) соответствует кислота
1) HNO22) HNO33) NH34) NaNO2
3. Среди металлов Au, Hg, W, Na, Cu, Zn очень мягкий, режется ножом
1) медь 2) натрий 3) золото 4) вольфрам
4. Вещества с металлической кристаллической решёткой
1) кремний и теллур 3) галлий и хлор
2) литий и азот 4) кальций и золото
5. При взаимодействии 3 моль цинка с серной кислотой образуется _____ моль водорода
1) 1 2) 2 3) 3 4) 4
6. Формула высшего оксида элемента, имеющего строение электронной оболочки 2,8,5
1) P2O32) SO33) P2O54) Al2O3
7. Ряд Ве(ОH)2, Ba(OH)2, H3PO4 соответственно представляет гидроксиды
Ряд Ве(ОH)2, Ba(OH)2, H3PO4 соответственно представляет гидроксиды
1) основный, амфотерный, кислотный
2) кислотный, основный, амфотерный
3) амфотерный, кислотный, основный
4) амфотерный, основный, кислотный
8. Необратимая химическая реакция произойдет при сливании растворов веществ, формулы которых:
1.KOH и NaCl 3.CuCl2 и KOH
2.MgCl2 и HNO3 4.Al2(SO4)3 и Сu(NO3)2
9. С разбавленной серной кислотой НЕ взаимодействует
1) ртуть 2) алюминий 3) цинк 4) железо
10. Сумма коэффициентов в сокращённом ионном уравнении
Fe(OH)3 + HNO3 равна
1) 4 2) 5 3) 6 4) 8
11. Какой атом имеет такое же строение внешнего слоя как и ион Ca2+ ?
В ответе укажите русское название элемента, в именительном падеже.
12. И с серной кислотой и с гидроксидом калия будут взаимодействовать
1) NaOH 2)Al(OH)3 3) HNO3 4) FeCl2 5) BeO 6) Zn(OH)2
Ответ запишите в виде последовательности цифр.
13. Дополните предложение. Продуктами взаимодействия натрия с водой являются водород и _______________ натрия.
14. Восстановительными свойствами обладают
1) Na + 2) Сu 0 3) Al 0 4) Ca0 5) Fe3+
Ответ запишите в виде последовательности цифр.
15. Окислительно-восстановительными реакциями являются
1) 4Li + O2 2Li2O
2) 2Fe(OH)3 Fe2O3 + 3H2O
3) Mg + CuCl2 MgCl2 + Cu
4) ZnO + C Zn + CO
5) Ca(OH)2 + 2HNO3 Ca(NO3)2 + 2H2O
Ответ запишите в виде последовательности цифр.
16. Объём кислорода (н.у.), необходимый для окисления 25,6 г меди, составляет ______ л. В бланк ответа запишите число с точностью до сотых.
Критерии оценивания
Максимальное число баллов за тест- 22, из них за задания части 1 – 10 (по 1 баллу за задание), части 2 -12 (по 2 балла за задание).Задание 16 оценивается -3 балла.
Перевод баллов в отметки:
Отметки | ||
«3» | «4» | «5» |
Баллы | ||
7-10 | 11-20 | 21-23 |
Решение заданий
Часть 1
№ задания | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Вариант 1 | 3 | 1 | 4 | 3 | 3 | 3 | 3 | 3 | 4 | 3 |
Вариант 2 | 3 | 1 | 2 | 4 | 3 | 3 | 4 | 3 | 1 | 4 |
№ задания | Вариант 1 | Вариант 2 |
11 | НЕОН | АРГОН |
12 | 356 | 256 |
13 | ВОДОРОД | ГИДРОКСИД |
14 | 13 | 234 |
15 | 235 | 134 |
16 | 89,6 | 4,48 |
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Химия меди
Химия меди ИсторияИнформация о история меди доступен в Медном Development Association, Inc, где они отмечают, что:
«В течение почти 5000 лет медь была единственным металлом, известным человеку. Сегодня это один из наиболее часто используемых и повторно используемых наших современных металлов ».
Люди впервые использовали медь около 10 000 лет назад.
кулон, обнаруженный в Северном Ираке, считается датируемым
около 8700 г. до н.э.Доисторический человек, вероятно, использовал медь для оружия
изготовление. Древние египтяне, похоже, тоже ценили
коррозионная стойкость металла. Они использовали медные ленты и
гвозди в судостроении и медные трубы использовались для передачи
воды. Некоторые из этих артефактов сохранились до наших дней в хорошем состоянии.
Оценка общего объема производства меди в Египте за 1500 лет
составляет 10 000 тонн.
Некоторые из этих артефактов сохранились до наших дней в хорошем состоянии.
Оценка общего объема производства меди в Египте за 1500 лет
составляет 10 000 тонн.
Спустя годы появились медные сплавы. Бронзы (медно-оловянные сплавы) возникла сначала, а гораздо позже появилась латунь (медно-цинковая сплавы).«Бронзовый век» видел широкое использование меди и бронза для оружия, монет, домашней утвари, мебели и др. Предметы. Самый ранний известный пример использования латуни — римская монета. чеканили во время правления Августа 27 г. до н.э. — 14 г. н.э., позже медь сыграли важную роль в появлении электричества и сегодня по-прежнему остается одним из наших самых ценных материалов.
Использование соединений меди также относится к периоду до 4000 г. до н.э.
Например, сульфат меди был особенно важным соединением.
в ранние времена.Древние египтяне использовали его в качестве протравы в своих
процесс окрашивания. Соединение также использовалось для изготовления мазей и
другие подобные препараты. Позже лекарственное использование медного купороса
появился с рецептом от болезней легких. Медь
сульфат по-прежнему широко используется и не имеет вредных побочных эффектов.
Сообщалось о эффектах его предписанного использования .
Позже лекарственное использование медного купороса
появился с рецептом от болезней легких. Медь
сульфат по-прежнему широко используется и не имеет вредных побочных эффектов.
Сообщалось о эффектах его предписанного использования .
Происхождение
Медь — 25 -й самый распространенный элемент Земли, но один из менее распространенных переходных металлов первого ряда.Это происходит как мягкий красноватый металл, который встречается в виде больших валунов весом несколько сотен тонн или в виде сульфидных руд. Последние сложные смеси меди, железа и серы в сочетании с другие металлы, такие как мышьяк, цинк и серебро. Медь концентрация в таких рудах обычно составляет 0,5-2%.
Самая распространенная руда — халькопирит, CuFeS 2 , латунь.
желтая руда, на долю которой приходится примерно 50% мировых
месторождения меди.Множество других медных руд разного цвета.
и композиции существуют. Примеры — малахит,
Cu 2 CO 3 (OH) 2 , ярко-зеленая руда,
и краснорудный куприт Cu 2 O.
Международный центр экологических и ядерных наук (ICENS)
имеет текущую программу картирования геохимического содержания Ямайки. «Геохимический атлас Ямайки» был опубликован в 1995 году и доступен на Amazon или ICENS.
Результаты, полученные для меди, показаны ниже (любезно предоставлено профессором Г.К. Лалором).
Красный пигмент в мягкоклювый T (o) uraco Bird содержит медно-порфириновый комплекс.Пигмент сильно водный растворим в щелочных условиях и был сообщается в 1952 г. что в результате попыток смотрителей зоопарка помыть птицу вода становится окрашенным в красный цвет.
T (o) uracos считаются единственными птицами, обладающими истинно красным и зеленым окрасом.
Обычно цвет, который вы воспринимаете, наблюдая за птицами, обусловлен отражениями. производятся структурой пера. Красный и зеленый пигменты (турацин и тураковердин)
обнаруженные в перьях T (o) uraco, оба содержат медь.
производятся структурой пера. Красный и зеленый пигменты (турацин и тураковердин)
обнаруженные в перьях T (o) uraco, оба содержат медь.
Свойства меди
Отличный сайт для выяснения свойств элементов, включая медь —
Еще одна полезная ссылка на Страницы проекта геологии в Univ. Невады, Рино.
Добыча меди
Медь извлекается из руды двумя основными способами:
- Пирометаллургическим методом
- Гидрометаллургический метод
Этот метод часто используется при добыче сульфидных руд.Выделяют четыре основных этапа:
- Горно-обогатительный комбинат
- Руда измельчается и измельчается в порошок.
обычно содержит менее 1% меди.
Минералы концентрируются в суспензии, которая составляет около 15%. медь.
Медные минералы отделяются от бесполезного материала путем флотации. с использованием пенообразующих растворов.
- Плавка
- Выплавка и извлечение медного концентрата нагреванием, потоком и добавлением кислорода.Сера, железо и прочее удаляются нежелательные элементы и товар называется черновая медь.
- Нефтепереработка
- Это заключительный этап процесса
получение меди высокого качества. Методы огневого и электрорафинирования
используются методы. Последний производит медь высокой чистоты.
подходит для электрического использования.
Гидрометаллургический метод -SX / EW
Экстракция растворителем / электрохимическое извлечение является наиболее распространенным методом выщелачивания. процесс, используемый сегодня при извлечении меди из химических решения.Как следует из названия, метод включает два основных Этапы:
Экстракция растворителем — процесс выщелачивания ионов меди или иным образом извлеченные из сырой руды с использованием химических агенты.
Электролиз — электролиз раствора, содержащего ионы металла. так что ионы Cu внутри него осаждаются на катоде и
после этого удаляется в элементарной форме.
так что ионы Cu внутри него осаждаются на катоде и
после этого удаляется в элементарной форме.
Процесс проходит в следующие этапы:
- Выщелачивающий раствор (выщелачивающий раствор) выбирается для использования в выщелачивание ионов Cu из руды.Обычные реагенты — слабые кислоты например H 2 SO 4 , H 2 SO 4 + Fe 2 (SO 4 ) 3 , хлорид кислоты решения например FeCl 2 , хлорид аммония и аммоний солевые составы.
- При нанесении на руду выбранный выщелачивающий агент растворяет ионы меди, присутствующие в выщелачивающем продукте, называемом «беременным» выщелачивающий раствор ».
- Затем выбирается органический экстрагент для удаления ионов Cu из водный раствор.Предпочтительные органические экстрагенты состоят из гидроксифенилоксимы, имеющие основную химическую формулу:
- C 6 H 3 (R) (OH) CNOHR *, R = C 9 H 19 или C 12 H 25 и R * = H, CH 3 или C 6 H 5
| Структура 5-нонилсалицилальдоксима |
Примерами таких экстрагентов являются 5-нонилсалицилальдоксим и смесь этого соединения и 2-гидрокси-5-нонилацетофенона оксим.
 Коммерчески доступные реагенты обычно содержат 5-10%
оксима в 90-95% нефтяном разбавителе, таком как
керосин.
Коммерчески доступные реагенты обычно содержат 5-10%
оксима в 90-95% нефтяном разбавителе, таком как
керосин.Перед смешиванием с выщелачивающим средством экстрагент будет содержат мало или совсем не содержат меди и на этой стадии называется «бесплодный органический экстрагент».
- Ионы меди переносятся из выщелачивающего раствора в органический экстрагент при смешивании двух реагентов. Фаза происходит разделение на водную и органическую фазы. названы соответственно первой водной и первой органической фазами.Первая водная фаза, «рафинат», представляет собой выщелачивающий агент. лишенный ионов меди, в то время как первая органическая фаза представляет собой «нагруженный органический экстрагент», т.е. экстрагент с ионами меди настоящее время.
- Рафинат возвращается на площадку для выщелачивания, в то время как
загруженный органический экстрагент смешивается с раствором электролита
называется «обедненный электролит» (т.е. не содержащий меди).
Типичные электролиты — это кислотные растворы, такие как серная кислота,
Н 2 СО 4 .
 Ионы меди, присутствовавшие в
органический экстрагент растворяется в растворе электролита.
чтобы получить медь, содержащую «богатый электролит». Здесь снова там
это фазовое разделение. Вторая органическая фаза — бесплодная
органический экстрагент, в то время как вторая водная фаза является «богатой»
электролит ». Бесплодный органический экстрагент затем рециркулируют для
повторное использование в приложении к выщелачиванию.
Ионы меди, присутствовавшие в
органический экстрагент растворяется в растворе электролита.
чтобы получить медь, содержащую «богатый электролит». Здесь снова там
это фазовое разделение. Вторая органическая фаза — бесплодная
органический экстрагент, в то время как вторая водная фаза является «богатой»
электролит ». Бесплодный органический экстрагент затем рециркулируют для
повторное использование в приложении к выщелачиванию. - Заключительный этап процесса — электролиз
кислотный раствор иона металлов.В результате растворенные ионы меди
осаждаются на катоде, и элементарная медь удаляется.
На этом процесс восстановления завершен.
A Примечание о примесях
Присутствие взвешенных загрязняющих веществ в системе SX / EW может
значительно снижают эффективность его работы. Такой
загрязняющие вещества могут попадать в систему из руды или
из окрестностей. Система подвержена загрязнению
от дождя, ветра и других факторов окружающей среды с первого
защитный сосуд, в котором хранится выщелачивающий продукт, обычно
открыты и расположены на открытом воздухе. Таким образом, твердые отходы в
форма грязи, песка, каменной пыли, растительных остатков, минеральных остатков
и взвешенные твердые частицы часто попадают в систему в
ранних стадиях и сохраняется на последующих стадиях
процесс.
Таким образом, твердые отходы в
форма грязи, песка, каменной пыли, растительных остатков, минеральных остатков
и взвешенные твердые частицы часто попадают в систему в
ранних стадиях и сохраняется на последующих стадиях
процесс.
Воздействие этих загрязняющих веществ является значительным и включают:
- увеличенное время разделения фаз на стадиях, когда органические и смешиваются водные растворители.
- Отсутствие полного разделения фаз после экстракции,
это приводит к потере дорогостоящего органического экстрагента, поскольку многие его остается в водном растворе. - снижение КПД по току и уменьшение чистота плакированного медного продукта при электролизе сцена.
 Переработанный органический
поэтому экстрагент содержит мало или совсем не содержит примесей, зависящих от
от того, была ли часть или вся вторая органическая фаза
фильтрованный.Было обнаружено, что этот этап фильтрации
значительно повышает эффективность работы, даже если только
часть экстрагента обрабатывается.
Переработанный органический
поэтому экстрагент содержит мало или совсем не содержит примесей, зависящих от
от того, была ли часть или вся вторая органическая фаза
фильтрованный.Было обнаружено, что этот этап фильтрации
значительно повышает эффективность работы, даже если только
часть экстрагента обрабатывается.Использование меди и ее соединений
Медь на протяжении веков уступала только железу по полезности. Металл и его соединения используются во всех сферах жизни от электротехническая, медицинская и сельскохозяйственная.
Использование металлической меди
Электротехническая промышленность является бенефициаром большинства стран мира. выпуск меди.Металл используется в производстве электротехники. такие аппараты, как катоды и провода.
Другое применение:
— Кровля
-Посуда
-Монеты
-Металл работы
-Сантехника
— Змеевики холодильника и кондиционера
-Сплавы напр. бронза, латунь
бронза, латунь
Применение соединений меди
Соединения меди наиболее широко используются в сельском хозяйстве. С момента открытия их токсичности для некоторых насекомых, грибки и водоросли эти соединения использовались в инсектицидах, фунгициды и предотвратить развитие водорослей в питьевой воде водохранилища.Поэтому они используются для борьбы с животными и болезни растений. Удобрения также часто дополняют соединения меди, например сульфат меди, чтобы увеличить почву плодородие и, следовательно, рост урожая.
Соединения меди также используются в фотографии и в качестве красителей. для стекла и фарфора.
Медь для хорошего здоровья
Медь — один из многих микроэлементов, необходимых для хорошего здоровья. Это
входит в простетические группы многих белков и ферментов и
таким образом, необходим для их правильного функционирования.Поскольку тело может
не синтезирует медь, ее необходимо принимать с пищей. Орехи, семена,
злаки, мясо (например, печень) и рыба — хорошие источники
медь.
Орехи, семена,
злаки, мясо (например, печень) и рыба — хорошие источники
медь.
Медь нашла применение и в медицине. Он использовался с самого начала раз при лечении ран груди и очистке воды. Это недавно было высказано предположение, что медь помогает предотвратить воспаление, связанное с артритом и такими заболеваниями. Продолжаются исследования лекарств, содержащих медь, для лечения этого и других условий.
Для получения дополнительной информации о важности меди для здоровья и дефицит меди см .: МатьПрирода и / или исследования витаминов Продукция
Соединения меди
Медь содержит множество соединений, многие из которых
цветные. Двумя основными степенями окисления меди являются +1 и
+2, хотя известны некоторые +3 комплексы. Соединения меди (I) представляют собой
ожидается, что они диамагнитны по природе и обычно бесцветны,
кроме случаев, когда цвет возникает в результате переноса заряда или
анион.Ион +1 имеет тетраэдрическую или квадратную плоскую геометрию. В
твердые соединения, медь (I) часто является более стабильным состоянием при
умеренные температуры.
В
твердые соединения, медь (I) часто является более стабильным состоянием при
умеренные температуры.
Ион меди (II) обычно является более стабильным состоянием в водной среде. решения. Соединения этого иона, часто называемые соединениями меди, обычно окрашены. На них влияет Искажения Яна Теллера и демонстрируют широкий спектр стереохимии с Преобладают четыре, пять и шесть координационных соединений. +2 ion часто демонстрирует искаженную тетраэдрическую геометрию.
Галогениды меди
Известно, что все галогениды меди (I) существуют, хотя
фторид в чистом виде пока не получен. Медь
хлориды, бромиды и йодиды бесцветны, диамагнитны
соединения. Они кристаллизуются при обычных температурах с
структура цинковой обманки, в которой атомы Cu тетраэдрически связаны
до четырех галогенов. Хлорид и бромид меди (I) представляют собой
получают путем кипячения кислого раствора ионов меди (II) в
избыток меди.При разбавлении белый CuCl или бледно-желтый
CuBr производится. Добавление растворимого йодида к водной
раствор ионов меди (II) приводит к образованию
осадок иодида меди (I), который быстро разлагается до Cu (I)
и йод.
Добавление растворимого йодида к водной
раствор ионов меди (II) приводит к образованию
осадок иодида меди (I), который быстро разлагается до Cu (I)
и йод.
Галогениды меди (I) плохо растворимы в воде и большей части медь в водном растворе находится в состоянии Cu (II). Несмотря на это, плохая растворимость соединений меди (I) увеличивается при добавление галогенид-ионов.В таблице ниже показаны некоторые свойства галогениды меди (I).
| Формула | Цвет | МП | Б.П. | Структура |
|---|---|---|---|---|
| CuCl | белый | 430 | 1359 | – |
| CuBr | белый | 483 | 1345 | – |
| CuI | белый | 588 | 1293 | Цинковая обманка |
Приготовлен восстановлением CuX 2 -> CuX;
за исключением F, который не был получен в чистом виде.

| Формула | Цвет | МП | Б.П. | м (BM) | Структура |
|---|---|---|---|---|---|
| CuF 2 | белый | 950 разложить | – | 1,5 | |
| CuCl 2 | коричневый | 632 | 993разложить | 1.75 | CdCl 2 |
| CuBr 2 | черный | 498 | – | 1,3 |
Известны все четыре галогенида меди (II), хотя йодид меди
быстро разлагается до йодида меди и йода. Желтый
хлорид меди (II) и почти черный бромид меди (II) являются
общие галогениды. Эти соединения принимают структуру с
бесконечные параллельные полосы квадрата CuX 4 шт.Медь
хлориды и бромиды хорошо растворимы в воде и в донорских
растворители, такие как ацетон, спирт и пиридин.
Галогениды меди (II) являются умеренными окислителями из-за Пара Cu (I) / Cu (II). В воде, где потенциал в значительной степени аква-комплексов, здесь не так много разница между ними, но в неводных средах окислительные (галогенирующая) мощность увеличивается последовательно; CuF 2 << CuCl 2 << CuBr 2 .
Их можно получить прямой реакцией с соответствующими
галогены:
Cu + F 2 → CuF 2 ;В качестве альтернативы они могут быть получены из CuX 2 .aq путем нагрев -> CuX 2
Cu + Cl 2 /450 C → CuCl 2 ;
Cu + Br 2 → CuBr 2
Оксиды меди
Оксиды меди (I) более стабильны, чем оксиды меди (II) при
высокие температуры.Оксид меди (I) встречается сам по себе как красный
куприт. В лаборатории снижение
Решение Фелинга
с редуцирующим сахаром, например глюкозой, образуется красный осадок. Тест достаточно чувствителен, чтобы произвести даже 1 мг сахара.
характерный красный цвет соединения. Закись меди может
также может быть приготовлен в виде желтого порошка путем контролируемого восстановления
щелочная соль меди (II) с гидразином. Термическое разложение
оксид меди (II) также дает оксид меди (I), поскольку последний имеет
большая термическая стабильность.Таким же методом можно приготовить
соединение из нитрата, карбоната меди (II) и
гидроксид.
Тест достаточно чувствителен, чтобы произвести даже 1 мг сахара.
характерный красный цвет соединения. Закись меди может
также может быть приготовлен в виде желтого порошка путем контролируемого восстановления
щелочная соль меди (II) с гидразином. Термическое разложение
оксид меди (II) также дает оксид меди (I), поскольку последний имеет
большая термическая стабильность.Таким же методом можно приготовить
соединение из нитрата, карбоната меди (II) и
гидроксид.
Оксид меди (II) встречается в природе в виде тенорита. Этот черный кристаллическое твердое вещество может быть получено пиролизом нитратные, гидроксидные или карбонатные соли. Он также образуется при порошковая медь нагревается на воздухе или в кислороде. В таблице ниже показаны некоторые характеристики оксидов меди.
| Формула | Цвет | Состояние окисления | МП |
|---|---|---|---|
| CuO | черный | Cu 2+ | 1026 разложить |
| Cu 2 O | красный | Cu + | 1230 |
Редокс-химия меди
Cu 2+ + e- → Cu + E = 0.15 В
Cu + + e- → Cu E = 0,52 В
Cu 2+ + 2e- → Cu E = 0,34 В
Принимая во внимание эти данные, будет видно, что любой окислитель достаточно силен, чтобы скрыть Cu в Cu + более чем достаточно силен, чтобы преобразовать Cu + в Cu 2+ (0,52 ср. 0,14 В). Это не так поэтому ожидается, что любые стабильные соли Cu + будут существовать в водный раствор.
Также может происходить диспропорционирование:
2Cu + → Cu 2+ + Cu E = 0.37 В или К = 10 6Координационные комплексы
Реакция EDTA 4- с медью (II) дает комплекс
где EDTA оказался пентадентатным НЕ гексадентатным, в отличие от
другие ионы M (II).
Cu (ЭДТА) 2-
Структура иона [Cu (ox) 2 ] 2- может быть описана как квадратный плоский или как искаженный октаэдр, когда упаковка в кристаллическая решетка.
 В случае натриевой соли
отдельные блоки параллельны в ячейке с медью
связаны с кислородом, координированным с медью в
единицы, сидящие как сверху, так и снизу, тогда как в
калийная соль, единицы не параллельны и при взгляде на три
единиц центральный почти под прямым углом к двум другим.
Здесь медь связана с одним из некоординированных атомов кислорода.
в блоках над и под ним.
В случае натриевой соли
отдельные блоки параллельны в ячейке с медью
связаны с кислородом, координированным с медью в
единицы, сидящие как сверху, так и снизу, тогда как в
калийная соль, единицы не параллельны и при взгляде на три
единиц центральный почти под прямым углом к двум другим.
Здесь медь связана с одним из некоординированных атомов кислорода.
в блоках над и под ним.Na + и K + соли [Cu (ox) 2 ] 2-
Cu (OH) 2 реагирует с NH 3 с образованием раствора который растворяет целлюлозу.Это эксплуатируется в промышленная подготовка района. Решения содержат тетраммины и пентаммины. С пиридином только тетрамины являются образуется, например, Cu (py) 4 SO 4 .
Взаимодействие меди (II) с аминокислотами широко изучено.
Почти во всех случаях продукт содержит группы в trans конфигурация, которая, как ожидается, будет более стабильной. В случае
глицина первым осажденным продуктом всегда является изомер цис- который преобразуется в транс- при нагреве. Увидеть
Лабораторное руководство для C31L
Больше подробностей.
Увидеть
Лабораторное руководство для C31L
Больше подробностей.
Аналитическое определение меди (II)
Полезный реагент для аналитического определения
Ион меди (II) представляет собой натриевую соль N, N-диэтилдитиокарбамата.
В разбавленных спиртовых растворах наличие следовых количеств
Cu 2+ обозначен желтым цветом, который может быть
измеряется спектрофотометром, а концентрация определяется
из сюжета Закона Пива.Комплекс
Cu (Et 2 dtc) 2 , который может быть выделен как
коричневое твердое вещество.
Cu (Et 2 dtc) 2
«Комплексы и переходные элементы первого ряда», Д. Николлс
«Основы неорганической химии», Ф.А. Коттон, Г. Уилкинсон и П.Л. Gaus
«Продвинутая неорганическая химия», Ф.А. Коттон, Дж. Уилкинсон, К.А. Мурильо и М. Бохманн,
«Химия элементов», Гринвуд и Эрншоу
вернуться на курс CHEM2101 (C21J) наброски
Вернуться в химию, UWI-Mona, Домашняя страница
Авторские права © 2000-2020 Роберт Джон
Ланкашир, все права защищены.
(с благодарностью Клиффа Райли и Джоди-Энн Сваби),
Кафедра химии Вест-Индского университета,
Кампус Мона, Кингстон 7, Ямайка.
Дата создания: июнь 2000 г. Ссылки проверены и / или последние изменен 28 сентября 2020 г.
URL http://wwwchem.uwimona.edu.jm/courses/copper.html
Медь | Введение в химию
Цель обучения
- Перечислите названия двух наиболее часто встречающихся степеней окисления меди.
Ключевые моменты
- Медь образует множество соединений со степенями окисления +1 и +2, которые часто называют одновалентной и медной, соответственно.
- Простейшие соединения меди представляют собой бинарные соединения (т.е. содержащие только два элемента). Основные соединения — оксиды, сульфиды и галогениды.
- Аминокислоты образуют очень прочные хелатные комплексы с медью (II).

Условия
- лиганд Ион, молекула или функциональная группа, которая связывается с другим химическим соединением с образованием более крупного комплекса. Координационный комплекс
- Класс соединений, в которых центральный атом металла (обычно переходный элемент) окружен группой ионов или молекул (лигандов).
Медь
Медь — пластичный металл с очень высокой теплопроводностью и электропроводностью; его символ — Cu, а его атомный номер — 29. Чистая медь мягкая и податливая; свежая поверхность имеет красновато-оранжевый цвет. Он используется как проводник тепла и электричества, строительный материал и входит в состав различных металлических сплавов.Его соединения обычно встречаются в виде солей меди (II), которые часто придают синий или зеленый цвет минералам, таким как бирюза, и широко используются в качестве пигментов. Ионы меди (II) растворимы в воде, что означает, что они действуют при низкой концентрации как бактериостатические вещества, фунгициды и консерванты для древесины. В достаточном количестве они ядовиты для высших организмов; в более низких концентрациях они являются незаменимым микроэлементом для всех высших растений и животных. У животных медь в основном содержится в печени, мышцах и костях.
В достаточном количестве они ядовиты для высших организмов; в более низких концентрациях они являются незаменимым микроэлементом для всех высших растений и животных. У животных медь в основном содержится в печени, мышцах и костях.
Медь образует множество соединений со степенями окисления +1 и +2, которые часто называют медью и медью соответственно. Он не реагирует с водой, но медленно реагирует с атмосферным кислородом, образуя слой коричнево-черного оксида меди. В отличие от окисления железа влажным воздухом, этот оксидный слой останавливает дальнейшую коррозию. Сероводород и сульфиды реагируют с медью с образованием различных сульфидов меди на поверхности. В последнем случае медь корродирует, как это видно, когда медь подвергается воздействию воздуха, содержащего соединения серы.
Оксид меди (I) Медь (I) имеет красный цвет. Простейшие соединения меди представляют собой бинарные соединения, т.е. содержащие только два элемента. Основные соединения — оксиды, сульфиды и галогениды. Известны как оксиды меди, так и оксиды меди. Галогениды меди с хлором, бромом и йодом хорошо известны, как и галогениды меди с фтором, хлором и бромом.
Известны как оксиды меди, так и оксиды меди. Галогениды меди с хлором, бромом и йодом хорошо известны, как и галогениды меди с фтором, хлором и бромом.
Медь, как и все металлы, образует координационные комплексы с лигандами. В водных растворах медь (II) существует как [Cu (h3O) 6 ] 2+ .{-} [/ латекс]
Сульфат тетраммин-меди (II) Медь (II) приобретает темно-синюю окраску в присутствии аммиачных лигандов. Медь образует множество соединений со степенями окисления +1 и +2, которые часто называют медью и медью соответственно. Он не реагирует с водой, но медленно реагирует с атмосферным кислородом, образуя слой коричнево-черного оксида меди. В отличие от окисления железа влажным воздухом, этот оксидный слой останавливает дальнейшую объемную коррозию. Сероводород и сульфиды реагируют с медью с образованием различных сульфидов меди на поверхности.В последнем случае медь корродирует, как это видно, когда медь подвергается воздействию воздуха, содержащего соединения серы.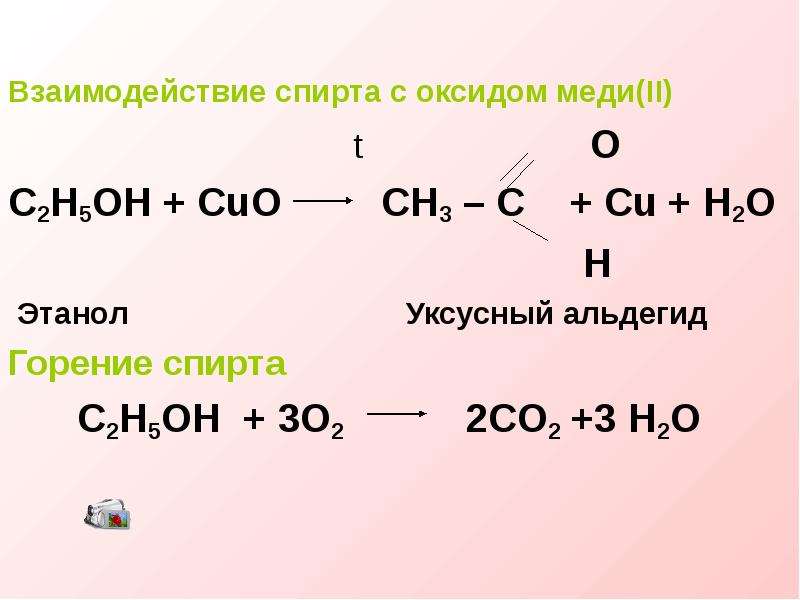 Кислородсодержащие растворы аммиака образуют водорастворимые комплексы с медью, а также кислород и соляная кислота, которые образуют хлориды меди, и подкисленный пероксид водорода, образующие соли меди (II). Хлорид меди (II) и медь объединяются с образованием хлорида меди (I).
Кислородсодержащие растворы аммиака образуют водорастворимые комплексы с медью, а также кислород и соляная кислота, которые образуют хлориды меди, и подкисленный пероксид водорода, образующие соли меди (II). Хлорид меди (II) и медь объединяются с образованием хлорида меди (I).
Простейшие соединения меди представляют собой бинарные соединения (т. Е. Содержащие только два элемента). Основные соединения — оксиды, сульфиды и галогениды.Известны как оксиды меди, так и оксиды меди. Среди множества сульфидов меди важными примерами являются сульфид меди (I) и сульфид меди (II). Галогениды меди с хлором, бромом и йодом хорошо известны, как и галогениды меди с фтором, хлором и бромом. Попытки получить иодид меди (II) приводят к получению йодида меди и йода.
Медь, как и все металлы, образует координационные комплексы с лигандами. В водных растворах медь (II) существует как [Cu (h3O) 6 ] 2+ .{-} [/ латекс]
Многие другие оксианионы образуют комплексы: к ним относятся ацетат меди (II), нитрат меди (II) и карбонат меди (II). Сульфат меди (II) образует синий кристаллический пентагидрат, который является наиболее известным соединением меди в лаборатории. Он используется в фунгициде, называемом бордосской смесью. Полиолы, соединения, содержащие более одной спиртовой функциональной группы, обычно взаимодействуют с солями двухвалентной меди. Например, соли меди используются для проверки восстанавливающих сахаров. В частности, при использовании реагента Бенедикта и раствора Фелинга присутствие сахара сигнализируется изменением цвета с синего меди (II) на красноватый оксид меди (I).Реагент Швейцера и родственные комплексы с этилендиамином и другими аминами растворяют целлюлозу. Аминокислоты образуют очень прочные хелатные комплексы с медью (II). Существует множество влажных химических тестов на ионы меди; один, например, с участием ферроцианида калия, который дает коричневый осадок с солями меди (II).
Сульфат меди (II) образует синий кристаллический пентагидрат, который является наиболее известным соединением меди в лаборатории. Он используется в фунгициде, называемом бордосской смесью. Полиолы, соединения, содержащие более одной спиртовой функциональной группы, обычно взаимодействуют с солями двухвалентной меди. Например, соли меди используются для проверки восстанавливающих сахаров. В частности, при использовании реагента Бенедикта и раствора Фелинга присутствие сахара сигнализируется изменением цвета с синего меди (II) на красноватый оксид меди (I).Реагент Швейцера и родственные комплексы с этилендиамином и другими аминами растворяют целлюлозу. Аминокислоты образуют очень прочные хелатные комплексы с медью (II). Существует множество влажных химических тестов на ионы меди; один, например, с участием ферроцианида калия, который дает коричневый осадок с солями меди (II).
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Этот конкретный ресурс использовал следующие источники:
Оксид меди (I) | Энциклопедия.com
ОБЗОР
Оксид меди (I) (KOPP-er one OK-side) также известен как оксид меди, красный оксид меди, протоксид меди, гемоксид меди и субоксид меди. Это желтоватое, красное или коричневое кристаллическое вещество, в зависимости от метода его приготовления. Не горит и устойчив на сухом воздухе. Во влажном воздухе он медленно превращается в оксид меди (II) (CuO). Это соединение использовалось людьми в течение тысяч лет, сначала в качестве пигмента в глазури, а затем в фунгицидах, электронных компонентах и промышленных реакциях.
В 1883 году оксид меди (I) был первым веществом, обладающим полупроводниковыми свойствами. Полупроводник проводит электрический ток, хотя и не так эффективно, как проводник, такой как медь, золото или серебро. Полупроводниковые компоненты в настоящее время широко используются в компьютерных микросхемах, хотя теперь они изготавливаются из кремния, а не из оксида меди (I).
КЛЮЧЕВЫЕ ФАКТЫ
ДРУГИЕ НАИМЕНОВАНИЯ:
См. Обзор.
ФОРМУЛА:
Cu 2 O
ЭЛЕМЕНТЫ:
Медь, кислород
ТИП СОЕДИНЕНИЯ:
Металлический оксид
СОСТОЯНИЕ:
Твердый
МОЛЕКУЛЯРНЫЙ ВЕС
09 г / моль
ТОЧКА ПЛАВЛЕНИЯ:
1235 ° C (2255 ° F)
ТОЧКА КИПЕНИЯ:
Разлагается при 1800 ° C (3300 ° F)
РАСТВОРИМОСТЬ:
Нерастворим в воде; растворим в неорганических кислотах, таких как соляная, серная и азотная кислоты.
КАК ЭТО ПРОИЗВОДИТСЯ
Оксид меди (I) встречается в природе в виде минерального куприта. Он образуется, когда самородная медь (медь как элемент) подвергается воздействию воздуха, хотя процесс происходит очень медленно. Оксид меди (I) также можно получить синтетически, подвергая металлическую медь воздействию высокой концентрации кислорода при повышенной температуре.Однако необходимо соблюдать осторожность, чтобы предотвратить полное окисление меди с образованием оксида меди (II). Также доступен ряд других промышленных методов синтеза оксида меди (I). Например, электролиз раствора хлорида натрия с использованием медных электродов приводит к образованию оксида меди (I).
Также доступен ряд других промышленных методов синтеза оксида меди (I). Например, электролиз раствора хлорида натрия с использованием медных электродов приводит к образованию оксида меди (I).
ОБЫЧНОЕ ИСПОЛЬЗОВАНИЕ И ПОТЕНЦИАЛЬНАЯ ОПАСНОСТЬ
Оксид меди (I) используется в качестве пигмента в фарфоровой глазури и витражах. В непрозрачном стекле он дает яркий кирпично-красный цвет, если используются достаточно крупные кристаллы.Более мелкие кристаллы дают желтоватый цвет. Использование оксида меди (I) в качестве пигмента в глазури восходит к временам Древнего Египта.
Многие необрастающие морские краски содержат оксид меди (I). Необрастающие краски — это краски, предотвращающие образование ракушек и других организмов на дне лодки. Соединение также используется как противогрибковое средство, вещество, убивающее плесень, ржавчину и другие виды грибков. Фунгициды на основе оксида меди (I) обычно используются на различных культурах, подверженных атаке таких организмов. Оксид меди (I) действует, подавляя рост спор грибов (из которых развиваются новые растения), а не убивает зрелые грибы.
Оксид меди (I) действует, подавляя рост спор грибов (из которых развиваются новые растения), а не убивает зрелые грибы.
Оксид меди (I) используется в фотоэлементах, которые представляют собой элементы, вырабатывающие электрический ток при воздействии света. Фотоэлектрические материалы обычно являются полупроводниками. Фотоэлементы из оксида меди (I) не вырабатывают много энергии, но они быстро реагируют на изменения уровня света. Это свойство делает их полезными в качестве детекторов света, которые имеют множество приложений, от камер с настройками автоматической регулировки до автоматических открывателей дверей и охранной сигнализации.
В 1980-х годах было обнаружено, что керамическая форма оксида меди (I) обладает сверхпроводящими свойствами при температурах выше, чем известные ранее сверхпроводники. Сверхпроводники обладают способностью проводить электрический ток практически без сопротивления. Как только в сверхпроводнике возникает ток, он продолжает проходить через материал практически бесконечно. Исследования сверхпроводников могут привести к появлению новых технологий, от более дешевой электроэнергии до высокоскоростных поездов на магнитной подушке.
Исследования сверхпроводников могут привести к появлению новых технологий, от более дешевой электроэнергии до высокоскоростных поездов на магнитной подушке.
Интересные факты
- Медь иногда используется для кровли известных зданий, таких как художественные музеи или столицы штатов. Со временем на медном металле образуется патина — тонкий цветовой слой, который придает крыше элегантности. Патина состоит в основном из оксида меди (I).
- В 1904 году немецкий физик Вильгельм Халльвакс (1859–1922) обнаружил, что комбинация металлической меди и оксида меди (I) проявляет фотоэлектрический эффект, при котором луч света заставляет электричество течь через материал.
Воздействие умеренного количества оксида меди (I) может вызывать раздражение кожи, глаз и дыхательной системы. При нагревании выделяются пары меди, которые могут вызывать симптомы, похожие на простуду, и могут обесцветить кожу и волосы. При проглатывании оксид меди (I) имеет металлический привкус и может вызвать рвоту, тошноту и боль в желудке. В самых тяжелых случаях оксид меди (I) может вызвать черный или дегтеобразный стул, желтуху и кровавую рвоту с долгосрочным повреждением печени. В окружающей среде оксид меди (I) очень токсичен для рыб и ракообразных.
В самых тяжелых случаях оксид меди (I) может вызвать черный или дегтеобразный стул, желтуху и кровавую рвоту с долгосрочным повреждением печени. В окружающей среде оксид меди (I) очень токсичен для рыб и ракообразных.
слов, которые нужно знать
- ЭЛЕКТРОЛИЗ
- Процесс, в котором электрический ток используется для осуществления химических изменений.
- ОКИСЛИТЬ
- Для соединения с кислородом.
- ФОТОЭЛЕКТРИЧЕСКАЯ ЯЧЕЙКА
- Устройство, вырабатывающее электричество при воздействии света.
- ПОЛУПРОВОДНИК
- Вещество, которое позволяет электричеству проходить через него с меньшей скоростью, чем проводник, но с большей, чем непроводящее вещество.
- СВЕРХПРОВОДНИК
- Вещество, которое позволяет электричеству проходить через него с очень небольшим сопротивлением.
- СИНТЕЗ
- Химическая реакция, в которой некоторый желаемый химический продукт получается из простых исходных химикатов или реагентов.

ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
«Куприт». Дейл Минералз Интернэшнл. http://www.webmineral.com/data/Cuprite.shtml (по состоянию на 3 октября 2005 г.).
«Закись меди.»Hummel Croton, Inc. http://www.hummelcroton.com/msds/cu2o_m.html (доступ 3 октября 2005 г.).
Patnaik, Pradyot. Справочник по неорганическим химическим веществам . Нью-Йорк: McGraw-Hil, 2003, 271-273.
Richardson, HW, ed. Справочник по соединениям меди и их применению . Нью-Йорк: Марсель Деккер, 1997.
См. Также Оксид меди (II)
Химия меди — химические либретексты
Медь относится к тому же семейству периодической таблицы, что и серебро и золото, поскольку каждое из них имеет по одному s-орбитальному электрону поверх заполненной электронной оболочки, которая образует металлические связи.Это сходство в электронной структуре делает их похожими по многим характеристикам. Все они обладают очень высокой теплопроводностью и электропроводностью, и все они являются ковкими металлами. Среди чистых металлов при комнатной температуре медь занимает второе место по электропроводности и теплопроводности после серебра.
Среди чистых металлов при комнатной температуре медь занимает второе место по электропроводности и теплопроводности после серебра.
Введение
Использование меди уходит корнями в далекую историю. Медные бусы были найдены на территории современного Ирака, датируемой 9000 годом до нашей эры. Этот металл относительно легко добывать и обрабатывать, что способствовало его раннему и широкому использованию.Однако из-за своей мягкости он не подходит для изготовления надежных инструментов и оружия. Первые мастера по металлу еще в 3000 году до нашей эры научились сочетать медь с другими металлами для производства более прочных сплавов. Два примера — латунь (медь и цинк) и бронза (медь и олово). Символ и название меди происходят от латинского cuprum , что буквально означает «с острова Кипр», одного из первых источников медной руды.
До 1982 года гроши США состояли из чистой меди. Сейчас это в основном цинковые с тонкой медной оболочкой.Большая часть добываемой сегодня меди очищается и вытягивается в проволоку для использования в электротехнической промышленности. Значительная часть также используется при производстве водопроводных труб. Медь, конечно, имеет характерный цвет, который узнает большинство людей. Это один из лучших проводников электричества, устойчивый к коррозии от большинства кислот (кроме азотной и горячей концентрированной серной). При воздействии элементов в течение определенного периода времени на нем образуется зеленоватый налет или патина, представляющая собой карбонат меди (II), защитное покрытие, предотвращающее дальнейший износ.
Значительная часть также используется при производстве водопроводных труб. Медь, конечно, имеет характерный цвет, который узнает большинство людей. Это один из лучших проводников электричества, устойчивый к коррозии от большинства кислот (кроме азотной и горячей концентрированной серной). При воздействии элементов в течение определенного периода времени на нем образуется зеленоватый налет или патина, представляющая собой карбонат меди (II), защитное покрытие, предотвращающее дальнейший износ.
Возникновение и добыча меди
Медь встречается как в смешанном, так и в свободном состоянии, а также во многих рудах. Важные руды меди — это медный колчедан (\ (CuFeS_2 \)), куприт и медный глянец. Медные руды в основном находятся на севере Индии. Извлечение меди также включает много этапов. Руда, используемая для добычи, — это медный колчедан, который измельчается, концентрируется и затем нагревается в присутствии воздуха. Во время нагревания влага удаляется, и медный колчедан превращается в сульфид железа и сульфид меди.
\ [2CuFeS_2 + O_2 \ вправо Cu_2S + 2FeS + SO_2 \]
Доменная печь предназначена для нагрева смеси обожженной руды, порошкообразного кокса и песка. В доменной печи протекают реакции окисления. Сульфид железа образует оксид железа, который соединяется с кремнеземом и образует шлак (\ (FeSiO_2 \)).
\ [2FeS + 3O_2 \ вправо 2FeO + 2SO_2 \]
\ [FeO + SiO_2 \ стрелка вправо FeSiO_3 \]
Сульфид меди образует закись меди, которая частично превращается в сульфид меди.
\ [Cu_2S + 3 O_2 \ стрелка вправо 2Cu_2O + 2SO_2 \]
\ [Cu_2O + FeS \ стрелка вправо Cu_2S + FeO \]
Этот сульфид меди содержит некоторое количество сульфида железа, и его называют штейном. Штейн удаляется из основного выхода доменной печи. Удаленный штейн перемещается в конвертер Бессемера, который внутри футерован оксидом магния. В этом конвертере есть трубы, по которым подается горячий воздух и \ (SiO_2 \). В этом конвертере \ (Cu_2S \) преобразуется в \ (Cu_2O \), а \ (FeS \) преобразуется в \ (FeO \). Закись железа образует шлак с \ (SiO_2 \). Образовавшаяся закись меди вступает в реакцию с Cu2S и образует медь.
Закись железа образует шлак с \ (SiO_2 \). Образовавшаяся закись меди вступает в реакцию с Cu2S и образует медь.
\ [2Cu_2O + Cu_2S \ стрелка вправо 6Cu + SO_2 \]
Образованная таким образом медь подлежит очистке электролизом.
Реакции ионов меди (II) в растворе
Самый простой ион, который образует медь в растворе, — это типичный синий ион гексааквакоппера (II) — [Cu (H 2 O) 6 ] 2+ .
Реакции ионов гексааквакоппера (II) с гидроксид-ионами
Ионы гидроксида (например, из раствора гидроксида натрия) удаляют ионы водорода из лигандов воды, присоединенных к иону меди.После удаления иона водорода из двух молекул воды у вас остается комплекс без заряда — нейтральный комплекс. Он не растворяется в воде, и образуется осадок.
Цветовая кодировка показывает, что это не реакция обмена лиганда. Кислороды, которые первоначально были присоединены к меди, все еще присоединены к нейтральному комплексу.
В пробирке изменение цвета:
Реакции ионов гексааквакоппера (II) с раствором аммиака
Аммиак действует как основание и лиганд.{2+} + H_2O \]
Примечание
Вы можете задаться вопросом, почему это второе уравнение дается исходя из исходного гексааква-иона, а не нейтрального комплекса. Объяснить, почему осадок снова растворяется, довольно сложно. Вы найдете полное объяснение реакции между гексааква-ионами и раствором аммиака на странице.
Изменения цвета:
Взаимодействие ионов гексааквакоппера (II) с карбонат-ионами
Вы просто получаете осадок, который можно представить как карбонат меди (II).{2-} + 6H_2O \]
Поскольку реакция обратима, вы получаете смесь цветов из-за обоих комплексных ионов. Цвет иона тетрахлоркупрата (II) также можно описать как оливково-зеленый или желтый. Если вы добавите воду в зеленый раствор, он вернется к синему цвету.
Реакция ионов гексааквакоппера (II) с иодид-ионами
Ионы меди (II) окисляют ионы йодида до молекулярного йода, а в процессе сами восстанавливаются до йодида меди (I).
Исходная грязно-коричневая смесь разделяется на грязно-белый осадок иодида меди (I) в растворе йода.- (водн.) \]
По мере того, как раствор тиосульфата натрия течет из бюретки, цвет йода бледнеет. Когда все почти закончится, вы добавляете немного раствора крахмала. Он обратимо реагирует с йодом с образованием темно-синего комплекса крахмал-йод, который намного легче увидеть.
Вы добавляете последние несколько капель раствора тиосульфата натрия медленно, пока синий цвет не исчезнет. Если вы проследите пропорции реагирующих веществ с помощью двух уравнений, вы обнаружите, что на каждые 2 моля ионов меди (II), с которыми вы должны были начать, нужно 2 моля раствора тиосульфата натрия.Если вам известна концентрация раствора тиосульфата натрия, легко вычислить концентрацию ионов меди (II).
Некоторые основные химические вещества меди (I)
Диспропорционирование ионов меди (I) в растворе
Химический состав меди (I) ограничен реакцией, которая происходит с участием простых ионов меди (I) в растворе. Это хороший пример диспропорционирования — реакции, в которой что-то окисляется и восстанавливается. Ионы меди (I) в растворе диспропорционируют с образованием ионов меди (II) и осадка меди.Реакция:
Любая попытка получить простое соединение меди (I) в растворе приводит к этому. Например, если вы реагируете оксидом меди (I) с горячей разбавленной серной кислотой, вы можете ожидать получения раствора сульфата меди (I) и воды. Фактически вы получаете коричневый осадок меди и синий раствор сульфата меди (II) из-за реакции диспропорционирования.
\ [Cu_2O + H_2SO_4 \ стрелка вправо Cu + CuSO_4 + H_2O \]
Стабилизация степени окисления меди (I)
Мы уже видели, что йодид меди (I) образуется в виде осадка не совсем белого цвета, если вы добавляете раствор йодида калия к раствору, содержащему ионы меди (II).Иодид меди (I) практически не растворяется в воде, поэтому реакции диспропорционирования не происходит. Подобным образом хлорид меди (I) может быть получен в виде белого осадка (реакция описана ниже). Если его отделить от раствора и как можно быстрее высушить, он останется белым. Однако при контакте с водой он медленно становится синим, поскольку образуются ионы меди (II). Реакция диспропорционирования происходит только с простыми ионами меди (I) в растворе.
Образование комплексов меди (I) (кроме комплекса с водой в качестве лиганда) также стабилизирует степень окисления меди (I).Например, оба [Cu (NH 3 ) 2 ] + и [CuCl 2 ] — представляют собой комплексы меди (I), которые не вызывают диспропорционирования . Хлорсодержащий комплекс образуется, если оксид меди (I) растворяется в концентрированной соляной кислоте. Вы можете представить себе это в двух стадиях. Сначала получается хлорид меди (I):
\ [Cu_2O _ {(s)} + 2HCl _ {(водный)} \ rightarrow 2CuCl _ {(s)} + H_2O _ {(l)} \]
Но в присутствии избытка хлорид-ионов из HCl он реагирует с образованием стабильного растворимого комплекса меди (I).-_ {(водный)} \]
Вы можете получить белый осадок хлорида меди (I) (упомянутый выше), добавив к этому раствору воду. Это полностью изменяет последнюю реакцию за счет удаления лишнего хлорид-иона.
Авторы и авторство
Медь против оксида меди: в чем разница?
Медь — старейший из известных металлов, используемый человечеством для изготовления инструментов и украшений, помогающий сформировать переход от каменного века к бронзовому веку.После тысячелетий использования дерева, камней и костей животных медь изменила способности древних народов, подтолкнув их к изобретениям плавки руды, добычи полезных ископаемых и обработки металлов. В результате этих навыков, оттачиваемых поколениями, культуры по всему миру сделали следующий шаг, объединив металлические руды для создания более твердых металлов, таких как бронза, комбинация меди и олова. В чем особенность меди и как она выведет нас на новый уровень безопасности в сфере здравоохранения?
Медь
Красновато-оранжевый металл, медь обладает высокой проводимостью тепла и электричества.Он разделяет эту способность с серебром и золотом, поскольку каждый из этих элементов имеет электрон «свободного агента», который открыт для переговоров о химических связях с любым окружающим доступным атомом. Все остальные электроны прочно сжаты, чтобы оставаться со своей командой, но на этот можно легко повлиять на перенос.
Металлическая связь медной проволоки, например, создает кристаллическую форму с морем электронов, которые находятся в состоянии притяжения ко всем окружающим ядрам, существующих в стабильном общем состоянии.В результате этих валентных электронов, когда электричество или тепло подводятся к проводу, эти свободные электроны перемещаются через материал, создавая ток.
Валентный электрон имеет плохую репутацию из-за своих способностей к халявной загрузке, но он ничего не может поделать с тем, что находится там один, с более слабой связью с командой.Прямо под электронным уровнем свободного агента находится уровень, забитый электронами — на этот уровень больше ничего не поместится. Это означает, что перенос электронов с этого уровня очень затруднен.В результате металлические связи меди существуют только на этом внешнем слое свободно движущихся электронов, что является довольно слабой связью для металлов. Вот почему медь такая мягкая, ее легко гнуть и резать.
Медь окисленная
Тот же самый электрон свободного агента играет роль в окислении или ржавлении. Когда на медь воздействуют молекулы воды (два водорода и один кислород), этот свободный электрон передается соседнему атому кислорода , связывая его в молекулу.Если с молекулой кислорода связан только один атом меди, он называется оксидом меди. Если два атома меди связаны с атомом кислорода, это оксид меди. Оксид меди считается «полностью окисленным», в то время как закись меди все еще находится в активном состоянии.
Ключом к закиси меди, аспекту, который делает ее чрезвычайно эффективной в качестве биоцида, является это активное состояние. Он по-прежнему производит активных форм кислорода , высокореактивных молекул. Это нестабильные молекулы, которые вызывают повреждение клеточных структур.
Что лучше?
Когда дело доходит до уничтожения бактерий, вам нужны высокореактивные молекулы. Они очень хорошо отталкивают электроны, высвобождают свободные радикалы и, как правило, разрушают окружающую среду. В случае патогена они прорывают мембраны и разрушают механизмы, производящие ДНК, как горячий нож сквозь масло. Медь должна окисляться, чтобы достичь того же уровня токсичности, и хотя оксид меди окисляется, он находится в более стабильной степени окисления, поэтому он не причиняет такого же ущерба, как его брат, закись меди.
Так почему закись меди настолько токсична для бактерий и безопасна для человека? Все сводится к размеру. Поверхность, пропитанная закисью меди в бактериальной клетке, представляет собой высокотоксичный ландшафт из-за соотношения Cu2O к бактериальной клетке. Так что красивая столешница или стол для нас — это ядовитое минное поле для болезнетворных микроорганизмов. ( Как нам нравится! )
Примечание редактора: этот пост был первоначально опубликован в июле 2015 года и был обновлен для обеспечения свежести, точности и полноты.
Оценка моделей растворимости и летучести соединений меди в условиях генерации пара (конференция)
Палмер Д. и Петров А. Оценка моделей растворимости и летучести соединений меди в условиях генерации пара . США: Н. П., 1999.
Интернет.
Палмер, Д., и Петров, А. Оценка моделей растворимости и летучести соединений меди в условиях парообразования . Соединенные Штаты.
Палмер Д. и Петров А. Вс.
«Оценка моделей растворимости и летучести соединений меди в условиях парообразования». Соединенные Штаты. https://www.osti.gov/servlets/purl/10472.
@article {osti_10472,
title = {Оценка моделей растворимости и летучести соединений меди в условиях парообразования},
author = {Палмер, Д. и Петров, А.},
abstractNote = {Снижение эффективности электростанций со смешанной металлургией из-за переноса и осаждения меди и ее оксидов в турбинах высокого давления признано одной из ключевых проблем, которые необходимо решить в мировой энергетической отрасли.В этом контексте наиболее важной проблемой, которую необходимо решить, является растворимость и летучесть соединений меди в условиях парообразования. В этой статье представлена оценка различных моделей конечной летучести по растворимости для соединений меди и представлено сравнение расчетных данных с данными испытаний.

 8.1
8.1 9.1
9.1 2.1а, 3.7.1, 3.8.1, 3.9.1
2.1а, 3.7.1, 3.8.1, 3.9.1 д.а.) ОКП 26 1121
д.а.) ОКП 26 1121 Массовая доля железа (Fe), %, не более
Массовая доля железа (Fe), %, не более Массовая доля суммы натрия, калия и кальция (Na+K+Ca), %, не более
Массовая доля суммы натрия, калия и кальция (Na+K+Ca), %, не более 0,02 до 0,05
0,02 до 0,05

 Ионы меди, присутствовавшие в
органический экстрагент растворяется в растворе электролита.
чтобы получить медь, содержащую «богатый электролит». Здесь снова там
это фазовое разделение. Вторая органическая фаза — бесплодная
органический экстрагент, в то время как вторая водная фаза является «богатой»
электролит ». Бесплодный органический экстрагент затем рециркулируют для
повторное использование в приложении к выщелачиванию.
Ионы меди, присутствовавшие в
органический экстрагент растворяется в растворе электролита.
чтобы получить медь, содержащую «богатый электролит». Здесь снова там
это фазовое разделение. Вторая органическая фаза — бесплодная
органический экстрагент, в то время как вторая водная фаза является «богатой»
электролит ». Бесплодный органический экстрагент затем рециркулируют для
повторное использование в приложении к выщелачиванию. 15 В
15 В 

Leave A Comment