ЕГЭ. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Строение атома 11 класс
Тема 2: Строение атома. Периодический закон
Урок 4: ЕГЭ. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Строение атома
- Видео
- Тренажер
- Теория
Заметили ошибку?
Задания с выбором ответов
|
Вопрос |
Комментарий |
|
А1. Из каких частиц состоит атомное ядро?
|
Атом – это электронейтральная частица, состоящая из протонов, нейтронов и электронов. Протоны и нейтроны входят в состав ядра атома, а электроны вращаются вокруг. Правильный ответ 2. |
|
А2. Что такое изотопы?
|
Изотопы – это атомы одного химического элемента. У них одинаковое число электронов и протонов в атоме, но разное число нейтронов и поэтому разная масса. Правильный ответ 3. |
|
А3. Что называется химическим элементом?
|
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Правильный ответ 1. |
|
А4. Какая частица состоит из 8 протонов, 10 нейтронов и 8 электронов?
|
Находим в периодической системе элемент № 8. Это кислород. Прибавив к 8 протонам 10 нейтронов, получим массу атома 18. Это 18О. Правильный ответ 2. |
|
А5. Электронная формула атома химического элемента – 1s22s22p63s23p4. Укажите знак элемента и формулу его высшего оксида.
|
Нужно просуммировать количество электронов, которое равно количеству протонов.
Правильный ответ 3. |
|
А6. Наиболее сильно выражены металлические свойства у:
|
Чем левее и ниже элемент расположен в Периодической системе, тем ярче выражены его металлические свойства. Все приведенные элементы, кроме фосфора, находятся в 6 группе. Фосфор – это типичный неметалл. Теллур (Те) находится ниже всех в группе. Правильный ответ 4. |
|
А7. Число электронов в атоме равно:
|
Атом – это электронейтральная частица, поэтому число электронов равно числу протонов. Правильный ответ 2. |
|
А8. К р-элементам относится:
|
Al находится в III-A группе. Электронное строение внешнего энергетического уровня …3s23p1. Правильный ответ 4. |
|
А9. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
|
По группе сверху вниз атомные радиусы увеличиваются, а по периоду слева направо – уменьшаются.
Правильный ответ 2. |
|
А10. Химический элемент расположен в IV периоде I-A группе.
|
Это 19К. Сумма электронов в ряду должна быть равна 19.
Правильный ответ 3. |
|
А11. Бром – это элемент
|
Правильный ответ 3. |
|
А12. Элементу с зарядом ядра +12 соответствует высший оксид:
|
По заряду ядра находим этот элемент в Периодической системе.
Правильный ответ 1. |
|
А13. Электроное строение внешнего энергeтического уровня атома кремния: 1. …2s22p2 2. …3s23p2 3. …2s22p4 4. …3s23p4 |
Кремний находится в 3-ем периоде, поэтому у него три энергетических уровня. Не учитываем варианты с цифрой 2. Так как Si – в IV группе, то валентных электронов 4. Только во втором варианте сумма электрона равна 4.
Правильный ответ 2. |
Задания на соответствие
Задания с кратким ответом
В3. Химический элемент железо представлен в природе несколькими изотопами:  Определить, сколько протонов содержат атомы всех этих изотопов.
Определить, сколько протонов содержат атомы всех этих изотопов.
При обозначении изотопов вверху пишется массовое число, т. е. сумма масс протонов и нейтронов. Для определения числа протонов нужно посмотреть положение железа в Периодической системе. Порядковый номер железа – 26, значит, ядро атома железа содержит 26 протонов.
Правильный ответ 26.
В4. Определить, сколько нейтронов содержит ядро атома изотопа неона-22.
Для определения числа нейтронов нужно посмотреть положение неона в Периодической системе. Порядковый номер неона – 10. Это количество протонов. Вычитаем из массового числа количество протонов, получаем число нейтронов. Это 12.
Правильный ответ 12.
В5. Какой заряд ядра имеют изотопы химического элемента фтора?
Порядковый номер фтора – 9. Значит, заряд его ядра будет равен +9.
Правильный ответ +9
В6. Ядро атома одного из изотопов калия содержит 21 нейтрон.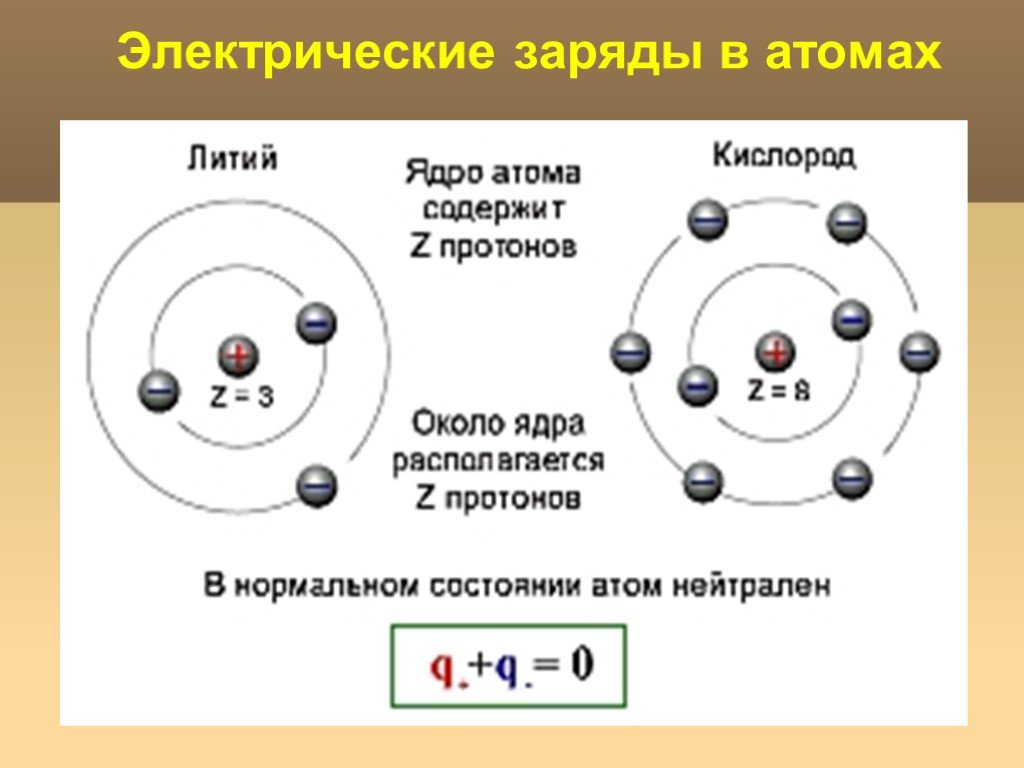 Определить массовое число данного изотопа.
Определить массовое число данного изотопа.
Массовое число равно сумме количества нейтронов и протонов. Нужно сложить число протонов (19) и число нейтронов (21).
Правильный ответ 40.
В7. Определить число нейтронов в ядре атома фосфора -31.
Вычитаем из массового числа (31) его порядковый номер (15) получаем число нейтронов. Это 16.
Правильный ответ 16.
В8. Под номерами 1-3 в колонке слева приведены ряды химических элементов. Укажите, какими буквами в колонке справа обозначены закономерности, на основе которых составлен каждый из этих рядов.
|
1. Na, Mg, Al, Si, P, S, Cl |
А) Электроотрицательность уменьшается |
|
2. F, O, N, Cl |
Б) Изменяется характер химических свойств высших оксидов: основные свойства ослабевают, кислотные усиливаются |
|
3. |
В) Неметалличность свойств простых веществ, образованных химическими элементами, усиливается |
|
|
Г) Степени окисления атомов химических элементов в соединении с кислородом увеличиваются |
|
|
Д) Степени окисления атомов химических элементов в соединении с водородом увеличиваются |
|
|
Е) Радиусы атомов увеличиваются |
|
|
Ж) Степень окисления атомов в высших оксидах одинакова |
Комментарий к В8. При решении этого задания нужно вспомнить таблицу, которая приводилась в предыдущем уроке.
Закономерности изменения периодических свойств приведены в Табл. 1.
1.
|
Параметр |
По группе вниз |
По периоду вправо |
|
Заряд ядра |
Увеличивается |
Увеличивается |
|
Число валентных электронов |
Не меняется |
Увеличивается |
|
Число энергетических уровней |
Увеличивается |
Не меняется |
|
Радиус атома |
Увеличивается |
Уменьшается |
|
Электроотрицательность |
Уменьшается |
Увеличивается |
|
Металлические свойства |
Увеличиваются |
Уменьшаются |
|
Степень окисления в высшем оксиде |
Не меняется |
Увеличивается |
|
Степень окисления в водородных соединениях (для элементов IV-VII групп) |
Не меняется |
Увеличивается |
Табл.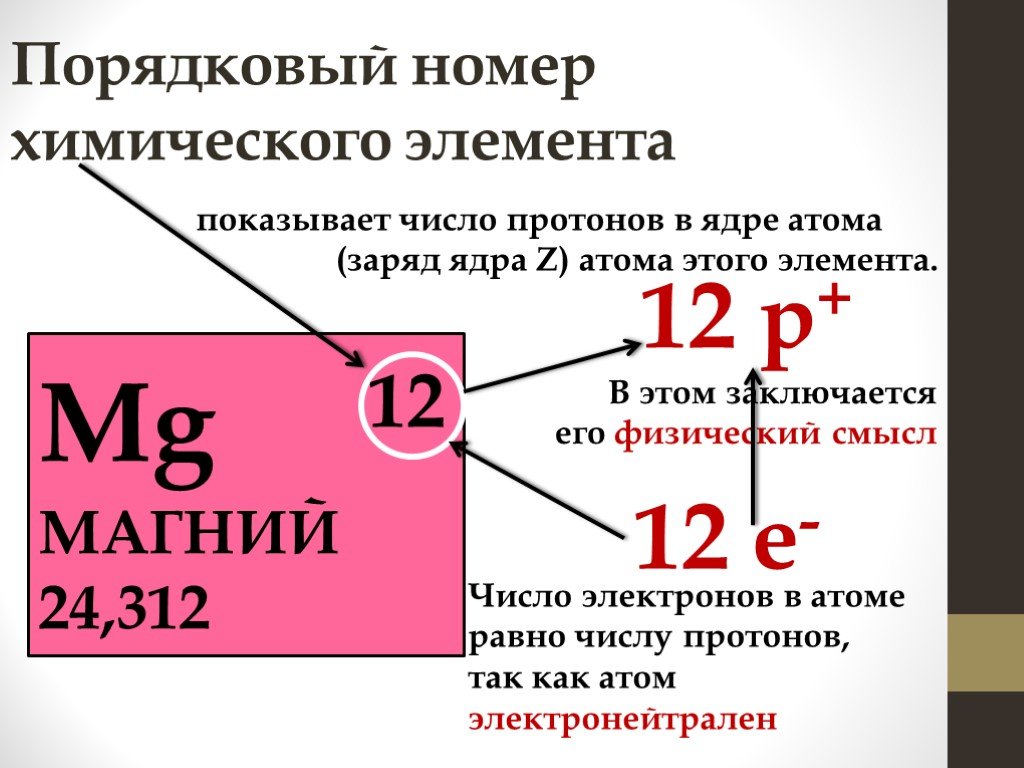 1.
1.
Представленные в вопросе элементы находятся либо в одном периоде, либо в одной группе.
- Na, Mg, Al, Si, P, S, Cl соответствуют варианты Б, В, Г
- F, O, N, Cl не соответствуют ни один из вариантов
- Be, Mg, Ca, Sr, Ba соответствуют варианты А, Е, Ж
Правильный ответ 1-Б В Г; 2-; 3-А Е Ж.
Задания с развернутым ответом
|
Вопрос |
Комментарий |
|
С1. Опишите химические свойства элемента с порядковым номером 23 по его положению в Периодической системе. |
Элемент № 23 – это ванадий V. Это металл, т. к. он находится в побочной подгруппе V группы, в 4-ом периоде. Его электронная конфигурация: 1s22s22p63s23p64s23d3. Летучих водородных соединений не образует. Высший оксид V2O5 – кислотный оксид. Как металл отдает свои валентные электроны. |
|
С2. Элемент образует высший оксид состава ЭО3. В летучем водородном соединении массовая доля водорода составляет 5,88 %. Рассчитайте относительную атомную массу элемента и назовите его. |
По формуле высшего оксида понятно, что элемент находится в VI группе. Формула водородного соединения – Н2Э. Массовая доля равна отношению массы элемента к суммарной массе соединения. Пусть атомная масса элемента будет Х. Тогда , отсюда Х = 200 : 5,88 — 2 = 32. Значит этот элемент – сера S. |
Подведение итога урока
На уроке были рассмотрены задачи ЕГЭ по теме «Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома». Мы научились характеризовать общие свойства химических элементов и их соединений на основе положения в химической системе Д. И. Менделеева.
Список литературы
- Рудзитис Г.
 Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. - Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
- Учебно-тренировочные материалы для подготовки к единому государственному экзамену. Химия / Каверина А. А., Добротин Д. Ю., Медведев Ю. Н., Корощенко А. С. – М.: Интеллект- Центр, 2011.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Официальный информационный портал Единого Государственного Экзамена (Источник)
- Интернет-портал «chemport.ru» (Источник)
- Интернет-портал «Химик» (Источник)
Домашнее задание
- №№ 1-3 (с. 7) Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.
 Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. - Какие закономерности наблюдают в изменении атомных радиусов в периодах слева направо и при переходе от одного периода к другому?
- Высший оксид состава RO3 образует элемент с электронной конфигурацией внешнего электронного слоя: 1) ns2np1; 2) ns2np3; 3) ns2np4; 4) ns2np6. Назовите этот элемент.
Заметили ошибку?
Расскажите нам об ошибке, и мы ее исправим.Видеоурок: ЕГЭ. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Строение атома по предмету Химия за 11 класс.
Физики из России узнали, как часто нейтроны «сбегают» из атомов
https://ria.ru/20170817/1500530516.html
Физики из России узнали, как часто нейтроны «сбегают» из атомов
Физики из России узнали, как часто нейтроны «сбегают» из атомов — РИА Новости, 17. 08.2017
08.2017
Физики из России узнали, как часто нейтроны «сбегают» из атомов
. Физики из России и Франции выяснили, как часто происходят распады ядер легких элементов, при которых один из их нейтронов совершает «побег», сведения о чем… РИА Новости, 17.08.2017
2017-08-17T13:52
2017-08-17T13:52
2017-08-17T13:52
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/104357/12/1043571294_228:0:2000:997_1920x0_80_0_0_9a060f72f5d4c010c0b22610dc71c749.jpg
дубна
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2017
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.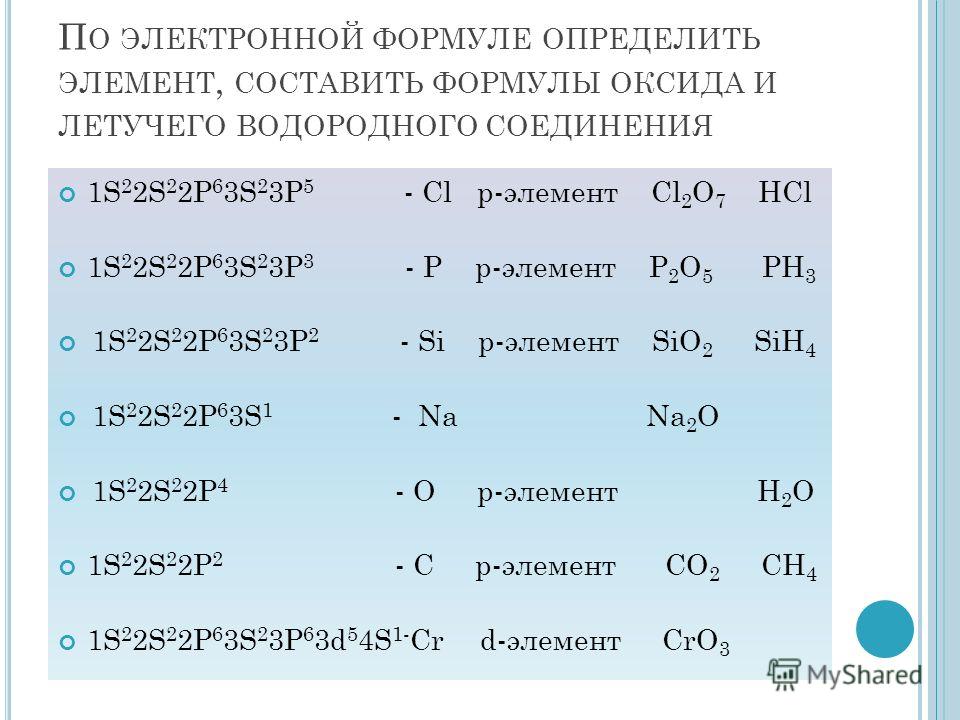 ru/docs/about/copyright.html
ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
1920
1080
true
1920
1440
true
https://cdnn21.img.ria.ru/images/104357/12/1043571294_671:0:2000:997_1920x0_80_0_0_f616cf593413bf29c5bf10f2ac45ea85.jpg
1920
1920
true
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
открытия — риа наука, дубна, объединенный институт ядерных исследований, российский научный фонд
Открытия — РИА Наука, Наука, Дубна, Объединенный институт ядерных исследований, Российский научный фонд
МОСКВА, 17 авг – РИА Новости. Физики из России и Франции выяснили, как часто происходят распады ядер легких элементов, при которых один из их нейтронов совершает «побег», сведения о чем помогут космологам раскрыть тайны химической эволюции Вселенной, говорится в статье, опубликованной в журнале Physical Review C.
Физики из России и Франции выяснили, как часто происходят распады ядер легких элементов, при которых один из их нейтронов совершает «побег», сведения о чем помогут космологам раскрыть тайны химической эволюции Вселенной, говорится в статье, опубликованной в журнале Physical Review C.
«Эти данные позволяют определить вероятность образования легких элементов, количество протонов в атомных ядрах которых варьируется от 10 до 70. Эта характеристика распада имеет большое значение при изучении процесса синтеза тяжелых элементов в недрах звезд в астрофизике», — рассказал Юрий Пенионжкевич из Объединенного института ядерных исследований РАН в Дубне, чьи слова приводит пресс-служба Российского научного фонда.
Ученые пока не нашли следов «новой физики» в распаде нейтронов
NaN , NaN:NaN
Все ядра элементов тяжелее водорода состоят из двух типов элементарных частиц – протонов, заряженных положительно, и нейтронов, не имеющих заряда. То, как много протонов и нейтронов содержит атом, определяет то, насколько стабильным он является.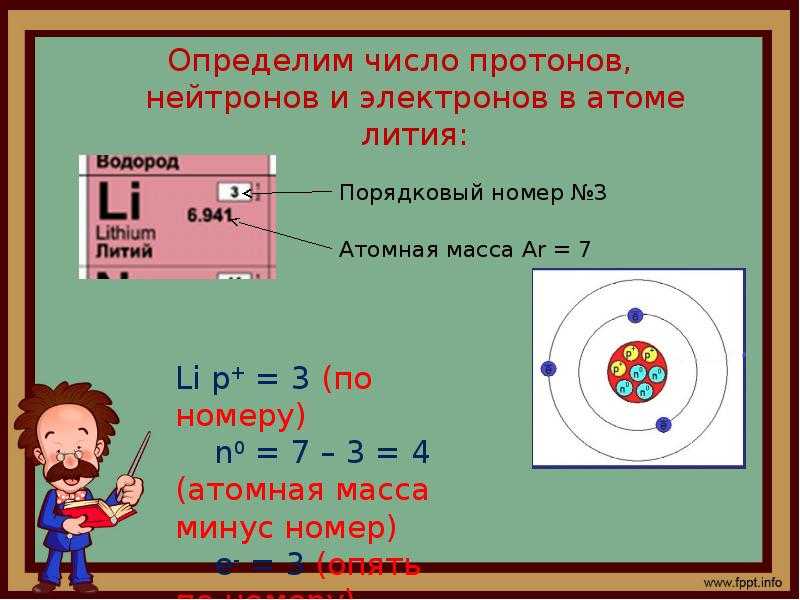 При избытке и того, и другого типа частиц ядро старается избавиться от «лишних» протонов или нейтронов, превращая один из нейтронов в протон или наоборот, трансмутируя протон в нейтрон.
При избытке и того, и другого типа частиц ядро старается избавиться от «лишних» протонов или нейтронов, превращая один из нейтронов в протон или наоборот, трансмутируя протон в нейтрон.
В некоторых редких случаях, когда в атоме содержится гораздо больше нейтронов, чем протонов, подобные распады приводят к выделению свободных нейтронов или пар нейтронов и электронов. Пока ученые не знают, как часто происходят подобные события и не знают, какие именно процессы заставляют нестабильное ядро вести себя таким образом, что мешает точному определению того, какие элементы формируются в звездах и как подобные нейтроны влияют на поведение топлива в ядерных реакторах.
Ситуация осложняется тем, что существует целый набор элементов с определенным количеством протонов и нейтронов, так называемым «магическим числом», которые обладают заметно более высокой стабильностью, чем предсказывает теория, и не распадаются подобным образом. Как полагают сегодня ученые, понимание принципов нейтронного распада ядер позволит нам вычислять подобные «магические числа» теоретически, а не искать их вслепую.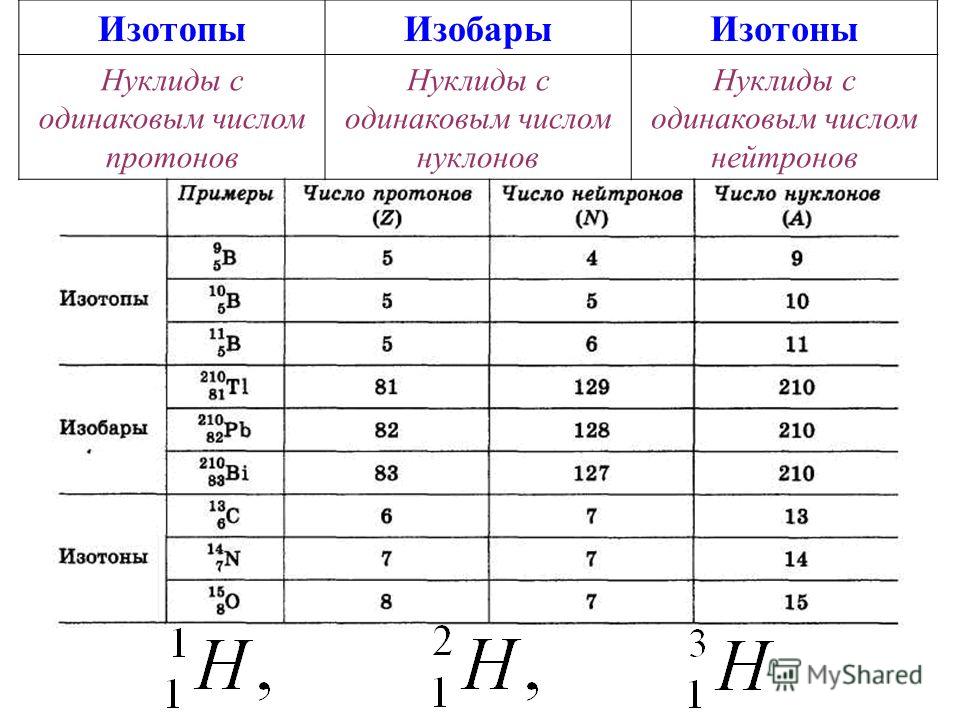
Физики ЦЕРНа нашли новое «магическое число» для сверхтяжелых элементов
NaN , NaN:NaN
Как отмечает Пенионжкевич, ответ на этот вопрос найти крайне сложно, так как нейтроны, в отличие от других продуктов распада нестабильных элементов, гораздо сложнее увидеть и «поймать» из-за отсутствия у них положительного или отрицательного заряда.
Российские ученые решили эту проблему, создав детектор TETRA, способный «видеть» подобные нейтроны, замедляя их и заставляя их взаимодействовать с атомами гелия-3. Эти взаимодействия порождают потоки заряженных частиц, обладающих уникальными чертами, благодаря которым физики могут отличать следы «сбежавших» нейтронов от частиц, попавших в детектор случайно.
© Фото : ОИЯИ, пресс-служба РНФДетектор TETRA, созданный физиками из ОИЯИ РАН в Дубне
© Фото : ОИЯИ, пресс-служба РНФ
Этот детектор Пенионжкевич и его коллеги подключили к ускорительной установке ALTO в городе Орсэ во Франции, способной вырабатывать пучки ионов трех изотопов галлия – галлия-82, галлия-83 и галлия-84. Все эти три версии этого металла могут распадаться по двум сценариям – путем «обычного» бета-распада, в ходе которого нейтрон превращается в протон и остается внутри атома, и путем нейтронного распада, когда еще один нейтрон покидает ядро вместе с электроном, возникшим в ходе подобного превращения.
Все эти три версии этого металла могут распадаться по двум сценариям – путем «обычного» бета-распада, в ходе которого нейтрон превращается в протон и остается внутри атома, и путем нейтронного распада, когда еще один нейтрон покидает ядро вместе с электроном, возникшим в ходе подобного превращения.
Ученых интересовало то, как часто происходят распады по этим двум сценариям, и то, как соотношение числа нейтронов и протонов, а также расстояние до «магического числа», влияют на вероятность «побега» нейтрона из атома галлия при его превращении в германий.
Один из изотопов кальция помог физикам найти новое «магическое число»
NaN , NaN:NaN
Как показали эти наблюдения, вероятность подобного распада зависит от особых коллективных колебаний нейтронов и протонов в ядре атома, так называемого малого резонанса Гамова-Теллера, в существовании которого многие ученые сомневались. К примеру, в пользу этого говорит то, что вероятность нейтронного распада более тяжелого галлия-84 была меньше, а не выше, чем у галлия-83, что нельзя объяснить иным путем.
Открытие его следов, как считает Пенионжкевич, поможет ученым не только понять, как возникла Земля и другие планеты и звезды Вселенной, но и поможет открыть новые «магические числа», в том числе характерные для сверхтяжелых элементов в пока не открытом «острове стабильности».
Ванадий — Атомный номер — Атомная масса — Плотность ванадия
Автор
Атомный номер ванадия
Ванадий — химический элемент с атомным номером 3 3 0 и числом протонов 3
1 2 электроны в структуре атома. Химический символ
для ванадия равен V .Поскольку количество электронов отвечает за химическое поведение атомов, атомный номер обозначает различные химические элементы.
Как атомный номер определяет химическое поведение атомов?
Атомная масса ванадия
Атомная масса ванадия 50,9415 ед.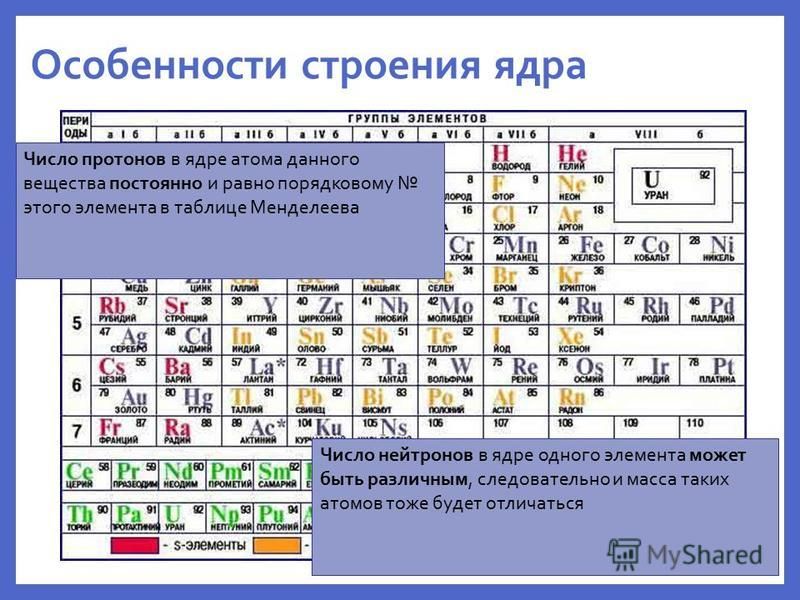
Обратите внимание, что каждый элемент может содержать больше изотопов. Следовательно, эта результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их распространенности.
Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 х 10 -24 грамм. Одна единая атомная единица массы составляет приблизительно массы одного нуклона (либо отдельного протона, либо нейтрона) и численно эквивалентна 1 г/моль.
Для 12 C атомная масса точно равна 12u, так как по ней определяется единица атомной массы. Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0,1 ед от массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в его основное состояние ядра составляет 62,91367 u.
Различие между массовым числом и изотопной массой, известное как дефект массы, объясняется двумя причинами:
- Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов.

- Энергия связи между ядрами различается. Ядро с большей энергией связи имеет меньшую полную энергию, поэтому0009 меньшая масса согласно соотношению эквивалентности массы и энергии Эйнштейна E = mc 2 . Для 63 Cu, атомная масса меньше 63, поэтому этот фактор должен быть доминирующим.
Число атомной массы определяет прежде всего атомную массу атомов. Массовое число различно для каждого изотопа химического элемента.
Как атомная масса определяет плотность материалов?
Плотность ванадия
Плотность ванадия 6,11 г/см 3 .
Типичные плотности различных веществ при атмосферном давлении.
Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, деленная на объем:
ρ = m/V
вещества, деленное на общий объем (V), занимаемый этим веществом. Стандартная единица СИ — килограммов на кубический метр ( кг/м 3 ). Стандартная английская единица измерения – 90 009 фунтов массы на кубический фут ( фунтов/фут 3 ).
Стандартная единица СИ — килограммов на кубический метр ( кг/м 3 ). Стандартная английская единица измерения – 90 009 фунтов массы на кубический фут ( фунтов/фут 3 ).
See also: What is Density
See also: Densest Materials of the Earth
Vanadium – Properties Summary
| Element | Vanadium |
|---|---|
| Atomic Number | 23 |
| Символ | V |
| Element Category | Transition Metal |
| Phase at STP | Solid |
| Atomic Mass [amu] | 50.9415 |
| Density at STP [g/cm3] | 6.11 |
| Электронная конфигурация | [AR] 3D3 4S2 |
| Возможные состояния окисления | +2,3,4,5 |
| +2,3,4,5 | |
| +2,3,4,5 | |
| Electronegativity [Pauling scale] | 1.63 |
| 1st Ionization Energy [eV] | 6.7463 |
| Year of Discovery | 1801 |
| Discoverer | Del Rio, Andrés Manuel (1801) & Sefström, Nils Gabriel (1830) |
| Термические свойства | |
| Температура плавления [шкала Цельсия] | 1910 |
| 0145 | 3407 |
| Thermal Conductivity [W/m K] | 30.7 |
| Specific Heat [J/g K] | 0.49 |
| Heat of Fusion [kJ/mol] | 20.9 |
| Heat of Vaporization [kJ/mol] | 0.452 |
Vanadium in Periodic Table
| Hydrogen1H | Helium2He | ||||||||||||||||||
| Lithium3Li | Beryllium4Be | Boron5B | Carbon6C | Nitrogen7N | Oxygen8O | Fluorine9F | Neon10Ne | ||||||||||||
| Sodium11Na | Magnesium12Mg | Aluminium13Al | Silicon14Si | Phosphorus15P | Sulfur16S | Chlorine17Cl | Argon18Ar | ||||||||||||
| Калий19K | Кальций20Ca | Скандий21Sc | Titanium22Ti | Vanadium23V | Chromium24Cr | Manganese25Mn | Iron26Fe | Cobalt27Co | Nickel28Ni | Copper29Cu | Zinc30Zn | Gallium31Ga | Germanium32Ge | Arsenic33As | Selenium34Se | Bromine35Br | Krypton36Kr | ||
| Rubidium37Rb | Стронций38Sr | Иттрий39Y | Цирконий40Zr | Niobium41Nb | Molybdenum42Mo | Technetium43Tc | Ruthenium44Ru | Rhodium45Rh | Palladium46Pd | Silver47Ag | Cadmium48Cd | Indium49In | Tin50Sn | Antimony51Sb | Tellurium52Te | Iodine53I | Xenon54Xe | ||
| Caesium55Cs | Barium56Ba | Лантан57La | Гафний72Hf | Tantalum73Ta | Tungsten74W | Rhenium75Re | Osmium76Os | Iridium77Ir | Platinum78Pt | Gold79Au | Mercury80Hg | Thallium81Tl | Lead82Pb | Bismuth83Bi | Polonium84Po | Astatine85At | Radon86Rn | ||
| Francium87Fr | Radium88Ra | Actinium89Ac | Rutherfordium104Rf | Dubnium105Db | Seaborgium106Sg | Bohrium107Bh | Hassium108Hs | Meitnerium109Mt | Darmstadtium110Ds | Roentgenium111Rg | Copernicium112Cn | Nihonium113Nh | Flerovium114Fl | Moscovium115Mc | Livermorium116Lv | Tennessine117Ts | Oganesson118Og | ||
| Церий58Ce | Празеодим59Pr | Neodymium60Nd | Promethium61Pm | Samarium62Sm | Europium63Eu | Gadolinium64Gd | Terbium65Tb | Dysprosium66Dy | Holmium67Ho | Erbium68Er | Thulium69Tm | Ytterbium70Yb | Lutetium71Lu | ||||||
| Thorium90Th | Протактиний91Pa | Уран92U | Нептуний93Np | Plutonium94Pu | Americium95Am | Curium96Cm | Berkelium97Bk | Californium98Cf | Einsteinium99Es | Fermium100Fm | Mendelevium101Md | Nobelium102No | Lawrencium103Lr | ||||||
–
–
–
report это объявление
Факты о ванадии | Live Science
Когда вы совершаете покупку по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Вот как это работает.
Ванадий — металл средней твердости стального синего цвета. Хотя это менее известный металл, он весьма ценен в обрабатывающей промышленности благодаря своей ковкости, пластичности и коррозионной стойкости.
Ванадий редко встречается в природе в виде свободного элемента, но его можно найти примерно в 65 различных минералах, включая магнетит, ванадинит, карнотит и патронит. Его также можно найти в фосфоритах и некоторых видах сырой нефти. Согласно данным Jefferson Lab, ванадий обычно получают путем нагревания измельченной руды в присутствии углерода и хлора с получением трихлорида ванадия, который затем нагревают с магнием в атмосфере аргона. Около 98 процентов добываемой ванадиевой руды поступает из Южной Африки, России и Китая.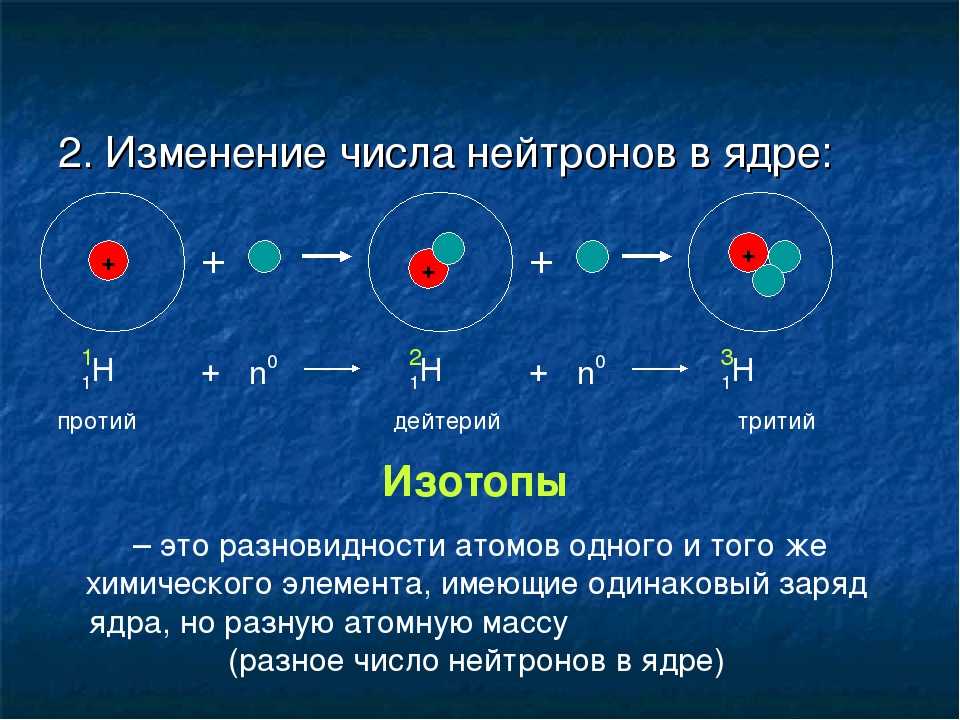
Ванадий составляет 150 частей на миллион (ppm) ядра Земли и составляет 0,019 процента земной коры, согласно PeriodicTable.com. Космическое количество ванадия во Вселенной составляет около 0,0001 процента. Ванадий можно обнаружить спектроскопически в лучах Солнца и иногда в свете других звезд.
Только факты
- Атомный номер (количество протонов в ядре): 23
- Атомный символ (в периодической таблице элементов): V
- Атомный вес (средняя масса атома): 50,9415
- Плотность: грамм на кубический сантиметр
- Фаза при комнатной температуре: Твердая
- Температура плавления: 3470 градусы Фаренгейта (1910 градусов Цельсия)
- Температура кипения: 6165 F (3407 C)
- Количество изотопов (атомов одного и того же элемента с разным числом нейтронов): 2; один стабильный В-51; один радиоактивный В-50
- Наиболее распространенные изотопы: В-51 (99,75 процента естественного изобилия)
Discovery
Ванадий был обнаружен дважды, по данным Королевского общества Химия. В 1801 году Андрес Мануэль дель Рио, профессор минералогии из Мехико, обнаружил его в образце ванадита. Он отправил образцы элемента (которого он назвал эритронием) вместе с письмом с описанием своих методов в Институт Франции для проверки и подтверждения. К сожалению, его письмо было потеряно во время кораблекрушения, согласно Лаборатории Джефферсона, и Институт получил только его образец вместе с короткой запиской, в которой говорилось, что новый элемент похож на хром. Институт пришел к выводу, что образец на самом деле был минералом хрома, и дель Рио отозвал свое заявление.
В 1801 году Андрес Мануэль дель Рио, профессор минералогии из Мехико, обнаружил его в образце ванадита. Он отправил образцы элемента (которого он назвал эритронием) вместе с письмом с описанием своих методов в Институт Франции для проверки и подтверждения. К сожалению, его письмо было потеряно во время кораблекрушения, согласно Лаборатории Джефферсона, и Институт получил только его образец вместе с короткой запиской, в которой говорилось, что новый элемент похож на хром. Институт пришел к выводу, что образец на самом деле был минералом хрома, и дель Рио отозвал свое заявление.
Позже, в 1830 году, ванадий был заново открыт шведским химиком Нильсом Габриэлем Сефстрёмом, когда он анализировал образцы железа из шахты в Швеции. Возможно, вдохновленный красиво окрашенными соединениями этого элемента, Сефстрем назвал элемент ванадием в честь древнескандинавской богини Ванадис, древнескандинавского имени Фрейи, которая ассоциируется с красотой и плодородием.
Этот элемент был окончательно выделен в 1867 году английским химиком сэром Генри Энфилдом Роско, когда он комбинировал трихлорид ванадия (VCl 3 ) с газообразным водородом (H 2 ).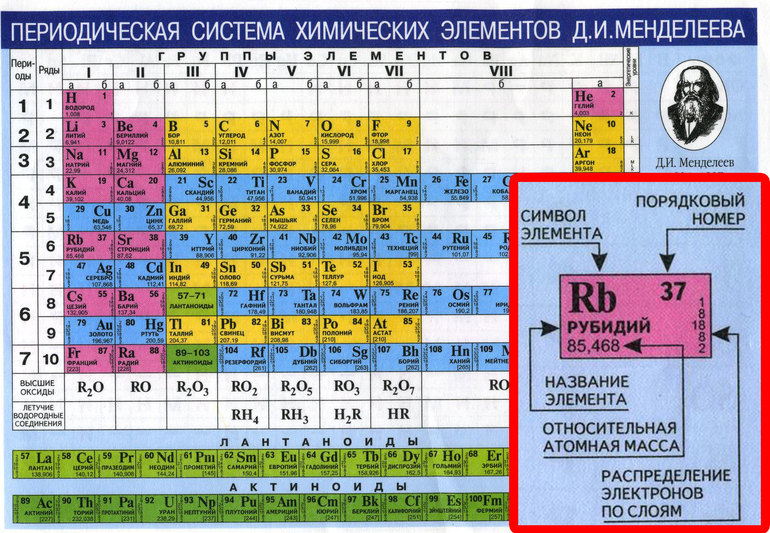
Микроскопический минерал
Высокие дозы ванадия токсичны для человека, но ученые считают, что нам может понадобиться этот элемент в очень малых количествах для нормального роста костей. Ванадий можно найти в следовых количествах во многих видах пищи, включая грибы, черный перец, петрушку, укроп, моллюски, пиво, вино и зерно. По данным Королевского химического общества, при сбалансированном питании мы потребляем всего 0,01 миллиграмма в день, и этого более чем достаточно для наших биологических потребностей.
Очень немногие исследования ванадия проводились на людях (большинство из них проводилось на животных), поэтому в настоящее время ванадий не рекомендуется при каких-либо конкретных заболеваниях или состояниях здоровья. Тем не менее, по данным Медицинского центра Университета Мэриленда, несколько исследований на животных и несколько небольших исследований на людях показывают, что ванадий может снижать уровень сахара в крови и улучшать чувствительность к инсулину у пациентов с диабетом 2 типа.
В некоторых исследованиях на мышах, например, было показано, что ванадий снижает уровень сахара в крови и уровни холестерина липопротеинов низкой плотности (ЛПНП) и триглицеридов. В 19В исследовании на козах, опубликованном в Журнале Американской ассоциации диетологов, козлята, матери которых потребляли пищу с дефицитом ванадия, рождались с дефектами скелета и умирали через три дня.
Во многих исследованиях ванадия на людях участвовало небольшое количество людей в течение коротких периодов времени и с высокими дозами, значительно превышающими допустимый верхний уровень потребления (UL), и ученые не знают, безопасны ли эти уровни вообще для потребления человеком. .
Ванадий продается в качестве добавки для бодибилдинга, как правило, в форме сульфата ванадила. Добавка продается как способ увеличить поглощение мышцами глюкозы и аминокислот и усилить синтез гликогена и белка. Однако, согласно некоторым научным исследованиям, ванадий не повышает активность инсулина у здоровых людей, а только у диабетиков.
Использование
По данным Jefferson Lab, около 80 процентов производимого ванадия сплавляется с железом для получения ударопрочной и коррозионно-стойкой добавки к стали, называемой феррованадием. Феррованадий содержит от 1 до 6 процентов ванадия.
Сплавы ванадиевой стали используются для изготовления чрезвычайно прочных инструментов, таких как оси, броневые пластины, автомобильные шестерни, пружины, режущие инструменты, поршневые штоки и коленчатые валы. По данным Королевского химического общества, сплавы ванадия также используются для изготовления ядерных реакторов из-за их свойств с низким поглощением нейтронов. Фактически, первое широкое промышленное использование ванадия было в стальном каркасе модели T Ford, что позволило сделать раму легче, но с большей прочностью на растяжение.
Соединение пятиокиси ванадия (V 2 O 5 ) используется в качестве протравы (вещества, которое навсегда закрепляет красители на тканях), в качестве катализатора в некоторых химических реакциях и в производстве керамики. По данным Jefferson Lab, его также можно комбинировать с галлием для образования сверхпроводящих магнитов. При смешивании с алюминием и титаном ванадий может образовывать очень прочный сплав, который используется для специальных применений, таких как зубные имплантаты и реактивные двигатели.
По данным Jefferson Lab, его также можно комбинировать с галлием для образования сверхпроводящих магнитов. При смешивании с алюминием и титаном ванадий может образовывать очень прочный сплав, который используется для специальных применений, таких как зубные имплантаты и реактивные двигатели.
Кто знал?
- Вдыхание большого количества ванадия может привести к проблемам с легкими, таким как бронхит или пневмония. Было показано, что рабочие, подвергшиеся воздействию пероксида ванадия, более восприимчивы к раздражению глаз, носа и горла.
- Ванадий использовался для изготовления переносных артиллерийских орудий и бронежилетов во время Первой мировой войны.
- В исследовании 1996 года, опубликованном в медицинском журнале «Метаболизм», восемь человек с диабетом 2 типа получали добавки ванадия в течение одного месяца. Оказалось, что он умеренно эффективен в снижении уровня сахара в крови с небольшими побочными эффектами. В течение первой недели шесть из восьми участников испытали некоторые проблемы с желудочно-кишечным трактом, но эти побочные эффекты исчезли при продолжении приема.

- Ванадий имеет очень яркие степени окисления, включая фиолетовый, зеленый, синий и желтый.
- В 1911 году немецкий химик Мартин Хенце обнаружил ванадий в клетках крови асцидий.
- Атомы ванадия имеют 23 электрона, 28 нейтронов и 23 протона.
- Поскольку ванадиевая сталь сохраняет свою твердость при высоких температурах, она используется в циркулярных пилах, сверлах, турбинах двигателей и других движущихся частях, которые выделяют большое количество тепла.
- Ванадий можно использовать в процессе очистки урана для ядерных целей.
- Ванадий присутствует в небольшом количестве метеоритов.
Дополнительные ресурсы
- Агентство по регистрации токсичных веществ и заболеваний: Ванадий
- Информация о минералах USGS: Ванадий
- Периодическая таблица видео: Ванадий
Трейси Педерсен — независимый автор, который много писал на темы науки, психологии, религии и альтернативного здоровья для различных публикаций.


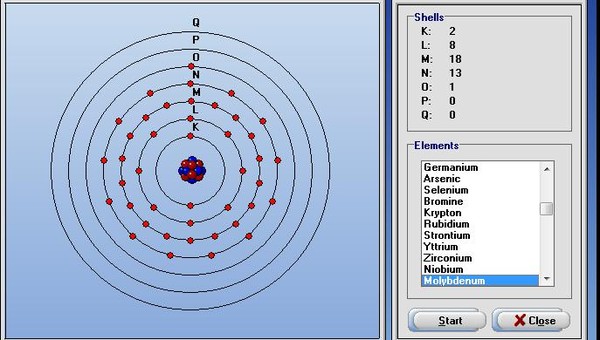
 Это число 16. Это сера S, формула её высшего оксида – SO3.
Это число 16. Это сера S, формула её высшего оксида – SO3.
 Распределению электронов в атоме этого элемента соответствует ряд чисел:
Распределению электронов в атоме этого элемента соответствует ряд чисел: Это Mg. Ему соответствует оксид ЭО.
Это Mg. Ему соответствует оксид ЭО.  Be, Mg, Ca, Sr, Ba
Be, Mg, Ca, Sr, Ba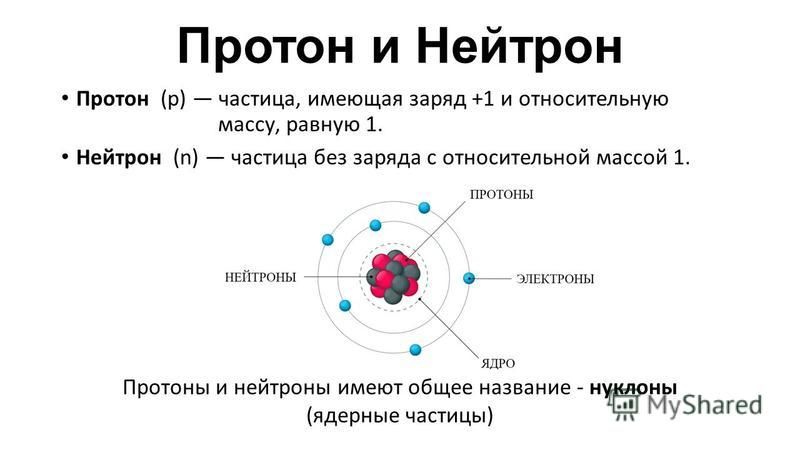
 Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.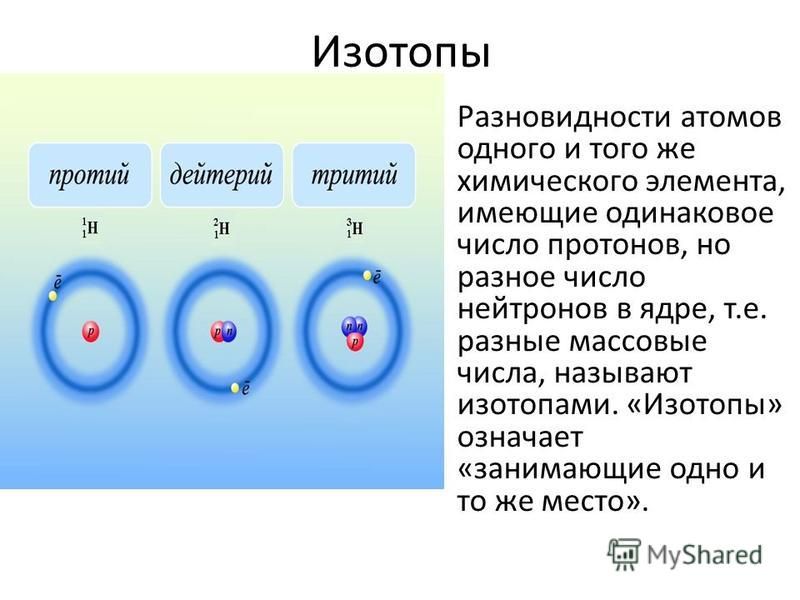 Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
 3,4,4,544.0145
3,4,4,544.0145
Leave A Comment