2.3. Гибрид из орбиталей . Удивительный мир органической химии
Итак, электронные орбитали различаются между собой размерами и формами, а также различным расположением в пространстве. Такие орбитали обозначают символами: 1s, 2s, 2рх, 2ру, 2pz. Первая цифра приблизительно определяет энергию электрона, следующая за ней буква — форму орбитали, а буква, расположенная снизу, показывает ориентацию орбиталей.
Теперь мы подошли к очень важной работе: распределим шесть электронов атома углерода по его атомным орбиталям. Это нетрудно сделать, зная общее количество электронов и орбиталей в атоме. Первая, ближайшая к ядру орбиталь (ls-подуровень) имеет два спаренных 1s-электрона (они, как известно, не принимают участия в образовании химических связей). Остальные четыре электрона располагаются так: два 2s-электрона — на нижнем 2s-подуровне (на одной орбитали) и 2р-электрона — на более высоком 2р-подуровне, но на разных орбиталях (по одному электрону на каждой).
При такой записи добавляется еще одна цифра (сверху). Это показатель количества электронов на соответствующей орбитали. Запись электронной конфигурации все же нагляднее представить такой схемой:
Из этой схемы хорошо видно, что на внешнем электронном уровне два неспаренных 2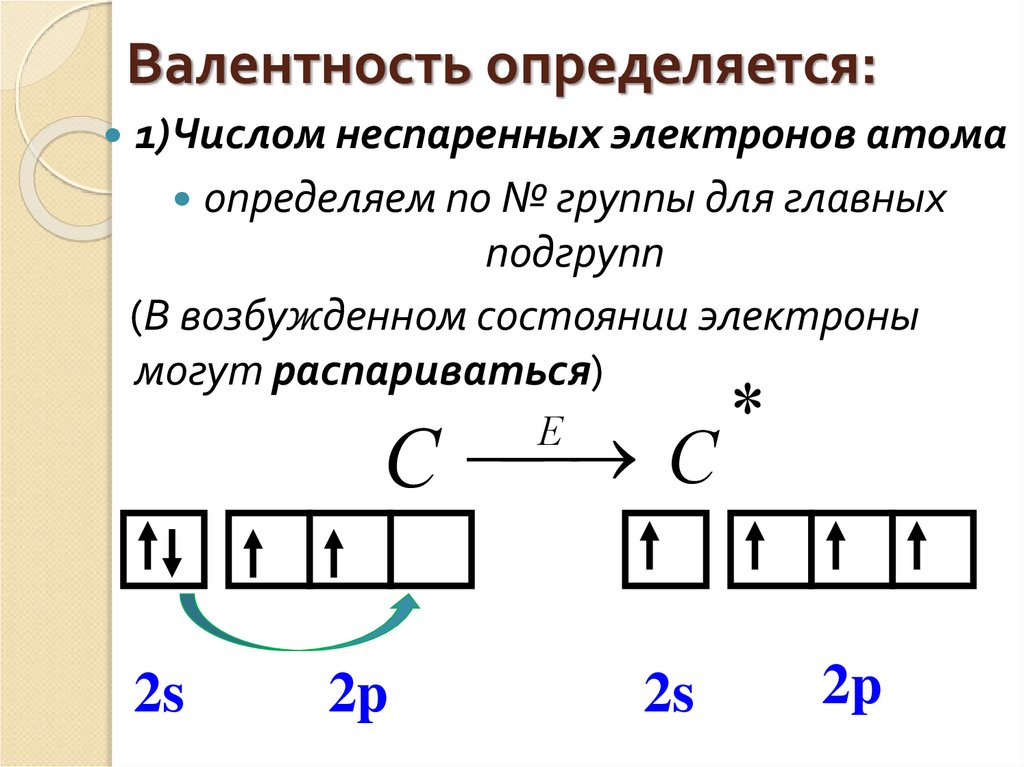 Именно эти, неспаренные, электроны и могут образовать химическую связь. Спаренные же электроны (2s2) на это не способны! Но что же получается? Если исходить из того, что валентность любого элемента определяется числом его неспаренных электронов, то атом углерода… двухвалентный? Но это же противоречит фактам: во всех органических соединениях он четырехвалентен! Как объяснить такое противоречие?
Именно эти, неспаренные, электроны и могут образовать химическую связь. Спаренные же электроны (2s2) на это не способны! Но что же получается? Если исходить из того, что валентность любого элемента определяется числом его неспаренных электронов, то атом углерода… двухвалентный? Но это же противоречит фактам: во всех органических соединениях он четырехвалентен! Как объяснить такое противоречие?
Начнем с того, что при образовании химической связи атом углерода (как и любой другой) всегда становится «возбужденным». Это происходит потому, что реагирующие вещества при проведении химической реакции обычно нагревают или облучают светом, лучи которого обладают определенной энергией. Это делают для того, чтобы химическая реакция началась и полностью завершилась. Вот почему происходит «возбуждение» атома. При этом углеродный атом перестраивает электронную конфигурацию во втором энергетическом уровне: один из двух 2
После такого перехода на внешнем электронном уровне находятся уже не два, а четыре неспаренных электрона (один 2s- и три 2p-электрона). Таким образом, в «возбужденном» состоянии атом углерода имеет другую конфигурацию электронов: 1s22s2p3.
Таким образом, в «возбужденном» состоянии атом углерода имеет другую конфигурацию электронов: 1s22s2p3.
Конечно, для такого перехода, как уже говорили, необходимо затратить энергию, и, кстати, немалую. Но эта энергия не пропала даром. Наоборот, она окупается за счет того, что углерод становится четырехвалентным и способен теперь образовывать четыре химические связи.
Итак, на внешнем электронном уровне атома углерода четыре неспаренных электрона (2s, 2рх, 2py, 2pz,). Но энергия-то у них разная. У них даже формы орбиталей различаются: одна орбиталь — сферическая (не ориентирована в пространстве), а три другие — взаимно перпендикулярны друг к другу. Не приведет ли это к тому, что углеродный атом образует четыре различающиеся между собой химические связи? Нет, этого опасаться не стоит. И вот почему.
 ) четыре связи углерода практически одинаковы. Это происходит потому, что для атома крайне невыгодно, если его связи образованы электронами с различной энергией. Не только математический подход, но даже здравый смысл говорит о том, что в молекуле, например, метана электроны находятся не на «чистых» 2s- и 2p-орбиталях, а на смешанных — гибридных. Такие орбитали симметрично расположены в пространстве и имеют одинаковую энергию. Процесс образования гибридных орбиталей химики назвали гибридизацией.
) четыре связи углерода практически одинаковы. Это происходит потому, что для атома крайне невыгодно, если его связи образованы электронами с различной энергией. Не только математический подход, но даже здравый смысл говорит о том, что в молекуле, например, метана электроны находятся не на «чистых» 2s- и 2p-орбиталях, а на смешанных — гибридных. Такие орбитали симметрично расположены в пространстве и имеют одинаковую энергию. Процесс образования гибридных орбиталей химики назвали гибридизацией.Для атома углерода возможны три типа гибридизации. Рассмотрим их подробнее.
Первый тип гибридизации — sp3—гибридизация. Она происходит при «смешении» (комбинации) одной 2s-орбитали и трех 2p-орбиталей. В результате образуются четыре одинаковые sp3—гибридные орбитали, каждая из которых имеет грушевидную форму (одна часть «гантели» стала вытянутой в одну сторону от ядра) (рис.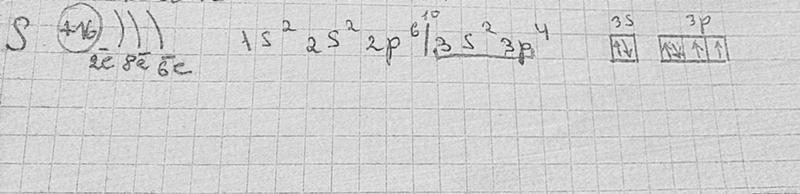 8).
8).
Такая форма очень выгодна. При образовании химических связей она способствует более полному перекрыванию с орбиталями других атомов. А чем полнее такое перекрывание, тем прочнее химическая связь. В пространстве четыре
Второй тип гибридизации — sp2-гибридизация. При «смешении» одной 2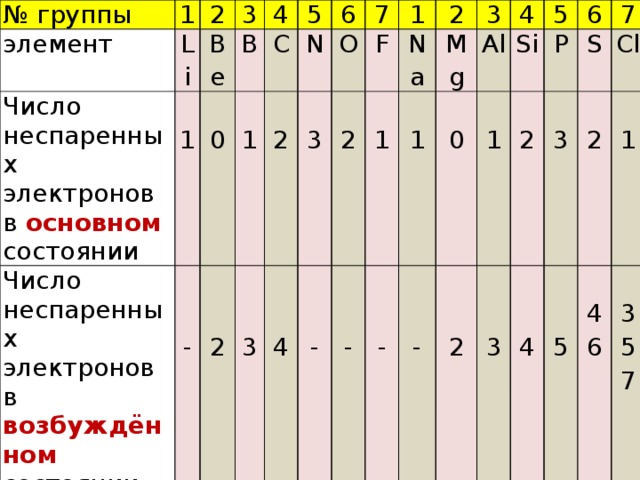 Эта орбиталь располагается в плоскости, которая перпендикулярна плоскости трех гибридных орбиталей (рис. 11). Этот тип гибридизации характерен для углерода, который входит в состав соединений с двойной связью — алкенов (например, этилена, пропилена и др.).
Эта орбиталь располагается в плоскости, которая перпендикулярна плоскости трех гибридных орбиталей (рис. 11). Этот тип гибридизации характерен для углерода, который входит в состав соединений с двойной связью — алкенов (например, этилена, пропилена и др.).
И наконец, sp-гибридизация. Она происходит при «смешении» одной 2
Происходит ли процесс гибридизации в действительности? Нет. Это лишь математический прием, гипотеза химиков-теоретиков, не подтвержденная экспериментально. Но теория гибридизации оказала большую услугу химикам. Она позволяет объяснить характер образующихся связей, их особенности, но главное — показать пространственное строение многих органических молекул.
Валентность химических элементов
жүктеу/скачать 1.65 Mb.
|
1 2 3 4 5 6 7 8 9 10 11
Байланысты:
определение валентность
определение валентность
|
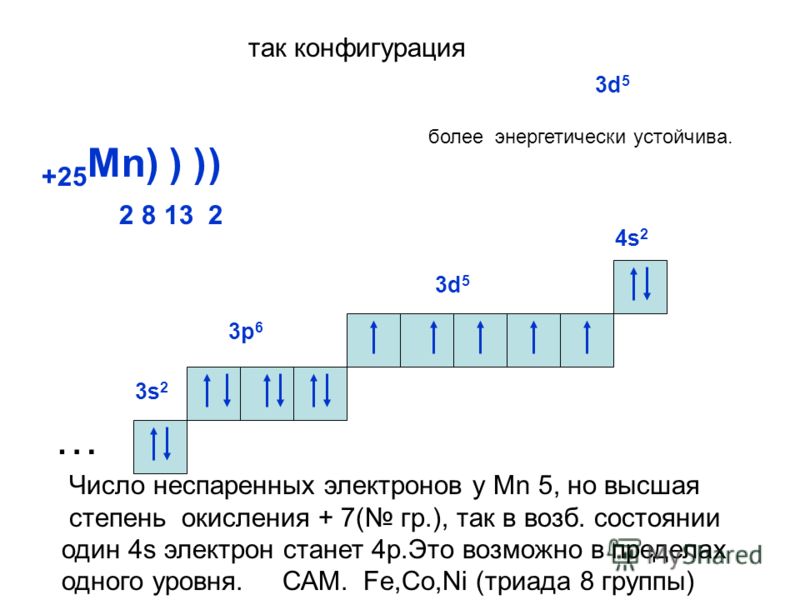
В образовании новых химических связей участвуют неспаренные электроны внешнего энергетического уровня. Именно они, как правило, определяют валентностъ элемента. ■ Валентность — это способность атомов химических элементов образовывать химические связи с другими атомами. Валентность выражается числом атомов одновалентных элементов, которое атом данного элемента может замещать или присоединять во время образования определенного химического соединения. Существуют одновалентные (Н, Li, Na, K, F, Br), двухвалентные (Mg, Ca, Ba, O, S), трехвалентные (Al, N, P), четырехвалентные (C, Si) и т. п. элементы. Понятно, что один атом двухвалентного элемента соединяется с двумя атомами одновалентного элемента (CaCl2, Н2О), но с одним атомом двухвалентного атома (CaO). Атом трехвалентного элемента соединяется с тремя атомами одновалентного элемента FeCl3), два атома — трехвалентного (AlN). Существуют атомы, имеющие постоянную (Na, K, Ca, Al, О) и переменную валентности. Например, валентность серы бывает II, IV и VI: Рассмотрев электронно-графические формулы элементов, можно определить, что валeнтность атома водорода равна I (имеет один неспаренный электрон). По одному неспаренному электрону у лития, фтора, натрия, калия. Однако химические элементы в соединениях далеко не всегда проявляют валентность, соответствующую количеству неспаренных электронов в основном состоянии атома. Например, углерод может проявлять валентность IV (CO2). Возможность проявлять ту или иную валентность зависит также и от количества свободных орбиталей на внешнем электронном слое атома: при наличии незанятых электронами р-орбиталей один из спаренных s-электронов может переходить на свободную р-орбиталь (при условии получения определенной порции дополнительной энергии извне). Состояние атома, при котором электроны переходят с одной орбитали на другую в пределах одного энергетического уровня, называется возбужденным. Пример. В основном состоянии атом углерода имеет два неспаренных электрона на р-подуровне; при переходе атома в возбужденное состояние один из двух электронов s-подуровня может переходить на свободную р-орбиталь. Количество неспаренных электронов в возбужденном состоянии увеличится до четырех. Валентность углерода при этом также изменится с двух до четырех. Если в атомах нет свободных орбиталей (например, у кислорода или фтора), то разъединить электронные пары в этом случае невозможно. Поэтому вaлентность этих элементов будет совпадать с количеством неспаренных электронов: кислород двухвалентен, фтор одновалентен. Определение валентности жүктеу/скачать 1.65 Mb. Достарыңызбен бөлісу: |
1 2 3 4 5 6 7 8 9 10 11
©emirsaba. org 2023
org 2023
әкімшілігінің қараңыз
Разница между спаренными и неспаренными электронами
Автор: Madhu
Спаренные электроны в атоме встречаются в виде пар на орбите, но неспаренные электроны не встречаются в виде электронных пар или пар. Ключевое различие между спаренными и неспаренными электронами заключается в том, что спаренных электронов вызывают диамагнетизм атомов, тогда как неспаренные электроны вызывают парамагнетизм или ферромагнетизм в атомах.
Электроны — субатомные частицы в атомах. Каждый атом содержит по крайней мере один электрон. В нейтральном состоянии атома количество электронов равно количеству протонов в атомном ядре. Но когда он имеет электрический заряд, эти числа не равны (что и вызывает электрический заряд). Мы можем записать электронную конфигурацию атома; он дает расположение электронов на разных энергетических уровнях. Эта электронная конфигурация говорит о спаренных и неспаренных электронах в атоме. Теперь давайте обсудим, что представляют собой эти две формы.
Эта электронная конфигурация говорит о спаренных и неспаренных электронах в атоме. Теперь давайте обсудим, что представляют собой эти две формы.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое спаренные электроны
3. Что такое неспаренные электроны
4. Сравнение бок о бок – спаренные и непарные электроны в табличной форме
5. Резюме
Что такое спаренные электроны ?
Спаренные электроны — это электроны в атоме, которые находятся на орбитали в виде пар. Орбиталь — это расположение электрона в атоме; вместо конкретного местоположения он дает область, в которой электрон движется вокруг атома, потому что электроны постоянно движутся вокруг атомного ядра. Согласно современным теориям, электроны существуют на орбиталях. На одной простейшей орбитали может находиться максимум два электрона. Когда на одной орбитали находятся два электрона, мы говорим, что существует пара электронов. Это спаренный электрон в атоме. Некоторые химические элементы, у которых все электроны спарены, очень стабильны.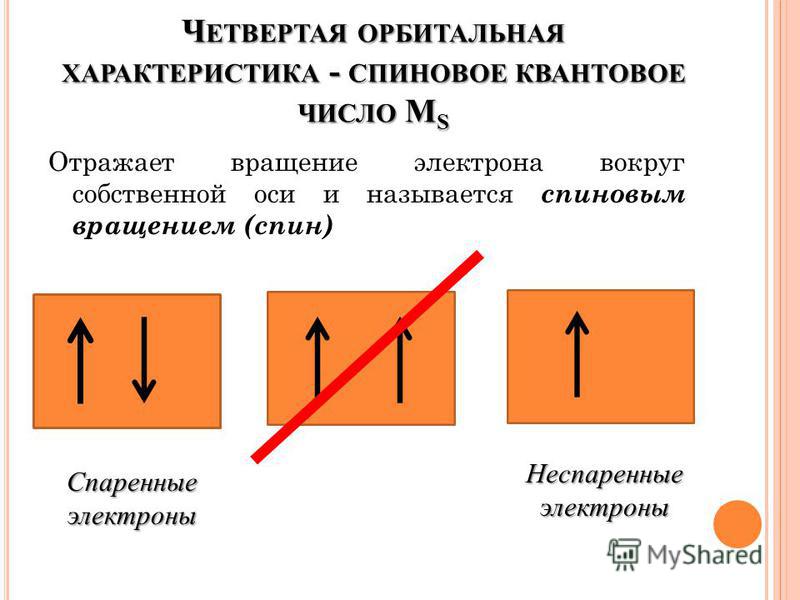 Но некоторые реактивны. Стабильность зависит от электронной конфигурации атома.
Но некоторые реактивны. Стабильность зависит от электронной конфигурации атома.
Рисунок 01: Расположение электронов на орбиталях атома азота
Более того, если мы рассмотрим магнитные свойства химического элемента, то можно выделить три основных типа магнетизма: диамагнитные, парамагнитные и ферромагнитные элементы. Этот магнетизм в основном зависит от количества неспаренных электронов. Следовательно, спаренные электроны не вносят вклада в магнетизм. Тогда мы можем назвать химические элементы, у которых все электроны спарены, диамагнитными химическими элементами; диамагнетизм означает, что он не притягивается к магнитному полю.
Что такое неспаренные электроны?
Неспаренные электроны — это электроны в атоме, находящиеся только на одной орбитали. Это означает, что эти электроны не спарены или не встречаются в виде электронных пар. Мы можем легко определить, есть ли в атоме неспаренные электроны, просто записав его электронную конфигурацию.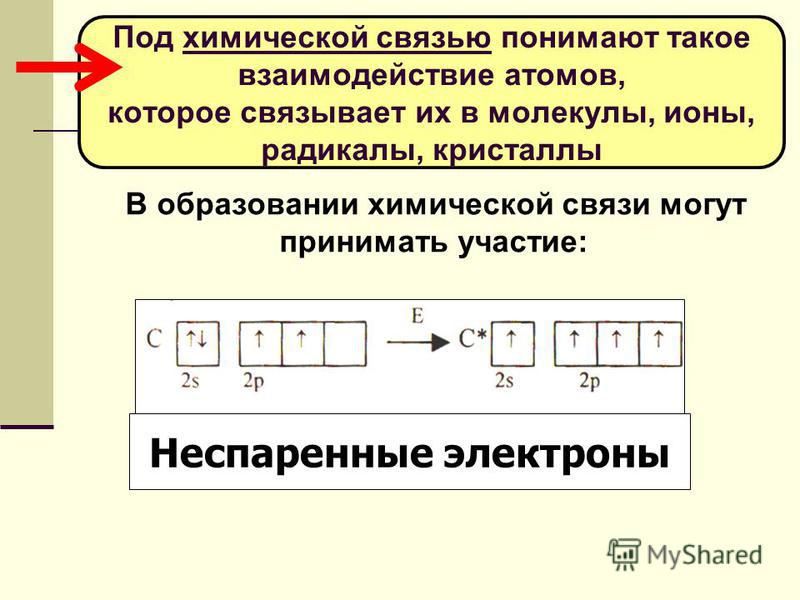 Атомы, имеющие эти электроны, проявляют парамагнитные свойства или ферромагнитные свойства.
Атомы, имеющие эти электроны, проявляют парамагнитные свойства или ферромагнитные свойства.
Парамагнетики имеют мало неспаренных электронов, в то время как ферромагнитные материалы имеют больше неспаренных электронов; таким образом, ферромагнитные материалы притягиваются к магнитному полю в большей степени, чем парамагнетики. Когда атом или молекула имеют такой тип электрона, мы называем это свободным радикалом. Химические элементы, имеющие эти электроны, обладают высокой реакционной способностью. Это потому, что они стремятся спарить все свои электроны, чтобы стать стабильными; наличие неспаренного электрона нестабильно.
В чем разница между спаренными и неспаренными электронами?
Спаренные электроны — это электроны в атоме, которые встречаются на орбитали в виде пар, тогда как неспаренные электроны — это электроны в атоме, которые встречаются на одной орбитали. Следовательно, спаренные электроны всегда встречаются как пара электронов, а неспаренные электроны встречаются как одиночные электроны на орбитали.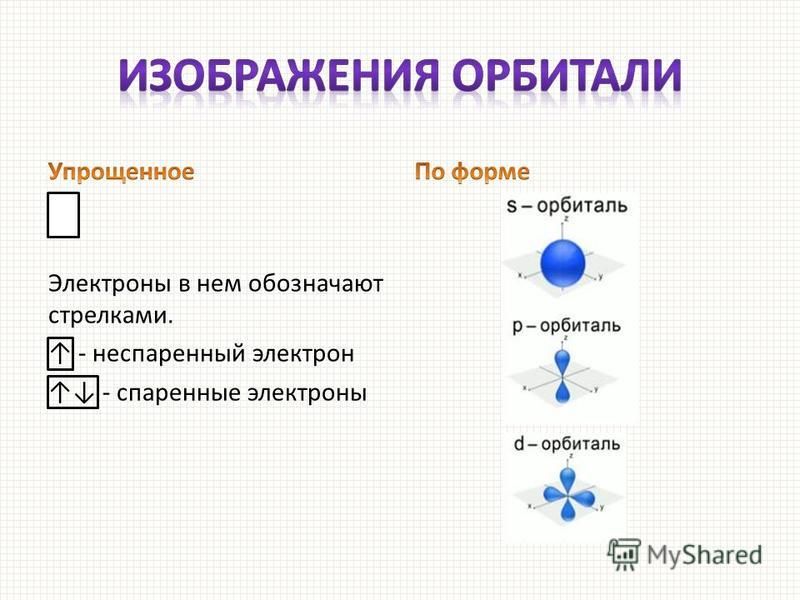 В этом фундаментальное различие между спаренными и неспаренными электронами. Более того, спаренные электроны вызывают диамагнетизм атомов, тогда как неспаренные электроны вызывают парамагнетизм или ферромагнетизм в атомах. Мы можем сказать, что это ключевое различие между спаренными и неспаренными электронами.
В этом фундаментальное различие между спаренными и неспаренными электронами. Более того, спаренные электроны вызывают диамагнетизм атомов, тогда как неспаренные электроны вызывают парамагнетизм или ферромагнетизм в атомах. Мы можем сказать, что это ключевое различие между спаренными и неспаренными электронами.
Резюме – Спаренные и неспаренные электроны
Электроны находятся на атомных орбиталях. Они находятся в свободном движении вокруг ядра атома. Эти электроны могут встречаться в двух типах как спаренные или неспаренные электроны. Разница между спаренными и неспаренными электронами заключается в том, что спаренные электроны вызывают диамагнетизм атомов, тогда как неспаренные электроны вызывают парамагнетизм или ферромагнетизм в атомах.
Ссылка:
1. «Неспаренный электрон». Википедия, Фонд Викимедиа, 3 июля 2018 г. Доступно здесь
Магнитные свойства — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 615
Цели обучения
- Понять разницу между ферромагнетизмом, парамагнетизмом и диамагнетизмом
- Чтобы определить, будет ли химическое вещество парамагнитным или диамагнитным при воздействии внешнего магнитного поля
Магнитный момент системы измеряет силу и направление ее магнетизма.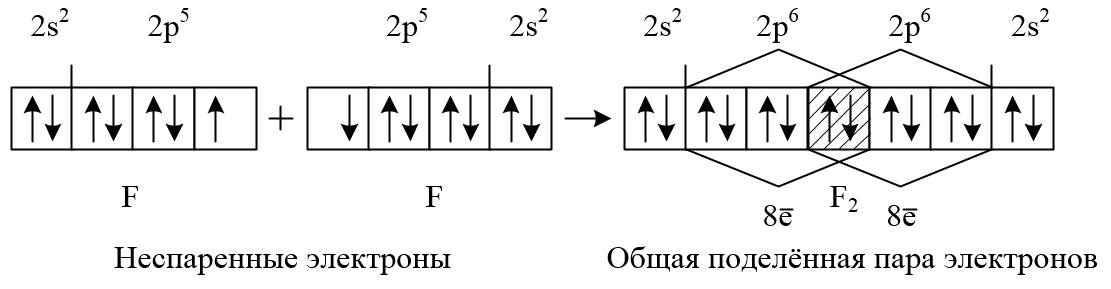 Сам термин обычно относится к магнитному дипольному моменту. Все, что является магнитным, например, стержневой магнит или петля электрического тока, имеет магнитный момент. Магнитный момент является векторной величиной, имеющей величину и направление. Электрон обладает магнитным дипольным моментом электрона, создаваемым собственным свойством вращения электрона, что делает его движущимся электрическим зарядом. Есть много различных магнитных свойств, включая парамагнетизм, диамагнетизм и ферромагнетизм.
Сам термин обычно относится к магнитному дипольному моменту. Все, что является магнитным, например, стержневой магнит или петля электрического тока, имеет магнитный момент. Магнитный момент является векторной величиной, имеющей величину и направление. Электрон обладает магнитным дипольным моментом электрона, создаваемым собственным свойством вращения электрона, что делает его движущимся электрическим зарядом. Есть много различных магнитных свойств, включая парамагнетизм, диамагнетизм и ферромагнетизм.
Интересной характеристикой переходных металлов является их способность образовывать магниты. Комплексы металлов с неспаренными электронами являются магнитными. Поскольку последние электроны находятся на d-орбиталях, этот магнетизм должен быть связан с наличием неспаренных d-электронов. Спин отдельного электрона обозначается квантовым числом \(m_s\) как +(1/2) или –(1/2). Этот спин отрицается, когда электрон соединяется с другим, но создает слабое магнитное поле, когда электрон не спарен.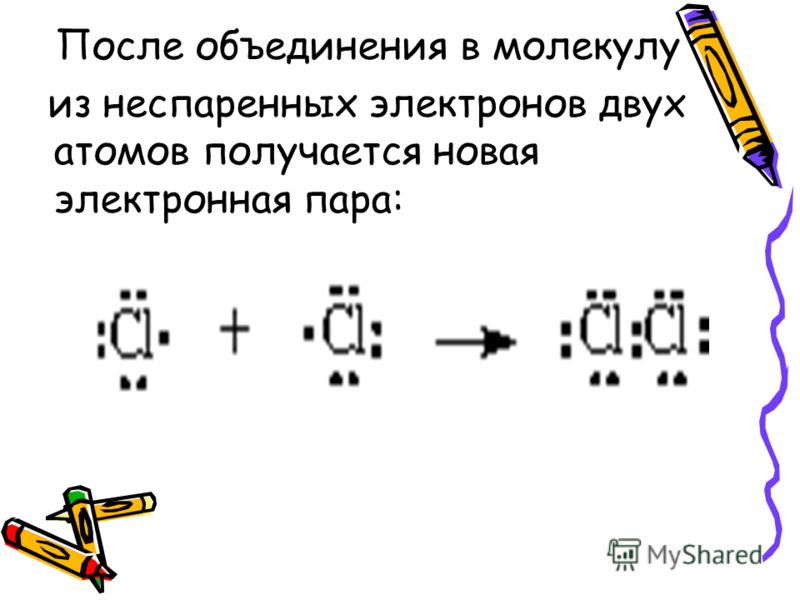 Более неспаренные электроны усиливают парамагнитные эффекты. Электронная конфигурация переходного металла (d-блок) изменяется в координационном соединении; это происходит из-за сил отталкивания между электронами в лигандах и электронами в соединении. В зависимости от силы лиганда соединение может быть парамагнитным или диамагнитным.
Более неспаренные электроны усиливают парамагнитные эффекты. Электронная конфигурация переходного металла (d-блок) изменяется в координационном соединении; это происходит из-за сил отталкивания между электронами в лигандах и электронами в соединении. В зависимости от силы лиганда соединение может быть парамагнитным или диамагнитным.
Ферромагнетизм (постоянный магнит)
Ферромагнетизм — это основной механизм, с помощью которого некоторые материалы (например, железо) образуют постоянные магниты . Это означает, что соединение проявляет постоянные магнитные свойства, а не только в присутствии внешнего магнитного поля (рис. \(\PageIndex{1}\)). В ферромагнитном элементе электроны атомов сгруппированы в домены, в которых каждый домен имеет одинаковый заряд. В присутствии магнитного поля эти домены выстраиваются так, что заряды во всем соединении параллельны. Может ли соединение быть ферромагнитным или нет, зависит от количества неспаренных электронов и размера его атома.
Ферромагнетизм, постоянный магнетизм, связанный с никелем, кобальтом и железом, является обычным явлением в повседневной жизни. Примеры знания и применения ферромагнетизма включают дискуссию Аристотеля в 625 г. до н.э., использование компаса в 1187 г. и современный холодильник. Эйнштейн продемонстрировал, что электричество и магнетизм неразрывно связаны в его специальной теории относительности.
Парамагнетизм (притяжение к магнитному полю)
Парамагнетизм относится к магнитному состоянию атома с одним или несколькими неспаренными электронами. Неспаренные электроны притягиваются магнитным полем из-за магнитных дипольных моментов электронов. Правило Хунда гласит, что электроны должны занимать каждую орбиталь по отдельности, прежде чем любая орбиталь будет занята дважды. Это может оставить атом со многими неспаренными электронами.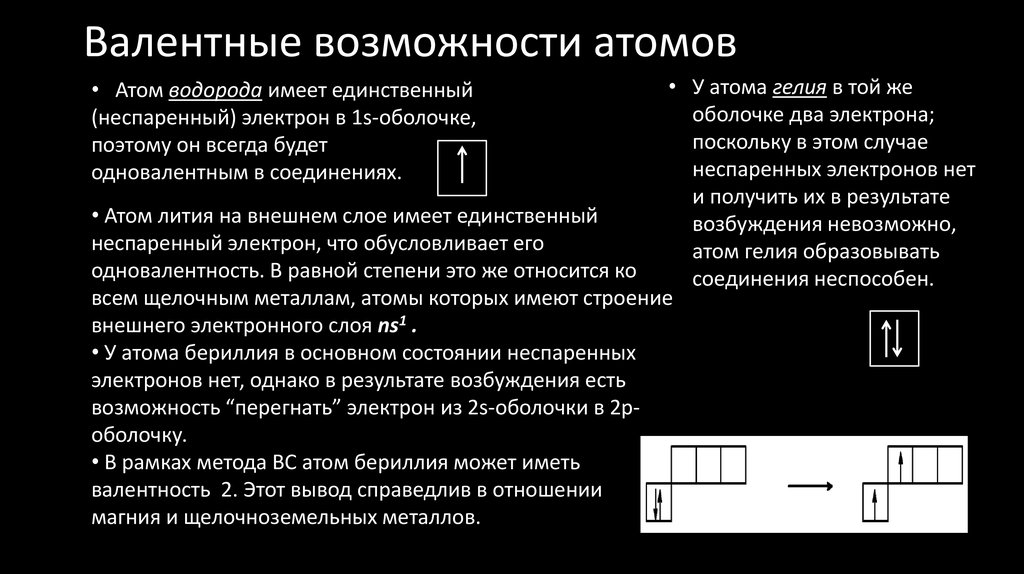 Поскольку неспаренные электроны могут вращаться в любом направлении, они проявляют магнитные моменты в любом направлении. Эта способность позволяет парамагнитным атомам притягиваться к магнитным полям. Двухатомный кислород \(O_2\) является хорошим примером парамагнетизма (описанного с помощью теории молекулярных орбиталей). На следующем видео показан жидкий кислород, притягиваемый магнитным полем, создаваемым сильным магнитом:
Поскольку неспаренные электроны могут вращаться в любом направлении, они проявляют магнитные моменты в любом направлении. Эта способность позволяет парамагнитным атомам притягиваться к магнитным полям. Двухатомный кислород \(O_2\) является хорошим примером парамагнетизма (описанного с помощью теории молекулярных орбиталей). На следующем видео показан жидкий кислород, притягиваемый магнитным полем, создаваемым сильным магнитом:
Диамагнетизм (отталкивание магнитным полем)
Как показано в видео, молекулярный кислород (\(\ce{O2}\)) является парамагнитным и притягивается к магнит. Напротив, молекулярный азот (\(\ce{N_2}\)) не имеет неспаренных электронов и является диамагнитным; на него не действует магнит. Диамагнетики характеризуются наличием спаренных электронов, например, отсутствием неспаренных электронов.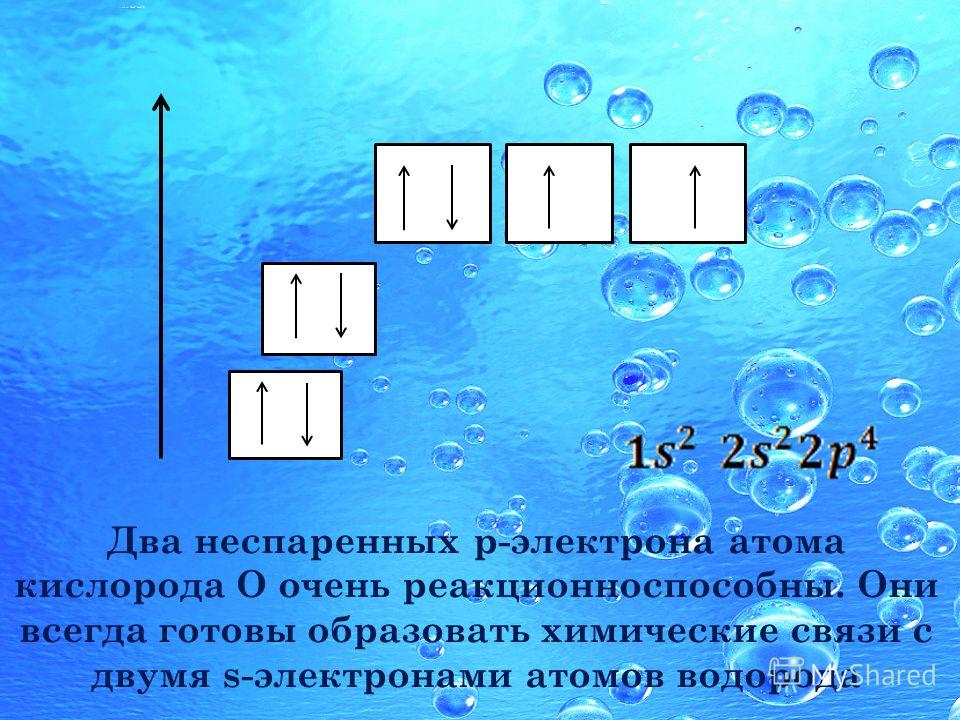 Согласно принципу запрета Паули, который гласит, что никакие два электрона не могут одновременно находиться в одном и том же квантовом состоянии, спины электронов ориентированы в противоположных направлениях. Это заставляет магнитные поля электронов уравновешиваться; таким образом, нет чистого магнитного момента, и атом не может быть притянут магнитным полем. На самом деле диамагнитные вещества слабо отталкивает магнитным полем, как показано на примере пироуглеродного листа на рисунке \(\PageIndex{2}\).
Согласно принципу запрета Паули, который гласит, что никакие два электрона не могут одновременно находиться в одном и том же квантовом состоянии, спины электронов ориентированы в противоположных направлениях. Это заставляет магнитные поля электронов уравновешиваться; таким образом, нет чистого магнитного момента, и атом не может быть притянут магнитным полем. На самом деле диамагнитные вещества слабо отталкивает магнитным полем, как показано на примере пироуглеродного листа на рисунке \(\PageIndex{2}\).
Как определить, является ли вещество парамагнетиком или диамагнетиком
Магнитные свойства вещества можно определить, исследуя его электронную конфигурацию: если в нем есть неспаренные электроны, то вещество является парамагнетиком, а если все электроны спарены, то вещество является диамагнитный. Этот процесс можно разбить на три этапа:
Этот процесс можно разбить на три этапа:
- Запишите электронную конфигурацию
- Нарисуйте валентные орбитали
- Определите, существуют ли неспаренные электроны
- Определите, является ли вещество парамагнитным или диамагнитным
Пример \(\PageIndex{1}\): Атомы хлора
Шаг 1. Найдите электронную конфигурацию
Для атомов хлора электронная конфигурация 3s 2 3p 7 5 900 : Нарисуйте валентные орбитали
Игнорируйте основные электроны и сосредоточьтесь только на валентных электронах.
Шаг 3: Найдите неспаренные электроны
Имеется один неспаренный электрон.
Шаг 4: Определите, является ли вещество парамагнитным или диамагнитным
Поскольку имеется неспаренный электрон, атомы \(\ce{Cl}\) парамагнитны (хотя и слабо).
Пример \(\PageIndex{2}\): Атомы цинка
Шаг 1. Найдите электронную конфигурацию
Найдите электронную конфигурацию
Для атомов Zn электронная конфигурация 4s 2 3d 10
90 Шаг 2: Нарисуйте валентные орбиталиШаг 3: Найдите неспаренные электроны
Неспаренных электронов нет.
Шаг 4: Определите, является ли вещество парамагнитным или диамагнитным
Поскольку неспаренных электронов нет, атомы \(\ce{Zn}\) диамагнитны.
Упражнение \(\PageIndex{1}\)
- Сколько неспаренных электронов содержится в атомах кислорода?
- Сколько неспаренных электронов содержится в атомах брома? 9{2+}}\) ионы бывают парамагнитными или диамагнитными.
- Ответить на
- Атом O имеет электронную конфигурацию 2s 2 2p 4 . Следовательно, O имеет 2 неспаренных электрона.
- Ответ б
- Атом Br имеет электронную конфигурацию 4s 2 3d 10 4p 5 .


 Валентность — свойство элемента, проявляемое в соединениях. Валентность обозначают римскими цифрами, она может составлять от I до VIII.
Валентность — свойство элемента, проявляемое в соединениях. Валентность обозначают римскими цифрами, она может составлять от I до VIII.
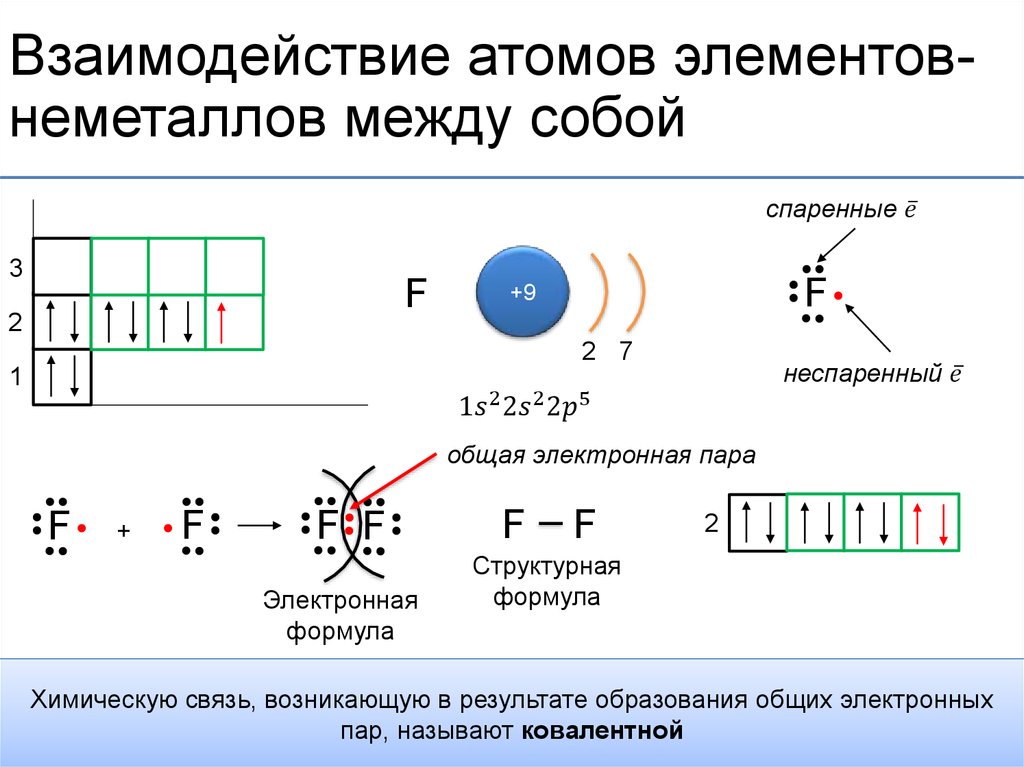 Эти атомы тоже одновалентны. Магний двухвалентен, т. к. у него два неспаренных электрона. У атомов гелия, неона и аргона все электроны спарены и отсутствуют свободные орбитали. Эти элементы химически инертны, то есть обладают нулевой валентностью.
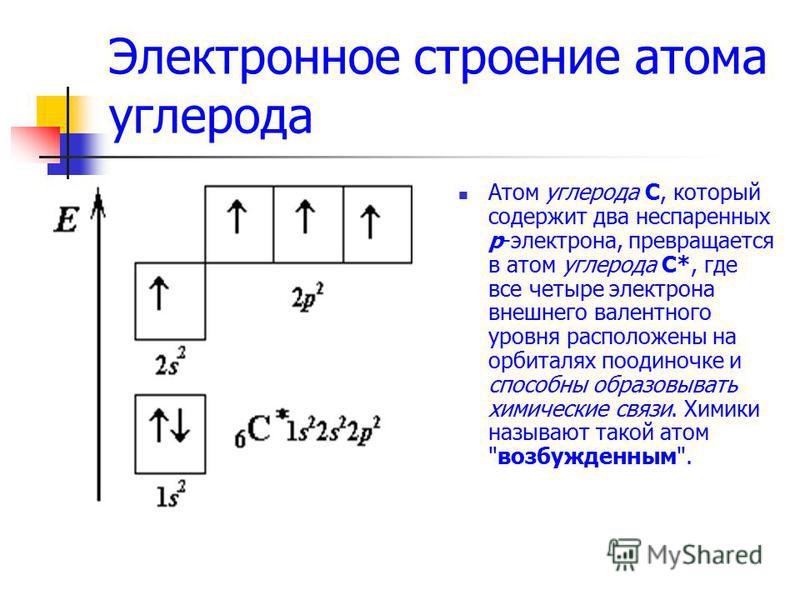
Эти атомы тоже одновалентны. Магний двухвалентен, т. к. у него два неспаренных электрона. У атомов гелия, неона и аргона все электроны спарены и отсутствуют свободные орбитали. Эти элементы химически инертны, то есть обладают нулевой валентностью. Рассмотрим атом углерода в основном и возбужденном состояниях (значком * обозначается возбужденное состояние атома):
Рассмотрим атом углерода в основном и возбужденном состояниях (значком * обозначается возбужденное состояние атома):
Leave A Comment