Основные оксиды – список с химическими свойствами
4.6
Средняя оценка: 4.6
Всего получено оценок: 2367.
4.6
Средняя оценка: 4.6
Всего получено оценок: 2367.
Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов, и каковы их химические свойства?
Классификация оксидов
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
Рис. 1. Классификация оксидов.Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO2), так и твердыми (Fe2O3) или жидкими веществами (H
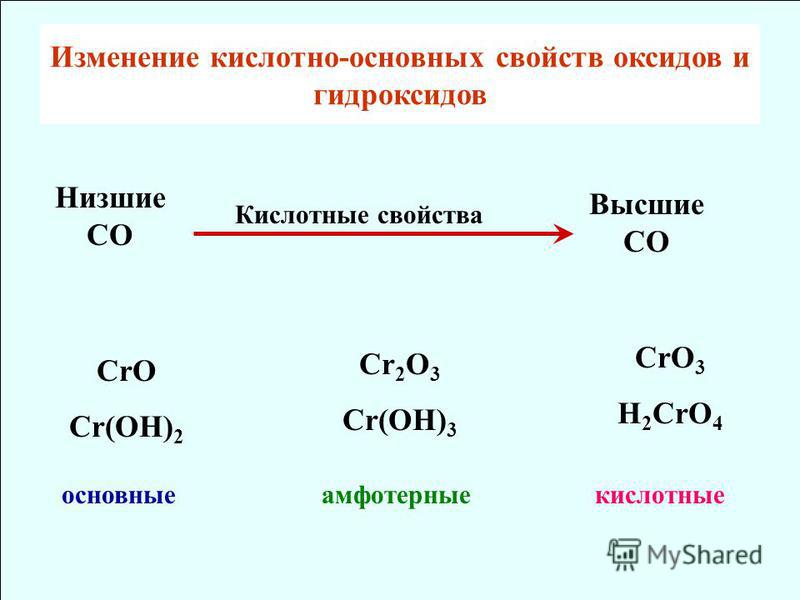
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K2O, СaO соответствуют основания KOH, Ca(OH)2 .
Рис. 2. Основные оксиды и соответствующие им основания.Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
CaO (основной оксид)+CO2 (кислотный оксид)=СaCO3 (соль)
FeO (основной оксид)+H2 SO4 (кислота)=FeSO4 (соль)+2H2O (вода)
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
CaO+ZnO=CaZnO2
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
BaO (основной оксид)+H2O (вода)=Ba(OH)2 (основание щелочнозем.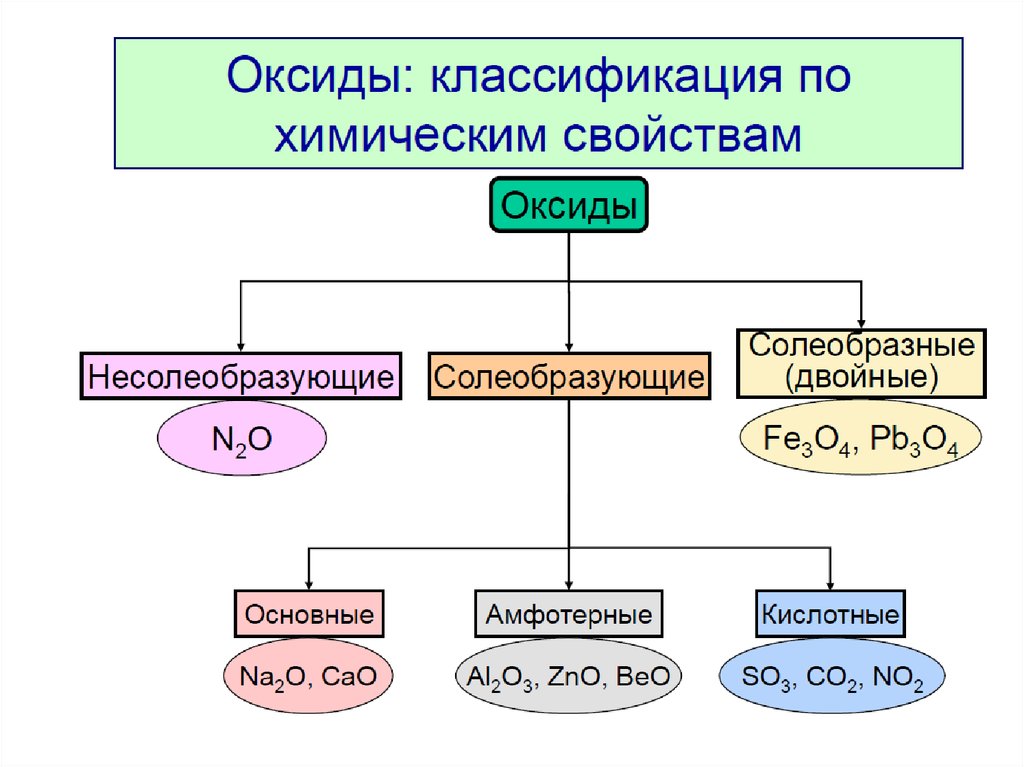
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
3CuO+2NH3 =3Cu+3H2 O+N2
При нагревании разлагаются только оксиды ртути и благородных металлов:
2AU2O=4Au+O2
2HgO=2Hg+O2
Рис. 3. Оксид ртути.Список основных оксидов:
| Название оксида | Химическая формула | Свойства |
| Оксид кальция | CaO | негашенная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | BaO | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета практически нерастворимое в воде |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
| Оксид калия | K2O | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na2O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Li2 O | вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки |
В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов
Что мы узнали?
При образовании основных оксидов одним из обязательных элементов является кислород. Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.
Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 2367.
А какая ваша оценка?
Оксиды — что это такое? Химические свойства и классификация
Поможем понять и полюбить химию
Начать учиться
110.1K
Знакомство с оксидами обычно начинается на уроках химии в 8 классе. Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т.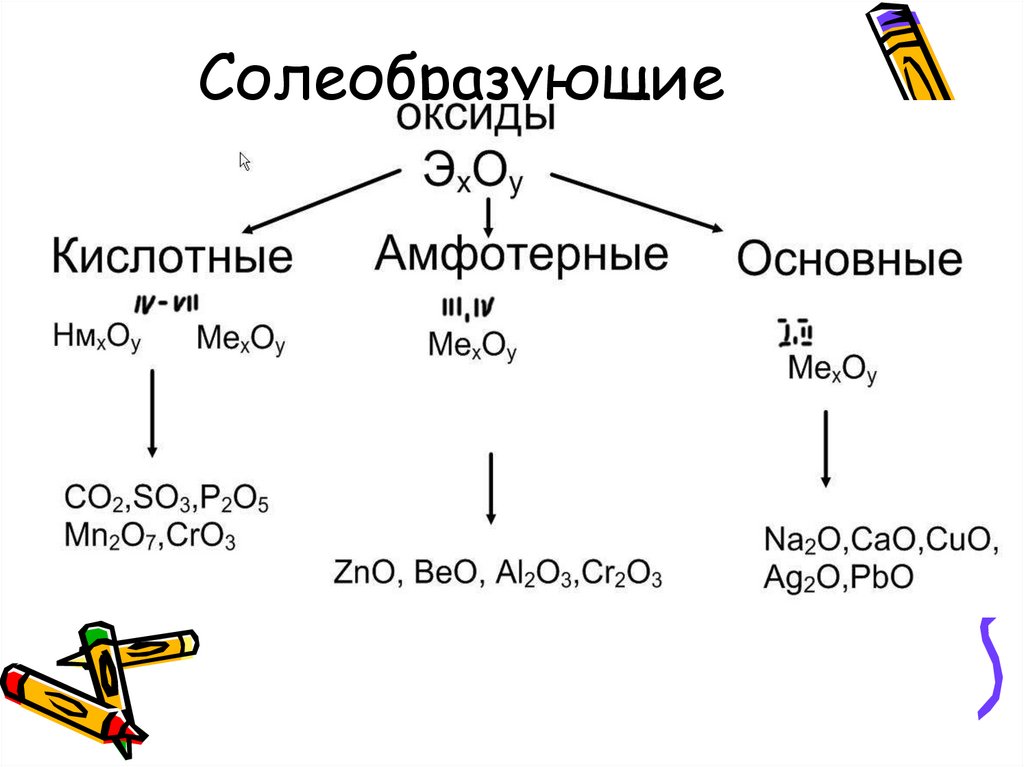 е. бинарные соединения), один из которых — кислород в степени окисления −2.
е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).

Примеры кислотных оксидов: S+6O3, N2
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».

Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида | Бытовое (тривиальное название) | Возможное научное название |
|---|---|---|
| H2O | Вода | Оксид водорода |
| CO2 | Углекислый газ | Оксид углерода (IV), диоксид углерода |
| CO | Угарный газ | Оксид углерода (II), монооксид углерода |
| SO3 | Серный газ | Оксид серы (VI), триоксид серы |
| SO2 | Сернистый газ | Оксиды серы (IV), диоксид серы |
| SiO2 | Кварц, горный хрусталь, песок кварцевый, речной и морской | Оксид кремния |
| Al2O3 | Глинозем | Оксид алюминия |
| Fe2O3 | Гематит (крокус) | Оксид железа (III) |
| CaO | Негашеная известь | Оксид кальция |
Химические свойства основных оксидов
1.
 Взаимодействие с водой
Взаимодействие с водойС водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание Например: Na2O + H2O = 2NaOH |
|---|
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль Например: BaO + SO3 = BaSO4 Основный оксид + кислота = соль + вода Например: Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O |
|---|
3.
 Взаимодействие с амфотерными оксидами
Взаимодействие с амфотерными оксидамиВ эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль Например: Na2O + Al2O3 = NaAlO2 |
|---|
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
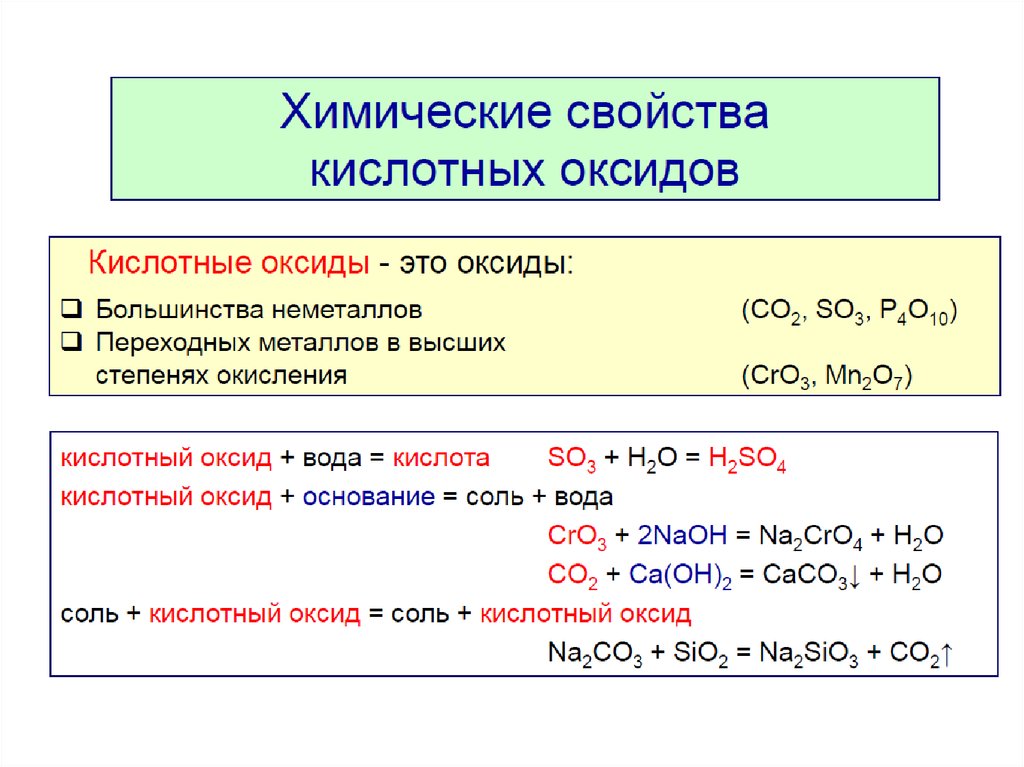
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота Например: SO3 + H2O = H2SO4 |
|---|
2.
 Взаимодействие с основными оксидами и щелочами
Взаимодействие с основными оксидами и щелочамиКислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль Например: SO3 + CuO = CuSO4 Кислотный оксид + основание = соль + вода Например: N2O5 + 2NaOH = 2NaNO3 + H2O |
|---|
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль Например: SO3 + Al2O3 = Al2(SO4)3 Кислотный оксид + амфотерный оксид = соль + вода Например: SO3 + Al(OH)3 = Al2(SO4)3 + H2O |
|---|
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠ |
|---|
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль Например: Al2O3 + N2O5 = 2Al(NO3)3 Амфотерный оксид + кислота = соль + вода Например: Al2O3 + 6HCl = 2AlCl3 + 3H2O |
|---|
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль Например: Al2O3 + Na2O = 2NaAlO2 |
|---|
4.
 Взаимодействие со щелочами
Взаимодействие со щелочамиПродукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль Например: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] Амфотерный оксид + щелочь (расплав) = средняя соль + вода Например: ZnO + 2KOH = K2ZnO2 + H2O |
|---|
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Исключение
Не взаимодействуют с кислородом: платина, золото и палладий.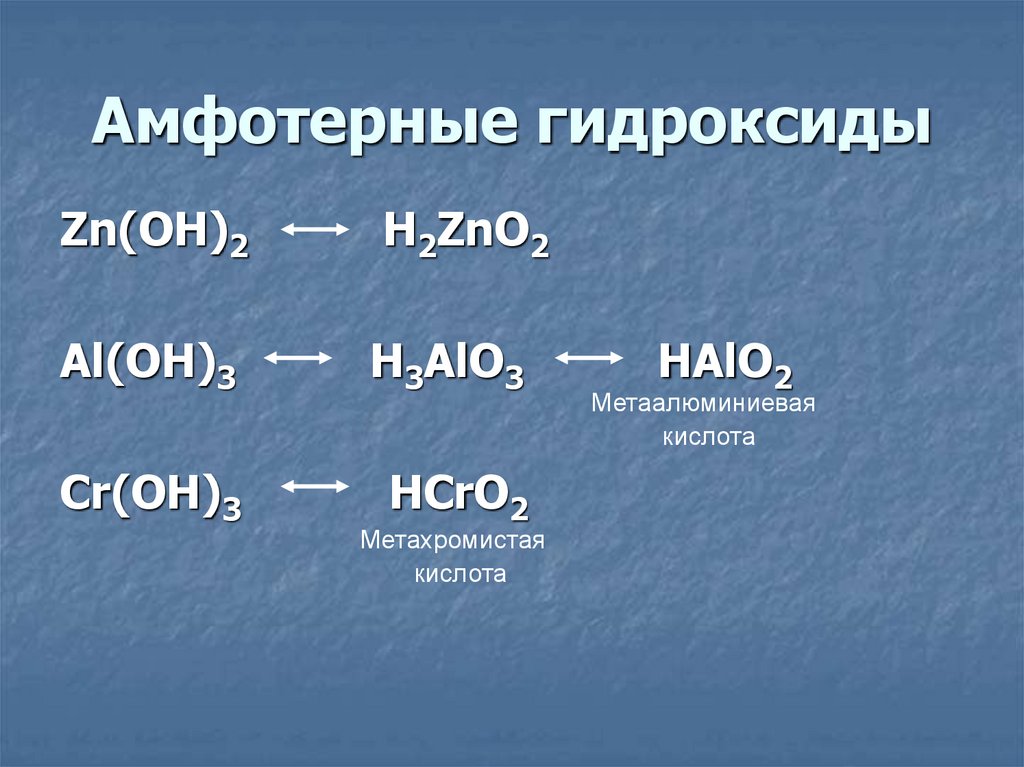
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
4Cr + 3O2 = 2Cr2O3
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
4P + 5O2 (избыток) = 2P2O5
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
4P + 3O2 (недостаток) = 2P2O3
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
S + O2 = SO2
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
N2 + O2 = 2NO
Запомнить
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).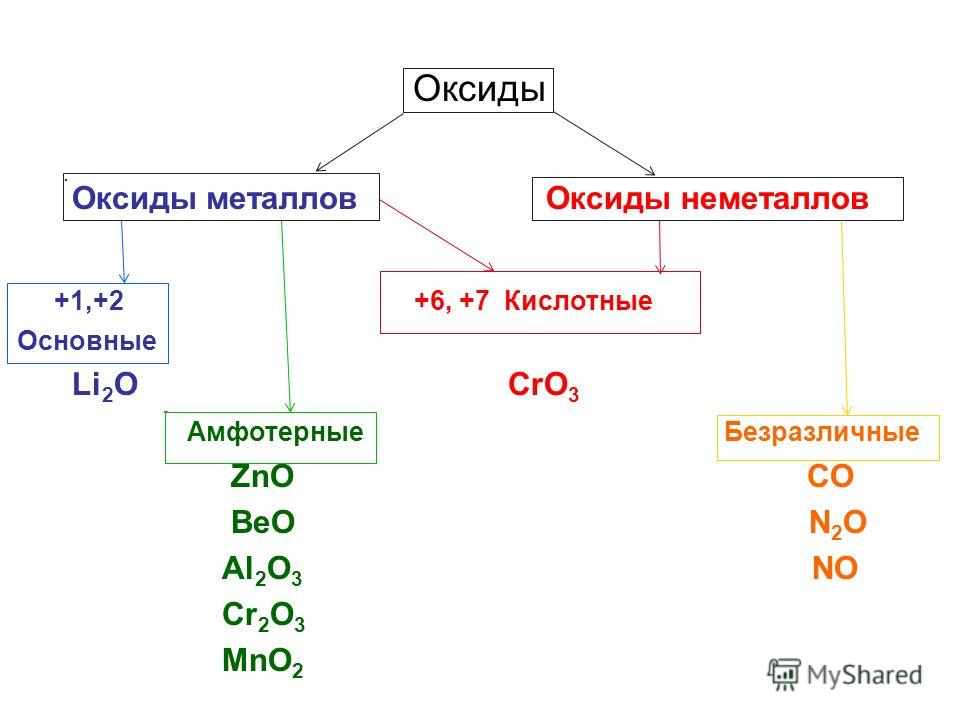
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Например:
H2SO3 = SO2↑ + H2O
H2CO3 = CO2↑ + H2O
Ag(OH) = Ag2O + H2O
NH4OH = NH3↑ + H2O
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
Например:
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Например:
2H2S + 3O2 = 2SO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т.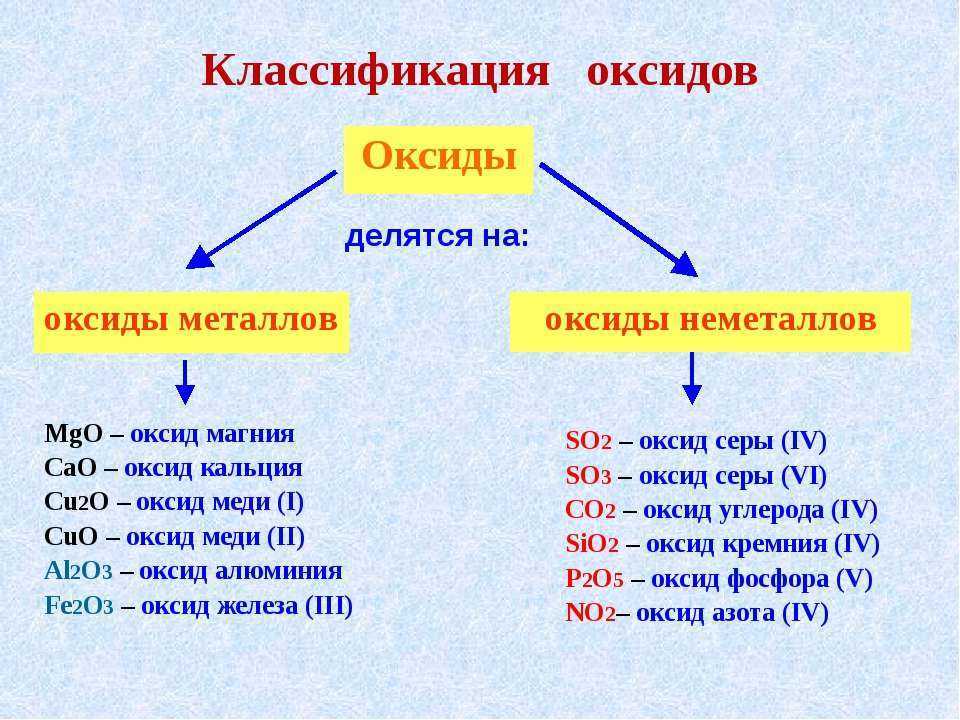 д.
д.
Например, Li2CO3 = Li2O + CO2↑
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Татьяна Сосновцева
К предыдущей статье
Ковалентные неполярные и полярные связи
К следующей статье
Химические свойства металлов
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
фактов, которые вы должны знать —
Суприя Упадхья
Основные оксиды — это оксиды, которые являются основными по своей природе и содержат один или несколько атомов кислорода, либо они реагируют с водой с образованием основания, либо реагируют с кислотой с образованием соль.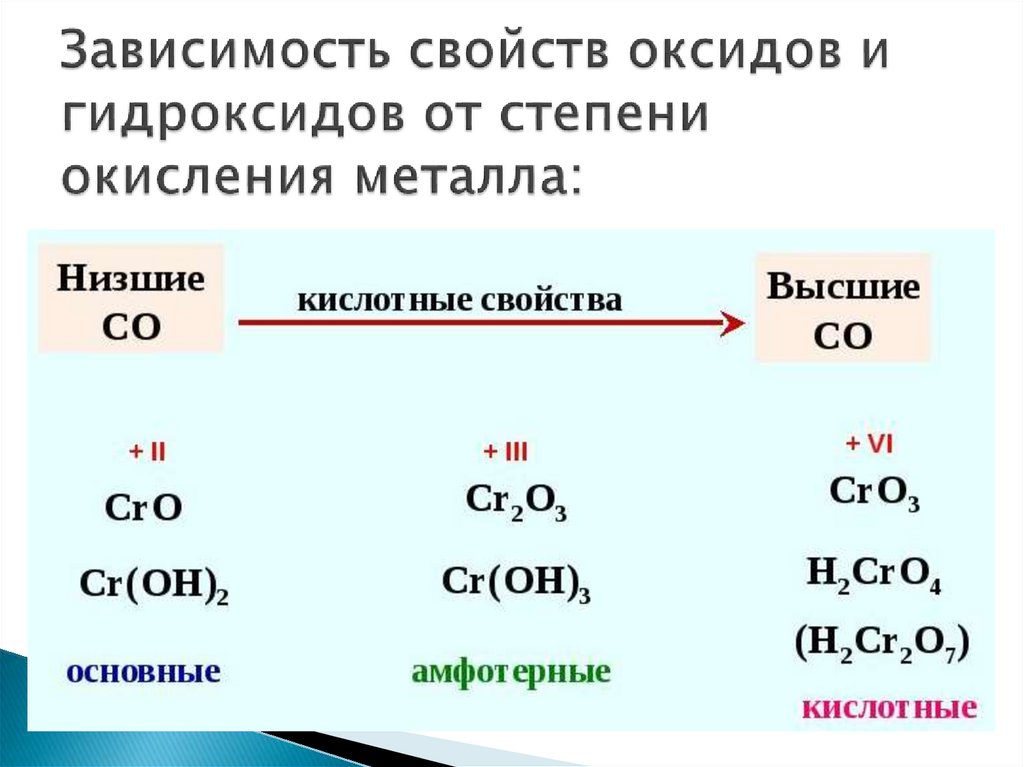 В периодической таблице элементы 1-й группы — щелочные, элементы 2-й группы — щелочноземельные металлы, элемент 13-й группы — Tl2O, и элемент 15-й группы — Bi 2 O 3 образуют основные оксиды. Примеры основных оксидов включают
В периодической таблице элементы 1-й группы — щелочные, элементы 2-й группы — щелочноземельные металлы, элемент 13-й группы — Tl2O, и элемент 15-й группы — Bi 2 O 3 образуют основные оксиды. Примеры основных оксидов включают
- Lithium Oxide ( Li 2 O)
- Sodium Oxide ( Na 2 O)
- Potassium Oxide ( K 2 O)
- Оксид рубидия (RB 2 O)
- Оксид цезия ( CS 2 O)
- Магний Оксид (MGO)
- CALCIDE (966555955 (59559559565 (595955955955955 (9000)
- .0022
- Strontium Оксид (SRO)
- Оксид бария ( BAO)
- Thallium (I) Оксид ( TL 2
- 9000.
 O 3 )
O 3 )
1.
Окись лития:соединяется с кислородом при температуре выше 100 °C
4Li + O 2 → 2Li 2 O.
При сжигании металлического лития образуется оксид лития из ВикипедииОксид лития реагирует с водой и паром и образует гидроксид лития. Используется в керамической промышленности и барьерных покрытиях.
2. Оксид натрия:Химическая формула оксида натрия: Na 2 O. Это белое твердое вещество, которое образуется в результате реакции f натрия с следует:
2NaOH + 2Na → 2Na 2 O + H 2
Реакция оксида натрия с водой дает гидроксид натрия, который является основанием. Реакция приведена ниже. Реакция представлена как
Na 2 O + 2HCl → 2NaCl + H 2 O
В различных материалах, таких как керамика и стекло, в качестве компонента используется оксид натрия.
3.
Оксид калия:Химическая формула оксида калия K 2 O. Это бледно-желтое твердое вещество, обладающее высокой реакционной способностью. Оксид калия получают реакцией пероксида с калием.
K 2 O 2 +2K→ 2K 2 O
4.
Оксид рубидия:Химическая формула Оксид рубидия Rb 2 O. Это твердое вещество желтого цвета, которое играет важную роль в применении топливных элементов. Он реагирует с водой с образованием гидроксида рубидия, который дается как
Rb 2 O + H 2 O → 2 RbOH
Оксид рубидия реагирует с водородом с образованием гидрида рубидия и гидроксида рубидия. Реакция протекает следующим образом:
Rb 2 O + H 2 → RbOH + RbH
5.
Оксид цезия: Химическая формула Оксид цезия Cs 2 O.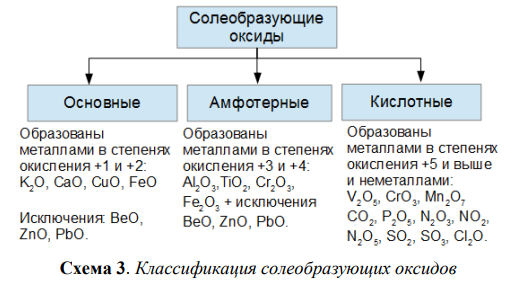 Это кристалл желто-оранжевого цвета, который используется в фотокатодах телевизионных камер. Оксид цезия реагирует с водой с образованием гидроксида цезия.
Это кристалл желто-оранжевого цвета, который используется в фотокатодах телевизионных камер. Оксид цезия реагирует с водой с образованием гидроксида цезия.
Cs 2 O (s) + H 2 O (l) → 2CsOH (водн.)
6.
Оксид магния: 9 оксид магния Это белое гигроскопичное твердое вещество, состоящее из Mg 9.0226 2+ и O 2- удерживаются вместе за счет ионной связи. Оксид магния реагирует с водой с образованием гидроксида магния Реакция задается какMgO + 2 HCl → MgCl 2 + H 2 O
Одним из физических свойств оксида магния является то, что он является хорошим теплопроводником и электрическим изолятором, который широко используется в теплоизоляции и огнеупорный кирпич. Оксид магния используется в медицине, пищевых добавках, изоляторах, удобрениях для растений и кормах для животных.
7.
Оксид кальция: Химическая формула оксида кальция CaO. Ее еще называют негашеной или известью. Оксид кальция реагирует с водой и образует основание, называемое гидроксидом кальция.
Ее еще называют негашеной или известью. Оксид кальция реагирует с водой и образует основание, называемое гидроксидом кальция.
CaO +H 2 O → Ca (OH) 2
Оксид кальция широко используется в сталелитейной промышленности, при очистке воды.
8.
Оксид стронция:Химическая формула Оксид стронция SrO. это белого цвета, а растворим в гидроксиде калия. Смесь оксида стронция и нитрида стронция образуется при сжигании стронция на воздухе . Оксид стронция играет важную роль в электронно-лучевых трубках и блокирует рентгеновское излучение.
9. Оксид бария:Химическая формула Оксид бария – BaO. Это негорючее соединение белого цвета. Его получают нагреванием карбоната бария при высокой температуре.
BaCO 3 → BaO + CO 2
Оксид бария используется в качестве компонента кронового стекла, электронно-лучевых трубок и катализаторов.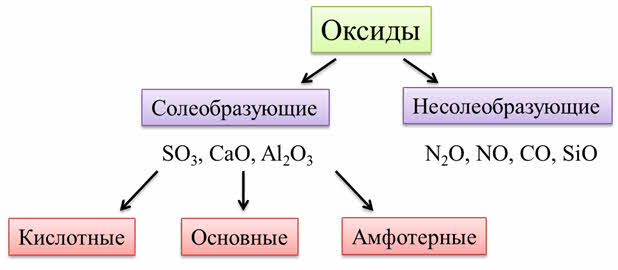
Химическая формула Оксид таллия (I): Tl 2 O, где таллий находится в степени окисления +1. Это элемент группы 13, который имеет черный цвет и меняет цвет на желтый при растворении в воде с образованием гидроксида таллия (I).
Оксид таллия (I) реагирует с водой с образованием гидроксида таллия (I). Реакция приведена ниже
Tl 2 O (s) + H 2 O (l) → 2 TlOH (aq)
Он используется в качестве важного компонента в высокотемпературных сверхпроводниках и в стекле с высоким индексом.
11. Оксид висмута (IΙΙ):Химическая формула Оксид висмута (IΙΙ) Bi 2 O 3. Висмут относится к элементу 15 группы в периодической таблице и имеет желтый цвет. Оксид висмута (IΙΙ) из Википедии
Оксид висмута (IΙΙ) реагирует с водой с образованием гидроксида висмута (III).
Bi 2 O 3 (s) + 3 H 2 O (l) → 2 Bi(OH) 3 (aq)
Bi 2 O 3 оксидные топливные элементы, стоматологические материалы и гидравлические силикатные цементы.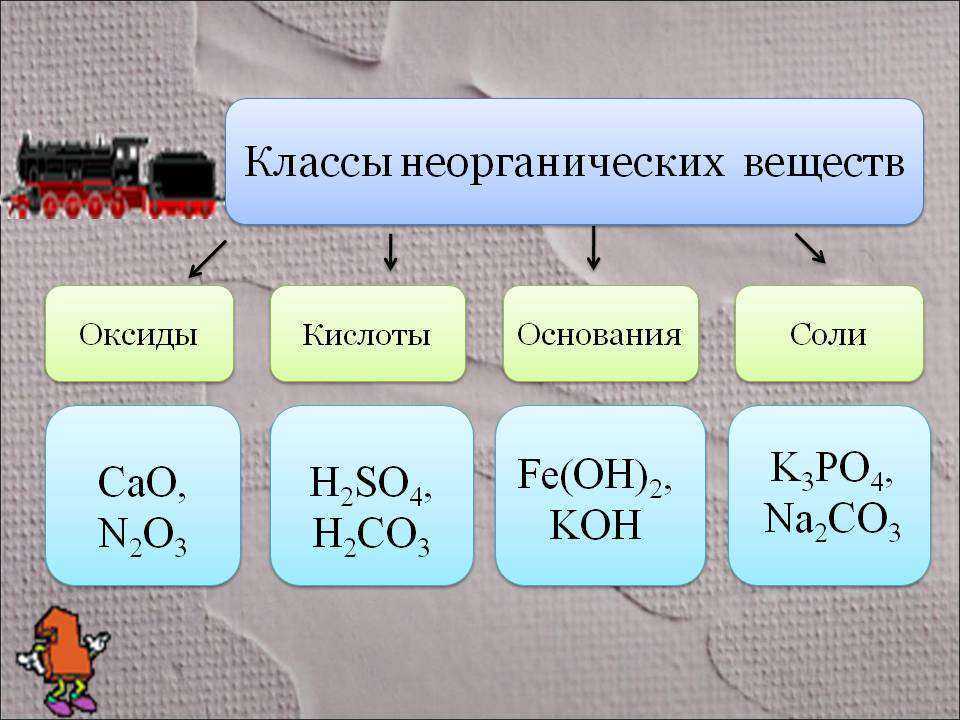
Основные оксиды являются основными по своей природе, реагируют ли они с водой или кислотой. Щелочной, щелочноземельный металл, элемент группы 13, который представляет собой Tl2O, и элемент группы 15, который представляет собой Bi2O3, являются примерами основных оксидов, и они также являются основными по своей природе.
Разница между кислотными и основными оксидами
Основное отличие – кислотные и основные оксиды
Оксид – это любое химическое соединение, содержащее один или несколько атомов кислорода. Оксиды могут быть кислотными или основными в зависимости от их химического состава, реакций и рН. Кислотные оксиды реагируют с водой, образуя кислый раствор. Они могут реагировать с основанием с образованием соли. Основные оксиды реагируют с водой, образуя основной раствор, и они могут реагировать с кислотой с образованием соли. Кислотные оксиды имеют низкий pH, тогда как основные оксиды имеют высокий pH. Однако основное различие между кислотными оксидами и основными оксидами заключается в том, что кислотные оксиды при растворении в воде образуют кислоты, тогда как основные оксиды при растворении в воде образуют основания.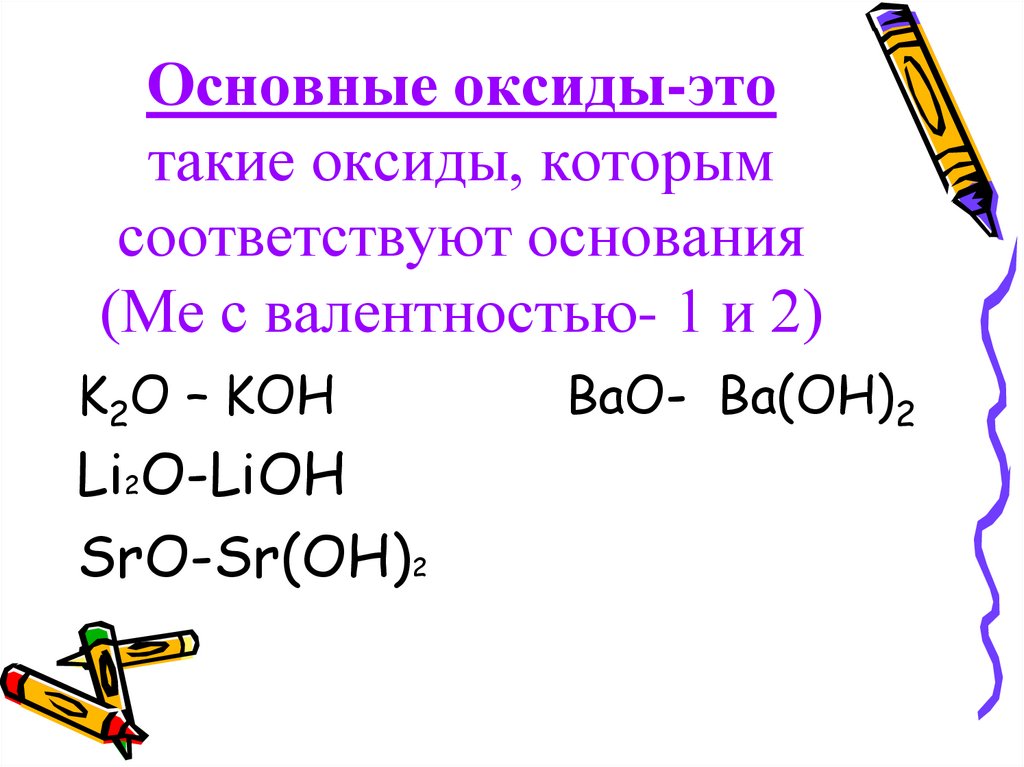
Ключевые области, охватываемые
1. Что представляет собой кислый оксид
— Определение, химические свойства, неметальные оксиды, примеры
2. Основные оксид
— определения, определения, определения, химические свойства, химии, химические свойства, Chemicalies, Chemicalies, Cemicalies, Gemacilies, Chemicalies, Cemicalies, Cemicalies, Cemicalies, Cemicalies, Cemicalies, Chemicalies. , Примеры
3. В чем разница между кислотными и основными оксидами
– Сравнение основных различий
Ключевые слова: кислоты, ангидриды кислот, оксиды кислот, основания, ангидриды оснований, оксиды оснований, оксиды неметаллов, оксиды металлов, оксиды, рН, соли
которые могут образовывать кислые растворы при растворении в воде. Кислотные оксиды образуются при взаимодействии неметалла с кислородом. Иногда кислотные оксиды образуются, когда металлы (с более высокими степенями окисления) также реагируют с кислородом.
 Кислотные оксиды реагируют с водой и образуют водные кислоты.
Кислотные оксиды реагируют с водой и образуют водные кислоты.Кислотные оксиды классифицируются как ангидриды кислот . Это потому, что они производят кислотное соединение этого оксида при растворении в воде. Например, диоксид серы называется сернистым ангидридом, а триоксид серы называется серным ангидридом. Кислотные оксиды могут реагировать с основанием с образованием его соли.
Обычно кислотные оксиды имеют низкие температуры плавления и низкие температуры кипения, за исключением оксидов, таких как диоксид кремния, которые имеют тенденцию образовывать гигантские молекулы. Эти оксиды растворяются в основаниях и образуют соль и воду. Когда кислотный оксид растворяется в воде, он снижает pH пробы воды из-за образования H + ионов. Некоторыми распространенными примерами кислотных оксидов являются CO 2 , P 2 O 5 , NO 2 , SO 3 и т. д.
Рис.
Оксиды неметаллов
Оксиды неметаллов представляют собой оксидные соединения, образованные неметаллическими элементами. Большинство элементов p-блока являются неметаллами. Они образуют различные оксидные соединения. Оксиды неметаллов являются ковалентными соединениями, поскольку они делят электроны с атомами кислорода, образуя молекулы оксида. Большинство оксидов неметаллов после реакции с водой дают кислоты. Следовательно, оксиды неметаллов являются кислотными соединениями. Например, когда SO 3 растворяется в воде, образуя раствор H 2 SO 4 , обладающий высокой кислотностью. Оксиды неметаллов реагируют с основаниями с образованием солей.
Большинство элементов p-блока являются неметаллами. Они образуют различные оксидные соединения. Оксиды неметаллов являются ковалентными соединениями, поскольку они делят электроны с атомами кислорода, образуя молекулы оксида. Большинство оксидов неметаллов после реакции с водой дают кислоты. Следовательно, оксиды неметаллов являются кислотными соединениями. Например, когда SO 3 растворяется в воде, образуя раствор H 2 SO 4 , обладающий высокой кислотностью. Оксиды неметаллов реагируют с основаниями с образованием солей.
Что такое основной оксид
Основные оксиды, также называемые ангидридами оснований , представляют собой соединения, которые могут образовывать основные растворы при растворении в воде. Основные оксиды образуются в результате реакции кислорода с металлами. Из-за разницы в электроотрицательности кислорода и металлов большинство основных оксидов имеют ионную природу. Таким образом, они имеют ионные связи между атомами.
Основные оксиды активно реагируют с водой, образуя основные соединения. Эти оксиды реагируют с кислотами и образуют соль и воду. При добавлении в воду основного оксида рН воды увеличивается из-за образования гидроксильных ионов (ОН – ). Некоторыми примерами распространенных основных оксидов являются Na 2 O, CaO, MgO и т. д. Следовательно, оксиды металлов в основном являются основными оксидами.
Рис. 2: MgO — основной оксид. Это оксид металла.
Оксиды металлов
Оксиды металлов представляют собой химические соединения, содержащие металл и один или несколько атомов кислорода. Здесь степень окисления кислорода равна -2, и это по существу анион, тогда как металл является катионом. Щелочные металлы (элементы группы 1), щелочноземельные металлы (элементы группы 2) и переходные металлы (некоторые элементы d-блока) образуют основные оксиды. Но металлы с высокими степенями окисления могут образовывать оксиды ковалентной природы. Они более кислые, чем основные.
Они более кислые, чем основные.
Количество атомов кислорода, которые связываются с ионом металла, зависит от степени окисления иона металла. Щелочные металлы образуют только одновалентные катионы. Поэтому они образуют только оксиды типа М 2 О (где М — ион металла, О — анион оксида). Щелочноземельные металлы образуют двухвалентные катионы. Поэтому они образуют оксиды типа МО. Эти соединения являются основными.
Разница между кислотными и основными оксидами
Определение
Кислотные оксиды: Кислотные оксиды — это соединения, которые могут образовывать кислые растворы при растворении в воде.
Основные оксиды: Основные оксиды представляют собой соединения, которые могут образовывать основные растворы при растворении в воде.
Формирование
Кислотные оксиды: Кислотные оксиды образуются, когда кислород реагирует с неметаллами.
Основные оксиды: Основные оксиды образуются при взаимодействии кислорода с металлами.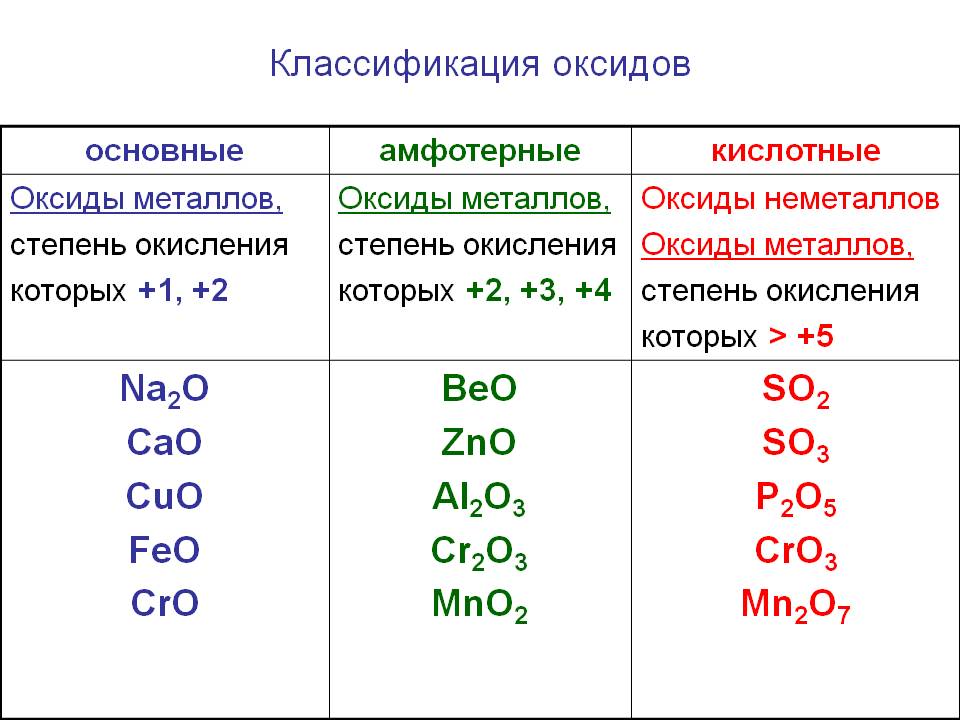
Реакция с водой
Кислотные оксиды: Кислотные оксиды реагируют с водой с образованием кислотных соединений.
Основные оксиды: Основные оксиды реагируют с водой с образованием основных соединений.
Реакция с кислотами
Кислотные оксиды: Кислые оксиды не реагируют с кислотами.
Основные оксиды: Основные оксиды реагируют с кислотами с образованием соли.
Реакция с основаниями
Кислотные оксиды: Кислые оксиды реагируют с основаниями с образованием соли.
Основные оксиды: Основные оксиды не реагируют с основаниями.
Связки
Кислотные оксиды: Кислотные оксиды имеют ковалентные связи.
Основные оксиды: Основные оксиды имеют ионные связи.
Влияние на pH
Кислотные оксиды: Когда кислотные оксиды растворяются в воде, это снижает pH.



 O 3 )
O 3 )
Leave A Comment