Строение атома кислорода и схема электронной оболочки элемента
4.5
Средняя оценка: 4.5
Всего получено оценок: 323.
4.5
Средняя оценка: 4.5
Всего получено оценок: 323.
Кислород (O) – жизненно важный газ, необходимый для дыхания, поддержания горения, окисления. Относится к группе халькогенов. Самый распространённый на Земле элемент. Строение атома кислорода позволяет ему соединяться с металлами и неметаллами, образуя оксиды.
Строение
По положению в периодической таблице Менделеева можно определить строение атома элемента кислорода. Это восьмой элемент, расположенный в VI группе, втором периоде. Относительная атомная масса – 16. Существует три изотопа элемента:
- 16O;
- 17O;
- 18O.
Наиболее распространён 16O.
Рис. 1. Положение кислорода в периодической таблице.Электронная конфигурация атома кислорода – 1s22s22p4. Ядро атома кислорода имеет заряд +8. Кислород относится к элементам р-семейства. На внешнем энергетическом уровне находится шесть валентных электронов. Два спаренных электрона находится на 2s-орбитали. На 2р-уровне находится два спаренных и два неспаренных электрона, поэтому во всех соединениях кислород проявляет вторую валентность.
Ядро атома кислорода имеет заряд +8. Кислород относится к элементам р-семейства. На внешнем энергетическом уровне находится шесть валентных электронов. Два спаренных электрона находится на 2s-орбитали. На 2р-уровне находится два спаренных и два неспаренных электрона, поэтому во всех соединениях кислород проявляет вторую валентность.
Молекула кислорода имеет два атома – О2. При присоединении ещё одного атома образуется озон – О3.
Физические свойства
Кислород – бесцветный и безвкусный газ, плохо растворимый в воде и спирте. Хорошо растворим в жидком серебре. В сжиженном виде приобретает светло-голубой цвет, в твёрдом – синий. Занимает 21 % атмосферного воздуха.
Рис. 3. Твёрдый кислород.Кислород поддерживает горение, поэтому его легко обнаружить с помощью тлеющей лучины (вспыхивает).
Химические свойства
Благодаря электронному строению обладает высокой степенью окисления. Однако большую активность проявляет при нагревании из-за прочных двойных связей между атомами.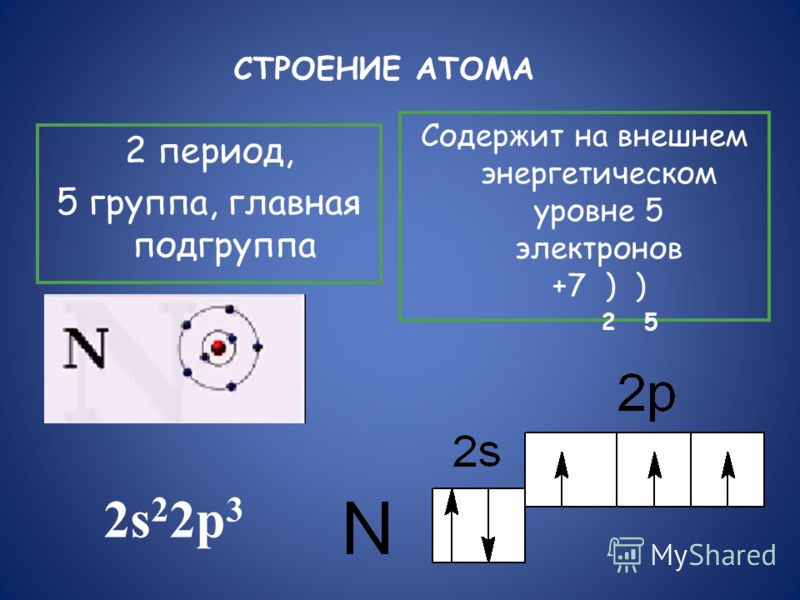 При комнатной температуре быстро реагирует с наиболее активными элементами – щелочными и щелочноземельными металлами, некоторыми неметаллами.
При комнатной температуре быстро реагирует с наиболее активными элементами – щелочными и щелочноземельными металлами, некоторыми неметаллами.
Соединяясь с элементами, образует оксиды. Окисляет органические вещества. Примеры реакций с простыми веществами:
- K + O2 → KO2;
- 3Fe + 2O2 → Fe3
- S + O2 → SO2.
С фосфором, серой, углеродом (графитом), водородом кислород реагирует при нагревании:
- 4Р + 5О2 → 2Р2О5;
- S + O2 → SO2;
- С + О2 → СО2;
- 2Н2 + О2 → 2Н2О.
Быстро пропуская фтор через щёлочь, получают реакцию кислорода с фтором:
2F2 + 2NaOH → 2NaF + H2O + OF2.
Кислород с фтором непосредственно взаимодействует при электрическом разряде. В этом случае кислород играет роль восстановителя:
O2 + F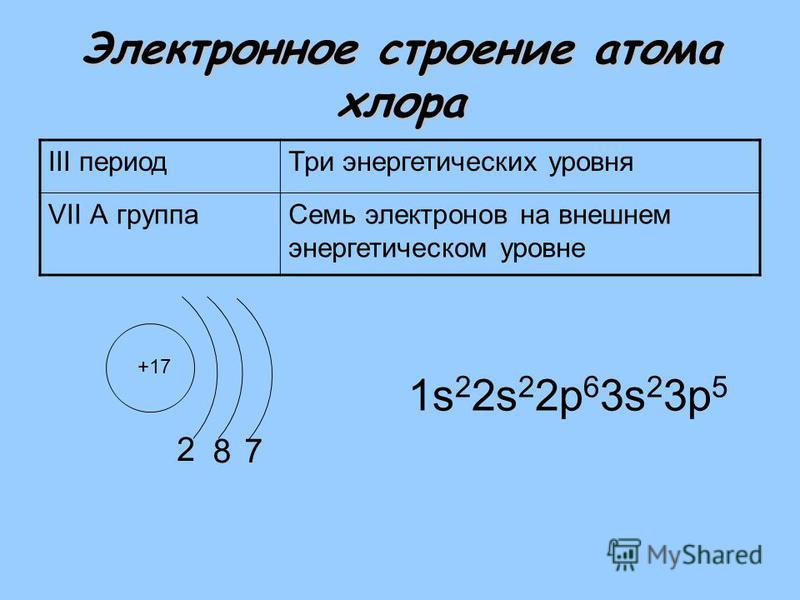
Кислород реагирует со сложными веществами, образуя оксиды:
- 2CuS + 3O2 → 2CuO + 2SO2;
- 2H2S + 3O2 → 2SO2 + 2H2O;
- 2C6H6 + 15O2 → 12CO2 + 6H2O;
- CH4 + 2O2 → CO2 + 2H2O.
Кислород не реагирует с золотом и инертными газами. Взаимодействие с галогенами происходит в условиях ультрафиолета или электрического тока.
Что мы узнали?
Кислород – распространённый в природе бесцветный газ. Схема строения атома – +8 О)
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
5/5
Мила Кондратьева
5/5
Семён Гольдфарб
5/5
Александр Котков
5/5
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 323.
А какая ваша оценка?
Квантовые числа | CHEMEGE.RU
Материалы портала onx.distant.ru
Общая характеристика квантовых чисел
Принцип (запрет) Паули
Правило Хунда
Примеры решения задач
Задачи для самостоятельного решения
Общая характеристика квантовых чисел
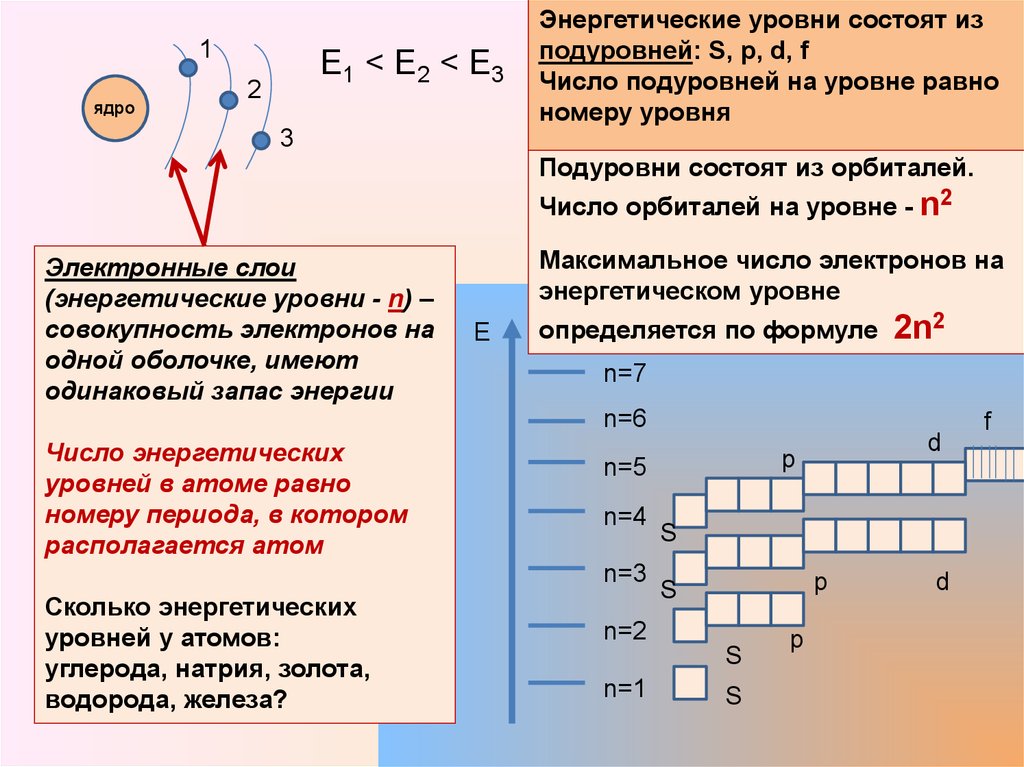
Главное квантовое число n характеризует энергию электрона в атоме и размер электронной орбитали. Оно соответствует также номеру электронного слоя, на котором находится электрон. Совокупность электронов в атоме с одинаковым значением главного квантового числа n называют электронным слоем (энергетическим уровнем).
Оно соответствует также номеру электронного слоя, на котором находится электрон. Совокупность электронов в атоме с одинаковым значением главного квантового числа n называют электронным слоем (энергетическим уровнем).
| Значение n | 1 | 2 | 3 | 4 | 5 | 6 |
| Обозначение слоя | K | L | M | N | O | P |
Различия в энергиях электронов, принадлежащих к различным подуровням данного энергетического уровня, отражает побочное (орбитальное) квантовое число l. Электроны в атоме с одинаковыми значениями n и l составляют энергетический подуровень (электронную оболочку)
Nl = 2(2l + 1). (1)
(1)
Побочное квантовое число принимает целые значения 0, 1, … (n – 1). Обычно l обозначается не цифрами, а буквами:
| Значение l | 0 | 1 | 2 | 3 | 4 |
| Обозначение орбитали | s | p | d | f | g |
Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, форму орбитали, орбитальный момент импульса электрона.
Таким образом, электрон, обладая свойствами частицы и волны, движется вокруг ядра, образуя электронное облако, форма которого зависит от значения l. Так, если l = 0, (s-орбиталь), то электронное облако имеет сферическую симметрию. При l = 1 (p-орбиталь) электронное облако имеет форму гантели.
- Формы электронных облаков для различных состояний электронов в атомах
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве, а также определяет величину проекции орбитального момента импульса на ось Z. ml принимает значения от +l до — l, включая 0. Общее число значений m
Магнитное спиновое квантовое число ms характеризует проекцию собственного момента импульса электрона на ось Z и принимает значения +1/2 и –1/2 в единицах h/2p (h – постоянная Планка).
Принцип (запрет) Паули
В атоме не может быть двух электронов со всеми четырьмя одинаковыми квантовыми числами. Принцип Паули определяет максимальное число электронов Nn, на электронном слое с номером n:
Nn = 2n2. (2)
На первом электронном слое может находиться не более двух электронов, на втором – 8, на третьем – 18 и т. д.
Правило Хунда
Заполнение энергетических уровней происходит таким образом, чтобы суммарный спин был максимальным. Например, три р-электрона на орбиталях р-оболочки располагаются следующим образом:
Таким образом, каждый электрон занимает одну р-орбиталь.
Примеры решения задач
Задача 1. Охарактеризуйте квантовыми числами электроны атома углерода в невозбужденном состоянии. Ответ представьте в виде таблицы.
Задача 2. Охарактеризуйте квантовыми числами внешние электроны атома кислорода в основном состоянии. Ответ представьте в виде таблицы.
Охарактеризуйте квантовыми числами внешние электроны атома кислорода в основном состоянии. Ответ представьте в виде таблицы.
Задача 3. Охарактеризуйте квантовыми числами пять электронов, находящихся в состоянии 4d. Ответ представьте в виде таблицы.
Задача 4. Рассчитайте максимальное число электронов в электронном слое с n = 4.
Задача 5. Рассчитайте максимальное число электронов в электронной оболочке с l = 3.
Задачи для самостоятельного решения
1. Охарактеризуйте квантовыми числами электроны атома бора в основном состоянии. Ответ представьте в виде таблицы:
| № электрона | n | l | ml | |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
2. Охарактеризуйте квантовыми числами d-электроны атома железа в основном состоянии. Ответ представьте в виде таблиц:
Охарактеризуйте квантовыми числами d-электроны атома железа в основном состоянии. Ответ представьте в виде таблиц:
Расположение 3d-электронов атома железа на орбиталях:
| ? | ? | ? | ? | ? |
Значения квантовых чисел этих электронов:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
3. Каковы возможные значения магнитного квантового числа ml, если орбитальное квантовое число l = 3?
4. Охарактеризуйте квантовыми числами находящиеся во втором электронном слое электроны:
Охарактеризуйте квантовыми числами находящиеся во втором электронном слое электроны:
Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
| 7 | ? | ? | ? | ? |
5. Определите максимальное число электронов на электронном слое, для которого главное квантовое число n = 6.
6. Определите максимальное число электронов на электронной оболочке, для которой побочное квантовое число l = 4.
7. Определите максимальное число электронов на третьем слое.
8. Определите максимальное число электронов на 5d электронной оболочке.
9. Какие значения может принимать орбитальное (побочное) квантовое число l?
Понравилось это:
Нравится Загрузка…
Chem4Kids.com: Oxygen: Orbital and Bonding Info
Посмотрите на доску. В этом поле слева есть вся информация, которую вам нужно знать об одном элементе. Он сообщает вам массу одного атома, сколько частей внутри и где он должен быть помещен в периодической таблице.
В следующем разделе мы рассмотрим электронные орбитали или электронные оболочки. Это может быть новой темой для некоторых из вас.
Взгляните на картинку ниже. Каждый из этих цветных шаров является электроном. В атоме электроны вращаются вокруг центра, также называемого ядром. Электроны любят быть отдельными снаряды/орбитали . Оболочка номер один может содержать только 2 электрона, оболочка номер два может содержать 8, а для первых восемнадцати элементов оболочка номер три может содержать максимум восемь электронов. Когда вы узнаете об элементах с более чем восемнадцатью электронами, вы обнаружите, что третья оболочка может содержать больше восьми. Как только одна оболочка заполнена, следующий добавленный электрон должен перейти на следующую оболочку.
Электроны любят быть отдельными снаряды/орбитали . Оболочка номер один может содержать только 2 электрона, оболочка номер два может содержать 8, а для первых восемнадцати элементов оболочка номер три может содержать максимум восемь электронов. Когда вы узнаете об элементах с более чем восемнадцатью электронами, вы обнаружите, что третья оболочка может содержать больше восьми. Как только одна оболочка заполнена, следующий добавленный электрон должен перейти на следующую оболочку.
Итак… для элемента КИСЛОРОД вы уже знаете, что атомный номер говорит вам о количестве электронов. Это означает, что в атоме кислорода 8 электронов. Глядя на картинку, вы можете видеть, что на первой оболочке два электрона, а на второй — шесть.
► Подробнее об истории и местах, где можно найти кислород.
► Следующий элемент периодической таблицы.
- Скажи/Найди
- Орбитали/связи
- Предыдущий элемент
- Следующий элемент
- Список элементов
- Периодическая таблица
- Дополнительные темы
Это молекула воды. Даже если вы найдете сложные названия для других молекул, все называют H 2 O «вода». Вода состоит из двух атомов водорода (Н) и одного атома кислорода (О). Формула воды: H 2 O . Атомы водорода имеют заполненные орбитали двумя электронами, а атом кислорода заполнен восемью электронами. Даже если вы найдете сложные названия для других молекул, все называют H 2 O «вода». Вода состоит из двух атомов водорода (Н) и одного атома кислорода (О). Формула воды: H 2 O . Атомы водорода имеют заполненные орбитали двумя электронами, а атом кислорода заполнен восемью электронами. | ||
| Два атома лития (Li) могут быть связаны с одним атомом кислорода (O), что дает формулу Li 2 O . Кислород любит иметь два дополнительных электрона, чтобы сделать его счастливым. Каждый атом лития обеспечивает один. Вы можете видеть, что атом кислорода имеет восемь электронов (6 собственных и по одному от каждого лития), а два атома лития имеют по два электрона каждый. | ||
Два атома водорода (H) также могут быть связаны с двумя атомами кислорода (O), образуя формулу H 2 O 2 .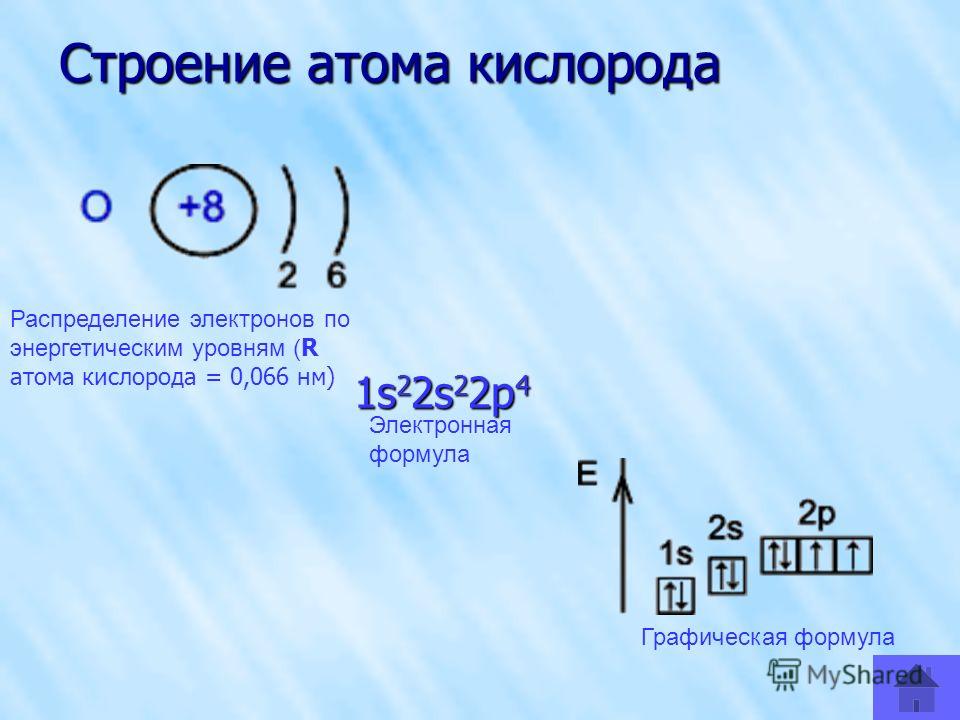 Это всего лишь на один кислород больше, чем в воде, но это совершенно другое соединение. Вы можете видеть, что каждый из атомов кислорода имеет восемь электронов, а два атома водорода имеют по два электрона. Видите, как делятся электроны? Это всего лишь на один кислород больше, чем в воде, но это совершенно другое соединение. Вы можете видеть, что каждый из атомов кислорода имеет восемь электронов, а два атома водорода имеют по два электрона. Видите, как делятся электроны? | ||
Видео с вопросами: определение структуры электронной оболочки атома кислорода
Стенограмма видео
На каком изображении показано расположение электронов в атоме кислорода?
Нам дали пять диаграммы электронных оболочек. В середине рисунок А. ядро, намного, намного больше по отношению к атому, чем оно было бы в действительности жизнь. Красные кружки с p — протоны, а белые кружки с n — нейтроны. Черные кружки это электроны оболочки, в которых может разместиться ограниченное число электронов. А синие точки это электроны.
Что задает вопрос?
рисунок, показывающий расположение электронов в атоме кислорода. Кислород – это элемент, который мы можем
найти в периодической таблице. Там мы видим, что атомный
число кислорода равно восьми. Это означает, что каждый атом или ион
у кислорода восемь протонов в ядре. Атомы нейтральны, значит, мы
необходимо равное количество электронов и протонов. Первое, что мы можем сделать, это проверить
на всех наших диаграммах изображено восемь протонов и восемь электронов.
Кислород – это элемент, который мы можем
найти в периодической таблице. Там мы видим, что атомный
число кислорода равно восьми. Это означает, что каждый атом или ион
у кислорода восемь протонов в ядре. Атомы нейтральны, значит, мы
необходимо равное количество электронов и протонов. Первое, что мы можем сделать, это проверить
на всех наших диаграммах изображено восемь протонов и восемь электронов.
Все ядра выглядят одинаково, и каждый из них имеет восемь протонов. Это означает, что мы имеем дело с ядра кислорода, и мы можем перейти к следующему тесту. Самый простой способ посчитать электронов состоит в том, чтобы разработать электронную конфигурацию каждой диаграммы. Делаем это, считая электронов в каждой оболочке, начиная с первой оболочки.
На первой диаграмме есть два
электронов на первой электронной оболочке, на второй их два, а на
четыре в третьем. Это правильное количество
электронов, но мы вернемся к этому через мгновение. На второй схеме есть
конфигурация два, шесть. И третий
диаграмма имеет конфигурацию ноль, восемь. Помните, ноль по-прежнему имеет значение
потому что это внутренняя оболочка. На четвертой схеме есть
конфигурация восьмая. И последняя схема имеет
конфигурация четыре, четыре.
Это правильное количество
электронов, но мы вернемся к этому через мгновение. На второй схеме есть
конфигурация два, шесть. И третий
диаграмма имеет конфигурацию ноль, восемь. Помните, ноль по-прежнему имеет значение
потому что это внутренняя оболочка. На четвертой схеме есть
конфигурация восьмая. И последняя схема имеет
конфигурация четыре, четыре.
Каждая электронная оболочка имеет фиксированную максимальное количество электронов, которое он может поместить. Вы можете поместить два электрона в первой электронной оболочки и до восьми во второй. Другой принцип, который мы собираемся использовать, чтобы найти ответ, что электроны занимают наиболее стабильное пространство. Для диаграмм электронных оболочек это означает самую низкую доступную оболочку.
Итак, на первой диаграмме мы можем
см., что есть два электрона в самой нижней доступной оболочке. Это хорошо. Однако имеется четыре электрона
в третьей оболочке, когда во второй еще есть место. Значит, это не правильно
диаграмма. На второй схеме есть
снова два электрона на первой электронной оболочке. А оставшиеся шесть из
восемь электронов заполняют вторую оболочку, как и должны. Значит, это правильно
диаграмма. Но давайте посмотрим на остальные три
на всякий случай.
Это хорошо. Однако имеется четыре электрона
в третьей оболочке, когда во второй еще есть место. Значит, это не правильно
диаграмма. На второй схеме есть
снова два электрона на первой электронной оболочке. А оставшиеся шесть из
восемь электронов заполняют вторую оболочку, как и должны. Значит, это правильно
диаграмма. Но давайте посмотрим на остальные три
на всякий случай.
На третьей диаграмме есть
восемь электронов на второй оболочке при наличии двух свободных мест в
первый. Значит, это не правильно
конфигурация. Для четвертой диаграммы все
электронов в первой электронной оболочке, что на шесть слишком много. А на последней схеме есть
два слишком много электрона в первой электронной оболочке. Это означает, что изображение, которое показывает
правильное расположение электронов в атоме кислорода — восемь
протонов в ядре, два электрона в первой оболочке и шесть во второй.

Leave A Comment