Строение атома кислорода (O), схема и примеры
Общие сведения о строении атома кислорода
Порядковый номер равен 8. Заряд ядра равен +8. Атомный вес – 15,999а.е.м. В природе встречаются три изотопа кислорода: 16O,17O и 18O, из которых наиболее распространенным является 16O (99,762 %).
Электронное строение атома кислорода
Атом кислорода имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы –VI (халькогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 6 валентных электронов. Обладает высокой окислительной способностью (выше только у фтора).
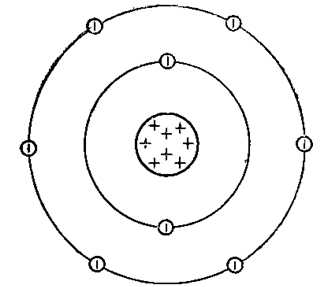
Рис. 1. Схематичное изображение строения атома кислорода.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p4.
Кислород – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
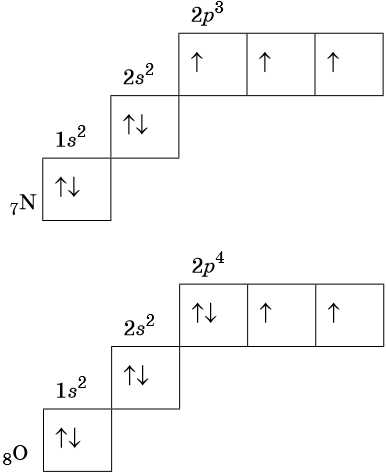
У кислорода есть 2 пары спаренных электронов и два неспаренных электрона. Во всех своих соединениях кислород проявляет валентность II.
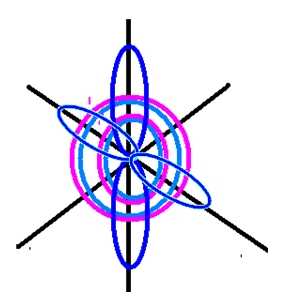
Рис. 2. Пространственное изображение строения атома кислорода.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Тест по теме «Строение атома»
Тема «Строение атома»
Часть А. Тестовые задания с выбором одного ответа
1 Электронная формула внешнего энергетического уровня атома серы
А) 3s23p2 В) 3s23p4С) 3s13p4 D) 4s2
2. Порядковый номер элемента в Периодической системе указывает на
A) заряд ядра атома
В) число электронов в наружном слое атома
С) число электронных слоев в атоме
D) значение электроотрицательности элемента
Е) число энергетических подуровней на электронном слое
F) значение атомной массы элемента
G) число нейтронов в атоме
H) максимальную валентность элемента в соединениях с кислородом
3. Ряд чисел 2,8,5 соответствует распределению электронов по энергетическим уровням атома
А) алюминияВ) фосфораС) азотаD) хлора Е) сера F) аргон G) кремний H) магний
4. Электронная формула атома 1s22s22p63s23p2. Химический знак и формула водородного соединения этого элемента
А) C и CH4В) Si и SiH4С) О и Н2ОD) Cl и HCl
Е) S и H2S F) P и PH3 G) N и NH3 H) F и HF
5. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А) В и Si В) S и Se С) К и Са D) Na и K Е) Мn и Fe F) G) H)
6. Является s-элементом
А) барий В) марганец С) сера D) углерод Е) цинк F) кремний G) кислород H)азот
7. Элемент с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле
А) Э2О В) Э2О3 С) ЭО2 D) ЭО Е) Э2О
8. Атом неона Ne, катион натрия Na+ и анион фтора F— имеют одинаковое
A) число протонов B)число электронов C) значение максимальной валентности D) число нейтронов E) энергетических подуровней F) значение максимальной степени окисления
G) значение атомной массы H) значение электроотрицательности
9. Число протонов, нейтронов и электронов в атоме 40Ar соответственно равно
A) 18, 22, 18 B) 40, 18, 40 C) 22, 18, 40 D) 18, 40, 18 E) 22, 40, 22 F) 18, 22, 40 G) 40, 22, 18 H) 22,18,18
10. Распределение электронов в атоме элемента четвертого периода IА группы соответствует ряду чисел
А) 2,8,8,2 В) 2,8,8,1 С) 2,8,18,2 D) 2,8,18,1 Е) 2,8,18,3 F) 2,8,18,3 G)2,8,18,1 H) 2,8,18,2
11. В четвертом электронном слое содержит пять электронов атом
А) V B) Р C) As D) Sn E) Zr F) Сu G) Sb H) N
12. Одинаковое число электронов и нейтронов в
A) атоме Ве B) ионе S2- C) ионе F— D) атоме Cr E) атоме S F) Ar G) Li H) Na
13 Атом кислорода и атом серы сходны по
A) числу электронов на внешнем слое B) значению максимальной степени окисления C) числу энергетических уровней D) числу нейтронов в ядре E) числу электронов в атоме F) заряду ядра
G) значению атомной массы H) значению электроотрицательности
14. В ядре атома элемента с электронной формулой 1s2 2s2 2p6 3s2 3p2 число протонов равно
A) 18 B) 10 C) 14 D) 12 E) 16 F) 24 G) 15 H)2
15. Атом металла, высший оксид которого Ме2О3, имеет электронную формулу внешнего энергетического уровня
A) ns
16. Ниже приведена томная модель атома химического элемента. Укажите данный элемент.
A) Mg B) Na C) Al D) Ar E) Cl F) P G) Si H) S
17. У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
А) 4 и + 16 В) 6 и + 32 С) 4 и + 32 D) 6 и + 16
18. Одинаковое электронное строение имеют частицы
А) Na0 и Na+В) Na+ и F— С) Na0 и K0 D) Cr2+ и Сr3+
E) Na0 и F— F) Na0 и K+ G) K0 и Cl0 H)K0 и Cl—
19. Является p-Элементом является
А) натрий B) фосфор C) уран D) кальций E) калий F) литий G) рубидий H)цезий
20. Формула высшего оксида элемента, электронная формула которого 1s
А) B2O3 В) N2O5C) P2O5 D) Al2O3 E) As2O5 F) SO3 G) P2O3 H) SiO3
21. В пятом электронном слое содержит четыре электрона атом
А) V B) Sb C) As D) Sn E) Zr F) Si G) Pb H) Sr
Часть В. Задания с выбором нескольких правильных ответов.
Состав аниона серы
А) протонов 32 В) электронов 18
F) протонов 16 G) электронов 14 H) протонов 18
2. Относятся к s- элементам
А) Zn В) Na С) Mg D) S Е) Li F) C G)Zn H) Cu
3. На внешнем энергетическом уровне пять электрон у
A) N B) Cl C) Si D) C E) Н F) Na G) P H) As
4. Атомы углерода и кремния различаются между собой
A) относятся к р-элементам
B) числом валентных электронов
C) относятся к неметаллам
D) числом вакантных орбиталей на внешнем энергетическом уровне
E) зарядом ядра
F) количеством электронов на последнем энергетическом уровне
G) значением максимальной валентности
H) числом энергетических уровней
5. Порядковый номер элемента в Периодической системе указывает на
A) заряд ядра атома
В) число электронов в наружном слое атома
С) число электронов в атоме
D) число нейтронов в атоме
Е) число энергетических подуровней на электронном слое
F) число протонов
G) максимальную валентность элемента в соединениях с кислородом
H) число электронных слоев в атоме
6. На последнем энергетическом уровне находится 8 электронов у
А) aтом аргона Ar B) атом кальция С) атом калия K D) анион хлора Сl—
Е) атом калия К F)катион кальция Са2+ G) атом хлора H) анион фтора F—
7. Электронная формула 1s22s22р6 соответствует
А) атому неона B) аниону кислорода C) атому кислорода D) аниону фтора
E) атому фтора F) атом кислорода G) атому натрия H) аниону хлора
8. Атом данного металла имеет электронную формулу внешнего энергетического уровня ns2np1
A) В B) O C) P D) As E) Аl F) C G) Ga H)Si
9. В реакциях элемент отдает один электрон
А) Li В) Zn С) Cl D) Rb Е) Na F) Аl G) Ca H) F
10. Двухэлектронную внешнюю оболочку имеет ион
А) S6+ В) S2-С) Br5+D) S4+Е) С2+ F) Sn4+ G) С4+ H) Br—
11. Является p- элементом
А) S В) Na С) Ca D) P Е) O F) K G) Zn H) Li
12. В реакциях элемент принимает один электрон
А) Li В) Zn С) Cl D) Rb Е) Вr F) K G) Ca H) F
13. Атом элемента, максимальная степень окисления которого + 4, в основном состоянии может иметь электронную конфигурацию внешнего энергетического уровня:
А) 3s23p4 В) 2s22p2 С) 2s22p4 D)3s23p2 Е) 2s22p6 F) 3s23p4 G) 4s24p2 H) 2s22p5
14. Частицы в паре имеют одинаковую электронную структуру
А) F— и Na+ В) F и Na+ С) Mg и Ca D) Mg2+ и Si2+
Е) F— и Na F) Mgи Si4+ G) H) Mg и Si2+H) K и Cl—
15. На s-подуровне находится 2 электрона (основное состояние) у
А) Са В) S С) Na D) Mg Е) Li F)К G) Rb H) H
16. Состав аниона фтора
А) протонов 19
В) электронов 10
С) нейтронов 10
D) электронов 16
Е) электронов 19
F) протонов 9
G) нейтронов 19
H) протонов 18
17. Относятся к d- элементам
А) Ag В) Zn С) K D) Cu Е) Na F) C G) S H) Cl
18. На внешнем энергетическом уровне 4 электрона у
A) N B) Cl C) Si D) C E) Н F) Na G) P H) Sn
19. Атомы азота и фосфора различаются между собой
A) значением максимальной валентности
B) числом валентных электронов
C) относятся к неметаллам
D) числом вакантных орбиталей на внешнем энергетическом уровне
E) зарядом ядра
F) количеством электронов на последнем энергетическом уровне
G) относятся к р-элементам
H) числом энергетических уровней
20. Порядковый номер элемента в Периодической системе указывает на:
A) число нейтронов в атоме
В) заряд ядра атома
С) число электронов в атоме
D) число протонов
Е) число энергетических подуровней на электронном слое
F) число электронов в наружном слое атома
G) число электронных слоев в атоме
H) максимальную валентность элемента в соединениях с кислородом
21 . Имеет 18 электронов
А) атом кальция B) атом фтора F С) атом калия К D) анион хлора Сl—
Е) катион калия K+ F)катион кальция Са2+ G) атом хлора H) анион фтора F—
22. Электронная формула 1s22s22р6 3 s23р6 соответствует
А) атому аргона B) аниону кислорода C) атому кислорода D) катиону кальция
E) атому фтора F) катиону калия G) атому натрия H) атому хлора
23 . Атом данного металла имеет электронную формулу внешнего энергетического уровня ns2np3
A) В B) O C) P D) As E) Аl F) N G) Ga H)Si
24. Данные элементы при взаимодействии отдают два электрона
А) Li В) Zn С) Cl D) Rb Е) Mg F) K G) Ca H) F
25. Двухэлектронную внешнюю оболочку имеет ион
А) S6+В) Br5+ С) S2- D) S4+ Е) С4+ F) Sn4+G) С2+ H) Br—
26. Данные химические элементы относятся к s — элементам
А) S В) Р С) Ca D) Аl Е) O F) K G) C H) Li
27. Данные элементы при взаимодействии принимают один электрон
А) Li В) Zn С) Cl D) Rb Е) Вr F) K G) Ca H) F
28. Атом элемента, максимальная степень окисления которого + 4, в основном состоянии может иметь электронную конфигурацию внешнего энергетического уровня:
А) 3s23p4 В) 2s22p2 С) 2s22p4 D)3s23p2 Е) 2s22p6 F) 3s23p4 G) 4s24p2 H) 2s22p5
29. Частицы в паре имеют одинаковую электронную структуру
А) F— и Na+ В) F и Na+ С) Mg и Ca D) Mg2+ и Si2+
Е) F— и Na F) Mgи Si4+ G) Mg и Si2+H) K и Cl—
30. На s-подуровне находится 1 электрона (основное состояние)
А) Са В) S С) Na D) Mg Е) Li F) Ва G) Rb H) H
Часть С. Тестовые задания на соотнесение.
Установите соответствие элементом и его электронной формулой
Элемент
Электронная формула
Берилий
Натрий
Хлор
А) 1s22s22p3
В) 1s22s2
С) 1s22s22p63s23p5D) 1s22s1
E) 1s22s22p63s¹F) 1s22s22p63s23p6
Установите соответствие между энергетическим подуровнем и числом орбиталей на нем:
Энергетический подуровень
Число орбиталей
1) s -подуровень
2) p-подуровень
3) d -подуровень
А) 2
В) 7
С) 1D) 3
E) 5
F) 4
Установите соответствие между ионом и его электронной формулой:
Ион
Электронная формула
1) Ca2+
2) O2-
3) Rb+
А) 1s22s22р63s23р6 4s23d104 р65s1
В) 1s22s22р63s23р64s2
С) 1s22s22р63s23р6
D) 1s22s22р6
E) 1s22s22р4
F) 1s22s22р63s23р6 4s23d104 р6
Установите соответствие между атомом элемента и количеством электронов, которые он отдает или принимает для завершения внешней электронной оболочки:
Атом элемента | Количество электронов |
| А) отдает 1 электрон В) отдает 2 электронa D) принимает 1 электрон E) принимает 2 электронa F) принимает 3 электронa |
Установите соответствие элементом и его электронной формулой
Элемент
Электронная формула
Алюминий
Калий
3) Сера
А) 1s22s22p63s23p64s1
В) 1s22s22p63s23p6
С) 1s22s22p63s23p4
D) 1s22s22p63s23p3
E) 1s22s22p63s23p1
F) 1s22s22p63s23p64s2Установите соответствие между энергетическим подуровнем и числом орбиталей на нем:
Энергетический подуровень
Число орбиталей
1) s -подуровень
2) p-подуровень
3) d -подуровень
А) 1
В) 2
С) 3D) 5
E) 7
F) 14
Установите соответствие между ионом и его электронной формулой
Ион | Электронная формула |
1) Cl— 2) F— 3) C+2 | А) 1s22s22р2 С) 1s22s22р63s23р6 D) 1s22s22р63s23р5 E) 1s22s2 |
8. Установите соответствие между атомом элемента и количеством электронов, которые он отдает
или принимает для завершения внешней электронной оболочки:
Атом элемента | Количество электронов |
| А) отдает 1 электрон В) принимает 1 электрона С) отдает 2 электронa D) принимает 2 электронa E) отдает 3 электронa F) принимает 3 электронa |
КЛЮЧ
Часть А. Тестовые задания с выбором одного ответа | |
1 | B |
2 | A |
3 | B |
4 | B |
5 | D |
6 | A |
7 | E |
8 | B |
9 | A |
10 | B |
11 | C |
12 | E |
13 | А |
14 | С |
15 | С |
16 | C |
17 | D |
18 | B |
19 | B |
20 | C |
21 | D |
Часть В. Задания с выбором нескольких правильных ответов. | |
1 | B C F |
2 | B C E |
3 | A H G |
4 | D E H |
5 | A C F |
6 | A D F |
7 | A B D |
8 | A E G |
9 | A D E |
10 | C D E |
11 | A D E |
12 | C E H |
13 | B D G |
14 | A G H |
15 | A B D |
16 | B C F |
17 | A B D |
18 | C D H |
19 | D E H |
20 | B C D |
21 | D E F |
22 | A D F |
23 | C D F |
24 | B E G |
25 | B D G |
26 | C F H |
27 | C E H |
28 | B D G |
29 | A G H |
30 | C E H |
Часть С. Тестовые задания на соотнесение. | |
1 | 1-B 2- Е, 3- С |
2 |
|
3 | 1- C 2- D 3- F |
4 | 1- A 2- E 3-C |
5 | 1-E 2-A 3-C |
6 | 1-A 2-C 3-D |
7 | 1-C 2-F 3-E |
8 |
|
kopilkaurokov.ru
Ответы@Mail.Ru: Помогите пожалуйста сделать химию
Обязательная часть 1. В атоме химического элемента электроны распределяются по электронным слоям соответственно ряду чисел: 2, 8, 6. Какое место в периодической системе химических элементов Д. И, Менделеева занимает этот элемент? Г. Третий период, VI группа, побочная подгруппа 2. Какой ряд чисел отражает распределение электронов по электронным слоям в ионе кальция? А. 2,8,8. 3. Выберите общие формулы, соответствующие высшему оксиду азота и азотной кислоте. Д. R2O5, HRO3 4. Оксид натрия не взаимодействует с … А. основаниями Г. основными оксидами 5. Выберите формулы ионных соединений: Г. KCl 6. Выберите формулы соединений азота, в которых он проявляет степень окисления, равную + 5. Б. NF5 Д. N2O5 Дополнительная часть 7. Укажите, какими буквами обозначены характеристики каждого из элементов 1-4 Ответ запишите в виде: 1 – А, 2 –Б, В, … . 1. Кремний 2. Сера 3. Азот 4. Вольфрам 3-А. Значения степеней окисления атомов элемента в соединениях: -3; +1; +2; +3; +4; +5. 1 -Б. Число электронов в атоме равно 14 3 -В. Образует летучее водородное соединение состава Rh4 1- Г. Распределение электронов по электронным слоям в атоме соответствует ряду Чисел: 2, 8, 4. 2 — Д. Внешний электронный слой образован шестью электронами. 2 -Е. Высший оксид состава RO3 обладает кислотными свойствами.
1)-Г. | Вроде 2)-А. | 3)-А. | 4)-НЕ знаю 5)-НЕ знаю 6)-Б. | 7)- а-хз б- 1 в- 3 г- 1 д- 2 е- 2 8)-хз
это из какого учебника или сборник тестов?
touch.otvet.mail.ru
Атомы внешний слой электронов — Справочник химика 21
Атом азота имеет семь электронов, из них пять находится во внешнем слое. Электронная формула атома азота 15 2з 2р соот- ветствует расположению [c.14]Естественно, что фундаментальный закон химии, открытый Д. И. Менделеевым, — периодический закон—должен найти себе объяснение в закономерности строения атоМов, вскрываемой квантовой механикой. Периодичность в изменении химических свойств элементов при возрастании заряда ядра определяется периодическим повторением у определенных атомов строения внешних электронных оболочек. Легко заметить, что число электронов в последовательности от 5 до ближайшей конфигурации (первый период) или (остальные периоды) равно 2, 8, 8, 18, 32 (табл. 3), т. е. совпадает с числом элементов в периодах системы Д. И. Менделеева и объясняет, почему именно столько элементов содержится в данном периоде. Период начинается элементом, у которого впервые в системе возникает новый квантовый слой, содержащий один л-электрон (щелочной металл), и оканчивается элементом, у которого впервые в этом квантовом слое достраивается шестью электронами -подоболочка (благородные газы). Очевидно, что номер периода )авен главному квантовому числу электронов внешнего слоя. Например, атом натрия, открывающий третий период, и атом аргона, заканчивающий его, имеют конфигурации К 13л и К соответст- [c.60]
Фосфор Р. Атом фосфора отличается от атома азота так же, как атом кремния от атома углерода. В атомах кремния и фосфора во внешнем электронном слое есть вакантные З -орби-тали, а в атомах углерода и азота на валентном (внешнем) слое вакантных -орбиталей нет. Разница в структуре валентного слоя атомов Р и N откладывает отпечаток на свойства веществ, образуемых этими элементами, которые в сходных соединениях заметно отличаются друг от друга. Так, например, молекула N2 чрезвычайно прочна, так как а-связь в этой молекуле дополнена двумя л-связями. В парах при температурах ниже 1000 °С, а также в жидком состоянии устойчивы четырехатомные молекулы Р4. При конденсации паров образуется белый фосфор — вещество с молекулярной кристаллической решеткой, в узлах которой находятся молекулы Р4. Белый фосфор плавится при температуре 45 °С и легко растворяется в органических растворителях (СЗа и др.). Белый фосфор ядовит. [c.278]
Рассмотрим электронную структуру оксида азота (I) с учетом того, что его ковалентность определяется не только числом неспаренных электронов, но и наличием у него неподеленной пары электронов. Атом кислорода, имеющий два неспаренных электрона, образует две ковалентных связи с центральным атомом азота. За счет неспаренного электрона, оставшегося у центрального атома азота, последний образует ковалентную связь со вторым атомом азота. Таким образом, внешние электронные слои атома кислорода и центрального атома азота оказываются заполненными здесь образуются устойчивые восьмиэлектронные конфигурации. Но во внешнем электронном слое крайнего атома азота размещено только шесть электронов этот атом люжет, следовательно, быть акцептором еще одной электронной пары. Соседний же с ним центральный атом азота обладает неподеленной электронной парой и может выступать в качестве донора. Это приводит к образованию по донорно-акцепторному способу еще одной ковалентной связи между атомами азота. Теперь каждый из трех атомов, составляющих молекулу N20, обладает устойчивой восьмиэлектронной структурой внешнего слоя. Если ковалентную связь, образованную донорно-акцепторным способом, обозначить, как это принято, стрелкой, направленной от атома-донора к атому-акцептору, то структурную формулу оксида азота (I) можно представить следующим образом О—N—N. [c.124]
Рассмотренные примеры показывают, что атомы обладают разнообразными возможностями для образования ковалентных связей. Последние могут создаваться и за счет неспаренных электронов невозбужденного атома, и за счет неспаренных электронов, появляющихся в результате возбуждения атома ( распаривания электронных пар), и, наконец, по донорно-акцепторному способу. Тем не менее, общее число ковалентных связей, которые способен образовать данный атом, ограничено. Оно определяется общим числом валентных орбита-лей, т. е. тех орбиталей, использование которых для образования ковалентных связей оказывается энергетически выгодным. Квантовомеханический расчет показывает, что к подобным орбиталям принадлежат s- и р-орбитали внешнего электронного слоя и -орбитали предшествующего слоя в некоторых случаях, как мы видели на примерах атомов хлора и серы, в качестве валентных орбиталей могут использоваться и d-орбитали внешнего слоя. Атомы всех элементов второго периода имеют во внешнем электронном слое четыре орбитали при отсутствии (i-орбиталей в предыдущем слое. Следовательно, на валентных орбиталях этих атомов может разместиться не более восьми электронов. Это означает, что максимальная ковалентность элементов второго периода равна четырем. Атомы элементов третьего и последующих периодов могут использовать для образования ковалентных связей не только s- и р-, но также и d-орбитали. Известны соединения d-элементов, в которых в образовании ковалентных связей [c.125]
Суммарное число электронов во внешних слоях ато- ов Э] и Эг равно 8. [c.387]
Как будет показано в 34, повышенной энергетической устойчивостью обладают н электронные конфигурации с ровно наполовину заполненным подуровнем (нанрнмер, структуры, содержащие три р-электрона во внешнем слое, пять й- лектроноп в предвнепшем слое или семь /-электронов в еще более глубоко расположенном слое). Этим объясняется проскок одного 45-электрона в атоме хрома (2 = 24) на Зй-нодуровень, в результате которого атом хрома приобретает устойчивую электронную структуру (15% 2р «3 23р 3 м ) с ровно наполовину заполненным З -подуровнем аналогичный переход. -элекгрона на 4с(-подуровень происходит и в атоме молибдена (Z = 42). [c.98]
Замыкает шестой период элемент радон (Кп 2 = 86), атом которого во внешнем слое содержит октет электронов . ..бз бр . Радон относится к числу, инертных элементов. Структура его атома лежит в основе з-семейства элементов седьмого периода. [c.48]
Элементы основной подгруппы УП группы имеют следующее электронное строение. У атома фтора семь электронов внешнего слоя могут разместиться по четырем ячейкам единственным способом, при котором атом может присоединять еще только один электрон. У фтора при химических реакциях не происходит разъединения спаренных электронов [c.107]
Бром образует несколько кислородных соединений. Из них отметим НВгО — бромноватистую и НВгОз — бромноватую кислоты. Эти кнслоты дают ряд солей. Бром в них соответственно +1-и +5-валентен. Хотя атом брома во внешнем слое содержит 7 электронов, соединения положительно семивалентного брома в настоящее время неизвестны. [c.526]
Как отмечает В. И. Кузнецов [17] Даже при беглом в гляде на состав химических соединений мы убеждаемся, что атомность только в исключительных случаях, прежде всего для кислорода, водорода и фтора, неизменна. Элементарные атомы часто проявляют к положительным элементам другую атомность, чем к отрицательным . Это очень важное замечание. Оно побуждает к иному объяснению природы валентности, так как взаимодействуют не только положительный атом с отрицательным атомом. Взаимодействуют друг с другом и однознаковые атомы, что, казалось бы, ломает все предписанные им Периодической системой правила поведения . Э го кажущееся противоречие снимается, как только мы переходим к рассмотрению хими
www.chem21.info
Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
Число нейтронов в ядре N определяют по формуле:
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:
Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон ( е–) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:
В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д.И. Менделеева.
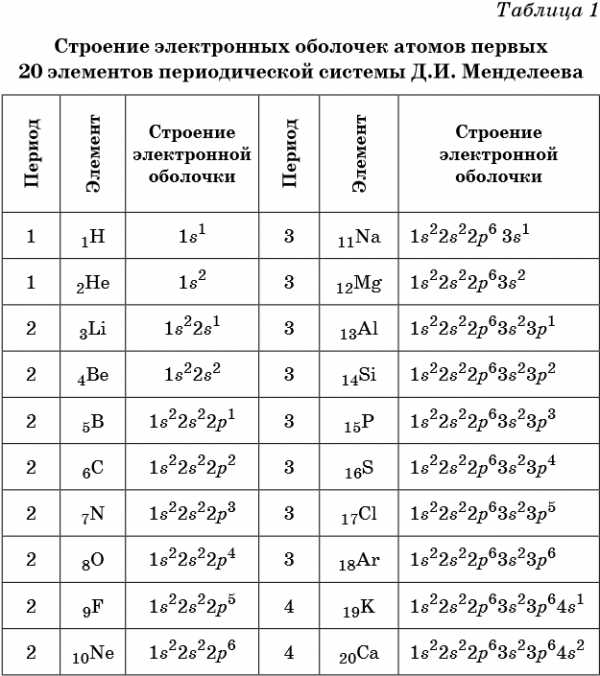
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
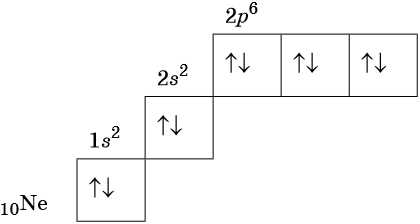
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.
Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1?
- Li
- Na
- K
- Cl
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns2np4
- ns2np2
- ns2np3
- ns2np6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тренировочные задания
1. Общее число s-электронов в атоме кальция равно
1) 20
2) 40
3) 8
4) 6
2. Число спаренных p-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
3. Число неспаренных s-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
4. Число электронов на внешнем энергетическом уровне атома аргона равно
1) 18
2) 6
3) 4
4) 8
5. Число протонов, нейтронов и электронов в атоме 94Be равно
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s22s22p4 образует летучее водородное соединение, формула которого
1) ЭН
2) ЭН2
3) ЭН3
4) ЭН4
9. Число электронных слоёв в атоме химического элемента равно
1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s22s22p63s23p64s1, образует оксид состава
1) Li2O
2) MgO
3) K2O
4) Na2O
13. Число электронных слоев и число p-электронов в атоме серы равно
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. Электронная конфигурация ns2np4 соответствует атому
1) хлора
2) серы
3) магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
16. Атомы азота и фосфора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1) калия
2) алюминия
3) бериллия
4) бора
18. Атомы углерода и фтора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
1) 1
3) 3
2) 2
4) 4
20. В атоме кислорода в основном состоянии число спаренных электронов равно
1) 2
3) 4
2) 8
4) 6
Ответы
himi4ka.ru
Вариант 3
Задание №1.
Число электронных слоев и число электронов во внешнем слое в атоме хлора равны соответственно:
1. 4 и 6
2. 2 и 5
3. 3 и 7
4. 4 и 5
Объяснение: хлор находится в третьем периоде (значит имеет 3 электронных слоя) и в седьмой группе, значит на внешнем слое имеет семь валентных электронов. Правильный ответ — 3.
Задание №2.
Основные свойства проявляет гидроксид элемента, находящегося в Периодической системе
1. В 3-м периоде, IIIA группе
2. Во 2-м периоде, IIA группе
3. В 4-м периоде, IIA группе
4. В 4-м периоде, VIA группе
Объяснение: запишем указанные элементы: алюминий, берриллий, кальций, хром. Среди гидроксидов перечисленных элементов, основные свойства проявляет только гидроксид кальция. Правильный ответ — 3.
Задание №3.
Ионной связью образовано каждое из веществ:
1. F2, Nh4, NaCl
2. Na2S, CaO, KI
3. CO2, MgF2, SO3
4. h3S, Ch5, CuO
Объяснение: ионная связь образуется между металлом и неметаллом, то есть здесь подходят все вещества, указанные в ответе 2. Правильный ответ — 2.
Задание №4.
Азот проявляет одинаковую степень окисления в каждом из двух веществ, формулы которых:
1. N2O5 и LiNO3
2. Li3N и NO2
3. NO2 и HNO2
4. Nh4 и N2O3
Объяснение: найдем степени окисления азота во всех представленных соединениях.
1. +5 и +5
2. -3 и +4
3. +4 и +3
4. -3 и +3
Правильный ответ — 1.
Задание №5.
Вещества, формулы которых Р2О5 и Na3PO4 являются соответственно
1. Амфотерным оксидом и солью
2. Основным оксидом и основанием
3. Кислотным оксидом и солью
4. Несолеобразующим оксидом и солью
Объяснение: Р2О5 — кислотный оксид (ему соответствует ортофосфорная кислота), а фосфат натрия — средняя соль. Правильный ответ — 3.
Задание №6.
Признаком протекания химической реакции между иодидом алюминия и нитратом серебра является
1. Появление запаха
2. Выделение газа
3. Изменение цвета раствора
4. Выпадение желтого осадка
Объяснение: запишем реакцию: AlI3 + 3AgNO3 = Al(NO3)3 + 3AgI↓ — иодид серебра (желтый осадок). Правильный ответ — 4.
Задание №7.
При полной диссоциации сульфида натрия образуются ионы:
1. Na+ и HS‾
2. Na+ и SO3²‾
3. Na+ и S²‾
4. Na+ и SO4²‾
Объяснение: формула сульфида натрия — Na2S, при его диссоциации образуется два катиона натрия и сульфид-анион. Правильный ответ — 3.
Задание №8.
Нерастворимая соль образуется при взаимодействии веществ, формулы которых:
1. NaOH(р-р) и h4PO4(р-р)
2. HNO3(р-р) и Al2O3
3. Ca(OH)2(р-р) и K3PO4(р-р)
4. CuCl2(р-р) и Ca(OH)2(р-р)
Объяснение: запишем все реакции.
3NaOH + h4PO4 = Na3PO4 + 3h3O
6HNO3 + Al2O3 = 2Al(NO3)3 + 3h3O
3Ca(OH)2 + 2K3PO4 = Ca3(PO4)2↓ + 6KOH
CuCl2 + Ca(OH)2 = CaCl2 + Cu(OH)2↓
Как видно из реакций, нерастворимая соль образуется в третьей реакции. Правильный ответ — 3.
Задание №9.
Железо восстанавливается в реакции между:
1. Оксидом железа (III) и углеродом
2. Сульфатом меди (II) и железом
3. Хлоридом железа (II) и гидроксидом натрия
4. Железом и серой
Объяснение: запишем изменения степеней окисления железа в приведенных превращениях.
1. 2Fe2O3 + 3C → 4Fe + 3CO2, СО: +3 +3е→ 0 — окислитель
2. CuSO4 + Fe → FeSO4 + Cu, CO: 0 -2е→ +2 — восстановитель
3. FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl, степень окисления не меняется
4. Fe + S → FeS, СО: 0 -2е→ +2 — восстановитель
То есть, железо восстанавливается в первой реакции. Правильный ответ — 1.
Задание №10.
Оксид алюминия взаимодействует с раствором:
1. Аммиака
2. Хлороводорода
3. Карбоната натрия
4. Хлорида калия
Объяснение: оксид алюминия — амфотерный оксид, то есть он проявляет как кислотные, так и основные свойства. С чем реагируют амфотерные оксиды можно повторить здесь. Из приведенных выше веществ оксид алюминия реагирует только с хлороводородом. Правильный ответ — 2.
Задание №11.
Разбавленная азотная кислота при комнатной температуре взаимодействует с каждым из веществ, формулы которых:
1. Cu, CaCO3, Fe(OH)3
2. Na2SiO3, FeCl2, ZnSO4
3. Al, CuSO4, KOH
4. AlCl3, HCl, P2O5
Объяснение: свойства разбавленной азотной кислоты можно посмотреть здесь. В данном случае азотная кислота реагирует со всеми веществами из варианта 1.
8HNO3(разб) + 3Cu → 3Cu(NO3)2 + 2NO↑ + 2h3O
2HNO3 + CaCO3 → Ca(NO3)2 + h3O + CO2↑
3HNO3 + Fe(OH)3 → Fe(NO3)3 + 6h3O
Правильный ответ — 1.
Задание №12.
Химическая реакция возможна между солями, формулы которых:
1. Na2SO4 и CuCl2
2. NaNO3 и PbCO3
3. Ca3(PO4)2 и NaCl
4. AgNO3 и HgCl2
Объяснение: реакция между солями возможна только при образовании нерастворимой соли. Запишем все реакции.
Na2SO4 + CuCl2 ≠ CuSO4 + 2NaCl (обе полученные соли растворимы — реакция не идет)
NaNO3 + PbCO3 ≠ Pb(NO3)2 + Na2CO3 (все нитраты и все соли натрия растворимы — реакция не идет)
Ca3(PO4)2 + 6NaCl ≠ 2Na3PO4 + 3CaCl2 (обе полученные соли растворимы — реакция не идет)
2AgNO3 + HgCl2 → 2AgCl↓ + Hg(NO3)2 (образуется нерастворимая соль (осадок) — реакция идет до конца)
Правильный ответ — 4.
Задание №13.
Верны ли следующие суждения о правилах безопасности работы в химической лаборатории?
А. Горящий натрий можно затушить водой.
Б. Пламя спиртовки можно затушить, накрыв его колпачком.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: горящий натрий нельзя тушить водой, так как реакция натрия с водой идет очень бурно и ситуация только усугубиться. Горящий натрий рекомендуется тушить порошковыми огнетушителями, мелким сухим кварцевым песком, кальцинированной содой, мелкой поваренной солью. А пламя спиртовки, действительно, гаснет при закрывании колпачка, так как прекращается доступ кислорода. Правильный ответ — 2.
Задание №14.
В химической реакции, уравнение которой
CO + CuO → Cu + CO2
восстановителем является:
1. Медь в оксиде меди (II)
2. Углерод в оксиде углерода (II)
3. Кислород в оксиде углерода (II)
4. Кислород в оксиде меди (II)
Объяснение: в представленной реакции кислород вообще не меняет степень окисления, поэтому два последних варианта ответа точно неправильный. Углерод и медь меняют степень окисления. Чтобы понять кто из них окислитель, а кто восстановитель, запишем баланс:
С(+2) -2е → С(+4) — восстановитель
Cu(+2) +2e → Cu(0) — окислитель
Правильный ответ — 2.
Задание №15.
Массовая доля кислорода, равная 0,22, соответствует соединению железа, формула которого:
1. Fe3O4
2. Fe2O3
3. FeO
4. Fe(OH)3
Объяснение: молярная масса одного атома железа — 56 г/моль, а кислорода — 16 г/моль. Найдем процентное содержание кислорода в каждом из веществ.
1. ω(О) = (16х4)/(16х4 + 56х3) = 64/232 = 0,275
2. ω(О) = (3х16)/(16х3 + 2х56) = 48/160 = 0,3
3. ω(О) = 16/(56+16) = 16/72 = 22,2
4. ω(О) = (16х3)/(17х3 + 56) = 48/107 = 0,45
Правильный ответ — 3.
Задание №16.
Различия магния и кальция заключаются
1. В наличии одинакового числа электронов на внешнем электронном слое их атомов
2. В том, что они относятся к элементам-металлам
3. В наличии трех электронных слоев в их атомах
4. В проявлении щелочных свойств образованными ими гидроксидами
5. В образовании ими оксидов с общей формулой ЭО
Объяснение: оба элемента являются щелочноземельными металлами, находятся во второй группе главной подгруппе, а значит имеют 2 электрона на внешнем электронном слое. Но магний находится в третьем периоде и имеет три электронных слоя, а кальций — в четвертом и, соответственно, имеет 4 электронных слоя. Гидроксид кальция малорастворим и проявляет щелочные свойствах (конечно, не так, как гидроксиды калия или натрия и т.д.), а гидроксид магния нерастворим и щелочных свойств не проявляет. Правильный ответ — 34.
Задание №17.
Для метана характерны реакции
1. С водой
2. С хлороводородом
3. С хлором
4. С кислородом
5. С водородом
Объяснение: метан является простейшим предельным углеводородом и для него характерны, в основном, реакции замещения, то есть реакция с хлором и реакция горения с кислородом. Правильный ответ — 34.
Задание №18.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
Вещества Реактив
А. (Nh5)2SO4(р-р) и (Nh5)2S(р-р) 1. HNO3(р-р)
Б. Zn(OH)2 и FeCl2 2. NaOH(р-р)
В. CaCO3(тв) и CaO(тв) 3. K2SO4(р-р)
4. Pb(NO3)2(р-р)
Объяснение: сульфат и сульфид аммония можно различить при помощи их реакций с раствором азотной кислоты, реакция с сульфатом аммония не пойдет, а в реакции с сульфидом аммония выделится сероводород. Гидроксид цинка различаем при помощи щелочи, в реакции гидроксида цинка и гидроксида цинка образуется бесцветный, растворимый в щелочи кристаллогидрат, а в реакции с хлоридом железа — гидроксид железа (светло-зеленое нерастворимое вещество). Карбонат кальция и оксид кальция различим при помощи раствора азотной кислоты. В первом случае образуется углекислый газ, а во втором — вода и нитрат кальция. Правильный ответ — 121.
Задание №19.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
Название вещества
1. Фосфор
2. Оксид фосфора (V)
3. Фосфорная кислота
Реагенты
1. CuO, HCl(р-р)
2. O2, KClO3(крист)
3. h3O, K2O
4. NaOH(р-р), AgNO3(р-р)
Объяснение:
1. Фосфор реагирует с кислородом с образованием оксида.
4P + 5O2 → 2P2O5
И с перхлоратом калия.
6P + 5KClO3 = 3P2O5 + 5KCl
2. Оксид фосфора (V) — кислотный оксид, которому соответствует фосфорная кислота, ее можно получить по реакции:
3h3O +P2O5 → 2h4PO4
И реагирует с оксидом калия с образованием фосфата калия:
3K2O + P2O5 → 2K3PO4
3. Ортофосфорная кислота реагирует с основаниями и солями:
h4PO4 + 3NaOH → Na3PO4 + 3h3O
h4PO4 + 3AgNO3 →Ag3PO4↓ + 3HNO3
Правильный ответ — 234.
Задание №20.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Nh4 + O2 → NO + h3O
Определите окислитель и восстановитель.
Объяснение: в данной окислительно-восстановительной реакции степень окисления меняют азот и кислород. Запишем баланс.
N(-3) -5e → N(+2) | 4 — восстановитель
O2(0) +4e → 2O(-2) | 5 — окислитель
Расставляем коэффициенты.
4Nh4 + 5O2 → 4NO + 6h3O
Задание №21.
Определите массу осадка, получившегося при добавлении раствора гидроксида бария к 100 г 4,9%-ного раствора серной кислоты.
Объяснение: запишем уравнение реакции.
Ba(OH)2 + h3SO4 → BaSO4↓ + 2h3O
Найдем массу вещества серной кислоты.
m(h3SO4) = 100 x 0,049 = 4,9 г
Найдем количество вещества серной кислоты.
n(h3SO4) = 4,9/98 = 0,05 моль
Количество вещества осадка равно количеству вещества серной кислоты, так как у них обоих коэффициенты единички.
n(h3SO4) = n(BaSO4) = 0,05 моль
Теперь находим массу осадка — сульфата бария.
m(BaSO4) = 0,05 x (137 + 96) = 11,65 г.
Ответ: масса получившегося осадка равна 11,65 г.
Задание №22.
Даны вещества: HNO3(разб), Ca(OH)2, HCl, Fe, h3SiO3, h3. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа (III). Опишите признаки проведения реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Объяснение: железо со степенью окисления +3 получаем по реакции с разбавленной азотной кислотой:
Fe + 4HNO3(разб) = Fe(NO3)3 + NO + 2H2O
Затем проводим реакцию с гидроксидом кальция.
2Fe(NO3)3 + 3Ca(OH)2 = 2Fe(OH)3↓ + 3Ca(NO3)2
Запишем для этой реакции сокращенное ионного уравнение.
Fe²+ + 3OH‾ = Fe(OH)3↓
cleverpenguin.ru
Помогите пожалуйста А1 одинаковое число электронов во…
А1 одинаковое число электронов во внешнем электронном слое имеют атомы
1)углерод и кремний.
А2 для какого вещества характерна ковалентная полярная связь ?
2) NO
A3 кислотному оксиду в кислоте соответствуют формулы :
ни одна не соответствует
A4 массовая доля кислорода в карбонате калия равна( само решение)
1) 13% 2) 20% 3)48% 4)40%-ни одно не верно.
Mr(K₂CO₃)=39×2+12+16×3=138
ω(O)=48÷138=0,347 или 34,7% в карбонате калия 34,7% кислорода.
А5 для хим.элементов (бор-углерод-азот-кислород) характерны(две) следующие закономерности
2)увеличивается число электронов во внешнем электронном слое
5)усиливаются неметаллические свойства
А6 установите соответствие между исходными веществами и продуктами реакции
B) — 3 K₂O +H₂SO₄ =K₂SO₄ +H₂O
A7 дана схема превращений
Cu ->CuCl₂ ->Cu(OH)2 -> CuO -> Cu
Напишите уравнение реакций , с помощь которых можно осуществить указанные превращения:
Cu+CI₂=CuCI₂
CuCI₂ +2 NaOH= 2NaCI+Cu(OH)₂↓
Cu(OH)₂+t =CuO+ H₂O
CuO + H₂= Cu + H₂O
А8 сколько грамм серной кислоты потребуется для нейтрализации 5.6 грамм гидроксида калия?(само решение)
Дано:
m(KOH)=5,6г.
———————
m(H₂SO₄)-?
1. Определим молярную массу гидроксида калия:
M(KOH)=39+16+1=56г./моль
2. Определим количество вещества n в 5,6г. гидроксида калия:
n=m÷M n(KOH)=m(KOH)÷M(KOH)=5,6г÷56г./моль=0,1моль
3. Запишем уравнение реакции:
H₂SO₄ + 2KOH= K₂SO₄+ 2H₂O
4. Анализируем уравнение реакции: по уравнению реакции 1моль серной кислоты взаимодействует с 2 моль гидроксида калия, а у нас по условию 0,1моль гидроксида калия, значит потребуется:
n(H₂SO₄)=0.1мольх1моль÷2моль=0,05моль
5. Определим молярную массу серной кислоты и массу ее количеством вещества 0,05моль:
M(H₂SO₄)=2+32+16×3=98г./моль
m(H₂SO₄)= n(H₂SO₄) х M(H₂SO₄)=0,05мольх98г./моль=4,9г.
6. Ответ: Для нейтрализации 5,6г. гидроксида калия потребуется 4,9г. серной кислоты.
Оцени ответ
shkolniku.com

Leave A Comment