8 класс. Химия. Электронная оболочка атома — Электронная оболочка атома
Комментарии преподавателяСостояние электронов в атоме
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
Рис. 1. Бор Нильс Хендрих Давид (1885–1962)
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов с близкими значениями энергии; поэтому электронные слои называют еще энергетическими уровнями.
Правила распределения электронов
Ядро находится в центре атома каждого элемента, а электроны, образующие электронную оболочку, размещаются вокруг ядра слоями.
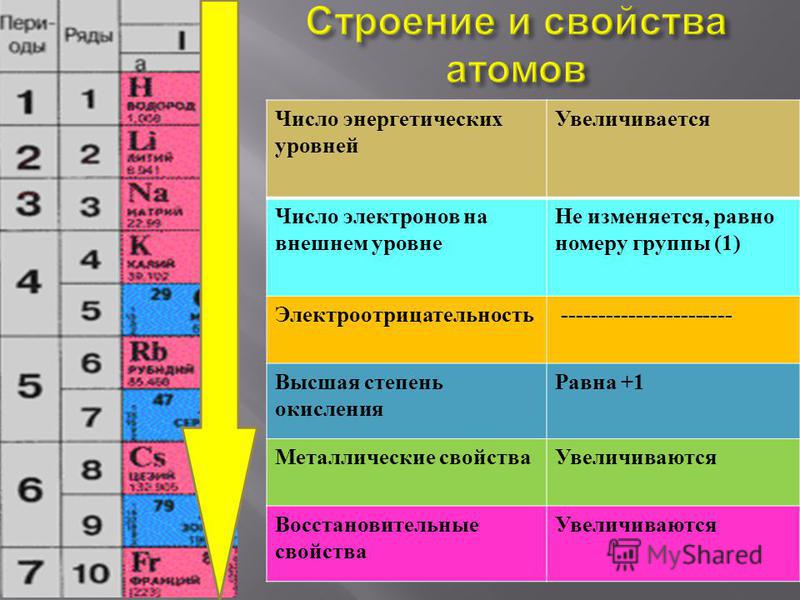
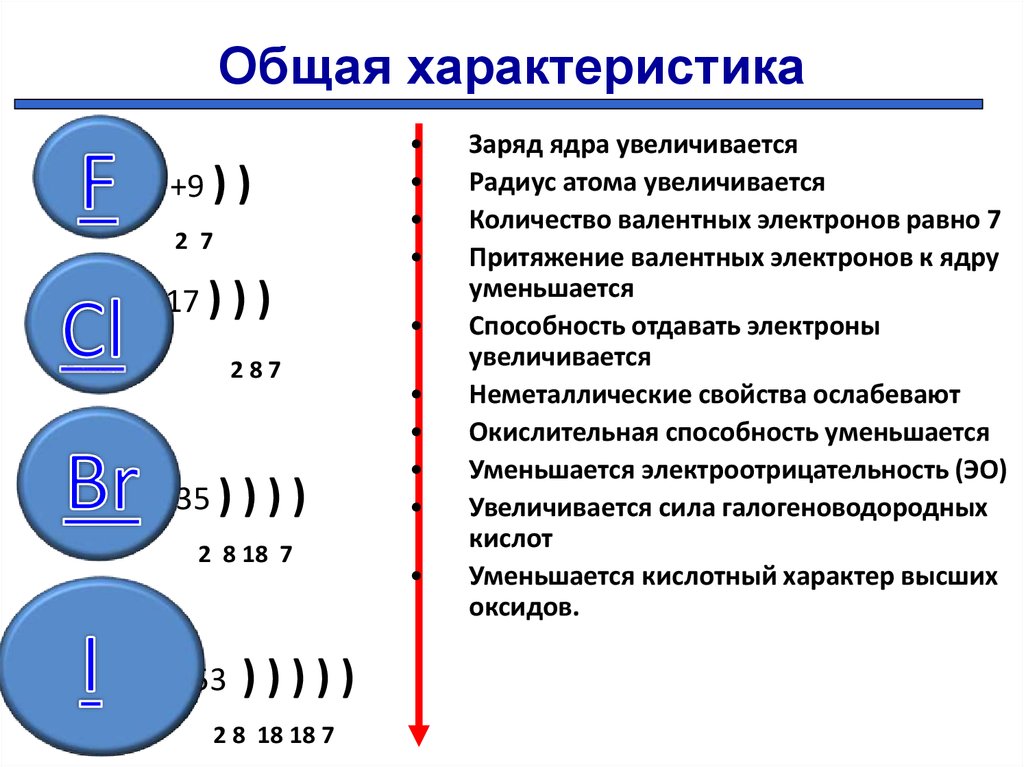
Число электронных слоев в атоме элемента равно номеру периода, в котором находится данный элемент.
Например, натрий Na – элемент 3-го периода, значит, его электронная оболочка включает 3 энергетических уровня. В атоме брома Br – 4 энергетических уровня, т. к. бром расположен в 4-м периоде (Рис. 2).
Модель атома натрия: Модель атома брома:
Рис. 2. Модели строения электронных оболочек атомов натрия и брома
Максимальное число электронов на энергетическом уровне рассчитывается по формуле: 2n2, где n – номер энергетического уровня.
Таким образом, максимальное число электронов на:
1 слое – 2
2 слое – 8
3 слое – 18 и т. д.
У элементов главных подгрупп номер группы, к которой относится элемент, равен числу внешних электронов атома.
Внешними называют электроны последнего электронного слоя.
Например, в атоме натрия – 1 внешний электрон (т. к. это элемент IА подгруппы). В атоме брома – 7 электронов на последнем электронном слое (это элемент VIIА подгруппы).
Строение электронных оболочек элементов 1–3 периодов
В атоме водорода заряд ядра равен +1, и этот заряд нейтрализуется единственным электроном (Рис. 3).
Рис. 3. Схема строения атома водорода
Следующий за водородом элемент – гелий, тоже элемент 1-го периода. Следовательно, в атоме гелия 1 энергетический уровень, на котором размещаются два электрона (Рис. 4). Это максимально возможное число электронов для первого энергетического уровня.
Рис 4. Схема строения атома гелия
Элемент № 3 – это литий. В атоме лития 2 электронных слоя, т. к. это элемент 2-го периода. На 1 слое в атоме лития находится 2 электрона (этот слой завершен), а на 2 слое –1 электрон. В атоме бериллия на 1 электрон больше, чем в атоме лития (Рис. 5).
Рис. 5. Схемы строения атомов лития и бериллия
Аналогично можно изобразить схемы строения атомов остальных элементов второго периода (Рис. 6).
Рис. 6. Схемы строения атомов некоторых элементов второго периода
В атоме последнего элемента второго периода – неона – последний энергетический уровень является завершенным (на нем 8 электронов, что соответствует максимальному значению для 2-го слоя). Неон – инертный газ, который не вступает в химические реакции, следовательно, его электронная оболочка очень устойчива.
Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
После неона следует элемент 3-го периода – натрий. В атоме натрия – 3 электронных слоя, на которых расположены 11 электронов (Рис. 7).
Na
Рис. 7. Схема строения атома натрия
Натрий находится в 1 группе, его валентность в соединениях равна I, как и у лития. Это связано с тем, что на внешнем электронном слое атомов натрия и лития находится 1 электрон.
Свойства элементов периодически повторяются потому, что у атомов элементов периодически повторяется число электронов на внешнем электронном слое.
Строение атомов остальных элементов третьего периода можно представить по аналогии со строением атомов элементов 2-го периода.
Строение электронных оболочек элементов 4 периода
Четвертый период включает в себя 18 элементов, среди них есть элементы как главной (А), так и побочной (В) подгрупп. Особенностью строения атомов элементов побочных подгрупп является то, что у них последовательно заполняются предвнешние (внутренние), а не внешние электронные слои.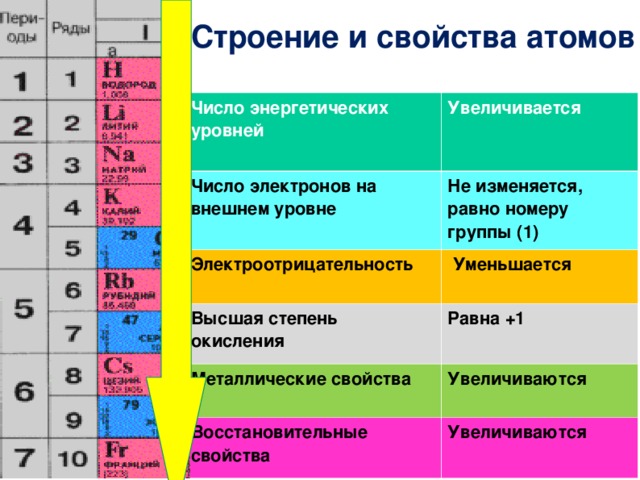
Четвертый период начинается с калия. Калий – щелочной металл, проявляющий в соединениях валентность I. Это вполне согласуется со следующим строением его атома. Как элемент 4-го периода, атом калия имеет 4 электронных слоя. На последнем (четвертом) электронном слое калия находится 1 электрон, общее количество электронов в атоме калия равно 19 (порядковому номеру этого элемента) (Рис. 8).
Рис. 8. Схема строения атома калия
За калием следует кальций. У атома кальция на внешнем электронном слое будут располагаться 2 электрона, как и у бериллия с магнием (они тоже являются элементами II А подгруппы).
Следующий за кальцием элемент – скандий. Это элемент побочной (В) подгруппы. Все элементы побочных подгрупп – это металлы. Особенностью строения их атомов является наличие не более 2-х электронов на последнем электронном слое, т. е. последовательно заполняться электронами будет предпоследний электронный слой.
Так, для скандия можно представить следующую модель строения атома (Рис.
Рис. 9. Схема строения атома скандия
Такое распределение электронов возможно, т. к. на третьем слое максимально допустимое количество электронов – 18, т. е. восемь электронов на 3-м слое – это устойчивое, но не завершенное состояние слоя.
У десяти элементов побочных подгрупп 4-го периода от скандия до цинка последовательно заполняется третий электронный слой.
Схему строения атома цинка можно представить так: на внешнем электронном слое – два электрона, на предвнешнем – 18 (Рис. 10).
Рис. 10. Схема строения атома цинка
Следующие за цинком элементы относятся к элементам главной подгруппы: галлий, германий и т. д. до криптона. В атомах этих элементов последовательно заполняется 4-й (т. е. внешний) электронный слой. В атоме инертного газа криптона будет октет на внешней оболочке, т. е. устойчивое состояние.
Подведение итога урока
На этом уроке вы узнали, как устроена электронная оболочка атома и как объяснить явление периодичности. Познакомились с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
Познакомились с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
Источники
http://www.youtube.com/watch?t=7&v=xgPDyORYV_Q
http://www.youtube.com/watch?v=RNu0Ql4Htjg
http://www.youtube.com/watch?v=8h3nw8m3x6k
заставка http://www.youtube.com/watch?v=z0Muwg71Rmc
источник презентации — http://www.myshared.ru/slide/834600/#
Конспект http://interneturok.ru/ru/school/chemistry/8-klass
ОГЭ 2019. Химия. Вариант 21 – iq2u – Тесты. Тест. Тесты онлайн. Онлайн тесты. Онлайн тест. Тест онлайн. Тестирование. Тесты с ответами. Пройти тест
Пройдите тест, узнайте свой уровень и посмотрите правильные ответы!
Категория:
Химия
Уровень:
ОГЭ
Одинаковое число электронов на внешнем энергетическом уровне имеют атомы
бария и гелия
лития и бериллия
серы и фосфора
кислорода и фтора
В молекулах галогенов химическая связь
ионная
ковалентная полярная
ковалентная неполярная
металлическая
Солью является
хлорид фосфора(III)
хлорид алюминия
хлорид серы(II)
фторид кислорода
Электролитом является
Сокращенному ионному уравнению реакции
NH4+ + OH‒ = NH3 + H2O
соответствует взаимодействие
NH4Cl и Fe(OH)2
(NH4)2SO4 и NaOH
(NH4)2SO4 и Ba(OH)2
NH4NO3 и Cu(OH)2
Соляная кислота не реагирует с
гидроксидом железа(III)
сульфатом бария
нитратом серебра
карбонатом натрия
Верны ли следующие суждения о правилах безопасного обращения с веществами в быту?
А. При работе с жидкими чистящими препаратами для ванн и раковин рекомендуется использовать резиновые перчатки.
При работе с жидкими чистящими препаратами для ванн и раковин рекомендуется использовать резиновые перчатки.
Б. Столовый уксус должен храниться вместе с препаратами бытовой химии.
верно только А
верно только Б
верны оба суждения
оба суждения неверны
На какой диаграмме распределение массовых долей элементов соответствует количественному составу нитрата железа(III)?
В ряду химических элементов:
P → Si → Al
происходит увеличение (усиление)
- радиуса атомов
- восстановительной способности
- числа электронов во внешнем электронном слое атомов
- значения высшей степени окисления
- кислотных свойств высших оксидов
Установите соответствие между двумя веществами, взятыми в виде водных растворов, и реактивом, с помощью которого можно различить эти два вещества.
ВЕЩЕСТВА
А) KCl и KI
Б) KCl и BaCl2
В) MgCl2 и AlCl3
РЕАКТИВ
- K2SO4
- KOH
- HCl
- AgNO3
А1 Б3 В4
А1 Б3 В2
А4 Б1 В2
А4 Б1 В3
Мы занимаемся обработкой ваших ответов
Проверь себя, пройди другие тесты онлайн
- ОГЭ 2017. История. Вариант 11 Расположите имена в хронологическом порядке их жизни и деятельности.
 Укажите ответ в виде последовательности цифр выбран…
Укажите ответ в виде последовательности цифр выбран… - ЕГЭ 2017. Химия. Вариант 38 Реагируют друг с другом в водном растворе И с разбавленной серной кислотой, и с гидроксидом калия реагирует
- ОГЭ 2017. Химия. Вариант 18 Верны ли следующие суждения о получении углекислого газа в лаборатории? А. Углекислый газ в лаборатории получают раз…
- ОГЭ 2017. Химия. Вариант 35 Верны ли следующие суждения о правилах безопасной работы в химической лаборатории? А. В лаборатории нельзя знакомитьс…
- ОГЭ 2017. Биология. Вариант 15 Исходными для фотосинтеза являются вещества Границей между внутренней средой гидры и внешней средой является
- ОГЭ 2019. Химия. Вариант 3 Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
 НАЗВА…
НАЗВА… - ЕГЭ 2019. Химия. Вариант 49 Из предложенного перечня выберите два неполярных соединения с ковалентной полярной связью. 1) сернистый газ 2) фосфи…
- ОГЭ 2018. Химия. Вариант 40 Установите соответствие между исходными веществами и продуктами реакции. ИСХОДНЫЕ ВЕЩЕСТВА А) h3SO4(конц.) + Cu Б) h3…
- ЕГЭ 2019. Химия. Вариант 67 Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие воды с пропином.каталитическа…
- ОГЭ 2019. Химия. Вариант 37 Какое количество нейтронов содержит ядро атома <sup>7</sup>Li? Взаимодействие магния с соляной кислотой отно…
- ОГЭ 2019. Химия. Вариант 9 Установите соответствие между двумя веществами, взятыми в виде водных растворов, и реактивом, с помощью которого можно р.
 ..
.. - ОГЭ 2020. Химия. Вариант 7 Верны ли суждения о чистых веществах и смесях?А. Воздух является чистым веществом.Б. Гранит является смесью веществ.
3.4: Литий, первый металл
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 78934
- Стэнли Э. Манахан
- Университет Миссури
Элемент с атомным номером 3 — литий (Li), атомная масса 6,941. Самый распространенный изотоп лития имеет в ядре 4 нейтрона. Несколько процентов атомов гелия составляют изотоп, который имеет всего 3 нейтрона. Третий электрон в литии не может поместиться в самой низкоэнергетической оболочке, которая, как отмечалось выше, заполнена всего двумя электронами. Следовательно, третий электрон в литии переходит во вторую оболочку, то есть во внешнюю оболочку .
Следовательно, третий электрон в литии переходит во вторую оболочку, то есть во внешнюю оболочку .
Вследствие своей электронной структуры литий является элементом с наименьшим атомным номером, то есть металл . В общем смысле металлы — это элементы, которые обычно имеют только 1–3 электрона на своих внешних оболочках. Эти электроны могут быть потеряны металлами с образованием положительно заряженных катионов с зарядами +1, +2 или +3. В чистом элементарном состоянии металлы часто имеют характерный блеск (блеск), они ковкие (можно сплющить или придать им различные формы без разрушения) и они проводят электричество . Хотя некоторые металлы, особенно свинец и ртуть, очень плотные, литий является наименее плотным металлом с плотностью всего 0,531 г/см3.
Два из 3 электронов лития представляют собой внутренних электрона , содержащихся в внутренней оболочке , как и в непосредственно предшествующем инертном газе гелии. Символ Льюиса для атомов, таких как литий, которые имеют электроны как на внутренней, так и на внешней оболочках, обычно показывает только последний. (Электроны внутренней оболочки могут быть показаны на символах, чтобы проиллюстрировать точку зрения, но обычно это занимает слишком много места и может сбить с толку.) Поскольку литий имеет только один электрон внешней оболочки, его символ Льюиса равен Учтите, что атом лития имеет внутреннюю оболочку из 2 электронов, как у гелия. Находясь всего в 1 электроне от структуры благородного газа гелия, литий имеет тенденцию терять свой дополнительный электрон, поэтому он может быть подобен гелию, как показано ниже: 9{+}}\) катионы. Соединения лития имеют множество применений. Карбонат лития, Li2CO3, широко назначают в качестве лекарственного средства для облегчения симптомов мании при маниакально-депрессивных и шизоаффективных психических расстройствах. Карбонат лития является наиболее распространенным исходным материалом для получения других соединений лития и входит в состав специальных стекол и эмалей, а также керамической посуды, которая лишь минимально расширяется при нагревании. Гидроксид лития \(\ce{LiOH}\) используется для приготовления некоторых видов консистентных смазок. В сочетании с йодом литий использовался для изготовления элементов, которые являются источниками электроэнергии для кардиостимуляторов. Имплантированные в грудь пациента, некоторые из этих кардиостимуляторов и их батареи прослужили 10 лет, прежде чем их пришлось заменить. 9{+}}\) ионов во время разряда стали привлекательными (хотя и дорогими) вариантами на рынке одноразовых сухих элементов, поскольку они очень долговечны и несут гораздо больший заряд на единицу массы, чем стандартные щелочные сухие элементы. Наиболее распространенным источником лития являются литиевые рассолы, в которых литий концентрируется в результате выщелачивания горных пород и испарения воды из высокогорных солончаков в Южной Америке и западном Китае. Соли лития собираются для переработки при выпаривании воды из рассолов в прудах-испарителях. Боливия является крупнейшим производителем лития, и существует значительный потенциал производства в Чили, Аргентине, Австралии, Китае и, возможно, даже в штате Невада. По мере увеличения использования лития в батареях переработанный литий из отработанных батарей станет важным источником этого элемента. Эта страница под названием 3.4: Lithium, The First Metal распространяется в соответствии с лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором этой страницы является Стэнли Э. Манахан. Литий — редкий элемент, встречающийся в основном в расплавленных породах и соленой воде в очень небольших количествах. Считается, что он не является жизненно важным для биологических процессов человека, хотя он используется во многих лекарственных препаратах из-за его положительного воздействия на мозг человека. Из-за его реактивных свойств люди использовали литий в батареях, реакциях ядерного синтеза и термоядерном оружии. Литий впервые был идентифицирован как компонент минерального петалита и был открыт в 1817 году Йоханом Августом Арфведсоном, но не был выделен некоторое время спустя У. Т. Бранде и сэром Хамфри Дэви. В своих минеральных формах он составляет всего 0,0007% земной коры. Его соединения используются в некоторых видах изделий из стекла и фарфора. Совсем недавно литий стал играть важную роль в сухих батареях и ядерных реакторах. Некоторые соединения лития использовались для лечения маниакально-депрессивных состояний. Литий представляет собой щелочной металл с атомным номером 3 и атомной массой 6,941 г/моль. Это означает, что литий имеет 3 протона, 3 электрона и 4 нейтрона (6,941 — 3 = ~4). Будучи щелочным металлом, литий является мягким, легковоспламеняющимся и очень реакционноспособным металлом, который имеет тенденцию образовывать гидроксиды. Он также имеет довольно низкую плотность и при стандартных условиях является наименее плотным твердым элементом. Литий — самый легкий из всех металлов, названный в честь греческого слова «камень» (lithos). Это первый представитель семейства щелочных металлов. Он менее плотный, чем вода (с которой реагирует), и при контакте с воздухом образует черный оксид. Находясь в верхней левой части Периодической таблицы, литий имеет довольно низкую электроотрицательность и сродство к электрону по сравнению с остальными элементами. Литий относится к группе щелочных металлов 1, которые обладают высокой реакционной способностью и никогда не встречаются в чистом виде в природе. Это связано с их электронной конфигурацией, поскольку они имеют один валентный электрон (рис. 1), который очень легко отдается для создания связей и образования соединений. _↑ ↓ _ _↑__ 1s 2 2s 1  Электроны внутренней оболочки, такие как эти, в среднем остаются относительно близко к ядру, очень крепко удерживаются, не обмениваются и не разделяются в химических связях. Как упоминалось выше, третий электрон в литии — это внешних электрона, которые находятся дальше от ядра и менее сильно притягиваются к нему. Говорят, что внешний электрон находится в 9-м атоме атома.{+}}\) ион, присутствующий в ионных соединениях (см. раздел 2.12).
Электроны внутренней оболочки, такие как эти, в среднем остаются относительно близко к ядру, очень крепко удерживаются, не обмениваются и не разделяются в химических связях. Как упоминалось выше, третий электрон в литии — это внешних электрона, которые находятся дальше от ядра и менее сильно притягиваются к нему. Говорят, что внешний электрон находится в 9-м атоме атома.{+}}\) ион, присутствующий в ионных соединениях (см. раздел 2.12).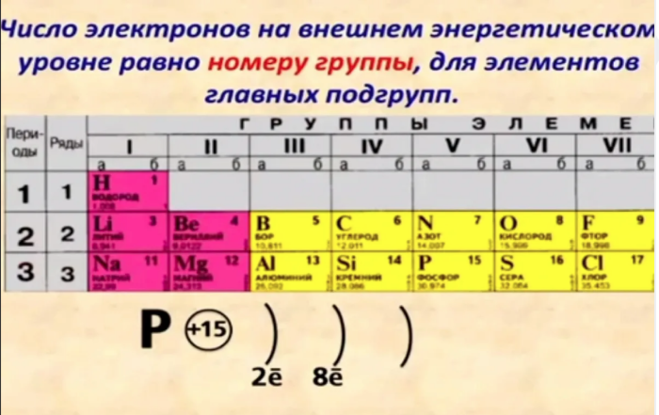 Затем они притягиваются к отрицательно заряженным анионам в ионных соединениях.
Затем они притягиваются к отрицательно заряженным анионам в ионных соединениях.

На этой странице нет тегов.
Химия лития (Z=3) — Химия LibreTexts

Введение
Свойства
Атомный номер 3 Атомная масса 6,941 г/моль Атомный радиус 152 вечера Плотность 0,534 г/см 3 Цвет светло-серебристый Температура плавления 453,69 К Температура кипения 1615 К Теплота плавления 3,00 кДж/моль Теплота парообразования 147,1 кДж/моль Удельная теплоемкость 24,860 кДж/моль Первая энергия ионизации 520,2 кДж/моль Степени окисления +1, -1 Электроотрицательность 0,98 Кристаллическая структура объемно-центрированный куб Магнетизм парамагнитный 2 стабильных изотопа 6 Li (7,5%) и 7 Li (92,5%) Периодические тенденции лития
 Кроме того, литий имеет высокий металлический характер и, следовательно, более низкий неметаллический характер по сравнению с другими элементами. Литий имеет более высокий атомный радиус, чем большинство элементов периодической таблицы. В соединениях литий (как и все щелочные металлы) имеет заряд +1. В чистом виде он мягкий и серебристо-белый, имеет относительно низкую температуру плавления (181°C).
Кроме того, литий имеет высокий металлический характер и, следовательно, более низкий неметаллический характер по сравнению с другими элементами. Литий имеет более высокий атомный радиус, чем большинство элементов периодической таблицы. В соединениях литий (как и все щелочные металлы) имеет заряд +1. В чистом виде он мягкий и серебристо-белый, имеет относительно низкую температуру плавления (181°C). Реакционная способность
гидроксид и газообразный водород.
\[ 2Li (т) + 2H_2O (ж) \rightarrow 2LiOH (водн.) + H_2 (г)\]
Из всех металлов группы 1 литий реагирует наименее бурно, медленно выделяя газообразный водород, который может создавать ярко-оранжевое пламя только при использовании значительного количества лития. Это происходит потому, что литий имеет самую высокую энергию активации в своей группе, то есть для удаления одного валентного электрона лития требуется больше энергии, чем для других элементов группы 1, потому что электрон лития находится ближе к его ядру. Атомы с более высокой энергией активации будут реагировать медленнее, хотя литий будет выделять больше тепла в течение всего процесса.
Это происходит потому, что литий имеет самую высокую энергию активации в своей группе, то есть для удаления одного валентного электрона лития требуется больше энергии, чем для других элементов группы 1, потому что электрон лития находится ближе к его ядру. Атомы с более высокой энергией активации будут реагировать медленнее, хотя литий будет выделять больше тепла в течение всего процесса.
Реакции с воздухом
Чистый литий образует гидроксид лития из-за влаги в воздухе, а также нитрид лития (\(Li_3N\)) из газа \(N_2\) и карбонат лития \((Li_2CO_3\ )) из углекислого газа. Эти соединения придают обычно серебристо-белому металлу черный оттенок. Кроме того, он будет гореть с кислородом в виде красного пламени с образованием оксида лития.
\[ 4Li (s) + O_2 (g) \rightarrow 2Li_2O \]
Применение
В своих минеральных формах он составляет всего 0,0007% земной коры. Его соединения используются в некоторых видах изделий из стекла и фарфора. Совсем недавно литий стал играть важную роль в сухих батареях и ядерных реакторах. Некоторые соединения лития использовались для лечения маниакально-депрессивных состояний.
Его соединения используются в некоторых видах изделий из стекла и фарфора. Совсем недавно литий стал играть важную роль в сухих батареях и ядерных реакторах. Некоторые соединения лития использовались для лечения маниакально-депрессивных состояний.
Батареи
Литий можно использовать в качестве литиевой батареи, в которой металлический литий служит анодом. Ионы лития служат в литий-ионных батареях (заряжаемых), в которых ионы лития перемещаются от отрицательного электрода к положительному при разрядке и наоборот при зарядке.
Теплопередача
Литий имеет самую высокую удельную теплоемкость среди твердых тел. Литий, как правило, используется в качестве охладителя для технологий и приложений теплопередачи.
Источники и извлечение
Литий чаще всего встречается в сочетании с алюминием, кремнием и кислородом с образованием минералов, известных как сподумен (LiAl(SiO 3 ) 2 ) или петалит /
80 касторит LiAlSi 4 O 10 ).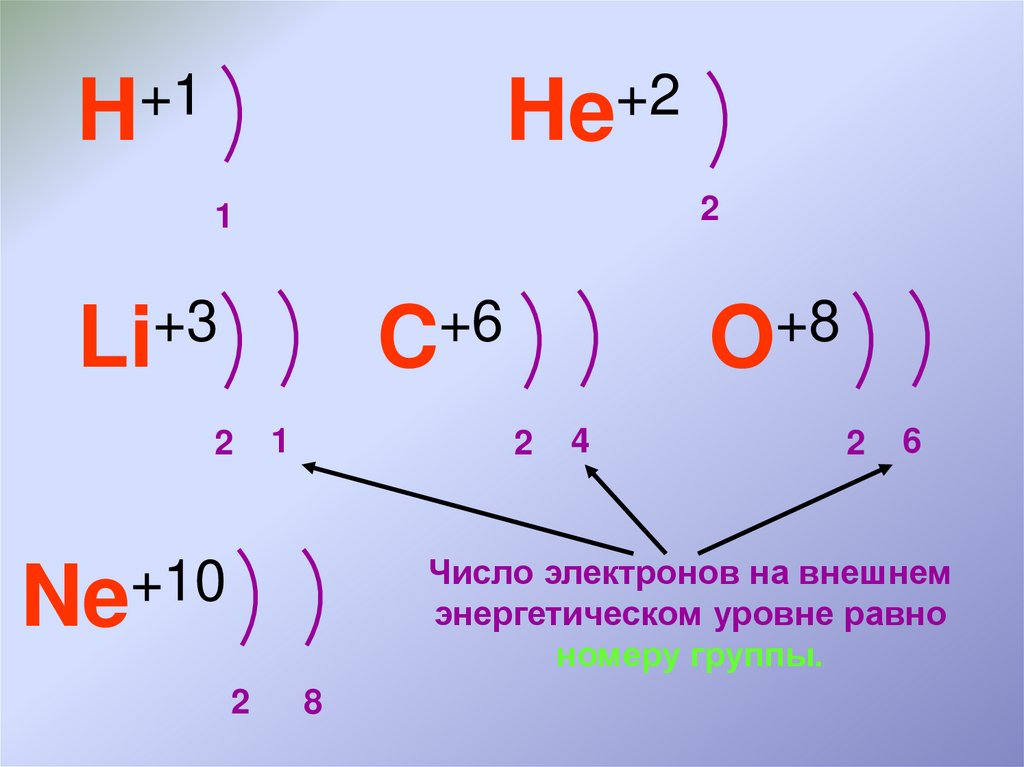 Они были найдены на каждом из 6 обитаемых континентов, но добываются они в основном в Западной Австралии, Китае и Чили. Минеральные источники лития становятся менее важными, поскольку в настоящее время разработаны методы использования солей лития, содержащихся в соленой воде.
Они были найдены на каждом из 6 обитаемых континентов, но добываются они в основном в Западной Австралии, Китае и Чили. Минеральные источники лития становятся менее важными, поскольку в настоящее время разработаны методы использования солей лития, содержащихся в соленой воде.Извлечение из минералов
Минеральные формы лития нагревают до достаточно высокой температуры (1200 K — 1300 K) для их измельчения и, таким образом, облегчения последующих реакций. После этого процесса можно применить один из трех методов.
- Использование серной кислоты и карбоната натрия для осаждения железа и алюминия из руды — оттуда на оставшийся материал наносится больше карбоната натрия, что позволяет литию осаждаться, образуя карбонат лития. Его обрабатывают соляной кислотой с образованием хлорида лития.
- Использование известняка для прокаливания руды с последующим выщелачиванием водой с образованием гидроксида лития. Опять же, это обрабатывают соляной кислотой с образованием хлорида лития.

- Использование серной кислоты, а затем выщелачивание водой с образованием моногидрата сульфата лития. Его обрабатывают карбонатом натрия с образованием карбоната лития, а затем соляной кислотой с образованием хлорида лития.
Хлорид лития, полученный любым из трех способов, подвергается окислительно-восстановительной реакции в электролизере для отделения ионов хлорида от ионов лития. Ионы хлора окисляются, а ионы лития восстанавливаются. 9- \rightarrow Ли \;\; \text{(восстановление)}\]
Извлечение из соленой воды
Морская вода естественным образом содержит хлорид лития, который должен быть извлечен в виде карбоната лития, затем повторно обработан, разделен на ионы и восстановлен в той же электролитический процесс, как при извлечении из литиевых руд. В настоящее время для добычи лития используются только три соленых озера в мире: в Неваде, Чили и Аргентине.
Соленая вода направляется в неглубокие пруды, и в течение года или более вода испаряется, оставляя после себя различные соли.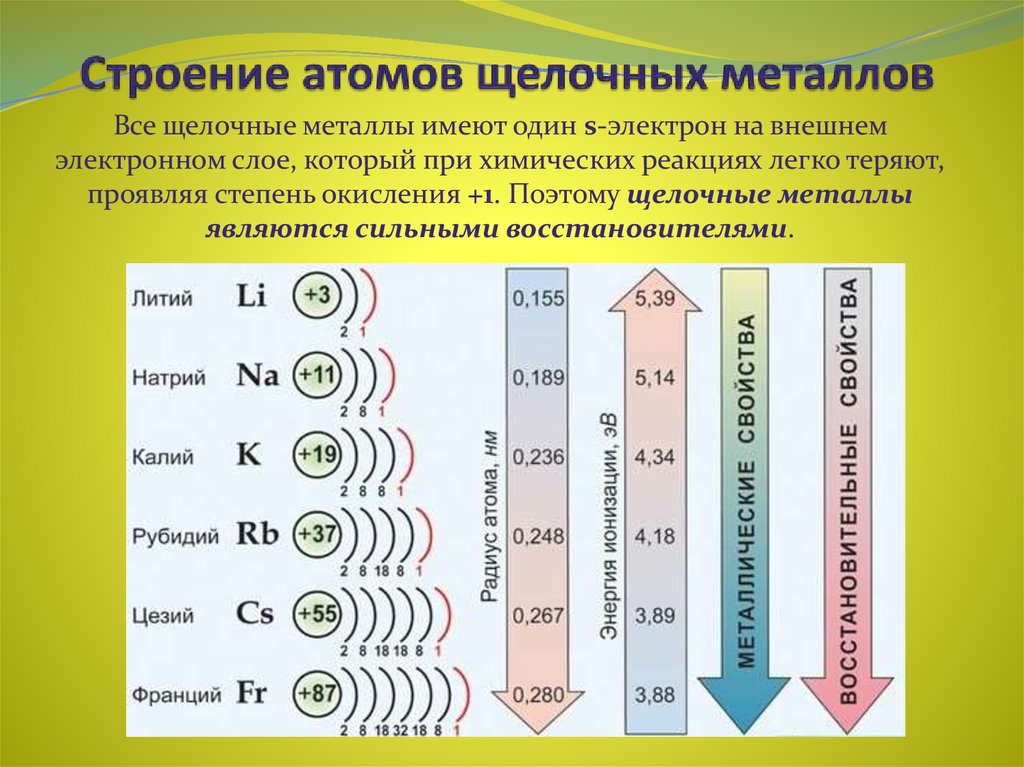 Известь используется для удаления соли магния, так что оставшийся раствор содержит довольно концентрированное количество хлорида лития. Затем раствор обрабатывают карбонатом натрия для осаждения пригодного для использования карбоната лития.
Известь используется для удаления соли магния, так что оставшийся раствор содержит довольно концентрированное количество хлорида лития. Затем раствор обрабатывают карбонатом натрия для осаждения пригодного для использования карбоната лития.
Ссылки
- Кипурос, Джордж Дж. и Садовей, Дональд Р. «К новым технологиям производства лития». Журнал металлов . Общество минералов, металлов и материалов. Том 50, № 5, май 1998 г .: 24–32.
- Шин, Ю. Дж. ; Ким, И. С.; О, С. К.; Парк, С.К. и Ли, К.С. «Извлечение лития из радиоактивных расплавленных солевых отходов электролизом». Журнал радиоаналитической и ядерной химии. Akadémiai Kiadó and Springer Science+Business Media BV, том 243, № 3, март 2000 г.: 639-643.
- Тахил, Уильям. «Проблемы с литием — последствия будущего производства PHEV для спроса на литий». Международные исследования Меридиана. Январь 2007 г.
Внешние ссылки
- http://en.Wikipedia.org/wiki/Lithium
- http://intelegen.
 com/nutrients/lithium.htm
com/nutrients/lithium.htm - www.scribd.com/doc/11579770/Extraction-Properties-and-Uses-of-Lithium
Задачи
- С какой группой элементов литий легче всего образует соединения?
- Какова электронная конфигурация Li + ?
- Каковы некоторые общие области применения лития?
- Для литий-ионной батареи, содержащей LiCoO 2 , следует ли помещать соединение в анод или катод?
- Учитывая, что 7 Li составляет 7,0160 а.е.м. и 6 Li составляет 6,0151 а.е.м., а их процентное содержание составляет 92,58% и 7,42% соответственно, какова атомная масса лития?
Растворы
- Группа 17 Галогены (литий образует с ними сильные межионные связи, так как галогены сильно электроотрицательны, а литий имеет свободный электрон)
- 1с 2
- Литий-ионные батареи, одноразовые литиевые батареи, пиротехника, создание прочных металлических сплавов и др.

- Анод — литий окислен (LiCoO 2 → Li + + CoO 2 )
- 6,942 г/моль
Авторы и ссылки
- Кэтрин Селонг (UCD), Кевин Фан
Chemistry of Lithium (Z=3) распространяется под лицензией CC BY-NC-SA 4.0, автор, ремикс и/или куратор LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.



 Укажите ответ в виде последовательности цифр выбран…
Укажите ответ в виде последовательности цифр выбран… НАЗВА…
НАЗВА…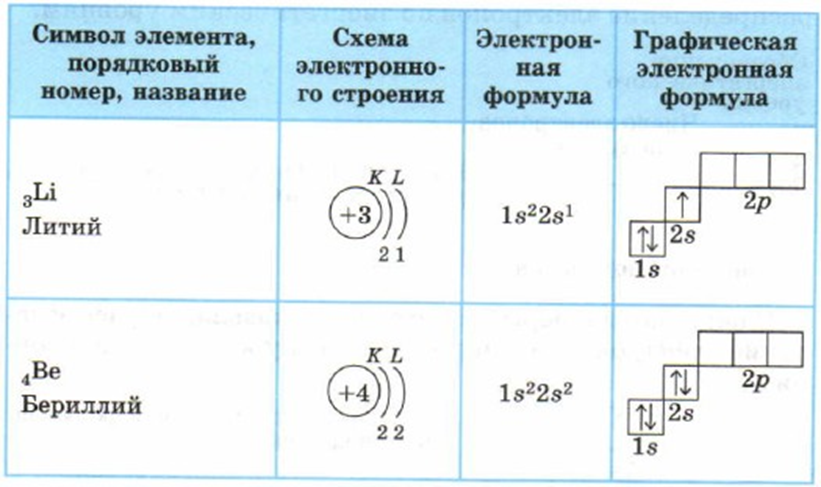 ..
..
 com/nutrients/lithium.htm
com/nutrients/lithium.htm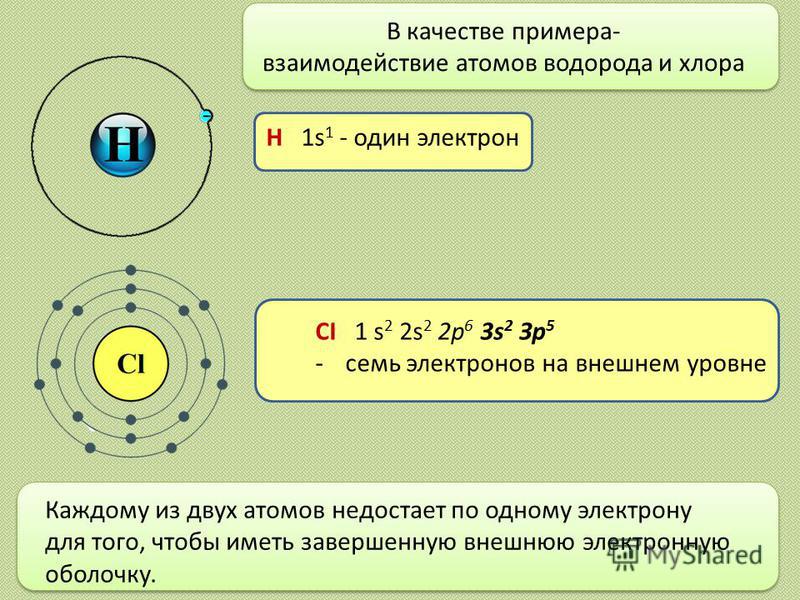

Leave A Comment