Каждый энергетический уровень делится на подуровни. На первом уровне только один подуровень — s. На втором уровне два подуровня — s и p. на третьем — s, p и d. На четвертом — s, p, d и f.
Максимальное число электронов на подуровнях
- 2 — максимальное число электронов на s-подуровне.
- 6 — максимальное число электронов на p-подуровне.
- 10 — максимальное число электронов на d-подуровне.
- 14 — максимальное число электронов на f-подуровне.
Максимальное число электронов на подуровне не зависит от номера уровня.
Заполнение энергетических уровней
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s
Геометрия орбиталей
Примеры
Полезные ссылки
Источник материала
Электронная оболочка атома (видео)
Строение атома (Часть 1) (видео)
Строение атома (Часть 2) (видео)
Строение атома. Ядерные силы (видео)
Дополнительные материалы
Модели строения атома (видео)
Строение атома: Атомное ядро (видео)
Химия. Строение атома: Строение электронных оболочек (видео)
Строение атома (видео)
2. Заполнение электронных слоёв атомов элементов малых периодов
Общее число электронов в атоме равно порядковому номеру химического элемента в Периодической таблице.
Каждый электрон находится на своей орбитали. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Электроны с близкими значениями энергии образуют энергетический уровень (электронный слой).
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии.
Энергетические уровни нумеруют, начиная с самого близкого к ядру.
Установлено, что максимальное число электронов на энергетическом уровне равно \(2n²\), где \(n \)— его номер. Значит, на первом уровне может находиться не более \(2\) электронов, на втором — не более \(8\), на третьем — не более \(18\) и т. д.
В атоме водорода — один электрон, и он располагается на первом энергетическом уровне:
h2)1.
В атоме гелия — два электрона. Первый энергетический уровень у гелия завершён, так как он не может содержать более двух электронов:
He2)2.
В атоме лития — три электрона. Два из них находятся на первом уровне. Третий электрон имеет большую энергию и движется дальше от ядра. В атоме лития появляется второй энергетический уровень:
Li3)2)1.
У следующих элементов второго периода электроны добавляются на второй уровень:
Be4)2)2; B5)2)3; C6)2)4; N7)2)5; O8)2)6; F9)2)7; Ne10)2)8.
У неона второй электронный слой завершён, так как содержит \(8\) электронов — максимально возможное число.
Заполнение третьего энергетического уровня начинается у атома натрия и завершается у атома аргона:
Na11)2)8)1; Mg12)2)8)2; Al13)2)8)3; Si14)2)8)4; P15)2)8)5; S16)2)8)6; Cl17)2)8)7; Ar18)2)8)8.
Максимальное количество электронов на третьем слое равно \(18\), но у элементов третьего периода его заполнение не происходит, потому что внешний электронный слой не может содержать более \(8\) электронов.
Обрати внимание!
На внешнем электронном слое не может быть более \(8\) электронов.
У элементов четвёртого периода начинается заполнение четвёртого энергетического уровня:
K19)2)8)8)1; Ca20)2)8)8)2.
Полностью четвёртый электронный слой заполняется, как и в малых периодах, у инертного газа криптона.
Периодический закон и Периодическая система
В начале XX века была создана теория строения атома, на основе которой периодический закон в настоящее время формулируется так: «Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атома.»
- Между положением элемента в периодической системе и его электронным строением существует связь.
- Порядковый номер элемента в периодической системе равен заряду ядра атома (следовательно, порядковый номер показывает число протонов в ядре и число электронов в атоме).
- Каждый период начинается элементом, в атомах которого начинает застраиваться новый электронный слой, причём номер этого слоя равен номеру периода (следовательно, номер периода показывает число электронных слоёв в атомах элементов данного периода).
- Элементы, атомы которых обладают сходными по строению электронными оболочками, попадают в одну подгруппу периодической системы. У всех элементов главных подгрупп электронами заполняется внешний электронный слой, причём число электронов на этом слое равно номеру группы.
У элементов I и II групп электронами заполняется s-подуровень, поэтому они называются s-элементами. У элементов III-VIII групп происходит заполнение р-подуровня, поэтому эти элементы относятся к семейству р-элементов. У элементов побочных подгрупп происходит заполнение электронами d-подуровня предпоследнего слоя, а у лантаноидов и актиноидов f-подуровня предпредпоследнего слоя.
- Свойства элементов определяются их строением. Элементы, имеющие на последнем слое 1 – 2 электрона являются металлическими, 2 – 5 электронов – переходными, 4 – 8 электронов – неметаллическими.
В главной подгруппе с возрастанием заряда ядра атомов металлические свойства усиливаются, а неметаллические уменьшаются. Это связано с увеличением числа электронных слоёв, а следовательно с уменьшением сил притяжения электронов последнего слоя к ядру.
Периодическое повторение свойств элементов объясняется периодическим повторением числа электронов на внешнем энергетическом уровне и повторением электронных структур атома.
Химическая активность элементов определяется строением внешнего электронного слоя. Активность галогенов объясняется нехваткой 1 электрона до завершения внешнего слоя. У инертных элементов внешний электронный слой завершён, поэтому они химически неактивны. У атомов щелочных металлов 1 электрон на последнем слое является как бы лишним.
Полезные ссылки
Источник материала
Периодическая система как условная запись периодического закона (видео)
Характеристика элементов по положению в таблице Менделеева (видео)
Изменение свойств элементов и их соединений по периодам и группам (видео)
Периодический закон и Периодическая система химических элементов (видео)
Описание элемента по положению в Периодической системе (видео)
Закономерности изменения электроотрицательности элементов в группе и периоде (видео)
Дополнительные материалы
Периодический закон и периодическая система элементов Менделеева (видео)
Периодическая система элементов (видео)
Электронный слой — Справочник химика 21
Р е ш е и и е.
Какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом л =4 [c.44]
Поляризующее действие иона (т. е. его способность деформировать, поляризовать другой ион) возрастает с увеличением заряда и уменьшением радиуса иона и сильно зависит от его электронной структуры. Ионы с благородногазовой электронной конфигурацией (например, Са +, Ва +) оказывают более слабое поляризующее действие, чем ионы с незавершенным электронным слоем (Т1 +, Ре +, РЬ + и т. п.). Наиболее сильное поляризующее действие (при одном и том же заряде иона) проявляют ионы с 18-электронной структурой внешнего слоя (Си+, А +, 1п +, Сс1 +, Н +).
Десять -элементов, — начиная со скандия и кончая цинком,— принадлежат к переходным элементам. Особенность построения электронных оболочек этих элементов, по сравнению с предшествующими (5- и р-элементами) заключается в том, что при переходе к каждому последующему -элементу новый электрон появляется не во внешнем ( = 4), а во втором снаружи ( — 3) электронном слое. В связи с этим важно отметить, что химические свойства элементов в первую очередь определяются структурой внешнего электронного слоя их атомов и лишь в меньшей степени зависят от строения предшествующих (внутренних)
Поляризуемость ионов с аналогичным электронным строением возрастает с ростом ионного радпуса (т. е. с увеличением числа электронных слоев). Так, по возрастанию поляризуемости ионы можно расположить в следующие ряды [c.68]
В подгруппах же элементов с возрастанием порядкового номера элемента (увеличение числа электронных слоев) раз.
Первый энергетический уровень (/(-слой, п=1) содержит только -подуровень, второй энергетический уровень -слой, п = 2) состоит нз — и р-подуровней и т. д. Учитывая это, составим таблицу максимального числа электронов, размещающихся в различных электронных слоях (табл. 2 на стр. 88). [c.87]
Индукционное взаимодействие. Установлено, что раствори — тели, обладающие значительным дипольным моментом, способны индуцировать дипольный момент у молекул асимметричной и сла— боасимметричной структуры. Следовательно, индуцированию подвержены как полярные, так и некоторые неполярные углеводороды масляного сырья. Поляризации подвержены в большей степени полициклические ароматические углеводороды, у которых ароматические кольца слабо экранированы нафтеновыми циклами и короткими алкильными цепями (то есть голоядерные). Под влиянием элв стростатического поля растворителя в таких молекулах масляной фракции возникает дeфopмai ия внешнего электронного слоя, что приводит к неравномерному распределению зарядов на отдельных участках молекул. В результате неполярная молекула временно превращается в индуцированный диполь. Молекулы с индуцированным дипольным моментом подвергаются далее ориентационному взаимодействию и переходят и раствор полярного растворителя. Индукционные силы взаимодействия зависят от силы электростатического поля полярной молекулы, то есть от значения дипольного момента и химической природы неполярных молекул, а именно от способности их поляризоваться. Индуцированный дипольный момент пропорционален напряженности поля Е, то есть =аЕ, где а характеризует степень поляризуемости индуцированной молеку — лы.
Изменение атомных и ионных радиусов в периодической системе имеет периодический характер (рис. 17). В периодах атомные и ионные радиусы по мере увеличения заряда ядра в общем уменьшаются. Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, так как у них происходит заполнение внешнего электронного слоя. В больших же периодах в пределах семейств й- и /-элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называется соответственно й- и -сжатием. [c.38]
Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, так как у них происходит заполнение внешнего электронного слоя. В больших же периодах в пределах семейств й- и /-элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называется соответственно й- и -сжатием. [c.38]
В 5-м периоде заполнение электронных слоев и подслоев происходит, как и в 4-м периоде, а именно у двух первых ( -элементов Rb и 5г) и шести последних ( о-элементов 1п—Хе) заполняется внешний слой. Между 5- и 7-элементами располагаются десять -элементов (У—Сс1), у которых заполняются -орбитали предвнешнего слоя (4 -подсюй). [c.27]
Рентгеновское излучение возникает за счет квантовых переходов внутренних электронов атомов. Последнее становится возможным в результате облучения вещества потоком электронов высокой энергии или жесткими рентгеновскими лучами, при котором происходит вырывание электронов из внутренних электронных слоев. На освободившиеся орбитали переходят электроны из более далеких от ядра слоев (рис. 85), что и сопровождается выделением квантов рентгеновского излучения. [c.141]
Если же исходить из того, что для завершения внешнего электронного слоя атому водорода не хватает одного электрона, то водород следует поместить в VII группе. Кроме того, как и атомы галогенов, атомы водорода характеризуются высокими значениями энергии ионизации. Многие ученые помещают водород в VII группу периодической системы. Вместе с тем водород—элемент особый, и размещение его в той или иной группе таблицы в значительной мере условно. [c.272]
Структура валентного электронного слоя атома элемента выражается формулой а) [c.45]
Бром и его аналоги — неметаллические элементы. Но с увеличением числа заполняемых электронных слоев атомов неметаллические признаки элементов в ряду Вг — I — ослабевают. Об этом, в частности, свидетельствует уменьшение энергии ионизации и сродства к электрону. Иод и астат проявляют даже заметные признаки амфотер н ости. [c.298]
Иод и астат проявляют даже заметные признаки амфотер н ости. [c.298]
Пространственная структура молекулы определяется видом гибридизации валентных орбиталей центрального атома и числом неподеленных электронных иар, содержащихся в его валентном электронном слое. [c.65]
В соответствии со строением валентного электронного слоя [c.470]
Здесь точками обозначены электроны, первоначально принадлежавшие атому азота, а крестиками — принадлежавшие атомам водорода. Из восьми внешних электронов атома азота шесть образуют три ковалентные связи и являются общими для атома азота и атомов водорода. Но два электрона принадлежат только азоту и образуют неподеленную электронную пару. Такая пара электронов тоже может участвовать в образовании ковалентной связи с другим атомом, если во внешнем электронном слое этого атома есть свободная орбиталь, Незаполненная 15-орбиталь у меется, например, у иона водорода Н+, вообще лишенного электронов [c.130]
Таким образом, начнь ая с бора (Е —5) и заканчивая нсоном (2 = 10), происходит заполнение р-нодуровня внешнего электронного слоя элементы этой части второго периода относятся, следовательно, к семейству р — э л е м е и т о в. [c.91]
Решение. Как в ионе аммония, так и в молекуле аммиака валентный электронный слой атома азота содержит четыре электронных пары [c.65]
Такая закономерность объясняется увеличением числа электронных слоев и растущим удалением внешних электронов от ядра. [c.100]
Периоды и семейства элементов. Как мы видели, период представляет собой последовательный ряд элементов, в атомах которых происходит заполнение одинакового числа электронных слоев. При атом номер периода совпадает со значением главного квантового числа п внешнего энергетического уровня. Различие в последовательности (аполнения электронных слоев (внешних и более близких к ядру) объясняет причину различной длины периодов. [c.28]
[c.28]
Э( х )ект экранирования заряда ядра обусловлен наличием в атоме между данным электроном и ядром других электронов, которые экранируют, ослабляют воздействие на этот электрон положительного заряда ядра и тем самым ослабляют связь его с ядром. Понятно, чтб экранирование возрастает с увеличением числа внут-эенних электронных слоев. [c.32]
Уменьшение энергии ионизации в подгруппах 5- и р-элементов объясняется усиливающимся (по мере увеличения числа электронных слоев) экранированием заряда ядра электронами, предшествующими внешиим электронам. [c.35]
Пг- электронной конфигурации, а следовательно и по свойствам водорэд занимает в главной подгруппе VII группы особое положение (ом. ниже). Согласно электронной конфигурации атомов (одинаковая ip/ктура внешнего и пргдвнешнего электронных слоев) бром, иод м астат объединяют в подгруппу брома фтор и хлор относят к типи- [c.271]
Атом водорода по сравнению с атомами других элементов наиболее простой по структуре Is . Но это, конечно, не означает, что его химия наиболее проста. Наоборот, она во многом отличается от химии других элементов. Основная особенность атома водорода заключается в том, что в отличие от всех других элементов (кроме гелия) его валентный э1ектрон находится непосредственно в сфере действия атомного ядра — у него нет промежуточного электронного слоя. Положительный ион вадорода Н+ представляет собой элементарную частицу — протон. [c.272]
В главную подгруппу VIII группы входят гелий Не, неон Ne, аргон Аг и элементы подгруппы криптона — криптон Кг, ксенон Хе, радон Rn. Их атомы имеют завершенную конфигурацию внешнего электронного слоя Is (Не) и ns np . [c.494]
Решение. В указанном ряду размеры валентных электронных облаков элеменюв (О, 5, Зе, Те) возрастают, что приводит к умен11и1ению степени их перекрывания с электронным облаком атома водорода и к возрастающему удалению области перекрывания от ядра атома соответствующе] о элемента. Это вызывает ослабление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т. е. ослабление связи. К этому же результату приводит возрастающее экранирование ядер рассматриваемых элементов в ряду О—5—5е—Те вследствие увеличения числа промежуточных электронных слоев. Таким образом, при переходе от кислорода к теллуру прочность связи Н—Э умеиыиается. [c.56]
Это вызывает ослабление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т. е. ослабление связи. К этому же результату приводит возрастающее экранирование ядер рассматриваемых элементов в ряду О—5—5е—Те вследствие увеличения числа промежуточных электронных слоев. Таким образом, при переходе от кислорода к теллуру прочность связи Н—Э умеиыиается. [c.56]
Потому что 1) в молекуле Nh4 внешний электронный слой атома азота полностью заполнен элек-i тронами 2) между молекулами Nh4 и ВРз возможно образование связи по донорио-акцепторному механизму. [c.246]
Птак, максимальное число электронов на 5-подуровне каждого электронного слоя равно 2. При / = 1 (р-подуровень) возможны уже три различных значения магнитного квантового числа (—1, О, 4-1)- Следовательно, на р-подуровне имеется три орбитали, каждая из которых может быть занята не более чем двумя электронам и. Всего иа р-подуровне может разместиться б элек-тропов [c.87]
Продолжим рассмотрение электронного строения атомо . Мы остановились на атоме аргона, у которого целиком заполнены 3s- и Зр-подуровнн, но остаются незанятыми все орбитали З -под-уровня. Однако у слсдуюилих за аргоном элементов — калия (Z = 19) и кальция (Z = 20) —заполиение третьего электронного слоя временно прекращается и начинает формироваться -подуровень четвертого слоя электронное строение атома калия выражается формулой ls 22s 2//3i 3p 4.s , атома кальция [c.92]
Благодаря отсутстьию у атомов лаитаноадов существенных различий в ст )уктуре внешнего н нрсдииршиего электронных слоев, все лантаноиды проявляют болг.шое сходство в химических свойствах. [c.97]
С началом застронки нового электронного слоя, более удален ного от ядра, т. е. при переходе к следующему периоду, атомные радиусы возрастают (сравните, например, радиусы атомов фтора и натрия). В результате в пределах подгруппы с возрастанием заряда ядра размеры атомов увеличиваются. Приведем в качестве примера значения атомных радиусов (в нм) элементов некоторых главных подгрупп [c.99]
Приведем в качестве примера значения атомных радиусов (в нм) элементов некоторых главных подгрупп [c.99]
Промежуточных электронных слоев, расположенных между ядром атома и внешними электронами, приводит к более сильному экранированию ядра, т. е. к уменьшер1ию его эффективного заряда. Оба эти фактора (растущее удаление внешних электронов от ядра и уменьшение его эффективного заряда) приводят к ослаблению связи внешних электронов с ядром и, следовательно, к уменьшС нию потенциала ионизации. [c.102]
Для наглядного изображения валентных схем обычно пользуются следующим способом. Электроны, находящиеся во внещ-нем электронном слое, обо и1ячают точками, располагаемыми вокруг химического символа атома. Общие для дву.х атомов электроны показывают точками, помещаемыми между их химическими символами двойная или тройная связь обозначается соответственно двумя или тремя парами общих точек. Применяя эти обозначения, образование молекулы водорода можно представить следующим образом [c.122]
Теперь во пнещнем электронном слое атома углерода иаход. тся четыре неспаренных эле1Строна следовательно, возбужденный атом углерода может участвовать в образовании четы( ех козалент п.1х связей. При этом увеличение числа создаваемых ковалентных свя- [c.128]
Если возбуждение атома, приводящее к увеличению числа неспарениых электронов, связано с очень большими затратами энергии, то эти затраты не, компенсируются энергией образования новых связей тогда такой процесс в целом оказывается энергетически навыгодным. Так, атомы кислорода и фтора 16 имеют свободных орбиталей во внешнем электронном слое [c.129]
Во многих случаях ковалентные связи воз1П1кают и за счет спа-рс1П1ых электронов, имеющихся во внешнем электронном слое атома. Рассмотрим, например, электронную структуру молекулы аммиака [c.130]
Таким образом, внешние электронные слои атома кислорода и центрального атома азота оказываются заполненными здесь образуются устойчивые восьмиэлектроиггые конфигурации. Но во внешнем электронном слое крайнего атома азота размещено только шесть электронов этот атом может, следовательно, быть акцептором еще одной электронггой пары. Соседний же с ним центральный атом азота обладает неподеленной электронной парой и мажет выступать в качестве донора. Это приводит к образованию [c.131]
Но во внешнем электронном слое крайнего атома азота размещено только шесть электронов этот атом может, следовательно, быть акцептором еще одной электронггой пары. Соседний же с ним центральный атом азота обладает неподеленной электронной парой и мажет выступать в качестве донора. Это приводит к образованию [c.131]
Атомы всех элементов второго периода имеют во внешнем электронном слое четыре орбитали при отсутствии /-с рбиталей в предыдущем слое. Следовательно, иа валептпых орбиталях этих атомов может разместиться ие более восг.ми электропоз. Это означает, что максимальная ковалентность элементов второго периода равна четырем. [c.132]
Атомы элементов третьего и иоследуюидих периодов могут использовать для образования ковалеитиых связей не только 5- и р-, по также п /-орбитали. Известны соединения -элементов, в которых в образовагши ковалентных связей участвуют 5- и р-орбнтали внешнего электронного слоя и все пять -орбиталей предшествующего слоя в подобных случаях ковалентность соответствующего элемента достигает девяти. [c.132]
Число электронов в слое электронной оболочки атома
Относительно палладия заметим, что это единственный элемент в таблице Менделеева, у которого число электронных слоев не совпадает с номером периода Pd находится в пятом периоде, а его атом в своей электронной оболочке содержит 4 электронных слоя ( 1). [c.507] Естественно, что фундаментальный закон химии, открытый Д. И. Менделеевым, — периодический закон—должен найти себе объяснение в закономерности строения атоМов, вскрываемой квантовой механикой. Периодичность в изменении химических свойств элементов при возрастании заряда ядра определяется периодическим повторением у определенных атомов строения внешних электронных оболочек. Легко заметить, что число электронов в последовательности от 5 до ближайшей конфигурации (первый период) или (остальные периоды) равно 2, 8, 8, 18, 32 (табл. 3), т. е. совпадает с числом элементов в периодах системы Д. И. Менделеева и объясняет, почему именно столько элементов содержится в данном периоде. Период начинается элементом, у которого впервые в системе возникает новый квантовый слой, содержащий один л-электрон (щелочной металл), и оканчивается элементом, у которого впервые в этом квантовом слое достраивается шестью электронами -подоболочка (благородные газы). Очевидно, что номер периода )авен главному квантовому числу электронов внешнего слоя. Например, атом натрия, открывающий третий период, и атом аргона, заканчивающий его, имеют конфигурации К 13л и К соответст- [c.60]
3), т. е. совпадает с числом элементов в периодах системы Д. И. Менделеева и объясняет, почему именно столько элементов содержится в данном периоде. Период начинается элементом, у которого впервые в системе возникает новый квантовый слой, содержащий один л-электрон (щелочной металл), и оканчивается элементом, у которого впервые в этом квантовом слое достраивается шестью электронами -подоболочка (благородные газы). Очевидно, что номер периода )авен главному квантовому числу электронов внешнего слоя. Например, атом натрия, открывающий третий период, и атом аргона, заканчивающий его, имеют конфигурации К 13л и К соответст- [c.60]
Магнитные свойства ферромагнитных материалов определяются магнитными свойствами многоэлектронного атома. Однако далеко не все материалы с многоэлектронными атомами обладают ферромагнитными свойствами. Строение атомов ферромагнитных материалов имеет ряд особенностей. Атом состоит из положительно заряженного ядра, вокруг которого вращаются электроны, образующие электронные слои и оболочки. Число электронных слоев определяют главным квантовым числом, которое принимает целые значения 1, 2, 3,. .., п. Число оболочек в слое выражают орбитальным квантовым числом I и обозначают их буквами 8, р, планетарная модель атома железа, из которого видно, что в атоме содержится четыре электронных слоя. В первом слое находится одна электронная оболочка 18 с двумя электронами во втором слое содержатся оболочки 28 с двумя электронами, 2р с шестью электронами в третьем слое — оболочка Зз с двумя электронами, оболочка Зр с шестью электронами и оболочка 3(1 с шестью [c.238]
Любой атом согласно теории Косселя имеет тенденцию принять наиболее устойчивую электронную конфигурацию во внешнем слое, встречающуюся у инертных газов. Это достигается или отдачей электрона или восприятием электрона. В результате этого процесса нарушается электронейтральность атома. В первом случае он получает положительный заряд благодаря преобладанию числа зарядов ядра, во втором атом заряжается отрицательно, ибо он воспринимает электроны. Так, у наиболее электроположительных атомов, например у лития, на внешней оболочке имеется один электрон, у наиболее электроотрицательного—фтора — внешняя оболочка содержит семь электронов. [c.67]
Так, у наиболее электроположительных атомов, например у лития, на внешней оболочке имеется один электрон, у наиболее электроотрицательного—фтора — внешняя оболочка содержит семь электронов. [c.67]
Атомы различных элементов имеют разные объемы, более или менее закономерно изменяющиеся по периодической системе в разных направлениях. Так, сверху вниз по любой главной подгруппе, в связи с увеличением числа квантовых слоев радиус атомов резко увеличивается. Поэтому, атом франция (№ 87, Гг, I гр.) больше атома лития (№ 3, Ь1) атом астатина (№ 85, АЬ, VII гр.) больше атома фтора (Л а 9, Г). Слева направо по любому периоду, в связи с постепенным возрастанием положительного заряда ядра при одном и том же числе квантовых слоев у всех элементов периода, электронная оболочка сжимается и радиус атома уменьшается-, поэтому атом фтора (№ 9, Г, II период) меньше атома лития (оХг 3, Ь1) атом астатина (№ 85, А1, VI период) меньше атома цезия (Л 55, Сз). [c.139]
После заполнения Зd-пoдypoвня (п = 3, / = 2) электроны, в соответствии со вторым правилом Клечковского, занимают подуровень 4р (п = 4, / = 1), возобновляя тем самым построение Л -слоя. Этот процесс начинается у атома галлия (2 = 31) и заканчивается у атома криптона Е = 36), электронное строение которого выражается формулой 1з 2з 2р 38 Зр Зс °4з Ар . Как и атомы предшествующих благородных газов — неона и аргона, атом криптона характеризуется структурой внешней электронной оболочки пз пр , где тг — главное квантовое число (неон — 2з 2р , аргон — 3в23р , криптон — Аз Ар ). [c.68]
При заполнении электронных слоев и оболочек атомы подчиняются 1) принципу наименьшей энергии, согласно которому электроны сначала заполняют вакантные орбитали с минимальной энергией 2) принципу Паули 3) правилу Гунда — на вырожденных орбиталях суммарное спиновое число электронов должно быть максимальным. В квантовых ячейках с одинаковой энергией заселение электронами происходит так, чтобы атом имел наибольшее число неспаренных электронов. Это отвечает нормальному состоянию атома (минимум энергии). Рассмотрим связь между электронным строением атомов и положением элементов в короткой 8-клеточной Периодической сис ме (см. форзац). У каждого следующего элемента Периодической системы по сравнению с предыдущим на один электрон больше. Наиболее прост первый период системы, состоящий лишь из двух элементов. У водорода единственный электрон заселяет наинизшую по энергии орбиталь 1 , а у гелия на этой орбитали два электрона с антипарал-лельными спинами. Гелием заканчивается первый период системы и исчерпаны все вариации квантовых чисел при п = I. Таким образом, у атома гелия полностью формируется наиболее близкий к ядру А -слой. [c.40]
Это отвечает нормальному состоянию атома (минимум энергии). Рассмотрим связь между электронным строением атомов и положением элементов в короткой 8-клеточной Периодической сис ме (см. форзац). У каждого следующего элемента Периодической системы по сравнению с предыдущим на один электрон больше. Наиболее прост первый период системы, состоящий лишь из двух элементов. У водорода единственный электрон заселяет наинизшую по энергии орбиталь 1 , а у гелия на этой орбитали два электрона с антипарал-лельными спинами. Гелием заканчивается первый период системы и исчерпаны все вариации квантовых чисел при п = I. Таким образом, у атома гелия полностью формируется наиболее близкий к ядру А -слой. [c.40]
В самом деле, принцип Паули — это принцип запрета, чисто негативный, ограничительный по своей природе. Он дает число электронов, наибольшее для данного уровня. Больше этого числа электронов атом разместить не может, но меньше — сколько угодно. Из принципа Паули не вытекает количественная оценка самого значения энергии электронов на разных уровнях, и может быть и такое положение, когда энергия электрона на более далеком уровне будет меньшей, чем на более близком, а потому атом, комплектуя свои оболочки, сможет и не использовать дозволенные Паули уровни и начать размещать электроны в более далеких слоях до тех пор, пока энергетически это будет выгодно (см. табл. 8). [c.81]
Величина заряда иона зависит от числа потерянных или присоединенных атомом электронов. Так, например, если атом магния, имеющий в своей оболочке всего 12 электронов, потеряет два электрона наружного слоя, то образовавшийся ион магния будет иметь заряд +2, так как от потери электронов заряд ядра, равный +12, не изменится, а общий заряд оставшихся электронов станет равным —10 (заряд иона будет —10+12 =+2). [c.82]
Общее число валентных электронов в молекулах, подобных ВеСЬ, недостаточно для того, чтобы целиком заполнить внешнюю электронную оболочку атома бериллия. Поэтому такие молекулы называют электронодефицитными. Так, в молекуле ВеСЬ в наружном слое атома бериллия находятся всего четыре электрона. Поэтому атом бериллия способен быть акцептором электронных пар и образовывать еще две ковалентные связи по донорно-акцепторному способу. В то же время каждый атом хлора, входящий в состав молекулы ВеСЬ, обладает неподеленными электронными парами и может выступать в качестве их донора. Поэтому при охлаждении газообразного хлорида бериллия между отдельными молекулами ВеСЬ возникают новые ковалентные связи в соответствии со схемой 4.8. В итоге, при конденсации хлорида бериллия образуются линейные полимерные цепи, в которых атомы хлора играют роль мостиков, связывающих атомы бериллия. Атомы, выполняющие такую функцию, называются мостиковыми атомами. Видно, что ковалентность и координационное число бериллия в твердом ВеСЬ равны четырем. [c.389]
Поэтому такие молекулы называют электронодефицитными. Так, в молекуле ВеСЬ в наружном слое атома бериллия находятся всего четыре электрона. Поэтому атом бериллия способен быть акцептором электронных пар и образовывать еще две ковалентные связи по донорно-акцепторному способу. В то же время каждый атом хлора, входящий в состав молекулы ВеСЬ, обладает неподеленными электронными парами и может выступать в качестве их донора. Поэтому при охлаждении газообразного хлорида бериллия между отдельными молекулами ВеСЬ возникают новые ковалентные связи в соответствии со схемой 4.8. В итоге, при конденсации хлорида бериллия образуются линейные полимерные цепи, в которых атомы хлора играют роль мостиков, связывающих атомы бериллия. Атомы, выполняющие такую функцию, называются мостиковыми атомами. Видно, что ковалентность и координационное число бериллия в твердом ВеСЬ равны четырем. [c.389]
Если рассмотреть структуры внешних электронных слоев атомов наиболее пассивных в химическом отношении элементов, например инертных газов, легко убедиться, что их внешние электронные оболочки содержат четное число электронов атом гелия — 2 электрона, атомы всех остальных инертных газов — по 8 электронов. Напротив, во внешней электронной оболочке наиболее активных элементов — галогенов, щелочных металлов имеется нечетное число электронов. [c.99]
Образование ионной связи вызвано стремлением атома к приобретению устойчивой оболочки с полным числом электронов во внешнем слое, как у благородных газов. Например, атом Na (№ 11 по системе Менделеева) имеет две заполненные оболочки с числом электронов 2 — — 8 и один электрон на внешнем уровне, который он стремится отдать, а атом С1 имеет 7 электронов на внешней оболочке — ему не хватает одного электрона, чтобы приобрести конфигурацию, как у аргона. Поэтому в ионном кристалле происходит объединение [c.146]
Разъединение электронной пары происходит с затратой энергии. Если затрачиваемая при этом энергия не компенсируется в результате образования новых электронных пар, то атомы данного элемента не вступают в химическое взаимодействие с атомами другого элемента. Это встречается у некоторых инертных газов, в атомах которых все электроны спаренные. Разъединение электронных пар ограничено числом ячеек для электронного слоя. Так, для электронного слоя (в данном случае и для электронной оболочки) гелия возможна одна ячейка, где и размещаются два электрона атома этого элемента. Возможно допустить разъединение этой пары путем переноса электрона во второй слой, но расчет показывает, что при этом потребуется затратить такое количество энергии (около 400 ккал/г-атом), которое не компенсируется при химических реакциях. Атомы лития, как и атомы других щелочных металлов, имеют по одному электрону во внешнем слое, поэтому литий и все другие щелочные металлы одновалентны. Азот, если исходить из ячеистой структуры его оболочки, может проявлять валентность от 1 до 3 за счет неспаренных электронов. Всего же атом азота может давать на образование ковалентных связей максимально четыре электрона, так как в его внешнем электронном слое имеется всего четыре ячейки. Но азот бывает и пятивалентен, причем одна связь у него ионная. Следовательно, в соединениях, в которых азот пятивалентен, валентность этого элемента имеет смешанный характер. Кислород двухвалентен и фтор одновалентен. Углерод двухвалентен за счет двух неспаренных электронов. Но у атома углерода одна ячейка свобод- [c.73]
Это встречается у некоторых инертных газов, в атомах которых все электроны спаренные. Разъединение электронных пар ограничено числом ячеек для электронного слоя. Так, для электронного слоя (в данном случае и для электронной оболочки) гелия возможна одна ячейка, где и размещаются два электрона атома этого элемента. Возможно допустить разъединение этой пары путем переноса электрона во второй слой, но расчет показывает, что при этом потребуется затратить такое количество энергии (около 400 ккал/г-атом), которое не компенсируется при химических реакциях. Атомы лития, как и атомы других щелочных металлов, имеют по одному электрону во внешнем слое, поэтому литий и все другие щелочные металлы одновалентны. Азот, если исходить из ячеистой структуры его оболочки, может проявлять валентность от 1 до 3 за счет неспаренных электронов. Всего же атом азота может давать на образование ковалентных связей максимально четыре электрона, так как в его внешнем электронном слое имеется всего четыре ячейки. Но азот бывает и пятивалентен, причем одна связь у него ионная. Следовательно, в соединениях, в которых азот пятивалентен, валентность этого элемента имеет смешанный характер. Кислород двухвалентен и фтор одновалентен. Углерод двухвалентен за счет двух неспаренных электронов. Но у атома углерода одна ячейка свобод- [c.73]
Сколько электронных слоев может иметь каждый из нас Вы начали перечислять первый слой, третий слой, пятый… десятый… И сколько их еще там Откуда же возьмется так много электронов Вот я сделал такой расчет. Если, действительно, электроны стремятся занять самый низкий энергетический уровень и создание каждого слоя начинают только после того, как полностью заполняют предыдущий слой, то атом Лоуренсия, один из самых богатых среди нас по числу своих электронов, будет иметь электронную оболочку самое большое из пяти слоев. У него 103 электрона в первом слое 2, во втором 8, в третьем 18, в четвертом 32, а пятый будет неполный — 43 электрона. Какой же смысл тогда говорить о шестом слое, седьмом и т. д., выводить общие формулы и прочее [c.156]
д., выводить общие формулы и прочее [c.156]
В каждом вертикальном столбце системы собраны изоэлектронные по внешней оболочке гомологи, отличающиеся друг от друга нарастающим (по столбцу сверху вниз) отталкиванием внутренних электронных слоев, постепенным вхождением в состав электронных конфигураций (1- и /-вакансий, частично заполненных в свободных атомах или Заполняемых при образовании химических связей вхождением, характеризуемым радиальными сжатиями электронных облаков, изменением типа гибридизации, координационного числа, а также симметрии расположения связей в пространстве. Всему этому сопутствуют изменения сродства к электрону и окислительной способности, а также донорской способности электронов уединенных пар, переходящих от лиганда к центральному атому. [c.95]
Атом любого элемента состоит из положительно заряженного ядра, величина заряда которого определяется порядковым номером элемента в периодической системе, и из электронов, расположенных вокруг ядра и составляющих его оболочку. Атом является системой электронейтральной число отрицательно заряженных электронов равно положительному заряду ядра. Распределение электронов по отдельным слоям (уровням) электронной оболочки атомного ядра подчиняется следующим правилам [c.46]
Пирамидальная четырехатомная молекула аммиака. Перейдем к описанию молекул, имеющих форму тригональной пирамиды, примером которых может служить молекула NHз, Атом азота имеет во внешнем электронном слое 5 электронов 2з 2р ), присоединив 3 атома водорода, он дополняет свою электронную оболочку до 8 электронов. Это оптимальное число, Ь характеризующее предельное заселение электронами всех связевых орбиталей. Опыт показывает, что МНз — устойчивое соединение, разлагающееся эндотермически [c.310]
Из этого принципа, однако, не следует, что движение электронов в атоме совсем произвольно. Напротив, электроны должны находиться во вполне определенных областях пространства, расположенных вокруг атомного ядра.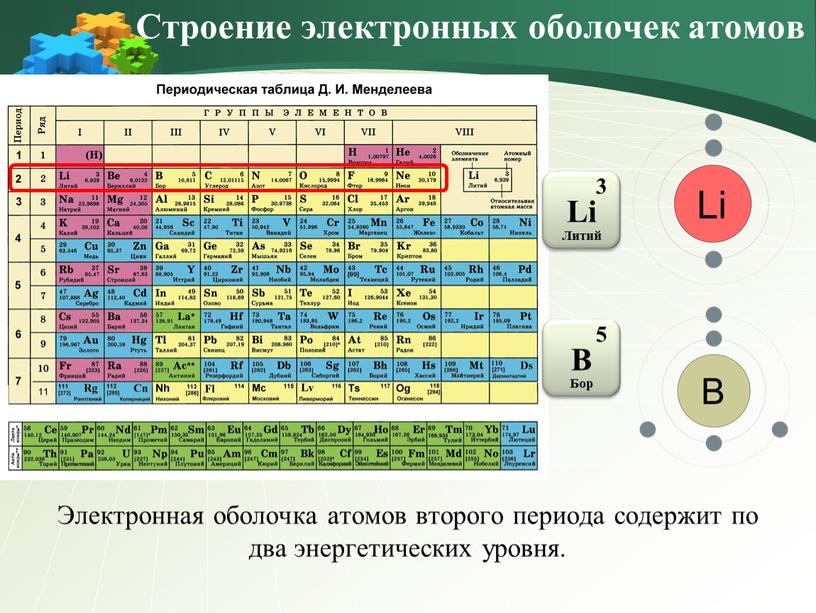 Эти области, заменившие первоначальные боровские орбиты, обычно называют орбиталями. Такие области образуют некоторые замкнутые пространственные слои вокруг ядра, которые принято называть оболочками. Электроны вокруг ядра образуют оболочечную структуру. На каждой оболочке может находиться только вполне определенное число электронов. Если атом не возбужден, то электроны, вообще говоря, занимают оболочки по порядку, начиная с самой внутренней. Оболочкам, начиная с самой внутренней, присвоены порядковые номера 1, 2, Зит. д. Номер наружной оболочки, в которой еще имеется злектрон, соответствует номеру периода таблицы Менделеева, в котором расположен элемент данного атома. [c.162]
Эти области, заменившие первоначальные боровские орбиты, обычно называют орбиталями. Такие области образуют некоторые замкнутые пространственные слои вокруг ядра, которые принято называть оболочками. Электроны вокруг ядра образуют оболочечную структуру. На каждой оболочке может находиться только вполне определенное число электронов. Если атом не возбужден, то электроны, вообще говоря, занимают оболочки по порядку, начиная с самой внутренней. Оболочкам, начиная с самой внутренней, присвоены порядковые номера 1, 2, Зит. д. Номер наружной оболочки, в которой еще имеется злектрон, соответствует номеру периода таблицы Менделеева, в котором расположен элемент данного атома. [c.162]
Во П и И1 периодах Системы насыщение внешней электронной оболочки атома идет от 1 е до достижения законченной восьмиэлектронной структуры. Углерод и кремний находятся при этом в особом положении в центре ряда число наличных электронов во внешнем слое их атомов равно 4, а до насыщения им не хватает также 4 е . Это накладывает на химию углерода свой отпечаток в одних случаях атом углерода может участвовать в образовании связей своими четырьмя электронами в качестве донора — так или иначе продвигая их в направлении восстанавливаемых им атомов окислителя, например хлора, в соединении ССЦ в других — атом углерода служит акцептором четырех электронов от восстановителя, например от водорода, в молекуле Hj. [c.300]
У элемента цезия начинается заполнение шестого слоя, но подуровень Ъй остается свободным. В этом подуровне электрон появляется у атома лантана, но у следующих за лантаном элементов заполняется подуровень 4/, причем электрон с подуровня Ъй переходит на 4f, так что церий имеет электронную конфигурацию [Хе] 4рб5 . Лантаноидов всего 14, так как четвертый слой достраивается в этой последовательности элементов с 18 до 32 электронов. Далее возобновляется заполнение пятого, а затем и шестого слоев. Для последовательности актиноидов характерно заполнение подуровня 5/. По правилу, предложенному В. М. Клечков-ским, заполненпе электронных оболочек происходит так, что электрон, присоединяясь к ионизированному атому элемента, занимает уровень с минимальным значением суммы квантовых чисел п+1. По Клечковскому, заполнение уровней (по мере роста атомного номера) происходит последовательно от групп уровней с меньшим значением суммы п + 1 к группам с большим значением этой суммы, а в пределах каждой (п-Ь/)-группы заполнение происходит от групп с меньшим значением главного квантового числа п и с большим значением орбитального I к подгруппам с большим п и меньшим I. Заполнение уровней группы завершается 5-электронами. После этого происходит переход к следующей (м-Ь/)-группе. Отсюда вытекает, что электронные оболочки должны заполняться в следующем порядке 15 , 25 , 2р , 35 , Зр , 4×2, Зсг °, 4р 552. [c.166]
По правилу, предложенному В. М. Клечков-ским, заполненпе электронных оболочек происходит так, что электрон, присоединяясь к ионизированному атому элемента, занимает уровень с минимальным значением суммы квантовых чисел п+1. По Клечковскому, заполнение уровней (по мере роста атомного номера) происходит последовательно от групп уровней с меньшим значением суммы п + 1 к группам с большим значением этой суммы, а в пределах каждой (п-Ь/)-группы заполнение происходит от групп с меньшим значением главного квантового числа п и с большим значением орбитального I к подгруппам с большим п и меньшим I. Заполнение уровней группы завершается 5-электронами. После этого происходит переход к следующей (м-Ь/)-группе. Отсюда вытекает, что электронные оболочки должны заполняться в следующем порядке 15 , 25 , 2р , 35 , Зр , 4×2, Зсг °, 4р 552. [c.166]
Общее число электронов в оболочке нейтрального атома равно заряду ядра атома и, следовательно, порядковому номеру элемента. Так, например, в атоме водорода имеется всего 1 электрон, а в атоме урана — 92. Для того чтобы выяснить более точно строение атома, надо знать распределение его электронов по слоям. По мысли Бора, атом строится из электронов оболочками, которые распо- [c.24]
Кислород даже по отношению к электроотрицательным элементам всегда двухвалентен, в то время как S, Se и Те могут быть также четырех- и шестивалентными. Эти различия в поведении элементов VI группы объясняются современной теорией строения электронных оболочек атомов. Шесть валентных электронов кислорода находятся в L-слое (с главным квантовым числом п = 2). Для его заполнения необходимо всего два электрона, поэтому атом кислорода может иметь только две ковалентные связи — либо с двумя одновалентными атомами, либо с двухвалентным атомом или радикалом (двойная связь). Для образования большего числа связей потребовались бы орбитали следующего М-слоя, что невозможно, так как их энергия значительно больше. Следовательно, во всех своих соединениях атом кислорода имеет в L-слое восемь электронов (полный октет). У атома S валентные электроны находятся [c.395]
У атома S валентные электроны находятся [c.395]
Возможность образования комплексных соединений кремния или германия, например К2151Рв], может быть объяснена следующим образом. У атома кремния в молекуле 51р4 целиком заполнены все 5- и р-ячейки внешнего электронного слоя, но оболочка содержит еще пять пустых -ячеек. Благодаря их наличию атом кремния может образовать донорно-акцепторные связи, в которых сам играет роль акцептора. Число этих связей меньше числа -ячеек и равно двум. Это можно объяснить тем, что вокруг атома кремния не может разместиться больше шести атомов фтора. Несмотря на наличие свободных ячеек у атома кремния, молекула 51С14 не присоединяет к себе ионов сН, поскольку они имеют больший радиус, чем ион Р»», и вокруг атома кремния не может разместиться больше четырех атомов хлора. [c.194]
Кроме общей характеристики по сходству для Р, С1 и О как элементов правого верхнего угла Системы Д. И. Менделеева следует произвести в отдельности сопоставление С1 и Р, а также С1 и О. В случае первой пары элементов существует сходство, состоящее в том, что нейтральные атомы Р и С1 имеют семь внешних электронов. Такого рода сходство, в основе которого лежит один и тот же тип внешней оболочки атома, прототипом которого является семиэлектронный в наружном слое атом фтора, повторяется не только у хлора, но и у брома, иода и астата, т. е. у всех элементов главной подгруппы VII вертикального столбца Системы. Подобное равенство числа наружных электронов имеется и в других вертикальных столбцах Системы в группе щелочных металлов число наружных электронов равно 1, в группе щелочноземельных металлов — 2 и т. д. Отсюда возникает формальное сходство возможных степеней окисления — восстановления и химических формул. Так, например, для соединений элементов одного и того же вертикального столбца имеется первая степень окисления и общая формула их для всех галидов щелочных металлов (МХ) первая степень восстановления всех галогенов и общая формула (НХ) для их соединений с водородом НР, НС1, НВг, Н1 и НА1.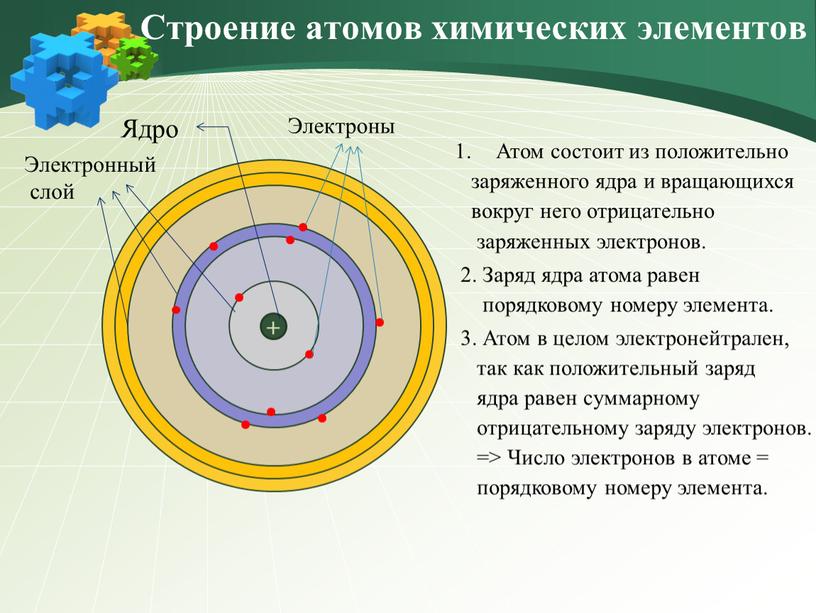 [c.197]
[c.197]
Атом азота. Атом азота имеет два электронных слоя во внутреннем слое (гелийная оболочка) содержится два, во внешнем слое с квантовым числом 2 — пять электронов. До октета во внешнем слое недостает трех электронов. Поэтому азот выступает в качестве трехвалентного элемента 1) при образовании ковалентных связей 2) при захвате электронов от электроположительных элементов, превращаясь в электроотрицательный ион N—. Соединения электроотрицательного азота называются нитридами. [c.421]
Как известно, Менделеевское число (порядковый номер) элемента в периодической системе соответствует числу положитель-ны.х зарядов ядра его ато ма и является ио-ходяой величиной, характеризующей элемент. Химические же свойства элемента, в первую очередь, определяются структурой последни.х и предпоследних слоев электронных оболочек. Периодическое изменение химических свойств элел1ентов связано с периодическим повторением одних и тех же структур последних и предпоследних электронных слоев. Однако, нельзя забывать, что при передвижении по периодической систе.ме сверху вниз имеет место последовательное возрастание числа электронных слоев, что ведет к увеличению радиуса и сказывается на поляризационных свойствах иопсз. Как показал Б. В. Некрасов, н менно эти факторы определяют характер поляризационного взаимодействия [юнов, а следовательно, в основных чертах, и ряд свойств обра-.зуемых соединений. [c.47]
Следующий слой это -оболочка, состоящая из четырех орбит. 25, 2р , 2р , 2р . Из этих орбит 2з несколько стабильнее, чем орбита 2р. В атомах, начиная с лития и до неона, электроны заполняют эти орбиты. Два электрона на одной и той же орбите имеют противоположные спины. Неон с заполненной -оболочкой с восемью электронами имеет электронную конфигурацию 1з 28 2р 2р 2р ,, или 1 28 2р . Верхний индекс указывает число электронов на данной орбите. В этих символах числа 1 и 2 (соответственно для К- и -оболочек) дают значения главного квантового числа п и буквы 8 и р выражают значение азимутального квантового числа 2 / буквы 8, р, (1, соответствуют 1 = 0, 1, 2, 3,. .. с максимальным значением 1 = п— 1. В атоме или одноатомном ионе электроны стремятся занять попарно наиболее стабильные орбиты если имеется несколько орбит с одной 1 т0й же нергией, 4сак /1 2д , то электроны не стремятся образовать пары друг с другом, а занимают разные орбиты (по одному электрону на орбите), сохраняя параллельные спины. Например, атом азота в основном состоянии имеет конфигурацию 18 2 2р 2р 2р, с тремя неспаренншми р-электронами. В кислороде восьмой электрон -оболочки должен образовать пару с одним из трех р-электронов, так что остается только два неспаренных электрона. Тот же процесс приводит к одному холостому электрону у фтора и отсутствию неспаренных электронов у неона. В оболочке с главным квантовым числом п имеется орбит.- 1 в К-о6о-лочке, 4 в , 9 в М, 16 в и т. д. Число электронов, занимающих заполненную оболочку, равно 2пР. [c.34]
.. с максимальным значением 1 = п— 1. В атоме или одноатомном ионе электроны стремятся занять попарно наиболее стабильные орбиты если имеется несколько орбит с одной 1 т0й же нергией, 4сак /1 2д , то электроны не стремятся образовать пары друг с другом, а занимают разные орбиты (по одному электрону на орбите), сохраняя параллельные спины. Например, атом азота в основном состоянии имеет конфигурацию 18 2 2р 2р 2р, с тремя неспаренншми р-электронами. В кислороде восьмой электрон -оболочки должен образовать пару с одним из трех р-электронов, так что остается только два неспаренных электрона. Тот же процесс приводит к одному холостому электрону у фтора и отсутствию неспаренных электронов у неона. В оболочке с главным квантовым числом п имеется орбит.- 1 в К-о6о-лочке, 4 в , 9 в М, 16 в и т. д. Число электронов, занимающих заполненную оболочку, равно 2пР. [c.34]
Образование комплексных соединений всегда происходит с участием -орбиталей. Последние могут существовать только для уровней с главным квантовым числом > 3. При этом оказывается, что участвовать в образовании координационных связей в комплексе могут как внутренние, т. е. находящиеся ниже валентной оболочки, так и внешние -орбитали. Примером последнего является молекула 8Ре, где внешний электронный слой атома 8 в основном состоянии имеет конфигурацию (Зх) (3/>) -Так как из четырех электронов, размещенных на трех орбиталях — Рх,Ру и Р , два обязательно должны быть спарены (принцип Паули), атом серы в основном состоянии является двухвалентным потому, что в образовании связей могут принимать участие только песпаренные электроны. То, что указанное соединение тем не менее образуется, является следствием двукратного возбуждения атома серы в состояние (Зх) (Зр) (3 ) . Объясняется такая возможность двумя причинами. Во-нервых, возмущение в поле окружающих молекул приводит к тому, что внешняя -орбиталь оказывается сильно сжатой и энергетически мало отличается от существующей внешней оболочки. С другой стороны, образование связующих внешних орбиталей с примесью -орбиталей, как впервые показал Полинг [15], приводит к образованию очень четко направленных и сильных связей. [c.97]
[c.97]
Элементы подгруппы титана относятся к числу переходных — они содержат недостроенную электронную оболочку п—Электронная подкладка у атомов таких элементов, т. е. оболочка, предшествующая слою валентных электронов, относится к 8-электронному типу (имеет благороднотазовое строение). Как известно, в подгруппах таких элементов, ввиду жесткости (малой деформируемости) 8-злект-ронных оболочек (в отличие от 18-электронных, характерных для ностпереходных элементов), с ростом атомного номера и радиуса ато-ма (иона) наблюдается уменьшение поляризующего действия. Наиболее сильным поляризующим действием (при прочих равных усло виях) обладает титан из-за малого размера атома (иона) в этой подгруппе он сильнее всего удерживает валентные электроны и поэтому относительно легко может быть переведен в состояние с более низкой степенью окисления, чем обычное валентное состояние, характеризуемое степенью окисления +4. [c.105]
Этим путём число электронов сильно уменьшается и ядро очень быстро коллапсирует, поскольку именно вырожденные электроны способны противостоять силам гравитации. Внешние слои звезды (рис. 3.4.5) практически не замечают этого коллапса. При этом в ядре звезды образуются главным образом нейтроноизбыточные нестабильные ядра, которые распадаются на свободные нейтроны путём реакций типа е + Z, А) Z — , А — п и , что приводит к нейтронизации звезды. При плотности р 5 10 г/см , материя становится непрозрачной для нейтрино, они начинают поглош,аться во внешних оболочках звезды, вызывая в последних термоядерные реакций. [c.73]
Бром относится к числу галогенов, составляющих 7 А подгруппу р-элементов периодической системы. Атом брома имеет во внешнем слое семь электронов. Следовательно, до устойчивой 8-электронной оболочки инертного газа ему недостает одного электрона. Вследствие этого он обладает типично выраженными неметаллическими свойствами. По своей реакционной способности бром занимает про . жуточвое ноложение между хлором и йодом, В основных соединениях гн оявля-вт валентность, равную — I, Кроме того, для него характерна также [c.5]
жуточвое ноложение между хлором и йодом, В основных соединениях гн оявля-вт валентность, равную — I, Кроме того, для него характерна также [c.5]
Алюминий отличается сравнительно низкими первым и вторым ионизационными потенциалами (5, 96 и 18, 74 эв) и очень высоким третьим (28, 31 эв) ионизационным потенциалом. В результате отделения двух внешних р,s-электронов и сохранения одного 3 -электрона ион алюминия приобретает внешнюю электронную оболочку, имеющую сферическую симметрию. Электронный газ с концентрацией два электрона на атом способствует упаковке сферических ионов алюминия в плотную гранецентрированную кубическую структуру. У галлия образуется ромбическая решетка, сходная с ковалентной решеткой Р-графита атомы галлия образуют деформированные гексагональные сетки, в которых каждый атом имеет трех ближайших соседей (одного на расстоянии 2,44 А, двух на расстоянии 2,71 А) и, кроме того, двух соседей в смежных слоях на расстоянии 2,74 А. Таким образом, структура носит ковалентный характер с числом связей, приближенно равным пяти. Индий имеет наипизший в группе Ша первый ионизационный потенциал (5, 76 ав). Атомы его, по-видимому, двукратно ионизированы и, обладая одним внешним электроном на 4 -уровне, соответствующим сферической симметрии иона упаковываются в плотную ГЦ тетрагональную решетку с отношением с/а=1,075. При повышении давления до Юкбар тетрагональность повышается до 1,088, а затем при увеличении давления до 100—110 кбар вновь понижается, так что можно ожидать появления ГЦК модификации. Наиболее электроположительный элемент П1а группы — таллий, подобно кальцию и стронцию, при низких температурах имеет плотную гексагональную решетку. В интервале 262— 302,5° таллий в результате коллективизации трех внешних электронов и обменного взаимодействия ионов с шестью d-орбиталями образует ОЦК решетку. [c.219]
Число электронных слоев в атоме
Главные подсказки:число электронных слоев в атоме определяется
номером периода.

число электронов на внешнем уровне для
элементов главных подгрупп определяет номер
группы.
у атомов элементов побочных подгрупп строится
не внешний уровень, а предвнешний с 8 эл до 18, а
затем снова внешний с 2 до 8 эл.
у d элементов- строится предвнешний d подуровень
у атомов элементов сверхбольших периодов
вначале ,как и у больших, но есть лантаноиды и
актиноиды .
:
План рассмотрения строение электронных
оболочек атомов I—III периодов
1. определяем общее число электронов в атоме,
которое равно № (порядковому номеру элемента в
периодической системе)
2. определяем число энергетических уровней в
электронной оболочке (равно номеру периода, в
котором находится элемент)
3. определяем число электронов на каждом уровне.
На 1-м не больше двух, на 2-м не больше 8
электронов, на 3-м не больше 8. Хотя максимальное
число электронов на 3-м уровне равно 18, атомы
элементов 3 периода могут разместить на нем только
8 электронов.
На последнем внешнем уровне число электронов равно
номеру группы, в которой расположен данный
элемент.
3. 1 период
Н+1n=1
+
1 S1
S
Одиночный электрон на незавершенной оболочке
1
Нe + 2
n=1
2
1 S2
S — элементы
S
2 спаренных электрона на завершенной оболочке
+
4. 2 период
Li + 3+
p
n=2
2 1
S
n=1
S
1 S2 2 S1
S — элементы
p
Be + 4
n=2
n=1
2 2
S
S
p
n=2
B+5
n=1
2 3
S
S
+
1 S2 2 S 2
р — элемент
1 S2 2 S2 2p1
++
5. 2 период
С+6p
n=2
2 4
р — элементы
S
2 2 S2 2p2
1
S
S
n=1
p
N+7
n=2
n=1
2 5
S
1 S2 2 S2 2p3
S
p
n=2
O+8
n=1
2 6
S
S
1 S2 2 S2 2p4
6. 2 период
F+92 7
р — элементы
p
n=2
S
n=1
2 2 S2 2p5
1
S
S
Ne + 10
n=2
n=1
2 8
p
S
2 2 S2 2p6
1
S
S
3 период
d
Na + 11
n=3
n=2
2 8 1
n=1
p
S
S
S
1
p
S2 2
S — элемент
S2 2p6 3 S1
1. Одинаковое число электронных слоев, содержащих электроны, имеют атомы элементов. 2. Пять электронов находятся во внешнем электронном слое атома
Задания ФИПИ 1 и 2 (страницы базы 1-20)
Page 1 of 17 Задание 184C9A Задания ФИПИ 1 и 2 (страницы базы 1-20) Вещества, формулы которых CO и Zn(OH), соответственно являются 1) кислотным оксидом и основанием 2) несолеобразующим оксидом и амфотерным
ПодробнееАТОМ. ХИМИЧЕСКИЙ ЭЛЕМЕНТ
ПРЕДИСЛОВИЕ В этом сборнике предложены задания контрольных и проверочных работ по химии для 8 9 классов. Каждая работа по теме содержит 25 вариантов (приблизительно на один класс) однотипных заданий одинаковой
ПодробнееЗадания А2 по химии 1. В ряду элементов
Задания А2 по химии 1. В ряду элементов уменьшаются радиусы атомов уменьшается число протонов в ядрах атомов увеличивается число электронных слоёв в атомах уменьшается высшая степень окисления атомов У
ПодробнееУДК :54 ББК 24.1я72 Г12
УДК 373.167.1:54 ББК 24.1я72 Г12 Г12 Габриелян, О. С. Химия. 8 кл. Контрольные работы к учебнику О. С. Габриеляна «Химия. 8 класс» : учебное пособие / О. С. Габриелян, В. Г. Краснова. 2-е изд., стереотип.
ПодробнееЗадания А3 по химии
Задания А3 по химии 1. Верны ли следующие суждения о соединениях металлов? А. Степень окисления алюминия в высшем оксиде равна +3. Б. Оснóвные свойства оксида натрия выражены сильнее, чем у оксида алюминия
ПодробнееТ-4 вариант 2. Т-4 вариант 1
Т-4 вариант 1 1. Какие частицы входят в состав ядра атома? 1) электроны 3) ионы 2) протоны 4) нейтроны А) Al Б) Br В) Fe Г) Se 1) 34 4) 56 2) 13 5) 35 3) 80 6) 26 А) магний В) водород Б) сера Г) натрий
ПодробнееФОНД ОЦЕНОЧНЫХ СРЕДСТВ
Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа 1» Приложение 2 к ООП ООО ФОНД ОЦЕНОЧНЫХ СРЕДСТВ по текущей аттестации предмет: Химия. 8 класс Составители: Домнарева
ПодробнееБанк заданий химия 9 класс
Банк заданий химия 9 класс 1. Элемент имеет три электрона на 2-м энергетическом уровне. Порядковый номер элемента 3 5 7 13 2. Сколько электронов находится на внешнем уровне элемента с порядковым номером
Подробнее1) IV 2) V 3) VI 4) VII
2 1. В ряду: Na Mg Al Si 1) увеличивается число энергетических уровней в атомах 2) усиливаются металлические свойства элементов 3) уменьшается высшая степень окисления элементов 4) ослабевают металлические
ПодробнееАвторы: О. С. Габриелян, П. Н. Березкин, А. А. Ушакова, Г. В. Майорова, Н. В. Кузьмина, А. Е. Кириллова
УДК 373.167.1:54 ББК 24.1я72 Г12 Авторы: О. С. Габриелян, П. Н. Березкин, А. А. Ушакова, Г. В. Майорова, Н. В. Кузьмина, А. Е. Кириллова Г12 Габриелян, О. С. Химия. 9 кл. Контрольные и проверочные работы
ПодробнееСтроение электронных оболочек
Строение электронных оболочек Улучшить знания уровень, 9 класс Химия. Строение атома: Строение электронных оболочек. Це Атомная орбиталь Все химические свойства веществ, то есть способность вступать в
ПодробнееАТОМНЫЕ СИСТЕМЫ СО МНОГИМИ ЭЛЕКТРОНАМИ
АТОМНЫЕ СИСТЕМЫ СО МНОГИМИ ЭЛЕКТРОНАМИ Принцип неразличимости тождественных частиц. Классическая механика оперирует индивидуализированными объектами (частицами). Даже если свойства двух частиц полностью
ПодробнееÍÅÎÐÃÀÍÈ ÅÑÊÀß ÕÈÌÈß
НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ УНИВЕРСИТЕТ Ò. È. Õàõàíèíà, Í. Ã. Íèêèòèíà, Â. È. Ãðåáåíüêîâà ÍÅÎÐÃÀÍÈ ÅÑÊÀß ÕÈÌÈß УЧЕБНОЕ ПОСОБИЕ ДЛЯ СПО И ПРИКЛАДНОГО БАКАЛАВРИАТА Ðåêîìåíäîâàíî Ó åáíî-ìåòîäè åñêèì îòäåëîì
ПодробнееАТОМНЫЕ СИСТЕМЫ СО МНОГИМИ ЭЛЕКТРОНАМИ
АТОМНЫЕ СИСТЕМЫ СО МНОГИМИ ЭЛЕКТРОНАМИ Принцип неразличимости тождественных частиц. Классическая механика оперирует индивидуализированными объектами (частицами). Даже если свойства двух частиц полностью
ПодробнееРасписание и структура занятий
Расписание и структура занятий Программа курса рассчитана на 4 недели (май). Занятия проводятся два раза в неделю, вторник и четверг в 18.00(мск). Всего 8 занятий. Этот курс охватывает повторение всех
ПодробнееÍÅÎÐÃÀÍÈ ÅÑÊÀß ÕÈÌÈß
Ò. È. Õàõàíèíà, Í. Ã. Íèêèòèíà, Â. È. Ãðåáåíüêîâà ÍÅÎÐÃÀÍÈ ÅÑÊÀß ÕÈÌÈß УЧЕБНОЕ ПОСОБИЕ ДЛЯ ПРИКЛАДНОГО БАКАЛАВРИАТА Ðåêîìåíäîâàíî Ó åáíî-ìåòîäè åñêèì îòäåëîì âûñøåãî îáðàçîâàíèÿ â êà åñòâå ó åáíîãî ïîñîáèÿ
ПодробнееУДК :54 ББК 24.1я72 Г12
УДК 373.167.1:54 ББК 24.1я72 Г12 Г12 Габриелян, О. С. Химия. 9 класс : учебник / О. С. Габриелян. 6-е изд., стереотип. М. : Дрофа, 2018. 319, [1] с. : ил. IBN 978-5-358-19690-2 Учебник О. С. Габри еляна
ПодробнееСтроение атома 1. Атомное ядро.
Строение атома 1. Атомное ядро. Атом мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Электронная
ПодробнееТЕМА 1. Щелочные металлы и их соединения
ТЕМА 1. Щелочные металлы Тренировочные задания 1. Верны ли следующие суждения? А. Семейство щелочных металлов расположено в IА группе Периодической системы химических элементов Д.И. Менделеева. Б. Максимальная
ПодробнееАвторы: А. А. Каверина, Ю. Н. Медведев, Г. Н. Молчанова, Н. В. Свириденкова, М. Г. Снастина, С. В. Стаханова
УДК 373.167.1:54 12+ ББК 24я72 Я11 Авторы: А. А. Каверина, Ю. Н. Медведев, Г. Н. Молчанова, Н. В. Свириденкова, М. Г. Снастина, С. В. Стаханова Модульный курс «Я сдам ЕГЭ!» создан авторским коллективом
ПодробнееФОНД ОЦЕНОЧНЫХ СРЕДСТВ
Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа 1» Приложение 2 к ООП ООО ФОНД ОЦЕНОЧНЫХ СРЕДСТВ по текущей аттестации предмет: Химия. 9 класс Составители: Домнарева
ПодробнееПоложение таблицы Менделеева и электронная конфигурация
Цель обучения
- Используйте периодическую таблицу для определения свойств атомов, таких как группы и электронные конфигурации.
Ключевые моменты
- Элементы организованы по периоду и группе, причем период соответствует основному уровню энергии, а группа — степени заполнения подоболочек.
- Свойства атома напрямую связаны с количеством электронов на различных орбиталях, и периодическая таблица очень похожа на дорожную карту для этих орбиталей, так что химические свойства могут быть выведены по положению элемента на таблице.
- Электроны во внешней или валентной оболочке особенно важны, потому что они могут участвовать в совместном использовании и обмене, который отвечает за химические реакции.
Условия
- квантовое число Одно из определенных целых или полуцелых чисел, которые определяют состояние квантово-механической системы (например, электрона в атоме).
- электронная оболочка: Коллективные состояния всех электронов в атоме, имеющие одинаковое главное квантовое число (визуализируются как орбита, по которой движутся электроны).
- орбитальная — спецификация энергии и плотности вероятности электрона в любой точке атома или молекулы.
Основные разделы периодической таблицы
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Элементы представлены в возрастающем атомном номере. Основная часть таблицы представляет собой сетку 18 × 7. Элементы с одинаковым числом валентных электронов хранятся вместе в группах, таких как галогены и благородные газы.Есть четыре различных прямоугольных области или блока. F-блок обычно не включается в основную таблицу, а размещается ниже, поскольку встроенный f-блок часто делает таблицу непрактично широкой. Используя периодические тенденции, таблица Менделеева может помочь предсказать свойства различных элементов и отношения между свойствами. Таким образом, он обеспечивает полезную основу для анализа химического поведения и широко используется в химии и других науках.
Атомные орбитали
Электроны в частично заполненной самой внешней оболочке (или оболочках) определяют химические свойства атома; ее называют валентной оболочкой.Каждая оболочка состоит из одной или нескольких подоболочек, а каждая подоболочка состоит из одной или нескольких атомных орбиталей.
Свойства атома зависят в конечном итоге от числа электронов на различных орбиталях и от заряда ядра, который определяет компактность орбиталей. Чтобы связать свойства элементов с их расположением в периодической таблице, часто удобно использовать упрощенный вид атома, в котором ядро окружено одной или несколькими концентрическими сферическими «оболочками», каждая из которых состоит из орбиталей с наивысшим главным квантовым числом, содержащих по крайней мере один электрон; это s- и p-орбитали и могут включать d- или f-орбитали, которые зависят от атома.Модель оболочки, как и любая научная модель, — это не столько описание мира, сколько упрощенный взгляд на него, который помогает нам понимать и соотносить различные явления.
Мы рассмотрим несколько визуализаций таблицы Менделеева. Однако сначала было бы поучительно посмотреть, как это устроено с логической точки зрения. Таблица сегодня является результатом непрерывных усилий более чем 100 лет наблюдений, измерений, предсказаний и доказательств взаимосвязи химических и физических явлений с электронными конфигурациями и зарядами.
Периоды 1, 2 и 3
Начиная с простых элементов, первые три строки периодической таблицы, называемые периодами 1, 2 и 3, соответствуют уровням n = 1, n = 2 и n = 3.
Конфигурации электронных оболочек первых 18 элементов. Конфигурации электронных оболочек первых 18 элементов периодической таблицы. Соответствующие уровни энергии (n) указаны зелеными цифрами слева. Число электронов внешней оболочки представлено крайней правой цифрой в номерах групп.Водород имеет 1 электрон на уровне 1s, а справа, гелий в Группе 18, имеет 2 электрона на уровне 1s, полностью заполненная оболочка, правило дуэта. Гелий — первый из благородных газов. Переходя к периоду 2, литий является первым элементом в строке с заполненной конфигурацией единиц. В течение периода сначала заполняются 2s, а затем 2p орбитали, достигая конфигурации для неона, следуя правилу октетов. Период 3 следует аналогичной схеме. Обратите внимание, что количество электронов внешней оболочки является основным фактором, определяющим валентность элемента.
Конфигурации электронных оболочек элементов Положение в периодической таблице на основе конфигурации электронных оболочек. На этом изображении показана вся таблица Менделеева с диаграммами атомов и электронных оболочек, заполняемых движением по таблице. На этом изображении численно показана электронная конфигурация, показывающая населенность электронов в каждой подоболочке, начиная каждый период с полностью заполненного благородного газа. Периодическая таблица с отображением электронных оболочек. Элементы в этой таблице расположены в стандартной конфигурации периодов и групп.Каждый блок включает представление структуры электронной оболочки элемента. Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Периодическая таблица и модели уровней энергии | Глава 4: Периодическая таблица и связь
Познакомьте студентов с идеей о том, что электроны окружают ядро атома в областях, называемых энергетическими уровнями.
Повторите со студентами, что на втором уроке они сосредоточились на количестве протонов, нейтронов и электронов в атомах каждого элемента. В этом уроке они сосредоточатся на расположении электронов в каждом элементе.
Спроецировать изображение Поперечное сечение уровня энергии.
Объясните студентам, что электроны окружают ядро атома в трех измерениях, делая атомы сферическими. Они могут думать об электронах как о находящихся на разных энергетических уровнях, подобных концентрическим сферам вокруг ядра.Поскольку эти сферы очень сложно показать, уровни энергии обычно показаны в двух измерениях.
Подробнее о моделях уровня энергии читайте в разделе «Информация о учителе».
Спроецировать изображение Атом кислорода.
Скажите студентам, что эта модель энергетического уровня представляет атом. Ядро представлено точкой в центре, которая содержит как протоны, так и нейтроны. Меньшие точки, окружающие ядро, представляют электроны на энергетических уровнях.Сообщите учащимся, что они узнают больше об электронах и уровнях энергии позже на этом уроке.
Попросите учащихся взглянуть на Периодическую таблицу элементов 1–20, которые они использовали в уроке 2, чтобы ответить на следующий вопрос:
- Можете ли вы определить, какой атом представляет эта модель?
- Если учащиеся не могут ответить на этот вопрос, укажите, что здесь 8 электронов. Поскольку нейтральные атомы в периодической таблице имеют такое же количество электронов, что и протоны, у атома должно быть 8 протонов.Число протонов такое же, как и атомный номер, поэтому атом — это кислород.
Попросите группы работать вместе, чтобы разместить каждую карту с ее правильным атомом.
Покажите учащимся, что у вас есть 80 карточек (по 4 на каждый из первых 20 элементов). Прежде чем раздавать карточки, объясните, что каждая карточка содержит информацию об электронах и уровнях энергии первых 20 элементов таблицы Менделеева. Задача учеников — внимательно прочитать карточку, выяснить, какой элемент она описывает, и положить карточку в то место в комнате, где находится этот элемент.Напомните учащимся, что им нужно будет подсчитать электроны, чтобы идентифицировать каждый атом. Как только учащиеся поймут свое задание, раздайте карточки группам.
Обсудите размещение карт для двух или трех атомов.
После того, как все карты были размещены на 20 различных атомах, выберите два или три атома и проверьте, правильно ли были размещены карты. Этот обзор поможет укрепить представления о структуре атомов и поможет студентам определить количество протонов и электронов в каждом атоме.
Раздайте каждому ученику лист с заданием «Периодическая таблица уровней энергии». Эта таблица содержит модели уровней энергии для первых 20 элементов. Электроны включены только для атомов в начале и в конце каждого периода.
Спроецируйте Периодическую таблицу уровней энергии и обсудите расположение электронов по мере того, как учащиеся заполняют свой рабочий лист.
Спроецировать изображение Периодическая таблица уровней энергии.
Изображение, которое вы проецируете, содержит все электроны для элементов 1–20. Однако периодическая таблица в таблице активности содержит электроны только для элементов в начале и в конце каждого периода. Обсудите расположение электронов на энергетических уровнях этих атомов и попросите студентов заполнить электроны для других атомов.
Примечание. На диаграммах уровней энергии электроны равномерно распределены по уровням. В некоторых книгах они показаны таким образом, а в других — парами.Спаривание электронов означает, что электроны находятся на отдельных орбиталях в пределах каждого энергетического уровня. На уровне средней школы учащимся не обязательно изучать электронные орбитали. Эта информация предлагается для того, чтобы вам было понятнее, почему электроны часто показаны парами на диаграммах уровней энергии и на точечных диаграммах, используемых в качестве дополнения в конце этой главы. Орбиталь определяет область на уровне энергии, где высока вероятность обнаружения пары электронов.На каждой орбитали может быть максимум два электрона. Вот почему электроны часто изображаются парами на уровне энергии.
Скажите студентам, что строки в периодической таблице называются периодами.
Период 1
- Водород
- Объясните, что водород имеет 1 протон и 1 электрон. 1 электрон находится на первом энергетическом уровне.
- Гелий
- Объясните, что гелий имеет 2 протона и 2 электрона.2 электрона находятся на первом энергетическом уровне.
Период 2
- Литий
- Объясните, что у лития 3 протона и 3 электрона. На первом энергетическом уровне 2 электрона, а на втором — 1 электрон. Объясните, что первый энергетический уровень может иметь только 2 электрона, поэтому следующий электрон в литии находится на следующем (втором) уровне.
- Неон
- Объясните, что у неона 10 протонов и 10 электронов.На первом уровне энергии 2 электрона, а на втором — 8 электронов.
- Бериллий-фтор
- Помогите студентам указать правильное количество электронов на энергетических уровнях для остальных атомов в периоде 2.
Период 3
- Натрий
- Объясните, что у натрия 11 протонов и 11 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне и 1 электрон на третьем уровне энергии.Объясните, что второй энергетический уровень может иметь только 8 электронов, поэтому следующий электрон в натрия должен находиться на следующем (третьем) уровне.
- Аргон
- Объясните, что аргон имеет 18 протонов и 18 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне и 8 электронов на третьем уровне энергии. Попросите учащихся заполнить модель энергетического уровня аргона в своей периодической таблице.
- Магний-хлор
- Помогите студентам указать правильное количество электронов на энергетических уровнях для остальных атомов в периоде 3.
Период 4
- Калий
- Объясните, что у калия 19 протонов и 19 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне, 8 электронов на третьем уровне энергии и 1 на четвертом уровне энергии. Объясните: после того, как на третьем энергетическом уровне будет 8 электронов, следующий электрон перейдет на четвертый уровень.
- Кальций
- Помогите студентам указать правильное количество электронов на энергетических уровнях кальция.
Примечание: учащиеся могут задаться вопросом, почему энергетический уровень может удерживать только определенное количество электронов. Ответ на этот вопрос выходит далеко за рамки химического подразделения средней школы. Он включает в себя представление об электронах как о трехмерных волнах и о том, как они будут взаимодействовать друг с другом и с ядром.
Попросите учащихся найти закономерности в строках и столбцах первых 20 элементов периодической таблицы.
Продолжайте проецировать изображение Периодическая таблица уровней энергии для элементов 1–20 и попросите учащихся просмотреть свои листы действий, чтобы найти закономерности в количестве электронов на каждом уровне энергии.
Попросите учащихся взглянуть на точки (пересекающиеся строки).
Количество уровней энергии за каждый период
- Атомы в первом периоде имеют электроны на одном энергетическом уровне.
- Атомы во втором периоде имеют электроны на двух уровнях энергии.
- Атомы в третьем периоде имеют электроны на трех уровнях энергии.
- Атомы в четвертом периоде имеют электроны на 4 уровнях энергии.
Как электроны заполняют энергетические уровни
- Первый уровень энергии = 1, 2
- Второй энергетический уровень = 1, 2, 3,… 8
- Третий энергетический уровень = 1, 2, 3,… 8
- Четвертый энергетический уровень = 1, 2
Узнайте больше о таблице Менделеева в разделе «История учителя».
Определенное количество электронов переходит на уровень до того, как на следующем уровне могут быть электроны.После того, как первый энергетический уровень содержит 2 электрона (гелий), следующие электроны переходят на второй энергетический уровень. После того, как второй энергетический уровень имеет 8 электронов (неон), следующие электроны переходят на третий энергетический уровень. После того, как на третьем энергетическом уровне будет 8 электронов (аргон), следующие 2 электрона переходят на четвертый энергетический уровень.
Примечание. Третий энергетический уровень может фактически содержать до 18 электронов, поэтому он не заполняется, когда на нем 8 электронов. Но когда третий уровень содержит 8 электронов, следующие 2 электрона переходят на четвертый уровень.Затем, хотите верьте, хотите нет, еще 10 электронов продолжают заполнять остаток третьего уровня. Студентам не обязательно это знать.
Попросите учащихся взглянуть на группы (столбцы вниз).
Скажите студентам, что вертикальные столбцы в периодической таблице называются группами или семьями.
Попросите учащихся сравнить количество электронов на внешнем энергетическом уровне атомов в группе. Студенты должны понимать, что каждый атом в группе имеет одинаковое количество электронов на внешнем энергетическом уровне.Например, водород, литий, натрий и калий имеют 1 электрон на внешнем энергетическом уровне. Сообщите учащимся, что эти электроны на внешнем энергетическом уровне называются валентными электронами. Это электроны, отвечающие за связывание, которые студенты изучат на следующем уроке.
Сравните химическую реакцию различных элементов и соотнесите это с их расположением в таблице Менделеева.
Скажите студентам, что атомы в периодической таблице в одном столбце, называемом группой, обладают определенными характеристиками и могут реагировать аналогичным образом.
Проецировать видео «Натрий в воде и калий в воде».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#sodium_in_water
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#potasium_in_water
Студенты увидят, что, хотя калий реагирует более энергично, чем натрий, реакции аналогичны. Попросите учащихся взглянуть на периодическую таблицу, чтобы увидеть, где находятся натрий и калий по отношению друг к другу.
Спроецировать видео «Кальций в воде».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#calcium_in_water
Студенты увидят, что эта реакция отличается от реакции натрия и калия. Попросите их найти кальций в периодической таблице и указать, что он находится в другой группе, чем натрий и калий.
Проецировать видео «Натрий в кислоте и калий в кислоте».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#sodium_in_acid
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#potassium_in_acid
Покажите, что натрий реагирует с кислотой, а затем калий реагирует с кислотой. HCl — это соляная кислота. HNO3 — это азотная кислота. Каждая кислота используется в двух разных концентрациях. Убедитесь, что учащиеся понимают, что натрий и калий реагируют аналогичным образом, хотя калий реагирует более энергично.
Спроецировать видео «Кальций в кислоте».
www.middleschoolchemistry.com//multimedia/chapter4/lesson3#calcium_in_acid
Укажите, что кальций реагирует иначе, чем натрий и калий.
Спросите студентов:
- Обладают ли элементы в одной группе схожими свойствами и одинаково ли реагируют?
- Студенты должны понимать, что натрий и калий находятся в одной группе и реагируют одинаково. Кальций находится рядом с ними в периодической таблице, но находится в другой группе, поэтому он реагирует по-разному.
атом | Определение, структура, история, примеры, диаграммы и факты
Атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также мельчайшая единица вещества, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Оболочечная модель атомаВ оболочечной модели атома электроны занимают разные энергетические уровни или оболочки.Оболочки K, и L показаны для атома неона.
Британская энциклопедия, Inc.Большая часть атома представляет собой пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что, таким образом, вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств. В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других случаях электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов.Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья открывается широким обзором фундаментальных свойств атома и составляющих его частиц и сил. После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, сформулированных на протяжении веков. Для получения дополнительной информации, относящейся к структуре ядра и элементарным частицам, см. субатомных частиц.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчасБольшая часть вещества состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать. Каждый отдельный атом состоит из более мелких частиц, а именно электронов и ядер. Эти частицы электрически заряжены, и электрические силы, действующие на заряд, несут ответственность за удержание атома вместе.Попытки разделить эти более мелкие составляющие частицы требуют постоянно увеличивающегося количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом в основном состоит из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, которые имеют положительный заряд, и нейтронов, которые не имеют заряда. Протоны, нейтроны и окружающие их электроны — это долгоживущие частицы, присутствующие во всех обычных, встречающихся в природе атомах.Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Примерно 50 миллионов атомов твердого вещества, выстроенных в ряд, имеют размер 1 см (0,4 дюйма). Удобной единицей длины для измерения размеров атомов является ангстрем (Å), который определяется как 10 −10 метров. Радиус атома составляет 1-2 Å.По сравнению с общим размером атома, ядро еще более миниатюрное. Он находится в той же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метров пространства в атоме, то есть 1 часть на 100 000. Удобной единицей длины для измерения размеров ядер является фемтометр (фм), который равен 10 −15 метрам. Диаметр ядра зависит от количества содержащихся в нем частиц и колеблется от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец.Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их широкую вариацию массы. Самое легкое ядро, ядро водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Основные свойства
Самой важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если у атома Z из 6, это углерод, а Z из 92 соответствует урану. Нейтральный атом имеет равное количество протонов и электронов, так что положительный и отрицательный заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
Зависящие от толщины электронные свойства дихалькогенидов Pt
Golden, J. et al. Вариации рения в молибдените (MoS 2 ): свидетельство прогрессирующего подповерхностного окисления. Планета Земля. Sci. Lett. 366 , 1–5 (2013).
CAS Статья Google Scholar
Колобов А.В., Томинага Дж. Двумерные дихалькогениды переходных металлов , Vol.239 (Springer International Publishing AG, Швейцария, 2016).
Дикинсон Р. Г. и Полинг Л. Кристаллическая структура молибденита. J. Am. Chem. Soc. 45 , 1466–1471 (1923).
CAS Статья Google Scholar
Фриндт Р.Ф. Монокристаллы MoS 2 толщиной в несколько молекулярных слоев. J. Appl. Phys. 37 , 1928–1929 (1966).
CAS Статья Google Scholar
Joensen, P., Frindt, R.F. и Morrison, S.R. Однослойный MoS 2 . Mater. Res. Бык. 21 , 457–461 (1986).
CAS Статья Google Scholar
Уилсон, Дж. А. и Йоффе, А. Д. Обсуждение дихалькогенидов переходных металлов и интерпретация наблюдаемых оптических, электрических и структурных свойств. Adv. Phys. 18 , 193–335 (1969).
CAS Статья Google Scholar
Новоселов К.С. и др. Эффект электрического поля в атомарно тонких углеродных пленках. Наука. 306 , 666–669 (2004).
CAS Статья Google Scholar
Рамакришна Матте, Х.С.С. и др. MoS2 и WS2 аналоги графена. Энгью. Chem. Int. 49 , 4059–4062 (2010).
Roldán, R. et al. Электронные свойства однослойных и многослойных дихалькогенидов переходных металлов MX 2 (M = Mo, W и X = S, Se). Ann. Phys. 526 , 347–357 (2014).
Артикул Google Scholar
Эллис, Дж. К., Лусеро, М. Дж. И Скусерия, Дж. Э. Непрямая запрещенная зона в многослойном MoS 2 , предсказанная экранированной гибридной теорией функционала плотности. Заявл. Phys. Lett. 99 , 261908 (2011).
Артикул Google Scholar
Conley, H.J. et al. Зонная инженерия напряженного монослоя и бислоя MoS 2 . Nano Lett. 13 , 3626–3630 (2013).
CAS Статья Google Scholar
He, X. et al. Инженерия деформаций в монослое WS 2 , MoS 2 и гетероструктуры WS 2 / MoS 2 . Заявл. Phys. Lett. 109 , 173105 (2016).
Артикул Google Scholar
Шен Т., Пенумача А. В. и Аппенцеллер Дж. Деформационная инженерия для полевых транзисторов на основе дихалькогенидов переходных металлов. ACS Nano 10 , 4712–4718 (2016).
CAS Статья Google Scholar
Гуо, С. и Ван, Ю. Небольшой переход полупроводник — металл, вызванный деформацией сжатия, и термоэлектрические свойства, повышенные деформацией растяжения в монослое PtTe 2 . Полуконд.Sci. Technol. 32 , 7 (2017). стр.
Google Scholar
Zhang, Y. et al. Прямое наблюдение перехода от непрямой запрещенной зоны к прямой в атомарно тонком эпитаксиальном MoSe 2 . Нат. Nanotechnol. 9 , 111–115 (2014).
CAS Статья Google Scholar
Jin, W. et al. Прямое измерение зависящей от толщины электронной зонной структуры MoS 2 с помощью фотоэмиссионной спектроскопии с угловым разрешением. Phys. Rev. Lett. 111 , 106801 (2013).
Артикул Google Scholar
Zeng, H. et al. Оптическая сигнатура вариаций симметрии и спин-долинного взаимодействия в атомарно тонких дихалькогенидах вольфрама. Sci. Отчет 3 , 2–6 (2013).
Google Scholar
Куц А., Зибуш Н. и Хайне Т. Как квантовое ограничение влияет на электронную структуру сульфидов переходных металлов TmS 2 . Phys. Ред. B 83 , 1–4 (2011).
Артикул Google Scholar
Wang, Y. et al. Монослой PtSe 2 , новый полупроводниковый дихалькогенид переходного металла, эпитаксиально выращенный путем прямой селенизации Pt. Nano Lett. 15 , 4013–4018 (2015).
CAS Статья Google Scholar
О’Брайен, М.и другие. Рамановская характеристика тонких пленок диселенида платины. 2D Mater. 3 , 021004 (2016).
Артикул Google Scholar
Чиаррокки А., Авсар А., Овчинников Д. и Кис А. Преобразование металл-полупроводник с модуляцией толщины в дихалькогениде переходного металла. Нат. Commun. 9 , 1–6 (2018).
CAS Статья Google Scholar
Yu, X. et al. Атомно тонкий дихалькогенид благородного металла: широкополосный полупроводник среднего инфракрасного диапазона. Нат. Commun. 9 , 1–9 (2018).
Артикул Google Scholar
Zhao, Y. et al. Высокая подвижность электронов и воздухоустойчивый 2D слоистый PtSe 2 полевых транзисторов. Adv. Матер. 29 , 1–10 (2016).
CAS Google Scholar
Chia, X. et al. Электрокатализ слоистых дихалькогенидов платины (PtS 2 , PtSe 2 , PtTe 2 ): монотонная зависимость от размера халькогена. Adv. Функц. Матер. 26 , 4306–4318 (2016).
CAS Статья Google Scholar
Furuseth, S. et al. Переопределенные кристаллические структуры NiTe 2 , PdTe 2 , PtS 2 , PtSe 2 и PtTe 2 . Acta Chem. Сканд. 19 , 257–258 (1965).
CAS Статья Google Scholar
Zhao, Y. et al. Чрезвычайно сильное межслоевое взаимодействие в двумерном слоистом PtS 2 . Adv. Матер. 28 , 2399–2407 (2016).
CAS Статья Google Scholar
Su, T. Y. et al. Фазово-инженерные пленки PtSe 2 -слоев с помощью процесса плазменной селенизации по отношению ко всем полевым транзисторам на основе PtSe 2 в высокочувствительные, гибкие фотодетекторы с широким спектром фотоотклика. Малый 14 , 1–10 (2018).
Google Scholar
Саджад М., Сингх Н. и Швингеншлёгл У. Сильно связанные экситоны в монослое PtS 2 и PtSe 2 . Заявл. Phys. Lett. 112 , 043101 (2018).
Артикул Google Scholar
Kandemir, A. et al. Структурные, электронные и фононные свойства PtSe2: от монослоя к объему. Полуконд. Sci. Technol. 33 , 085002 (2018).
Артикул Google Scholar
Guo, G. Y. & Liang, W. Y. Электронные структуры дихалькогенидов платины: PtS 2 , PtSe 2 и PtTe 2 . J. Phys. C. Физика твердого тела. 19 , 995–1008 (1986).
CAS Статья Google Scholar
Dai, D. et al. Тенденции в структуре и связях в слоистом диоксиде платины и дихалькогенидах PtQ 2 (Q = O, S, Se, Te). J. Solid State Chem. 173 , 114–121 (2003).
CAS Статья Google Scholar
Миро П., Горбани-Асл М. и Хейне Т. Двумерные материалы помимо MoS2: дихалькогениды благородных переходных металлов. Энгью. Chem. Int. 5 3, 3015–3018 (2014).
Лю, Г., Ган, Й., Кухе, Р. и Лу, П. Зависимые от деформации электронные и оптические свойства монослоя PtS 2 . Chem. Phys. Lett. 709 , 65–70 (2018).
Артикул Google Scholar
Ли, П., Ли, Л. и Цзэн, X. C. Настройка электронных свойств монослоя и бислоя PtS и 2: Разработка деформаций с помощью микропроцессора. J. Mater. Chem. С. 4 , 3106–3112 (2016).
CAS Статья Google Scholar
Zhang, W., Qin, J., Huang, Z. & Zhang, W. Механизм изменения количества слоев и ширины запрещенной зоны 2D кристалла PtSe 2 , зависящей от деформации. J. Appl. Phys. 122 , 205701 (2017).
Артикул Google Scholar
Ван Хов, Л. Корреляции в пространстве и времени и рожденное приближение рассеяния в системах взаимодействующих частиц. Phys. Rev. 95 , 249–262 (1954).
Артикул Google Scholar
Кон, В. и Латтинджер, Дж. М. Новый механизм сверхпроводимости. Phys. Rev. Lett. 15 , 524–526 (1965).
Артикул Google Scholar
Хирш, Дж. Э. и Скалапино, Д. Дж. Повышенная сверхпроводимость в квазидвумерных системах. Phys. Rev. Lett. 56 , 2732–2735 (1986).
CAS Статья Google Scholar
Хонеркамп, К. и Зальмхофер, М. Магнитная и сверхпроводящая нестабильности модели Хаббарда при заполнении ванхова. Phys. Rev. Lett . 8 7, 187004 (2001).
Флек М., Олес А. М. и Хедин Л. Магнитные фазы вблизи сингулярности Ван Хова в s- и d-полосной модели Хаббарда. Phys. Ред. B 56 , 8 (1999).
Google Scholar
Хлубина Р., Сорелла С. и Гвинея Ф. Ферромагнетизм в двумерной t − t ‘модели Хаббарда при плотности Ван Хова. Phys. Rev. Lett. 78 , 1343–1346 (1997).
CAS Статья Google Scholar
Лин, Х. К. и Хирш, Дж. Э. Двумерная модель Хаббарда с перескоками между ближайшими и следующими ближайшими соседями. Phys. Ред. B 35 , 3359–3368 (1987).
CAS Статья Google Scholar
Дас Р., Пандей С. К. и Махадеван П. Изменения электронной структуры в дихалькогенидах переходных металлов — роль геометрического ограничения. arXiv: https://arxiv.org/abs/1702.04535. 1–17 (2017).
Нода К., Инаба К. и Ямашита М. Магнетизм в трехмерной слоистой решетке Либа: повышенная температура перехода через плоские зоны и сингулярности Ван Хова. Phys. Ред. A. 91 , 1–7 (2015).
Артикул Google Scholar
Зилетти, А., Хуанг, С. М., Кокер, Д. Ф. и Лин, Х. Сингулярность Ван Хова и ферромагнитная нестабильность в фосфорене. Phys. Ред. B. 92 , 1–11 (2015).
Артикул Google Scholar
Чу, З. Д., Хе, В. Й. и Хе, Л. Сосуществование сингулярностей Ван Хова и сверхрешеточных точек Дирака в слегка закрученном бислое графена. Phys. Ред. B. 87 , 2–9 (2013).
Артикул Google Scholar
Хоэнберг, П. и Кон, В. Неоднородный электронный газ. Phys. Ред. 136 , B864 – B871 (1964).
Артикул Google Scholar
Blöchl, P.E. Метод расширенных волн проектора. Phys. Ред. B 50 , 17953–17979 (1994).
Артикул Google Scholar
Кресс, Г. и Жубер, Д. От сверхмягких псевдопотенциалов к методу дополненной волны проектора. Phys. Ред. B 59 , 1758–1775 (1999).
CAS Статья Google Scholar
Дион М., Ридберг Х., Шредер Э., Лангрет Д. К. и Лундквист Б. И. Функционал плотности Ван-дер-Ваальса для общей геометрии. Phys. Rev. Lett. 92 , 22–25 (2004).
Артикул Google Scholar
Thonhauser, T. et al. Функционал плотности Ван-дер-Ваальса: самосогласованный потенциал и природа связи Ван-дер-Ваальса. Phys. Ред. B. 76 , 1–11 (2007).
Артикул Google Scholar
Климеш, Дж., Боулер, Д. Р. и Михаэлидис, А.Химическая точность функционала плотности Ван-дер-Ваальса. J. Phys. Конденс. Дело 22 , 022201 (2010).
Артикул Google Scholar
Климеш, Дж., Боулер, Д. Р. и Михаэлидес, А. Ван-дер-Ваальсовы функционалы плотности применительно к твердым телам. Phys. Ред. B. 83 , 1–13 (2011).
Артикул Google Scholar
Perdew, J. P. & Wang, Y. Точное и простое аналитическое представление энергии корреляции электронного газа. Phys. Ред. B 45 , 244–249 (1992).
Артикул Google Scholar
Perdew, J. et al. Атомы, молекулы, твердые тела и поверхности: применение приближения обобщенного градиента для обмена и корреляции. Phys. Ред. B 46 , 6671–6687 (1992).
CAS Статья Google Scholar
Perdew, J. P. et al. Ошибки: атомы, молекулы, твердые тела и поверхности: применение приближения обобщенного градиента для обмена и корреляции. Phys. Ред. B 48 , 4978–4978 (1993).
CAS Статья Google Scholar
Кресс, Г. и Хафнер, Дж. Ab initio молекулярная динамика жидких металлов. Phys. Ред. B 47 , 558–561 (1993).
CAS Статья Google Scholar
Кресс, Г. и Хафнер, Дж. Молекулярно-динамическое моделирование из первых принципов перехода жидкий металл – аморфный полупроводник в германии. Phys. Ред. B 49 , 14251–14269 (1994).
CAS Статья Google Scholar
Крессе, Г. и Фуртмюллер, Дж. Эффективные итерационные схемы для ab initio расчетов полной энергии с использованием базисного набора плоских волн. Phys. Ред. B 54 , 11169–11186 (1996).
CAS Статья Google Scholar
Крессе, Г. и Фуртмюллер, Дж. Эффективность расчетов полной энергии ab-initio для металлов и полупроводников с использованием базисного набора плоских волн. Comput. Матер. Sci. 6 , 15–50 (1996).
CAS Статья Google Scholar
Монкхорст, Х. Дж. И Пак, Дж. Д. Особые моменты для интеграции зоны Бриллюэна. Phys. Ред. B 13 , 5188–5192 (1976).
Артикул Google Scholar
Villaos, R.A. et. al. Зависящие от толщины электронные свойства дихалькогенидов Pt — PtX 2 (X = S, Se и Te). (2018). https://doi.org/10.5281/zenodo.1975488.
Ионосфера | UCAR Center for Science Education
Области ионосферы, показаны слои D, E и F.
Предоставлено: сотрудники Центра естественнонаучного образования UCAR (Рэнди Рассел)
Атмосфера Земли состоит из ряда областей, которые имеют относительно большое количество электрически заряженных атомов и молекул.Все вместе эти регионы называются ионосферой.
Рентгеновские лучи высокой энергии и ультрафиолетовый (УФ) «свет» Солнца постоянно сталкиваются с молекулами и атомами газа в верхних слоях атмосферы Земли. Некоторые из этих столкновений выбивают электроны из атомов и молекул, создавая электрически заряженные ионы (атомы или молекулы с отсутствующими электронами) и свободные электроны. Эти электрически заряженные ионы и электроны движутся и ведут себя иначе, чем нормальные, электрически нейтральные атомы и молекулы.Области с более высокими концентрациями ионов и свободных электронов находятся на нескольких разных высотах и известны как группа ионосфера.
Есть три основных области ионосферы, называемые D-слоем, E-слоем и F-слоем. Эти регионы не имеют резких границ, а высота, на которой они возникают, варьируется в течение дня и от сезона к сезону. Область D является самой низкой, начиная примерно с 60 или 70 км (37 или 43 миль) над землей и простираясь вверх примерно до 90 км (56 миль).Далее идет область E, которая начинается примерно с 90 или 100 км (56 или 62 мили) и простирается до 120 или 150 км (75 или 93 мили). Самая верхняя часть ионосферы, область F, начинается примерно на 150 км (93 мили) и простирается далеко вверх, иногда на 500 км (311 миль) над поверхностью нашей родной планеты.
Области ионосферы не считаются отдельными слоями, например более знакомые тропосфера и стратосфера. Вместо этого они представляют собой ионизированные области, встроенные в стандартные слои атмосферы.Область D обычно формируется в верхней части мезосферы, в то время как область E обычно появляется в нижней термосфере, а область F находится в верхних пределах термосферы.
Высота, доля ионизированных частиц и даже наличие различных областей ионосферы со временем меняются. Ионосфера днем и ночью сильно отличается. В течение дня рентгеновские лучи ультрафиолетового излучения Солнца непрерывно обеспечивают энергию, которая отталкивает электроны от атомов и молекул, производя непрерывный приток ионов и свободных электронов.В то же время некоторые из ионов и электронов сталкиваются и повторно объединяются, образуя нормальные, электрически нейтральные атомы и молекулы. В течение дня создается больше ионов, чем разрушается, поэтому количество ионов в трех областях увеличивается. Ночью в отсутствие солнечного света начинается процесс рекомбинации, и количество ионов падает. В течение большинства ночей область D полностью исчезает, а область E ослабевает по мере того, как количество ионов в этом слое резко падает. Каждое утро, когда возвращаются солнечные рентгеновские лучи и ультрафиолетовый свет, области D и E заново заселяются ионами.Область F с наибольшей высотой сохраняется всю ночь, но обычно разделяется на верхний слой F 2 и нижний слой F 1 в течение дня.
До того, как связь через спутники стала обычным явлением, операторы систем радиосвязи часто использовали ионосферу для расширения диапазона своих передач. Радиоволны обычно распространяются по прямым линиям, поэтому, если высокая передающая башня не может «видеть» вершину башни приемника, кривизна Земли ограничивает диапазон радиопередач до станций, которые не находятся за горизонтом.Однако некоторые частоты радиоволн отражаются от электрически заряженных частиц в определенных слоях ионосферы. Предварительная спутниковая радиосвязь часто использовала это явление, отражая радиоволны от «неба», чтобы расширить диапазон сигналов. Радистам приходилось учитывать постоянные изменения в ионосфере, особенно сдвиги или исчезновение слоев между днем и ночью, чтобы эффективно использовать преимущества этих зеркальных отражений радиоволн.
Области ионосферы могут поглощать или ослаблять радиосигналы, или они могут изгибать радиоволны, а также отражать сигналы, как описано выше. Конкретное поведение зависит как от частоты радиосигнала, так и от характеристик рассматриваемой области ионосферы. Поскольку спутники глобальной системы позиционирования (GPS) используют радиосигналы для определения местоположения, точность GPS может быть значительно снижена, когда эти сигналы искажаются при прохождении через регионы ионосферы. Точно так же некоторые радиосвязи могут быть нарушены, если используется частота, которую ионосферный слой полностью ослабляет или поглощает, что приводит к ослаблению сигнала или даже к полной потере связи.Ученые постоянно измеряют и создают компьютерные модели постоянно меняющейся ионосферы, чтобы люди, отвечающие за радиосвязь, могли предвидеть сбои.
Ученые используют радиоволны различными способами для исследования и мониторинга невидимой ионосферы. Различные радиоантенны и радиолокационные системы на земле и на спутниках используются для наблюдения за постоянно изменяющейся ионосферой. Радиоантенны «слушают» радиосигналы, генерируемые самой ионосферой, радиолокационные системы отражают сигналы разных слоев, а пары передатчиков и приемников посылают сигналы через ионосферу, чтобы определить, насколько эти сигналы ослабляются или перенаправляются.
Наряду с суточными колебаниями в ионосфере существуют также сезонные и долгосрочные вариации в этом сложном наборе регионов. На разных широтах тепло и прохладно в зависимости от времени года, поскольку интенсивность солнечного света варьируется от места к месту из-за наклона оси Земли. Точно так же ионосфера меняется в зависимости от сезона, поскольку местоположение пика интенсивности солнечного рентгеновского излучения и ультрафиолетового света, которые определяют скорость образования ионов, перемещается по земному шару. Сезонные изменения химического состава атмосферы также играют роль, влияя на скорость событий рекомбинации, которые удаляют ионы из атмосферы.В долгосрочной перспективе 11-летний цикл солнечных пятен оказывает сильное влияние на верхние слои атмосферы, включая ионосферу. Яркость Солнца в видимых длинах волн света, которые мы можем видеть, варьируется менее чем на 1/10 одного процента между верхней и нижней точкой цикла солнечных пятен. Тем не менее, рентгеновское и ультрафиолетовое излучение Солнца намного больше меняется в течение солнечного цикла, колеблясь в 10 или более раз. Поскольку эти рентгеновские лучи и УФ-излучение контролируют скорость образования ионов, которые образуют ионосферу, большие вариации в этих типах излучения приводят к большим изменениям плотности ионов в областях ионосферы.Кроме того, большие геомагнитные бури, вызванные солнечными вспышками и выбросами корональной массы Солнца, могут создавать серьезные временные нарушения в ионосфере.
(PDF) Надежный метод с высоким пространственным разрешением для определения количества слоев MoS2 с использованием сканирующей электронной микроскопии
Надежный метод с высоким пространственным разрешением для определения количества слоев MoS2 709
4. Заключение
MoS
2
чешуек различной толщины были приготовлены на подложке из SiO
толщиной 300 нм
2
с использованием техники механического отслаивания
.Затем хлопья наблюдали с помощью спектроскопии комбинационного рассеяния
, АСМ и низковольтного сканирующего электронного микроскопа, и результаты
сравнивали для одно- и пятислойных чешуек. Мы обнаружили
, что определенное АСМ количество слоев демонстрирует достаточно линейную зависимость
с соответствующим контрастом
SEM. Кроме того, СЭМ может разрешить слишком мелкие детали
, чтобы их можно было различить с помощью оптической микроскопии.
предполагает, что низковольтный СЭМ может быть эффективно использован
с пространственным разрешением на наноуровне для определения количества
слоев MoS
2
чешуек на SiO
2
/ Si подложке.Благодаря высокому пространственному разрешению
его можно в дальнейшем использовать для изучения морфологии
2D-материалов.
Благодарность
Эта исследовательская работа была поддержана стипендиями РА
Университета Пайчай, а также грантом
NRF-2017R1D1A1B03034454 от Национального исследовательского фонда Кореи
.
Список литературы
1. Гейм А.К., Новоселов К.С., Nature Mater., 6, 183
(2007).
2.А. Кастелланос-Гомес, Nature Photonics, 10, 202 (2016).
3. Р.В. Горбачев, И. Риаз, Р.Р. Наир, Р. Джалил, Л. Бритнелл,
BD Belle, EW Hill, К.С. Новоселов, К. Ватанабе,
Т. Танигучи, А.К. Гейм и П. Блейк, Нано Микро
Малый, 7, 465 (2011).
4. Д. Пасиле, Дж. К. Мейер,. Ö. Girit, A. Zettl, Appl.
Phys. Lett., 92, 133107 (2008).
5. К. Р. Дин, А. Ф. Янг, И. Мерик, К. Ли, Л. Ван, С.
Соргенфрей, К.Ватанабэ, Т. Танигучи, П. Ким, К. Л.
Шепард и Дж. Хоун, Nature Nanotechnol., 5, 722 (2010).
6. Х. Ли, Г. Лу, З. Инь, К. Хе, Х. Ли, К. Чжан и Х.
Чжан, Nano Micro Small, 8, 682 (2012).
7. А. Кастелланос-Гомес, Н. Аграит и Г. Рубио-Боллинджер,
Appl. Phys. Lett., 96, 213116 (2010).
8. D. J. Late, B. Liu, H. S. S. R. Matte, C. N. R. Rao и
V. P. Dravid, Adv. Func. Матем., 22, 1894 (2012).
9.Б. Радисавлевич, А. Раденович, Я. Бривио, В. Giacometti
и A. Kis, Nat. Нанотехнологии, 6, 147 (2011).
10. А. Сплендиани, Л. Сан, Й. Чжан, Т. Ли, Дж. Ким, К. Ю.
Чим, Г. Галли и Ф. Ван, Nano Lett., 10, 1271 (2010).
11. М. М. Бенамер, Б. Радисавлевич, Дж. С. Херон, С. Саху,
Х. Бергер и А. Кис, IOP Nanotechnology, 22, 125706
(2011).
12. Л. Ли, Й. Ю, Г. Дж. Е, К. Ге, Х. Оу, Х. Ву, Д. Фэн, Х.
Х.Чен и Ю. Чжан, Нат. Нанотехнологии, 9, 372 (2014).
13. С. П. Кениг, Р. А. Доганов, Х. Шмидт, А. Х. Кастро
Нето, Б. Озилмаз, Appl. Phys. Lett., 104, 103106
(2014).
14. Р. Фей, Л. Ян, Nano Lett., 14, 2884 (2014).
15. Y. H. Lee, X. Q. Zhang, W. Zhang, M. T. Chang, C. T.
Lin, K. D. Chang, Y. C. Chu, J. T. Wang, C. S. Chang,
L. J. Li и T. W. Lin, Adv. Матер., 24, 2320 (2012).
16. Ю.Ши, В. Чжоу, А.Ю. Лу, В. Фанг, Й.Х. Ли, AL
Хсу, С.М. Ким, К.К. Ким, Х.И. Ян, Л.Дж. Ли, JC
Идробо и Дж. Конг, Nano Lett., 12, 2784 ( 2012).
17. В. Николози, М. Чховалла, М. Г. Канатзидис, М. С.
Страно и Дж. Н. Коулман, Science, 340, 1226419 (2013).
18. К. С. Новоселов, Д. Цзян, Ф. Щедин, Т. Дж. Бут, В. В.
Хоткевич, С. В. Морозов, А. К. Гейм, Proc. Natl.
Акад. США, 102, 10451 (2005).
19. Х. Ли, Г. Лу, Й. Ван, З. Инь, К. Конг, К. Хэ, Л. Ван,
Ф. Дин, Т. Ю и Х. Чжан, Nano Micro Small, 9, 1974
(2013).
20. Х. Ли, Дж. Ву, Х. Хуанг, Г. Лу, Дж. Ян, Х. Лу, К. Сюн
и Х. Чжан, ACS Nano, 7, 10344 (2013).
21. Д. Акинванде, Н. Петроне и Дж. Хоун, Nat. Commun.,
5, 5678 (2014).
22. С. Ларентис, Б. Фаллахазад, Э. Тутук, Appl. Phys.
Lett., 101, 223104 (2012).
23.Р. С. Шарбидре, К. Дж. Ли, С. Г. Хонг, Дж. Рю и Т. Н.
Kim, Korean J. Mater. Исследования, 26, 704 (2016).
24. П. Ли, К. Цзян, С. Сюй, Ю. Чжуан, Л. Гао, А. Ху, Х.
Ван и Ю. Лу, Nanoscale, 9, 9119 (2017).
25. Биннинг Г. К., Phys. Scr., T19, 53 (1987).
26. Х. Ли, К. Чжан, К. К. Р. Яп, Б. К. Тай, Т. Х. Т. Эдвин,
А. Оливье и Д. Байларджит Adv. Функц. Матер., 22, 1385
(2012).
27. P. Nemes-Incze, Z.Осват, К. Камарас и Л. П. Биро,
Carbon, 46, 1435 (2008).
28. Дж. Х. Ли, Д. В. Джанг, С. Г. Хонг, Б. К. Парк, Дж. Х. Ким
и Х. Дж. Юнг, Карбон, 118, 475 (2017).
29. P. E. Gaskell, H. S. Skulason, C. Rodenchuk and T.
Szkopek, Appl. Phys. Lett., 94, 2007 (2009).
30. Я. Хванбо, К. К. Ли, А. Э. Мэг-Иса, Дж. В. Джанг, Х. Дж.
Ли, С. Б. Ли, С. С. Ким и Дж. Х. Ким, Карбон, 77, 454
(2014).
31.К. Ли, Х. Ян, Л. Э. Брус, Т. Ф. Хайнц, Дж. Хоун и С.
Рю, ACS Nano, 4, 2695 (2010).
32. Y. Y. Wang, R. X. Gao, Z. H. Ni, H. He, S. P. Guo, H.
P. Yang, C. X. Cong, T. Yu, IOP Nanotechnology, 23,
495713 (2012).
33. А. Э. Мэг-Иса, К. К. Ли, С. М. Ким, Дж. Х. Ким и К.
С. О, Карбон, 94, 646 (2015).
34. Х. Хиура, Х. Миядзаки и К. Цукагоши, Appl. Phys.
Экспресс, 3, 95101 (2010).
D, E, F, F1, F2, Регионы »Электроника
Внутри ионосферы есть несколько различных ионосферных областей, которые по-разному влияют на распространение радиосигналов и радиосвязь — слой D, слой E, слой F, который разделяется на слои F1 и F2, по-разному влияют на радиосигналы.
Учебное пособие по ионосферному распространению включает. . . .
Ионосферное распространение
Ионосфера
Ионосферные слои
Skywaves и пропуск
Критическая частота, МПЧ, LUF и OWF
Как использовать ионосферное распространение
Множественные отражения и прыжки
Ионосферное поглощение
Затухание сигнала
Солнечные индексы
Программное обеспечение для распространения
NVIS
Трансэкваториальное распространение
Распространение серой линии
Спорадический E
Спред F
Традиционный взгляд на ионосферу указывает на ряд отдельных слоев, каждый из которых влияет на ВЧ радиосвязь немного по-разному.Действительно, ранние открытия ионосферы указывали на присутствие ряда слоев.
Слои были обозначены как слои D, E и F ионосферы, и концепция отдельных слоев с этими названиями сохранялась в течение многих лет.
Рассматривая ионосферу и то, как она влияет на радиосигналы, стоит внимательнее изучить распространение ионизации в ионосфере и то, как различные области ионосферы влияют на сигналы радиосвязи и как это можно использовать.
Области ионосферы
Хотя концепция отдельных слоев D, E и F является удобным способом изобразить структуру ионосферы, она не совсем верна. Ионизация существует по всей ионосфере, ее уровень меняется с высотой. Пики уровня можно рассматривать как разные слои или, возможно, более правильно, как области. Следовательно, терминология регионов D, E и F. является более подходящей.
Существует также область C ниже других, но уровень ионизации настолько низок, что не оказывает никакого влияния на радиосигналы и радиосвязь, и о нем редко упоминают.
Типичное распределение электронов в ионосфереРазличные слои или области в ионосфере имеют разные характеристики и по-разному влияют на радиосвязь. Есть также различия в том, как они создаются и поддерживаются. В связи с этим стоит более подробно рассмотреть каждый из них и то, как они меняются в течение всего дня в светлое и темное время суток.
D Регион
Когда небесная волна покидает поверхность Земли и движется вверх, первая представляющая интерес область, которую она достигает в ионосфере, называется D-слоем или D-областью.
Он присутствует на высотах от 60 до 90 километров, а радиация в нем присутствует только в дневное время до такой степени, что заметно влияет на радиоволны. Он поддерживается солнечным излучением, и уровень ионизации быстро падает в сумерках, когда источник излучения удаляется.
Слой D в основном создается под действием формы излучения, известного как излучение Лаймана, которое имеет длину волны 1215 ангстрем и ионизирует газообразный оксид азота, присутствующий в атмосфере.Жесткие рентгеновские лучи также способствуют ионизации, особенно на пике солнечного цикла.
Слой D или область D в основном влияет на поглощение или ослабление сигналов радиосвязи, особенно в НЧ и СЧ частях радиоспектра, его влияние уменьшается с увеличением частоты.
Ночью падение уровня ионизации означает, что она мало влияет на большинство сигналов радиосвязи, хотя ее все еще достаточно для преломления сигналов СНЧ.
Эта область ослабляет проходящие сигналы. Уровень затухания зависит от частоты. Низкие частоты приглушаются сильнее, чем высокие. Фактически обнаружено, что затухание изменяется как обратный квадрат частоты, то есть удвоение частоты снижает уровень затухания в четыре раза. Это означает, что низкочастотные сигналы часто не достигают более высоких областей, за исключением ночи, когда область исчезает.
Где:
k = постоянная
f = рабочая частота (Гц)
Область D ослабляет сигналы, потому что радиосигналы заставляют свободные электроны в этой области колебаться.Когда они колеблются, электроны сталкиваются с молекулами, и при каждом столкновении происходит небольшая потеря энергии. Когда бесчисленные миллионы электронов колеблются, потери энергии становятся заметными и проявляются как снижение общего уровня сигнала. Величина потери сигнала зависит от ряда факторов.
Количество присутствующих молекул газа: Одним из факторов является количество присутствующих молекул газа. Чем больше количество молекул газа, тем больше количество столкновений и, следовательно, больше затухание.На высоте, где существует область D, все еще существует относительно высокий уровень молекул газа, и, следовательно, существует достаточно большое количество столкновений между ионами и молекулами, чтобы поглотить большое количество энергии при многих обстоятельствах.
Уровень ионизации: Уровень ионизации также очень важен. Чем выше уровень ионизации, тем большее количество электронов колеблется и сталкивается с молекулами.
Частота сигнала: Третьим основным фактором является частота сигнала.По мере увеличения частоты длина волны колебания укорачивается, а количество столкновений между свободными электронами и молекулами газа уменьшается. В результате сигналы с более низкими частотами радиочастотного спектра ослабляются гораздо сильнее, чем сигналы с более высокими частотами. Даже в этом случае высокочастотные сигналы по-прежнему испытывают некоторое снижение мощности.
На практике установлено, что уровень ослабления достаточен для предотвращения того, чтобы сигналы в СЧ части спектра достигли более высоких уровней.Однако ночью, когда ионизация в области D спадает, они могут достигать более высоких слоев, и могут быть слышны сигналы издалека. Это очевидно в диапазоне средних волн и более высоких частотах, где сигналы поглощаются D-областью.
Сигналы на более высоких частотах, которые «отражаются» более высокими областями в ионосфере, также будут в некоторой степени ослаблены, хотя это будет зависеть от частоты. Стоит отметить, что для каждого отражения сигнал должен будет дважды пройти через область D, каждый раз ослабляясь.Следовательно, сигналы, которые отражаются несколько раз, могут значительно ослабляться.
E Регион
Область E или слой E находится над областью D. Он существует на высоте от 100 до 125 километров. Вместо того, чтобы ослаблять сигналы радиосвязи, этот слой главным образом преломляет их, часто до такой степени, что они возвращаются на Землю. Похоже, что они были отражены этим слоем. Однако этот слой все еще действует в определенной степени как аттенюатор.
На высоте, где существует слой E или область E, плотность воздуха намного меньше, чем для области D. Это означает, что когда свободные электроны возбуждаются радиосигналами и колеблются, столкновений происходит гораздо меньше. В результате способ действия E-слоя или E-области несколько отличается. Электроны снова приводятся в движение радиосигналом, но они имеют тенденцию повторно излучать его. Поскольку сигнал распространяется в области, где плотность электронов увеличивается, чем дальше он продвигается в область, сигнал преломляется от области с более высокой концентрацией электронов.В случае ВЧ-сигналов этого преломления часто бывает достаточно, чтобы отогнуть их обратно на землю. Фактически кажется, что область «отразила» сигнал.
Тенденция к такому «отражению» зависит от частоты и угла падения. По мере увеличения частоты обнаруживается, что величина преломления уменьшается до тех пор, пока не будет достигнута частота, при которой сигналы проходят через область и переходят к следующей. В конце концов достигается точка, в которой сигнал проходит через слой E на следующий слой над ним.
Как и в области D, уровень ионизации относительно быстро падает после наступления темноты, поскольку электроны и ионы повторно объединяются, и ночью он практически исчезает. Однако остаточная ионизация в ночное время в нижней части области E вызывает некоторое ослабление сигналов в нижних частях ВЧ части спектра радиосвязи.
Ионизация в этой области возникает в результате нескольких типов излучения. Мягкие рентгеновские лучи производят большую часть ионизации, хотя экстремальные ультрафиолетовые (EUV) лучи (ультрафиолетовый свет с очень короткой длиной волны) также вносят свой вклад.В широком смысле излучение, вызывающее ионизацию в этой области, имеет длину волны от 10 до 100 ангстрем. Степень вклада всех составляющих зависит от состояния Солнца и широты, на которой производятся наблюдения.
F Регион
Наиболее важной областью в ионосфере для дальних ВЧ радиосвязи является F-область. В дневное время, когда излучение поступает от Солнца, оно часто разделяется на две части: нижняя — это область F1, а верхняя — область F2.Из них область F1 больше похожа на точку перегиба кривой электронной плотности (см. Выше) и обычно существует только летом.
Обычно слой F1 находится на высоте около 300 километров, а слой F2 над ним находится на высоте около 400 километров. Комбинированный слой F может быть центрирован на расстоянии от 250 до 300 километров. Высота всех слоев в слоях ионосферы значительно различается, а F-слой меняется больше всего. В результате приведенные цифры следует воспринимать только как приблизительные.Будучи самой высокой из ионосферных областей, она сильно зависит от состояния Солнца, а также от других факторов, включая время суток, год и т. Д.
Уровень F действует как «отражатель» сигналов в ВЧ-части радиочастотного спектра, позволяя установить радиосвязь во всем мире. Это основная область, связанная с распространением ВЧ сигнала.
Действие слоя F на радиосигналы такое же, как и для слоя E, хотя при меньшей плотности воздуха происходит меньше столкновений и меньше потерь энергии.В результате сигналы, отражаемые слоем F, и, в частности, F2 позже, подвергаются низкому уровню ослабления. В результате даже сигналы малой мощности можно услышать на большом расстоянии.
Подобно слоям D и E, уровень ионизации области F меняется в течение дня, снижаясь ночью по мере исчезновения солнечного излучения. Однако уровень ионизации остается намного выше. Плотность газов намного ниже, и в результате рекомбинация ионов и электронов происходит медленнее, примерно с четвертью скорости, которая происходит в E-области.В результате этого он по-прежнему влияет на радиосигналы в ночное время, будучи способным вернуть многих на Землю, хотя в некоторых аспектах он оказывает меньшее влияние.
Область F находится на самом высоком уровне в ионосфере и поэтому подвергается наибольшему воздействию солнечного излучения. Большая часть ионизации возникает из-за ультрафиолетового света в середине спектра, а также тех частей спектра с очень короткими длинами волн. Обычно излучение, вызывающее ионизацию, находится в диапазоне длин волн от 100 до 1000 ангстрем, хотя крайний ультрафиолетовый свет отвечает за некоторую ионизацию в нижних областях F-области.
Вариации ионосферы
Уже было замечено, что время суток вызывает некоторые очень существенные изменения в состоянии ионосферы, поскольку уровень ионизации ночью падает. Однако есть много других факторов, которые также влияют на ионосферу. Главный из них — это само Солнце, но другие факторы включают время года и положение на земном шаре.
Сезонные изменения: Точно так же, как количество тепла, получаемого местами на Земле, меняется в зависимости от времени года, изменяется и количество излучения, получаемого ионосферой.Это происходит из-за того, что летом полученное излучение распространяется на меньшую площадь, поскольку поверхность Земли находится ближе к перпендикулярному направлению излучения. Зимой поверхность Земли находится под большим углом, и излучение должно распространяться на большую площадь. В результате ионосфера зимой получает меньше радиации, чем летом.
Области D и E реагируют, как и ожидалось, более низкими уровнями ионизации зимой, чем летом, и область F 1 также следует аналогичной схеме.Однако для области F 2 существуют другие влияющие факторы, и она реагирует по-другому.
Для области F 2 тепловое воздействие Солнца играет решающую роль в его реакции. Температура зимой намного ниже, чем летом, потому что тепло от Солнца распространяется на большую площадь, потому что солнце находится ниже в небе. Летом температура газа повышается в области F2, поэтому активность в воздухе возрастает, и большее количество молекул поднимается выше в атмосферу.Зимой, когда температура падает, более тяжелые молекулы падают, а более легкие атомы поднимаются наверх.
Это означает, что зимой более высокая доля атомов находится на большей высоте в области F2. Атомы легче ионизировать, чем молекулы газа, поэтому количество подходящих мишеней для ионизации излучения также увеличивается. В результате уровни дневной ионизации зимой фактически выше, чем летом. Общий эффект заключается в том, что пиковые дневные уровни ионизации зимой повышаются выше, чем летом, но падают до более низкого уровня, поскольку солнечное излучение присутствует в течение меньшей части времени.
Географические различия: На уровни ионизации также влияет положение на земном шаре. Естественно, существуют вариации, связанные с широтой, где полярные области, которые получают меньше радиации, а экваториальные области имеют гораздо более высокие уровни радиации. В целом это приводит к более высоким уровням ионизации для областей D, E и F 1 в экваториальных областях, чем к полюсам.
Область F 2 имеет ряд других факторов, которые влияют на ее уровень ионизации, включая магнитное поле Земли, и она также получает ионизацию от других источников.В результате было обнаружено, что уровни ионизации выше в Азии и Австралии, чем в западном полушарии, включая Африку, Европу и Северную Америку.
Сводка
Ионосфера — это постоянно изменяющаяся область атмосферы. Он простирается с высоты около 60 километров до более чем 400 километров и содержит ионы и свободные электроны. Свободные электроны влияют на то, как радиоволны распространяются в этой области, и они оказывают значительное влияние на ВЧ радиосвязь.
Ионосферу можно разделить на несколько областей, соответствующих пикам электронной плотности. Эти регионы называются регионами D, E и F. Ввиду того факта, что излучение Солнца поглощается, когда оно проникает в атмосферу, различные формы излучения вызывают ионизацию в разных регионах, как показано в сводной таблице ниже:
| Краткое описание форм излучения, вызывающих ионизацию в ионосферных слоях или регионах. | |
|---|---|
| Область | Формы первичного ионизирующего излучения |
| С | Космический |
| D | Лайман альфа, жесткие рентгеновские лучи |
| E | Мягкие рентгеновские лучи и некоторые экстремальные ультрафиолетовые лучи |
| F1 | Экстремальный ультрафиолетовый и немного ультрафиолетовый |
| F2 | Ультрафиолетовый |
Ионосфера — это постоянно меняющаяся область.

Leave A Comment