Можно ли уксусом лечить болезни? Вот научные факты
- Гэбриэл Нил
- Статья с сайта Conversation
Подпишитесь на нашу рассылку ”Контекст”: она поможет вам разобраться в событиях.
Автор фото, Getty Images
Полезные для здоровья свойства яблочного уксуса известны давно, но подтверждают ли их научные исследования? Это решил выяснить профессор семейной медицины из Техаса Гэбриэл Нил.
В 1980-х, когда мы с братом были еще детьми, мы любили ходить в Long John Silver’s (американская сеть рыбного фастфуда).
Но манили нас туда не рыбные блюда, а бутылочки с солодовым уксусом, которые стояли на столиках.
Мы откручивали крышечку и потягивали прямо из бутылки пряный божественный нектар с карамельным оттенком.
Вы чувствуете отвращение? Возможно. Мы с братом опередили время? Очевидно, так.
Теперь уксус как панацею от любого недуга рекламируют в соцсетях, и простой поиск в интернете выдаст вам огромное количество ссылок на статьи об этой чудодейственной приправе.
Друзья и коллеги наперебой рассказывают истории об исцелении яблочным уксусом. «Покосил траву на лужайке перед домом и теперь не можешь разогнуться? Уксус — твой лучший друг. Никак не сбросишь лишние пять килограммов? От уксуса они просто растворятся. Что, сифилис? Ну, ты знаешь, что делать — уксус».
Меня как врача-практика и преподавателя медицины постоянно спрашивают о полезности яблочного уксуса. Мне нравятся такие вопросы — ведь можно подробно поговорить об истории уксуса, а затем перейти к сути вопроса: чем именно уксус может быть полезным.
- Медицинские мифы: при простуде нельзя есть мороженое?
- Медицинские мифы: совместим ли алкоголь с антибиотиками?
- Медицинские мифы.
 Молоко налаживает пищеварение?
Молоко налаживает пищеварение? - Медицинские мифы. Жевательная резинка не переваривается?
На протяжении истории уксусом лечили многие болезни. Гиппократ, например, советовал принимать его от кашля и простуды, а итальянский врач Томмазо дель Гарбо во время вспышки чумы в 1348 году мыл уксусом руки, лицо и рот, чтобы предотвратить заражение.
Уксус и воду считали отличным средством утолить жажду древнеримские легионеры, и современные спортсмены берут с них пример.
В общем, история предоставляет множество свидетельств полезного воздействия уксуса на организм человека. Но подтверждают ли это современные медицинские исследования?
Автор фото, Getty Images
Подпись к фото,Так насколько это научно — считать яблочный уксус панацеей от множества недугов?
Пропустить Подкаст и продолжить чтение.ПодкастЧто это было?Мы быстро, просто и понятно объясняем, что случилось, почему это важно и что будет дальше.
эпизоды
Конец истории Подкаст
Наиболее достоверные доказательства пользы яблочного уксуса для здоровья человека можно найти в нескольких исследованиях. Одно из них показало, что употребление яблочного уксуса улучшает уровень глюкозы в крови после еды у людей, имеющих резистентность к инсулину.
У 11 участников исследования, склонных к диабету, прием одной столовой ложки яблочного уксуса снижал уровень сахара в крови через 30-60 минут после еды более эффективно, чем у группы, принимавшей плацебо.
Ну что ж, неплохо, но речь идет только об 11 индивидуумах, склонных к диабету.
Другое исследование, в котором участвовали взрослые японцы с ожирением, показало заметное снижение у них веса, уровня жиров и триглицеридов в крови после приема этого самого уксуса.
Ученые разделили участников эксперимента на три группы по 155 человек. Одна группа ежедневно принимала 15 мл (примерно столовую ложку) яблочного уксуса, вторая — 30 мл и третья — плацебо.
Затем исследователи измеряли вес, жировую массу и уровень триглицеридов. У участников обеих групп, принимавших 15 и 30 мл уксуса, все три показателя снизились.
Что тут сказать? Хотя эти выводы и нуждаются в подтверждении более масштабными исследованиями, они обнадеживают.
Опыты на животных, прежде всего крысах, показывают, что уксус может снижать артериальное давление и количество жира в брюшной полости.
Автор фото, Getty Images
Подпись к фото,Уксус? Для фиш-энд-чипс он подходит отлично
Эти эксперименты побуждают провести схожие исследования с участием людей, поскольку выводы, основанные только на опытах с животными, недостаточно убедительны.
Итак, реальную пользу уксуса для здоровья предстоит еще проверить на исследованиях с участием большого количества людей. И такие исследования наверняка скоро появятся.
Попробуем теперь зайти с другой стороны: есть ли доказательства того, что уксус может навредить здоровью человека?
В общем-то, нет. Разве что вы будете его пить в больших количествах или слишком концентрированным — например, дистиллированный белый уксус, используемый для очистки (содержание уксусной кислоты в разрешенном для потребления в пищу уксусе составляет 4-8%).
Разве что вы будете его пить в больших количествах или слишком концентрированным — например, дистиллированный белый уксус, используемый для очистки (содержание уксусной кислоты в разрешенном для потребления в пищу уксусе составляет 4-8%).
И, конечно, не стоит втирать его в глаза (зачем?!) или нагревать в свинцовом чане, как это делали римляне, чтобы уксус стал сладким. Это, действительно, очень опасно для здоровья.
И, кстати, вообще никогда не разогревайте еду в свинцовом чане, это вредно.
Ну, а для рыбы и картофеля фри яблочный уксус подходит идеально. От всех недугов он вас при этом не исцелит, но гастрономическое удовольствие гарантировано.
А если вы где-то наткнетесь на бутылочку солодового уксуса, вспомните нас с братом и сделайте из нее глоток — на здоровье!
—
Правовая информация. Эта статья содержит только общие сведения и не должна рассматриваться в качестве замены рекомендаций врача или иного специалиста в области здравоохранения. Би-би-си не несет ответственности за любой диагноз, поставленный читателем на основе материалов сайта. Би-би-си не несет ответственности за содержание других сайтов, ссылки на которые присутствуют на этой странице, а также не рекомендует коммерческие продукты или услуги, упомянутые на этих сайтах. Если вас беспокоит состояние вашего здоровья, обратитесь к врачу.
Би-би-си не несет ответственности за любой диагноз, поставленный читателем на основе материалов сайта. Би-би-си не несет ответственности за содержание других сайтов, ссылки на которые присутствуют на этой странице, а также не рекомендует коммерческие продукты или услуги, упомянутые на этих сайтах. Если вас беспокоит состояние вашего здоровья, обратитесь к врачу.
Эта статья впервые была опубликована на сайте Conversation и перепечатывается здесь в рамках лицензии Creative Commons. Прочитать ее оригинал на английском языке можно на сайте BBC Future.
Демонстрация буферного раствора: уксусная кислота/ацетат и вода Сравнить pH
Эта демонстрация направлена на то, чтобы ознакомить учащихся с концепцией буферного раствора. Растворы с рН 4, 5, 6, 7, 8, 9, 10 помещают в отдельные промаркированные колбы Эрленмейера. К каждому раствору добавляется универсальный индикатор. [pH-метр не является обязательным]
Дистиллированная вода доводится до pH = 7,0. Половину этого раствора помещают в химический стакан «А». Стакан «А» и его содержимое находятся на мешалке с магнитной мешалкой в воде. Добавлен универсальный индикаторный раствор. Затем демонстратор строит буферный раствор перед учащимися, начиная с деионизированной воды в стакане «В», а затем добавляя уксусную кислоту. Стакан «В» и его содержимое находятся на мешалке с магнитной мешалкой в растворе. Преподаватель просит учащихся оценить рН раствора уксусной кислоты и написать уравнение равновесия, представляющее эту слабокислотную систему.
Половину этого раствора помещают в химический стакан «А». Стакан «А» и его содержимое находятся на мешалке с магнитной мешалкой в воде. Добавлен универсальный индикаторный раствор. Затем демонстратор строит буферный раствор перед учащимися, начиная с деионизированной воды в стакане «В», а затем добавляя уксусную кислоту. Стакан «В» и его содержимое находятся на мешалке с магнитной мешалкой в растворе. Преподаватель просит учащихся оценить рН раствора уксусной кислоты и написать уравнение равновесия, представляющее эту слабокислотную систему.
CH 3 COOH(водн.) + H 2 O(л) <=> H 3 O + (водн.)+ CH 3 COO — 9001 4 (водный) K а = 1,8 х 10 -5
В раствор уксусной кислоты добавляют универсальный индикатор и учащиеся наблюдают, что индикатор в растворе уксусной кислоты имеет цвет, соответствующий кислому.
Преподаватель спрашивает учащихся, что произойдет с pH раствора уксусной кислоты при добавлении ацетата натрия. Учащиеся должны ссылаться на принцип ЛеШателье и эффект общего иона. Ион ацетата является обычным ионом. При добавлении к системе уксусной кислоты при равновесии ацетат будет реагировать с некоторыми ионами гидроксония, вызывая сдвиг равновесия влево. Поскольку концентрация ионов гидроксония уменьшается, pH должен увеличиваться (становиться менее кислым).
Учащиеся должны ссылаться на принцип ЛеШателье и эффект общего иона. Ион ацетата является обычным ионом. При добавлении к системе уксусной кислоты при равновесии ацетат будет реагировать с некоторыми ионами гидроксония, вызывая сдвиг равновесия влево. Поскольку концентрация ионов гидроксония уменьшается, pH должен увеличиваться (становиться менее кислым).
Затем к раствору уксусной кислоты добавляют твердый ацетат натрия до тех пор, пока цвет индикатора в растворе не станет «зеленым», что соответствует pH = 7. И вода, и раствор уксусной кислоты/ацетата имеют одинаковый цвет, поэтому оба растворы имеют одинаковый рН.
К воде добавляют небольшое количество 0,10 М HCl, а затем 0,10 М NaOH. Учащиеся наблюдают резкое изменение цвета индикатора в воде. К раствору уксусной кислоты/ацетата добавляют небольшие количества 0,10 М HCl, а затем 0,10 М NaOH. Цвет индикатора в буферном растворе незначительно меняется. Вода не является буферным раствором, а раствор уксусной кислоты/ацетата является буферным раствором.
Кислотный буфер представляет собой раствор слабой кислоты (уксусной кислоты) и сопряженной с ней пары оснований (ацетат натрия), который предотвращает резкое изменение pH раствора за счет действия каждого компонента с поступающей кислотой или основанием.
Уксусная кислота в буферном растворе будет реагировать с добавлением гидроксида натрия, NaOH
CH 3 CO 2 H(водн.) + OH — (водн.) –> CH 3 CO 9000 7 2 — (водн.) + H 2 O(л) K=1,8 x 10 9
Ацетат-анион в буферном растворе будет реагировать с добавлением соляной кислоты, HCl
CH 3 CO 2 — (водн.) + H 3 O + (водный) –> CH 3 CO 2 H(водн.) + H 2 O(л) K=5,6 x 10 4
это интерактивная демонстрация. Эту деятельность может сопровождать компьютерная анимация, демонстрирующая динамическое представление взаимодействий слабого и сопряженного основания в кислотно-основных реакциях на уровне частиц. Когда преподаватели ожидают, что их студенты будут думать о буферах в микроскопических или символических терминах и будут связывать различные представления буферов друг с другом, они должны явно показать эти представления и их связи со студентами. Студенты обычно не устанавливают эти связи самостоятельно и не думают в терминах «молекулярных сцен».
Когда преподаватели ожидают, что их студенты будут думать о буферах в микроскопических или символических терминах и будут связывать различные представления буферов друг с другом, они должны явно показать эти представления и их связи со студентами. Студенты обычно не устанавливают эти связи самостоятельно и не думают в терминах «молекулярных сцен».
Это задание может сопровождаться вопросами-кликерами, в которых учащимся предлагается предсказать, что произойдет. Имеются вопросы викторины, позволяющие оценить понимание учащимися буферных растворов. Образцы конспектов лекций сопровождают это занятие.
Предлагаемые компьютерные анимации
Следующие анимации представляют собой упрощенное молекулярное представление того, что происходит, когда кислота или основание добавляются в буферную систему.
http://www.chembio.uoguelph.ca/educmat/chm19104/chemtoons/chemtoons7.htm
https://video.search.yahoo.com/yhs/search;_ylt=AwrUily3FcBa4lIAvYU2nIlQ?. ..
..
Трудности учащихся
1. Буферные решения обычно рассматриваются учащимися как статические системы, а не как динамические равновесия системы .
2. Учащимся трудно уверенно интерпретировать химические формулы. Учащимся трудно определить, представляет ли химическая формула слабую или сильную кислоту, слабое или сильное основание, кислую или основную ионную соль. Химические формулы солей сопряженных оснований особенно трудны для интерпретации учащимися.
3. Учащимся трудно понять и предсказать, будет ли растворенная ионная соль образовывать кислый, щелочной или нейтральный раствор при растворении в воде.
4. Учащимся трудно написать уравнение химического равновесия, представляющее буферную систему. Учащиеся не понимают связи между слабой кислотой и сопряженным с ней основанием. Учащиеся предполагают, что любые два смешанных химических вещества будут реагировать вместе, и учащиеся записывают уравнение химической реакции между слабой кислотой и ее сопряженным основанием.
HA + A — <=>
5. Трудности учащихся в концептуальном понимании буфера связаны с их неспособностью визуализировать буферы в микроскопическом масштабе. Учащиеся испытывают трудности с представлением (рисованием) буферного раствора с использованием «диаграммы-изображения» или «молекулярной сцены» и с трудом интерпретируют «молекулярную сцену», представляющую буфер. Студенты испытывают трудности с соотнесением макроскопических, микроскопических и символических представлений буферов. Студенты, которые могут рисовать и интерпретировать «молекулярные сцены» буферных растворов, демонстрируют и демонстрируют лучшее концептуальное понимание буферов по сравнению со студентами, которые не могут этого сделать.
6. Учащиеся путают концентрацию иона гидроксония в буферном растворе (используемую для расчета pH) с начальной концентрацией слабой кислоты (т.е. 1,0 М), которая используется в уравнении Хендерсона-Хассельбаха. Учащиеся не могут различать или связывать слабокислотный компонент буфера и ионы водорода, определяющие рН раствора.
7. Учащиеся считают, что все буферы имеют pH = 7, нейтральный.
8. Студенты не понимают концептуально, что pH представляет собой логарифмическую шкалу, а логарифм концентрации H 3 O + ионов в растворе (с учетом роли, которую играет коэффициент активности) определяет кислотность или щелочность раствора. Неспособность учащихся понять логарифмические функции (по основанию 10) имеет последствия для их понимания буферов.
9. Учащимся трудно различать K и и pK и или pH и [H + ].
10. Из-за того, что у учащихся нет хорошего концептуального понимания буферов и поскольку они пытаются подходить к проблемам с буферами с чисто математической точки зрения, некоторые студенты считают, что существует только один способ решения определенного типа задач с буферами.
11. Некоторые учащиеся считают, что сила буфера определяется силой составляющих его кислоты и основания: буфер, приготовленный из сильной кислоты и сильного основания, будет сильнее (имеет более высокую буферную емкость), чем буфер, сделанный из слабая кислота и слабое основание.
12. Некоторые учащиеся считают, что буферы обладают неограниченной способностью противостоять изменениям pH. На самом деле буферные растворы имеют ограниченную способность противостоять изменениям рН. В кислом буферном растворе количество молей слабой кислоты и количество молей сопряженного с ней основания определяют степень, в которой буфер может нейтрализовать добавленную кислоту или основание.
13. Учащимся трудно объяснить, что происходит, когда к буферной системе добавляют сильную кислоту или сильное основание. Студенты должны включить в свое объяснение химические уравнения, диаграммы частиц и письменные объяснения.
Цели обучения
1. Определить два компонента кислого буферного раствора и объяснить функцию каждого компонента.
2. Напишите уравнение химического равновесия, представляющее буферную систему уксусная кислота-ацетат натрия.
3. Напишите соответствующие химические уравнения и объясните, как один компонент буферной системы реагирует при добавлении кислоты, а другой компонент реагирует при добавлении основания.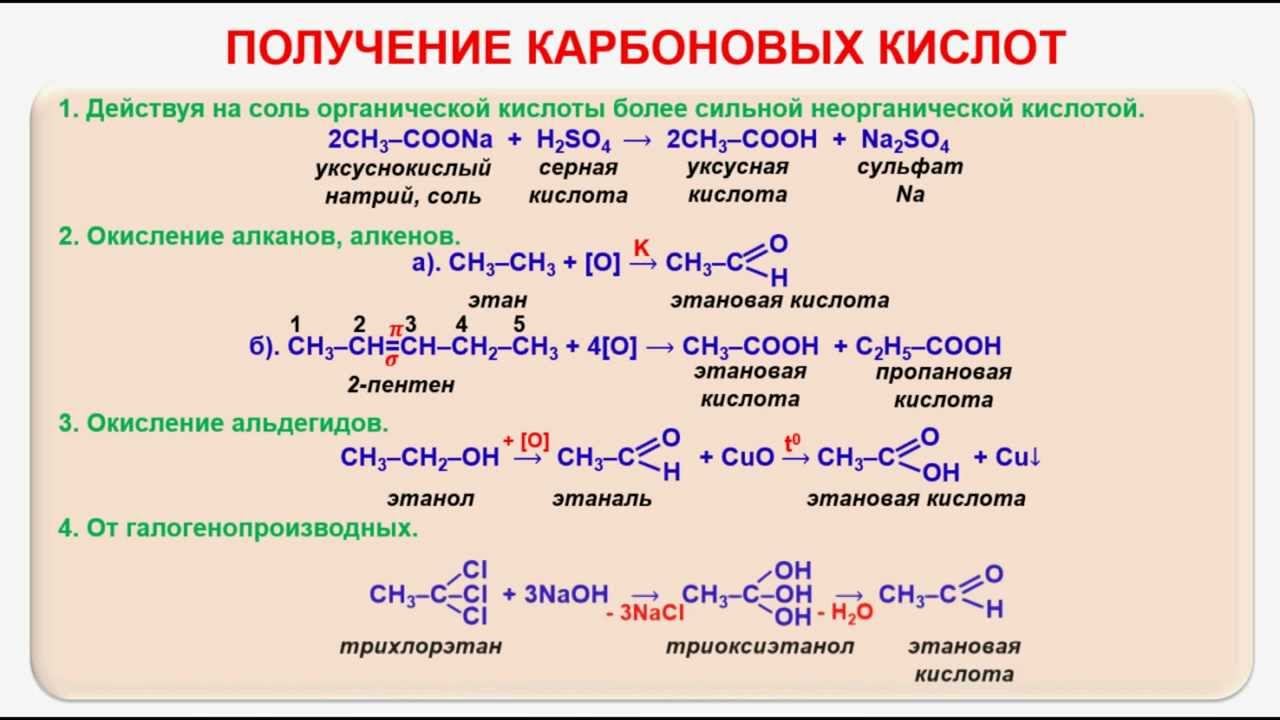 Покажите, что эти реакции лишь незначительно увеличивают или уменьшают рН раствора.
Покажите, что эти реакции лишь незначительно увеличивают или уменьшают рН раствора.
4. Напишите соответствующие химические уравнения и объясните, как вода реагирует при добавлении кислоты и при добавлении основания. Покажите, что эти реакции увеличивают или уменьшают рН раствора.
5. Напишите соответствующие химические уравнения и объясните, почему концентрации двух компонентов буфера должны быть высокими, чтобы свести к минимуму изменение pH из-за добавления небольшого количества кислоты, H 3 O + или основание OH — .
6. Объясните, почему наилучшее значение pH кислой буферной системы составляет ±1 pH от pK и слабой кислоты.
Цель обучения AP Chem
Учащийся может назвать раствор буферным раствором и объяснить механизм действия буфера с точки зрения реакций, которые происходят при добавлении кислоты или основания.
Время выполнения
Для этого проекта требуется один день выполнения.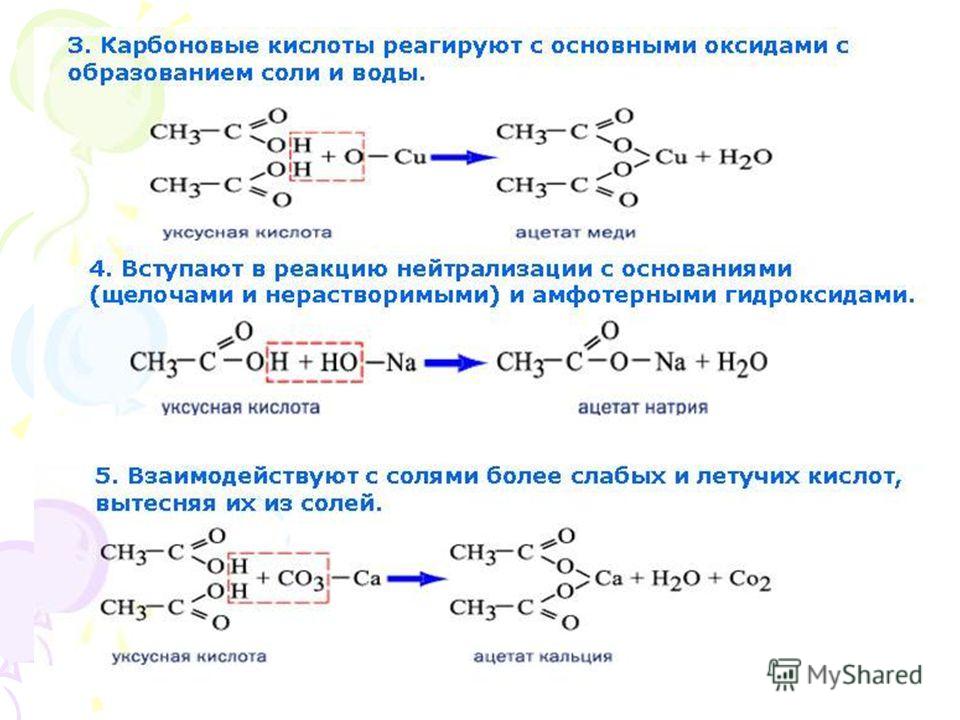
Обсуждение
Попросите учащихся предсказать pH этой системы. Почти все учащиеся с уверенностью скажут, что это кислотно. Добавьте немного раствора универсального индикатора, и учащиеся увидят, что цвет индикатора соответствует кислотному раствору. Скажите учащимся, что уксусная кислота — это «Большая собака» во дворе. «Большая собака» устанавливает систему равновесия.
Затем спросите учащихся, что произойдет с pH раствора, если к раствору уксусной кислоты добавить немного твердого ацетата натрия? Скажите учащимся, что ацетат натрия — это «Маленькая собачка». Напомните учащимся, что они наблюдали эффект обычного иона и знают принцип Ле Шателье. Студенты должны предсказать, что добавление некоторого количества ионов ацетата сместит равновесие влево, уменьшив [H + ] концентрации, что увеличивает значение рН.
Попросите учащихся написать уравнение равновесия, представляющее эту систему. Некоторые учащиеся попытаются написать
HA + A — <=>
Учащиеся должны быть убеждены, что уравнение, представляющее равновесную систему, остается
HA + H 2 O <=> H + + A —
Уксусная кислота – это «Большая собака», а «Большая собака» устанавливает равновесие во дворе.
Приготовление
3М или 6М уксусная кислота, 50 г твердого ацетата натрия, деионизированная вода, три больших стакана, две мешалки, две магнитные мешалки, универсальный индикаторный раствор, 0,10 М HCl. 0,10 М растворы NaOH pH = 4, 5, 6, 7, 8, 9, 10 в промаркированных колбах Эрленмейера с универсальным индикатором в каждом растворе. pH-метр не является обязательным.
Сноски
Ссылки
Orgill, M.K., & Sutherland, A. (2008). Восприятие и неправильное представление студентов бакалавриата о буферах и проблемах с буферами. Исследования и практика в области химического образования , 9, 131–143.
Дрекслер, М., и Шмидт, Х. Дж. (2005), Учебники и понимание учителями кислотно-щелочных моделей, используемых в преподавании химии, Исследования и практика в области химического образования, 6 (1) , 19–35.
Саммерлин, Л.; Боргфорд, К.; Ealy, J. C. «Химические демонстрации: справочник для учителей»; Том 2; 1987 год; п. 172-173.
172-173.
Донахью, Си Джей; Панель, М.Г. (1985). Буферная емкость различных систем уксусная кислота-ацетат натрия: лекционный эксперимент. Journal of Chemical Education , 62(4) стр. 337. DOI: 10.1021/ed062p337.
Пол Г. Хоуб мл. (1979). Демонстрация буферного эффекта на проекторе. J. Chem. Образовательный , 56 (1), стр. 47.
Джеймс С. Чанг (1976). Буферный раствор и его действие. J. Chem. Образовательный , 1976 , 53 (4), стр. 228.
Темы:
Преимущества, применение и побочные эффекты уксусной кислоты
Доказательная база
Этот контент Dr. Axe прошел медицинскую проверку или проверку фактов, чтобы гарантировать достоверность информации.
Следуя строгим редакционным правилам поиска источников, мы ссылаемся только на академические исследовательские институты, авторитетные сайты СМИ и, если доступны исследования, на исследования, прошедшие рецензирование с медицинской точки зрения. Обратите внимание, что числа в скобках (1, 2 и т. д.) являются интерактивными ссылками на эти исследования.
Обратите внимание, что числа в скобках (1, 2 и т. д.) являются интерактивными ссылками на эти исследования.
Информация в наших статьях НЕ предназначена для замены личных отношений с квалифицированным медицинским работником и не предназначена в качестве медицинской консультации.
Эта статья основана на научных данных, написанных экспертами и проверенных нашей квалифицированной редакцией. Обратите внимание, что числа в скобках (1, 2 и т. д.) являются интерактивными ссылками на исследования, прошедшие рецензирование с медицинской точки зрения.
В нашу команду входят лицензированные диетологи и диетологи, сертифицированные специалисты по санитарному просвещению, а также сертифицированные специалисты по силовой и физической подготовке, персональные тренеры и специалисты по корректирующим упражнениям. Наша команда стремится быть не только тщательной в своих исследованиях, но и объективной и непредвзятой.
Информация в наших статьях НЕ предназначена для замены личных отношений с квалифицированным медицинским работником и не предназначена в качестве медицинской консультации.
Рэйчел Линк, MS, RD
18 октября 2022 г.
Уксусная кислота может звучать так, как будто она должна быть в химической лаборатории или на научной ярмарке, а не в вашей кухонной кладовой. Тем не менее, это мощное соединение на самом деле является основным соединением, содержащимся в уксусе, и отвечает как за его уникальный вкус, так и за кислотность. Не только это, но также считается, что он способствует многим преимуществам яблочного уксуса для здоровья благодаря его мощным лечебным свойствам.
Так что же такое уксусная кислота и как она работает? В этой статье мы более подробно рассмотрим уксусную кислоту и то, как она может повлиять на ваше здоровье.
Что такое уксусная кислота?
Уксусная кислота, также известная как этановая кислота, представляет собой химическое соединение, содержащееся во многих различных продуктах. Он, пожалуй, наиболее известен как основной компонент уксуса, помимо воды, и считается, что он снабжает такие ингредиенты, как яблочный уксус, многими полезными для здоровья свойствами.
С химической точки зрения формула уксусной кислоты C2h5O2, что также может быть записано как Ch4COOH или Ch4CO2H. Из-за присутствия атома углерода в структуре уксусной кислоты она считается органическим соединением. Плотность уксусной кислоты составляет около 1,05 г/см³; по сравнению с другими соединениями, такими как азотная кислота, серная кислота или муравьиная кислота, плотность уксусной кислоты немного ниже. И наоборот, точка плавления уксусной кислоты значительно выше, чем у многих других кислот, а молярная масса уксусной кислоты и температура кипения уксусной кислоты, как правило, находятся примерно посередине.
Помимо использования в качестве натурального консерванта и распространенного ингредиента в различных продуктах, уксусная кислота также имеет несколько впечатляющих преимуществ для здоровья. Считается, что в дополнение к своим мощным антибактериальным свойствам это органическое соединение снижает уровень сахара в крови, способствует снижению веса, облегчает воспаление и контролирует кровяное давление.
Связанный: Что такое ацетилхолин? Функция, преимущества + дозировка этого нейротрансмиттера
Польза для здоровья
1. Убивает бактерии
Уксус уже давно используется в качестве природного дезинфицирующего средства, в основном из-за содержания в нем уксусной кислоты. Уксусная кислота обладает мощными антибактериальными свойствами и может эффективно уничтожать несколько конкретных штаммов бактерий.
Фактически, одно исследование 2014 года in vitro показало, что уксусная кислота способна блокировать рост миобактерий, рода бактерий, вызывающих туберкулез и проказу. Другие исследования показывают, что уксус может также защищать от роста бактерий, что может быть частично связано с присутствием уксусной кислоты.
2. Снижает кровяное давление
Мало того, что высокое кровяное давление создает дополнительную нагрузку на сердечную мышцу и заставляет ее медленно ослабевать с течением времени, высокое кровяное давление также является основным фактором риска сердечных заболеваний. Многообещающие исследования показали, что помимо изменения диеты и режима упражнений уксусная кислота может также помочь контролировать кровяное давление.
Многообещающие исследования показали, что помимо изменения диеты и режима упражнений уксусная кислота может также помочь контролировать кровяное давление.
Одна модель на животных, проведенная Mitsukan Group Corporation, показала, что уксусная кислота способна снижать кровяное давление у мышей. Считается, что он работает за счет снижения уровня ренина, специфического фермента, выделяемого почками, который участвует в контроле артериального давления.
3. Уменьшает воспаление
Острое воспаление играет важную роль в иммунной функции, помогая защитить организм от болезней и инфекций. Однако длительное поддержание высокого уровня воспаления может иметь пагубные последствия для здоровья, поскольку исследования показывают, что воспаление может способствовать развитию хронических заболеваний, таких как болезни сердца и рак.
Считается, что уксусная кислота уменьшает воспаление и защищает от болезней. Согласно исследованию, опубликованному в  Другое недавнее исследование 2019 года показало, что уксусная кислота помогла уменьшить воспалительную реакцию у мышей, изменив активность определенного белка, участвующего в иммунитете.
Другое недавнее исследование 2019 года показало, что уксусная кислота помогла уменьшить воспалительную реакцию у мышей, изменив активность определенного белка, участвующего в иммунитете.
4. Способствует снижению веса
Некоторые исследования показывают, что уксусная кислота может помочь контролировать вес, способствуя его снижению. Например, в отчете за 2017 год из Малайзии отмечается, что уксусная кислота снижает потребление пищи и массу тела у мышей. Еще одно исследование в
Связанный: Диета с яблочным уксусом: помогает ли она похудеть?
5. Способствует контролю уровня сахара в крови
Яблочный уксус хорошо изучен на предмет его способности поддерживать контроль уровня сахара в крови. Исследования показывают, что уксусная кислота, один из основных компонентов, содержащихся в яблочном уксусе, может играть роль в его мощных свойствах по снижению уровня сахара в крови.
В одном исследовании было обнаружено, что употребление уксуса с уксусной кислотой вместе с едой с высоким содержанием углеводов снижает уровень сахара в крови и уровень инсулина благодаря его способности замедлять опорожнение желудка. В другом исследовании in vitro были получены аналогичные результаты, в которых сообщалось, что уксусная кислота снижает активность нескольких ферментов, участвующих в углеводном обмене, что может уменьшить всасывание углеводов и сахара в тонком кишечнике.
Использование
Для чего используется уксусная кислота? Уксусная кислота чаще всего содержится в уксусе, который используется в рецептах, начиная от заправок для салатов и заканчивая приправами, супами и соусами. Уксус также используется в качестве пищевого консерванта и консерванта. Кроме того, его можно даже использовать для изготовления натуральных чистящих средств, тоников для кожи, спреев от насекомых и многого другого.
Некоторые лекарства содержат уксусную кислоту, в том числе используемые для лечения ушных инфекций. Некоторые также используют его для лечения других заболеваний, включая бородавки, вшей и грибковые инфекции, хотя необходимы дополнительные исследования для оценки его безопасности и эффективности.
Некоторые также используют его для лечения других заболеваний, включая бородавки, вшей и грибковые инфекции, хотя необходимы дополнительные исследования для оценки его безопасности и эффективности.
Уксусная кислота также используется производителями для создания множества различных продуктов. В частности, уксусная кислота используется для производства химических соединений, таких как мономер винилацетата, а также духов, средств гигиены полости рта, средств по уходу за кожей, чернил и красителей.
Риски, побочные эффекты и взаимодействия
Итак, каковы побочные эффекты уксусной кислоты? А вредна ли уксусная кислота для человека?
pH уксусной кислоты, который является мерой того, насколько щелочным или кислым является вещество, падает примерно до 2,4. Хотя он классифицируется как слабая кислота, он все же обладает высокой коррозионной активностью и может вызвать ожог или раздражение кожи при прямом нанесении.
Из-за потенциальной опасности уксусной кислоты часто рекомендуется разбавлять уксус водой перед употреблением или местным применением. Например, перед использованием яблочного уксуса рекомендуется разбавлять его одним стаканом воды на каждые 1–2 столовые ложки. Потребление больших количеств в неразбавленном виде может потенциально вызвать побочные эффекты, такие как жжение в горле, эрозия зубной эмали и раздражение кожи.
Например, перед использованием яблочного уксуса рекомендуется разбавлять его одним стаканом воды на каждые 1–2 столовые ложки. Потребление больших количеств в неразбавленном виде может потенциально вызвать побочные эффекты, такие как жжение в горле, эрозия зубной эмали и раздражение кожи.
При использовании любого вида уксуса в медицинских целях сначала поговорите со своим врачом, если у вас есть какие-либо сопутствующие заболевания или вы принимаете лекарства для предотвращения неблагоприятных взаимодействий. Не забудьте также начать с низкой дозы и постепенно повышать ее, чтобы оценить свою переносимость. Рассмотрите возможность уменьшения дозировки или прекращения использования, если вы заметили какие-либо негативные побочные эффекты, которые могут включать низкий уровень сахара в крови или проблемы с пищеварением.
Последние мысли
- Уксусная кислота представляет собой органическое химическое соединение, которое в основном содержится в уксусе.
- Полезна ли уксусная кислота для здоровья? Некоторые исследования показывают, что уксусная кислота может быть ответственна за многие полезные для здоровья свойства уксуса.


 Молоко налаживает пищеварение?
Молоко налаживает пищеварение?
Leave A Comment