Формула Фенола структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: C6H6O
Рациональная формула: C6H5OH
Химический состав Фенола
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12.011 | 6 | 76,6% |
| H | Водород | 1.008 | 6 | 6,4% |
| O | Кислород | 15.999 | 1 | 17% |
Молекулярная масса: 94,113
Фено́л (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов. Мировое производство фенола на 2006 год составляет 8,3 млн тонн/год. По объёму производства фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ.
Представляет собой бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ (это связано с промежуточным образованием хинонов). Обладает специфическим запахом (таким, как запах гуаши, так как в состав гуаши входит фенол). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Фенол ядовит. Относится к высокоопасным веществам (Класс опасности II). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют. Попадая на кожу, фенол очень быстро всасывается даже через неповреждённые участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Смертельная доза для человека при попадании внутрь 1—10 г, для детей 0,05—0,5 г.
formula-info.ru
C6H5OH
C6H5OH — Phenol Phe nol, n. [Gr. ? to show + ol: cf. F. ph[ e]nol.] (Chem.) 1. A white or pinkish crystalline substance, {C6H5OH}, produced by the destructive distillation of many organic bodies, as wood, coal, etc., and obtained from the heavy oil from… … The Collaborative International Dictionary of English
C6H5OH
Карболовая кислота — C6H5OH, то же, что Фенол; применяется в медицине как антисептическое и дезинфекционное средство … Большая советская энциклопедия
Phenol — This article is about the molecule. For the class of chemicals containing a phenol group, see Phenols. Phenol … Wikipedia
Фенол — Фенол … Википедия
Фенолы — (хим.) представляют ароматические углеводороды (см.), в которых один или несколько атомов водорода бензольного или вообще ароматического ядра замещены гидроксилами (ОН). По числу этих замещающих водород гидроксилов Ф. разделяются на одно , дву ,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
phenol — phenolic /fi noh lik, nol ik/, adj. /fee nawl, nol/, n. Chem. 1. Also called carbolic acid, hydroxybenzene, oxybenzene, phenylic acid. a white, crystalline, water soluble, poisonous mass, C6H5OH, obtained from coal tar, or a hydroxyl derivative… … Universalium
phénol — [ fenɔl ] n. m. • 1843; de phén(o) et ol ♦ Corps composé (C6H5OH), solide cristallisé blanc, soluble dans l eau, corrosif et toxique, à odeur caractéristique, qu on obtient par distillation du goudron de houille ou par synthèse à partir du… … Encyclopédie Universelle
Фенолы — оксипроизводные ароматических соединений (См. Ароматические соединения), содержащие одну или несколько гидроксильных групп (– OH), связанных с атомами углерода ароматического ядра. По числу ОН групп различают одноатомные Ф., например… … Большая советская энциклопедия
Phosphorus — This article is about the chemical element. For other uses, see Phosphorus (disambiguation). silicon ← phosphorus → sulfur … Wikipedia
en.academic.ru
Молекулярная и структурная формула фенола
Фенолы — общее название ароматических спиртов. По своим свойствам вещества являются слабыми кислотами. Важное практическое значение имеют многие гомологи гидроксибензола С6Н50Н (формула фенола) — простейшего представителя класса. Остановимся на этом подробнее.
Фенолы. Общая формула и классификация
Общая формула органических веществ, относящихся к ароматическим спиртам, — R-OH. Молекулы собственно фенолов и крезолов образованы радикалом — фенилом С6Н5, с которым непосредственно соединяется одна или несколько гидроксильных групп OH (оксигрупп). По их числу в молекуле фенолы классифицируются на одно-, двух- и многоатомные. Одноатомными соединениями этого типа являются фенол и крезол. Наиболее распространенные среди многоатомных гидроксибензолов — нафтолы, которые содержат в своем составе 2 конденсированных ядра.
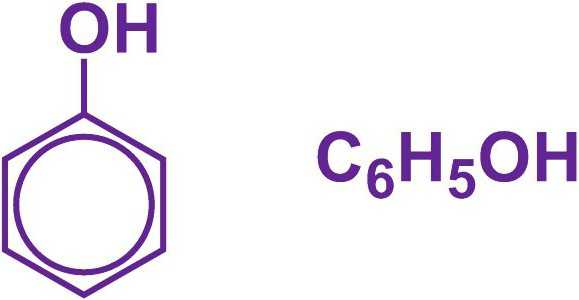
Фенол — представитель ароматических спиртов
Текстильщикам фенол был известен уже в XVIII веке: ткачи использовали его в качестве красителя. При перегонке каменноугольной смолы в 1834 году химик из Германии Ф. Рунге выделил кристаллы этого вещества с характерным сладковатым запахом. Латинское название угля — carbo, поэтому соединение называли карболовой кислотой (карболкой). Немецкому исследователю не удалось определить состав вещества. Молекулярная формула фенола была установлена в 1842 годах О. Лораном, считавшим карболку производным бензола. Для новой кислоты употребляли наименование «фениловая». Шарль Жерар определил, что вещество является спиртом, и назвал его фенолом. Первоначальные области применения соединения — медицина, дубление кож, выпуск синтетических красителей. Характеристики рассматриваемого вещества:
- Рациональная химическая формула — C6H5OH.
- Молекулярная масса соединения — 94,11 а. е. м.
- Брутто-формула, отражающая состав, — C6H6O.

Электронное и пространственное строение молекулы фенола
Циклическую структурную формулу бензола предложил немецкий химик-органик Ф. Кекуле в 1865 году, а незадолго до него — И. Лошмидт. Ученые представляли молекулу органического вещества в виде правильного шестиугольника с чередующимися простыми и двойными связями. По современным представлениям, ароматическое ядро — это особый вид кольцевой структуры, получивший название «сопряженная связь».
Шесть атомов углерода С испытывают процесс sp2-гибридизации электронных орбиталей. Не участвующие в образовании С—С-связей р-электронные облака перекрываются над и под плоскостью ядра молекулы. Возникают две части общего электронного облака, которое охватывает все кольцо. Структурная формула фенола может выглядеть по-разному, учитывая исторический подход к описанию строения бензола. Чтобы подчеркнуть непредельный характер ароматических углеводородов, условно считают двойными три из шести связей, которые перемежаются с тремя простыми.
Поляризация связи в оксигруппе
В простейшем ароматическом углеводороде — бензоле С6Н6 — электронное облако является симметричным. Формула фенола отличается на одну оксигруппу. Присутствие гидроксила нарушает симметрию, что находит отражение в свойствах вещества. Связь между кислородом и водородом в оксигруппе — полярная ковалентная. Смещение общей пары электронов к атому кислорода приводит к возникновению на нем отрицательного заряда (частичного). Водород лишается электрона и приобретает частичный заряд «+». Кроме того, кислород в О—Н-группе является обладателем двух неподеленных электронных пар. Одна из них притягивается электронным облаком ароматического ядра. По этой причине связь становится более поляризованной, атом водорода легче замещается металлами. Модели дают представления о несимметричном характере молекулы фенола.
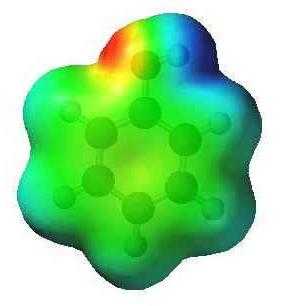
Особенности взаимовлияния атомов в феноле
Единое электронное облако ароматического ядра в молекуле фенола взаимодействует с гидроксильной группой. Происходит явление, получившее название сопряжения, в результате которого собственная пара электронов атома кислорода оксигруппы притягивается к системе бензольного цикла. Снижение отрицательного заряда компенсируется благодаря еще большей поляризации связи в группе О—Н.
В ароматическом ядре также изменяется система электронного распределения. Она понижается на углероде, который связан с кислородом, и повышается у ближайших к нему атомов, находящихся в орто-положениях (2 и 6). Сопряжение вызывает накопление на них заряда «–». Дальнейшее» смещение плотности — движение ее от атомов в мета-положениях (3 и 5) к углероду в пара-положении (4). Формула фенола для удобства изучения сопряжения и взаимовлияния обычно содержит нумерацию атомов бензольного кольца.
Объяснение химических свойств фенола на основе его электронного строения
Процессы сопряжения ароматического ядра и гидроксила сказываются на свойствах обеих частиц и всего вещества. Например, высокая электронная плотность у атомов в орто- и пара-положениях (2, 4, 6) делает С—Н-связи ароматического цикла фенола более реакционноспособными. Снижается отрицательный заряд атомов углерода в мета-положениях (3 и 5). Атаке электрофильных частиц в химических реакциях подвергается углерод, находящийся в орто- и пара-положениях. В реакции бромирования бензола изменения наступают при сильном нагревании и присутствии катализатора. Образуется моногалогенопроизводное — бромбензол. Формула фенола позволяет веществу реагировать с бромом практически мгновенно без нагревания смеси.
Ароматическое ядро влияет на полярность связи в оксигруппе, увеличивая ее. Атом водорода становится подвижнее, по сравнению с предельными спиртами. Фенол реагирует со щелочами, образуя соли – феноляты. Этанол не взаимодействует со щелочами, вернее, продукты реакции — этаноляты — разлагаются. В химическом плане фенолы — более сильные кислоты, чем спирты.
Представители класса ароматических спиртов
Брутто-формула гомолога фенола — крезола (метилфенола, гидрокситолуола) — C7H8O. Вещество в природном сырье часто сопутствует фенолу, тоже обладает антисептическими свойствами. Другие гомологи фенола:
- Пирокатехин (1,2-гидроксибензол). Химическая формула — С6Н4(ОН)2.
- Резорцин (1,3-гидроксибензол) — С6Н4(ОН)2.
- Пирогаллол (1,2,3- тригидроксибензол) — С6Н3(ОН)3.
- Нафтол. Брутто-формула вещества — C10H7OH. Применяется в производстве красителей, медикаментов, душистых соединений.
- Тимол (2-изопропил-5-метилфенол). Химическая формула — C6H3CH3(OH)(C3H7). Применяется в химии органического синтеза, медицине.
- Ванилин, кроме фенольного радикала, содержит простую эфирную группу и остаток альдегида. Брутто-формула соединения — C8H8O3. Ванилин широко используется как искусственная отдушка.
Формула реактива для распознавания фенолов
Качественное определение фенола можно проводить с помощью брома. В результате реакции замещения выпадает белый осадок трибромфенола. Пирокатехин (1,2-гидроксибензол) окрашивается в зеленый цвет в присутствии растворенного хлорида трехвалентного железа. С этим же реагентом вступает в химическую реакцию фенол, и образуется трифенолят, обладающий фиолетовым цветом. Качественная реакция на резорцин — появление темно-фиолетового окрашивания в присутствии хлорида трехвалентного железа. Постепенно цвет раствора становится черным. Формула реактива, который служит для распознавания фенола и некоторых его гомологов, — FeCl3 (хлорид железа (III)).
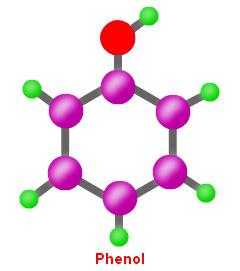
Гидроксибензол, нафтол, тимол — это все фенолы. Общая формула и состав веществ позволяет определить принадлежность этих соединение к ароматическому ряду. Все органические вещества, содержащие в своей формуле фенильный радикал С6Н5, с которым непосредственно связаны оксигруппы, проявляют особые свойства. От спиртов они отличаются лучше выраженным кислотным характером. По сравнению с веществами гомологического ряда бензола, фенолы — более активные химические соединения.
fb.ru
Фенол (гидроксибензол, карболовая кислота)
В свою очередь, Фено́лы — это класс органических соединений ароматического ряда, в молекулах которых гидроксильные группы OH− связаны с атомами углерода ароматического кольца.
По числу гидроксильных групп различают :
- одноатомные фенолы (аренолы): фенол и его гомологи;
- двухатомные фенолы (арендиолы): пирокатехин, резорцин, гидрохинон;
- трёхатомные фенолы (арентриолы): пирогаллол, гидроксигидрохинон, флороглюцин;
- многоатомные фенолы.
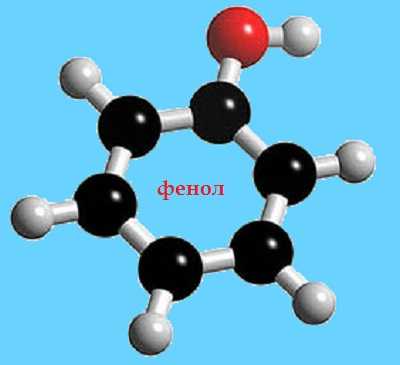 Соответственно, собственно фенол, как вещество, представляет собой простейший представитель группы фенолов и имеет одно ароматическое ядро и одну гидроксильную группу ОН.
Соответственно, собственно фенол, как вещество, представляет собой простейший представитель группы фенолов и имеет одно ароматическое ядро и одну гидроксильную группу ОН.
Свойства фенола
Свежеперегнанный фенол представляет собой бесцветные игольчатые кристаллы с температурой плавления 41 °С и температурой кипения 182 °С. При хранении, особенно во влажной атмосфере и в присутствии небольших количеств солей железа и меди, он быстро приобретает красную окраску. Фенол смешивается в любых соотношениях со спиртом, водой (при нагревании свыше
Из-за наличия -OH гидроксильной группы, фенол имеет химические свойства характерные для спиртов, так и ароматических углеводородов.
По гидроксильной группе фенол вступает в следующие реакции:
- Так как фенол обладает немного более сильными кислотными свойствами, чем у спирты, то под воздействием щелочей он образует соли — феноляты (к примеру, фенолят натрия — C6H5ONa):
C6H5OH + NaOH -> C6H5ONa + H2O
- В результате взаимодействия фенола с металлическим натрием также получается фенолят натрия:
2C6H5OH + 2Na -> 2C6H5ONa + H2
- Фенол непосредственно не этерифицируется карбоновыми кислотами, получение эфиров осуществляют путем взаимодействия фенолятов с ангидридами или галогенангидридами кислот:
C6H5OH + CH3COOH -> C6H5OCOCH3 + NaCl
- При перегонке фенола с цинковой пылью идет реакция замещения гидроксильной группы водородом:
C6H5OH + Zn -> C
Реакции фенола по ароматическому кольцу:
- Фенол вступает в реакции электрофильного замещения по ароматическому кольцу. Группа ОН, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в орто- и пара-положения. Фенол легко алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
- Реакция Кольбе — Шмитта служит для синтеза салициловой кислоты и её производных (ацетилсалициловой кислоты и других).
C6H5OH + CO
C6H4OH(COONa) –h3SO4-> C6H4OH(COOH)
Качественные реакции на фенол:
- В результате взаимодействия с бромной водой:
C6H5OH + 3Br2 -> C6H2Br3OH +3HBr
- образуется 2,4,6-трибромфенол — твёрдое вещество белого цвета.
- С концентрированной азотной кислотой:
C6H5OH + 3HNO3 -> C6H2(NO2)3OH + 3H2
- С хлоридом железа(III) (качественная реакция на фенол):
C6H5OH + FeCl3 -> ⌈Fe(C6H5OH)6⌉Cl3
Реакция присоединения
- Гидрированием фенола в присутствии металлических катализаторов Pt/Pd, Pd/Ni, получают циклогексиловый спирт:
C6H5OH -> C6H11OH
Окисление фенола
Вследствие наличия гидроксильной группы в молекуле фенола, устойчивость к окислению много ниже нежели, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты.
- Так под действием перекиси водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
C6H5OH + 2H2O2 – Fe> C6H4(OH)2
- При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
Получение фенола
Получают фенол из каменноугольной смолы (продукта коксования) и синтетическим путем.
В каменноугольной смоле коксохимического производства содержится от 0,01 до 0,1% фенолов, в продуктах полукоксования от 0,5 до 0,7%; в масле, образующемся при гидрогенизации, и в сточной воде, вместе взятых,— от 0,8 до 3,7%. В смоле бурого угля и сточных водах полукоксования содержится от 0,1 до 0,4% фенолов. Каменноугольную смолу перегоняют, отбирая фенольную фракцию, выкипающую при 160—250 °С. В состав фенольной фракции входят фенол и его гомологи (25—40%), нафталин (25—40%) и органические основания (пиридин, хинолин). Нафталин отделяют фильтрованием, а оставшуюся часть фракции обрабатывают 10—14%-ным раствором едкого натра.
Образовавшиеся феноляты отделяют от нейтральных масел и пиридиновых оснований путем продувки острым паром, а затем обрабатывают диоксидом углерода. Выделенные сырые фенолы подвергают ректификации, отбирая последовательно фенол, крезолы и ксиленолы.
Большая часть фенола, производимого в настоящее время в промышленном масштабе, получается различными синтетическими методами
Синтетические методы получения фенола
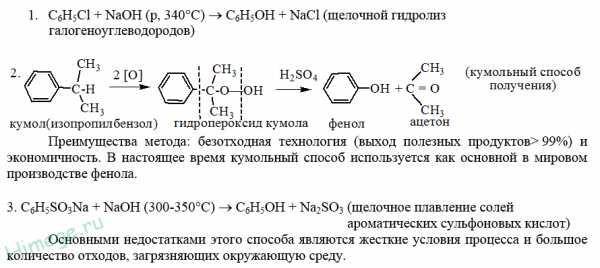
- По бензолсульфонатному методу бензол смешивают с купоросным маслом. Полученный продукт обрабатывают содой и получают натриевую соль бензолсульфокислоты, после чего раствор упаривают, отделяют выпавший сульфат натрия, а натриевую соль бензолсульфокислоты сплавляют со щелочью. Образовавшийся фенолят натрия либо насыщайте диоксидом углерода, либо добавляют серную кислоту до начала выделения диоксида серы и отгоняют фенол.
- Хлорбензольный метод заключается в прямом хлорировании бензола газообразным хлором в присутствии железа или его солей и омылении образующегося хлорбензола раствором едкого натра или при гидролизе в присутствии катализатора.
- Модифицированный метод Рашига основан на окислительном хлорировании бензола хлористым водородом и воздухом с последующим гидролизом хлорбензола и выделением фенола перегонкой.
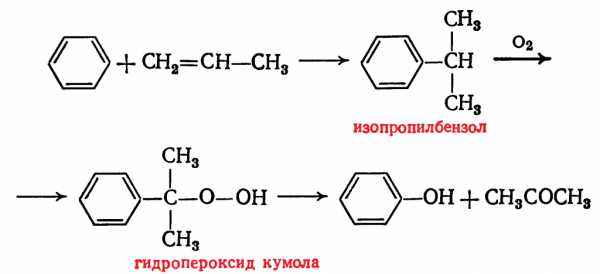
- Кумольный метод заключается в алкилировании бензола, окислении полученного изопропилбензола в гидропероксид кумола и последующем разложении его на фенол и ацетон:
 Изопропилбензол получают действием на бензол чистого пропилена или пропан-пропиленовой фракции нефтекрекинга, очищенной от других ненасыщенных соединений, влаги, меркаптанов и сероводорода, отравляющих катализатор. В качестве катализатора используют трихлорид алюминия, растворенный в полиалкилбензоле, например. в диизопропилбензоле. Алкилирование ведут при 85 °С и избыточном давлении 0,5 МПа, что обеспечивает протекание процесса в жидкой фазе. Изопропилбензол окисляют в гидропероксид кислородом воздуха или техническим кислородом при 110—130°С в присутствии солей металлов переменной валентности (железо, никель, кобальт, марганец) Разлагают гидропероксид разбавленными кислотами (серной или фосфорной) или небольшими количествами концентрированной серной кислоты при 30—60 °С. После ректификации получают фенол, ацетон и некоторое количество α-метилстирола. Промышленный кумольный метод, разработанный в СССР, является экономически наиболее выгодным по сравнению с другими методами получения фенола. Получение фенола через бензолсульфокислоту связано с расходованием больших количеств хлора и щелочи. Окислительное хлорирование бензола связано с большим расходом пара—в 3—6 раз большим, чем при применении других методов; кроме того, при хлорировании происходит сильная коррозия аппаратуры, что требует применения специальных материалов. Кумольный метод прост по аппаратурному оформлению и позволяет получать одновременно два технически ценных продукта: фенол и ацетон.
Изопропилбензол получают действием на бензол чистого пропилена или пропан-пропиленовой фракции нефтекрекинга, очищенной от других ненасыщенных соединений, влаги, меркаптанов и сероводорода, отравляющих катализатор. В качестве катализатора используют трихлорид алюминия, растворенный в полиалкилбензоле, например. в диизопропилбензоле. Алкилирование ведут при 85 °С и избыточном давлении 0,5 МПа, что обеспечивает протекание процесса в жидкой фазе. Изопропилбензол окисляют в гидропероксид кислородом воздуха или техническим кислородом при 110—130°С в присутствии солей металлов переменной валентности (железо, никель, кобальт, марганец) Разлагают гидропероксид разбавленными кислотами (серной или фосфорной) или небольшими количествами концентрированной серной кислоты при 30—60 °С. После ректификации получают фенол, ацетон и некоторое количество α-метилстирола. Промышленный кумольный метод, разработанный в СССР, является экономически наиболее выгодным по сравнению с другими методами получения фенола. Получение фенола через бензолсульфокислоту связано с расходованием больших количеств хлора и щелочи. Окислительное хлорирование бензола связано с большим расходом пара—в 3—6 раз большим, чем при применении других методов; кроме того, при хлорировании происходит сильная коррозия аппаратуры, что требует применения специальных материалов. Кумольный метод прост по аппаратурному оформлению и позволяет получать одновременно два технически ценных продукта: фенол и ацетон. - При окислительном декарбоксилировании бензойной кислоты сначала проводят жидкофазное каталитическое окисление толуола в бензойную кислоту, которая в присутствии Сu2+ превращается в бензолсалициловую кислоту. Этот процесс может быть описан следующей схемой: Бензоилсалициловая кислота разлагается водяным паром на салициловую и бензойные кислоты. Фенол образуется в результате быстрого декарбоксилирования салициловой кислоты.
Применение фенола
Фенол используют как сырье для производства полимеров: поликарбоната и эпоксидных смол (сначала синтезируют бисфенол А, а затем – эти полимеры), фенолфольмальдегидных смол, циклогексанола (с последующим получением нейлона и капрона).
В процессе нефтепереработки при помощи фенола проводят очистку масел от смолистых веществ, серосодержащих соединений и полициклических ароматических углеводородов.
Кроме того, фенол служит сырьем для производства ионола, неонолов (ПАВ), креозолов, аспирина, антисептиков и пестицидов.
Фенол хороший консервант и антисептик. Его используют для дезинфекции в животноводстве, в медицине, в косметологии.
Токсические свойства фенола
Фенол токсичен (класс опасности II). При вдыхании фенола нарушаются функций нервной системы. Пыль, пары и раствор фенола при попадании на слизистые оболочки глаз, дыхательных путей, кожу, вызывают химические ожоги. При попадании на кожу фенол всасывается в течение нескольких минут и начинает воздействовать на ЦНС. В больших дозах может вызывать паралич дыхательного центра.Смертельная доза для человека при попадании внутрь 1—10 г, для детей 0,05—0,5 г.
mplast.by
Получение фенола. Строение, свойства и применение фенола :: SYL.ru
Фенолы – это простые органические вещества, образованные на основе бензола. При нормальных условиях представляют собой твердые ядовитые вещества, обладающие специфическим ароматом. В современной промышленности эти химические соединения играют далеко не последнюю роль. По объемам использования фенол и его производные входят в двадцатку наиболее востребованных химических соединений в мире. Они широко применяются в химической и легкой промышленности, фармацевтике и энергетике. Поэтому получение фенола в промышленных масштабах – одна из основных задач химической промышленности.
Обозначения фенола
Первоначальное название фенола – карболовая кислота. Позднее данное соединение поучило название «фенол». Формула этого вещества представлена на рисунке:
Нумерация атомов фенола ведется от того атома углерода, который соединен с гидроксогруппой ОН. Последовательность продолжается в таком порядке, чтобы другие замещенные атомы получили наименьшие номера. Производные фенола существуют в виде трех элементов, характеристики которых объясняются различием их структурных изомеров. Различные орто-, мета-, паракрезолы являются лишь видоизменением основной структуры соединения бензольного кольца и гидроксильной группы, базовая комбинация которой и представляет собой фенол. Формула этого вещества в химической записи выглядит как C6H5OH.
Физические свойства фенола
Визуально фенол представляет собой твердые бесцветные кристаллы. На открытом воздухе они окисляются, придавая веществу характерный розовый оттенок. При нормальных условиях фенол довольно плохо растворяется в воде, но с повышением температуры до 70о этот показатель резко возрастает. В щелочных растворах это вещество растворимо в любых количествах и при любых температурах.
 Эти свойства сохраняются и в других соединениях, основным компонентом которых являются фенолы.
Эти свойства сохраняются и в других соединениях, основным компонентом которых являются фенолы.Химические свойства
Уникальные свойства фенола объясняются его внутренней структурой. В молекуле этого химического вещества р-орбиталь кислорода образует единую п-систему с бензольным кольцом. Такое плотное взаимодействие повышает электронную плотность ароматического кольца и понижает этот показатель у атома кислорода. При этом полярность связей гидроксогруппы значительно увеличивается, и водород, входящий в ее состав, легко замещается любым щелочным металлом. Так образуются различные феноляты. Эти соединения не разлагаются водой, как алкоголяты, но их растворы очень похожи на соли сильных оснований и слабых кислот, поэтому они имеют достаточно выраженную щелочную реакцию. Феноляты взаимодействуют с различными кислотами, в результате реакции восстанавливаются фенолы. Химические свойства этого соединения позволяют ему взаимодействовать с кислотами, образуя при этом сложные эфиры. Например, взаимодействие фенола и уксусной кислоты приводит к образованию финилового эфира (фениацетата).
Широко известна реакция нитрирования, в которой под воздействием 20% азотной кислоты фенол образует смесь пара- и ортонитрофенолов. Если воздействовать на фенол концентрированной азотной кислотой, то получается 2,4,6-тринитрофенол, который иногда называют пикриновой кислотой.
Фенол в природе
Как самостоятельное вещество фенол в природе содержится в каменноугольной смоле и в отдельных сортах нефти. Но для промышленных нужд это количество не играет никакой роли. Поэтому получение фенола искусственным способом стало приоритетной задачей для многих поколений ученых. К счастью, эту проблему удалось разрешить и получить в итоге искусственный фенол.
Свойства, получение
Применение различных галогенов позволяет получать феноляты, из которых при дальнейшей обработке образуется бензол. Например, нагревание гидроксида натрия и хлорбензола позволяет получить натрия фенолят, который при воздействии кислоты распадается на соль, воду и фенол. Формула такой реакции приведена здесь:
С6Н5-CI + 2NaOH -> С6Н5-ONa + NaCl + Н2O
Ароматические сульфокислоты также являются источником для получения бензола. Химическая реакция проводится при одновременном плавлении щелочи и сульфокислоты. Как видно из реакции, сначала образуются феноксиды. При обработке сильными кислотами они восстанавливаются до многоатомных фенолов.
Фенол в промышленности
В теории, получение фенола самым простым и многообещающим способом выглядит таким образом: при помощи катализатора бензол окисляют кислородом. Но до сих пор катализатор для этой реакции так и не был подобран. Поэтому в настоящее время в промышленности используются другие методы.
Непрерывный промышленный способ получения фенола состоит во взаимодействии хлорбензола и 7% раствора едкого натра. Полученную смесь пропускают через полуторакилометровую систему труб, нагретых до температуры в 300 С. Под воздействием температуры и поддерживаемого высокого давления исходные вещества вступают в реакцию, в результате которой получат 2,4-динитрофенол и другие продукты.
Не так давно был разработан промышленный способ получения фенолсодержащих веществ кумольным методом. Этот процесс состоит из двух этапов. Сначала из бензола получают изопропилбензол (кумол). Для этого бензол алкируют с помощью пропилена. Реакция выглядит следующим образом:
После этого кумол окисляют кислородом. На выходе второй реакции получают фенол и другой важный продукт — ацетон.
Получение фенола в промышленных масштабах возможно из толуола. Для этого толуол окисляется на кислороде, содержащемся в воздухе. Реакция протекает в присутствии катализатора.
Примеры фенолов
Ближайшие гомологи фенолов называются крезолами.
Существуют три разновидности крезолов. Мета-крезол при нормальных условиях представляет собой жидкость, пара-крезол и орто-крезол – твердые вещества. Все крезолы плохо растворяются в воде, а по своим химическим свойствами они почти аналогичны фенолу. В естественном виде крезолы содержатся в каменноугольной смоле, в промышленности их применяют при производстве красителей, некоторых видов пластмасс.
Примерами двухатомных фенолов могут служить пара-, орто- и мета-гидробензолы. Все они представляют собой твердые вещества, легко растворимые в воде.
Единственный представитель трехатомного фенола – пирогаллол (1,2,3-тригидроксибензол). Его формула представлена ниже.
Пирогаллол является довольно сильным восстановителем. Он легко окисляется, поэтому его используют для получения очищенных от кислорода газов. Это вещество хорошо известно фотографам, его используют как проявитель.
www.syl.ru
Фенолы — номенклатура, получение, химические свойства » HimEge.ru
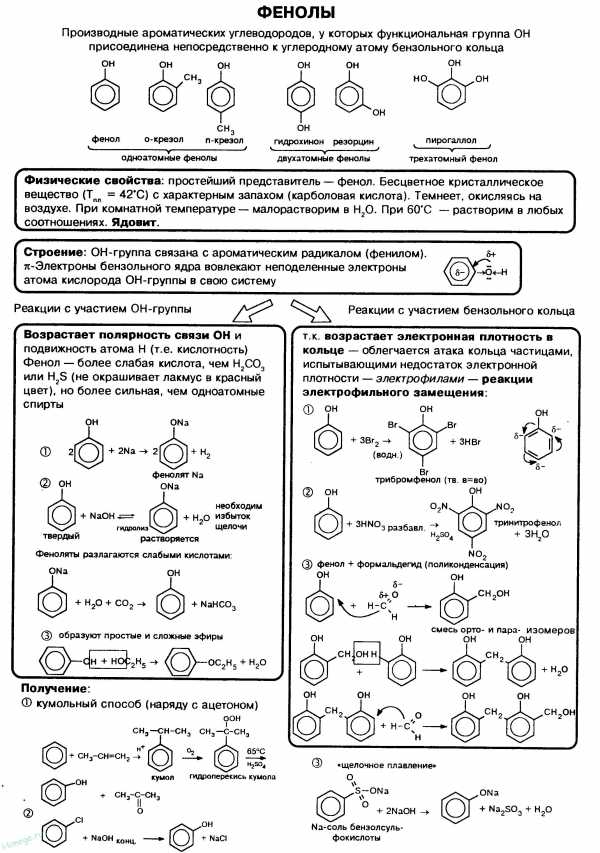
Фенолы — органические вещества,молекулы которых содержат радикал фенил,связанный с одной или несколькими гидроксогруппами. Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
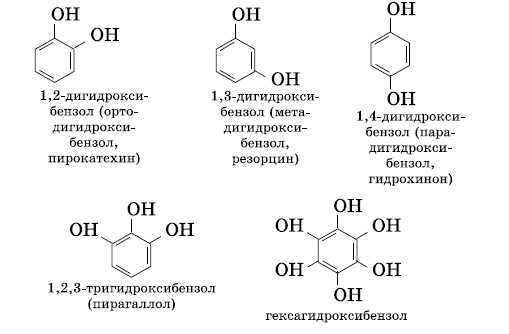
Существуют и многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Познакомимся поподробнее со строением и свойствами простейшего представителя этого класса- фенолом С6Н5ОН . Название этого вещества и легло в основу в основу названия всего касса — фенолы.
Физические свойства фенола
Фенол-твердое, бесцветное кристаллическое вещества, t°плавления=43°С, t°кипения=181°С, с резким характерным запахом.Ядовит.Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой.При попадании на кожу он вызывает ожоги,поэтому с фенолом нужно обращаться очень осторожно!
Химические свойства фенола
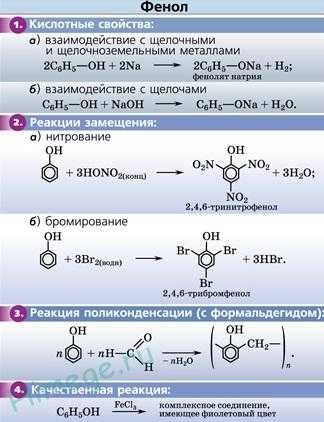
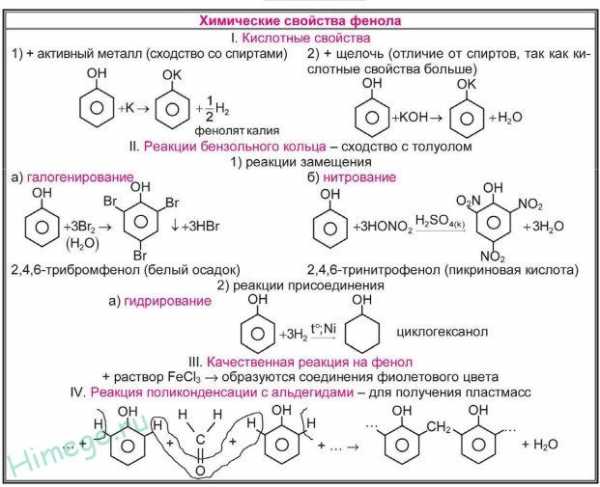
Фенолы в большинстве реакций по связи О–Н активнее спиртов, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие неподеленной электронной пары атома кислорода в системе p-сопряжения). Кислотность фенолов значительно выше, чем спиртов. Для фенолов реакции разрыва связи С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы)
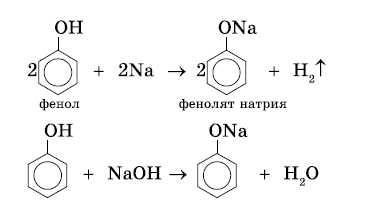
Кислотные свойства фенола
Атом водорода гидроксильной группы обладает кислотным характером. Т.к. кислотные свойства у фенола выражены сильнее, чем у воды и спиртов, то фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Кислотность фенолов зависит от природы заместителей (донор или акцептор электронной плотности), положения относительно ОН-группы и от количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры увеличивают прочность связи О-Н (тем самым уменьшая подвижность водорода и кислотные свойства), акцепторы уменьшают прочность связи О-Н, при этом кислотность возрастает:
Однако кислотные свойства у фенола выражены слабее, чем у неорганический и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше,чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
Качественная реакция на фенол
Фенол реагирует с хлоридом железа (3) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах.Другие фенолы,содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа(3).
Реакции бензольного кольца фенола
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
- Бромирование фенола. В отличие от бензола для бромирования фенола не требуется добавление катализатора (бромид железа(3)). Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и пара-положения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же как и реакция с хлоридом железа(3), служит для качественного обнаружения фенола.
2. Нитрирование фенола также происходит легче, чем нитрирование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пароизомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется 2,4,6, тринитритфенол-пикриновая кислота, взрывчатое вещество:
3. Гидрирование ароматического ядра фенола в присутствии катализатора проходит легко:
4. Поликонденсация фенола с альдегидами, в частности, с формальдегидом происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
В молекуле димера сохраняются «подвижные» атомы водорода, а значит,возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
Реакция поликонденсаци, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта(воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение этой же реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде.В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимера на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению,действию воды, щелочей, кислот.Они обладают высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин,полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы,сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе.Таким образом, фенол и продукты на его основе находят широкое применение.
Получение фенола
Применение фенолов
Фенол — твердое вещество, с характерным запахом, вызывает ожоги при попадании на кожу. Ядовит. Растворяется в воде, его раствор называют карболовой кислотой (антисептик). Она была первым антисептиком введенным в хирургию. Широко используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ.
himege.ru
| Класс соединения | Общая формула | Примеры соединений, системати-ческое название и пояснение | Тривиальные названия |
|
Предельные
одноатомные спирты |
CnH2n+1 OH
CnH2n+2O R─ OH |
CH3OHметанол |
метиловый спирт древесный спирт |
| C2H5OHэтанол | этиловый спирт | ||
|
Непредельные
одноатомные спирты |
CnH2n-1 OH |
CH2═ CH─CH2─OH пропен-2-ол-1 |
аллиловый спирт |
|
Предельные
многоатомные спирты |
CH2 ─ CH2 этандиол-1,2 | | OH OH |
этиленгликоль | |
|
CH2 ─ CH ─ CH2 | | | OH OH OH пропантриол-1,2,3 |
глицерин | ||
| Фенолы | C6H5OH Фенол гидроксибензол | карболовая кислота |
|
|
C6H4(CH3)OH 2-метилфенол
1-гидрокси-2-метилбензол |
орто-крезол (о- крезол) |
||
|
C6H4(CH3)OH 3-метилфенол
1-гидрокси-3-метилбензол |
мета-крезол (м- крезол) |
||
|
C6H4(CH3)OH 4-метилфенол
1-гидрокси-4-метилбензол |
пара-крезол (п- крезол) |
||
|
Ароматические
спирты |
C6H5─CH2 ─ OH фенилиметанол |
бензиловый спирт |
biofile.ru

 Изопропилбензол получают действием на бензол чистого пропилена или пропан-пропиленовой фракции нефтекрекинга, очищенной от других ненасыщенных соединений, влаги, меркаптанов и сероводорода, отравляющих катализатор. В качестве катализатора используют трихлорид алюминия, растворенный в полиалкилбензоле, например. в диизопропилбензоле. Алкилирование ведут при 85 °С и избыточном давлении 0,5 МПа, что обеспечивает протекание процесса в жидкой фазе. Изопропилбензол окисляют в гидропероксид кислородом воздуха или техническим кислородом при 110—130°С в присутствии солей металлов переменной валентности (железо, никель, кобальт, марганец) Разлагают гидропероксид разбавленными кислотами (серной или фосфорной) или небольшими количествами концентрированной серной кислоты при 30—60 °С. После ректификации получают фенол, ацетон и некоторое количество α-метилстирола. Промышленный кумольный метод, разработанный в СССР, является экономически наиболее выгодным по сравнению с другими методами получения фенола. Получение фенола через бензолсульфокислоту связано с расходованием больших количеств хлора и щелочи. Окислительное хлорирование бензола связано с большим расходом пара—в 3—6 раз большим, чем при применении других методов; кроме того, при хлорировании происходит сильная коррозия аппаратуры, что требует применения специальных материалов. Кумольный метод прост по аппаратурному оформлению и позволяет получать одновременно два технически ценных продукта: фенол и ацетон.
Изопропилбензол получают действием на бензол чистого пропилена или пропан-пропиленовой фракции нефтекрекинга, очищенной от других ненасыщенных соединений, влаги, меркаптанов и сероводорода, отравляющих катализатор. В качестве катализатора используют трихлорид алюминия, растворенный в полиалкилбензоле, например. в диизопропилбензоле. Алкилирование ведут при 85 °С и избыточном давлении 0,5 МПа, что обеспечивает протекание процесса в жидкой фазе. Изопропилбензол окисляют в гидропероксид кислородом воздуха или техническим кислородом при 110—130°С в присутствии солей металлов переменной валентности (железо, никель, кобальт, марганец) Разлагают гидропероксид разбавленными кислотами (серной или фосфорной) или небольшими количествами концентрированной серной кислоты при 30—60 °С. После ректификации получают фенол, ацетон и некоторое количество α-метилстирола. Промышленный кумольный метод, разработанный в СССР, является экономически наиболее выгодным по сравнению с другими методами получения фенола. Получение фенола через бензолсульфокислоту связано с расходованием больших количеств хлора и щелочи. Окислительное хлорирование бензола связано с большим расходом пара—в 3—6 раз большим, чем при применении других методов; кроме того, при хлорировании происходит сильная коррозия аппаратуры, что требует применения специальных материалов. Кумольный метод прост по аппаратурному оформлению и позволяет получать одновременно два технически ценных продукта: фенол и ацетон.
Leave A Comment