Исследование превращения метана и циклогексана в тлеющем и микроволновом разрядах методом матричной ИК-спектроскопии
%PDF-1.6 % 1 0 obj > endobj 5 0 obj /Title >> endobj 2 0 obj > /Encoding > >> >> endobj 3 0 obj > endobj 4 0 obj > stream

Ch5, C2H6, C3H8, C4h20, C5h22, C6h24
Чистые газы/вещества
- Метан [CH4]
- Этан [C2H6]
- Пропан [C3H8]
- Бутан [C4H10]
- Пентан [C5H12]
- Гексан [C6H14]
- Чистые вещества (газы) доступные для заказа
| Марка | 5.0 | 4.5 | 4.0 | 3.5 | 3.0 | 2.5 | 2.0 |
| Молярная доля, % | 99.999 | 99.995 — 99.998 | 99.99 — 99.994 | 99.95 — 99.8 | 99.9 — 99.94 | 99.5 — 99.8 | 99.0 — 99.4 |
Метан [Ch5]
| Марка | Концентрация, молярная доля, % |
Примеси, молярная доля, % |
5. 0 0 |
99.999 | N2+O2 C2H6+C3H8 CO2 |
| 4.5 | 99.995 — 99.998 | N2+O2 C2H6+C3H8 CO2 |
| 4.0 | 99.990 — 99.994 | N2+O2 C2H6+C3H8 CO2 |
| 3.5 | 99.95 — 99.98 | N2+O2 C2H6+C3H8 CO2 |
| 3.0 | 99.9 — 99.94 | N2+O2 C2H6+C3H8 |
Этан [C2H6]
| Марка | Концентрация, молярная доля, % |
Примеси, молярная доля, % |
| 5.0 | 99.999 | N2+O2 другие УВ CO+CO2 h3O |
| 4.5 | 99.995 — 99.998 | N2+O2 другие УВ CO+CO2 h3O |
4. 0 0 |
99.990 — 99.994 | N2+O2 другие УВ CO+CO2 h3O |
| 3.5 | 99.95 — 99.98 | N2+O2 другие УВ CO+CO2 h30 |
| 3.0 | 99.9 — 99.94 | N2+O2 другие УВ CO+CO2 h30 |
Пропан [C3H8]
| Марка | Концентрация, молярная доля, % |
Примеси, |
| 4.0 | 99.990 — 99.994 | N2 другие УВ C3H6 h3+O2 h3O |
| 3.5 | 99.95 — 99.98 | N2 другие УВ C3H6 O2 CO2 h3O |
| 3.0 | 99.9 — 99.94 | N2 другие УВ C3H6 O2+h3 h3O |
2. 5 5 |
99.5 — 99.8 | N2 другие УВ C3H6 O2 CO2 h3O |
Бутан [C4h20]
| Марка | Концентрация, молярная доля, % |
Примеси, молярная доля, % |
| 4.0 | 99.990 — 99.994 | N2 другие УВ O2 h3O |
| 3.5 | 99.95 — 99.98 | N2 другие УВ O2 h3O |
| 3.0 | 99.9 — 99.94 | N2 другие УВ O2 h3O |
| 2.5 | 99.5 — 99.8 | N2 другие УВ O2 h3O |
| 2.0 | 99.0 — 99.4 | N2 другие УВ O2 h3O |
Пентан [C5h22]
| Марка | Концентрация, молярная доля, % |
Примеси, молярная доля, % |
3. 0 0 |
99.9 — 99.94 | h3O другие примеси |
| 2.5 | 99.5 — 99.8 | h3O другие примеси |
| 2.0 | 99.0 — 99.4 | h3O другие примеси |
Гексан [C6h24]
| Марка | Концентрация, молярная доля, % |
Примеси, молярная доля, % |
| 3.5 (%) | 99.95 — 99.98 | h3O сульфиды другие примеси |
Процесс решения
Процесс решенияПроцесс решения
Что такое решение?
Растворы – гомогенные смеси двух или более чистых веществ. Для наших целей мы обычно будем обсуждать растворы, содержащие одно растворенное вещество и воду в качестве растворителя. Что такое растворитель? Грубо говоря, это молекула в смеси с наибольшей концентрацией.
Когда мы помещаем растворенные вещества и растворители вместе, происходит то, что мы называем процессом решения. Вы можете думать об этом как о том, что вы испытали бы, если бы попытались втиснуться в уже переполненный лифт. Каждый должен приспособиться, чтобы снова «найти свое пространство». Теперь, как и в лифте, молекулы будут приспосабливаться по-разному в зависимости от типа молекулы, совершающей вход. И также, как в лифте, наступит момент, когда больше нельзя будет добавить людей. Для раствора эта точка называется точкой насыщения, а само решение называется
Вообще говоря, в воде растворяются только определенные молекулы. Старая фраза «подобное растворяется в подобном» или «одного поля ягоды слетаются в стаи» очень верна в отношении того, в какой степени растворенные вещества растворимы или смешиваемы в разных растворителях. При очень низких концентрациях почти все молекулы частично растворимы во всех растворителях. Но по тенденции ионные и полярные растворенные вещества более растворимы в полярных растворителях, а неполярные молекулы растворимы в неполярных (в основном органических) растворителях. Единицы концентрации, которые мы только что обсуждали, используются для описания степени растворимости растворенного вещества в растворителе.
Старая фраза «подобное растворяется в подобном» или «одного поля ягоды слетаются в стаи» очень верна в отношении того, в какой степени растворенные вещества растворимы или смешиваемы в разных растворителях. При очень низких концентрациях почти все молекулы частично растворимы во всех растворителях. Но по тенденции ионные и полярные растворенные вещества более растворимы в полярных растворителях, а неполярные молекулы растворимы в неполярных (в основном органических) растворителях. Единицы концентрации, которые мы только что обсуждали, используются для описания степени растворимости растворенного вещества в растворителе.
Когда вы помещаете неполярную молекулу в полярный растворитель (например, масло в воду), молекулы пытаются свести к минимуму поверхностный контакт между собой. (как ты и парень с простудой в лифте). На самом деле это основа клеток нашего тела. Липиды (маслянистые жирные кислоты) образуют наши клеточные мембраны, так что их неполярные хвосты обращены внутрь от полярной цитоплазмы, а полярные головки обращены к полярной цитоплазме.
Почему формируются решения?
Хотя большая часть объяснений того, почему одни вещества смешиваются и образуют растворы, а другие — нет, выходит за рамки этого класса, мы можем получить представление о том, почему образуются растворы, взглянув на процесс, посредством которого этанол, C 2 H 5 OH, растворяется в воде. Этанол на самом деле смешивается с водой, а это означает, что две жидкости можно смешивать в любой пропорции без ограничения их растворимости. Многое из того, что мы сейчас знаем о тенденции частиц к более рассеянному, также может быть использовано для понимания такого рода изменений.
Представьте себе слой этанола, осторожно добавляемый поверх небольшого количества воды (рисунок ниже). Поскольку частицы жидкости постоянно движутся, часть частиц этанола на границе между двумя жидкостями немедленно перейдет в воду, а часть молекул воды перейдет в этанол. В этом процессе притяжение вода-вода и этанол-этанол нарушается и формируется притяжение этанол-вода. Поскольку и этанол, и вода являются молекулярными веществами со связями O-H, притяжение, нарушенное между молекулами воды, и притяжение, нарушенное между молекулами этанола, представляют собой водородные связи. Притяжения, которые образуются между молекулами этанола и воды, также являются водородными связями (рисунок ниже).
В этом процессе притяжение вода-вода и этанол-этанол нарушается и формируется притяжение этанол-вода. Поскольку и этанол, и вода являются молекулярными веществами со связями O-H, притяжение, нарушенное между молекулами воды, и притяжение, нарушенное между молекулами этанола, представляют собой водородные связи. Притяжения, которые образуются между молекулами этанола и воды, также являются водородными связями (рисунок ниже).
Поскольку притяжение между частицами очень похоже, свобода движения молекул этанола в водном растворе примерно такая же, как их свобода движения в чистом этаноле. То же самое можно сказать и о воде. Из-за этой свободы движения обе жидкости будут растекаться, чтобы заполнить общий объем объединенных жидкостей. Таким образом, они перейдут в наиболее вероятное, наиболее рассредоточенное доступное состояние, в состояние полного смешения. Существует гораздо больше возможных вариантов расположения этой системы, когда молекулы этанола и воды рассредоточены по всему раствору, чем когда они ограничены отдельными слоями. (Рисунок ниже).
(Рисунок ниже).
Теперь мы можем объяснить, почему охлаждающие жидкости автомобильных радиаторов растворяются в воде. Охлаждающие жидкости обычно содержат либо этиленгликоль, либо пропиленгликоль, которые, подобно этанолу и воде, содержат водородные связи O-H.
Эти вещества легко смешиваются с водой по той же причине, по которой этанол легко смешивается с водой. Притяжения, разрываемые при смешении, представляют собой водородные связи, а образующиеся притяжения также являются водородными связями. Нет никакой причины, по которой частицы каждой жидкости не могли бы свободно перемещаться из одной жидкости в другую и поэтому смещались бы в сторону наиболее вероятного (наиболее дисперсного) смешанного состояния.
Почему углеводороды нерастворимы в воде?
У нас другая ситуация, когда мы пытаемся смешать гексан, C 6 H 14 и воду. Если мы добавим гексан в воду, гексан будет плавать на поверхности воды без видимого перемешивания. Причины, по которым гексан и вода не смешиваются, сложны, но следующее дает вам некоторое представление о том, почему гексан нерастворим в воде.
Причины, по которым гексан и вода не смешиваются, сложны, но следующее дает вам некоторое представление о том, почему гексан нерастворим в воде.
На самом деле происходит очень незначительное смешивание молекул гексана и воды. Естественная тенденция к рассеиванию приводит к тому, что некоторые молекулы гексана перемещаются в воду, а некоторые молекулы воды — в гексан. При движении молекулы гексана в воду разрываются силы Лондона между молекулами гексана и водородные связи между молекулами воды. Новые притяжения между гексаном и молекулами воды действительно образуются, но поскольку новые притяжения сильно отличаются от прерванных притяжений, они вносят существенные изменения в структуру воды. Считается, что молекулы воды приспосабливаются, чтобы компенсировать потерю некоторых водородных связей и образование более слабых притяжений гексан-вода, образуя новые водородные связи и приобретая новое расположение.
В целом силы притяжения в системе после перехода молекул гексана и других углеводородов в воду примерно эквивалентны по силе притяжения в отдельных веществах. По этой причине при растворении небольшого количества углеводорода в воде поглощается или выделяется мало энергии. Поэтому, чтобы объяснить, почему в воде растворяются лишь очень небольшие количества углеводородов, таких как гексан, мы должны рассмотреть изменение энтропии системы. Неочевидно, но когда молекулы гексана переходят в слой воды, частицы в созданном новом расположении фактически менее дисперсны (более низкая энтропия), чем отдельные жидкости. Естественная тенденция к большему рассеиванию способствует разделению гексана и воды и препятствует их смешиванию.
По этой причине при растворении небольшого количества углеводорода в воде поглощается или выделяется мало энергии. Поэтому, чтобы объяснить, почему в воде растворяются лишь очень небольшие количества углеводородов, таких как гексан, мы должны рассмотреть изменение энтропии системы. Неочевидно, но когда молекулы гексана переходят в слой воды, частицы в созданном новом расположении фактически менее дисперсны (более низкая энтропия), чем отдельные жидкости. Естественная тенденция к большему рассеиванию способствует разделению гексана и воды и препятствует их смешиванию.
Это помогает объяснить, почему бензин и вода не смешиваются. Бензин представляет собой смесь углеводородов, включающую гексан. Бензин и вода не смешиваются, потому что неполярные молекулы углеводорода разрушили бы воду таким образом, чтобы создать структуру с более низкой энтропией; поэтому вероятность существования смеси меньше, чем отдельных жидкостей.
Мы можем применить наши знания о смешивании этанола и воды к смешиванию двух углеводородов, таких как гексан, C 6 H 14 и пентан C 5 H 12 . При переходе неполярных молекул пентана в неполярный гексан силы Лондона между молекулами гексана разрушаются, но между молекулами гексана и пентана образуются новые силы Лондона. Поскольку молекулы очень похожи, структура раствора и силы притяжения между частицами очень похожи на структуру и притяжение, обнаруживаемые в отдельных жидкостях. Когда эти свойства в растворе существенно не отличаются от отдельных жидкостей, можно предположить, что раствор имеет более высокую энтропию, чем отдельные жидкости. Поэтому, когда очень похожие жидкости, такие как пентан и гексан, смешиваются, естественная тенденция к увеличению энтропии переводит их в раствор.
При переходе неполярных молекул пентана в неполярный гексан силы Лондона между молекулами гексана разрушаются, но между молекулами гексана и пентана образуются новые силы Лондона. Поскольку молекулы очень похожи, структура раствора и силы притяжения между частицами очень похожи на структуру и притяжение, обнаруживаемые в отдельных жидкостях. Когда эти свойства в растворе существенно не отличаются от отдельных жидкостей, можно предположить, что раствор имеет более высокую энтропию, чем отдельные жидкости. Поэтому, когда очень похожие жидкости, такие как пентан и гексан, смешиваются, естественная тенденция к увеличению энтропии переводит их в раствор.
Экзотермические изменения приводят к увеличению энергии окружения, что приводит к увеличению числа способов, которыми эта энергия может быть организована в окружении, и, следовательно, приводит к увеличению энтропии окружения. Эндотермические изменения приводят к уменьшению энергии окружения, что ведет к уменьшению числа способов, которыми эта энергия может быть организована в окружении, и, следовательно, приводит к уменьшению энтропии окружения. Поэтому экзотермические изменения более вероятны, чем эндотермические изменения. Мы можем использовать это обобщение, чтобы объяснить, почему ионные соединения нерастворимы в гексане. Чтобы ионное соединение растворилось в гексане, необходимо разрушить ионные связи и притяжения между молекулами гексана, и возникнет притяжение между ионами и гексаном. Новые притяжения, образующиеся между ионами и гексаном, будут значительно слабее, чем нарушенные притяжения, что делает процесс растворения значительно эндотермическим. Тенденция к переходу к раствору с более высокой энтропией не может преодолеть уменьшение энтропии среды, сопровождающее эндотермическое изменение, поэтому ионные соединения нерастворимы в гексане.
Поэтому экзотермические изменения более вероятны, чем эндотермические изменения. Мы можем использовать это обобщение, чтобы объяснить, почему ионные соединения нерастворимы в гексане. Чтобы ионное соединение растворилось в гексане, необходимо разрушить ионные связи и притяжения между молекулами гексана, и возникнет притяжение между ионами и гексаном. Новые притяжения, образующиеся между ионами и гексаном, будут значительно слабее, чем нарушенные притяжения, что делает процесс растворения значительно эндотермическим. Тенденция к переходу к раствору с более высокой энтропией не может преодолеть уменьшение энтропии среды, сопровождающее эндотермическое изменение, поэтому ионные соединения нерастворимы в гексане.
Ионные соединения часто растворимы в воде, потому что притяжение, образующееся между ионами и водой, часто бывает достаточно сильным, чтобы сделать их раствор либо экзотермическим, либо лишь слегка эндотермическим. Например, раствор гидроксида натрия экзотермичен, а раствор хлорида натрия несколько эндотермичен. Даже если раствор слегка эндотермичен, тенденция к переходу к раствору с более высокой энтропией часто делает ионные соединения растворимыми в воде.
Даже если раствор слегка эндотермичен, тенденция к переходу к раствору с более высокой энтропией часто делает ионные соединения растворимыми в воде.
Прогнозирование растворимости
Граница между тем, что мы называем растворимым, и тем, что мы называем нерастворимым, является произвольной, но следующие общие критерии для описания веществ как нерастворимых, растворимых или умеренно растворимых.
Если в 100 миллилитрах (или 100 г) растворителя растворяется менее 1 грамма вещества, то вещество считается нерастворимым.
Если в 100 миллилитрах (или 100 г) растворителя растворяется более 10 граммов вещества, то вещество считается растворимым.
Если в 100 миллилитрах (или 100 г) растворителя растворяется от 1 до 10 граммов вещества, то вещество считается умеренно растворимым.
Хотя трудно определить конкретную растворимость, не найдя ее экспериментально или не обратившись к таблице растворимости, у нас есть рекомендации, которые позволяют нам предсказать относительную растворимость.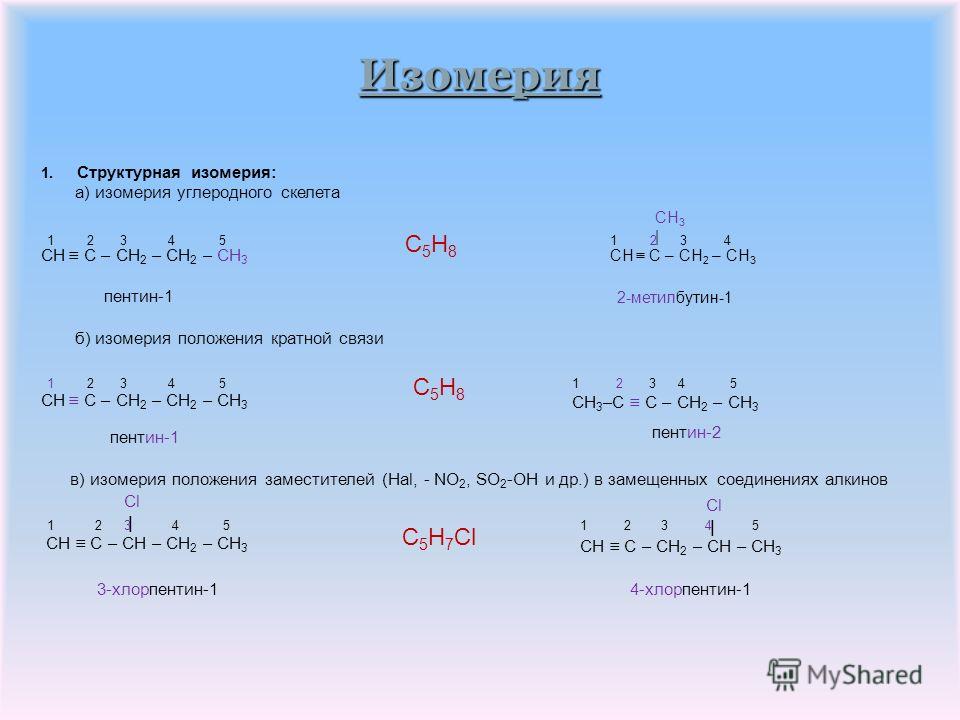 Главным среди них является
Главным среди них является
Подобное растворяется в подобном.
Например, это руководство можно использовать для предсказания того, что этанол, состоящий из полярных молекул, будет растворим в воде, которая также состоит из полярных молекул. Точно так же пентан (C5h22), молекулы которого неполярны, смешивается с гексаном, молекулы которого также неполярны. Мы будем использовать правило «подобно растворяется подобно», чтобы предсказать, будет ли вещество более растворимо в воде или в гексане. Его также можно использовать для предсказания того, какое из двух веществ более растворимо в воде и какое из двух веществ более растворимо в неполярном растворителе, таком как гексан:
Полярные вещества, вероятно, растворяются в полярных растворителях. Например, ионные соединения, которые очень полярны, часто растворимы в воде полярного растворителя.
Неполярные вещества, вероятно, растворяются в неполярных растворителях. Например, неполярные молекулярные вещества, вероятно, растворяются в гексане, обычном неполярном растворителе.
Из них вытекают два дополнительных руководства:
Неполярные вещества вряд ли растворяются в значительной степени в полярных растворителях. Например, неполярные молекулярные вещества, такие как углеводороды, скорее всего, будут нерастворимы в воде.
Полярные вещества вряд ли растворяются в значительной степени в неполярных растворителях. Например, ионные соединения нерастворимы в гексане.
Предсказать растворимость полярных молекулярных веществ труднее, чем растворимость ионных соединений и неполярных молекулярных веществ. Многие полярные молекулярные вещества растворимы как в воде, так и в гексане. Например, этанол смешивается как с водой, так и с гексаном. Полезно следующее обобщение:
Вещества, состоящие из небольших полярных молекул, такие как ацетон и этанол, обычно растворимы в воде. (Они также часто растворяются в гексане.)
Краткое изложение рекомендаций по растворимости
Тип вещества Растворим в воде? Растворим в гексане? Ионные соединения Часто № Молекулярные соединения с неполярными молекулами № Да Молекулярные соединения с малыми полярными молекулами Обычно Часто
Процесс растворения — это процесс, в котором участвует разрыв и создание связей , и что требует энергии . Из закона Гесса мы знаем, что мы можем суммировать энергии каждого шага в цикле, чтобы определить энергию всего процесса. Следовательно, энергия образования раствора, энтальпия растворения, равна сумме трех стадий: DH soln = DH 1 + DH 2 + DH 3 .
Из закона Гесса мы знаем, что мы можем суммировать энергии каждого шага в цикле, чтобы определить энергию всего процесса. Следовательно, энергия образования раствора, энтальпия растворения, равна сумме трех стадий: DH soln = DH 1 + DH 2 + DH 3 .
- Разрыв связей требует или поглощает энергию. Этот процесс эндотермический. -ДХ решетка (здесь необходим отрицательный знак, поскольку энергия решетки обычно измеряется для образования соли, не разрушая ее)
- При образовании связей высвобождается энергия. Этот процесс экзотермический. DH увлажнение
- Растворение в целом может быть либо эндотермическим, либо экзотермическим, в зависимости от того, было ли потрачено больше энергии на разрыв связей или больше энергии было высвобождено при образовании новых связей. Если при образовании связей высвобождается больше энергии, чем используется при их разрыве, то процесс является экзотермическим.
 Если используется больше энергии, чем высвобождается, то процесс эндотермический.
Если используется больше энергии, чем высвобождается, то процесс эндотермический.
Щелкните в любом месте рисунка ниже, чтобы запустить анимацию. ПРИМЕЧАНИЕ. Для запуска вам понадобится Java Script.
Получите факты: гексан – будущее без токсичных веществ
Когда в 1976 году был принят Закон о контроле над токсичными веществами (TSCA), он был предназначен для обеспечения безопасности химических веществ на протяжении всего их жизненного цикла, от производства до использования и утилизации. Но из-за недостатков в законе Агентство по охране окружающей среды (EPA) не смогло принять меры в отношении известных опасностей для здоровья.
Другие законы, например те, которые устанавливают стандарты безопасности воздуха, воды и рабочего места, не регулируют должным образом воздействие большинства химических веществ и не учитывают опасности, которые химические вещества могут представлять на протяжении всего их жизненного цикла. Действия Агентства по охране окружающей среды необходимы для быстрого снижения воздействия токсичных химических веществ, таких как гексан, которые используются в основном в промышленных целях, но также содержатся в обычных бытовых продуктах, включая пятновыводители, аэрозольные клеи и краски для рукоделия. Гексан* легко вдыхается и может вызвать длительное и даже необратимое повреждение нервов.
Действия Агентства по охране окружающей среды необходимы для быстрого снижения воздействия токсичных химических веществ, таких как гексан, которые используются в основном в промышленных целях, но также содержатся в обычных бытовых продуктах, включая пятновыводители, аэрозольные клеи и краски для рукоделия. Гексан* легко вдыхается и может вызвать длительное и даже необратимое повреждение нервов.
Мы призываем EPA использовать свои полномочия в соответствии с обновленным TSCA для защиты людей и окружающей среды от токсичных химических веществ, таких как гексан.
Действия федерального агентства по регулированию гексана не заходят достаточно далеко
Гексан — это растворитель, широко используемый в качестве промышленного очистителя и обезжиривателя, а также компонент многих потребительских товаров. Уже более 40 лет известно, что гексан, легко вдыхаемый или всасываемый через кожу, вызывает длительное и даже необратимое повреждение нервов в ступнях, ногах, кистях и руках. Существующие правила не касаются использования потребителями и не обеспечивают достаточной защиты от воздействия на рабочем месте. Только TSCA может обеспечить полный жизненный цикл этого химического вещества от производства до использования и утилизации. Неизвестное количество потребителей покупают и используют продукты, содержащие гексан, не зная о рисках для здоровья. Пришло время расширить защиту населения от гексана и других вредных химических веществ.
Существующие правила не касаются использования потребителями и не обеспечивают достаточной защиты от воздействия на рабочем месте. Только TSCA может обеспечить полный жизненный цикл этого химического вещества от производства до использования и утилизации. Неизвестное количество потребителей покупают и используют продукты, содержащие гексан, не зная о рисках для здоровья. Пришло время расширить защиту населения от гексана и других вредных химических веществ.
Доступны более безопасные и эффективные заменители гексана
Очистители на водной основе могут заменить гексан и другие токсичные растворители в авторемонтной промышленности и других отраслях, где требуется точная очистка. Клеи на водной основе также являются более безопасными заменителями гексана во многих потребительских товарах. В полиграфической промышленности вместо гексана можно использовать очистители растительного и растительного происхождения. Несмотря на реакцию рынка на спрос на более безопасные растворители, защита прав потребителей и работников не должна быть оставлена на усмотрение частного сектора. К сожалению, несмотря на хорошо известное серьезное повреждение нервов, вызванное гексаном, и доступность экономичных и более безопасных альтернатив, это токсичное вещество по-прежнему содержится в повседневных потребительских товарах и широко используется в промышленности в качестве растворителя, подвергая американцев ненужному воздействию. риск для здоровья.
К сожалению, несмотря на хорошо известное серьезное повреждение нервов, вызванное гексаном, и доступность экономичных и более безопасных альтернатив, это токсичное вещество по-прежнему содержится в повседневных потребительских товарах и широко используется в промышленности в качестве растворителя, подвергая американцев ненужному воздействию. риск для здоровья.
Отрасли, в которых используется гексан
Ежегодно в Соединенных Штатах производится несколько сотен миллионов фунтов гексана в виде растворителей. Он используется в качестве чистящего средства в полиграфии, производстве обуви, текстиля, ремонте автомобильных тормозов и производстве мебели. Он также используется в пищевой промышленности.
Продукты, в которых содержится гексан
Обычные бытовые продукты, такие как аэрозольные клеи, контактный цемент, краски для рукоделия и пятновыводители, содержат гексан. В базе данных товаров для дома Министерства здравоохранения и социальных служб США (HHS) перечислены 54 потребительских товара, содержащих гексан. Половина этих продуктов также содержит растворители, которые усиливают тяжесть повреждения нервов гексаном. Хотя большинство продуктов, содержащих гексан, из этого списка используются в быту, в частности, для ухода за домом, декоративно-прикладного искусства, а также в автомобильных продуктах.
Половина этих продуктов также содержит растворители, которые усиливают тяжесть повреждения нервов гексаном. Хотя большинство продуктов, содержащих гексан, из этого списка используются в быту, в частности, для ухода за домом, декоративно-прикладного искусства, а также в автомобильных продуктах.
Воздействие и риск для здоровья
Гексан легко испаряется, поэтому вдыхание загрязненного воздуха во время производства и использования химического вещества является наиболее распространенной формой воздействия. Люди, живущие рядом с рабочими местами, где производится или используется гексан, или рядом с опасными свалками, содержащими гексан, могут подвергаться воздействию при попадании растворителя в окружающий воздух. И любой может подвергнуться воздействию при использовании многих бытовых продуктов, содержащих гексан. Рабочие, использующие продукты, содержащие гексан, без надлежащей вентиляции и защитного оборудования, могут подвергаться воздействию уровней, вызывающих повреждение нервов.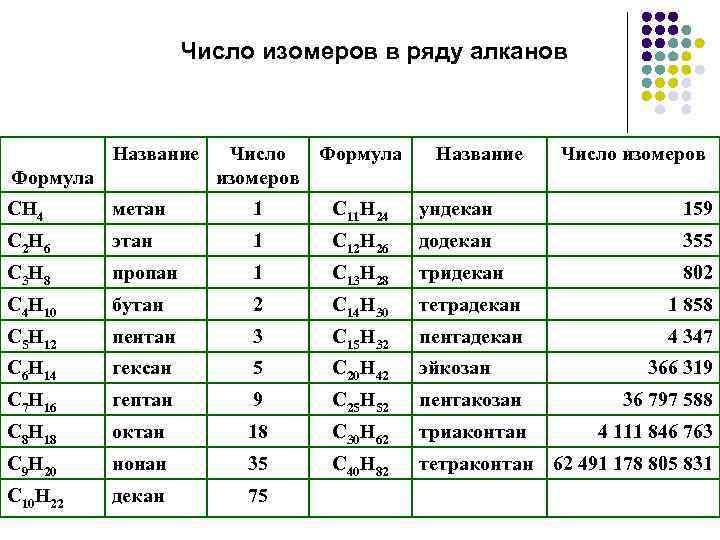
Кратковременное воздействие влияет на центральную нервную систему (головной мозг) и может вызывать головные боли, головокружение, спутанность сознания, тошноту, неуклюжесть, сонливость и другие эффекты, сходные с интоксикацией. Если воздействие высокое и происходит часто в течение месяцев или лет, воздействие на мозг может быть длительным и, возможно, постоянным. Высокие уровни воздействия были связаны с заболеванием, называемым периферической невропатией — симптомы включают онемение и покалывание в ступнях и ногах, а затем в руках. Также может быть снижена способность ощущать прикосновение, боль, вибрацию и температуру. Мышцы могут стать слабыми. В тяжелых случаях мышцы могут сокращаться или ослабевать, может возникнуть паралич. В сочетании с другими растворителями, такими как ацетон или метилэтилкетон, увеличивается повреждение нервов, связанное с гексаном.
Как гексан определяется и регулируется в настоящее время
Конгресс специально определил гексан как опасный загрязнитель воздуха в соответствии с Законом о чистом воздухе, и он регулируется как таковой EPA.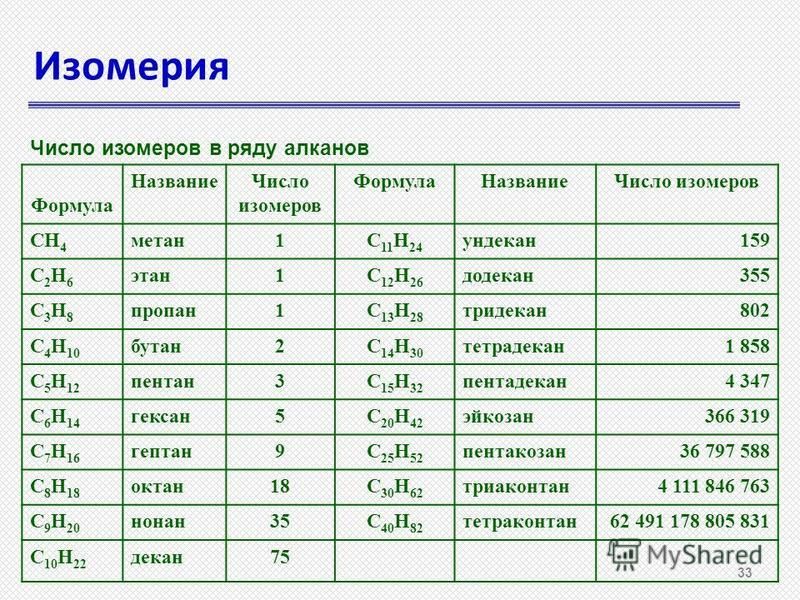
Были предприняты некоторые ограниченные шаги для решения проблемы воздействия гексана, включая контроль за выбросами в наружный воздух, (слабые) ограничения на воздействие на рабочем месте и некоторые требования к раскрытию информации о выбросах в окружающую среду.
Калифорнийский совет по воздушным ресурсам определяет гексан как токсичный загрязнитель воздуха.
Агентство по охране окружающей среды Калифорнии и США установили аналогичные «безопасные» уровни воздействия при вдыхании гексана, исходя из хронических последствий для здоровья.
Департамент общественного здравоохранения Калифорнии опубликовал бюллетень об опасности для здоровья, чтобы предупредить о повреждении нервов гексаном среди авторемонтников Калифорнии. Департамент также опубликовал рекомендации или рекомендации для врачей по диагностике и лечению периферической невропатии, связанной с гексаном. Однако, поскольку у этого агентства нет регулирующего органа, никаких дополнительных действий предпринимать нельзя.

 Если используется больше энергии, чем высвобождается, то процесс эндотермический.
Если используется больше энергии, чем высвобождается, то процесс эндотермический.
Leave A Comment