Реакции кислот с кадмием, цинком и ртутью. Задача 1021
Задача 1021.
Сравнить отношение цинка, кадмия и ртути к разбавленным и концентрированным кислотам: а) соляной; б) серной; в) азотной. Написать уравнения соответствующих реакций.
Решение:
Цинк, кадмий и ртуть – металлы, образующие подгруппу цинка. Активность их понижается от Zn к Hg. Цинк – амфотерен: легко растворяется в кислотах, а при нагревании – в щелочах. Кадмий в щелочах не растворяется, а в кислотах -менее энергично, чем цинк. Ртуть взаимодействует только с кислотами, которые являются сильными окислителями.
Отношение цинка, кадмия и ртути к разбавленным и концентрированным кислотам:
а) Отношение цинка, кадмия и ртути к соляной кислоте.
Соляная кислота взаимодействует с металлами, стоящими в электрохимическом ряду металлов до водорода с образованием соли и выделением газообразного водорода:
1) Цинк легко растворяется в соляной кислоте:
2) Кадмий значительно хуже, чем цинк растворяется в соляной кислоте:
Cd + 2HCl = ZnCl2 + H2↑
3) Ртуть не растворяется в соляной кислоте, она растворяется в царской водке:
3Hg + 2HNO3 + 6HCl = 3HgCl2 + 2NO↑ + 4H2O
б) Отношение цинка, кадмия и ртути к серной кислоте.
1) Взаимодействие серной кислоты с металлами проходит различно в зависимости от её концентрации. Разбавленная серная кислота окисляет своим ионом водорода. Из-за этого она взаимодействует только с теми металлами, которые стоят в ряду напряжений до водорода, например Zn и Cd:
Zn + H2SO4 = ZnSO4 + H2↑
Cd + H2SO4 = ZnSO4 + H2↑
Ртуть не взаимодействует с разбавленной серной кислотой (в ряду напряжений металлов ртуть находится после водорода; нормальный потенциал Hg / Hg2+ = +0,85 B).
2) Концентрированная серная кислота является окислителем за счёт серы. Она окисляет металлы, стоящие в ряду напряжений до серебра включительно. Продукты её восстановления могут быть различными в зависимости от активности металла и от условий (концентрация кислоты, температура).
При взаимодействии серной кислоты с более активными металлами продуктами восстановления могут быть как SO Так, при взаимодействии с цинком могут протекать реакции:
Так, при взаимодействии с цинком могут протекать реакции:
Zn + 2H2SO4 = ZnSO4 + SO2↑ + 2H2O
3Zn + 4H2SO4 = 3ZnSO4 + S↓ + 4H2O
4Zn + 5H2SO4 = 4ZnSO4 + H2S↑ + 4H2O.
Взаимодействие серной кислоты с кадмием протекает труднее, чем с цинком:
Cd + 2H2SO4 = ZnSO4 + SO2↑ + 2H2O
3Cd + 4H
4Cd + 5H2SO4 = 4ZnSO4 + H2S↑ + 4H2O.
При растворении ртути в горячей концентрированной серной кислоте в зависимости от избытка ртути или кислоты образуются соли одновалентной или двухвалентной ртути:
Hg + 2H2SO4 = HgSO4 + SO2↑ + 2H2O2
Hg + 2H2SO4 = Hg2SO4 + SO2↑ + 2H2O.
а) Отношение цинка, кадмия и ртути к азотной кислоте.
C металлами, стоящими в ряду напряжений левее водорода азотная кислота реагирует по разному в зависимости от концентрации, например с цинком и кадмием:
Zn + 4HNO3(60%) = Zn(NO3)2 + 2NO2↑ + 2H2O
3Zn + 8HNO3(30%) = 3Zn(NO3)2 + 2NO↑ + 4H2O
4Zn + 10HNO3(20%) = Zn(NO3)2 + N2O + 5H2O
5Zn + 12HNO3(10%) = 5Zn(NO3)2 + N2↑ +6H2O
4Zn + 10HNO3(20%) = 4Zn(NO3)2 + NH4NO3 + 3H2
Реакции азотной кислоты с кадмием протекают аналогично, как и с цинком только труднее.
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации кислоты ← NO2, NO, N2O, N2, NH4NO3 → увеличение активности металла.
При растворении ртути в разбавленной азотной кислоте образуется нитрат ртути (II):
3Hg + 8HNO3 = 3Hg(NO3)2 + 2NO↑+ 4H2O
При избытке ртути образуется нитрат ртути (I):
6Hg + 8HNO3 = 3Hg2(NO3)2 + 2NO↑ + 4H2O.
Ртуть легко растворяется в концентрированной азотной кислоте – образуется нитрат ртути (II):
Hg + 4HNO3 = Hg(NO3)2 + 2NO2 + 2H2O
Гальваническое цинкование: особенности и этапы процесса
Гальваническое цинкование металлоконструкций является одним из самых востребованных видов цинкования, благодаря которому изделия приобретают высокие защитные и декоративные свойства.
В отличие от горячего метода обработки, данная технология является более простой и дешевой.
Однако она имеет определенные ограничения по использованию, что обусловлено сравнительно тонким слоем защитного покрытия (не превышает 40 мкм).
Технология гальваники предусматривает осаждение цинка из состава электролита на металлоконструкцию, которая в свою очередь подключена к сети питания через отрицательный полюс.
Чтобы увеличить уровень механической и коррозийной устойчивости, а также для повышения декоративных качеств деталей, цинковое покрытие дополнительно подвергают хроматированию, кадмированию или обработке фосфатными составами.
На производстве гальваническая обработка металла проводится в строгой последовательности
- Очистка поверхности деталей от лакокрасочных и смазочных материалов, ржавчины и окалины (процедура проводится с использованием обезжиривающих и щелочных смесей).
- Промывка чистой водой в специальной проточной ванне.
- Электролитическое обезжиривание и последующая промывка.

- Травление в составе, который включает воду и соляную кислоту. Процедура удаляет остатки ржавчины и окалины, исключая растворение или деформацию основного металла, а также декапирует поверхности перед обработкой.
- Промывка, непосредственно гальваническая оцинковка и повторная промывка.
- Для устранения с поверхности окисной пленки применяться осветление металла в растворе, состоящем из воды и азотной кислоты.
- Промывка, фосфатирование (при необходимости) с последующей промывкой.
- Может быть проведена пассивация электролитическим хроматированием или путем хроматированного распыления.
- Сушка детали.
В зависимости от особенностей технологии обработки и типа продукции гальваническая обработка металла может включать дополнительные манипуляции.
Если обрабатывают полосу, то цинкование начинают с разматывания материала, а далее выполняют сварку концов. На заключительном этапе полосу обрабатывают маслом и сматывают.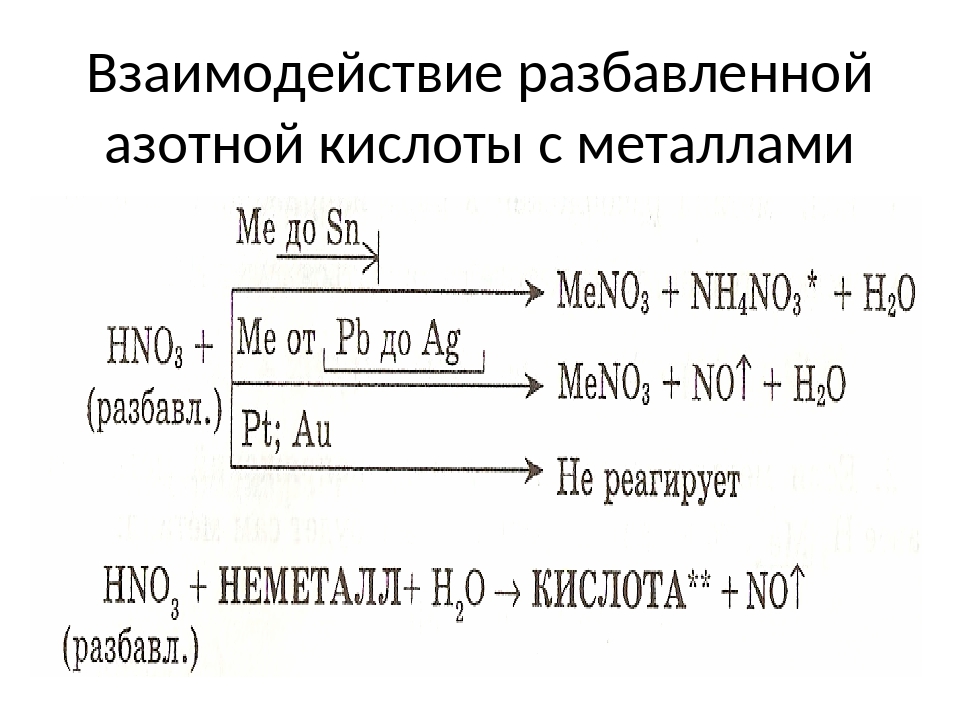
Дефекты при гальваническом цинковании
Среди причин, которые значительно влияют на уровень качества обрабатываемых деталей, выделяют следующие:
- Низкое качество подготовки металлоконструкций;
- Отклонение от соблюдения рецептуры электролита;
- Нарушения характеристик и последовательности этапов гальванической обработки.
Также качество готовой продукции зависит от конфигурации, особенностей расположения и состояния плоскостей ведущих и дополнительных анодов, а также пространственного расположения изделий в электролите.
Вследствие этого на деталях могут присутствовать такие дефекты, как:
- Питтинг – на металле образуются углубленные полосы или незначительные точечные каверны. Такие недостатки появляются, как правило, в результате того, что в электролите присутствуют гидрокисные или органические примеси, а также при низкой интенсивности перемешивания или его полном отсутствии.
- Низкий уровень адгезии – плохое схватывание цинкового слоя или его отслаивание может наблюдаться при нарушении процесса очистки, травления или обезжиривания детали.

- Разнотипность внешнего вида – вызывает несоблюдение рецептуры в части пропорции используемых компонентов электролита при одновременном накоплении в гальванической ванне определенного объема солей железа. Также причиной данного дефекта может выступать недостаточное перемешивание компонентов и пониженная температура, которая не отвечает норме.
- Повышенная шероховатость – свидетельствует о присутствии в гальванической смеси всевозможных механических примесей, сульфата цинка и гидроксидов в повышенном объеме. Также это возникает в результате недостаточного количества анионов цинка в электролите и при избыточной плотности тока.
- Хрупкость цинкового покрытия – является следствием превышенной плотности тока в катодном пространстве или присутствием в электролите органических примесей в большом объеме.

- Темный (преимущественно коричневый) цвет – вызывает наличие в гальванической ванне различных органических загрязнений. Такой эффект также может вызвать существенно снижение плотности тока возле катода и повышение температуры электролитической смеси.
Сравнительные характеристики горячего и гальванического цинкования
Сегодня применяется два вида цинкования металлоизделий – это горячее оцинкование путем окунания деталей в расплав цинка и гальванический способ обработки цинком, который предполагает воздействие на детали электрического тока. В свою очередь гальваническая технология цинкования производится двумя технологическими методами.
В первом случае обработка выполняется в специальных установках (барабанах), которые вращаются с определенной скоростью. Метод получил распространение для обработки деталей с резьбой и без резьбы.
Во втором случае металлоконструкции подвешивают при помощи медной проволоки, а затем опускают в смесь с электролитом. Широко применяется для оцинкования габаритных конструкций. В свою очередь метод горячего оцинкования также выполняется подвесным способом, используется для крупногабаритных конструкций.
Широко применяется для оцинкования габаритных конструкций. В свою очередь метод горячего оцинкования также выполняется подвесным способом, используется для крупногабаритных конструкций.
Перед выбором конкретного способа обработки деталей нужно учитывать следующие факторы:
- Эстетические и декоративные требования к защитному покрытию.
- Уровень влияния агрессивности факторов внешней среды, в которой планируется использовать конструкцию.
- Конструктивные особенности деталей (наличие отверстий, пр.).
- Насколько метод обработки отвечает технологическим нормам процессов оцинкования.
В случае, когда конструкции предполагается эксплуатировать на улице и в других агрессивных условиях, главным требованием к покрытию выступает высокая антикоррозийная стойкость. Такие изделия следует обрабатывать цинком по технологии горячего оцинкования, которая позволяет наносить покрытие толщиной от 60 микрометров.
В данном случае в течение года цинковое покрытие разрушается не больше, чем на 10 микрометров.
Однако метод горячей обработки может применяться только в отношении конструкций, в которых имеются отверстия определенного диаметра. Также следует учитывать, что на деталях, обработанных таким способом, могут оставаться наплывы, подтеки и капли.
Поэтому декоративные качества покрытия в данном случае достаточно низкие. К тому же тонкие металлоизделия могут деформироваться вследствие горячей обработки, что обусловлено особенностями технологии (цинк наносят при температуре 450°C).
Гальваническая оцинковка металла проводится при комнатной температуре, поэтому данный метод иногда называют «методом холодного цинкования», при котором металл не подвергается деформации.
Данный способ обработки отлично подходит для деталей, в которых присутствуют резьбовые соединения.
Сфера применения гальванического цинкования
Данный способ широко применяется на изделиях, изготовленных из углеродистых сталей и разных видов чугуна. Основной сортамент гальваники представлен разным инструментом, деталями машин и оборудования, всевозможными опорами и крепежными элементами, включая тонколистовой холоднокатаный металлопрокат.
Наряду с защитными свойствами, гальваническое цинкование также наделяет металл декоративными качествами. Это обусловлено равномерностью распределения покрытия по поверхности и точным повторением покрытия конфигурации детали.
Толщина цинкового покрытия составляет 6 – 9 микрометров, но при этом конструкции подвергаются пассивации в специальном хроматном растворе. Благодаря пассивации можно получить высокий эстетический эффект.
Процедура позволяет придать конструкциям такие цветовые решения, как радуга (золотистый цвет, который отлично переливается на солнце) и голубизна (цинк белого цвета приобретает голубой отлив).
Методика гальваники предполагает лишь внешнее покрытие деталей, поскольку нанести покрытие в труднодоступных местах невозможно вследствие отсутствия электропроводимости.
Металлоконструкции, оцинковка которых проводилась гальваническим способом, широко применяются в умеренной среде. Таким образом, такие конструкции могут использоваться на улице лишь периодически, при этом они не должны иметь прямой контакт с влагой.
Виды электролит
Применение данной технологии предусматривает соблюдение состава электролита и температурного режима. Это обусловлено тем, что эти параметры при требуемой плотности тока оказывают прямое воздействие на структуру наносимого покрытия и скорость осаждения цинка.
Чтобы получить желаемый декоративный эффект, в электролит добавляют окрашивающие и блескообразующие компоненты.
Метод гальванического оцинкования предполагает использование нескольких групп электролитов, которые отличаются составом рецептуры:
- Слабокислые и кислые – наиболее простые составы, при создании которых применяются сульфаты, хлориды, борфториды и их смеси;
- Цинкатные и цианидные – это щелочные вещества, в составе которых присутствует цианид натрия и цинкат натрия, которые растворяют в едком натре;
- Аммиакатные – нейтральные и щелочные составы, полученные посредством растворения оксида цинка в смеси хлорида или сульфата аммония.

Также технологи используют электролиты, создаваемые на основе аминосоединений. Однако такие растворы применяются крайне редко.
Вывод
Цинковый слой, нанесенный методом горячего оцинкования, способен сохранять эксплуатационные свойства на протяжении до 120 лет при использовании в обычных условиях. Это обусловлено толщиной слоя цинка, который составляет до 200 мкм.
В результате металл приобретает высокие защитные свойства и отличается стойкостью к механическим воздействиям. Более того, покрытие способно самостоятельно восстанавливаться при образовании трещин, что обусловлено особенным составом цинкового раствора.
В свою очередь толщина слой цинка при гальванике составляет не более 15 мкм. Поэтому срок службы изделий с такой толщиной покрытия в агрессивных условиях способно прослужить не более 1 года. Преимуществами данной методики выступают доступная стоимость, ровность и равномерность покрытия.
Реакция цинка с разбавленной и концентрированной азотной кислотой соответственно дает: А.
 $N{O_2}$ и $NO$B . $NO$ и ${N_2}O$C . $N{O_2}$ и ${N_2}O$D . $ {N_2} o $ и $ n n {o_2} $
$N{O_2}$ и $NO$B . $NO$ и ${N_2}O$C . $N{O_2}$ и ${N_2}O$D . $ {N_2} o $ и $ n n {o_2} $208,6 тыс.+ просмотров
Подсказка: Мы знаем, что реакция азотной кислоты с металлом зависит от концентрации кислоты. В задаче задана следующая реакция.
Реакция цинка с разбавленной азотной кислотой- $Zn + 10HN{O_3}(dil) \to 4Zn{(N{O_3})_2} + {N_2}O + 5{H_2}O$
Реакция цинка с концентрированной азотной кислота -$Zn + 4HN{O_3}(con) \to Zn{(N{O_3})_2} + 2N{O_2} + 2{H_2}O$
Полный ответ:
> Мы можем видеть здесь, когда Металлический цинк реагирует с разбавленной азотной кислотой, образуя закись азота, которая представляет собой бесцветный негорючий газ. Он также известен как веселящий газ. Он в основном используется для успокоения и обезболивания, потому что замедляет время реакции организма при вдыхании. Он имеет медицинское применение, например, в качестве анестезирующих препаратов. Во второй реакции концентрированная азотная кислота реагирует с металлическим цинком с образованием газообразного диоксида азота. Диоксид азота используется в качестве катализатора в некоторых реакциях окисления, в качестве ракетного топлива и взрывчатого вещества, в качестве отбеливателя муки. При более высокой температуре он выглядит как красновато-коричневый газ. Он парамагнитен по своей природе и имеет изогнутую форму. В основном он образуется в процессе горения с использованием воздуха в качестве окислителя, а в лаборатории его получают дегидратацией азотной кислоты.
Диоксид азота используется в качестве катализатора в некоторых реакциях окисления, в качестве ракетного топлива и взрывчатого вещества, в качестве отбеливателя муки. При более высокой температуре он выглядит как красновато-коричневый газ. Он парамагнитен по своей природе и имеет изогнутую форму. В основном он образуется в процессе горения с использованием воздуха в качестве окислителя, а в лаборатории его получают дегидратацией азотной кислоты.
Итак, здесь правильный вариант D, который равен ${N_2}O$ и $N{O_2}$.
Примечание. В этой задаче мы рассмотрели реакцию азотной кислоты с цинком при двух условиях: во-первых, когда азотная кислота разбавлена, а во-вторых, когда она концентрирована. В первом случае, когда разбавленная и холодная азотная кислота реагирует с цинком, выделяется азот. оксид $({N_2}O)$ и второе состояние, когда горячая и концентрированная азотная кислота выделяет красновато-коричневый диоксид азота $(N{O_2})$.
Недавно обновленные страницы
Вычислите изменение энтропии, связанное с конверсией. Химия класса 11 JEE_Main
Химия класса 11 JEE_Main
Закон, сформулированный доктором Нернстом, является первым законом термодинамики. двигатель, работающий между rm15rm0rm0rmC и rm2rm5rm0rmC класс 11 химии JEE_Main
Для реакции rm2Clg в rmCrmlrm2rmg знаки химии класса 11 JEE_Main
Изменение энтальпии перехода жидкой воды класса 11 химии JEE_Main
Вычислите изменение энтропии, связанное с конверсией. Химия класса 11 JEE_Main
Закон, сформулированный доктором Нернстом, является первым законом термодинамики. двигатель, работающий между rm15rm0rm0rmC и rm2rm5rm0rmC класс 11 химии JEE_Main
Для реакции rm2Clg в rmCrmlrm2rmg знаки химии класса 11 JEE_Main
Изменение энтальпии перехода жидкой воды класса 11 химии JEE_Main
Актуальные сомнения
Сбалансированное уравнение карбонат цинка + азотная кислота = нитрат цинка + диоксид углерода + вода
Цитата страницы Начать эссе значок-вопрос Задайте вопросНачать бесплатную пробную версию
Скачать PDF PDF Цитата страницы Цитировать Поделиться ссылкой ДелитьсяСсылайтесь на эту страницу следующим образом:
«Сбалансированное уравнение карбонат цинка + азотная кислота = нитрат цинка + углекислый газ + вода
» eNotes Editorial , 4 мая 2016 г. , https://www.enotes.com/homework-help/balanced-equation-zinc-carbonate-nitric-acid-zinc-676172.
По состоянию на 1 апреля 2023 г.
, https://www.enotes.com/homework-help/balanced-equation-zinc-carbonate-nitric-acid-zinc-676172.
По состоянию на 1 апреля 2023 г.
Ответы экспертов
Различные вещества, участвующие в реакции, имеют следующие химические формулы:
карбонат цинка: ZnCO3
азотная кислота: HNO3
Нитрат цинка: Zn(NO3)2
вода: h3O
углекислый газ: CO2
Химическое уравнение реакции можно записать так:
`ZnCO_3 + HNO_3 -> Zn(NO3)_2 + H_2O + CO_2 `
Проверим, сбалансировано ли уравнение. Сбалансированная химическая реакция имеет одинаковое количество каждого вида со стороны реагента и продукта.
Цинк: по 1 атому с каждой стороны
C: по 1 атому с каждой стороны
O: 6 атомов со стороны реагента и 9 атомов со стороны продукта
H: 1 атом на стороне реагента и 2 на стороне продукта
N: 1 атом на стороне реагента и 2 на стороне продукта.
Таким образом, кроме цинка и углерода все остальные атомы неуравновешены. Простой способ сбалансировать их — использовать множитель 2 для азотной кислоты.
Простой способ сбалансировать их — использовать множитель 2 для азотной кислоты.
Новое уравнение:
`ZnCO_3 + 2HNO_3 -> Zn(NO_3)_2 + H_2O + CO_2` Продуктная сторона реакции.
Таким образом, это хорошо сбалансированное химическое уравнение реакции.
Надеюсь, это поможет.
См. eNotes без рекламы
Начните с 48-часовой бесплатной пробной версией , чтобы получить доступ к более чем 30 000 дополнительных руководств и более чем 350 000 вопросов помощи при выполнении домашних заданий, на которые ответили наши эксперты.
Получите 48 часов бесплатного доступаУже зарегистрирован? Войдите здесь.
Утверждено редакцией eNotes
Задайте вопрос
Похожие вопросы
Просмотреть всеНаука
Последний ответ опубликован 17 июля 2012 г.




Leave A Comment