Ионные уравнения — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Cu2+
Al3+
ИОННЫЕ УРАВНЕНИЯ.
NO3Na+
СO32-
ОПЫТ № 1.
ПРОВЕДИТЕ РЕАКЦЮ МЕЖДУ
РАСТВОРАМИ
хлорида натрия и нитрата серебра
ЗАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ
NaCl + AgNO3 = NaNO3 + AgCl
ЧТО ТАКОЕ ДИССОЦИАЦИЯ?
ЗАПИШИТЕ УАВНЕНИЯ ДИССОЦИАЦИИ
ВЕЩЕСТВ:
NaCl =
AgNO3 =
http://him.1september.ru/
УРАВНЕНИЯ ДИССОЦИАЦИИ (РАСПАДА)
NaCl =
Na+
+
Cl-
AgNO3 = Ag+ + NO3-
Cl-
Na+
Ag+
NO3-
Что находится в растворах
хлорида натрия и нитрата серебра?
взаимодействие (реакция) в растворах
веществ?
Между какими ионами произошло
взаимодействие и что образовалось?
СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ
Ag++ Cl- = AgCl↓
ЧТО ПОКАЗЫВАЕТ СОКРАЩЕННОЕ
ИОННОЕ УРАВНЕНИЕ?
Если дописать в левую и правую части
сокращенного ионного уравнения
Ag+ + Cl- = AgCl↓
ионы, между которыми не произошло
взаимодействие
получим
ПОЛНОЕ ИОННОЕ УРАВНЕНИЕ
Na++ Cl- + Ag++ NO3- = AgCl↓+ Na++ NO3 —
ВЫВОДЫ:
1.
 РЕАКЦИ В РАСВОРАХ ЭЛЕКТРОЛИТОВ
РЕАКЦИ В РАСВОРАХ ЭЛЕКТРОЛИТОВИДУТ МЕЖДУ ИОНАМИ
2. РЕАКЦИИ МЕЖДУ ИОНАМИ
НАЗЫВАЮТСЯ РЕАКЦИЯМИ ИОННОГО
ОБМЕНА
3. УРАВНЕНИЯ ТАКИХ РЕАКЦИЙ
УЧИМСЯ ПИСАТЬ ИОННЫЕ УРАВНЕНИЯ
Молекулярное уравнение
Р
Р
Р
Н
NaCl + AgNO3 = NaNO3 + AgCl↓
распадаются (диссоциируют)
на ионы,
РР––распадаются
(диссоциируют)
на ионы,
записываем
в виде
ионовионов
записываем
в виде
(м/д,н/э)
н/э)––не
не распадаются,
распадаются,
НН(м/д,
переписываем без
переписываем
безизменения
изменения
Полное ионное уравнения
Na+ + Cl- + Ag+ + NO3- = Na+ + NO3- + AgCl↓
Полное ионное уравнение
Na+ + Cl- + Ag+ + NO3- = Na+ + NO3- + AgCl↓
Сократите в правой и левой части
уравнения одинаковые ионы
Сокращенное ионное уравнение
Молекулярное уравнение
NaCl + AgNO3 = NaNO3 + AgCl↓
Полное ионное уравнения
Na+ + Cl- + Ag+ + NO3- = Na+ + NO3- + AgCl↓
Сокращенное ионное уравнение
Ag+ + Cl- = AgCl↓
ОПЫТ 2.

ПРОВЕДИТЕ РЕАКЦИЮ МЕЖДУ
РАСТВОРАМИ
гидроксида калия и соляной кислоты
(в раствор гидроксида калия добавьте
индикатор фенолфталеин)
ЗАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ в
молекулярном, полном ионном,
Молекулярное уравнение
Р
Р
Р м/д
KOH + HCl = KCl + h3O
Полное ионное уравнения
K+ + OH- + H++ Cl- = K+ + Cl- + h3O
Сокращенное ионное уравнение
OH- + H+ = h3O
Между какими ионами произошло
взаимодействие и что образовалось?
ОПЫТ № 3.
ПРОВЕДИТЕ РЕАКЦИЮ МЕЖДУ
РАСТВОРАМИ
карбоната натрия и соляной кислоты
ЗАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ в
молекулярном, полном ионном,
сокращенном ионном виде
h3CO3 = CO2↑+ h3O
Молекулярное уравнение
Р
р
Р
м\д
н\э
Na2CO3 + 2HCl = 2NaCl + h3O + CO2↑
Молекулярное уравнение
Na2CO3 + 2HCl = 2NaCl + h3O + CO2↑
Полное ионное уравнение
Сокращенное ионное уравнение
СO32— + 2H+ = h3O + СO2↑
Между какими ионами произошло
взаимодействие и что образовалось?
ОПЫТ № 4.
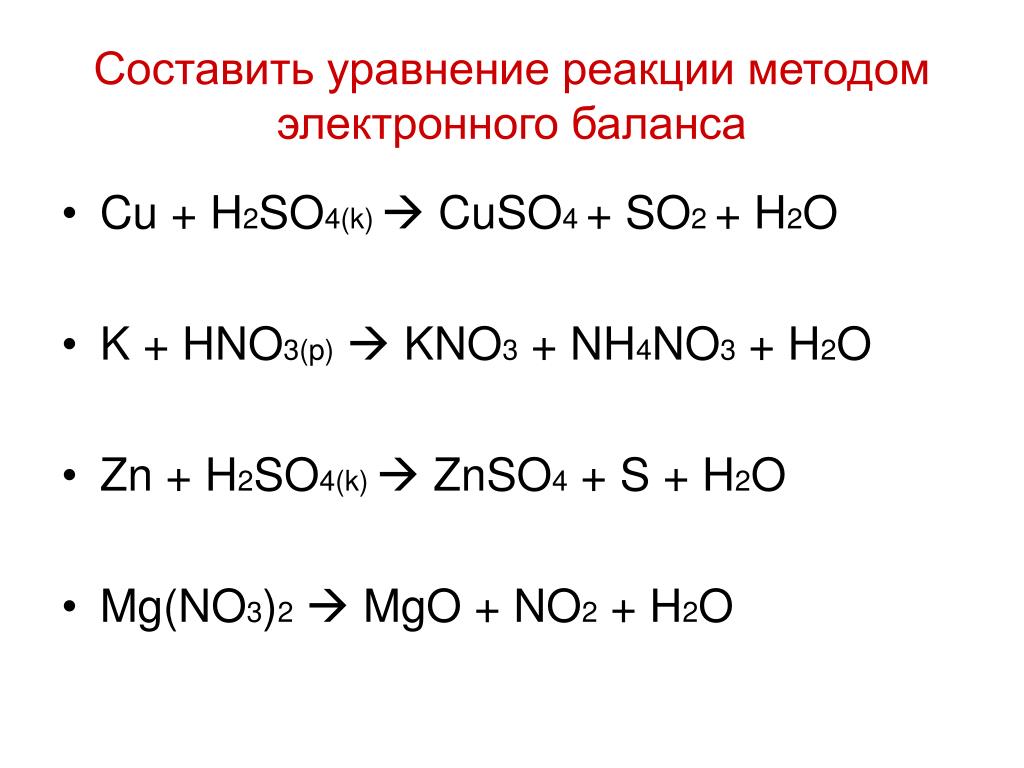
ПРОВЕДИТЕ РЕАКЦИЮ МЕЖДУ
РАСТВОРАМИ
сульфата натрия и хлорида калия
ЗАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ в
молекулярном, полном ионном,
сокращенном ионном виде
Молекулярное уравнение
Р
Р
Р
Р
Na2SO4 + 2KCl = 2NaCl + K2SO4
Полное ионное уравнение
2Na++SO42- + 2K++2Cl- = 2Na++ Cl- + 2K++ SO42-
В каких случаях реакции ионного
обмена идут до конца?
ВЫВОД:
РЕАКЦИИ ИОННОГО ОБМЕНА В
КОНЦА, ЕСЛИ
• ОБРАЗУЕТСЯ НЕРАСТВОРИМОЕ
ВЕЩЕСТВО (ОСАДОК)
• ВЫДЕЛЯЕТЯ ГАЗ
• ОБРАЗУЕТСЯ
МАЛОДИССОЦИИРУЮЩЕЕ
ВЕЩЕСТВО
Задание 1.
Между растворами каких веществ возможна
реакция ионного обмена?
а)
б)
в)
г)
Na2SO4 и
Al2(SO4)3 и
NaNO3 и
h3SO4 и
HNO3
BаCl2
K2SO4
NaNO3
Задание 2.
Между какими веществами реакция ионного
обмена идет с выделением газа?
а) гидроксид меди (II) и серная кислота;
б) гидроксид калия и серная кислота;
в) силикат калия и соляная кислота;
г) карбонат кальция и соляная кислота.

Задание 3.
Реакция между какими электролитами идет до
конца с образованием осадка?
а) гидроксид калия и нитрат натрия
б) карбонат натрия и соляная кислота
в) нитрат меди (II) и гидроксид натрия
г) гидроксид меди (II ) и серная кислота
Молекулярное уравнение
CuSO4 + 2NaOH = Cu(OH)2↓ + 2NaCl
Полное ионное уравнение
Cu2+ + SO42- + 2Na+ + 2OH- = Cu(OH)2↓ + 2Na+ +2Cl-
Сокращенное ионное уравнение
Cu2+ + 2OH- = Cu(OH)2↓
Молекулярное уравнение
Cu(OH)2 + 2HCl = CuCl2 + 2h3O
Полное ионное уравнение
Cu(OH)2 + 2H+ + 2Cl— = Cu2+ + 2Cl— + 2h3O
Сокращенное ионное уравнение
Cu(OH)2 + 2H+ = Cu2+ + 2h3O
Молекулярное уравнение
Молекулярное уравнение
Al2(SO4)3+ 6NaCl = 3Na2SO4 + 2AlCl3
Полное ионное уравнение
2Al3+ + 3SO42-+ 6Na+ +6Cl- = 2Al3+ + 3SO42-+ 6Na+ +6Cl-
English Русский Правила
что, как сбалансировать и часто задаваемые вопросы —
By Сания Джакати
AgNO3 является продуктом реакции между азотной кислотой и Ag (элементарным), поэтому легко реагирует с HCl. Рассмотрим некоторые факты о том, когда AgNO3 реагирует с HCl.
Рассмотрим некоторые факты о том, когда AgNO3 реагирует с HCl.
Соляная кислота, будучи сильной кислотой, обладает способностью полностью диссоциировать. Следовательно, он легко реагирует со многими соединениями. Нитрат серебра — это соль серебра, которая используется в качестве прекурсора для получения различных других соединений серебра (поскольку она довольно экономична).
Соляная кислота бесцветна и имеет характерный резкий запах. Он имеет pH 2. Нитрат серебра считается негигроскопичным соединением; следовательно, его можно легко использовать, и он очень устойчив к свету. В следующих разделах мы изучим множество фактов на основе HCl + AgNO.3 реакция.
Что является продуктом HCl и AgNO3?Когда HCl взаимодействует с AgNO3, полученные продукты — хлорид серебра и азотная кислота. Наблюдается, что образовавшийся продукт хлорид серебра нерастворим в воде.
HCl (водн. ) + AgNO3(водн.) → AgCl(s) + HNO3(водный)
) + AgNO3(водн.) → AgCl(s) + HNO3(водный)
Реакция между HCl и AgNO3 является простой формой кислотно-щелочной реакции. Его также можно назвать нейтрализация реакция, так как HCl действует как кислота, а AgNO3 выступает в качестве базы.
Как сбалансировать HCl + AgNO3?Мы можем сбалансировать HCl + AgNO3 легко реагировать, выполнив следующие шаги:
HCl + AgNO3 → AgCl + HNO3
- Первый шаг включает подсчет количества атомов каждого типа на стороне реагента и на стороне продукта.
- Следующий предполагает выравнивание количества атомов с обеих сторон (можно использовать любой метод).
- В приведенной выше реакции со стороны реагентов мы видим по одному атому водорода, хлора, серебра и азота.
 Элемент кислорода имеет 3 атома.
Элемент кислорода имеет 3 атома. - Со стороны продукта также водород, хлор, азот и серебро имеют по одному атому каждый, а кислород имеет 3 атома.
- Это означает, что уравнение уже находится в сбалансированной форме.
Для определения количества Ag можно провести титрование между Ag и HCl. Поскольку продуктом реакции является осадок, проводить ее следует очень осторожно.
Требуется аппаратБюретка (50 мл), подставка для бюретки, белая плитка, колба Эрленмейера и мерная колба.
ИндикаторныеФенолфталеин индикатор, может быть эффективно использован для проведения титрования между HCl и AgNO3 так как относится к классу кислотно-щелочных реакций. Индикатор дает розовый цвет в щелочной среде и становится от розового до бесцветного в кислой среде.
Пункт, который следует отметитьТитрантом при титровании является HCl, так как он добавляется в бюретку. AgNO3 раствор добавляют в колбу Эрленмейера.
AgNO3 раствор добавляют в колбу Эрленмейера.
- Аппарат необходимо правильно чистить и промывать соответствующими химикатами, используя очень меньшее количество химикатов.
- Бюретка заполнена стандартизированной HCl, а AgNO3 раствор отбирают в колбу Эрленмейера.
- В реакционную смесь добавляют индикатор фенолфталеин и тщательно перемешивают (при необходимости следует добавить буферный раствор).
- Титрование следует проводить очень осторожно, выпуская HCl по каплям из бюретки до тех пор, пока не будет наблюдаться изменение цвета.
- Когда видно характерное изменение цвета, мы можем сказать, что конечная точка реакции достигнута.
- Описанную выше процедуру следует повторить трижды, чтобы получить точные результаты.
- Используя формулу N1V1=N2V2, мы можем узнать желаемое количество.

Суммарное ионное уравнение реакции между HCl и AgNO3 обсуждается ниже:Чистое ионное уравнение
HCl + AgNO3 сопряженные парыСоль азотнокислого серебра и соответствующее сопряженное основание представляют собой сопряженную пару реакции между HCl и AgNO.3. Обратите внимание на следующую реакцию.
HCl + AgNO3 → Кл– + НАГНО3+
HCl и AgNO3 межмолекулярные силыМежмолекулярная сила, наблюдаемая в молекуле HCl, представляет собой взаимодействие ионного типа, при котором хлор (отрицательно заряженный) легко принимает электроны от водорода. Межмолекулярное взаимодействие, наблюдаемое в AgNO3 также ионное взаимодействие между катионом Ag и анионом нитрата.
HCl + AgNO3 энтальпия реакцииЭнтальпия реакции между HCl и AgNO3 составляет 22. 61 кДж/моль.
61 кДж/моль.
Реакция между HCl и AgNO3 не дает буферного раствора, так как образующиеся продукты представляют собой осадок (AgCl) и кислоту с pH 3 (HNO3).
HCl + AgNO3 полная реакция?Реакция между HCl и AgNO3 является полной реакцией, так как хлорид серебра и азотная кислота образуются почти в одинаковом соотношении.
HCl + AgNO3 экзотермическая или эндотермическая реакция?Реакция между HCl и AgNO3 есть эндотермическая реакция так как это реакция нейтрализации, а значение энтальпии положительное.
HCl + AgNO3 окислительно-восстановительная реакция?Реакция между HCl и AgNO3 не окислительно-восстановительный потенциал реакция. Причина обсуждается ниже.
- В окислительно-восстановительной реакции происходит как восстановление, так и окисление, и происходит изменение степени окисления веществ.

- В приведенном выше уравнении мы видим, что степени окисления видов не изменились. (Со стороны реагента и продукта степень окисления остается одинаковой). Это подтверждает, что это не окислительно-восстановительная реакция.
Реакция между HCl и AgNO3 является реакцией осаждения, так как образующийся продукт AgCl представляет собой осадок, нерастворимый в воде и оседающий на дне емкости.
HCl + AgNO3 обратимая или необратимая реакция?Реакция HCl + AgNO3 является необратимой реакцией, так как это реакция осаждения с образованием нерастворимого осадка.
HCl + AgNO3 реакция смещения?Реакция между HCl и AgNO3 представляет собой реакцию двойного замещения, поскольку два вещества взаимозаменяются с образованием продуктов.
Как сбалансировать NaOH + AgNO3 + HCl = AgCl + NaNO3 + H2OСледуя приведенным ниже шагам, мы можем легко сбалансировать уравнение:
- Сначала подсчитайте количество атомов каждого типа с обеих сторон.
 И уравнять количество атомов с обеих сторон.
И уравнять количество атомов с обеих сторон. - NaOH + AgNO3 + HCl = AgCl + NaNO3 + H2O
- Здесь, на стороне реагентов, у нас есть по одному атому натрия, серебра, хлора и азота. Два атома водорода и четыре атома кислорода.
- Со стороны продукта также имеется такое же количество атомов, по одному для азота, хлора, серебра и натрия. Два атома водорода и три кислорода. Следовательно, уравнение находится в сбалансированной форме.
- AgNO3 + HCl + NH3 = (Ag(NH3)2)Cl + HNO3
- Мы можем сбалансировать уравнение, выяснив каждый тип и количество атомов с обеих сторон. На следующем этапе их следует уравнять, как описано ниже.
- AgNO3 + HCl + 2NH3 = (Ag(NH3)2)Cl + HNO3
- Что мы сделали, так это умножили NH3 молекулы на 2.
 Таким образом, уравнение уравновешивается.
Таким образом, уравнение уравновешивается.
- FeCl2 + HCl + AgNO3 = Fe (НЕТ3)3 + AgCl + NO + H2O
- Приведенное выше уравнение может быть уравновешено путем уравнивания побочных частиц реагента и побочных частиц продукта, можно использовать метод проб и ошибок.
- Это означает, что количество атомов с обеих сторон должно быть одинаковым.
- Чтобы уравнять, мы умножили FeCl2 с 3, HCl с 4 и AgNO3 с 10 на стороне реагента.
- Что касается продукта, мы умножили Fe (NO3)3 с 3 и Н2О с 3.
- 3FeCl2 + 4HCl + 10AgNO3 = 3Fe(НЕТ3)3 + 10AgCl + NO + 2H2O
Реакция между HCl и AgNO3 представляет собой кислотно-щелочную реакцию, реакцию нейтрализации и двойного замещения. Поскольку значение энтальпии положительно, это эндотермическая реакция, необратимая, так как это реакция осаждения.
Поскольку значение энтальпии положительно, это эндотермическая реакция, необратимая, так как это реакция осаждения.
What, How to Balance & FAQs —
By Sania Jakati
AgNO 3 является продуктом реакции между азотной кислотой и Ag (элементарным), поэтому легко реагирует с HCl. Рассмотрим некоторые факты о реакции AgNO 3 с HCl.
Соляная кислота, будучи сильной кислотой, обладает способностью полностью диссоциировать. Следовательно, он легко реагирует со многими соединениями. Нитрат серебра — это соль серебра, которая используется в качестве прекурсора для получения различных других соединений серебра (поскольку она довольно экономична).
Соляная кислота бесцветна и обладает характерным резким запахом. Он имеет pH 2. Нитрат серебра считается негигроскопичным соединением; следовательно, его можно легко использовать, и он очень устойчив к свету. В следующих разделах мы изучим многие факты, основанные на реакции HCl + AgNO 3 .
При взаимодействии HCl с AgNO 3 получаются хлорид серебра и азотная кислота. Наблюдается, что образовавшийся продукт хлорид серебра нерастворим в воде.
HCl(водн.) + AgNO 3 (водн.) → AgCl(т) + HNO 3 (водн. )
Какой тип реакции HCl + AgNO 3 9 0006 ?Реакция между HCl и AgNO 3 представляет собой простую форму кислотно-щелочной реакции. Ее также можно назвать реакцией нейтрализации, поскольку HCl действует как кислота, а AgNO 3 действует как основание.
Как сбалансировать HCl + AgNO 3 ?Мы можем сбалансировать HCl + AgNO 3 легко вступает в реакцию, выполнив следующие шаги:
HCl + AgNO 3 → AgCl + HNO 3
- Первый шаг включает подсчет количества каждого типа атомов на стороне реагента и сторона продукта.

- Следующий предполагает выравнивание количества атомов с обеих сторон (можно использовать любой способ).
- В приведенной выше реакции со стороны реагентов мы видим по одному атому водорода, хлора, серебра и азота. Элемент кислорода имеет 3 атома.
- Что касается продукта, то водород, хлор, азот и серебро имеют по одному атому каждый, а кислород имеет 3 атома.
- Это означает, что уравнение уже находится в сбалансированной форме.
Чтобы определить количество Ag, мы можем провести титрование между Ag и HCl. Поскольку продуктом реакции является осадок, проводить ее следует очень осторожно.
Необходимый аппаратБюретка (50 мл), подставка для бюретки, белая плитка, колба Эрленмейера и мерная колба.
Индикатор Индикатор фенолфталеин можно эффективно использовать для титрования между HCl и AgNO 3 , так как он относится к классу кислотно-основных реакций. Индикатор дает розовый цвет в щелочной среде и становится от розового до бесцветного в кислой среде.
Индикатор дает розовый цвет в щелочной среде и становится от розового до бесцветного в кислой среде.
Титрантом при титровании является HCl, так как он добавляется в бюретку. Раствор AgNO 3 добавляют в колбу Эрленмейера.
Процедура- Прибор необходимо правильно чистить и промывать соответствующими химикатами, используя очень меньшее количество химикатов.
- Бюретку наполняют стандартизированной HCl, раствор AgNO 3 переносят в колбу Эрленмейера.
- В реакционную смесь добавляют индикатор фенолфталеин и тщательно перемешивают (при необходимости следует добавить буферный раствор).
- Титрование следует проводить очень осторожно, выпуская HCl по каплям из бюретки до изменения цвета.
- Когда видно характерное изменение цвета, можно сказать, что конечная точка реакции достигнута.

- Описанную выше процедуру следует повторить трижды, чтобы получить точные результаты.
- Используя формулу N 1 V 1 =N 2 V 2 , мы можем узнать искомое количество.
Суммарное ионное уравнение для реакции между HCl и AgNO 3 обсуждается ниже: 9001 1 Суммарное ионное уравнение
HCl + AgNO 3 сопряженных парНитрат серебра и соответствующее сопряженное основание представляют собой сопряженную пару реакции между HCl и AgNO 3 . Обратите внимание на следующую реакцию.
HCl + AgNO 3 → Cl – + HAgNO 3 +
HCl и AgNO 90 005 3 межмолекулярные силы Межмолекулярные силы, наблюдаемые в молекуле HCl, являются ионными тип взаимодействия, при котором хлор (отрицательно заряженный) легко принимает электроны от водорода. Межмолекулярное взаимодействие, наблюдаемое в AgNO 3 , также является ионным взаимодействием между катионом Ag и анионом нитрата.
Межмолекулярное взаимодействие, наблюдаемое в AgNO 3 , также является ионным взаимодействием между катионом Ag и анионом нитрата.
Энтальпия реакции между HCl и AgNO 3 составляет 22,61 кДж/моль.
Является ли HCl + AgNO 3 буферным раствором?Реакция между HCl и AgNO3 не дает буферного раствора, так как образующиеся продукты представляют собой осадок (AgCl) и кислоту с pH 3 (HNO 3 ).
Является ли HCl + AgNO 3 полной реакцией?Реакция между HCl и AgNO 3 является полной реакцией, так как хлорид серебра и азотная кислота образуются почти в одинаковом соотношении.
Является ли реакция HCl + AgNO 3 экзотермической или эндотермической? Реакция между HCl и AgNO 3 является эндотермической реакцией, так как это реакция нейтрализации, а значение энтальпии положительное.
Реакция между HCl и AgNO 3 не является окислительно-восстановительной реакцией. Причина обсуждается ниже.
- В окислительно-восстановительной реакции происходит как восстановление, так и окисление, и происходит изменение степени окисления веществ.
- В приведенном выше уравнении мы видим, что степени окисления видов не изменяются. (Со стороны реагента и продукта степень окисления остается одинаковой). Это подтверждает, что это не окислительно-восстановительная реакция.
Реакция между HCl и AgNO 3 является реакцией осаждения, так как образующийся продукт AgCl представляет собой осадок, который не растворяется в воде и оседает на дне контейнера.
HCl + AgNO 3 обратимая или необратимая реакция? Реакция между HCl + AgNO 3 является необратимой реакцией, так как это реакция осаждения с образованием нерастворимого осадка.
Реакция между HCl и AgNO3 представляет собой реакцию двойного замещения, поскольку два вещества взаимозаменяются с образованием продуктов.
Как сбалансировать NaOH + AgNO 3 + HCl = AgCl + NaNO 3 + H 2 OСледуя приведенным ниже шагам, мы можем легко сбалансировать уравнение :
- Сначала подсчитайте количество атомов каждого типа с обеих сторон. И уравнять количество атомов с обеих сторон.
- NaOH + AgNO 3 + HCl = AgCl + NaNO 3 + H 2 O
- Здесь со стороны реагента у нас есть по одному атому натрия , серебро, хлор и азот. Два атома водорода и четыре атома кислорода.
- Со стороны продукта также имеется такое же количество атомов, по одному для азота, хлора, серебра и натрия.
 Два атома водорода и три кислорода. Следовательно, уравнение находится в сбалансированной форме.
Два атома водорода и три кислорода. Следовательно, уравнение находится в сбалансированной форме.
- AgNO 3 + HCl + NH 3 = (Ag(NH 3 ) 2 )Cl + HNO 3
- Мы можем сбалансировать уравнение, выяснив каждый тип и количество атомов с обеих сторон. На следующем этапе их следует уравнять, как описано ниже.
- AgNO 3 + HCl + 2NH 3 = (Ag(NH 3 ) 2 )Cl + HNO 3
- Мы умножили молекулу NH 3 на 2. Таким образом, уравнение уравновешивается.
- FeCl 2 + HCl + AgNO 3 = Fe(NO 3 ) 3 + AgCl + NO + H 2 O
- Приведенное выше уравнение может быть уравновешено путем уравнивания побочных компонентов реагентов и побочных компонентов продукта методом проб и ошибок.
 можно использовать метод.
можно использовать метод. - Это означает, что количество атомов с обеих сторон должно быть одинаковым.
- Чтобы уравнять, мы умножили FeCl 2 на 3, HCl на 4 и AgNO 3 на 10 на стороне реагента.
- Со стороны продукта мы умножили Fe(NO 3 ) 3 на 3 и H 2 O на 3.
- 3FeCl 9000 5 2 + 4HCl + 10AgNO 3 = 3Fe( NO 3 ) 3 + 10AgCl + NO + 2H 2 O
Реакция между HCl и AgNO 9000 5 3 – реакция кислотно-основного типа, реакции нейтрализации и двойного замещения. . Поскольку значение энтальпии положительно, это эндотермическая реакция, необратимая, так как это реакция осаждения.
неорганическая химия. Реакция нитрата серебра и соляной кислоты
Одна из самых сложных частей химии — научиться распознавать тип реакции, основанный исключительно на ее реагентах.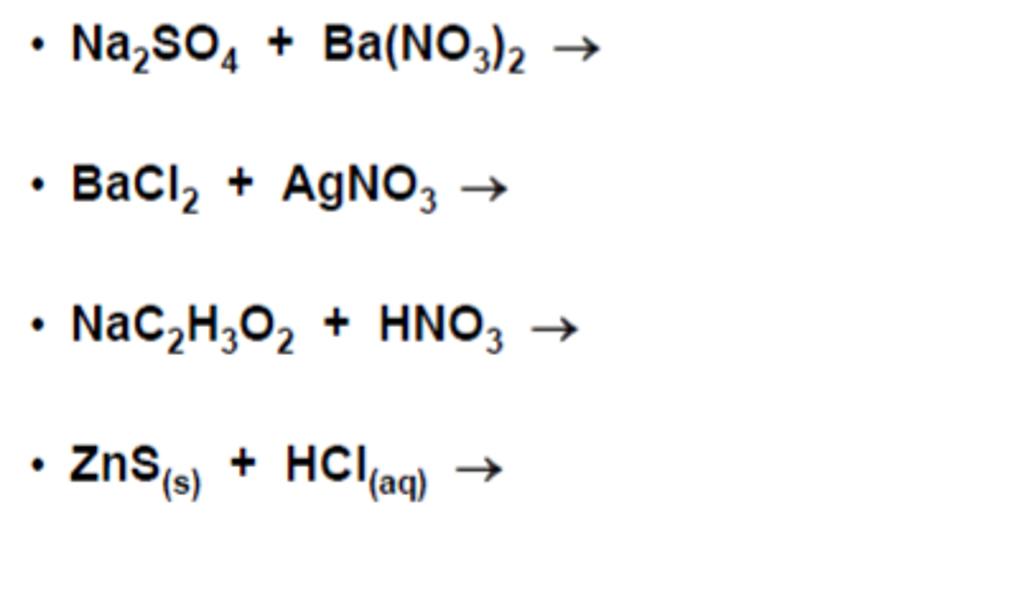 Это необходимо сделать до того, как вы сможете применить шаблон реакции к проблеме, поэтому очень важно сделать этот шаг правильно в самом начале.
Это необходимо сделать до того, как вы сможете применить шаблон реакции к проблеме, поэтому очень важно сделать этот шаг правильно в самом начале.
В этом случае вы смотрите на реакцию:
$$ \ce{AgNO3 + HCl -> AgCl + HNO3} $$
Вы уже знаете продукты, но задаетесь вопросом, как эти продукты могут образовываться, поскольку активность H больше, чем Ag, а это означает, что Ag легче окисляется, чем H. Это верно, но взгляните на окисление количество каждого вида в этой реакции:
$\ce{Ag: +1 -> +1}$
$\ce{NO3: -1 -> -1}$
$\ce{H: +1 -> +1}$
$\ce{Cl: -1 -> -1}$
Поскольку общего переноса электронов нет, это не может быть окислительно-восстановительной реакцией, а значит, активность здесь не имеет значения.
Это означает, что для этой реакции должна быть другая движущая сила — другая модель реакции, которая лучше подходит.
Я не хочу давать вам прямой ответ, но я дам вам несколько советов, которые должны помочь:
Напишите полное уравнение — , включая фазы.
$$ \ce{AgNO3(водн.) + HCl(водн.) -> AgCl(s) + HNO3(водн.)} $$
Посмотрите, сможете ли вы найти другую модель реакции, которая лучше соответствует этому уравнению. Позже я обновлю этот ответ, чтобы показать, как вы можете определить правильную схему водных реакций, используя только реагенты.
Обновление
Как я уже упоминал, одна из самых сложных частей химии — научиться идентифицировать модели реакций, основанные только на реагентах. Это реакция двойного замещения (или метатезиса, или осаждения). Теперь это легко увидеть, учитывая, что реагенты водные и по крайней мере один из продуктов твердый (осадок). Образование твердого вещества является движущей силой этой реакции — быстрое объяснение состоит в том, что силы, притягивающие ионы серебра и хлорида вместе, сильнее, чем силы сольватации между этими ионами и водой, а также силы, удерживающие их с ионами натрия и нитрата.
Это хорошо, но как заранее предсказать, что это реакция осаждения?
Ключ в том, чтобы иметь хорошее представление о трех распространенных типах реакций соли/кислоты/основы, происходящих в водном растворе, и научиться распознавать подсказки в реагентах.
Вкратце, наиболее часто встречаются следующие три типа:
- Осадки
- Кислота/основание (определение Аррениуса)
- Окислительно-восстановительный потенциал (одинарный рабочий объем)
Вы можете распознать каждый из них по реагентам, если знаете, что искать.
Осаждение — Две растворимые соли (ионогенные соединения) или соли с кислотой или основанием.
Кислота/основание — Кислота Аррениуса и основание (соединение, содержащее гидроксид)
Окислительно-восстановительный потенциал — соль или кислота и элементный металл
Существует много других типов реакций, которые происходят в водном растворе, множество вариаций кислотно-щелочной и окислительно-восстановительной категорий, но эти три охватывают случаи, наиболее часто встречающиеся в классе.
После того, как вы определили вероятный шаблон, по которому будет следовать реакция, следующим шагом будет предсказание продуктов, использующих этот шаблон, чтобы увидеть, имеют ли они смысл.

 Элемент кислорода имеет 3 атома.
Элемент кислорода имеет 3 атома.

 И уравнять количество атомов с обеих сторон.
И уравнять количество атомов с обеих сторон. Таким образом, уравнение уравновешивается.
Таким образом, уравнение уравновешивается.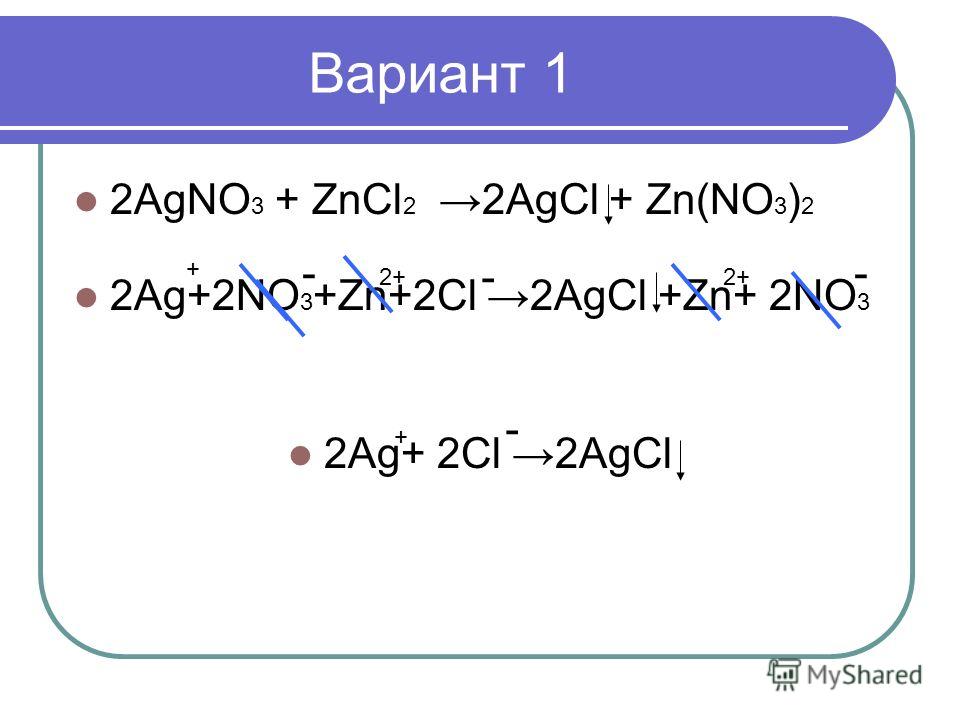

 Два атома водорода и три кислорода. Следовательно, уравнение находится в сбалансированной форме.
Два атома водорода и три кислорода. Следовательно, уравнение находится в сбалансированной форме.  можно использовать метод.
можно использовать метод.
Leave A Comment