физик Дмитрий Бузунов разложил на атомы вопросы школьников
Авторизация Регистрация
Сброс пароля
Подпишитесь на «СР-КУРЬЕР» Быстрая и маленькая, как атом, газета — доставляем свежие новости из «Росатома», России и мира прямиком в ваш почтовый ящик
Больше не показывать
Вы знаете больше и готовы рассказать?
У вас есть интересная история или вы знаете больше о теме, по которой мы уже выпустили материал. Поделитесь с СР любой идеей. Ждем ваших сообщений!
Прикрепить файл
Отправить
Что такое изотопы? Как уран попадает в реактор? Где применяют радиоактивные элементы? На встрече «100 вопросов ученому», организованной Политехническим музеем, на вопросы детей и их родителей ответил сотрудник Института проблем химической физики РАН Дмитрий Бузунов. Наш корреспондент побывала на лекции в павильоне «Рабочий и колхозница» на ВДНХ и записала самое интересное.
Наш корреспондент побывала на лекции в павильоне «Рабочий и колхозница» на ВДНХ и записала самое интересное.
Как устроен атом?
Атом состоит из плотного ядра положительно заряженных протонов и электрически нейтральных нейтронов, которое окружено облаком отрицательно заряженных электронов. В таблице Менделеева первое место занимает легкий газ водород, его порядковый номер 1. Ядро атома водорода называется «протон», что в переводе с древнегреческого означает «первый, основной». Вокруг ядра атома водорода движется один электрон. Зная порядковый номер любого химического элемента в периодической системе Менделеева, можно представить себе строение атомов. Например, порядковый номер кислорода — 8. Следовательно, в ядре атома кислорода восемь протонов, а на электронных оболочках находится восемь электронов. Его атомная масса равна 16. Масса ядра — это сумма масс протонов и нейтронов. Протонов у кислорода восемь, значит, и нейтронов у него восемь.
В таблице Менделеева мы видим, что каждый элемент существует в единичном экземпляре.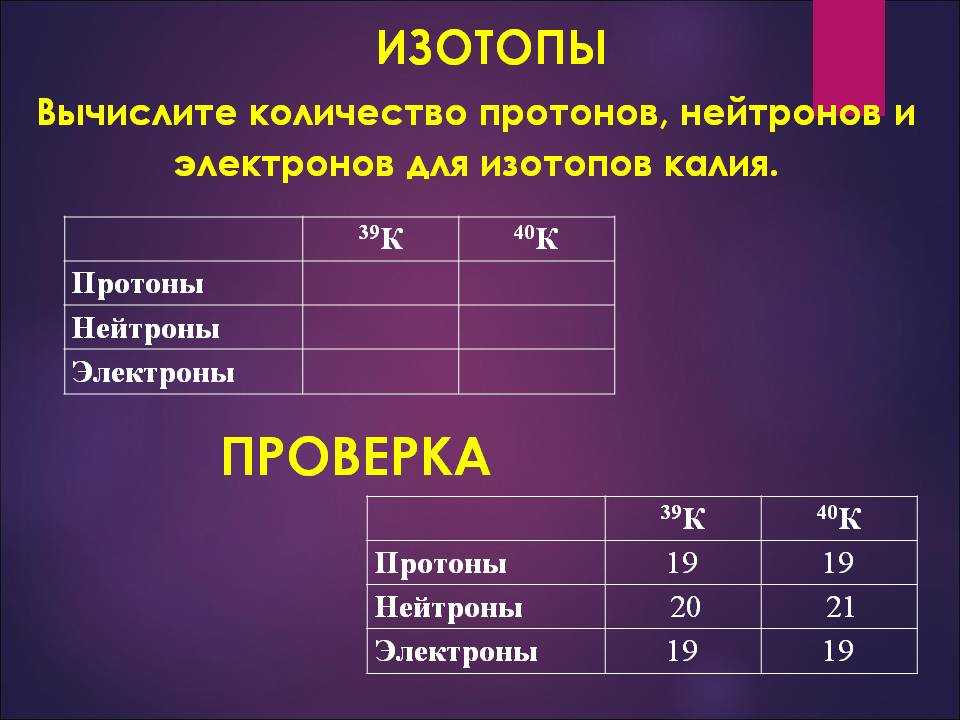 Может ли быть несколько вариантов кислорода или углерода?
Может ли быть несколько вариантов кислорода или углерода?
Да, есть такое понятие, как изотопы. Например, атомная масса кислорода равна 16 — в этом элементе восемь протонов и восемь нейтронов. Если добавить еще один нейтрон, получим атомную массу 17. Увеличим еще на один — атомная масса будет равна 18. В природе такие разновидности кислорода встречаются редко, но люди научились их получать. Изотопы 17 и 18 менее стабильны, чем изотоп 16, а в таблице указаны лишь самые стабильные химические элементы. Изотопы углерода часто используют в медицине.
Где применяют радиоактивные элементы?
Их часто используют в медицине для диагностики и лечения заболеваний небольшими дозами радиоактивного излучения, которое не приносит вреда. Активно применяют в онкологии. Гамма-лучи оказывают разрушающее действие на клетки злокачественных опухолей. Лучевое лечение безболезненно и удобно для больного. С помощью искусственных радиоактивных веществ можно не только лечить, но и диагностировать ранние признаки некоторых болезней, например опухоли мозга.
Какой элемент чаще всего используется в атомной энергетике?
Уран. Это основное топливо для атомных реакторов. Он имеет 26 изотопов, самые распространенные — уран‑235, 238, 239. То есть к 92 протонам урана добавляется разное количество нейтронов. Такой большой атом нестабилен и может развалиться. Это называется радиоактивным распадом. Все элементы имеют свой период распада, но для стабильных этот период очень большой — несколько миллионов лет.
Как работает АЭС?
Сердце станции — реактор, который за счет цепной реакции выделяет тепло для нагрева жидкости. В основе этой реакции лежит деление атомов нейтронами. После расщепления одного атома появляются новые нейтроны, которые и дальше разбивают атомы. Количество нейтронов постоянно растет, атомов делится все больше, растет температура. Охлаждая реактор, вода нагревается и превращается в пар. Пар раскручивает турбину, которая вырабатывает электричество. Если не остановить процесс деления атомов, энергии будет слишком много, и произойдет взрыв. В реакторе есть стержни управления, которые поглощают нейтроны и тормозят реакцию.
Охлаждая реактор, вода нагревается и превращается в пар. Пар раскручивает турбину, которая вырабатывает электричество. Если не остановить процесс деления атомов, энергии будет слишком много, и произойдет взрыв. В реакторе есть стержни управления, которые поглощают нейтроны и тормозят реакцию.
Как уран попадает в реактор?
Его загружают в реактор в специальных картриджах, которые называются тепловыделяющими сборками. В одном реакторе их количество может доходить до нескольких сотен. Топливные сборки доставляют на специальных платформах и загружают краном. 1 г урана‑235 позволяет получить столько же энергии, сколько получают, сжигая топливо, произведенное из 2 т нефти.
Что произойдет, если перестать загружать уран в атомный реактор? А если не охлаждать реактор?
В какой-то момент реактор просто остановится, не будет давать достаточное количество энергии, и атомная станция перестанет работать. А если не охлаждать атомный реактор, то он перегреется и может повредиться.
В чем плюсы атомной энергетики?
Угольные и дизельные электростанции сильно загрязняют окружающую среду. Существуют чистые источники энергии, основанные на использовании ветра, воды и солнца, но не везде можно поставить солнечную батарею или ветростанцию. Атомная энергия тоже чистая, но несет определенные риски. А вот управляемый термоядерный синтез сможет обеспечить чистую, безопасную, дешевую энергию. Это наше будущее.
ВОПРОСЫ ОТ РЕДАКЦИИ
— Что физика — это сложно, признают даже сами физики. Но почему многие школьники считают, что это еще и скучно? И как преподавать физику нескучно?
— Все зависит от преподавателя. Важно, чтобы ребенок понимал, какие процессы стоят за формулами. Когда на физике изучают радиоактивный распад, надо объяснять, что это касается атомных станций, рассказывать об интересных разработках, которые сейчас ведутся в атомной отрасли, о рисках, с которыми люди могут столкнуться в обычной жизни.
— Нужны ли специализированные физико-математические школы? Многие считают их пережитком прошлого и уверены, что сегодня не время узких специалистов.
— Да, нужны. Сейчас есть тренд на междисциплинарные исследования, но обычно ими занимается команда специалистов узкого профиля. Специализированные школы дают не только отличную базу за счет программы и преподавателей, но и возможность понять, интересно ли направление, еще до поступления в вуз.
— А вас когда увлекла физика?
— Я окончил Курчатовскую школу. Когда перешел в специализированный 10-й класс, школьную программу нам объясняли преподаватели из Московского физико-технического института. На уроках приводили примеры из реальных исследований, объясняли как взрослым. Становилось понятно, для чего мы учим каждую тему и как это пригодится в будущем.
— Какие книги, подкасты, передачи можете посоветовать школьникам, которые увлекаются физикой?
— Во-первых, есть «ПостНаука» — проект о современной фундаментальной науке и ученых, которые ее создают, о популяризации научных знаний. В том числе я слушаю их подкасты. Есть профильные журналы — например, уже винтажный «Квант», в архиве на сайте можно найти все выпуски. Могу посоветовать сборник лекций американского ученого Ричарда Фейнмана, а также книги о нем и его размышлениях.
В том числе я слушаю их подкасты. Есть профильные журналы — например, уже винтажный «Квант», в архиве на сайте можно найти все выпуски. Могу посоветовать сборник лекций американского ученого Ричарда Фейнмана, а также книги о нем и его размышлениях.
Есть интересная история?
Напишите нам
Читайте также:
КИСЛОРОД | Энциклопедия Кругосвет
Содержание статьи- Историческая справка.
- Строение атома.
- Молекулярный кислород.
- Электронная структура.
- Реакции.
- Получение и применение.
- Электролиз.
- Термическая диссоциация.
- Физические свойства.
- Химические свойства.
- Пероксид водорода.
- Оксоанионы и оксокатионы
- Озон.
КИСЛОРОД, O (oxygenium), химический элемент VIA подгруппы периодической системы элементов: O, S, Se, Te, Po – член семейства халькогенов. Это наиболее распространенный в природе элемент, его содержание составляет в атмосфере Земли 21% (об.), в земной коре в виде соединений ок. 50% (масс.) и в гидросфере 88,8% (масс.).
Это наиболее распространенный в природе элемент, его содержание составляет в атмосфере Земли 21% (об.), в земной коре в виде соединений ок. 50% (масс.) и в гидросфере 88,8% (масс.).
Кислород необходим для существования жизни на земле: животные и растения потребляют кислород в процессе дыхания, а растения выделяют кислород в процессе фотосинтеза. Живая материя содержит связанный кислород не только в составе жидкостей организма (в клетках крови и др.), но и в составе углеводов (сахар, целлюлоза, крахмал, гликоген), жиров и белков. Глины, горные породы состоят из силикатов и других кислородсодержащих неорганических соединений, таких, как оксиды, гидроксиды, карбонаты, сульфаты и нитраты.
Историческая справка.
Первые сведения о кислороде стали известны в Европе из китайских рукописей 8 в. В начале 16 в. Леонардо да Винчи опубликовал данные, связанные с химией кислорода, не зная еще, что кислород – элемент. Реакции присоединения кислорода описаны в научных трудах С.Гейлса (1731) и П. Байена (1774). Заслуживают особого внимания исследования К.Шееле в 1771–1773 взаимодействия металлов и фосфора с кислородом. Дж.Пристли сообщил об открытии кислорода как элемента в 1774, спустя несколько месяцев после сообщения Байена о реакциях с воздухом. Название oxygenium («кислород») дано этому элементу вскоре после его открытия Пристли и происходит от греческих слов, обозначающих «рождающий кислоту»; это связано с ошибочным представлением о том, что кислород присутствует во всех кислотах. Объяснение роли кислорода в процессах дыхания и горения, однако, принадлежит А.Лавуазье (1777).
Байена (1774). Заслуживают особого внимания исследования К.Шееле в 1771–1773 взаимодействия металлов и фосфора с кислородом. Дж.Пристли сообщил об открытии кислорода как элемента в 1774, спустя несколько месяцев после сообщения Байена о реакциях с воздухом. Название oxygenium («кислород») дано этому элементу вскоре после его открытия Пристли и происходит от греческих слов, обозначающих «рождающий кислоту»; это связано с ошибочным представлением о том, что кислород присутствует во всех кислотах. Объяснение роли кислорода в процессах дыхания и горения, однако, принадлежит А.Лавуазье (1777).
Строение атома.
Любой природный атом кислорода содержит 8 протонов в ядре, но число нейтронов может быть равно 8, 9 или 10. Наиболее распространенный из трех изотопов кислорода (99,76%) – это 168O (8 протонов и 8 нейтронов). Содержание другого изотопа, 188O (8 протонов и 10 нейтронов), составляет всего 0,2%. Этот изотоп используется как метка или для идентификации некоторых молекул, а также для проведения биохимических и медико-химических исследований (метод изучения нерадиоактивных следов).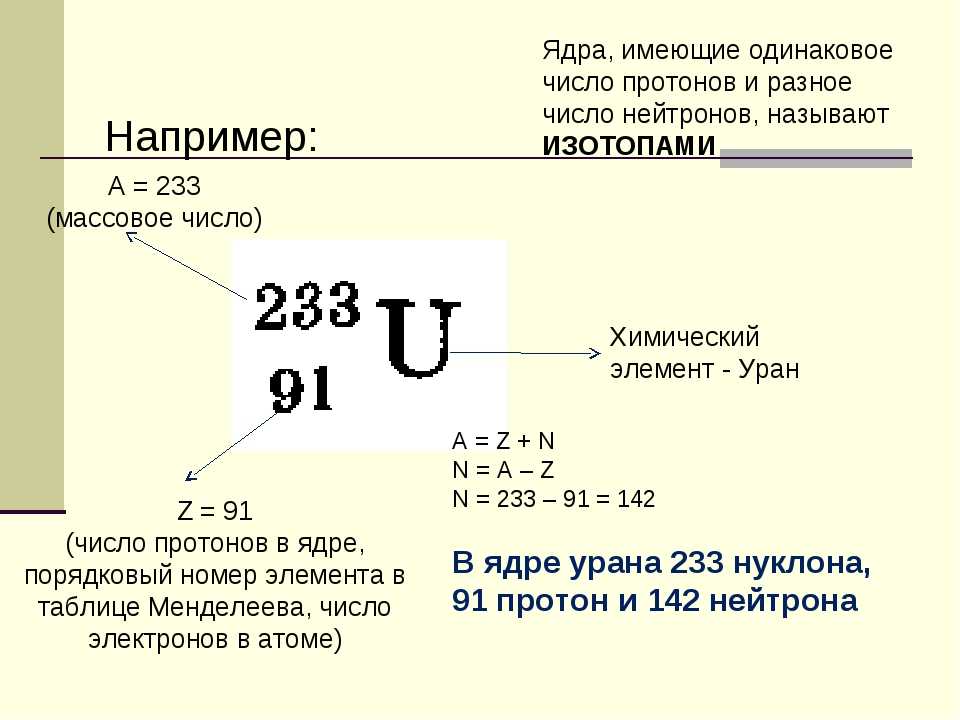 Третий нерадиоактивный изотоп кислорода 178O (0,04%) содержит 9 нейтронов и имеет массовое число 17. После того как в 1961 масса изотопа углерода 126C была принята Международной комиссией за стандартную атомную массу, средневзвешенная атомная масса кислорода стала равна 15,9994. До 1961 стандартной единицей атомной массы химики считали атомную массу кислорода, принятую для смеси трех природных изотопов кислорода равной 16,000. Физики за стандартную единицу атомной массы принимали массовое число изотопа кислорода 168O, поэтому по физической шкале средняя атомная масса кислорода составляла 16,0044 (см. также АТОМНАЯ МАССА).
Третий нерадиоактивный изотоп кислорода 178O (0,04%) содержит 9 нейтронов и имеет массовое число 17. После того как в 1961 масса изотопа углерода 126C была принята Международной комиссией за стандартную атомную массу, средневзвешенная атомная масса кислорода стала равна 15,9994. До 1961 стандартной единицей атомной массы химики считали атомную массу кислорода, принятую для смеси трех природных изотопов кислорода равной 16,000. Физики за стандартную единицу атомной массы принимали массовое число изотопа кислорода 168O, поэтому по физической шкале средняя атомная масса кислорода составляла 16,0044 (см. также АТОМНАЯ МАССА).
В атоме кислорода 8 электронов, при этом 2 электрона находятся на внутреннем уровне, а 6 электронов – на внешнем. Поэтому в химических реакциях кислород может принимать от доноров до двух электронов, достраивая свою внешнюю оболочку до 8 электронов и образуя избыточный отрицательный заряд (см.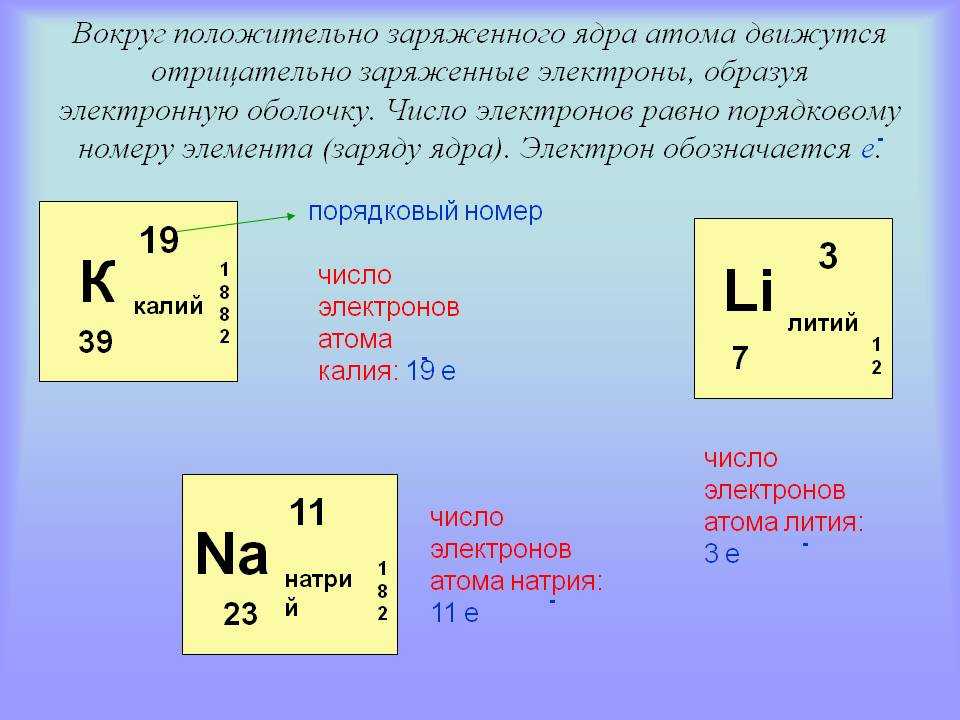 также АТОМА СТРОЕНИЕ).
также АТОМА СТРОЕНИЕ).
Молекулярный кислород.
Как большинство других элементов, у атомов которых для достройки внешней оболочки из 8 электронов не хватает 1–2 электронов, кислород образует двухатомную молекулу. В этом процессе выделяется много энергии (~490 кДж/моль) и соответственно столько же энергии необходимо затратить для обратного процесса диссоциации молекулы на атомы. Прочность связи O–O настолько высока, что при 2300° С только 1% молекул кислорода диссоциирует на атомы. (Примечательно, что при образовании молекулы азота N2 прочность связи N–N еще выше, ~710 кДж/моль.)
Электронная структура.
В электронной структуре молекулы кислорода не реализуется, как можно было ожидать, распределение электронов октетом вокруг каждого атома, а имеются неспаренные электроны, и кислород проявляет свойства, типичные для такого строения (например, взаимодействует с магнитным полем, являясь парамагнетиком).
Реакции.
В соответствующих условиях молекулярный кислород реагирует практически с любым элементом, кроме благородных газов. Однако при комнатных условиях только наиболее активные элементы реагируют с кислородом достаточно быстро. Вероятно, большинство реакций протекает только после диссоциации кислорода на атомы, а диссоциация происходит лишь при очень высоких температурах. Однако катализаторы или другие вещества в реагирующей системе могут способствовать диссоциации O2. Известно, что щелочные (Li, Na, K) и щелочноземельные (Ca, Sr, Ba) металлы реагируют с молекулярным кислородом с образованием пероксидов:
Однако при комнатных условиях только наиболее активные элементы реагируют с кислородом достаточно быстро. Вероятно, большинство реакций протекает только после диссоциации кислорода на атомы, а диссоциация происходит лишь при очень высоких температурах. Однако катализаторы или другие вещества в реагирующей системе могут способствовать диссоциации O2. Известно, что щелочные (Li, Na, K) и щелочноземельные (Ca, Sr, Ba) металлы реагируют с молекулярным кислородом с образованием пероксидов:
Получение и применение.
Благодаря наличию свободного кислорода в атмосфере наиболее эффективным методом его извлечения является сжижение воздуха, из которого удаляют примеси, CO2, пыль и т.д. химическими и физическими методами. Циклический процесс включает сжатие, охлаждение и расширение, что и приводит к сжижению воздуха. При медленном подъеме температуры (метод фракционной дистилляции) из жидкого воздуха испаряются сначала благородные газы (наиболее трудно сжижаемые), затем азот и остается жидкий кислород. В результате жидкий кислород содержит следы благородных газов и относительно большой процент азота. Для многих областей применения эти примеси не мешают. Однако для получения кислорода особой чистоты процесс дистилляции необходимо повторять. Кислород хранят в танках и баллонах. Он используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах. Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна по методу Бессемера для быстрого и эффективного удаления примесей C, S и P. Сталь при кислородном дутье получается быстрее и качественнее, чем при воздушном. Кислород используется также для сварки и резки металлов (кислородно-ацетиленовое пламя). Применяют кислород и в медицине, например, для обогащения дыхательной среды пациентов с затрудненном дыханием. Кислород можно получать различными химическими методами, и некоторые из них применяют для получения малых количеств чистого кислорода в лабораторной практике.
В результате жидкий кислород содержит следы благородных газов и относительно большой процент азота. Для многих областей применения эти примеси не мешают. Однако для получения кислорода особой чистоты процесс дистилляции необходимо повторять. Кислород хранят в танках и баллонах. Он используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах. Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна по методу Бессемера для быстрого и эффективного удаления примесей C, S и P. Сталь при кислородном дутье получается быстрее и качественнее, чем при воздушном. Кислород используется также для сварки и резки металлов (кислородно-ацетиленовое пламя). Применяют кислород и в медицине, например, для обогащения дыхательной среды пациентов с затрудненном дыханием. Кислород можно получать различными химическими методами, и некоторые из них применяют для получения малых количеств чистого кислорода в лабораторной практике.
Электролиз.
Один из методов получения кислорода – электролиз воды, содержащей небольшие добавки NaOH или H2SO4 в качестве катализатора: 2H2O ® 2H2 + O2. При этом образуются небольшие примеси водорода. С помощью разрядного устройства следы водорода в газовой смеси вновь превращают в воду, пары которой удаляют вымораживанием или адсорбцией.
Термическая диссоциация.
Важный лабораторный метод получения кислорода, предложенный Дж.Пристли, заключается в термическом разложении оксидов тяжелых металлов: 2HgO ® 2Hg + O2. Пристли для этого фокусировал солнечные лучи на порошок оксида ртути. Известным лабораторным методом является также термическая диссоциация оксосолей, например хлората калия в присутствии катализатора – диоксида марганца:
Диоксид марганца, добавляемый в небольших количествах перед прокаливанием, позволяет поддерживать требуемую температуру и скорость диссоциации, причем сам MnO2 в процессе не изменяется.
Используются также способы термического разложения нитратов:
а также пероксидов некоторых активных металлов, например:
2BaO2® 2BaO + O2
Последний способ одно время широко использовался для извлечения кислорода из атмосферы и заключался в нагревании BaO на воздухе до образования BaO2 с последующим термическим разложением пероксида. Способ термического разложения сохраняет свое значение для получения пероксида водорода.
| НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА | |
| Атомный номер | 8 |
| Атомная масса | 15,9994 |
| Температура плавления, °С | –218,4 |
| Температура кипения, °С | –183,0 |
| Плотность | |
| твердый, г/см3 (при tпл) | 1,27 |
| жидкий г/см3 (при tкип) | 1,14 |
| газообразный, г/дм3 (при 0° С) | 1,429 |
| относительная по воздуху | 1,105 |
| критическаяа, г/см3 | 0,430 |
| Критическая температураа, °С | –118,8 |
| Критическое давлениеа, атм | 49,7 |
| Растворимость, см3/100 мл растворителя | |
| в воде (0° С) | 4,89 |
| в воде (100° С) | 1,7 |
| в спирте (25° С) | 2,78 |
| Радиус, Å | 0,74 |
| ковалентный | 0,66 |
| ионный (О2–) | 1,40 |
| Потенциал ионизации, В | |
| первый | 13,614 |
| второй | 35,146 |
| Электроотрицательность (F = 4) | 3,5 |
а Температура и давление, при которых плотность газа и жидкости одинаковы. | |
Физические свойства.
Кислород при нормальных условиях – бесцветный газ без запаха и вкуса. Жидкий кислород имеет бледно-голубой цвет. Твердый кислород существует по крайней мере в трех кристаллических модификациях. Газообразный кислород растворим в воде и, вероятно, образует непрочные соединения типа O2ЧH2O, а возможно, и O2Ч2H2O.
Химические свойства.
Как уже упоминалось, химическая активность кислорода определяется его способностью диссоциировать на атомы O, которые и отличаются высокой реакционной способностью. Только наиболее активные металлы и минералы реагируют с O2 c высокой скоростью при низких температурах. Наиболее активные щелочные (IA подгруппы) и некоторые щелочноземельные (IIA подгруппы) металлы образуют с O2 пероксиды типа NaO2 и BaO2. Другие же элементы и соединения реагируют только с продуктом диссоциации O2. В подходящих условиях все элементы, исключая благородные газы и металлы Pt, Ag, Au, реагируют с кислородом. Эти металлы тоже образуют оксиды, но при особых условиях.
Эти металлы тоже образуют оксиды, но при особых условиях.
Электронная структура кислорода (1s22s22p4) такова, что атом O принимает для образования устойчивой внешней электронной оболочки два электрона на внешний уровень, образуя ион O2–. В оксидах щелочных металлов образуется преимущественно ионная связь. Можно полагать, что электроны этих металлов практически целиком оттянуты к кислороду. В оксидах менее активных металлов и неметаллов переход электронов неполный, и плотность отрицательного заряда на кислороде менее выражена, поэтому связь менее ионная или более ковалентная.
При окислении металлов кислородом происходит выделение тепла, величина которого коррелирует с прочностью связи M–O. При окислении некоторых неметаллов происходит поглощение тепла, что свидетельствует об их менее прочных связях с кислородом. Такие оксиды термически неустойчивы (или менее стабильны, чем оксиды с ионной связью) и часто отличаются высокой химической активностью. В таблице приведены для сравнения значения энтальпий образования оксидов наиболее типичных металлов, переходных металлов и неметаллов, элементов A- и B-подгрупп (знак минус означает выделение тепла).
В таблице приведены для сравнения значения энтальпий образования оксидов наиболее типичных металлов, переходных металлов и неметаллов, элементов A- и B-подгрупп (знак минус означает выделение тепла).
| Реакции | Энтальпии образования, кДж/моль |
| 4Na + O2 ® 2Na2Oa | –208 |
| 2Mg + O2 ® 2MgO | –297 |
| 4Al + 3O2 ® 2Al2O3 | –273 |
| Si + O2 ® SiO2 | –215 |
| 4P + 5O2 ® P4O10 | –151 |
| S + O2 ® SO2 | –74 |
| 2Cl2 + 7O2 ® 2Cl2O7 | +19 |
| 2Hg + O2 ® 2HgO | –45 |
| 2Cr + 3O2 ® 2CrO3 | –97 |
| 3Fe + 2O2 ® Fe3O4 | –140 |
a При нормальных условиях предпочтительнее образование Na2O2. | |
О свойствах оксидов можно сделать несколько общих выводов:
1. Температуры плавления оксидов щелочных металлов уменьшаются с ростом атомного радиуса металла; так, tпл (Cs2O) tпл (Na2O). Оксиды, в которых преобладает ионная связь, имеют более высокие температуры плавления, чем температуры плавления ковалентных оксидов: tпл (Na2O) > tпл (SO2).
2. Оксиды химически активных металлов (IA–IIIA подгрупп) более термически стабильны, чем оксиды переходных металлов и неметаллов. Оксиды тяжелых металлов в высшей степени окисления при термической диссоциации образуют оксиды с более низкими степенями окисления (например, 2Hg2+O ® (Hg+)2O + 0,5O2® 2Hg0 + O2). Такие оксиды в высоких степенях окисления могут быть хорошими окислителями.
3. Наиболее активные металлы взаимодействуют с молекулярным кислородом при повышенных температурах с образованием пероксидов:
Sr + O2® SrO2.
4. Оксиды активных металлов образуют бесцветные растворы, тогда как оксиды большинства переходных металлов окрашены и практически нерастворимы. Водные растворы оксидов металлов проявляют основные свойства и являются гидроксидами, содержащими OH-группы, а оксиды неметаллов в водных растворах образуют кислоты, содержащие ион H+.
5. Металлы и неметаллы A-подгрупп образуют оксиды со степенью окисления, соответствующей номеру группы, например, Na, Be и B образуют Na12O, BeIIO и B2IIIO3, а неметаллы IVA–VIIA подгрупп C, N, S, Cl образуют CIVO2, NV2O5, SVIO3, ClVII2O7. Номер группы элемента коррелирует только с максимальной степенью окисления, так как возможны оксиды и с более низкими степенями окисления элементов. В процессах горения соединений типичными продуктами являются оксиды, например:
2H2S + 3O2® 2SO2 + 2H2O
Углеродсодержащие вещества и углеводороды при слабом нагревании окисляются (сгорают) до CO2 и H2O. Примерами таких веществ являются топлива – древесина, нефть, спирты (а также углерод – каменный уголь, кокс и древесный уголь). Тепло от процесса горения утилизируется на производство пара (а далее электричества или идет на силовые установки), а также на отопление домов. Типичные уравнения для процессов горения таковы:
Примерами таких веществ являются топлива – древесина, нефть, спирты (а также углерод – каменный уголь, кокс и древесный уголь). Тепло от процесса горения утилизируется на производство пара (а далее электричества или идет на силовые установки), а также на отопление домов. Типичные уравнения для процессов горения таковы:
а) древесина (целлюлоза):
(C6H10O5)n + 6nO2® 6nCO2 + 5nH2O + тепловая энергия
б) нефть или газ (бензин C8H18 или природный газ CH4):
2C8H18 + 25O2® 16CO2 + 18H2O + тепловая энергия
CH4 + 2O2® CO2 + 2H2O + тепловая энергия
в) спирт:
C2H5OH + 3O2® 2CO2 + 3H2O + тепловая энергия
г) углерод (каменный или древесный уголь, кокс):
2C + O2® 2CO + тепловая энергия
2CO + O2® 2CO2 + тепловая энергия
Горению подвержены также ряд C-, H-, N-, O-содержащих соединений с высоким запасом энергии. Кислород для окисления может использоваться не только из атмосферы (как в предыдущих реакциях), но и из самого вещества. Для инициирования реакции достаточно небольшого активирования реакции, например удара или встряски. При этих реакциях продуктами горения также являются оксиды, но все они газообразны и быстро расширяются при высокой конечной температуре процесса. Поэтому такие вещества являются взрывчатыми. Примерами взрывчатых веществ служат тринитроглицерин (или нитроглицерин) C3H5(NO3)3 и тринитротолуол (или ТНТ) C7H5(NO2)3. См. также ХИМИЧЕСКОЕ И БИОЛОГИЧЕСКОЕ ОРУЖИЕ.
Кислород для окисления может использоваться не только из атмосферы (как в предыдущих реакциях), но и из самого вещества. Для инициирования реакции достаточно небольшого активирования реакции, например удара или встряски. При этих реакциях продуктами горения также являются оксиды, но все они газообразны и быстро расширяются при высокой конечной температуре процесса. Поэтому такие вещества являются взрывчатыми. Примерами взрывчатых веществ служат тринитроглицерин (или нитроглицерин) C3H5(NO3)3 и тринитротолуол (или ТНТ) C7H5(NO2)3. См. также ХИМИЧЕСКОЕ И БИОЛОГИЧЕСКОЕ ОРУЖИЕ.
Оксиды металлов или неметаллов с низшими степенями окисления элемента реагируют с кислородом с образованием оксидов высоких степеней окисления этого элемента:
Оксиды природные, полученные из руд или синтезированные, служат сырьем для получения многих важных металлов, например, железа из Fe2O3 (гематит) и Fe3O4 (магнетит), алюминия из Al2O3 (глинозем), магния из MgO (магнезия). Оксиды легких металлов используются в химической промышленности для получения щелочей или оснований. Пероксид калия KO2 находит необычное применение, так как в присутствии влаги и в результате реакции с ней выделяет кислород. Поэтому KO2 применяют в респираторах для получения кислорода. Влага из выдыхаемого воздуха выделяет в респираторе кислород, а KOH поглощает CO2. Получение оксида CaO и гидроксида кальция Ca(OH)2 – многотоннажное производство в технологии керамики и цемента.
Оксиды легких металлов используются в химической промышленности для получения щелочей или оснований. Пероксид калия KO2 находит необычное применение, так как в присутствии влаги и в результате реакции с ней выделяет кислород. Поэтому KO2 применяют в респираторах для получения кислорода. Влага из выдыхаемого воздуха выделяет в респираторе кислород, а KOH поглощает CO2. Получение оксида CaO и гидроксида кальция Ca(OH)2 – многотоннажное производство в технологии керамики и цемента.
Вода (оксид водорода).
Важность воды H2O как в лабораторной практике для химических реакций, так и в процессах жизнедеятельности требует особого рассмотрения этого вещества (см. также ВОДОРОД; ВОДА, ЛЕД И ПАР). Как уже упоминалось, при прямом взаимодействии кислорода и водорода в условиях, например, искрового разряда происходят взрыв и образование воды, при этом выделяется 143 кДж/(моль H2O).
Молекула воды имеет почти тетраэдрическое строение, угол H–O–H равен 104°30ў. Связи в молекуле частично ионные (30%) и частично ковалентные с высокой плотностью отрицательного заряда у кислорода и соответственно положительных зарядов у водорода:
Связи в молекуле частично ионные (30%) и частично ковалентные с высокой плотностью отрицательного заряда у кислорода и соответственно положительных зарядов у водорода:
Из-за высокой прочности связей H–O водород с трудом отщепляется от кислорода и вода проявляет очень слабые кислотные свойства. Многие свойства воды определяются распределением зарядов. Например, молекула воды образует с ионом металла гидрат:
Одну электронную пару вода отдает акцептору, которым может быть H+:
Молекулы воды связываются друг с другом в большие агрегаты (H2O)x слабыми водородными связями (энергия связи ~21 кДж)
Вода в такой системе водородных связей подвергается диссоциации в очень слабой степени, достигающей концентрации 10–7 моль/л. Очевидно, расщепление связи, показанное квадратными скобками, приводит к образованию гидроксид-иона OH– и иона гидроксония H3O+:
Пероксид водорода.

Другим соединением, состоящим только из водорода и кислорода, является пероксид водорода H2O2. Название «пероксид» принято для соединений, содержащих связь –O–O–. Пероксид водорода имеет строение асимметрично изогнутой цепи:
Пероксид водорода получают по реакции пероксида металла с кислотой
BaO2 + H2SO4® BaSO4 + H2O2
либо разложением пероксодисерной кислоты H2S2O8, которую получают электролитически:
Концентрированный раствор H2O2 может быть получен специальными методами дистилляции. Пероксид водорода используют как окислитель в двигателях ракет. Разбавленные растворы пероксида служат антисептиками, отбеливателями и мягкими окислителями. H2O2 добавляют ко многим кислотам и оксидам для получения соединений, аналогичных гидратам. В присутствии сильного окислителя (например, MnO2 или MnO4–) H2O2 окисляется, выделяя кислород и воду.
Оксоанионы и оксокатионы
– кислородсодержащие частицы, имеющие остаточный отрицательный (оксоанионы) или остаточный положительный (оксокатионы) заряд. Ион O2– имеет высокое сродство (высокую реакционную способность) к положительно заряженным частицам типа H+. Простейшим представителем стабильных оксоанионов является гидроксид-ион OH–. Это объясняет неустойчивость атомов с высокой зарядовой плотностью и их частичную стабилизацию в результате присоединения частицы с положительным зарядом. Поэтому при действии активного металла (или его оксида) на воду образуется OH–, а не O2–:
2Na + 2H2O ® 2Na+ + 2OH– + H2
или
Na2O + H2O ® 2Na+ + 2OH–
Более сложные оксоанионы образуются из кислорода с ионом металла или неметаллической частицей, имеющей большой положительный заряд, в результате получается низкозаряженная частица, обладающая большей стабильностью, например:
Озон.

Кроме атомарного кислорода O и двухатомной молекулы O2 существует третья форма кислорода – озон O3, содержащий три кислородных атома. Все три формы являются аллотропными модификациями. Озон образуется при пропускании тихого электрического разряда через сухой кислород: 3O2 2O3.
При этом образуется несколько процентов озона. Реакция катализируется ионами металлов. Озон имеет острый резкий запах, который можно обнаружить вблизи работающих электрических машин или в окрестности атмосферного электрического разряда. Газ имеет голубоватый цвет и конденсируется при –112° С в темноголубую жидкость, а при –193° С образуется темнопурпуровая твердая фаза. Жидкий озон слаборастворим в жидком кислороде, а в 100 г воды при 0° С растворяется 49 см3 O3. По химическим свойствам озон намного активнее кислорода и по окислительным свойствам уступает только O, F2 и OF2 (дифториду кислорода). При обычном окислении образуются оксид и молекулярный кислород O2. При действии озона на активные металлы в особых условиях образуются озониды состава K+O3–. Озон получают в промышленности для специальных целей, он является хорошим дезинфицирующим средством и используется для очистки воды и как отбеливатель, улучшает состояние атмосферы в закрытых системах, дезинфицирует предметы и пищу, ускоряет созревание зерна и фруктов. В химической лаборатории часто используют озонатор для получения озона, необходимого для некоторых методов химического анализа и синтеза. Каучук легко разрушается даже под действием малых концентраций озона. В некоторых промышленных городах значительная концентрация озона в воздухе приводит к быстрой порче резиновых изделий, если они не защищены антиоксидантами. Озон очень токсичен. Постоянное вдыхание воздуха даже с очень низкими концентрациями озона вызывает головную боль, тошноту и другие неприятные состояния.
При действии озона на активные металлы в особых условиях образуются озониды состава K+O3–. Озон получают в промышленности для специальных целей, он является хорошим дезинфицирующим средством и используется для очистки воды и как отбеливатель, улучшает состояние атмосферы в закрытых системах, дезинфицирует предметы и пищу, ускоряет созревание зерна и фруктов. В химической лаборатории часто используют озонатор для получения озона, необходимого для некоторых методов химического анализа и синтеза. Каучук легко разрушается даже под действием малых концентраций озона. В некоторых промышленных городах значительная концентрация озона в воздухе приводит к быстрой порче резиновых изделий, если они не защищены антиоксидантами. Озон очень токсичен. Постоянное вдыхание воздуха даже с очень низкими концентрациями озона вызывает головную боль, тошноту и другие неприятные состояния.
В элементе восемь протонов, девять нейтронов и восемь электронов….
В элементе восемь протонов, девять нейтронов и восемь электронов. … | Каналы для Pearson+
… | Каналы для Pearson+Последние каналы
- Общая биология
Химия
- Общая химия
- Органическая химия
8 90 G8 Химия
- Аналитика OB Химия
- Биохимия
Биология
- Общая биология
- Микробиология
- Анатомия и физиология
- Генетика
- Клеточная биология
Математика
- Колледж Алгебра
- Тригонометрия 90908 900us
- Precalc 002 Физика
- Физика
Бизнес
- Микроэкономика
- Макроэкономика
- Финансовый учет
Социальные науки
- Психология
Начните печатать, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.

Общая биология2. ChemistryAtoms- Наименьшая единица материи
Множественный выбор
8 и 16
9 и 16
9 и 17
8 и 17
След.
с небольшим видео объяснение от Джейсона Амореса СамптераНачать обучение
Видео по теме
Практика по теме
Структура атома
RicochetScience
227просмотров
Что такое атом? Лучшее объяснение
Обучение в
280просмотров
Путешествие в мир атомов
ЦЕРН
146просмотров
Атомы — наименьшая единица материи
705 2Джейсон Аморе 691views
Лучший способ изобразить атомы
minutephysics
204views
Структура атома и электроны — Структура атома — Что такое атомы — Нейтроны Протоны Электроны
Whats Up Dude
201просмотр
Что такое атом?
MonkeySee
146просмотров
Структура атома
Джейсон Аморес Самптер
704просмотров
Атомы – наименьшая единица материи Пример 1 9000 Amores Самптер Джейсон 0 723просмотров
Elements of Life
Джейсон Аморес Самптер
603просмотров
Atomic Properties
Jason Amores Sumpter
611views
Атомы — наименьшая единица материи Пример 2
Джейсон Аморес Самптер
624 просмотра
Электронные орбиты и энергетические оболочки
Джейсон Аморес Самптер
701 просмотр
Правило октетов 70005 900 Самптер Джейсон 521views
Атомы — мельчайшая единица материи Пример 3
Джейсон Аморес Самптер
487просмотров
4.
 7: Изотопы и массовые числа
7: Изотопы и массовые числа- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 289368
- Объяснить, что такое изотопы и как изотоп влияет на атомную массу элемента.
- Определите количество протонов, электронов и нейтронов элемента с данным массовым числом.
- Каково массовое число атома хрома (Cr), имеющего 30 нейтронов?
- Запишите различные обозначения изотопов или изотопные символы для этого изотопа.
- Cr имеет атомный номер ( Z ) 24, поэтому он имеет 24 p + . С 24 p + и 30 n 0 массовое число этого атома равно 54.
- Обозначения изотопов включают:
- хром-54 9{204}\mathrm{Hg}\)?
- Атомный номер равен 80, значит, 80 p + .
- Поскольку атом нейтрален, есть также 80 e – .
- Начиная с \(\text{массовое число}\:(A)=\text{число протонов}+\text{число нейтронов}\), переформулируйте уравнение, чтобы найти число нейтронов.

\(\text{количество нейтронов = массовое число}\:(A)-\text{количество протонов}\) = 204 – 80 = 124 n 0 9{45}_{20}\ce{Ca}\) - Ср-90
- Ответ А
- 27 п + , 27 д – , 33 п 0
- Ответ Б
- 11 п + , 11 д – , 13 п 0
- Ответ C
- 20 п + , 20 д – , 25 п 0
- Ответ D 9{94}\mathrm{Mo}\)
Решение
- Количество протонов всегда одинаково в атомах одного и того же элемента.
- Количество нейтронов может быть разным даже в атомах одного и того же элемента.
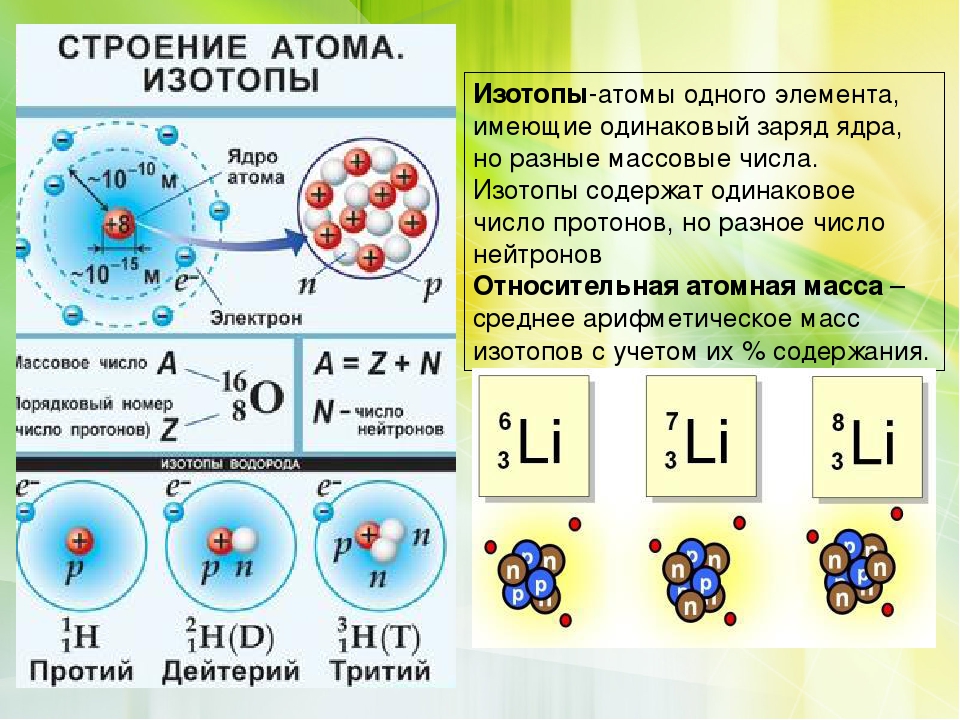
- Атомы одного и того же элемента, содержащие одинаковое количество протонов, но разное количество нейтронов, известны как изотопы .

⚙️ Цели обучения
Как обсуждалось в предыдущем разделе, атомы одного и того же элемента всегда имеют одинаковое количество протонов. Однако атомы одного и того же элемента могут иметь разное количество нейтронов. В то время как все атомы углерода имеют шесть протонов и большинство из них имеют шесть нейтронов, некоторые атомы углерода имеют семь нейтронов, а другие восемь.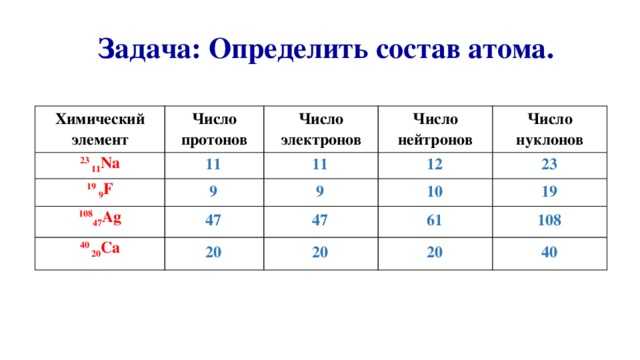 Атомы одного и того же элемента, различающиеся числом нейтронов, называются изотопами . Многие изотопы встречаются в природе. Довольно часто существует один или два изотопа элемента, которые являются наиболее стабильными и распространенными. Различные изотопы элемента обычно имеют одинаковые физические и химические свойства из-за того, что они имеют одинаковое количество протонов и электронов.
Атомы одного и того же элемента, различающиеся числом нейтронов, называются изотопами . Многие изотопы встречаются в природе. Довольно часто существует один или два изотопа элемента, которые являются наиболее стабильными и распространенными. Различные изотопы элемента обычно имеют одинаковые физические и химические свойства из-за того, что они имеют одинаковое количество протонов и электронов.
Массовое число
Массовое число (\(A\)) атома представляет собой сумму протонов и нейтронов в ядре этого атома и дает очень близкое приближение к массе атома в атомных единицах массы. Это связано с тем, что масса протона и нейтрона составляет около 1 а.е.м. каждая, а масса электрона по сравнению с ней очень мала.
\[\text{массовое число}\:(A)=\text{число протонов}+\text{число нейтронов}\]
Рассмотрим кислород, который имеет атомный номер (\(Z\)) из 8. Это означает, что атомы кислорода имеют 8 протонов. Большинство атомов кислорода также имеют 8 нейтронов.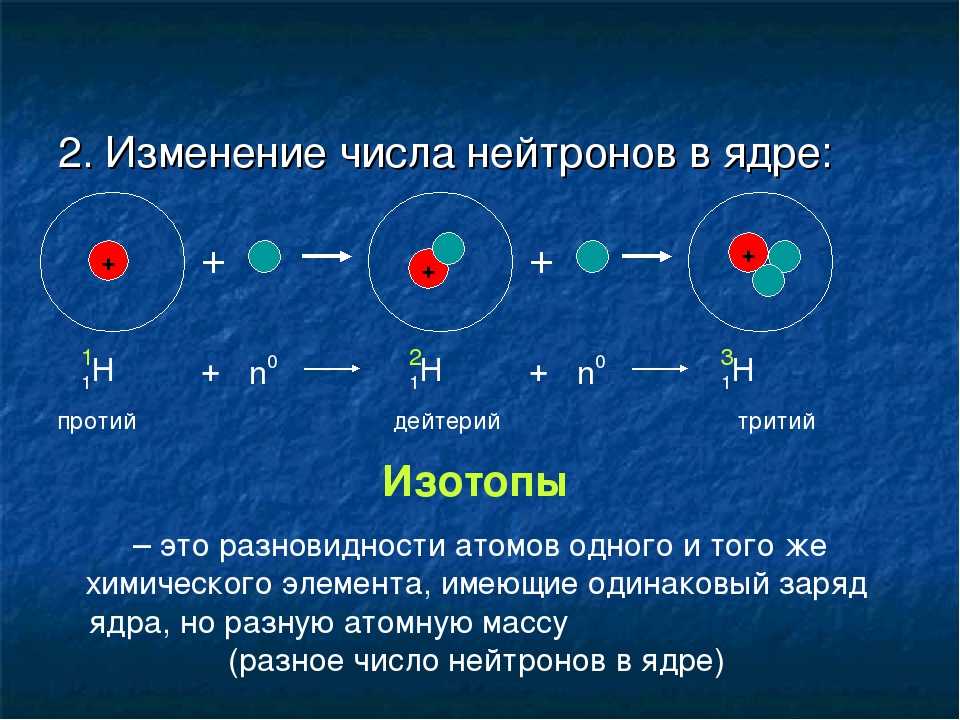 0\)), что означает, что они будут иметь массу около 16 а.е.м. 90\)), что означает, что они будут иметь массу около 18 а.е.м.
0\)), что означает, что они будут иметь массу около 16 а.е.м. 90\)), что означает, что они будут иметь массу около 18 а.е.м.
Обозначение изотопов
Три типа атомов кислорода, описанные выше, представляют собой три встречающихся в природе изотопов кислорода. Хотя существует несколько других известных изотопов кислорода, они нигде не встречаются в природе и могут быть синтезированы только в лаборатории, что не обязательно является «легким» занятием.
Изотопы элементов обозначаются их массовым числом. Атомы кислорода с массовым числом 16 называются кислородом-16, или О-16, тогда как атомы кислорода с массовым числом 17 называются кислородом-17, или О-17, а атомы кислорода с массовым числом 18 называются кислород-18 или О-18. 9{\mathrm A}\mathrm X\)
Если предположить, что атомы нейтральны, количество протонов, электронов и нейтронов в одном атоме каждого из трех встречающихся в природе изотопов кислорода показано в таблице \(\PageIndex{ 1}\) ниже.
| Изотоп | Аббревиатура | Символ изотопов | 9{18}\матрм О\)8 | 8 | 10 |
|---|
Важно отметить, что массовое число , а не , указанное в периодической таблице. Вы можете найти все известные изотопы данного элемента, щелкнув химический символ нужного элемента в Периодической таблице, расположенной по адресу https://www.webelements.com/isotopes.html.
Вы можете найти все известные изотопы данного элемента, щелкнув химический символ нужного элемента в Периодической таблице, расположенной по адресу https://www.webelements.com/isotopes.html.
✅ Пример \(\PageIndex{1}\)
Раствор
Резюме


 7: Изотопы и массовые числа
7: Изотопы и массовые числа
Leave A Comment