Изобутилен, химические свойства, получение, Ch3=C(Ch4)-Ch4
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Задание №33
Главная \ Подготовка к ЕГЭ \ Химия \ Разбор по заданиям \ Задание №33
Задания для самостоятельного решения (ответы ниже)
1. Непредельные углеводороды образуются в ходе реакции
1. Пропана с водой
2. Бензола с водородом
3. Карбида кальция с водой
4. Карбида магния с водой
5. Карбида алюминия с водой
6. Хлоралканов со спиртовым раствором щелочи
2. Алканы образуются в ходе реакции
1. Бромалканов с натрием
2. Бромалканов со спиртовой щелочью
3. Каталитического взаимодействия углерода и водорода
4. Гидрирования алкенов
5. Гидрирования спиртов
6. Гидрирования фенолов
3. Алканы образуются в ходе реакции
1. Сплавления натриевых солей карбоновых кислот с гидроксидом натрия
2. Электролиза спиртов
3. Электролиза карбоновых кислот
4. Гидрирования альдегидов
5. Гидрирования карбоновых кислот
6. Полного гидрирования алкинов
Полного гидрирования алкинов
4. Алкены образуются в ходе реакции
1. Полного гидрирования алкинов
2. Неполного гидрирования алкинов
3. Хлоралканов с водной щелочью
4. Хлоралканов со спиртовой щелочью
5. Вицинальных дигалогеналканов с цинком
6. Карбоновых кислот с цинком
5. Метан реагирует с
1. Концентрированной h3SO4
2. Разбавленной HNO3 в газовой фазе
3. Калием
4. Бромной водой
5. Бромом под действием УФ-облучения
6. Кислородом
6. Этан вступает в реакции
1. Электрофильного соединения
2. Радикального замещения
3. Со щелочными металлами
4. С концентрированными щелочами
5. С концентрированными щелочами
6. С хлором
7. Для пропана характерны
1. Образование 1-бромпропана в реакции с Br2
2. Образование 2-бромпропана в реакции с Br2
3. Реакция полимеризации
4. Взаимодействие с KMnO4
5. Сгорание в кислороде
6. Реакция с HNO3 в газовой среде
8. 2-метил пропан
2-метил пропан
1. Дает 1-бром-2-метилпропан в реакции с Br2
2. Дает 2-бром-2-метилпропан в реакции с Br2
3. Хорошо растворим в воде
4. Сгорает в кислороде
5. Реагирует с фенолом
6. Вступает в реакцию дегидрирования
9. Этен реагирует с
1. Натрием
2. Бромной водой
3. Водным раствором перманганата калия
4. Уксусной кислотой
5. Водородом
6. Глицерином
10. Пропен реагирует с
1. Хлороформом
2. Диэтиловым эфиром
3. Бензолом
4. Ацетоном
5. Кислородом
6. Водой
11. Для 2-метилпропена-1 характерны
1. Реакция полимеризации
2. Образование 2-бром-2-метилпропан в реакции с HBr
3. Обеспечивание водного раствора KMnO4
4. Реакция с формальдегидом
5. Высокая температура кипения
6. Высокая растворимость в воде
12. Для бутена-2 характерны
1. Реакция с уксусной кислотой
2. Существование геометрических изомеров
3. Реакция с глицерином
4. Обесцвечивание бромной воды
Обесцвечивание бромной воды
5. Высокая растворимость в воде
6. Обесцвечивание водного раствора перманганата калия
13. Бутен-2 в отличие от бутана
1. Реагирует с кислородом
2. Реагирует с окислом магния
3. Полимеризуется
4. Имеет межклассовые изомеры
5. Имеет структурные изомеры
6. Имеет геометрические изомеры
14. Ацетилен реагирует с
1. Аммиачным раствором оксида серебра
2. Уксусной кислотой
3. Уксусным альдегидом
4. Метилформиатом
5. Бензолом
6. Натрием
15. Пропин реагирует с
1. Толуолом
2. Бензальдегидом
3. Кислородом
4. Хромовой смесью
5. Бромной водой
6. Бромидом калия
16. Для бутина-2 характерны
1. Взаимодействие с бромной водой
2. Существование геометрических изомеров
3. Существование межклассовых изомеров
4. Высокая растворимость в воде
5. Образование 1,2-дибромбутена в реакции с бромом
6. Образование 2,2-дибромбутана в реакции с HBr
17. Для бутина-1 характерно
Для бутина-1 характерно
1. Существование геометрических изомеров
2. Существование межклассовых изомеров
3. Образование бутаналя в реакции с водой
4. Образование метилэтилкетона в реакции с водой
5. Взаимодействие с натрием
6. Взаимодействие с фосфором
18. И бутин-1, и бутин-2
1. Дают метилэтилкетон в реакции с водой
2. Реагируют с толуолом
3. Не имеют межклассовых изомеров
4. Реагируют с фенолом
5. Обесцвечивают бромную воду
6. Реагируют с кислородом
19. Бутадиен-1,3 вступает в реакцию с
1. Кальцием
2. Стиролом
3. Гидроксидом натрия
4. Бромом
5. Бромоводородом
6. Метаном
20. Изопрен реагирует с
1. Калием
2. Аммиачным раствором оксида серебра
3. Гидроксидом кальция
4. Водородом
5. Бромом
6. Кислородом
21. Бензол реагирует с
1. Раствором хлора в CCl4
2. Хлором в присутствии FeCl3
3. Этиленом
4. Пропиленом
5.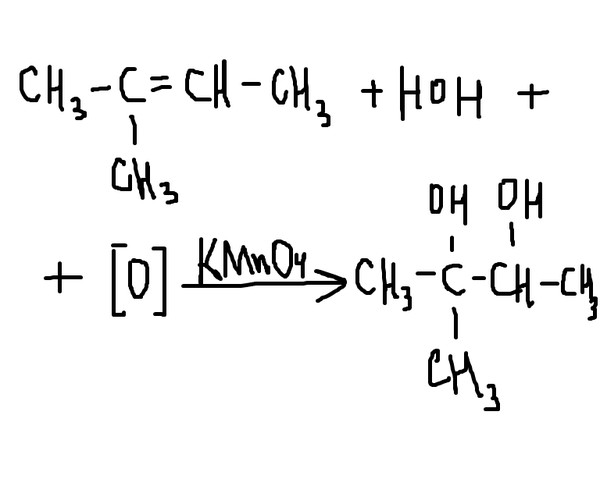 Уксусной кислотой
Уксусной кислотой
6. Ацетоном
22. Бензол реагирует с
1. Ацетиленом
2. Хлористым этилом в присутствии FeCl3
3. Хлористым ацетилом в присутствии FeCl3
4. Толуолом
5. Водой
6. Азотной кислотой
23. Толуол реагирует с
1. Подкисленным горячим раствором перманганата калия
2. Хлором
3. Серой
4. Фосфором
5. Оксидом лития
6. Азотной кислотой
24. Толуол образует
1. Хлористый бензил при реакции с хлором под действием УФ-облучения
2. 2-хлортолуол при реакции с хлором под действием УФ-облучения
3. Фенол при реакции с подкисленным раствором перманганата калия
4. 2,4,6-тринитротолуол при реакции с избытком HNO3
5. Бензойную кислоту под действием подкисленного перманганата калия
6. Бензол в реакции с водородом
25. Этилбензол образует
1. Фенол в реакции с водным раствором перманганата калия
2. Бензойную кислоту в реакции с перманганатом калия в кислой среде
3. Стирол в реакции дегидрирования
Стирол в реакции дегидрирования
4. 2-фенилэтанол в реакции с водой
5. 1-хлор-2-фенилэтен в реакции с Cl2 в присутствии FeCl3
6. Углекислый газ и воду при сгорании
26. И этилбензол, и толуол
1. Превращаются в бензойную кислоту при окислении перманганата калия в кислой среде
2. Нитриуются в орто- и пара-положении
3. Имеют формулу С7Н8
4. Имеют формулу С8Н10
5. Превращаются в хлористый бензил при взаимодействии Cl2 при УФ-облучении
6. Не реагируют с водой
27. Метанол взаимодействует с
1. Бромоводородом
2. Хлором
3. Натрием
4. Алюминием
5. Азотной кислотой
6. Муравьиной кислотой
28. Метанол не взаимодействует с
1. Алюминием
2. Перманганатом калия в кислой среде
3. Перманганатом калия в щелочной среде
4. Оксидом натрия
5. Оксидом меди
6. Фосфором
29. Этанол взаимодействует с
1. Фосфорной кислотой
2. Хлороводородом
3. Хлоридом фосфора (V)
4. Хлоридом натрия
Хлоридом натрия
5. Ацетальдегидом
6. Этилацетатом
30. Этанол не взаимодействует с
1. Бромидом натрия
2. Бромидом фосфора (V)
3. Уксусной кислотой
4. Формиатом натрия
5. Формальдегидом
6. Гидроксидом кальция
31. Пропанол взаимодействует с
1. Ацетоном
2. Водородом
3. Глицином
4. Ацетальдегидом
5. Метанолом
6. Оксидом натрия
32. Изопропиловый спирт не реагирует с
1. Этанолом
2. Тионилхлоридом
3. Хлоридом фосфора (V)
4. Триэтиламином
5. Анилином
6. Фенолом
33. Формальдегид реагирует с
1. Уксусной кислотой
2. Фенолом
3. Гидроксидом меди (II)
4. Кислородом
5. Глюкозой
6. Пропилацетатом
34. Формальдегид не реагирует с
1. Ацетатом калия
2. Этилацетатом
3. Триэтиламином
4. Аммиачным раствором оксида серебра
5. Кислородом
6. Подкисленным бихроматом калия
35. Ацетальдегид реагирует с
1. Гидросульфитом натрия
Гидросульфитом натрия
2. Водородом
3. Алюминием
4. Фосфором
5. Сульфатом калия
6. Подкисленным перманганатом калия
36. Ацетальдегид не реагирует с
1. Этиленгликолем
2. Гидросульфитом натрия
3. Фенилаланином
4. Хлоридом фосфора (V)
5. Гидроксидом алюминия
6. Этанолом
37. Этиленгликоль реагирует с
1. Хлоридом аммония
2. Гидроксидом меди (II)
3. Хлоридом железа (III)
4. Бромной водой
5. Этанолом
6. Азотной кислотой
38. Этиленгликоль не реагирует с
1. Фосфором
2. Фенилаланином
3. Гидроксидом меди (II)
4. Этанолом
5. Триэтиламином
6. Хлороводородом
39. Глицерин реагирует с
1. Глюкозой
2. Хлоридом кальция
3. Хлороводородом
4. Азотной кислотой
5. Кислородом
6. Карбонатом кальция
40. Глицерин не реагирует с
1. Алюминием
2. Гидроксидом меди (II)
3. Хлороводородом
4. Кислородом
Кислородом
5. Этиленом
6. Этилформиатом
41. Муравьиная кислота реагирует с
1. Гидроксидом натрия
2. Формальдегидом
3. Оксидом калия
4. Карбонатом калия
5. Сульфатом калия
6. Сульфатом бария
42. Муравьиная кислота не реагирует с
1. Соляной кислотой
2. Хлоридом лития
3. Глицином
4. Этанолом
5. Ацетатом серебра
6. Аммиачным раствором оксида серебра
43. Уксусная кислота реагирует с
1. Глицином
2. Глицерином
3. Хлором
4. Азотной кислотой
5. Ацетатом меди
6. Толуолом
44. Уксусная кислота не реагирует с
1. Серной кислотой
2. Стеариновой кислотой
3. Ацетиленом
4. Стиролом
5. Крезолятом натрия
6. Фенолятом калия
45. Пропионовая кислота
1. Относится к сильным кислотам
2. При хлорировании дает преимущественно 2-хлорпропановую кислоту
3. Не реагирует с гидроксидом натрия
4. Сгорает в избытке кислорода
5. Вступает в реакцию серебряного зеркала
Вступает в реакцию серебряного зеркала
6. Реагирует с этанолом
46. Муравьиная кислота в отличие от пропионовой
1. Вступает в реакцию серебряного зеркала
2. Окисляется свежеосажденным гидроксидом меди (II)
3. Относится к кислотам средней силы
4. Вступает в реакцию этерификации
5. Реагирует с щелочами
6. Не реагирует с сульфатом бария
47. Стеариновая кислота
1. Относится к сильным кислотам
2. Является твердой при комнатной температуре
3. Входит в состав жиров
4. Реагирует с йодом
5. Реагирует с водородом
6. Реагирует с гидроксидом калия
48. Линолевая кислота реагирует с
1. Этилацетатом
2. Формиатом натрия
3. Водородом
4. Йодом
5. Гидроксидом калия
6. Диэтиловым эфиром
49. Этилацетат реагирует с
1. Гидроксидом калия
2. Метанолом
3. Глицином
4. Кислородом
5. Гидроксидом алюминия
6. Водородом
50. Толуол образует
1. Хлористый бензил при реакции с хлором под действием УФ-облучением
Хлористый бензил при реакции с хлором под действием УФ-облучением
2. 2-хлортолуол при реакции с хлором под действием УФ-облучения
3. Фенол при реакции с подкисленным перманганатом калия
4. 2,4,6-тринитротолуол при реакции с избытком HNO3
5. Бензойную кислоту под действием подкисленного перманганата калия
6. Бензол в реакции с водородом
51. Метилакрилат реагирует с
1. Бромом
2. Водородом
3. Этилацетатом
4. Гидроксидом калия
5. Гидроксидом железа (II)
6. Глицерином
52. 2-метилпропанол-2
1. Восстанавливается водородом до изобутана
2. При дегидратации дает 2-метилпропен-1
3. Реагирует с бромоводородом
4. Реагирует с гидроксидом кальция
5. Вступает в реакцию этерификации
6. При нормальных условиях является газом
53. Бутиловый спирт
1. При комнатной температуре — твердое вещество
2. При дегидратации дает бутен-1
3. С уксусной кислотой дает бутилацетат
4. Не реагирует с Cu(OH)2
Не реагирует с Cu(OH)2
5. Сгорает в образованием SO2
6. Реагирует с ацетатом кальция
54. Первичные спирты
1. Обладаю высокой кислотностью
2. Окисляются в альдегиды под действием CuO
3. Окисляются в кетоны под действием CuO
4. Восстанавливаются водородом в алканы
5. Реагируют с карбоновыми кислотами
6. Дают галоидные алкилы при реакции с PCl5
55. Вторичные одноатомные спирты
1. Восстанавливаются водородом до алканов
2. Окисляются в кетоны под действием CuO
3. Дают галоидные алкилы при взаимодействии с SOCl2
4. При дегидратации переходят в алкилы
5. При дегидратации дают алкены
6. Вступают в реакцию полимеризации
56. Для альдегидов характерны
1. Более высокие по сравнению со спиртами температуры кипения
2. Основные свойства
3. Реакции со спиртами
4. Реакции с PCl5
5. Реакции гидролиза
6. Реакции с гидросульфитом натрия
57. Для кетонов характерны
1. Температуры кипения ниже, чем у спиртов с одинаковым числом углеродных атомов
Температуры кипения ниже, чем у спиртов с одинаковым числом углеродных атомов
2. Кислотные свойства
3. Реакции с PCl5
4. Восстановление во вторичные спирты
5. Реакция с серой
6. Реакция полимеризации
58. Для фенола характерны
1. Кислотность выше, чем у спиртов
2. Высокая растворимость в воде
3. Появление ярко-синей окраски в присутствии Cu(OH)2
4. Появление фиолетово-черной окраски в присутствии FeCl3
5. Образование белого осадка при взаимодействии с бромной водой
6. Взаимодействие с уксусной кислотой
59. Орто-крезол реагирует с
1. Сульфатом натрия
2. Гидроксидом натрия
3. Глицерином
4. Метилформиатом
5. Кислородом
6. Азотной кислотой
60. Пара-крезол не реагирует с
1. Гидрокарбонатом калия
2. Гидроксидом калия
3. Азотной кислотой
4. Уксусной кислотой
5. Угарным газом
6. Бромной водой
Ответы: 1. 346, 2. 134, 3. 136, 4. 245, 5. 256, 6. 256, 7. 256, 8. 246, 9. 235, 10. 356, 11. 123, 12. 246, 13. 346, 14. 126, 15. 345, 16. 136, 17. 245, 18. 156, 19. 245, 20. 456, 21. 234, 22. 236, 23. 126, 24. 145, 25. 236, 26. 126, 27. 136, 28. 146, 29. 235, 30. 146, 31. 345, 32. 456, 33. 234, 34. 123, 35. 126, 36. 135, 37. 256, 38. 125, 39. 345, 40. 156, 41.
134, 3. 136, 4. 245, 5. 256, 6. 256, 7. 256, 8. 246, 9. 235, 10. 356, 11. 123, 12. 246, 13. 346, 14. 126, 15. 345, 16. 136, 17. 245, 18. 156, 19. 245, 20. 456, 21. 234, 22. 236, 23. 126, 24. 145, 25. 236, 26. 126, 27. 136, 28. 146, 29. 235, 30. 146, 31. 345, 32. 456, 33. 234, 34. 123, 35. 126, 36. 135, 37. 256, 38. 125, 39. 345, 40. 156, 41. 134, 42. 125, 43. 123, 44. 124, 45. 246, 46. 123, 47. 236, 48. 345, 49. 146, 50. 145, 51. 124, 52. 235, 53. 234, 54. 256, 55. 235, 56. 346, 57. 134, 58. 145, 59. 256, 60. 145.
134, 42. 125, 43. 123, 44. 124, 45. 246, 46. 123, 47. 236, 48. 345, 49. 146, 50. 145, 51. 124, 52. 235, 53. 234, 54. 256, 55. 235, 56. 346, 57. 134, 58. 145, 59. 256, 60. 145.
Окисление алкенов манганатом калия
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3885
- Джим Кларк
- Школа Труро в Корнуолле
Двойные углерод-углеродные связи в алкенах, таких как этен, реагируют с раствором манганата калия (VII) (раствором перманганата калия).
Окисление алкенов разбавленным раствором манганата калия(VII) на холоду
Алкены реагируют с раствором манганата калия(VII) на холоду. Изменение цвета зависит от того, используется ли манганат калия (VII) в кислых или щелочных условиях.
- Если раствор манганата калия (VII) подкислить разбавленной серной кислотой, фиолетовый раствор становится бесцветным.
- Если раствор манганата калия (VII) сделать слегка щелочным (часто добавляя раствор карбоната натрия), фиолетовый раствор сначала становится темно-зеленым, а затем дает темно-коричневый осадок.
Химия реакции
Рассмотрим реакцию с этеном. Точно так же реагируют и другие алкены. Ионы манганата (VII) являются сильным окислителем и в первую очередь окисляют этилен до этан-1,2-диола (старое название: этиленгликоль). Глядя на уравнение чисто с точки зрения органической реакции:
Этот тип уравнения довольно часто используется в органической химии. Кислород, написанный в квадратных скобках, означает «кислород от окислителя». Причина этого в том, что более нормальное уравнение имеет тенденцию скрывать органические изменения в массе других деталей — как вы найдете ниже!
Причина этого в том, что более нормальное уравнение имеет тенденцию скрывать органические изменения в массе других деталей — как вы найдете ниже!
Полное уравнение зависит от условий.
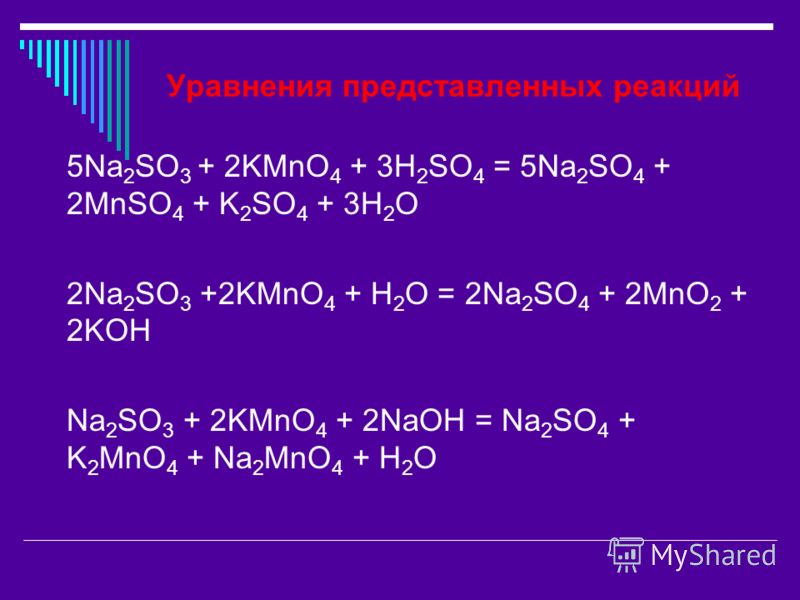
- В кислой среде ионы манганата(VII) восстанавливаются до ионов марганца(II).
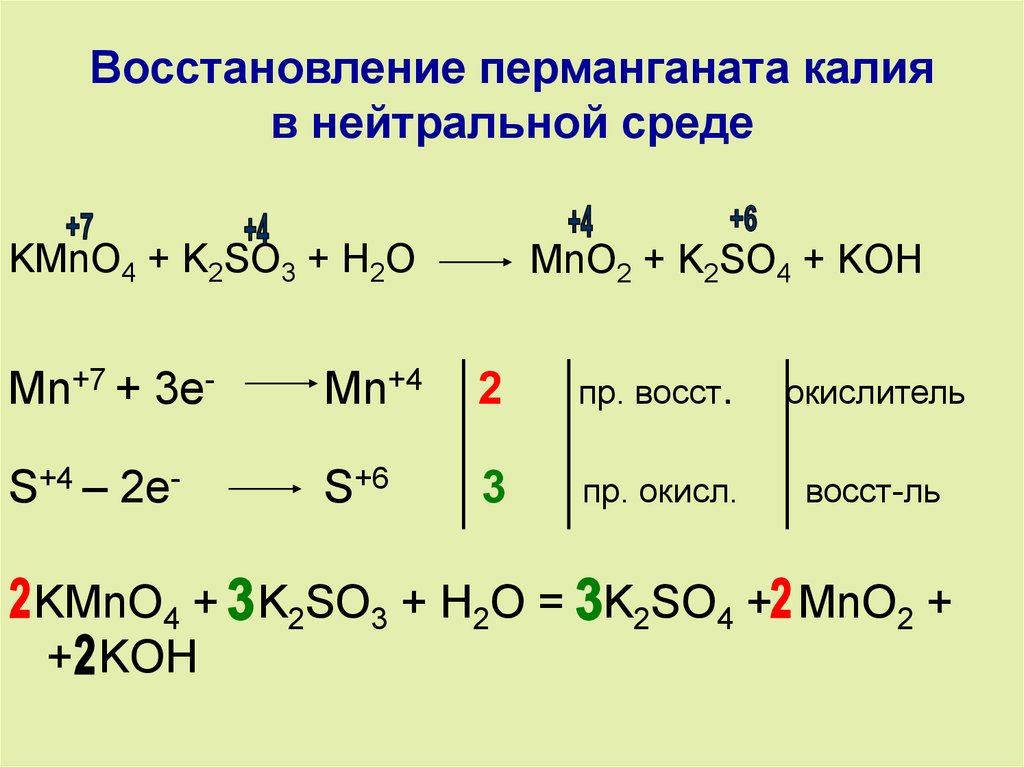
- В щелочных условиях ионы манганата (VII) сначала восстанавливаются до ионов зеленого манганата (VI). . .
. . . а затем далее до темно-коричневого твердого оксида марганца(IV) (диоксида марганца).
Эта последняя реакция также является той, которую вы получили бы, если бы реакция проводилась в нейтральных условиях. Вы заметите, что в левой части уравнения нет ни ионов водорода, ни ионов гидроксида.
Возможно, вы помните, что выше на странице написано, что манганат калия (VII) часто делают слегка щелочным, добавляя раствор карбоната натрия. Где здесь гидроксид-ионы? Ионы карбоната реагируют с водой до некоторой степени с образованием ионов гидрокарбоната и ионов гидроксида. 9- \]
9- \]
Именно присутствие этих гидроксид-ионов придает раствору карбоната натрия рН в диапазоне 10-11.
Использование реакции для определения углерод-углеродных двойных связей
Если органическое соединение реагирует с разбавленным щелочным раствором манганата калия (VII) на холоду с образованием зеленого раствора, за которым следует темно-коричневый осадок, то оно может содержать углерод- углеродная двойная связь. Но в равной степени это может быть любое из большого числа других соединений, все из которых могут быть окислены ионами манганата (VII) в щелочных условиях.
Ситуация с подкисленным раствором манганата калия (VII) еще хуже, поскольку он имеет тенденцию к разрыву углерод-углеродных связей. Он деструктивно реагирует с большим количеством органических соединений и редко используется в органической химии.
Вы могли бы использовать щелочной раствор манганата калия (VII), если, например, все, что вам нужно было сделать, это выяснить, является ли углеводород алканом или алкеном, другими словами, если не было ничего другого, что могло бы быть окислено. . Это не полезный тест. Бромная вода гораздо более четкая.
. Это не полезный тест. Бромная вода гораздо более четкая.
Окисление алкенов горячим концентрированным подкисленным раствором манганата калия(VII)
Диолы, такие как этан-1,2-диол, которые являются продуктами реакции с холодным разбавленным манганатом калия(VII), сами довольно легко окисляется ионами манганата(VII). Это означает, что реакция не остановится в этот момент до p, если только раствор манганата калия (VII) не будет очень разбавленным, очень холодным и желательно не в кислых условиях. Если вы используете горячий концентрированный подкисленный раствор манганата калия (VII), то, что вы в конечном итоге получите, зависит от расположения групп вокруг двойной углерод-углеродной связи.
Приведенная ниже формула представляет собой обычный алкен. В органической химии символ R используется для обозначения углеводородных групп или водорода в формуле, когда вы не хотите говорить о конкретных соединениях. Если вы используете символ более одного раза в формуле (как здесь), различные группы записываются как R 1 , R 2 и т. д.
д.
В этом конкретном случае двойная связь окружена четырьмя такие группы, и они могут быть любой комбинацией одинаковых или разных — так что они могут быть 2 водорода, метил и этил, или 1 водород и 3 метила, или 1 водород и 1 метил и 1 этил и 1 пропил, или любые другие комбинация, которую вы можете придумать. Другими словами, эта формула представляет все возможные простые алкены:
Первая стадия расширенного окисления
Подкисленный раствор манганата калия(VII) окисляет алкен, разрывая углерод-углеродную двойную связь и заменяя ее двумя углерод-кислородными двойными связями.
Продукты известны как карбонильные соединения , поскольку они содержат карбонильную группу C=O. Карбонильные соединения также могут реагировать с манганатом калия (VII), но то, как они реагируют, зависит от того, что присоединено к двойной связи углерод-кислород. Поэтому нам нужно проработать все возможные комбинации.
Если обе присоединенные группы R в продуктах представляют собой алкильные группы
Карбонильные соединения, в которых две углеводородные группы присоединены к карбонильной группе, называются кетонами. Кетоны не так легко окисляются, поэтому никаких дальнейших действий не требуется. (Но см. примечание, выделенное красным цветом ниже.) Если бы группы, присоединенные по обе стороны от исходной двойной углерод-углеродной связи, были одинаковыми, то в итоге вы получили бы один кетон. Если бы они были разными, то вы бы получили смесь из двух. Например:
В этом случае вы получите две идентичные молекулы, называемые пропанон. С другой стороны, если одну из метильных групп в исходной молекуле заменить на этильную, то получится смесь двух разных кетонов — пропанона и бутанона.
Что получится, если по обеим сторонам исходной двойной углерод-углеродной связи окажется метильная и этильная группы? Опять же, вы получите один кетон, в данном случае бутанон. Если вы не уверены в этом, нарисуйте структуры и посмотрите.
Если вы не уверены в этом, нарисуйте структуры и посмотрите.
Последний раздел является чрезмерным упрощением. На практике в этих условиях кетоны окисляют раствором манганата калия(VII). Реакция протекает беспорядочно и приводит к разрыву углерод-углеродных связей по обе стороны от карбонильной группы. Манганат калия (VII) является настолько разрушительным окислителем, что редко используется в органической химии.
Если продукт имеет одну углеводородную группу и один водород
Например, предположим, что первая стадия реакции была:
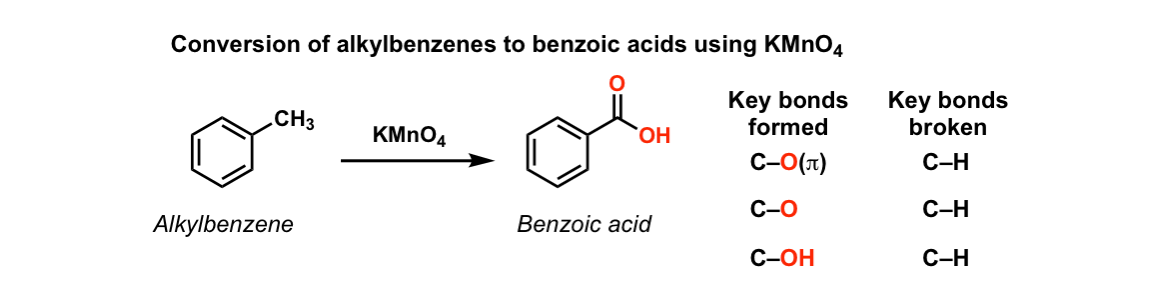
В этом случае первая молекула продукта имеет метильную группу и водород, присоединенный к карбонильной группе. Это другое соединение, известное как альдегид. Альдегиды легко окисляются с образованием карбоновых кислот, содержащих группу -СООН. Итак, на этот раз реакция пойдет дальше и даст этановую кислоту CH 3 COOH.
Структура кислоты была немного изменена, чтобы она больше походила на то, как мы обычно рисуем кислоты, но в результате между углеродом и водородом оказался кислород.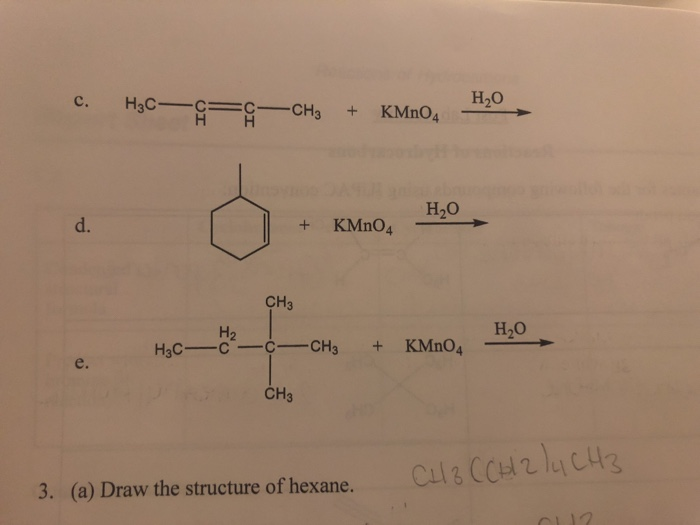 Таким образом, общий эффект манганата калия (VII) на этот вид алкена:
Таким образом, общий эффект манганата калия (VII) на этот вид алкена:
Очевидно, что если бы к обоим атомам углерода на концах двойной связи углерод-углерод был присоединен атом водорода, то образовались бы две молекулы карбоновой кислоты, которые могли бы быть одинаковыми или разными, в зависимости от того, алкильные группы или нет. были одинаковыми или разными.
Поэкспериментируйте с этим, пока он вам не понравится. Нарисуйте ряд алкенов, каждый из которых имеет водород, присоединенный к обоим концам двойной углерод-углеродной связи. Варьируйте алкильные группы — иногда одинаковые на каждом конце двойной связи, иногда разные. окислите их с образованием кислот и посмотрите, что получится.
Если продукт содержит два атома водорода, но не имеет углеводородной группы
Можно было ожидать, что это приведет к образованию метановой кислоты, как в уравнении:
Но это не так! Это связано с тем, что метановая кислота также легко окисляется раствором манганата калия (VII). Фактически, он полностью окисляет его до углекислого газа и воды. Таким образом, уравнение в таком случае может быть, например:
Фактически, он полностью окисляет его до углекислого газа и воды. Таким образом, уравнение в таком случае может быть, например:
Точная природа другого продукта (в данном примере, пропанона) будет варьироваться в зависимости от того, что было присоединено к правому углероду в углерод-углеродном соединении. двойная связь. Если бы на обоих концах двойной связи было два атома водорода (другими словами, если бы у вас был этен), то все, что вы получили бы, это углекислый газ и вода.
Пример
Обратный анализ результатов поможет вам определить структуру алкена. Например, алкен C 4 H 8 имеет три структурных изомера:
Выясните, какие из них дадут каждый из следующих результатов, если их обработать горячим концентрированным раствором манганата калия (VII).
- Изомер А дает кетон (пропанон) и диоксид углерода.
- Изомер B дает карбоновую кислоту (пропановую кислоту) и диоксид углерода.

- Изомер С дает карбоновую кислоту (этановую кислоту).
Раствор
Кислоты образуются, когда атом водорода присоединен хотя бы к одному из атомов углерода в двойной углерод-углеродной связи. Так как в C есть только один продукт, алкен должен быть симметричен относительно двойной связи. Это бут-2-ен. Если у вас есть два атома водорода на одном конце связи, это будет производить углекислый газ. А представляет собой 2-метилпропен, потому что другая молекула представляет собой кетон. B должен быть бутен-1, потому что он производит углекислый газ и кислоту.
Резюме
Подумайте об обоих концах двойной углерод-углеродной связи по отдельности, а затем объедините результаты.
- Если на одном конце связи есть две алкильные группы, эта часть молекулы даст кетон.
- Если на одном конце связи имеется одна алкильная группа и один водород, эта часть молекулы даст карбоновую кислоту.
- Если на одном конце связи есть два атома водорода, эта часть молекулы даст углекислый газ и воду.

- Если на одном конце связи есть два атома водорода, эта часть молекулы даст углекислый газ и воду.
Авторы
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги






 Именно присутствие этих гидроксид-ионов придает раствору карбоната натрия рН в диапазоне 10-11.
Именно присутствие этих гидроксид-ионов придает раствору карбоната натрия рН в диапазоне 10-11. 

 Кетоны не так легко окисляются, поэтому дальнейших действий не требуется. (Но см. примечание, выделенное красным ниже.)
Кетоны не так легко окисляются, поэтому дальнейших действий не требуется. (Но см. примечание, выделенное красным ниже.) На практике кетоны окисляются раствором манганата калия(VII) в этих условиях. Реакция протекает беспорядочно и приводит к разрыву углерод-углеродных связей по обе стороны от карбонильной группы. Если вы делаете CIE, вам придется изучить это, как указано выше. Если вы занимаетесь чем-то другим, вам, вероятно, не стоит тратить время на чтение этого. Манганат калия (VII) является настолько разрушительным окислителем, что редко используется в органической химии. Проверьте свою программу!
На практике кетоны окисляются раствором манганата калия(VII) в этих условиях. Реакция протекает беспорядочно и приводит к разрыву углерод-углеродных связей по обе стороны от карбонильной группы. Если вы делаете CIE, вам придется изучить это, как указано выше. Если вы занимаетесь чем-то другим, вам, вероятно, не стоит тратить время на чтение этого. Манганат калия (VII) является настолько разрушительным окислителем, что редко используется в органической химии. Проверьте свою программу! 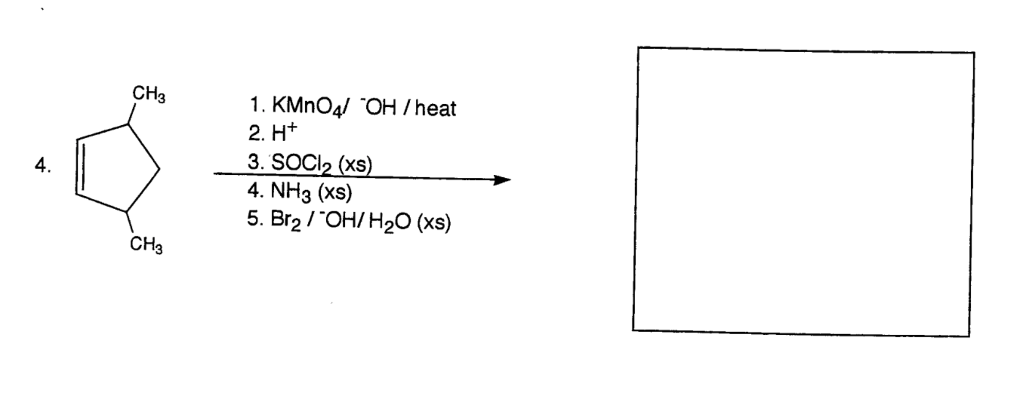 Итак, на этот раз реакция пойдет дальше и даст этановую кислоту CH 9 .0092 3 СООН.
Итак, на этот раз реакция пойдет дальше и даст этановую кислоту CH 9 .0092 3 СООН.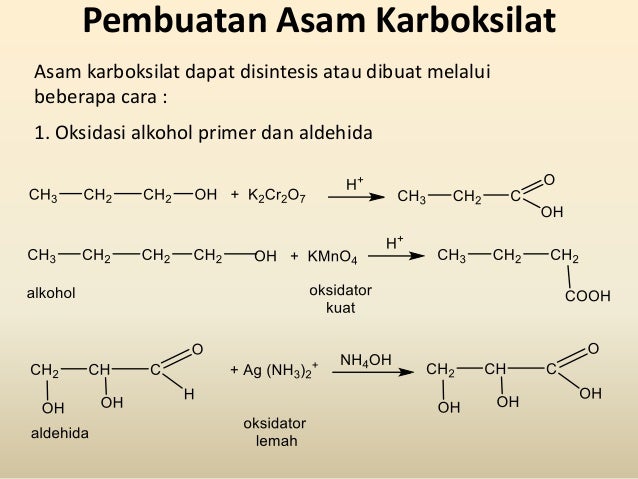



Leave A Comment