Вопросы — Страница 2 из 3
Как определить число протонов, нейтронов и электронов в изотопе?Как определить число протонов, нейтронов и электронов в изотопе?
Для того чтобы это сделать вам нужно знать 3 вещи:
- Как определить число протонов и нейтронов в атоме?
- Как определить общее число электронов в атоме?
- Что такое изотоп.
Вкратце напомню.
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Число нейтронов вычисляется по формуле:
N = A — Z
Где N — число нейтронов, A — атомная масса элемента (в целых числах), Z — заряд ядра атома (число протонов) или порядковый номер атома в периодической таблице Менделеева.
Что такое изотоп?
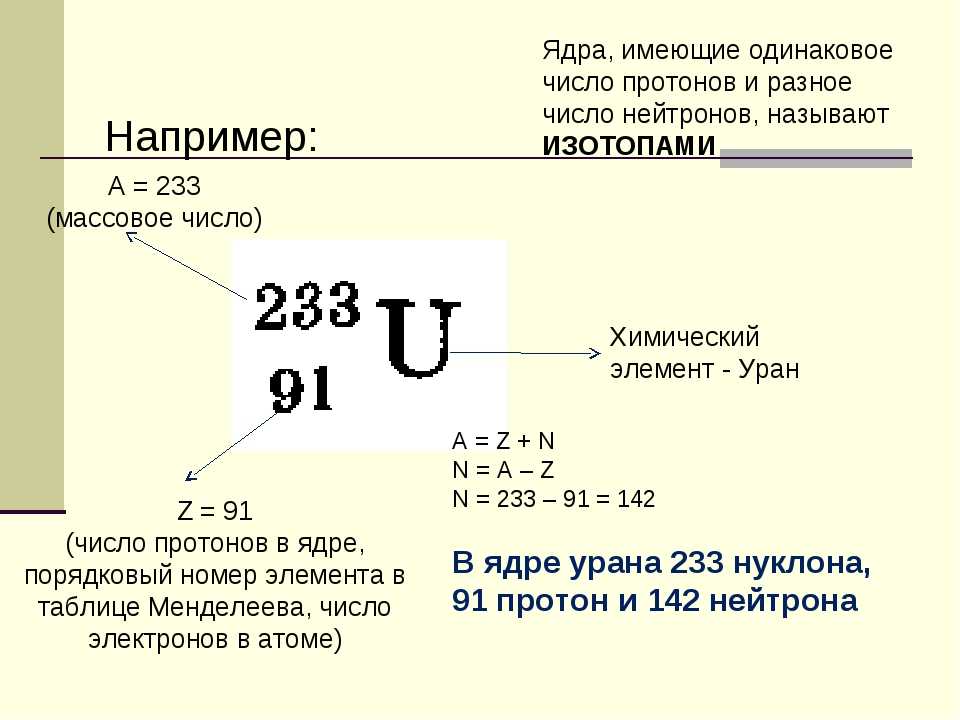
Изотопы это разновидности атомов химического элемента, которые имеют одинаковый заряд ядра (порядковый номер в таблице), но разные массовые числа.
Проще говоря, у изотопов в ядре атома одинаковое число протонов, но разное число нейтронов.
Таким образом, число протонов и электронов у изотопов такое же, как и у обычных атомов, разница лишь в количестве нейтронов.
Примеры
Сколько электронов, протонов и нейтронов содержит атом изотопа титана 50Ti?
Титан имеет порядковый номер 22. Значит в ядре содержится 22 протона, а в атоме 22 электрона.
Число нейтронов: N = 50 – 22 = 28 нейтронов.
Сколько электронов содержит нейтральный атом изотопа полония?
В данном случае нам даже не нужно знать массовое число изотопа, т.к. речь идет только об электронах. Порядковый номер полония 84, значит в ядре атома 84 протона, а в атоме 84 электрона.
Определите число протнов, нейтронов и электронов для изотопа 55Mn.
Порядковый номер марганца 25. Значит в ядре атома 25 протонов, а в атоме 25 электронов.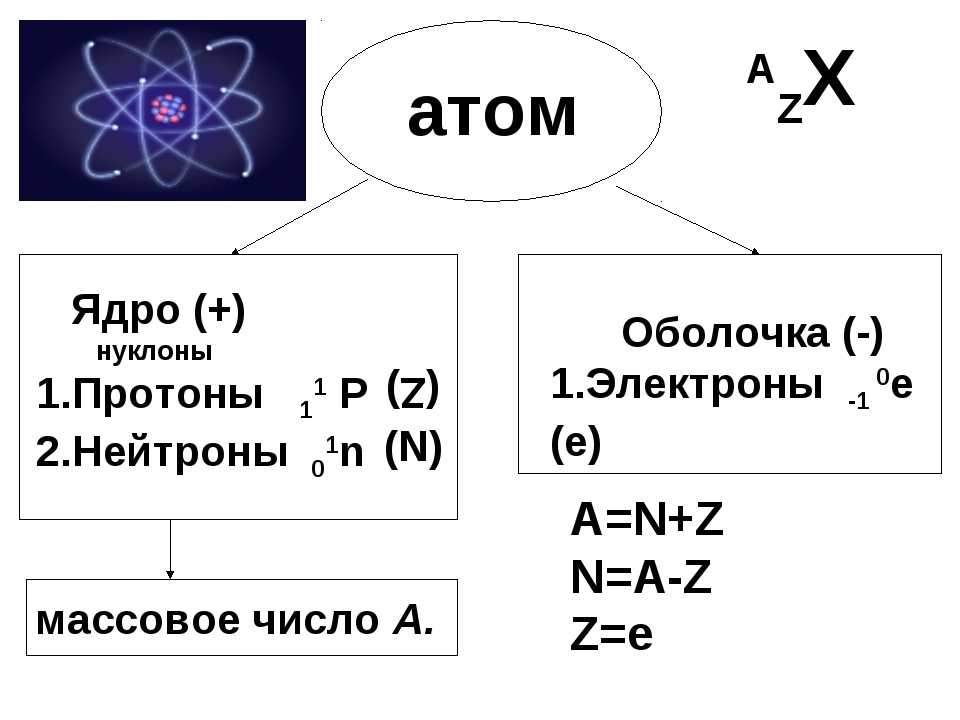
Найдем число нейтронов: N = 55 – 25 = 30 нейтронов.
Определите число протонов изотопа калия.
В этом случае массовое число изотопа не имеет значения, т.к. речь идет о протонах, число которых у изотопов одинаково. Калий имеет порядковый номер в таблице 19, значит у любого изотопа калия будет 19 протонов.
Похожие вопросы:
– Какие атомы имеют одинаковое число нейтронов?
– Как определить общее число электронов в атоме?
Число электронов в ионе
Число электронов в ионе
Как определить общее число электронов в ионе?
В ионе общее число электронов определяется суммой общего числа электронов атомов этого иона, и зарядом иона.
При этом нужно учесть, что положительный заряд иона означает, что электронов в ионе не достаточно (т.е. их не хватает). И наоборот: отрицательный заряд иона означает, что в ионе избыток электронов. Это связано с тем, что электрон имеет отрицательный заряд, а ядра атомов – положительный заряд.
Это связано с тем, что электрон имеет отрицательный заряд, а ядра атомов – положительный заряд.
Поэтому формулу для определения общего числа электронов в ионе нужно записать в виде:
Ne(иона) = Ne(атома) – Z (иона)
Где: Ne(иона) – общее число электронов в ионе, Ne(атома) – общее число электронов в атоме, Z (иона) – заряд иона.
Для сложных ионов (ионов соединений) формула примет вид:
Ne(иона) = x * Ne(атома A) + y * Ne(атома B) + z * Ne(атома C) + … – Z (иона)
Где: Ne(иона) – общее число электронов в ионе, Ne(атома A) – общее число электронов в атоме A, x – число атомов A в ионе; Ne(атома B) – общее число электронов в атоме B, y – число атомов B; Ne(атома C) – общее число электронов в атоме C, z – число атомов C; Z (иона) – заряд иона.
Примеры
Чему равно общее число электронов в ионах железа Fe2+ и Fe3+?
В периодической системе железо имеет №26. Таким образом, заряд ядра атома железа +26 (в ядре атома 26 протонов).
Ne(Fe2+) = Ne(Fe) – Z (Fe2+) = 26 – 2 = 24
Ne(Fe3+) = Ne(Fe) – Z (Fe3+) = 26 – 3 = 23
Число электронов в ионе калия K+: Ne(K+) = Ne(K) – Z (K+) = 19 – 1 = 18
Число электронов в ионе натрия Na+: Ne(Na+) = Ne(Na) – Z (Na+) = 11 – 1 = 10
Число электронов в ионе кальция Ca2+: Ne(Ca2+) = Ne(Ca) – Z (Ca2+) = 20 – 2 = 18
Число электронов в ионе меди Cu2+: Ne(Cu2+) = Ne(Cu) – Z (Cu2+) = 29 – 2 = 27
Число электронов в ионе цинка Zn2+: Ne(Zn2+) = Ne(Zn) – Z (Zn2+) = 30 – 2 = 28
Число электронов в ионе алюминия Al3+: Ne(Al3+) = Ne(Al) – Z (Al3+) = 13 – 3 = 10
Число электронов в ионе хрома Cr3+: Ne(Cr3+) = Ne(Cr) – Z (Cr3+) = 24 – 3 = 21
Число электронов в ионе фтора F–: Ne(F–) = Ne(F) – Z (F–) = 9 – (-1) = 9 + 1 = 10
Число электронов в ионе хлора Cl–: Ne(Cl–) = Ne(Cl) – Z (Cl–) = 17 – (-1) = 17 + 1 = 18
Число электронов в ионе серы S2-: Ne(S2-) = Ne(S) – Z (S2-) = 16 – (-2) = 16 + 2 = 18
Число электронов в ионе SO42-: Ne(SO42-) = Ne(S) + 4 * Ne(O) – Z (SO42-) = 16 + 4 * 8 – (-2) = 16 + 32 + 2 = 50
Число электронов в ионе HCO3–: Ne(HCO3–) = Ne(H) + Ne(C) + 3 * Ne(O) – Z (HCO3–) = 1 + 6 + 3 * 8 – (-2) = 1 + 6+ 24 +2 = 33
Число электронов в ионе Fe(CN)64-: Ne(Fe(CN)64-) = Ne(Fe) + 6 * Ne(C) + 6 * Ne(N) – Z (Fe(CN)64-) = 26 + 6 * 6 + 6 * 7 – (-4) = 26 + 36 + 42 + 4 = 108
Похожие вопросы:
– Как определить число протонов и нейтронов в атоме?
– Как определить общее число электронов в атоме?
– Как определить общее число электронов в молекуле?
Число электронов в молекуле
Число электронов в молекуле
Как определить общее число электронов в соединении?
Общее число электронов в соединении равно сумме электронов химических элементов этого соединения.
Число электронов химического элемента равно его порядковому номеру в периодической таблице: атом электронейтрален, а нумерация идет по заряду ядра. Каждый последующий химический элемент имеет заряд ядра на единицу больше, чем предыдущий. Водород +1, гелий +2, литий +3, бериллий +4, бор +5 и так далее.
При подсчете мы должны учитывать индексы (число атомов) элементов в соединении. Для этого число атомов данного химического элемента нужно умножить на число его электронов.
Примеры
Для начала рекомендую вам вспомнить, как определить общее число электронов в атоме?
Число электронов в молекуле хлора (Cl2) будет равно сумме электронов двух атомов хлора. Один атом хлора имеет 17 электронов, значит в молекуле хлора всего имеется 17 * 2 = 34 электрона.
Число электронов в молекуле воды (H2O) будет равно сумме электронов двух атомов водорода и одного атома кислорода: 1 * 2 + 8 = 10 электронов.
В молекуле глюкозы (C6H12O6) общее число электронов будет равно сумме электронов 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода: 6 * 6 + 12 * 1 + 6 * 8 = 36 + 12 + 48 = 96 электронов.
Суммарное число электронов в молекуле дактиномицина (C62H86N12O16) составляет собой сумму электронов 62 атомов углерода, 86 атомов водорода, 12 атомов азота и 16 атомов кислорода: 62 * 6 + 86 * 1 + 12 * 7 + 16 * 8 = 372 + 86 + 84 + 128 = 670 электронов.
Похожие вопросы:
– Как определить число протонов и нейтронов в атоме?
– Как определить общее число электронов в атоме?
Число электронов в атоме химического элемента
Число электронов в атоме химического элемента
Как определить общее число электронов в атоме?
Вам важно запомнить 2 вещи:
- Атом всегда электрически нейтрален (не имеет заряда).
- Заряд ядра атома равен его порядковому номеру в периодической таблице.
Исходя из этого несложно вывести формулу числа электронов в атоме:
N (e) = N (p) = Z
Где N(e) – число электронов в атоме химического элемента, а N (p) – число протонов в ядре атома, Z – заряд ядра его атома, который равен порядковому номеру этого элемента.
Т.е. можно упростить до следующего утверждения: общее число электронов в атоме равно порядковому номеру химического элемента в периодической таблице Д. И. Менделеева.
Примеры
Общее число электронов в атоме водорода (№1) равно 1.
N(e) = N(p) = Z = 1
Общее число электронов в атоме лития (№3) равно 3.
N(e) = N(p) = Z = 3
Общее число электронов в атоме бора (№5) равно 5.
N(e) = N(p) = Z = 5
Общее число электронов в атоме углерода (№6) равно 6.
N(e) = N(p) = Z = 6
Общее число электронов в атоме азота (№7) равно 7.
N(e) = N(p) = Z = 7
Общее число электронов в атоме кислорода (№8) равно 8.
N(e) = N(p) = Z = 8
Общее число электронов в атоме фтора (№9) равно 9.
N(e) = N(p) = Z = 9
Общее число электронов в атоме натрия (№11) равно 11.
N(e) = N(p) = Z = 11
Общее число электронов в атоме магния (№12) равно 12.
N(e) = N(p) = Z = 12
Общее число электронов в атоме алюминия (№13) равно 13.
N(e) = N(p) = Z = 13
Общее число электронов в атоме кремния (№14) равно 14.
N(e) = N(p) = Z = 14
Общее число электронов в атоме фосфора (№15) равно 15.
N(e) = N(p) = Z = 15
Общее число электронов в атоме серы (№16) равно 16.
N(e) = N(p) = Z = 16
Общее число электронов в атоме хлора (№17) равно 17.
N(e) = N(p) = Z = 17
Общее число электронов в атоме аргона (№18) равно 18.
N(e) = N(p) = Z = 18
Общее число электронов в атоме калия (№19) равно 19.
N(e) = N(p) = Z = 19
Общее число электронов в хрома (№24) равно 24.
N(e) = N(p) = Z = 24
Общее число электронов в атоме марганца (№25) равно 25.
N(e) = N(p) = Z = 25
Общее число электронов в атоме железа (№26) равно 26.
N(e) = N(p) = Z = 26
Общее число электронов в мышьяка (№33) равно 33.
N(e) = N(p) = Z = 33
Общее число электронов в атоме брома (№35) равно 35.
N(e) = N(p) = Z = 35
Общее число электронов в атоме золота (№79) равно 79.
N(e) = N(p) = Z = 79
Думаю, из приведенных примеров понятно, как определять общее число электронов в атоме. Самое главное не путать такие вещи как атом/молекула/ион и общее число электронов/число электронов на внешнем энергетическом уровне.
Похожие вопросы:
– Как определить число протонов и нейтронов в атоме?
– Какие атомы имеют одинаковое число нейтронов?
Атомы, имеющие одинаковые числа нейтронов
Атомы, имеющие одинаковые числа нейтронов
Атомы разных химических элементов, имеющие одинаковое количество нейтронов в атомном ядре называются изотонами.
Как мы уже говорили ранее, число нейтронов в ядре равно разнице между относительной атомной массы и порядковым номером химического элемента:
N = A – Z
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд ядра атом или порядковый номер атома в периодической таблице Менделеева.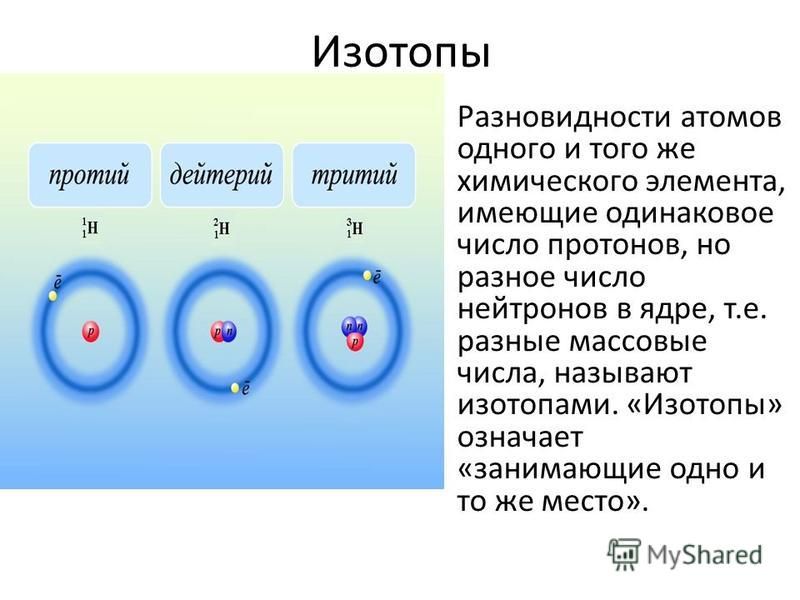
Итак, какие химические элементы относятся к изотонам? Для этого нам придется высчитать число нейтронов во всех элементах периодической таблицы. Расчеты показывают наличие следующих изотонов:
Бор и углерод: по 6 нейтронов.
N (B) = Ar (B) – Z (B) = 11 – 5 = 6
N (C) = Ar (C) – Z (C) = 12 – 6 = 6
Фтор и неон: по 10 нейтронов.
N (F) = Ar (F) – Z (F) = 19 – 9 = 10
Натрий и магний: по 12 нейтронов.
N (Na) = Ar (Na) – Z (Na) = 23 – 11 = 12
N (Mg) = Ar (Mg) – Z (Mg) = 24 – 12 = 12
Алюминий и кремний: по 14 нейтронов.
N (Al) = Ar (Al) – Z (Al) = 27 – 13 = 14
N (Si) = Ar (Si) – Z (Si) = 28 – 14 = 14
Фосфор и сера: по 16 нейтронов.
N (P) = Ar (P) – Z (P) = 31 – 15 = 16
N (S) = Ar (S) – Z (S) = 32 – 16 = 16
Калий и кальций: по 20 нейтронов.
N (K) = Ar (K) – Z (K) = 39 – 19 = 20
N (Ca) = Ar (Ca) – Z (Ca) = 40 – 20 = 20
Ванадий и хром: по 28 нейтронов.
N (V) = Ar (V) – Z (V) = 51 – 23 = 28
N (Cr) = Ar (Cr) – Z (Cr) = 52 – 24 = 28
Марганец и железо: по 30 нейтронов.
N (Mn) = Ar (Mn) – Z (Mn) = 55 – 25 = 30
N (Fe) = Ar (Fe) – Z (Fe) = 56 – 26 = 30
Медь и цинк: по 35 нейтронов.
N (Cu) = Ar (Cu) – Z (Cu) = 64 – 29 = 35
N (Zn) = Ar (Zn) – Z (Zn) = 65 – 30 = 35
Селен и бром: по 45 нейтронов.
N (Se) = Ar (Se) – Z (Se) = 79 – 34 = 45
N (Br) = Ar (Br) – Z (Br) = 80 – 35 = 45
Свинец, полоний и астат: по 125 нейтронов.
N (Pb) = Ar (Pb) – Z (Pb) = 207 – 82 = 125
N (At) = Ar (At) – Z (At) = 210 – 85 = 125
Из новейших, тяжелых элементов, можно назвать:
Rf, Db, Sg, Bh, Hs, Mt – по 157 нейтронов.
Cn, Nh – по 173 нейтрона.
Lv, Ts – по 177 нейтронов.
Кроме того, не нужно забывать про изотопы (ядра химических элементов, имеющих одинаковый заряд ядра, но разное число нейтронов). Пример изотонов: 15N и 14C. У них число нейтронов будет равно:
Пример изотонов: 15N и 14C. У них число нейтронов будет равно:
N (15N) = Ar (15N) – Z (Pb) = 15 – 7 = 8
N (14C) = Ar (14
Похожие вопросы:
– Как определить число протонов и нейтронов в атоме?
– Как определить общее число электронов в атоме?
Как определить число нейтронов, протонов и электронов в изотопе?
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Содержание
Как определить количество протонов, нейтронов и электронов в изотопе?
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Количество нейтронов рассчитывается по формуле:
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд атомного ядра (число протонов) или порядковый номер атома в периодической таблице Менделеева.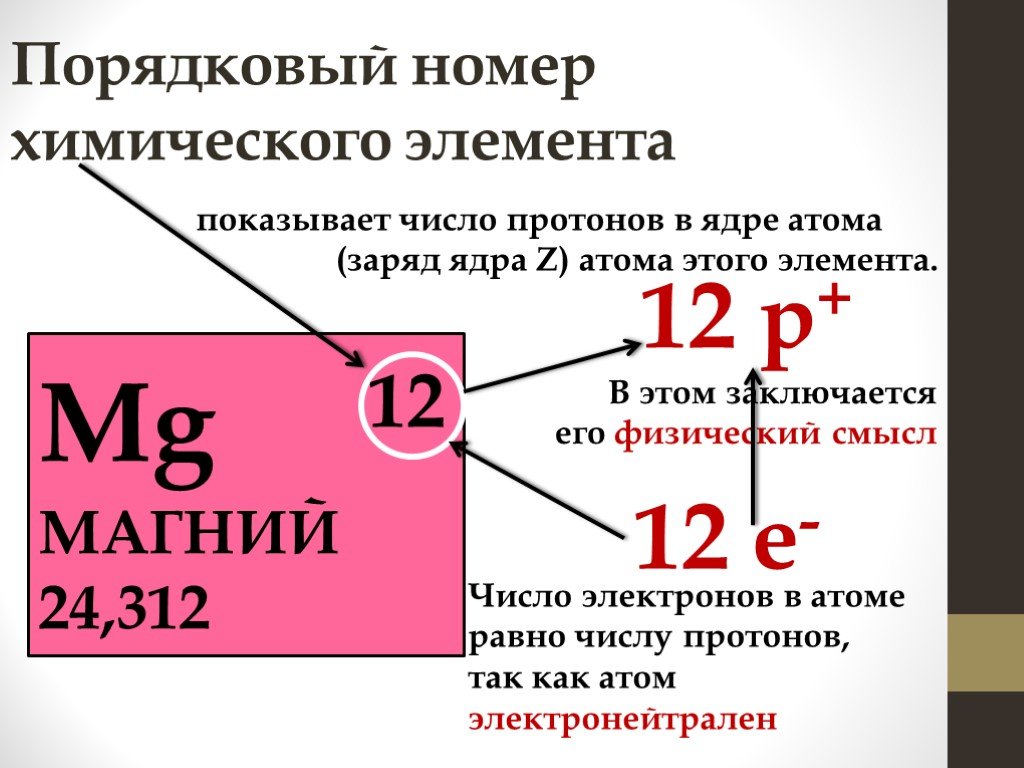
Что такое изотоп?
Изотопы – это разновидности атомов данного химического элемента, которые имеют одинаковый ядерный заряд (порядковый номер в таблице), но разные массовые числа.
Проще говоря, изотопы имеют одинаковое количество протонов в ядре атома, но разное количество нейтронов.
Таким образом, изотопы имеют такое же количество протонов и электронов, как и обычные атомы, единственное отличие – количество нейтронов.
Примеры
Сколько электронов, протонов и нейтронов содержит изотоп титана 50 Ti?
Титан имеет порядковый номер 22. Это означает, что в ядре 22 протона, а в атоме 22 электрона.
Количество нейтронов: N = 50 – 22 = 28 нейтронов.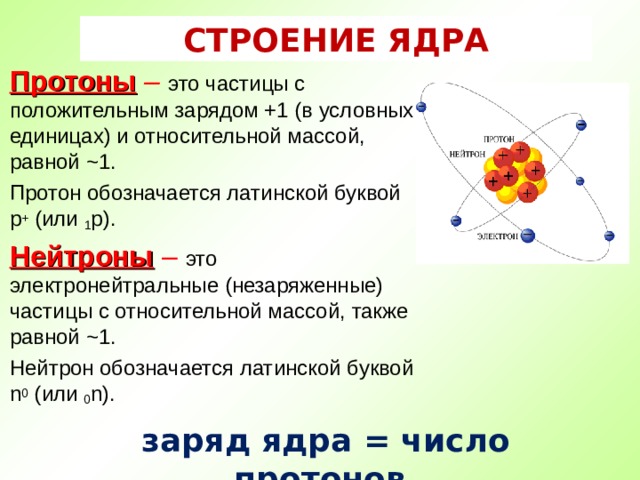
Сколько электронов содержится в нейтральном атоме изотопа полония?
В этом случае нам даже не нужно знать массовое число изотопа, потому что мы говорим только об электронах. Порядковый номер полония – 84, поэтому в ядре атома 84 протона и 84 электрона.
Определите число протонов, нейтронов и электронов для изотопа 55 Mn.
Порядковый номер марганца – 25. Значит, в ядре атома 25 протонов и 25 электронов.
Найдем число нейтронов: N = 55 – 25 = 30 нейтронов.
Найдите число протонов изотопа калия.
В этом случае массовое число изотопа не имеет значения, потому что все дело в протонах – количестве изотопов, имеющих одинаковое число протонов. Калий имеет порядковый номер 19 в таблице, что означает, что каждый изотоп калия будет иметь 19 протонов.
Предположим, что на каждую тысячу нормальных атомов приходится один дефектный. И хотя обычный атом золота имеет 117 нейтронов, иногда встречаются “раздутые” уродливые атомы, которые имеют 118 нейтронов.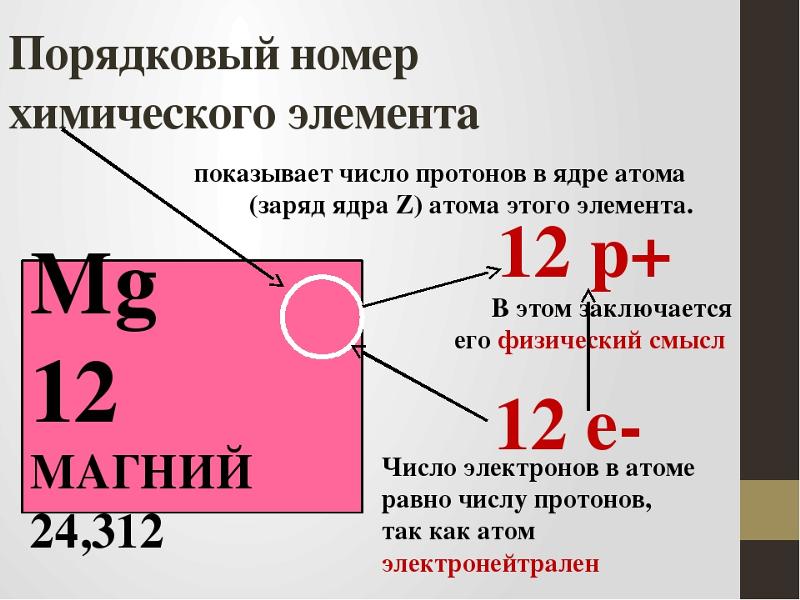 Все помидоры похожи на помидоры, но у одного помидора есть уродливый нарост на боку. Хорошо, мы можем это съесть.
Все помидоры похожи на помидоры, но у одного помидора есть уродливый нарост на боку. Хорошо, мы можем это съесть.
Протон, нейтрон, электрон. Святая троица.
Но прежде чем рассказать о них подробнее, я отвечу на закономерный вопрос, который вы должны задать себе снова: из чего состоят элементарные частицы? Может быть, они также состоят из еще более мелких частей?
Не вдаваясь в ненужные подробности, отвечу: нет! Это не так!
– Позвольте мне! – Какой-нибудь умный ребенок скажет мне, поправляя мизинцем свои круглые очки. – Позвольте мне! Весь мой опыт говорит мне, что если сильно ударить по чему-то, то оно развалится. Чашку – в осколки, частицу – в атомы, атомы – в эти ваши элементарные частицы. А если вы ударите по частицам, во что они распадутся, добрый гражданин?
– Какой умный мальчик! – Я отвечаю с некоторой робостью. – Он проник в самую суть вещей! Стук, говорит он, должен быть стуком. Вот чем занимаются физики, изучая частицы! Они разгоняют их в специальных ускорителях и бьют друг о друга.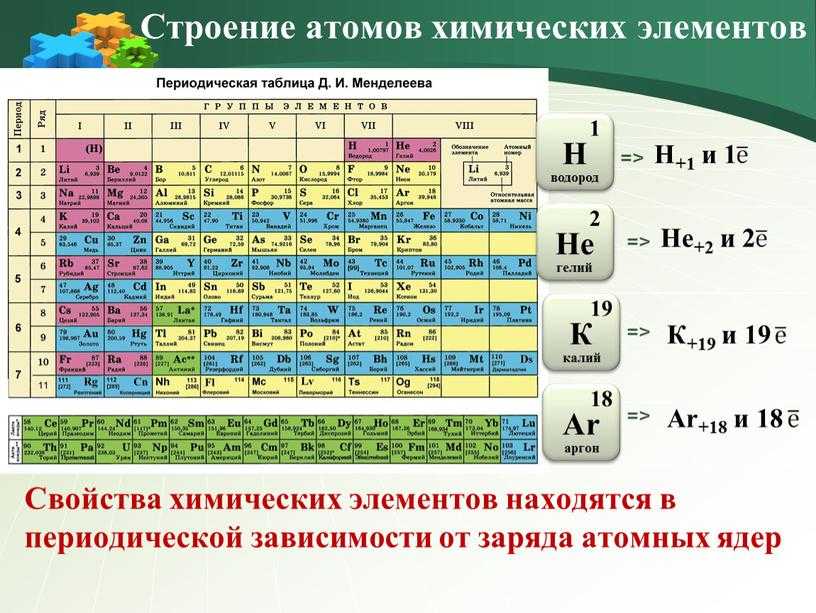 А чем еще их можно ударить, чтобы сломать, если они самые маленькие в мире? Поэтому они соединяют их вместе.
А чем еще их можно ударить, чтобы сломать, если они самые маленькие в мире? Поэтому они соединяют их вместе.
И что, по-вашему, происходит?
Элементарные частицы не распадаются, они превращаются в другие элементарные частицы. Эти превращения, называемые ядерными реакциями, зависят от скорости, с которой ускоряются частицы. То есть, она зависит от энергии, которую получили частицы. Дело в том, что энергия (скорость) может превращаться в материю, в массу. И более того – если посмотреть глубже, оказывается, что это одно и то же – энергия и масса, представьте себе! Мир един. Но об этом мы поговорим позже.
А пока давайте подробнее рассмотрим элементарные частицы. Они ужасно милые! (В целом, существует довольно много элементарных частиц. Но основных, из которых состоит вся материя в мире, всего три, как уже говорилось. Мы разберемся с ними, а остальной вселенский хлам оставим взрослым физикам”).
Давайте начнем с электрона. Он самый маленький, и малышам не может причинить вреда.
Так, в свете прожекторов электрон выходит на сцену, чтобы привлечь наше внимание поклоном. Что мы можем сказать о нем? Какого он цвета? Он грубый? Он влажный, твердый, газообразный? Тепло ли это?
Нет! Все эти свойства, к которым мы привыкли в нашем большом мире (называемом макрокосмосом), не имеют ничего общего с миром элементарных частиц (микрокосмосом). В микрокосмосе нет ни цвета, ни запаха, ни шероховатости, ни твердости. Все это свойства макрокосмоса. Все эти свойства состоят из множества частиц, они являются макросвойствами. А по отдельности частицы не обладают этими свойствами.
Так что же у них есть?
А что есть у электрона? В конце концов, он должен обладать какими-то свойствами! Иначе его бы не существовало! Потому что существовать – значит как-то проявляться, то есть иметь свойства!
Да, электрон обладает определенными свойствами. У него есть масса. Мы уже говорили об этом – электрон очень легкий, самый легкий из трех.
Электрон в 1820 раз легче протона. Для сравнения, если протон – это танк, то электрон – это канистра с топливом. Если протон – это человек, то электрон – это авторучка в его кармане. Это и есть разница в массе.
Для сравнения, если протон – это танк, то электрон – это канистра с топливом. Если протон – это человек, то электрон – это авторучка в его кармане. Это и есть разница в массе.
Вы, кстати, заметили новый физический термин необычайной сложности – “масса”? Я как бы представил это уже после того, как это произошло. Надеюсь, я вас не расстроил.
Что это такое? Масса – это просто количество материи. Чем тяжелее тело, тем оно массивнее. Отец более значителен, чем ребенок. Танк более массивный, чем автомобиль. Солнце массивнее Земли.
Массу не следует путать с весом. Хотя многие взрослые это делают. Даже генералы и начальники. И, возможно, даже сам президент. Но это совершенно разные вещи! Вес – это сила, с которой Земля притягивает массу. Это сила, с которой массивное тело оказывает давление на опору, на которой оно лежит, или растягивает подвес, на котором оно висит. В космосе, в невесомости, нет веса, поэтому она и называется невесомостью. Но даже в условиях невесомости толстый астронавт гораздо массивнее худого.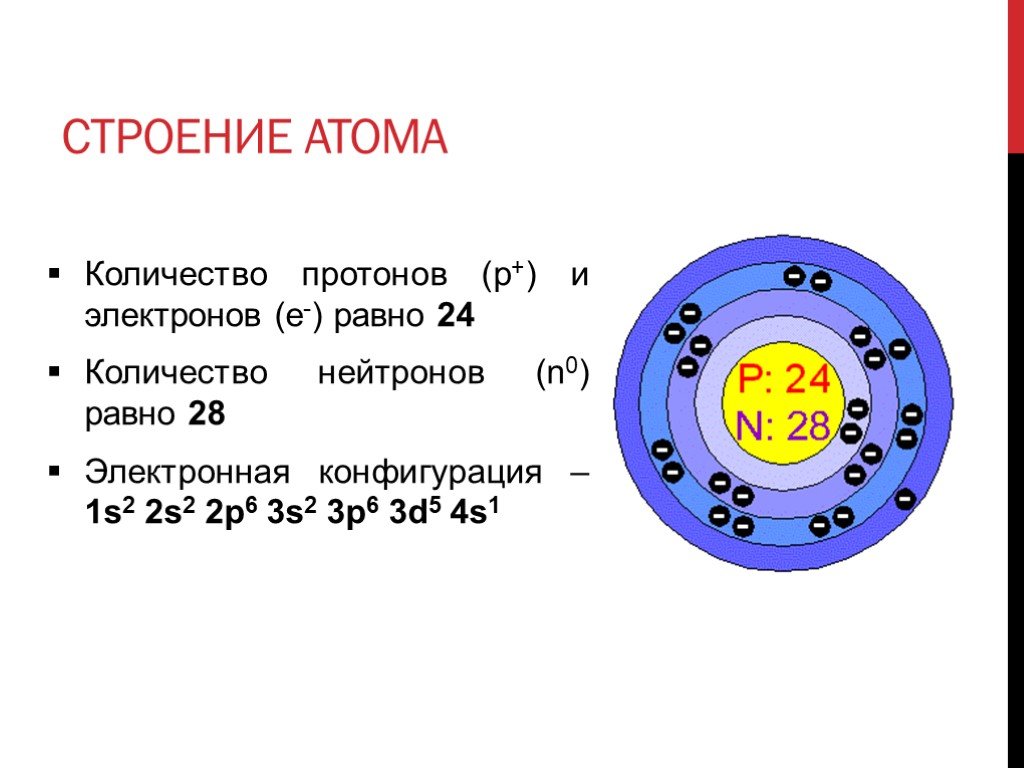 Если они оттолкнутся друг от друга, то полетят в разные стороны и с разной скоростью – толстый будет двигаться медленно, а худой быстро! Поскольку количество вещества в их организме разное, у толстого его много, а у худого – мало.
Если они оттолкнутся друг от друга, то полетят в разные стороны и с разной скоростью – толстый будет двигаться медленно, а худой быстро! Поскольку количество вещества в их организме разное, у толстого его много, а у худого – мало.
Физики даже измеряют вес и массу в разных единицах – массу в килограммах, а силу в специальных единицах – ньютонах. Масса определяется с помощью весов, а сила – с помощью специальных приборов – ньютон-метров. Вы понимаете?
Люди науки также называют массу мерой инерции тела. Действительно, массивное тело очень инертно, и для его ускорения требуется много усилий. Но легкое тело также легче разогнать, его инерция мала.
Электрон очень легкий. Его масса настолько мала, что мне приходится быть очень осторожным, чтобы не перепутать нули:
0,0000000000000000000000000000000000000009 грамм – столько весит электрон.
А еще есть размер электрона. Он также является крошечным:
0,000000000000000000000000001 миллиметр – таков размер электрона.
Электрон можно представить как маленький шарик, вращающийся вокруг собственной оси. Своего рода крошечная планета.
И, как вы понимаете, электрон может вращаться в одну или другую сторону, как показано на рисунке ниже. Это также одно из свойств электрона – вращение влево или вправо. С научной точки зрения, вращение электрона называется спином. Это не вращение, потому что шар не крутится, а вращается. Спин – это собственное вращение электрона, от английского слова “spin”.
Если ствол винтовки правша, то пуля, вылетающая из ствола, будет вращаться по часовой стрелке. Если он левосторонний, у него будет левостороннее вращение. Теперь представьте, что мы стреляем по мишени, которая слабо закреплена в центре и может вращаться. В этом случае снаряды с вращением по часовой стрелке, попадая в цель, будут передавать ей свое вращение, постепенно вращаясь в том же направлении – более или менее подобно тому, как отвертка вращает винт.
Если вы не знаете, в какую сторону вращаются пули, вылетающие из ствола, вы можете провести эксперимент, стреляя по вращающейся мишени.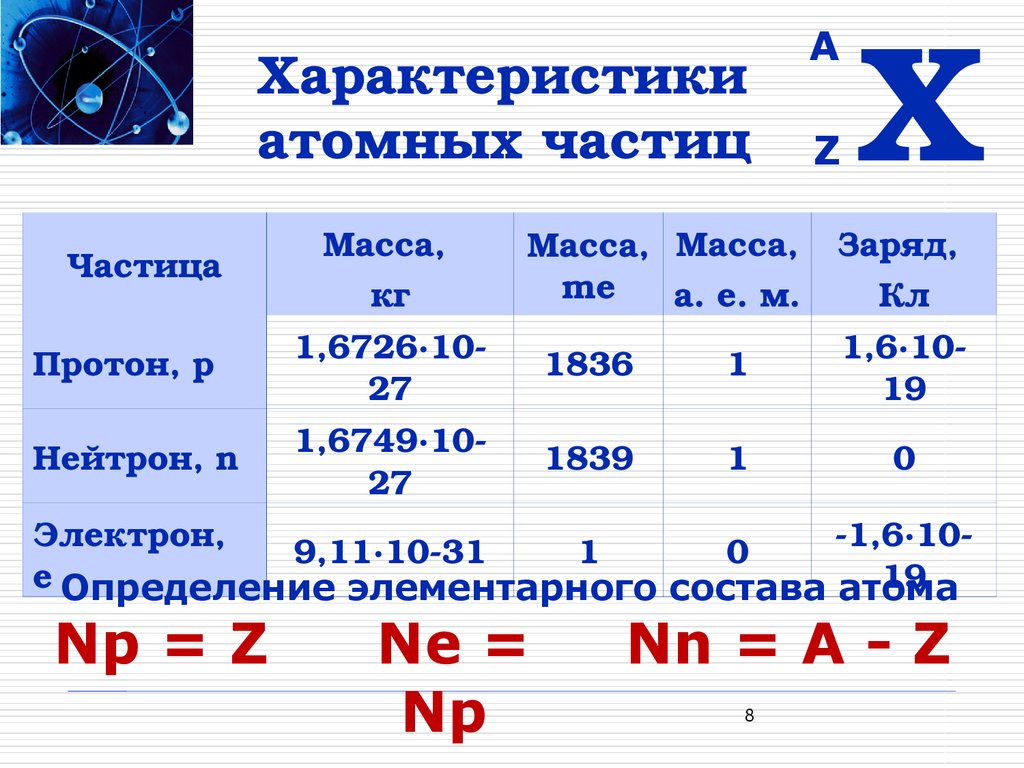 В какую сторону она вращается, в ту же сторону вращается и пуля.
В какую сторону она вращается, в ту же сторону вращается и пуля.
Но спин – ничто по сравнению с последним и самым загадочным свойством электрона. Это свойство называется зарядом. Но заряд не в том смысле, что электрон заряжен чем-то, как винтовка патроном, потому что патрон можно извлечь из винтовки. Но этот таинственный заряд не может быть удален с электрона. Это записано в нем, это его часть. Это его основное свойство. Электрон, по сути, является зарядом!
Какова плата?
Никто этого не знает. Но мы знаем, как проявляется этот таинственный заряд. И сейчас вы это узнаете.
Давным-давно люди заметили, что если потереть кусочек янтаря шерстяной тканью, то он притягивает к себе маленькие кусочки бумаги. Янтарь – это окаменевшая сосновая смола. У вашей мамы наверняка есть янтарные безделушки – кулон или серьги. Эти безделушки должны быть использованы с пользой! Возьмите кулон, аккуратно выковыряйте желтоватый янтарь из держателя (маме он больше не понадобится), возьмите шерстяной носок, порвите бумагу на мелкие кусочки. Затем, потерев янтарь, попробуйте вытянуть с его помощью клочки бумаги.
Затем, потерев янтарь, попробуйте вытянуть с его помощью клочки бумаги.
Надеюсь, вы не будете получать удовольствие от своих смелых исследований.
Это явление впервые заметили те же древние греки, очень вдумчивые люди. Греческое слово, обозначающее янтарь, – “электрон”. И вы, наверное, уже догадались, что за притягивание бумаг отвечают электроны, поскольку эти частицы были названы физиками в честь янтаря.
Действительно, в этом простом эксперименте человечество впервые столкнулось с действием электрических сил, возникающих из электрического заряда.
Теперь мы привыкли к электричеству. Теперь мы не можем жить без него. Теперь у нас повсюду вилки, которые бьют током умных детей, вставляющих в них свои тонкие пальчики. Сейчас мы просто окружены электричеством, без которого никуда. Стиральные машины, лифты, лампы, холодильники, троллейбусы и электропоезда, радиоприемники и телевизоры, фабрики и заводы – все работает на электричестве. Линии электропередач доставляют потребителям электроэнергию, которая вырабатывается на электростанциях.
Если бы атомы были непроницаемы, ничто не могло бы пройти через алюминиевую фольгу – ни фотоны видимого света, ни рентгеновские фотоны, ни электроны, ни протоны, ни атомные ядра. Все, что вы направите на фольгу, либо застрянет в ней, либо отскочит – точно так же, как любой брошенный предмет отскочит или застрянет в гипсокартоне (рис. 3). Но на самом деле высокоэнергетические электроны могут легко пройти через кусок алюминиевой фольги, как и рентгеновские фотоны, высокоэнергетические протоны, высокоэнергетические нейтроны, высокоэнергетические ядра и так далее. Электроны и другие частицы – почти все, если быть точным, – могут проходить через материал, не теряя ни энергии, ни импульса при столкновениях с чем-либо внутри атомов. Лишь небольшая часть из них попадет в ядро атома или электрон, и в этом случае они могут потерять большую часть своей первоначальной энергии движения. Но большинство электронов, протонов, нейтронов, рентгеновских лучей и т.д. просто спокойно пройдут мимо (рис. 4). Это не то же самое, что бросать камешки в стену; это то же самое, что бросать камешки в сетчатый забор (рис. 5).
4). Это не то же самое, что бросать камешки в стену; это то же самое, что бросать камешки в сетчатый забор (рис. 5).
Откуда мы знаем, что ядро атома маленькое?
Одно дело убедить себя, что определенное ядро определенного изотопа содержит Z протонов и N нейтронов; другое дело убедить себя, что атомные ядра крошечные, и что протоны и нейтроны, когда они сжимаются вместе, не размазываются в кашу и не рассеиваются в беспорядке, а сохраняют свою структуру, о чем нам говорит картинка из мультфильма. Как это можно подтвердить?
Я уже упоминал, что атомы практически пусты. Это легко проверить. Представьте себе алюминиевую фольгу, сквозь которую ничего не видно. Поскольку она непрозрачна, можно сделать вывод, что это атомы алюминия:
1. настолько большой, что между ними нет промежутков,
2. настолько плотный и твердый, что свет не может пройти сквозь него.
В первом случае вы будете правы: в твердых телах между двумя атомами почти нет пространства. Вы можете увидеть это на фотографиях атомов, полученных с помощью специальных микроскопов; атомы выглядят как маленькие шарики (края которых являются краями электронных облаков) и довольно плотно упакованы. Но что касается второго пункта, то вы ошибаетесь.
Но что касается второго пункта, то вы ошибаетесь.
Рисунок 4.
Если бы атомы были непроницаемы, то ничто не могло бы пройти через алюминиевую фольгу – ни фотоны видимого света, ни рентгеновские лучи, ни электроны, ни протоны, ни атомные ядра. Любой предмет, направленный на фольгу, либо застрянет в ней, либо отскочит от нее – точно так же, как любой предмет, брошенный в нее, должен отскочить от нее или застрять в гипсокартоне (рис. 3). Но в действительности высокоэнергетические электроны могут легко пройти через кусок алюминиевой фольги, как и рентгеновские фотоны, высокоэнергетические протоны, высокоэнергетические нейтроны, высокоэнергетические ядра и так далее. Электроны и другие частицы – точнее, почти все из них – могут проходить через материал, не теряя энергии и импульса при столкновениях с чем-либо в атомах. Лишь небольшая часть из них попадет в ядро атома или электрон, и в этом случае они могут потерять большую часть своей первоначальной энергии движения. Но большинство электронов, протонов, нейтронов, рентгеновских лучей и других лучей просто спокойно пройдут мимо (рис. 4). Это не то же самое, что бросать камешки в стену; это то же самое, что бросать камешки в сетчатый забор (рис. 5).
Но большинство электронов, протонов, нейтронов, рентгеновских лучей и других лучей просто спокойно пройдут мимо (рис. 4). Это не то же самое, что бросать камешки в стену; это то же самое, что бросать камешки в сетчатый забор (рис. 5).
Рис. 5
Чем толще фольга – например, при укладке все большего количества листов фольги – тем больше вероятность того, что запущенные в нее частицы столкнутся с чем-то, потеряют энергию, отскочат, изменят направление или даже остановятся. То же самое относится и к укладке одной проволочной сетки за другой (Рисунок 6). И, как вы понимаете, на основании того, насколько далеко средний камешек может проникнуть через слои решетки и насколько велики зазоры в решетке, ученые могут рассчитать, основываясь на расстоянии, пройденном электронами или атомными ядрами, насколько пуст атом.
Рисунок 6.
Благодаря таким экспериментам физики в начале XX века установили, что ничто внутри атома – ни атомное ядро, ни электроны – не может быть больше одной тысячной доли миллионной доли метра, или в 100 000 раз меньше самого атома. То, что ядро достигает таких размеров, в то время как электроны по крайней мере в 1 000 раз меньше, мы установили в других экспериментах – например, при рассеянии высокоэнергетических электронов друг от друга или от позитронов.
То, что ядро достигает таких размеров, в то время как электроны по крайней мере в 1 000 раз меньше, мы установили в других экспериментах – например, при рассеянии высокоэнергетических электронов друг от друга или от позитронов.
Чтобы быть еще более точным, следует упомянуть, что некоторые частицы потеряют часть своей энергии в процессе ионизации, в котором электрические силы, действующие между летящей частицей и электроном, могут вырвать электрон из атома. Это эффект дальнего действия, который на самом деле не является столкновением. В результате потери энергии значительны для летящих электронов, но не для летящего ядра.
Интересно, не похож ли способ прохождения частиц через пленку на способ прохождения пули через бумагу – измельчение кусочков бумаги. Возможно, первые несколько частиц просто раздвигают атомы, оставляя большие отверстия, через которые проходят последующие частицы? Мы знаем, что это не так, потому что можем провести эксперимент, в котором частицы входят и выходят из контейнера из металла или стекла, в котором существует вакуум. Если бы частица, проходящая через стенки контейнера, создавала отверстия размером больше, чем атомы, то молекулы воздуха устремились бы внутрь, и вакуум исчез бы. Но в таких экспериментах вакуум остается!
Если бы частица, проходящая через стенки контейнера, создавала отверстия размером больше, чем атомы, то молекулы воздуха устремились бы внутрь, и вакуум исчез бы. Но в таких экспериментах вакуум остается!
Также довольно легко сделать вывод, что ядро не является особо упорядоченной кучей, внутри которой нуклоны сохраняют свою структуру. Об этом можно догадаться уже из того, что масса ядра очень близка к сумме масс содержащихся в нем протонов и нейтронов. Это верно как для атомов, так и для молекул – их массы почти равны сумме масс их содержимого, за исключением небольшой поправки на энергию связи – и это отражается в том, что молекулы довольно легко разбить на атомы (например, нагревая их, чтобы они больше сталкивались друг с другом) и выбить электроны из атомов (опять же, нагревая их). Аналогичным образом, относительно легко разбить ядра на части, этот процесс мы называем делением, или собрать ядро из меньших ядер и нуклонов, этот процесс мы называем ядерным синтезом. Например, относительно медленно движущиеся протоны или маленькие ядра, сталкиваясь с большим ядром, могут разделить его на части; при этом нет необходимости, чтобы сталкивающиеся частицы двигались со скоростью света.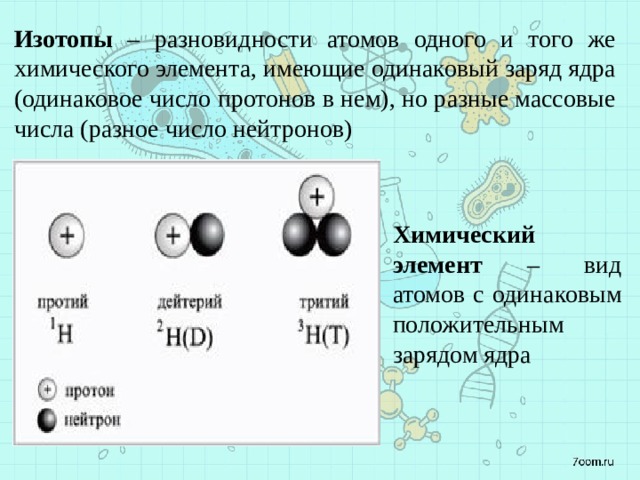
Рис. 7
Однако, чтобы понять, что это не является неизбежным, отметим, что сами протоны и нейтроны не обладают этими свойствами. Масса протона не равна приблизительной сумме масс объектов в нем; протон не может распадаться; и для того, чтобы протон продемонстрировал что-нибудь интересное, необходимы энергии, сравнимые с энергией массы самого протона. Молекулы, атомы и ядра относительно просты; протоны и нейтроны чрезвычайно сложны.
Количество электронов = номеру элемента.
Число протонов = номер элемента.
Число нейтронов = атомная масса – число протонов (т.е. порядковый номер элемента) [Пример: если мы найдем число протонов в Mg (магнии), то атомная масса магния равна 24, а его порядковый номер – 12, поэтому число нейтронов равно 12].
Объясните мне пожалуйста как найти протоны, нейтроны и электроны в атомах)) Пожалуйста, домашнее задание по химии на завтра) Начало 8 класса)
Количество электронов = номеру элемента.
Число протонов = номер элемента.
Число нейтронов = атомная масса – число протонов (которое является порядковым номером элемента) [Пример: предположим, мы находим число протонов в Mg (магний), атомная масса магния равна 24, а его порядковый номер – 12; следовательно, число нейтронов равно 12].
Атом переводится как неделимый.
Атом электрически инертен, состоит из ядра и вращающихся вокруг него электронов.
Электрон – это частица с отрицательным зарядом, не имеющая массы.
Ядро положительно заряжено и состоит из нейтронов и протонов.
Протон – частица с зарядом +1 и массой 1
Нейтрон-n-частица без заряда и массой 1
Заряд ядра=p=количество электронов
n=Ar-p
Прежде чем рассматривать два других правила, давайте введем понятие спина электрона. Спин – это свойство самого электрона, и его можно представить (это упрощенная модель, а не истинный физический смысл спина!) как направление движения электрона вокруг своей оси: по или против часовой стрелки.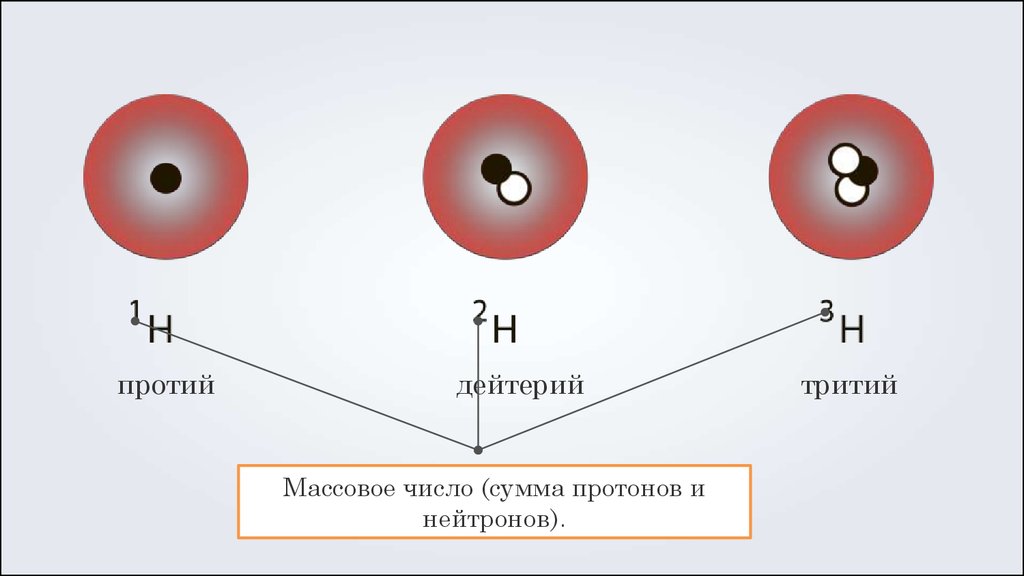 Существует только два возможных значения: +1/2 i -1/2.
Существует только два возможных значения: +1/2 i -1/2.
Структура атома
Атом – в переводе с древнегреческого – неделимый – это мельчайшая частица химического элемента, которая является носителем его свойств. Современные представления о строении атома требуют знания основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (состоящего из протонов и нейтронов) и электронов. Хотя на ядро приходится большая часть массы атома, оно очень маленькое.
| масса m | ||
| Протон p + | +1 | 1 |
| Нейтрон n 0 | 0 | 1 |
| Электрон e – – – | -1 | 0 |
Число протонов равно числу электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности между атомной массой и атомным номером элемента.
Бор – пятый элемент в периодической таблице, его атом имеет 5 протонов и 5 электронов. Атомная масса ≈ 11, число нейтронов 11 – 5 = 6.
Атомная масса ≈ 11, число нейтронов 11 – 5 = 6.
Элементы, которые имеют одинаковое количество протонов в ядре, но отличаются количеством нейтронов, называются изотопами.
Например, 35 Cl и 37 Cl – это изотопы, которые отличаются атомной массой и числом нейтронов.
| Количество протонов | Количество нейтронов | Количество электронов | |
| 35 Кл | 17 | 18 | 17 |
| 37 Кл | 17 | 20 | 17 |
Электроны движутся вокруг ядра по различным путям – орбиталям. Каждая орбиталь соответствует своему энергетическому уровню; чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны размещаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии:Электроны сначала заполняют самые низкие энергетические уровни (ближайшие к ядру).

Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s
| Тип орбиты | Максимальное количество электронов на этих орбиталях | |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Прежде чем рассматривать два других правила, давайте введем понятие спина электрона. Спин – это свойство самого электрона, и его можно представить (это упрощенная модель, а не истинный физический смысл спина!) как направление движения электрона вокруг своей оси: по или против часовой стрелки. Существует только два возможных значения: +1/2 i -1/2.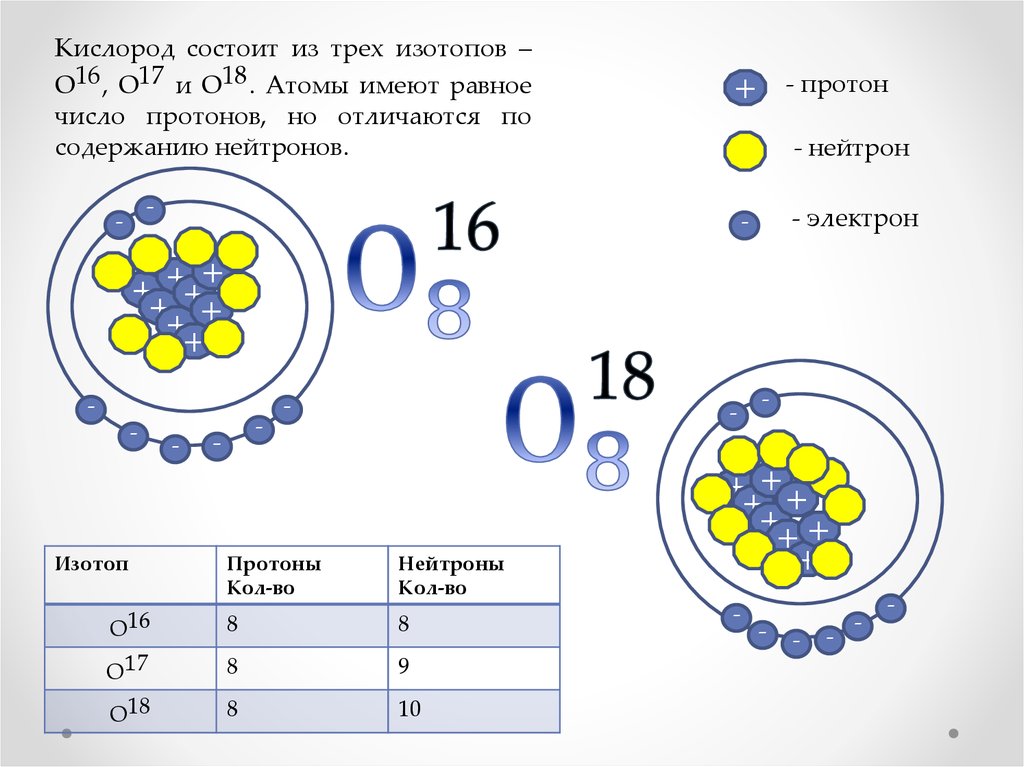
- Принцип Паули:На каждой орбитали не может быть более двух электронов, и их спины должны быть разными.
- Принцип Хунда:Общее вращение системы должно быть как можно больше.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. Каждый последующий элемент в таблице Менделеева имеет на один протон и один электрон больше, чем предыдущий. Элементы n-го периода заполнили предыдущие n-1 электронных уровней.
– Магний является двенадцатым элементом и имеет по 12 протонов и электронов. Давайте распределим эти электроны в соответствии с (●), помня, что на каждом подуровне не может быть более двух электронов.
Магний – элемент третьего периода, поэтому первый и второй энергетические уровни полностью заполнены – 1s 2 2s 2p 6 . Магний находится во второй группе, поэтому у него два электрона на третьем уровне – 3s 2 . Таким образом, получаем1s 2 2s 2p 6 3s 2 .
В основном состоянии атома магния нет неспаренных электронов.
Если атом получает дополнительную энергию (например, нагревается), пара электронов может испариться, и один из электронов перейдет на свободную орбиталь того же энергетического уровня. В своем возбужденном состоянии атом магния имеет два неспаренных электрона и может образовывать две связи (валентность II).
– Фосфор – пятнадцатый элемент, отдающий 15 электронов: Фосфор является элементом третьего периода, поэтому первый и второй энергетические уровни полностью заполнены – 1s 2 2s 2p 6. Фосфор находится в пятой группе, поэтому у него пять электронов на третьем уровне – 3s 2 3p 3 . Таким образом, получаем1s 2 2s 2 2p 6 3s 2 3p 3 .
Атом фосфора в основном состоянии имеет три неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовывать пять связей (валентность V).
– Цирконий является сороковым элементом и имеет 40 электронов. Цирконий – элемент пятого периода, поэтому первые четыре энергетических уровня полностью заполнены – 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 . Заполнение пятого уровня начинается с 5s 2 . Цирконий – второй d-элемент в пятом периоде, поэтому он содержит 2 электрона на 4d-подуровне. Таким образом, получаем: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 .
Заполнение пятого уровня начинается с 5s 2 . Цирконий – второй d-элемент в пятом периоде, поэтому он содержит 2 электрона на 4d-подуровне. Таким образом, получаем: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 .
Атом циркония имеет 2 неспаренных электрона в основном состоянии.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Исключение из общего порядка заполнения электронных подуровней составляют хром, марганец, медь, серебро и золото – в этих случаях происходит “падение” электронов с внешнего подуровня s на подуровень d. Например, электронные конфигурации хрома и меди вместо 4s 2 3d 4 и 4s 2 3d 9 имеют вид 4s 1 3d 5 и 4s 1 3d 10.
Протон – это частица, имеющая положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона – это p + .
Атомы состоят из еще более мелких частиц.
В центре каждого атома находится положительно заряженное ядро. В пространстве вокруг ядра находятся отрицательно заряженные частицы, называемые электронами, которые образуют так называемое электронное облако. Итак, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Итак, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Пример. Атом гелия состоит из ядра, которое содержит два протона, два нейтрона и два электрона:
Ядро атома – это центральная часть атома, где сосредоточена его основная масса и весь положительный электрический заряд. Атомное ядро состоит из протонов и нейтронов.
Протон – это частица, имеющая положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона – это p + .
Нейтрон – это частица, не имеющая электрического заряда. Заряд нейтрона равен 0. Символ нейтрона – это n 0 .
Протоны и нейтроны имеют общее название – нуклоны.
Атомные ядра имеют положительный заряд, поскольку состоят из положительно заряженных протонов и нейтронов. Этот заряд равен числу протонов в ядре и совпадает с порядковым номером элемента в периодической таблице.
Электрон – это частица, имеющая отрицательный электрический заряд. Заряд электрона равен -1 в условных единицах. Символом электрона является e .
Протоны, нейтроны и электроны имеют общее название – элементарные частицы или субатомные частицы.
| Имя | Символ | Гонорар |
|---|---|---|
| Протон | p + | +1 |
| Нейтрон | n 0 | 0 |
| Электрон | e | -1 |
Заряды протона и электрона равны по величине, но противоположны по знаку. Каждый атом содержит равное количество протонов и электронов, поэтому ядерный заряд и суммарный заряд всех электронов в атоме равны по величине, но противоположны по знаку. Поэтому атомы являются электрически нейтральными частицами.
Читайте далее:
- Многоликий протон.
- Определение количества нейтронов, протонов и электронов в атоме.

- Атомная структура.
- Заряд атомного ядра, теория и примеры.
- Как работают атомы.
- Свойства атомов и их периодичность – ЗФТШ, МФТИ.
- Атомы и электроны, подготовка к экзамену ЕГЭ по химии.
5.5 Изотопы элементов – расширенный вводный курс химии в колледже
Перейти к содержимому
К концу этого раздела вы сможете:
- Давать определения изотопам и идентифицировать примеры изотопов для нескольких элементов
- Запишите и расшифруйте символы, изображающие атомный номер, массовое число изотопов
- Запишите названия изотопов, используя общепринятые методы именования
Что такое изотоп?
Изотопы — это различные формы одного и того же элемента, имеющие одинаковое количество протонов, но разное количество нейтронов. По мере изменения числа нейтронов в атоме изменяется и его относительная изотопная масса. Относительная масса изотопа (также называемая массовым числом) представляет собой сумму протонов и нейтронов, присутствующих в этом изотопе.
Массовое число (A) = количество протонов + количество нейтронов
Символы изотопов для элементов используются для представления определенных изотопов атомов и включаются в верхний индекс, в нижний индекс, за которым следует символ элемента (X) в обычном случае (рис. 5.5a).
Количество протонов в ядре атома является его атомным номером (Z). Это определяющая черта элемента. Его атомный номер (Z) определяет идентичность атома. Например, любой атом, содержащий шесть протонов, является элементом углерода и имеет атомный номер 6, независимо от того, сколько в нем нейтронов или электронов. Если вы измените атомный номер на 7, вы больше не имеете дело с атомами углерода, а с атомами азота. Нейтральный атом должен содержать одинаковое количество положительных и отрицательных зарядов, поэтому количество протонов равно количеству электронов. Следовательно, атомный номер также указывает на количество электронов в атоме. Суммарное количество протонов и нейтронов в атоме называется его массовым числом (А). Таким образом, число нейтронов в этом атоме равно разнице между массовым числом (А) и атомным номером (Z).
Таким образом, число нейтронов в этом атоме равно разнице между массовым числом (А) и атомным номером (Z).
Итого:
[латекс]\begin{array}{r @ {{}={}} l} \text{атомный номер (Z)} & \text{число протонов} \\[1em] \text{массовое число (A )} & \text{количество протонов + количество нейтронов} \\[1em] \text{A — Z} & \text{количество нейтронов} \end{массив}[/latex]
Рисунок 5.5a Символы изотопов элементов: шаблон символа используется для отличия одного изотопа от другого. Символ элемента записывается для идентификации элемента. A представляет собой массовое число изотопа, а символ Z представляет собой атомный номер изотопа. Все изотопы элемента имеют одинаковое количество протонов и электронов, что означает, что они обладают схожими химическими свойствами. (кредит : «1.6 Изотопы и атомные массы» В Принципы общей химии (v. 1.0) Аноним, CC BY-NC-SA 3.0./ Адаптировано Джеки Макдональд.Примеры изотопов и их свойства:
Как упоминалось выше, символ определенного изотопа любого элемента записывается путем размещения массового числа в виде надстрочного индекса слева от символа элемента.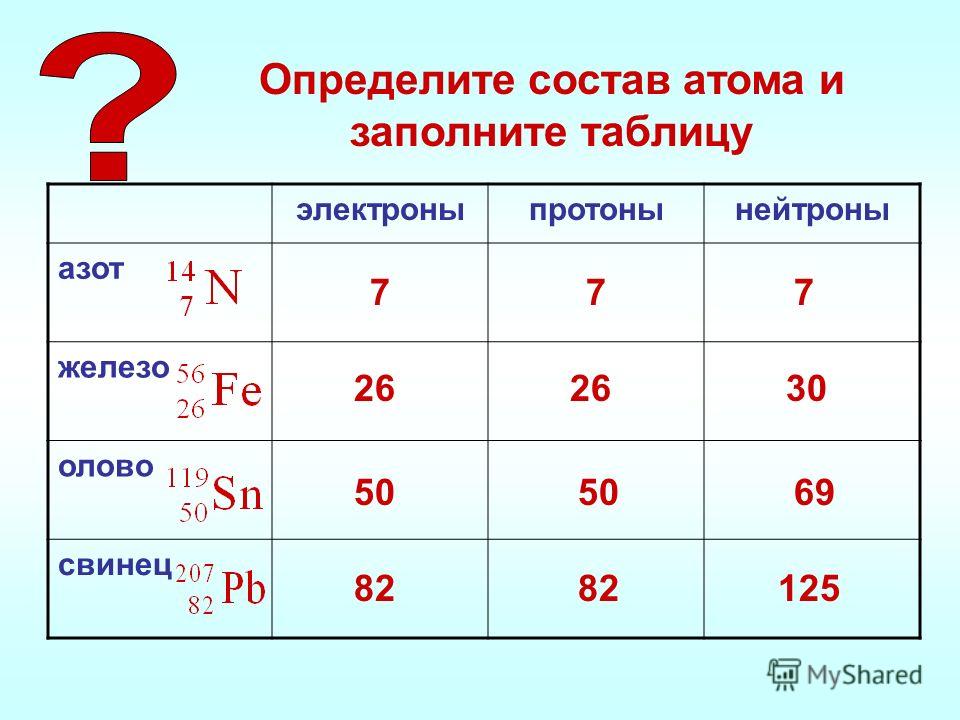 Атомный номер иногда записывается в виде нижнего индекса перед символом, но поскольку это число определяет идентичность элемента (атомный номер), как и его символ, его иногда опускают, как показано на рис. 5.5b. Различные изотопы элемента углерода и количество каждой субатомной частицы в этом изотопе показаны ниже:
Атомный номер иногда записывается в виде нижнего индекса перед символом, но поскольку это число определяет идентичность элемента (атомный номер), как и его символ, его иногда опускают, как показано на рис. 5.5b. Различные изотопы элемента углерода и количество каждой субатомной частицы в этом изотопе показаны ниже:
- Углерод-12 (или 12 C) имеет атомный номер 6 и массовое число 12 (шесть протонов и шесть нейтронов). Он содержит шесть протонов, шесть нейтронов и шесть электронов
- Углерод-13 (или 13 C) имеет атомный номер 6 и массовое число 13 (шесть протонов и семь нейтронов). Он содержит шесть протонов, семь нейтронов и шесть электронов.
- Углерод-14 (или 14 C) имеет атомный номер 6 и массовое число 14 (шесть протонов и восемь нейтронов). Он содержит шесть протонов, восемь нейтронов и шесть электронов
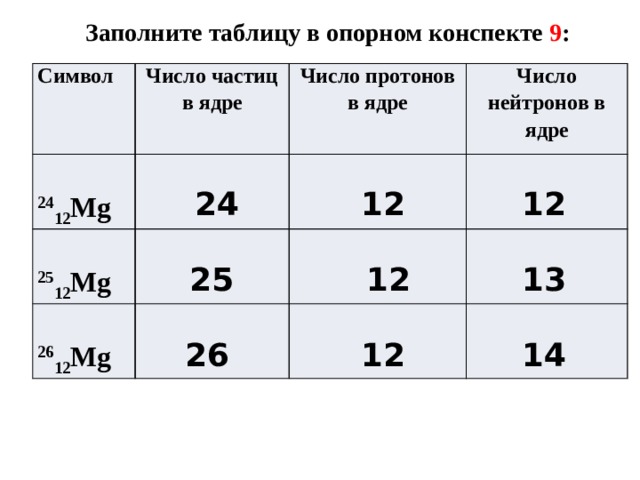
При чтении определенного символа изотопа он читается как «элемент, массовое число». Например, в случае магния 24 Mg читается как «магний-24» и может быть записано как «магний-24» или «Mg-24».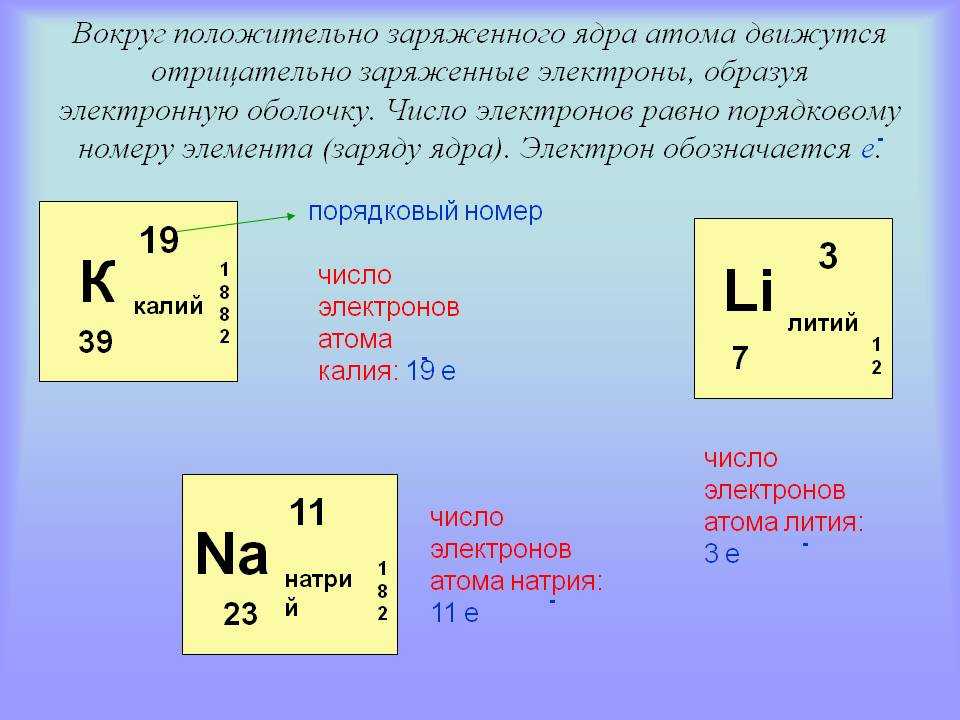 Все атомы магния имеют атомный номер 12, что означает наличие 12 протонов в ядре. Эти изотопы отличаются только тем, что атом 24 Mg имеет в своем ядре 12 нейтронов, атом 25 Mg имеет 13 нейтронов, а атом 26 Mg имеет 14 нейтронов.
Все атомы магния имеют атомный номер 12, что означает наличие 12 протонов в ядре. Эти изотопы отличаются только тем, что атом 24 Mg имеет в своем ядре 12 нейтронов, атом 25 Mg имеет 13 нейтронов, а атом 26 Mg имеет 14 нейтронов.
Пример 5.5a
Укажите краткую форму изотопа и символ изотопа (укажите только массовое число, не указывая атомный номер) для следующих изотопов: мышьяк-74, кальций-44. При необходимости обратитесь к периодической таблице.
Раствор
Мышьяк-74: краткая форма изотопа = As-74; символ изотопа = 74 As
Кальций-44: краткая форма изотопа = Ca-44; изотопный символ = 44 Ca
Пример 5.
 5b
5bУкажите правильное название изотопа с символом 202 Hg; 56 Fe. При необходимости обратитесь к периодической таблице.
Раствор
202 Hg; Название изотопа = Меркурий-202
56 Fe; Название изотопа = Железо – 56
Пример 5.5c
Напишите название изотопа и символ (только массовое число) для следующих двух элементов. При необходимости обратитесь к периодической таблице.
- Элемент 1 имеет 12 протонов и 13 нейтронов
- Элемент 2 имеет 17 протонов и 20 нейтронов
Раствор
Элемент 1 имеет 12 протонов (поэтому его атомный номер равен 12). Используя периодическую таблицу для справки, элемент с атомным номером 12 — это магний (Mg). Массовое число будет 12 p + + 13 n 0 = 25.
Название изотопа = Магний-25 или Mg-25
Обозначение изотопа = 25 Mg
Следовательно, у элемента 2 17 протонов (порядковый номер 7). Используя периодическую таблицу для справки, элемент с атомным номером 17 — это хлор (Cl). Массовое число будет 17 p + + 20 n 0 = 37.
Используя периодическую таблицу для справки, элемент с атомным номером 17 — это хлор (Cl). Массовое число будет 17 p + + 20 n 0 = 37.
Название изотопа = Хлор-37 или Cl-37
Обозначение изотопа = 37 Cl
Проверьте свое учебное упражнение (текстовая версия)Выберите вариант, который лучше всего отвечает утверждениям для каждого из предоставленных вопросов с несколькими вариантами ответов.
- Изотопы различаются по количеству
- орбитали
- протонов
- нейтронов
- электронов
- обвинений
- Водород имеет три встречающихся в природе изотопа. Что из перечисленного не является изотопом водорода?
- Кватрий, 4 H, содержит один электрон, один протон и три нейтрона
- Тритий, 3 H, содержит один электрон, один протон и два нейтрона
- Дейтерий, имеет символ 2 H, содержит один электрон, один протон и один нейтрон
- Протий, имеет символ 1 H, содержит один электрон, один протон и не содержит нейтронов
- Краткая форма изотопа и символ изотопа (включая только массовое число, без атомного номера) для йода-127:
- И-127; 127 я
- И-127; 127 я
- Ио-127; 127 Ио
- И-53; 53 я
- И-74; 74 я
- Что из следующего является символом изотопа (указать только массовое число, опустить атомный номер) для атома, который имеет 15 протонов и 16 нейтронов.

- 16 О
- 31 Га
- 15 Р
- 16 Р
- 31 Р
- Название изотопа и краткая форма нейтрального атома, имеющего 7 электронов и 8 нейтронов:
- азот – 8; Н-8
- азот – 14; Н-14
- азот – 15; Н-15
- кислород – 14; О-14
- кислород – 15; О-15
- Олово — серебристый ковкий металлический элемент, относящийся к 14 группе периодической таблицы. Олово имеет много стабильных природных изотопов, в том числе олово-120, естественное содержание которого составляет 32,58%. Что из следующего верно для изотопа олова-120?
- Как нейтральный изотоп, он содержит 50 протонов, 50 электронов и 70 нейтронов
- Его массовое число 120
- Его атомный номер 50
- Символ изотопа 120Sn
- все эти варианты содержат правдивую информацию о tin-120
- Элемент X в атоме с массовым числом (A) 33 и атомным номером (Z) 16 является
- Мышьяк
- Индий
- Сера
- Хлор
- ни один из этих элементов не представляет этот изотоп
- Что из следующего является элементом X в атоме с массовым числом 58 и содержит 30 нейтронов?
- Кобальт
- Медь
- Церий
- Никель
- Цинк
Проверьте свой ответ
[1]
Источник: «Упражнение 5. 5а» Джеки Макдональд, под лицензией CC BY-NC-SA 4.0.
5а» Джеки Макдональд, под лицензией CC BY-NC-SA 4.0.
Хотя атомная масса (массовое число) отдельных изотопов данного элемента различна, их физические и химические свойства остаются в основном одинаковыми. Однако изотопы отличаются своей стабильностью. Углерод-12 ( 12 C) является наиболее распространенным из изотопов углерода, на его долю приходится 98,93% углерода на Земле. Углерод-13 ( 13 C) стабилен, но его содержание в природе составляет всего около 1,07%. Изотопы углерода-14 ( 14 C) встречаются в природе в следовых количествах и нестабильны или радиоактивны. Радиоактивные изотопы могут со временем распадаться, испуская нейтроны, протоны и/или электроны и энергию для получения более стабильной формы. Дополнительная информация, касающаяся радиоактивности/радиоактивного распада, может быть более подробно рассмотрена в ядерной химии или ядерной физике.
Информация о встречающихся в природе изотопах элементов с атомными номерами от 1 до 10 приведена в таблице 5. 5а. Обратите внимание, что в дополнение к стандартным названиям и символам изотопы водорода часто упоминаются с использованием общих имен и сопутствующих символов. Водород-2, обозначаемый символом 2 H, также называется дейтерием и иногда обозначается символом D. Водород-3, обозначаемый символом 3 H, также называется тритием и иногда обозначается символом T.
5а. Обратите внимание, что в дополнение к стандартным названиям и символам изотопы водорода часто упоминаются с использованием общих имен и сопутствующих символов. Водород-2, обозначаемый символом 2 H, также называется дейтерием и иногда обозначается символом D. Водород-3, обозначаемый символом 3 H, также называется тритием и иногда обозначается символом T.
| 10 | 10 | 12 | 22 | 21.9914 | 9,25 |
В упражнении 5.5b выберите опцию симулятора ISOTOPES, чтобы исследовать различные изотопы первых 10 элементов. Обязательно расширьте и просмотрите атомный символ и распространенность данных о природе при сравнении изотопов. Чтобы создать изотопы данного элемента, выберите свой элемент, например углерод, затем добавьте или удалите нейтроны.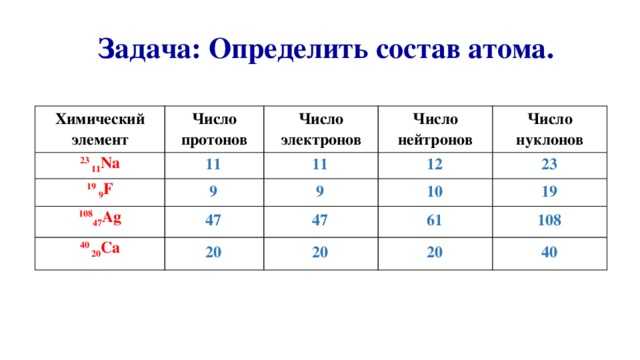 Наблюдайте, что происходит с символом элемента, обилием в природе (%) и его стабильностью.
Наблюдайте, что происходит с символом элемента, обилием в природе (%) и его стабильностью.
Практика использования следующего моделирования PhET: Изотопы и атомная масса
Источник активности: Моделирование PhET Interactive Simulations, Университет Колорадо в Боулдере, лицензия CC-BY-4.0
Рисунок 5.5c Атом кислорода-18: Изотоп кислорода-18 включает 8 протонов и 10 нейтронов в основном ядре и 8 электронов вокруг ядра. (кредит: работа SM358, PD). Как вы узнаете, изотопы важны в природе и особенно в человеческом понимании науки и медицины. Давайте рассмотрим только один естественный стабильный изотоп: кислород-18, который отмечен в таблице 5.5а выше и упоминается как один из изотопов окружающей среды. Например, это важно в палеоклиматологии, потому что ученые могут использовать соотношение между кислородом-18 и кислородом-16 в ледяном керне для определения температуры осадков с течением времени. Кислород-18 (рис.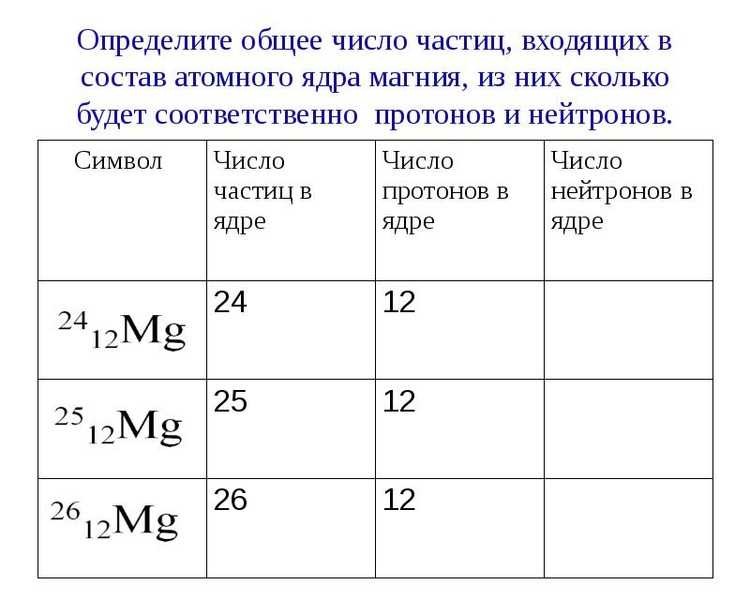 5.5c) также имел решающее значение для открытия метаболических путей и механизмов ферментов.
5.5c) также имел решающее значение для открытия метаболических путей и механизмов ферментов.
Милдред Кон впервые применила эти изотопы в качестве индикаторов, чтобы исследователи могли проследить их путь через реакции и лучше понять, что происходит. Одно из ее первых открытий дало представление о фосфорилировании глюкозы, происходящем в митохондриях. И методы использования изотопов для этих исследований внесли свой вклад в целые области исследований.
Узнайте больше о работе Милдред Кон и ее мотивирующей истории преодоления гендерных и религиозных предубеждений в статье Милдрен Кон (1913-2009) [Новая вкладка].
СМОТРЕТЬ Женщины в химии: Милдред Кон (18 мин 42 сек) .
Видео Источник: Институт истории науки (10 сентября 2012 г.). Женщины в химии: Милдред Кон [Видео]. YouTube.
YouTube.
Исследуйте изотопы в кабинете физики.
Атрибуция и ссылки
Если не указано иное, эта страница адаптирована Джеки Макдональдом из «2.3 — Атомная структура и символизм» в Chemistry 2e (Open Stax) Пола Флауэрса, Клауса Теопольда, Ричарда Лэнгли и Уильяма Р. Робинсона под лицензией CC BY 4.0. Бесплатный доступ по адресу Chemistry 2e (Open Stax) / Повторно использован раздел по изотопам, цели обучения переписаны.
- (1) в; (2) а; (3) а; (4) д; (5) в; (6) д; (7) в; (8)д ↵
Лицензия
Enhanced Introductory College Chemistry Грегори Андерсона; Кэрин Фэйи; Джеки Макдональд; Эдриенн Ричардс; Саманта Салливан Зауэр; Дж. Р. ван Харлем; и Дэвид Вегман находится под лицензией Creative Commons Attribution 4.0 International License, если не указано иное.
Поделиться этой книгой
Поделиться в Твиттере
Медь (Cu) состоит из двух встречающихся в природе изотопов с mas.
 ..
..Recent Channels
- General Chemistry
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Biology
- General Biology
- Микробиология
- Anatomy & Physiology
- Genetics
- Cell Biology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Business
- Microeconomics
- Macroeconomics
- Financial Accounting
Социальные науки
- Психология
Начните печатать, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
- 2. Атомы и элементы
- Атомная масса
Проблема
Соответствующее решение
3 м
Проиграйте видео: атомные массы. Нам нужно определить количество протонов и нейтронов для каждого из этих изотопов и определить символ изотопа. Наш первый шаг — вспомнить, как выглядит символ изотопа. Таким образом, у нас будет наш элемент, представленный X. У нас будет наш атомный номер, представленный символом Z. И затем над этим у нас будет символ, представляющий нашу атомную массу. Итак, мы должны помнить, что Z — это наш атомный номер, а А — наша атомная масса. А. К. А — наше массовое число. Мы хотим напомнить, что также наш атомный номер Z равен нашему количеству протонов. И мы также хотим вспомнить тот факт, что мы можем найти атомную массу, взяв наше количество протонов и добавив это к нашему количеству нейтронов. Итак, когда мы найдем магний в периодической таблице, мы найдем его во второй группе а. И мы видим, что это соответствует атомному номеру или Z, равному значению 12.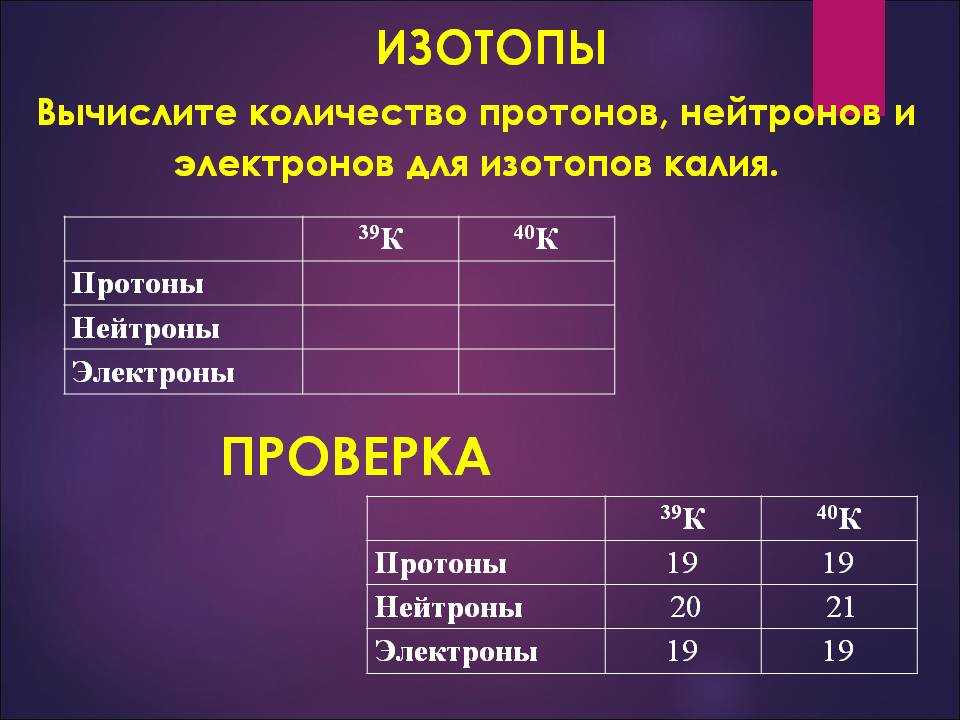 И это говорит нам о том, что у нас, следовательно, есть 12 протонов для каждого из наших изотопов магния. Итак, пока мы можем заполнить наш символ изотопа нашим атомом магния, и мы можем заполнить наш атомный номер как 12 здесь. Так что все, что нам не хватает, это наша атомная масса, которая здесь является нашей переменной. Итак, учитывая массу нашего первого изотопа, мы получили массу 23,9.85 утра использования. И мы собираемся вычесть эту массу из нашего числа протонов, которое, как мы только что подтвердили, равно 12 протонам. И эта разница дает нам наше число нейтронов, равное 12 нейтронам. Итак, чтобы завершить наш первый символ изотопа, мы хотим признать, что эта атомная масса представляет нашу атомную массу нашего изотопа. Итак, для нашего символа атомной массы мы просто округлим его примерно до 24, так как у нас есть 23,9. Таким образом, мы можем сказать, что у нас есть 24 для нашей атомной массы для нашего символа изотопа для нашего первого изотопа. И это будет соответствовать наличию нейтронов.
И это говорит нам о том, что у нас, следовательно, есть 12 протонов для каждого из наших изотопов магния. Итак, пока мы можем заполнить наш символ изотопа нашим атомом магния, и мы можем заполнить наш атомный номер как 12 здесь. Так что все, что нам не хватает, это наша атомная масса, которая здесь является нашей переменной. Итак, учитывая массу нашего первого изотопа, мы получили массу 23,9.85 утра использования. И мы собираемся вычесть эту массу из нашего числа протонов, которое, как мы только что подтвердили, равно 12 протонам. И эта разница дает нам наше число нейтронов, равное 12 нейтронам. Итак, чтобы завершить наш первый символ изотопа, мы хотим признать, что эта атомная масса представляет нашу атомную массу нашего изотопа. Итак, для нашего символа атомной массы мы просто округлим его примерно до 24, так как у нас есть 23,9. Таким образом, мы можем сказать, что у нас есть 24 для нашей атомной массы для нашего символа изотопа для нашего первого изотопа. И это будет соответствовать наличию нейтронов.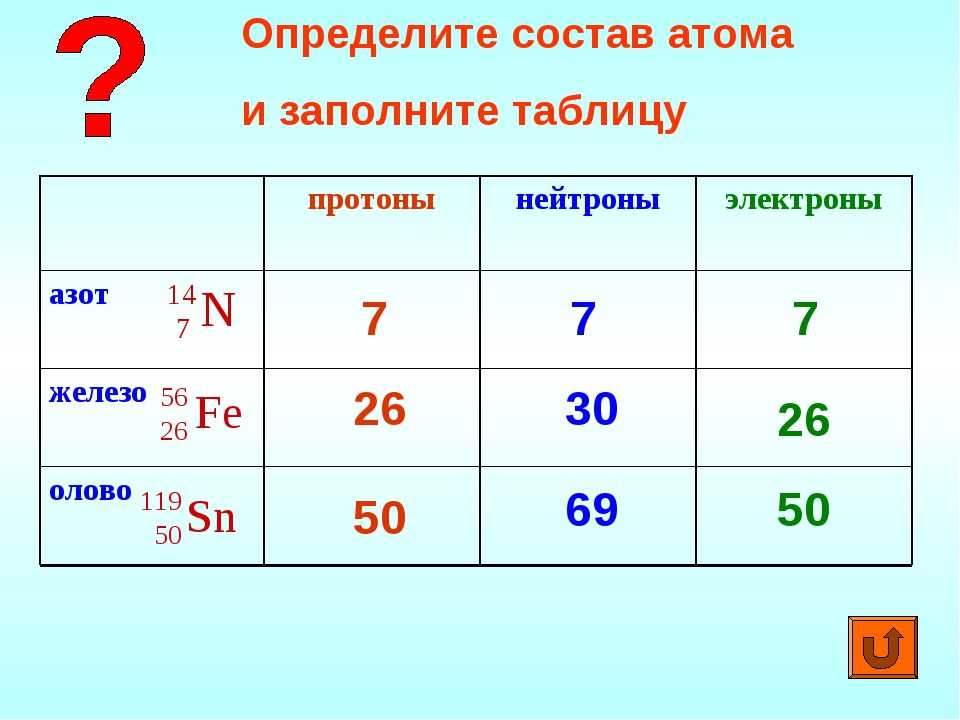 Итак, это наш первый ответ для нашего количества протонов и нашего количества нейтронов, а также наш изотопный символ для нашего первого изотопа здесь. Мы возьмем эту вторую массу при использовании 24 часов и вычтем ее из нашего числа протонов в магнии, которое, как мы подтвердили, равно 12 протонам. И эта разница дает нам значение в 13 нейтронов. Итак, чтобы завершить наш изотопный символ для нашего второго изотопа, у нас все еще был бы магний, у нас все еще был бы атомный номер 12. Однако теперь у нас будет масса, которую мы можем округлить до 24,9.. Так что мы можем округлить это до 25. Таким образом, наше массовое число для нашего второго изотопа теперь равно 25. И это наш второй ответ, который включает наше количество протонов, число нейтронов и наш изотопный символ для второго изотопа. И теперь у нас есть эта третья заданная масса, указанная как 25 м, вычтенная из 12 протонов, что дает нам разницу в 14 нейтронов. Итак, чтобы завершить наш третий символ изотопа, у нас все еще есть магний, у нас все еще есть количество протонов или атомный номер 12.
Итак, это наш первый ответ для нашего количества протонов и нашего количества нейтронов, а также наш изотопный символ для нашего первого изотопа здесь. Мы возьмем эту вторую массу при использовании 24 часов и вычтем ее из нашего числа протонов в магнии, которое, как мы подтвердили, равно 12 протонам. И эта разница дает нам значение в 13 нейтронов. Итак, чтобы завершить наш изотопный символ для нашего второго изотопа, у нас все еще был бы магний, у нас все еще был бы атомный номер 12. Однако теперь у нас будет масса, которую мы можем округлить до 24,9.. Так что мы можем округлить это до 25. Таким образом, наше массовое число для нашего второго изотопа теперь равно 25. И это наш второй ответ, который включает наше количество протонов, число нейтронов и наш изотопный символ для второго изотопа. И теперь у нас есть эта третья заданная масса, указанная как 25 м, вычтенная из 12 протонов, что дает нам разницу в 14 нейтронов. Итак, чтобы завершить наш третий символ изотопа, у нас все еще есть магний, у нас все еще есть количество протонов или атомный номер 12. И наше массовое число мы можем округлить от 25,9.832. Теперь 26 для нашего третьего изотопа. Итак, наш третий окончательный ответ — вот этот символ изотопа, 12 протонов и 14 нейтронов, связанных с этим третьим изотопом. Таким образом, это завершит наши ответы для этого примера. Если у вас есть какие-либо вопросы, пожалуйста, оставьте их ниже, и я увижу всех в следующем практическом видео.
И наше массовое число мы можем округлить от 25,9.832. Теперь 26 для нашего третьего изотопа. Итак, наш третий окончательный ответ — вот этот символ изотопа, 12 протонов и 14 нейтронов, связанных с этим третьим изотопом. Таким образом, это завершит наши ответы для этого примера. Если у вас есть какие-либо вопросы, пожалуйста, оставьте их ниже, и я увижу всех в следующем практическом видео.
Связанные видео
Связанная практика
Атомный номер, атомная масса и массовое число!
by Robin Реакция
158просмотров
Atomic Mass
от учителя PET
63Views
Изотопы и атомная масса
от Pearson
180Views
Атомная масса
от Juls Bruno
3004300views
. Повзаненный Atomic Atamic Atamic Atamic ATAMIC ATAMIC ATAMIC ATAMIC ATAMIC ATAMIC ATAMIC ATAMIC ATAMIC ATAMIC ATAMIC ATAMIC ATAMIC ATAMIC. Свойства материи | Химия | FuseSchool
от FuseSchool — Глобальное образование
112просмотров
Измерение атомной массы | Атомы и молекулы | Не запоминай
by Не запоминай
68просмотров
Что такое атомная масса? | Не запоминайте
By не запоминать
97Views
Атомная масса: введение
от Tyler Dewitt
77Views
Периодические таблицы
от Melissa Collins
107view 9000 3
ATOMIC AOMIC AOMIC AOMIC AOMIC AOMIC.



Leave A Comment