Химическая связь — основные виды, типы и характеристики
Поможем понять и полюбить химию
Начать учиться
184.9K
Какая сила удерживает вместе атомы в молекуле вещества и почему они не разбегаются в разные стороны? Эта сила называется химической связью, школьники узнают о ней в 8 классе. Еще Ньютон предположил, что она имеет электростатическую природу, но подробнее в этом разобрались лишь в начале ХХ века. Сейчас расскажем, что такое химическая связь и какой она бывает.
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Важно!
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Механизм образования химической ковалентной связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.

Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи

На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
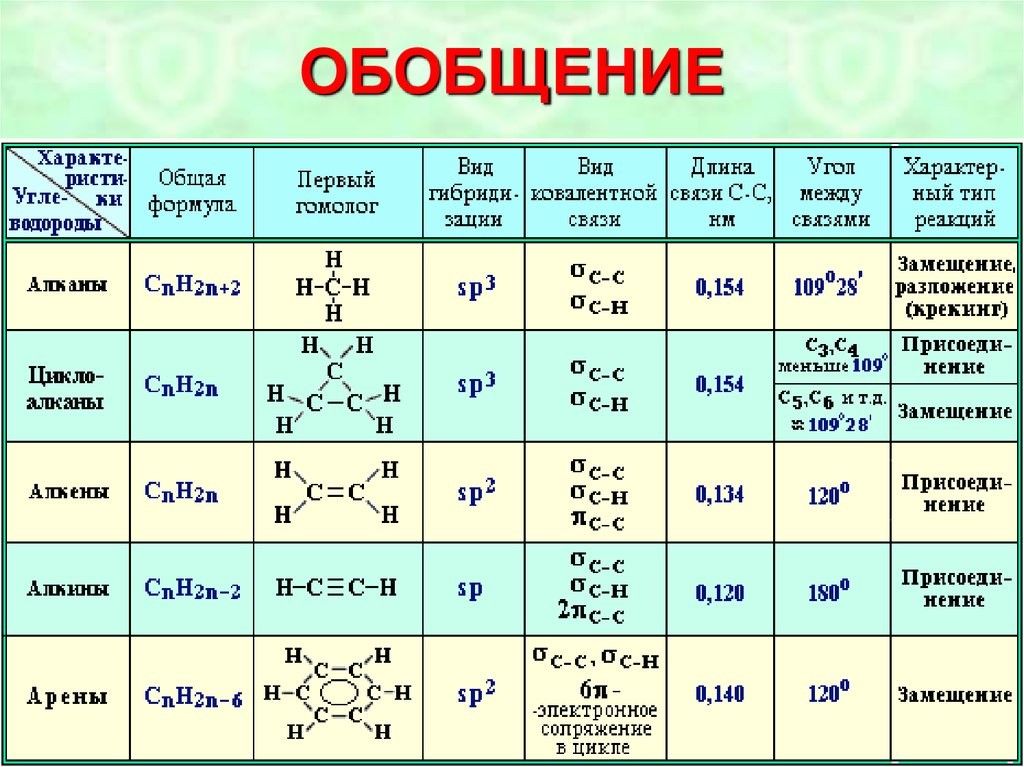
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
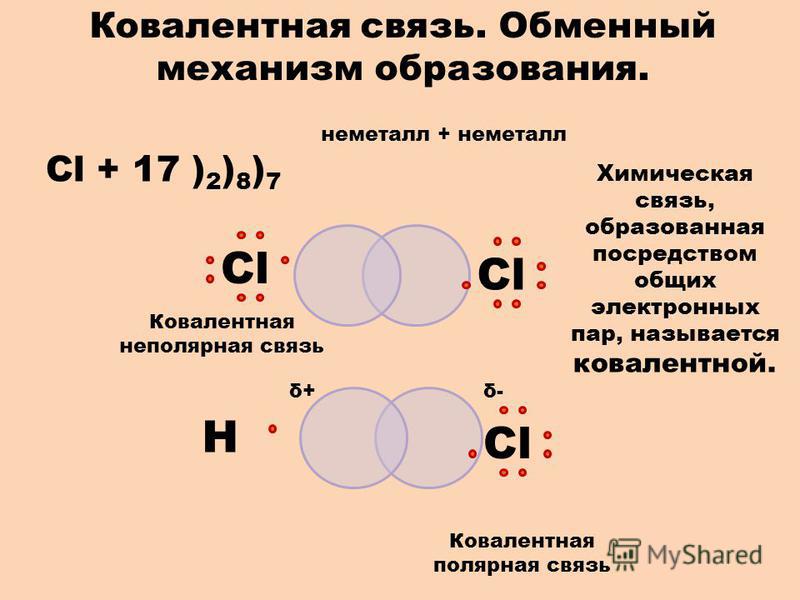
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Важно!
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.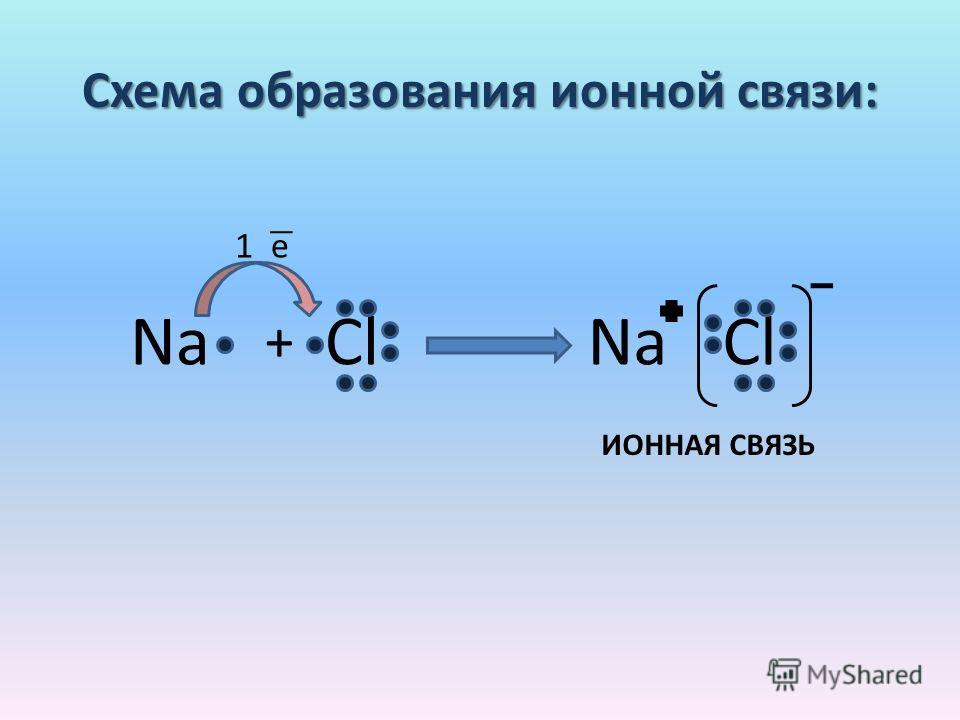
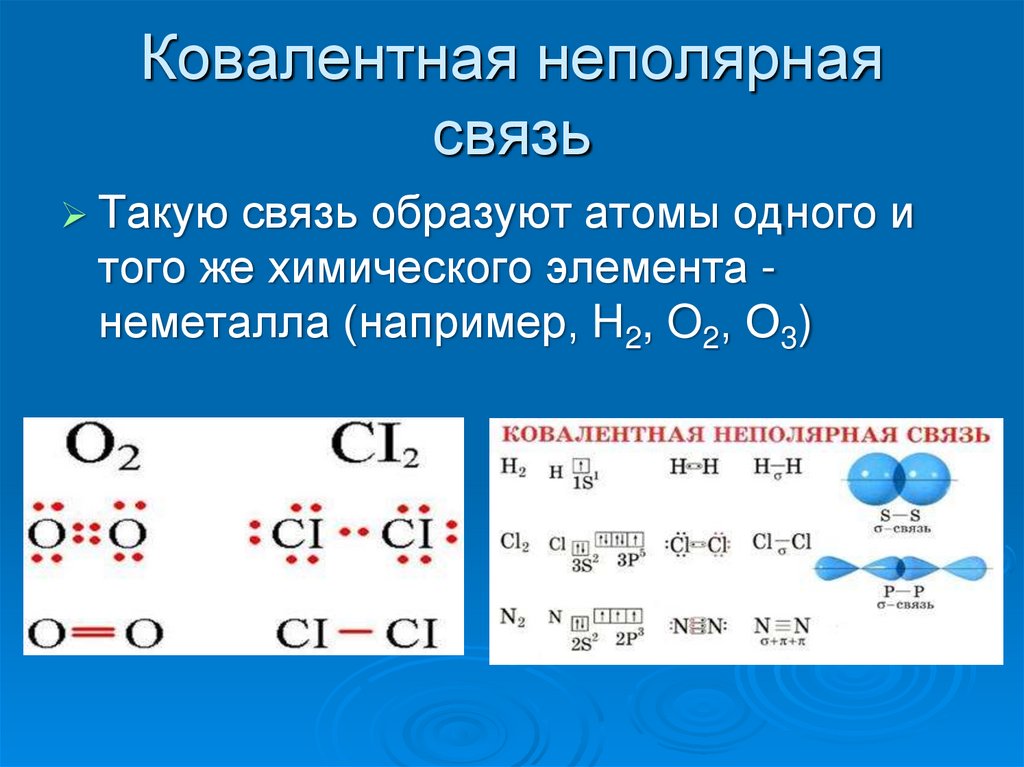
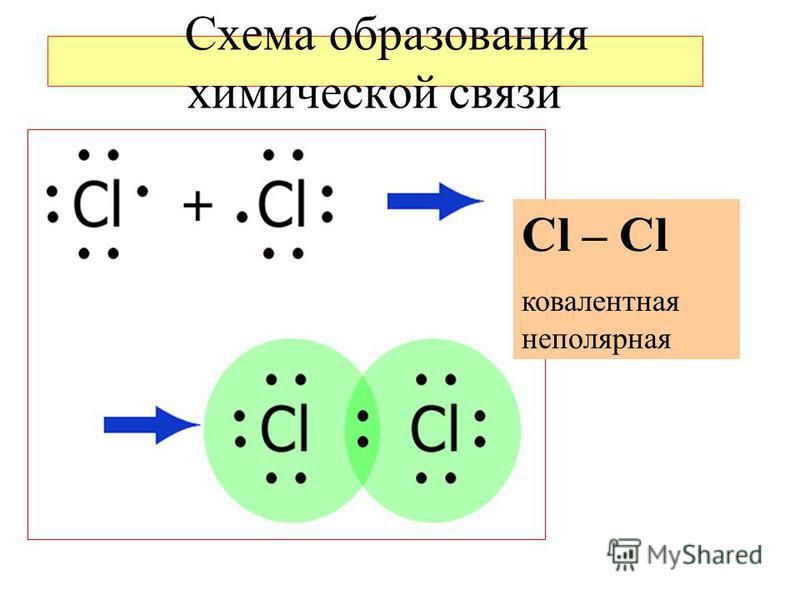
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
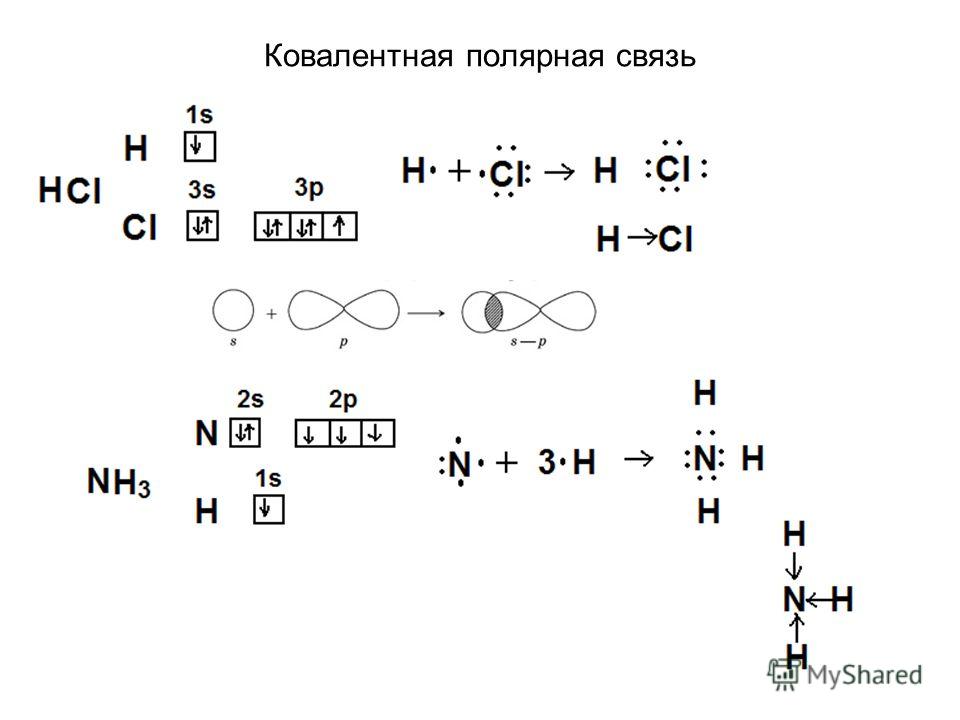
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью. |
Характеристики ковалентной связи:
- насыщена,
- направлена,
- имеет полярность.
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд.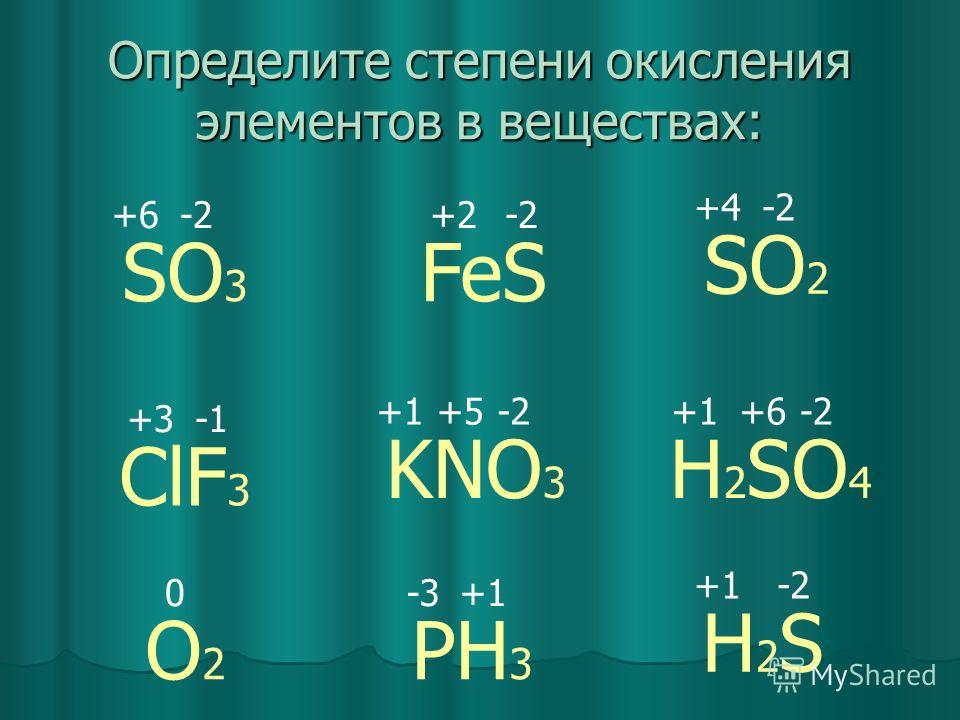
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Важно!
Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.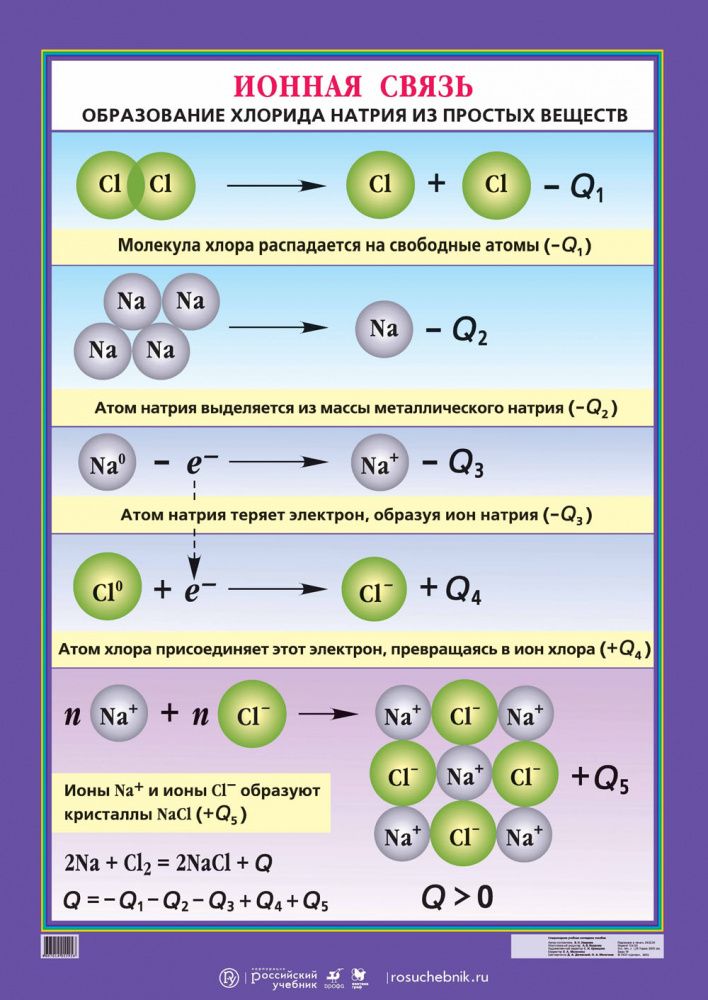
Характеристики ионной связи:
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Ковалентная связь | Ионная связь |
|---|---|
Характеризуется появлением электронных пар, принадлежащих обоим атомам. | Характеризуется появлением и взаимным притяжением ионов. |
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов. | Ионы с противоположными зарядами подвержены кулоновскому притяжению. |
Имеет направленность и насыщенность. | Ненасыщенна и не имеет направленности. |
Количество связей, образуемых атомом, называется валентностью. | Количество ближайших соседей атома называется координационным числом. |
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО. | Образуется между металлами и неметаллами — веществами со значимо разной ЭО. |
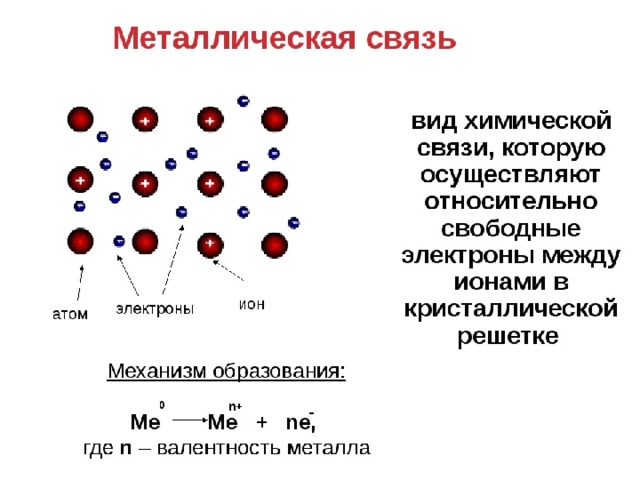
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».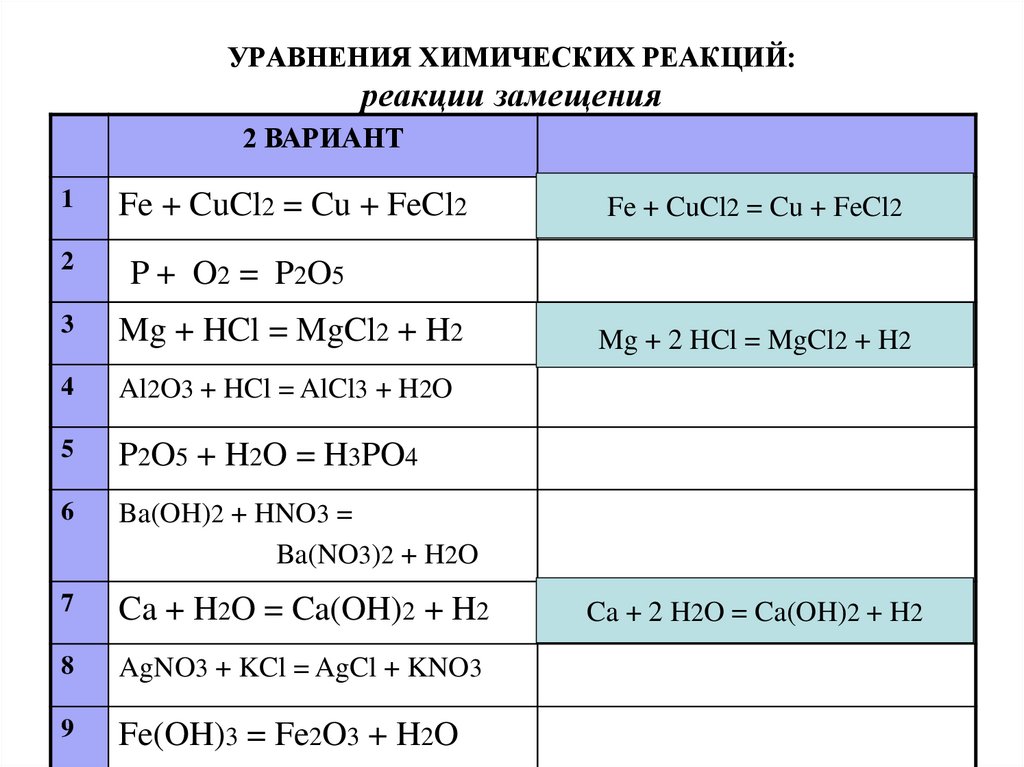
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
ненаправленность,
делокализованный характер,
многоэлектронность.

Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.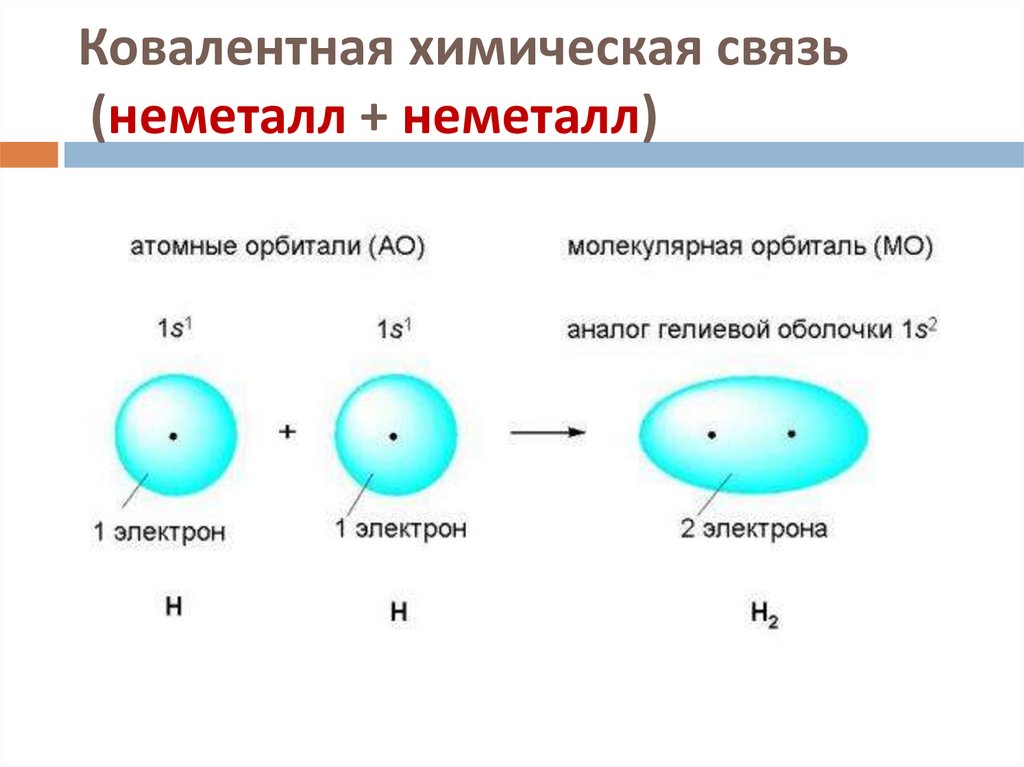
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
Важно!
В отдельных случаях водородная связь может образоваться внутри молекулы. Это характерно для органических веществ: многоатомных спиртов, углеводов, белковых соединений и т.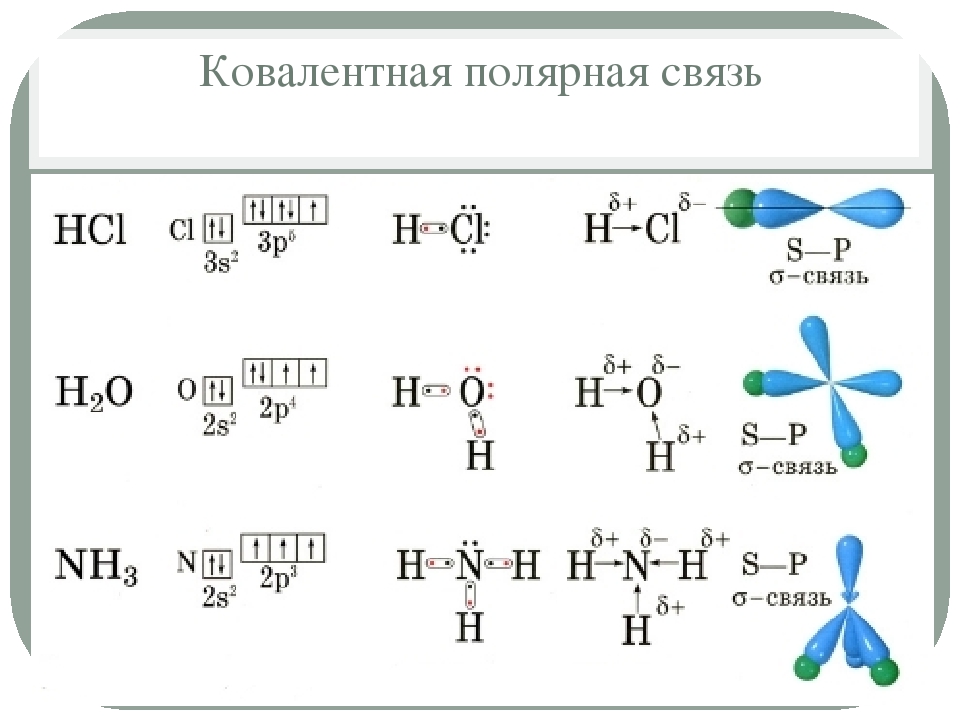 д.
д.
Характеристики водородной связи:
насыщенная,
направленная.
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.

Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.
Состав вещества | Элементы в составе вещества | Химическая связь | Тип кристаллической решетки |
|---|---|---|---|
Простой | Металл | Металлическая | Металлическая |
Неметалл с одинаковой ЭО | Ковалентная неполярная | Молекулярная или атомная | |
Сложный | Металл и неметалл | Ионная | Ионная |
Неметалл с разной ЭО | Ковалентная полярная | Молекулярная или атомная |
Вопросы для самоподготовки
Какие структуры могут появляться в результате химической связи?
Назовите два основных механизма ковалентной связи.

В каком случае ковалентная связь будет полярной, а в каком — неполярной?
От чего зависит энергия химической связи? Назовите минимум 2 фактора.
Что определяет прочность химической связи?
Как определить вид химической связи, если нам известны элементы в составе вещества?
К какому виду кристаллической решетки приводит ковалентная связь между атомами?
Какие элементы взаимодействуют в молекуле вещества в ходе образования металлической связи?
О чем говорит количество связей, которые может образовывать один атом в молекуле вещества?
Назовите характеристики ионной связи.
В каких веществах из перечисленных имеет место ковалентная полярная связь: SrO, PBr3, CsCl, P4, NH4NO3?
Определите, в какую сторону смещается электронная пара в соединениях HCl, HBr, HI, HS, HP.

Яна Кононенко
К предыдущей статье
Гидролиз
К следующей статье
Кристаллическая решетка
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
ГДЗ химия 11 класс Радецкий, дидактический материал, тема 3, раб 1, вариант 2, 3 задание. Определите вид химической связи и степени окисления
ГДЗ химия 11 класс Радецкий, дидактический материал, тема 3, раб 1, вариант 2, 3 задание. Определите вид химической связи и степени окисления – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Определите вид химической связи и степени окисления элементов в следующих соединениях: S8, СН4, Na202, OF2, HN03, Fe2(S04)3.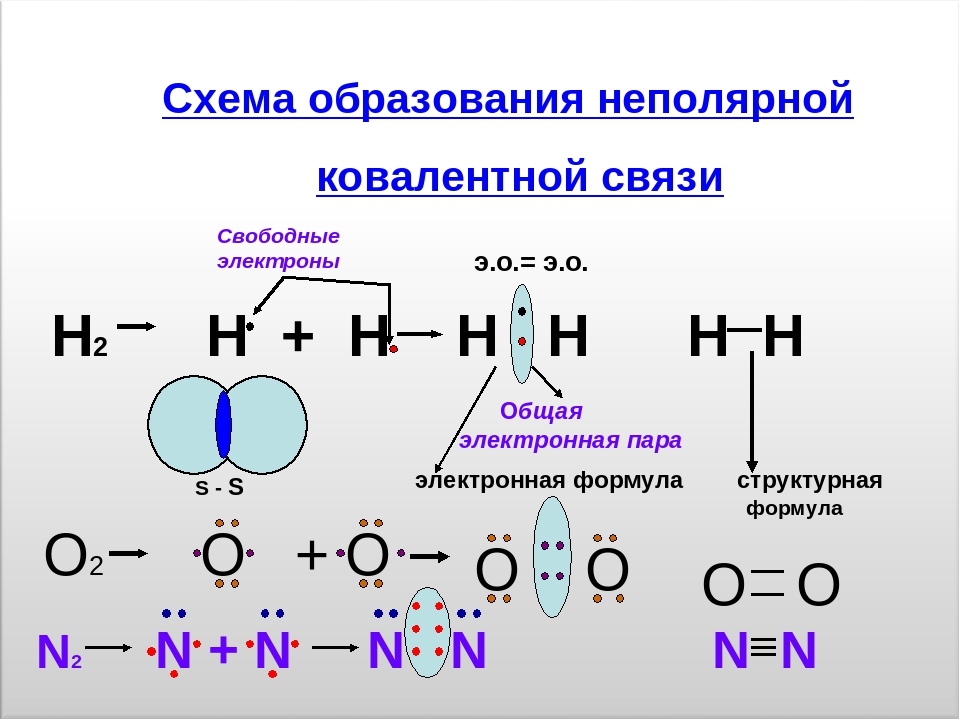
ответы
S08 связь ковалентная неполярная
C-4H4+1 связь ковалентная полярная
Na21O21 связь ионная
O+2F21 связь ковалентная полярная
H-1N+5O32 связь ковалентная полярная
Fe2+3 (S+6O4-2 )3 связь ковалентная полярная между атомами кисло-
рода и серы и ионная между ионами железа и сульфат-ионами.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Юмор
Олимпиады
ЕГЭ
10 класс
похожие вопросы 5
ЕГЭ Математика 11 класс.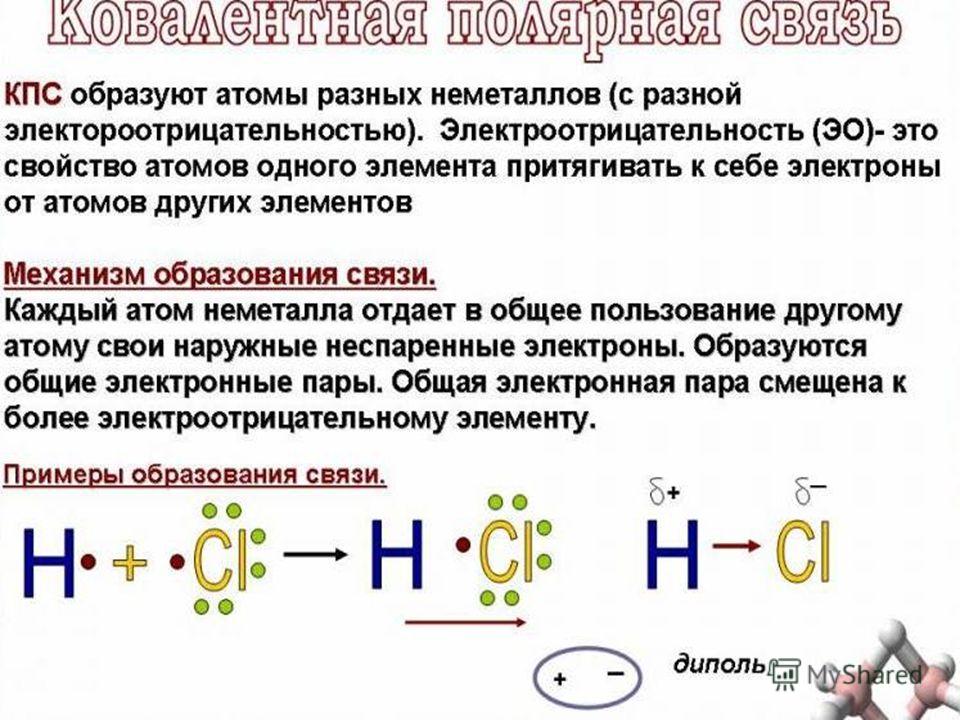 Ященко И. В. Тренировочная работа 39 Вопрос 10 Найдите корень уравнения.
Ященко И. В. Тренировочная работа 39 Вопрос 10 Найдите корень уравнения.
Привет пользователи! Окажите пожалуйста услугу…ответить помогите….
Найдите корень уравнения
(Подробнее…)
ЕГЭМатематикаЯщенко И.В.Семенов А.В.11 класс
Вкаким из вариантов только простые вещества А)вода угл. водарод Б) вода повар. Соль, мет, натрий В) вода, угл, газ, соль. Г) медь,озот фостов
Химия
Приветики! Поможете мне с прогрессией? Раздел II. № 6.21. ГДЗ Алгебра 9 класс ОГЭ Кузнецова.
1) Найдите сумму первых десяти членов арифмети-
ческой прогрессии, если сумма первых трех ее чле-
нов равна нулю, а сумма (Подробнее…)
ГДЗАлгебра9 классКузнецова Л. В.
Задача 4. Работа 3. Расчетные задачи. Химия. Дидактический материал. 10 класс. А.М. Радецкий ГДЗ
Помогите найти решение вот на такую задачу:
Какая масса сажи образуется при термическом разложении этана массой 90 г, если (Подробнее. ..)
..)
ГДЗХимияРадецкий А.М.10 класс
ГДЗ по информатике, 1 класс Горячев, ч. 2, 43 упр. Нужна схема
Нарисуй по картинке схему. (Подробнее…)
ГДЗИнформатика1 классГорячев А.В.
Металлическая связь и структура железа | 14-16 лет | План урока
Узнайте, как связывание в железе связано с его физическими свойствами, и развейте распространенные заблуждения, используя этот план урока с заданиями для 14–16-летних
правда или ложь. Это приводит к дальнейшим размышлениям и дискуссиям о связи в металлах.
Это упражнение проверяет неправильные представления о том, что:
- Структура железа является примером гигантской молекулы.
- Атомы железа удерживаются вместе ионными связями.
- Железо проводит электричество, потому что атомы железа движутся через твердое тело.
- Железо расширяется при нагревании, потому что атомы становятся больше.
- Металлическое железо — это серебро, потому что атомы железа — это серебро.

Цели обучения
Учащиеся смогут:
- Описать связь в железе и использовать это для объяснения физических свойств металла.
Последовательность действий
Введение
- Дайте каждому учащемуся гвоздь или скрепку, чтобы он посмотрел и потрогал их в качестве стимула для концентрации внимания.
- Поделитесь со студентами тем, что они собираются:
- Опишите соединение в железе.
- Объясните свойства металла, используя их представления о связи.
Упражнение: этап 1
Раздайте каждому учащемуся лист вопросов «Связь металлов и структура железа», содержащий 10 утверждений о структуре и свойствах железа. Попросите их работать индивидуально, чтобы:
- Прочитайте вопросы.
- Запишите в таблицу, считают ли они утверждения верными или ложными.
Упражнение: этап 2
Объедините учащихся в группы по три человека, чтобы:
- Рассмотрите каждый вопрос по очереди.

- Поделитесь своими отзывами и идеями.
- Согласовать групповой ответ.
- Запишите каждый ответ.
- Напишите индивидуально, как они изменили свои идеи в результате обсуждения.
Упражнение: этап 3
Выдайте мини-доски и спросите:
- Каждый учащийся должен нарисовать рисунок, изображающий соединение железа.
- Некоторые ученики делятся своими идеями.
Показать в электронном виде с помощью информационного проектора структуру металла и то, что с ним происходит при нагревании или подключении к батарее. Задайте вопросы:
- . Сделайте явную картину металлической связи с точки зрения внешней оболочки электронов, которые могут свободно перемещаться через гигантскую решетку положительных ионов.
- Объясните использование этой модели металлической связи для объяснения физических свойств, включая проводимость электричества, расширение при нагревании и внешний вид.
- Распространите представления о связи (и, следовательно, их физических свойствах) на металлы в целом.

Перед окончанием
Предоставьте учащимся возможность:
- Добавить к тому, что уже есть в вопроснике «Металлическая связь и структура железа».
- Напишите их имя.
Обратная связь
Просмотрите листы и прокомментируйте, как развивались их идеи, и обратите внимание на то, как учащийся может развиваться дальше.
Тактильный стимул помогает учащимся оценить цели занятия.
Работая в группах, учащиеся сравнивают свои идеи с другими, переоценивают свои первоначальные идеи и при необходимости развивают их. Наводящие вопросы имеют основополагающее значение для устранения неверных представлений и их замены правильной моделью. На протяжении всего урока учащимся предлагается проверить свое понимание.
Финальная проверка на этапе обратной связи сопровождается указанием дальнейших шагов, которые должен предпринять студент.
Оборудование
Для демонстрации (по возможности):
- Электронная анимация, показывающая строение металла и что с ним происходит при нагревании металла или при подключении к батарее.

- Проектор данных.
Для каждого учащегося:
- Гвоздь или скрепка.
- Мини-доска.
Ответы и примечания к ответам
- Железо имеет тип связи, называемый металлической связью.
- ИСТИНА. Железо — это металл, и все металлы имеют тип связи, называемый металлической связью, которая отличается от ковалентной или ионной связи. При металлической связи внешние оболочки соседних атомов перекрываются, и электроны внешних оболочек могут свободно перемещаться по решетке. Металл состоит из катионов металла и уравновешивающего числа этих «свободных» электронов.
- Структура железа является примером гигантской молекулы.
- ЛОЖЬ. В железе положительные ионы упакованы вместе в гигантскую решетку, но мы используем слово «молекула», чтобы подразумевать, что структура содержит ковалентные связи, которых нет в железе.
- В структуре железа есть положительные ионы.
- ИСТИНА.
 Поскольку электроны во внешней оболочке могут свободно перемещаться по решетке, они оставляют после себя положительные ионы железа.
Поскольку электроны во внешней оболочке могут свободно перемещаться по решетке, они оставляют после себя положительные ионы железа.
- ИСТИНА.
- Атомы железа удерживаются вместе ионными связями.
- ЛОЖЬ. Связь в железе металлическая. Это отличается от ионной связи, поскольку в ней отсутствуют отрицательные анионы.
- В структуре железа некоторые электроны могут двигаться вокруг твердого тела.
- ИСТИНА. Электроны с внешней оболочки атомов могут свободно перемещаться через решетку положительных ионов.
- Если железо нагреть до очень высокой температуры, оно станет газом.
- ИСТИНА. Если железо нагреть, оно расплавится. Если расплавленное железо нагреть до достаточно высокой температуры, оно закипит.
- Железо может проводить электричество, потому что атомы железа могут скользить по своим соседям и двигаться сквозь твердое тело.
- ЛОЖЬ. Катионы железа обычно зафиксированы в своих позициях в решетке и не могут перемещаться.

- ЛОЖЬ. Катионы железа обычно зафиксированы в своих позициях в решетке и не могут перемещаться.
- Железо проводит электричество, потому что оно содержит «море» электронов.
- ИСТИНА. Электроны из внешних оболочек атомов могут двигаться и проходить через металл, когда он подключен к батарее.
- Железо расширяется при нагревании, потому что атомы железа становятся больше.
- ЛОЖЬ. При нагревании железа положительные катионы вибрируют сильнее и отдаляются друг от друга.
- Железо — серебристо-серый металл, потому что атомы железа серебристо-серые.
- ЛОЖЬ. Цвет железа зависит от расположения катионов и электронов. Отдельный атом не имел бы цвета.
Дополнительная информация
Первоначально этот план урока был частью веб-сайта Assessment for Learning , опубликованного в 2008 году.
Assessment for Learning – это эффективный способ активного вовлечения учащихся в процесс обучения. Каждый план занятия содержит предложения по организации занятий и рабочие листы, которые можно использовать со студентами.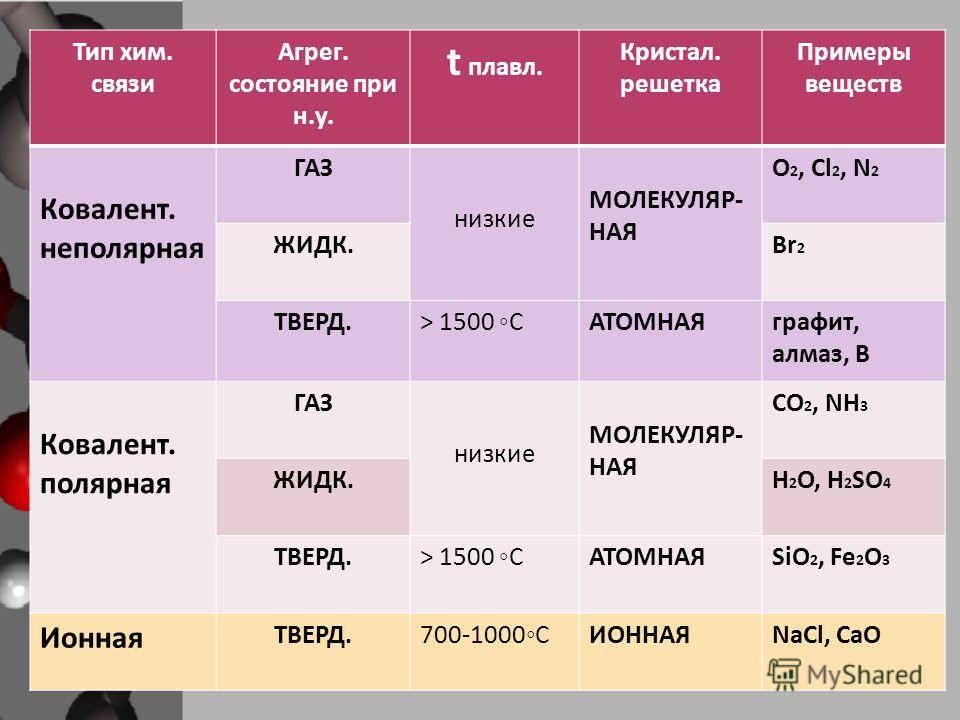
Благодарность
К. Табер, Заблуждения о химических веществах – профилактика, диагностика и лечение, Том 2: Ресурсы для занятий, Железо — металл . Лондон: Королевское химическое общество, 2002.
Является ли Fe ионным или ковалентным?
Следовательно, Fe 2 O 3 представляет собой ионную связь, а не ковалентную.
Запрос на удаление |
Полный ответ на byjus.com
Является ли Fe ионным металлом или ковалентным?
Ответ и объяснение: Вариант d (металлический) является правильным ответом. Железо (Fe) имеет атомный номер 26 и находится в левой части периодической таблицы в группах переходных металлов. Поскольку это переходный металл, он проявляет металлическую связь.
Запрос на удаление |
Полный ответ см. на сайте homework.study.com
Является ли FeO ковалентной связью?
Да, FeO — полярное ковалентное соединение.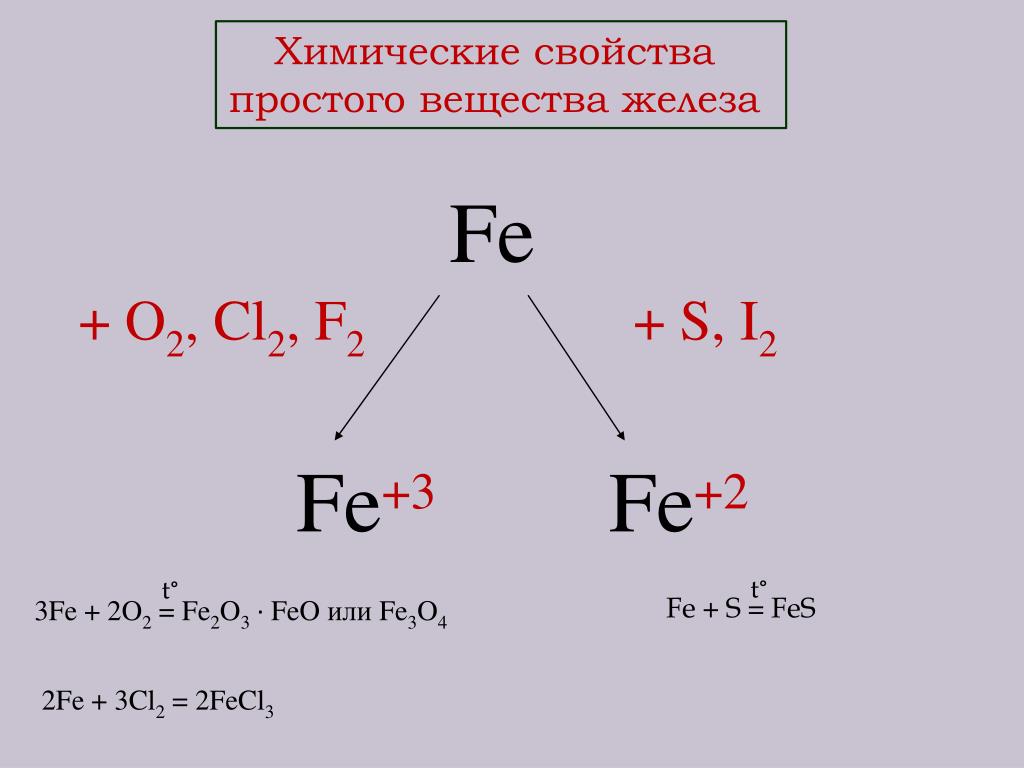 В структуре FeO атом железа имеет электроотрицательность 1,83, а атом кислорода имеет электроотрицательность 3,44.
В структуре FeO атом железа имеет электроотрицательность 1,83, а атом кислорода имеет электроотрицательность 3,44.
|
Посмотреть полный ответ на lambdageeks.com
Является ли FeO ионным?
FeO представляет собой ионное соединение, образующее октаэдрические кристаллы.
Запрос на удаление |
Полный ответ см. на сайте Study.com
Является ли Fe 2 ионным или ковалентным?
Оксид железа (II) представляет собой ионное соединение, также известное как оксид железа или монооксид железа.
Запрос на удаление |
Посмотреть полный ответ на geeksforgeeks.org
Fe2O3, оксид железа (III). Ионные или ковалентные?
Какой тип связи у Fe?
Связь в железе металлическая.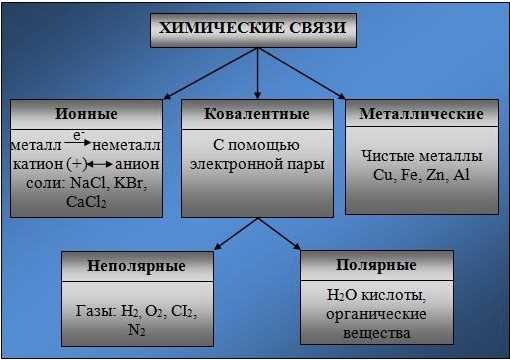
|
Посмотреть полный ответ на edu.rsc.org
Является ли pf3 ионным или ковалентным?
Молекула PF₃ содержит 3 одинарных связи PF. Эти связи образуются путем обмена электронами между атомами P и F. Это говорит о том, что связи PF являются ковалентными.
Запрос на удаление |
Полный ответ на studocu.com
Являются ли Fe и O ионной связью?
Следовательно, Fe 2 O 3 представляет собой ионную связь, а не ковалентную.
Запрос на удаление |
Посмотреть полный ответ на byjus.com
Является ли Fe металлом или неметаллом?
Железо — это химический элемент с символом Fe и атомным номером 26. Железо, классифицируемое как переходный металл, находится в твердом состоянии при комнатной температуре.
Запрос на удаление |
См.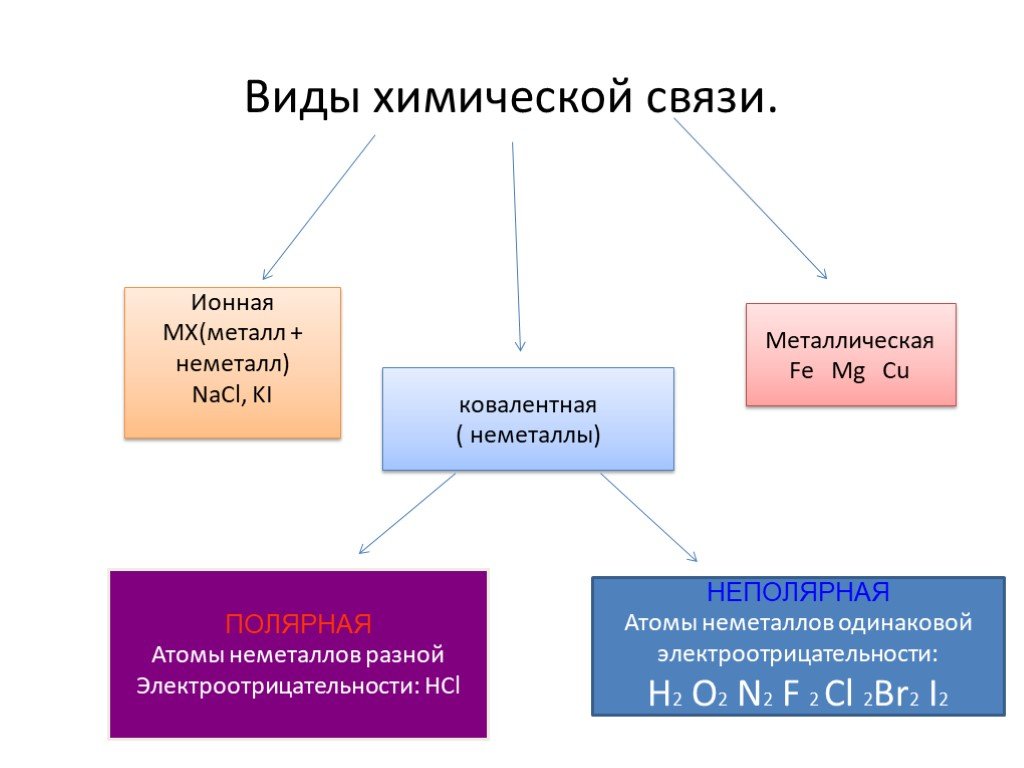 полный ответ на pubchem.ncbi.nlm.nih.gov
полный ответ на pubchem.ncbi.nlm.nih.gov
Является ли Fe ковалентным твердым телом?
Fe и Cu — просто элементы, а не ковалентные твердые тела.
Запрос на удаление |
Посмотреть полный ответ на Meritnation.com
Имеет ли Fes ковалентную связь?
Связи Fe-S демонстрируют все достоинства полярных ковалентных связей, лишь с незначительным накоплением заряда, но со значительной отрицательной плотностью энергии в критических точках связи.
Запрос на удаление |
Посмотреть полный ответ на pubs.rsc.org
Как узнать, ионная она или ковалентная?
Как правило, соединения, которые включают металлическую связь с неметаллом или полуметаллом, будут демонстрировать ионную связь. Соединения, состоящие только из неметаллов или полуметаллов с неметаллами, будут иметь ковалентную связь и будут классифицироваться как молекулярные соединения.
|
См. полный ответ на chem.libretexts.org
Является ли Fe металлическим?
железо (Fe), химический элемент, металл группы 8 (VIIIb) таблицы Менделеева, самый используемый и дешевый металл.
Запрос на удаление |
См. полный ответ на britannica.com
Fe и Cl являются ионными или ковалентными?
Хлорид железа (III) — ионное соединение, его формульная единица — FeCl3. Это указывает на то, что FeCl3 является наименьшим повторяющимся звеном в повторяющейся структуре кристаллической решетки соединения. В общем, ионные соединения классифицируются как соединения, состоящие как из металла, так и из неметалла.
Запрос на удаление |
Посмотреть полный ответ на socratic.org
Сколько ковалентных связей может образовывать Fe?
Сколько связей может образовывать железо? Железо может образовывать шесть связей, как гемоглобин. Ионные соединения, с другой стороны, не имеют общих электронов; вместо этого они притягивают окружающие их отрицательные ионы/атомы.
Ионные соединения, с другой стороны, не имеют общих электронов; вместо этого они притягивают окружающие их отрицательные ионы/атомы.
|
Посмотреть полный ответ на byjus.com
Как железо образует ионные связи?
Два Fe 0 9Каждый из 0319 атомов отдает по 3 электрона, которые подхватываются тремя атомами O 0 . Таким образом, атомы железа становятся Fe 3 + , а атомы кислорода становятся O 2 — . Затем ионы могут образовывать ионную связь с образованием (Fe 2 O 3 ). В качестве альтернативы железо иногда окисляется до Fe 2 + и соединяется с кислородом с образованием минерала вюстита (FeO).
Запрос на удаление |
Посмотреть полный ответ на geo.libretexts.org
Какой тип соединения представляет собой PF3?
Трифторид фосфора | Фосфор(III) фторид | ПФ3 — Эрезтех.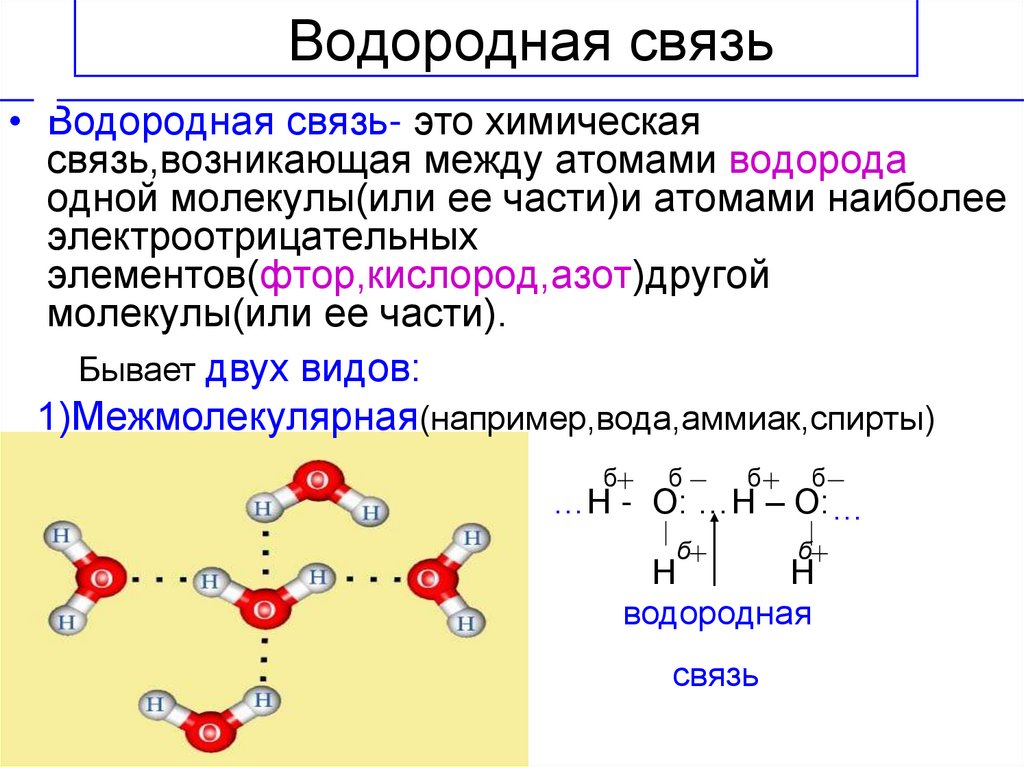
|
Посмотреть полный ответ на ereztech.com
Что такое ковалентная связь Ph4?
Связь, образованная между Ph4 и H+, является дативной ковалентной связью, в которой электроны связи исходят от фосфина.
Запрос на удаление |
Посмотреть полный ответ на toppr.com
Какой тип PF3?
Трифторид фосфора (формула PF 3 ) представляет собой бесцветный газ без запаха.
Запрос на удаление |
Посмотреть полный ответ на en.wikipedia.org
Является ли feh ковалентной связью?
В гидриде железа(I) атомы образуют сеть, причем отдельные атомы связаны между собой ковалентными связями.
Запрос на удаление |
Посмотреть полный ответ на en.wikipedia.org
Каковы свойства Fe?
Железо — блестящий, пластичный, ковкий металл серебристо-серого цвета (VIII группа периодической таблицы).







 Поскольку электроны во внешней оболочке могут свободно перемещаться по решетке, они оставляют после себя положительные ионы железа.
Поскольку электроны во внешней оболочке могут свободно перемещаться по решетке, они оставляют после себя положительные ионы железа.
Leave A Comment