Определение молекулярных формул | Задачи 106
Задача 106.
При сгорании 4,3г углеводорода образовалось 13,2г СО2. Плотность пара углеводорода по водороду равна 43. Вывести молекулярную формулу вещества.
Решение:
Находим массу углерода, содержащуюся в образце углеводорода из пропорции:
Теперь определим массу водорода, содержащуюся в образце углеводорода:
4,3 — 3,6 = 0,7г.
Обозначим числа атомов углерода и водорода в простейшей формуле углеводорода соответственно через атомные массы углерода и водорода равны соответственно 12 и 1. Поэтому массы углерода и водорода в составе углеводорода будут относиться как 12x : 1у. По условию задачи отношение масс углерода и водорода в образце углеводорода составляет: Следовательно, значения х и у можно найти из пропорции:
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
а затем умножим оба члена последнего отношения на 3, получим:
x : y = (1 . 3) : (2,33 . 3) = 3 : 7
3) : (2,33 . 3) = 3 : 7
Простейшая формула соединения будет иметь вид: С3Н7, которой отвечает молекулярная масса, равная 43. истинную молекулярную массу углеводорода находим исходя из его плотности по водороду:
M(СxНy) = D .M(H2) = 43 . 2 =86г/моль.
Находим коэффициент (n), показывающий во сколько раз истинная молекулярная масса вещества больше вычисленной:
Теперь найденные значения x и y умножаем на 2, получаем: n(СxНy) = C6H14.
Истинная формула вещества будет иметь вид: C6H14.
Ответ: C6H14.
Задача 107.
При полном сгорании навески органического бромсодержащего вещества массой 1,88г получено 0,88г СО2 и 0,3г Н2O. После превращения всего брома, содержавшегося в навеске, в бромид серебра, получено 3,76г AgВr. Плотность паров вещества по водороду равна 94. Определить молекулярную формулу исследуемого вещества.
Молекулярные массы углекислого газа, воды и бромида серебра соответственно равны 44, 18 и 187,8. Массы углерода, водорода брома, входящих в состав бромосодержащего органического вещества находим по массам образовавшихся углекислого газа, воды и бромида серебра. При этом учтём, что в одном моле СО2 содержится 12 г углерода, в одном моле Н2О – 2 г водорода, а в одном моле AgBr – 79,9 г брома. Находим массы углерода, водорода и брома, содержащихся СО
Таким образом, в сгоревшем образце бромосодержащего углеводорода содержится 0,24г углерода, 0,033г водорода и 1,6г брома. Так как сумма масс этих элементов равна массе навески сгоревшего вещества (1,88г), то кислорода в нём не содержится.
Так как сумма масс этих элементов равна массе навески сгоревшего вещества (1,88г), то кислорода в нём не содержится.
Обозначим числа атомов углерода, водорода и брома в простейшей формуле бромосодержащего углеводорода соответственно через Атомные массы углерода, водорода и брома равны соответственно 12, 1 и 79,9. Следовательно, значения можно найти из пропорции:
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них:
Простейшая формула соединения будет иметь вид: СН2Br, которой отвечает молекулярная масса, равная 93. Истинную молекулярную массу вещества находим исходя из его плотности по водороду:
M(СxНyBrz) = D . M(H2) = 94 . 2 =188г/моль.
Находим коэффициент (n), показывающий во сколько раз истинная молекулярная масса вещества больше вычисленной:
Теперь найденные значения x, y и z умножаем на 2, получаем: n(СxНyBrz) = С2Н
Истинная формула вещества будет иметь вид: С2Н4Br2.
Ответ: С2Н4Br2.
Задача 108.
При взрыве смеси, полученной из одного объема некоторого газа и двух объемов кислорода, образуются два объема СО2 и один объем N2. Найти молекулярную формулу газа.
Решение:
Обозначим один объём газа через и запишем схему уравнения реакции с учётом данных задачи, получим:
Из схемы вытекает, что газ, подвергшийся взрыву, состоит из двух атомов углерода (две молекулы СО
С2N2 + 2O2 = 2CO2 + N2 .
Ответ: С2N2.
Задача 109.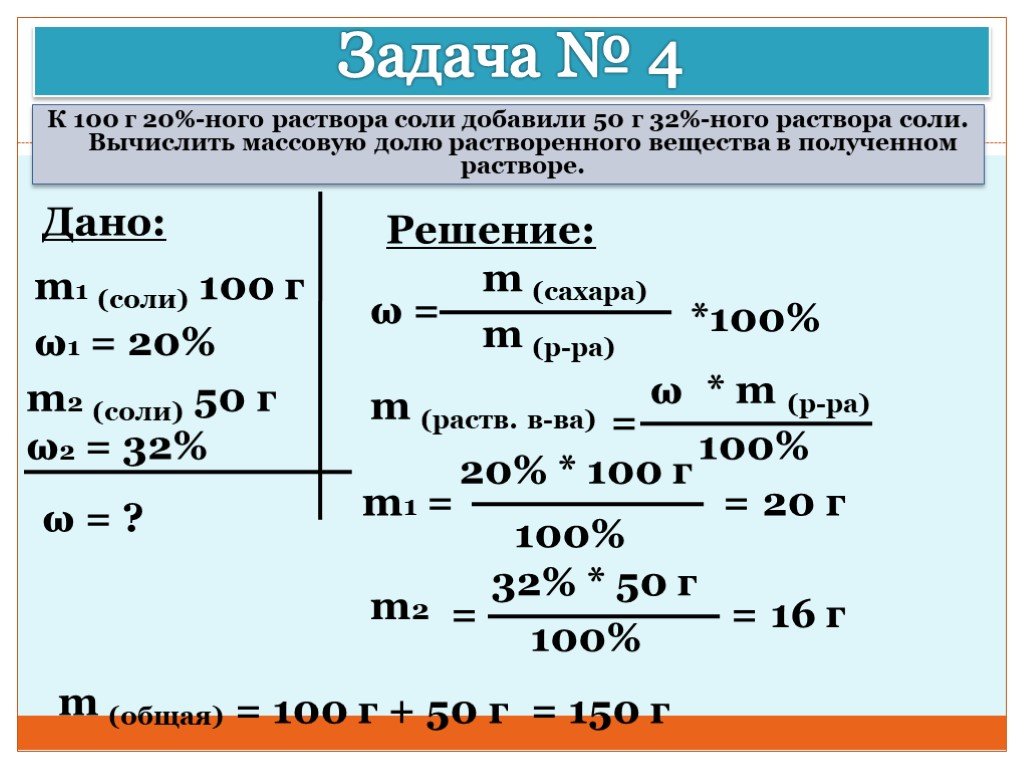
Найти молекулярную формулу соединения бора с водородом, если масса 1ч чл этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2% (масс.).
Решение:
Известно, что один моль любого газа при нормальных условиях занимает объём 22,4 л. Молекулярная масса азота равна 28.
Так как массы соединения бора с водородом и азота равны, то можно вычислить массу 1 л этого соединения из пропорции:
Здесь x — соединение водорода с бором.
Содержание водорода в веществе равно 21,8% (100 – 78,2 = 21,8).
Обозначим числа атомов бора и водорода в простейшей формуле исследуемого вещества соответственно через x и y. Атомные массы бора и водорода соответственно равны 10,8 и 1. Поэтому массы бора и водорода в веществе относятся как 10,8x : 1. По условию задачи отношение масс бора и водорода в исследуемом веществе равно 78,2 : 21,8. Следовательно, значения
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
Простейшая формула соединения будет иметь вид: BH3. В обычных условиях существует гидрид бора состава B2H6.
В обычных условиях существует гидрид бора состава B2H6.
Ответ: B2H6.
Задача 110.
Вычислить массу азота, содержащегося в 1 кг: а) калийной селитры KNO3; б) аммиачной селитры NH
Решение:
а) M(KNO3) = 101,09 г/моль. Массу азота, входящую в состав 1 кг калийной селитры находим из пропорции:
б) М(NH4NO3) = 80 г/моль. В молекуле аммиачной селитры содержится два атома азота. Массу азота, входящую в состав 1 кг аммиачной селитры находим из пропорции:
в) М[(NH4)2HPO4] = 132 г/моль. В молекуле аммофоса содержится два атома азота. Массу азота, входящую в состав 1 кг аммофоса находим из пропорции:
Ответ: а) 138,49 г; б) 350 г; в) 212,12 г.
Глинка Н.
 Л. Задачи и упражнения по общей химии. Задачи 99-120
Л. Задачи и упражнения по общей химии. Задачи 99-120Глинка Н. Л. Задачи и упражнения по общей химии. Учебное пособие для вузов / Под ред. В. А. Рабиновича и Х. М. Рубиной. – 23-е изд., исправленное – Л.: Химия, 1985. – 264 с., ил.
Задачи 99-120
99. Найти простейшую формулу вещества, содержащего (по массе) 43,4% натрия, 11,3% углерода и 45,3% кислорода. Решение
100. Найти простейшую формулу вещества, в состав которого входят водород, углерод, кислород и азот в соотношении масс 1:3:4:7. Решение
101. Найти простейшую формулу оксида ванадия, зная, что 2,73 г оксида содержат 1,53 г металла. Решение
102. Вещество содержит (по массе) 26,53% калия, 35,37% хрома и 38,10% кислорода. Найти его простейшую формулу. Решение
103. Найти формулу кристаллогидрата хлорида бария, зная, что 36,6 г соли при прокаливании теряют в массе 5,4 г. Решение с ключом
104. Найти молекулярную формулу масляной кислоты, содержащей (по массе) 54,5% углерода, 36,4% кислорода и 9,1% водорода, зная, что плотность ее паров по водороду равна 44. Решение
Решение
105. Найти молекулярную формулу вещества, содержащего (по массе) 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41. Решение
106. При сгорании 4,3 г углеводорода образовалось 13,2 г CO2. Плотность пара углеводорода по водороду равна 43. Вывести молекулярную формулу вещества. Решение с ключом
107. При полном сгорании навески органического бромсодержащего вещества массой 1,88 г получено 0,88 г CO2 и 0,3 г H2O. После превращения всего брома, содержащегося в навеске, в бромид серебра, получено 3,76 г AgBr. Плотность паров вещества по водороду равна 94. Определить молекулярную формулу исследуемого вещества. Решение с ключом
108. При взрыве смеси, полученной из одного объема некоторого газа и двух объемов кислорода, образуются два объема CO2 и один объем N2. Найти молекулярную формулу газа. Решение с ключом
109. Найти молекулярную формулу соединения бора с водородом, если масса 1 л этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2% (масс. ). Решение с ключом
). Решение с ключом
110. Вычислить массу азота, содержащегося в 1 кг: а) калийной селитры KNO3; б) аммиачной селитры NH4NO3; в) аммофоса (NH4)2HPO4. Решение
111. Вычислить процентное (по массе) содержание каждого из элементов в соединениях: а) Mg(OH)2; б) Fe(NO3)3; в) H2SO4; г) (NH4)2SO4. Решение
112. Какую массу железа можно получить из 2 г железной руды, содержащей 94% (масс.) Fe2O3? Решение
113. К раствору, содержащему 10 г H2SO4, прибавили 9 г NaOH. Какую реакцию имеет полученный раствор? Решение
114. Раствор, содержащий 34,0 г AgNO3, смешивают с раствором, содержащим такую же массу NaCl. Весь ли нитрат серебра вступит в реакцию? Сколько граммов AgCl получилось в результате реакции? Решение с ключом
115. При сжигании 3,00 г антрацита получилось 5,30 л CO2, измеренного при нормальных условиях. Сколько процентов углерода (по массе) содержит антрацит? Решение
Сколько процентов углерода (по массе) содержит антрацит? Решение
116. К раствору, содержащему 0,20 моля FeCl3, прибавили 0,24 моля NaOH. Сколько молей Fe(OH)3 образовалось в результате реакции и сколько молей FeCl3 осталось в растворе? Решение с ключом
117. Сколько литров гремучего газа (условия нормальные) получается при разложении 1 моля воды электрическим током? Решение с ключом
118. Какой объем ацетилена (условия нормальные) можно получить взаимодействием воды с 0,80 кг CaC2? Решение
119. Сколько граммов NaCl можно получить из 265 г Na2CO3? Решение
120. При пропускании над катализатором смеси, состоящей из 10 молей SO2 и 15 молей O2, образовалось 8 молей SO3. Сколько молей SO2 и O2 не вступило в реакцию? Решение с ключом
27.7: Реакции алканов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 24396
Алканы (самые основные из всех органических соединений) вступают в очень мало реакций. Двумя более важными реакциями являются горение и галогенирование (т. е. замещение одного атома водорода в алкане одним галогеном) с образованием галогеналкана. Реакция галогена очень важна в органической химии, потому что она открывает ворота для дальнейших химических реакций.
Двумя более важными реакциями являются горение и галогенирование (т. е. замещение одного атома водорода в алкане одним галогеном) с образованием галогеналкана. Реакция галогена очень важна в органической химии, потому что она открывает ворота для дальнейших химических реакций.
Сжигание
Полное сгорание (при достаточном количестве кислорода) любого углеводорода приводит к образованию двуокиси углерода и воды. Очень важно, чтобы вы могли написать правильно сбалансированные уравнения для этих реакций, потому что они часто возникают как часть термохимических расчетов. Некоторые легче, чем другие. Например, алканы с четным числом атомов углерода немного тверже, чем с нечетным!
Пример \(\PageIndex{1}\): сжигание пропана
Например, с пропаном (C 3 H 8 ) вы можете сбалансировать углерод и водород, записывая уравнение. Ваш первый черновой вариант будет таким:
\[ C_3H_8 + O_2 \rightarrow 3CO_2 + 4H_2O\]
Подсчет кислорода приводит непосредственно к окончательной версии:
\[ C_3H_8 + 5O_2 \rightarrow 3CO_2 + 4H_2O\] Пример \
(\PageIndex{2}\): Горение бутана
С бутаном (C 4 H 10 ) вы можете снова сбалансировать углерод и водород, записывая уравнение.
\[ C_4H_{10} + O_2 \rightarrow 4CO_2 + 5H_2O\]
Подсчет кислорода приводит к небольшой проблеме — с 13 справа. Простой трюк состоит в том, чтобы позволить себе иметь «шесть с половиной» молекул O 2 слева.
\[ C_4H_{10} + 6\dfrac{1}{2}\, O_2 \rightarrow 4CO_2 + 5H_2O\]
Если вас это оскорбляет, удвойте все:
\[ 2C_4H_{10} + 13 O_2 \ rightarrow 8CO_2 + 10 H_2O\]
Углеводороды труднее воспламеняются по мере того, как молекулы становятся больше. Это связано с тем, что более крупные молекулы не так легко испаряются — реакция идет намного лучше, если кислород и углеводород хорошо перемешаны в виде газов. Если жидкость не очень летучая, только те молекулы, которые находятся на поверхности, могут реагировать с кислородом. Молекулы большего размера имеют большее притяжение Ван-дер-Ваальса, что затрудняет их отрыв от своих соседей и превращение в газ.
При полном сгорании все углеводороды будут гореть синим пламенем. Однако сгорание имеет тенденцию быть менее полным по мере увеличения числа атомов углерода в молекулах. Это означает, что чем крупнее углеводород, тем больше вероятность того, что вы получите желтое дымное пламя. Неполное сгорание (при недостатке кислорода) может привести к образованию углерода или монооксида углерода. Проще говоря, водород в углеводороде получает первый шанс на кислород, а углерод получает все, что осталось! Присутствие в пламени тлеющих частиц углерода делает его желтым, а в дыму часто виден черный углерод. Угарный газ образуется в виде бесцветного ядовитого газа.
Это означает, что чем крупнее углеводород, тем больше вероятность того, что вы получите желтое дымное пламя. Неполное сгорание (при недостатке кислорода) может привести к образованию углерода или монооксида углерода. Проще говоря, водород в углеводороде получает первый шанс на кислород, а углерод получает все, что осталось! Присутствие в пламени тлеющих частиц углерода делает его желтым, а в дыму часто виден черный углерод. Угарный газ образуется в виде бесцветного ядовитого газа.
Примечание: почему окись углерода ядовита
Кислород переносится кровью гемоглобином, который, к сожалению, связывается точно с тем же участком гемоглобина, что и кислород. Разница в том, что монооксид углерода связывается необратимо (или очень сильно), что делает эту конкретную молекулу гемоглобина бесполезной для переноса кислорода. Если вы вдохнете достаточное количество угарного газа, вы умрете от своего рода внутреннего удушья.
Галогенирование алканов
Галогенирование представляет собой замену одного или нескольких атомов водорода в органическом соединении галогеном (фтором, хлором, бромом или йодом). В отличие от сложных превращений горения, галогенирование алкана, по-видимому, представляет собой простой процесс.0074 реакция замещения , в которой связь С-Н разрывается и образуется новая связь С-Х. Хлорирование метана, показанное ниже, представляет собой простой пример этой реакции.
В отличие от сложных превращений горения, галогенирование алкана, по-видимому, представляет собой простой процесс.0074 реакция замещения , в которой связь С-Н разрывается и образуется новая связь С-Х. Хлорирование метана, показанное ниже, представляет собой простой пример этой реакции.
CH 4 + Cl 2 + энергия → CH 3 Cl + HCl
Поскольку разрываются только две ковалентные связи (C-H и Cl-Cl) и образуются две ковалентные связи (C-Cl и H- Cl), эта реакция кажется идеальным случаем для механистических исследований и предположений. Однако одна сложность заключается в том, что все атомы водорода алкана могут подвергаться замещению, что приводит к смеси продуктов, как показано в следующем 9.0086 несбалансированное уравнение . Относительные количества различных продуктов зависят от пропорции двух используемых реагентов. В случае метана большой избыток углеводорода способствует образованию в качестве основного продукта хлористого метила; тогда как избыток хлора способствует образованию хлороформа и четыреххлористого углерода.
CH 4 + Cl 2 + энергия → CH 3 Cl + CH 2 Cl 2 + CHCl 3 + CCl 4 + HCl
В присутствии пламени реакции подобны реакции с фтором – образуется смесь углерода и галогеноводорода. Интенсивность реакции значительно падает по мере перехода от фтора к хлору и к брому. Интересные реакции происходят в присутствии ультрафиолетового света (подойдет солнечный свет). Это фотохимические реакции, которые происходят при комнатной температуре. Рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.
Происходят реакции замещения, в которых атомы водорода в метане по одному замещаются атомами хлора. В итоге вы получите смесь хлорметана, дихлорметана, трихлорметана и тетрахлорметана.
Первоначальная смесь бесцветного и зеленого газа будет производить пары хлористого водорода и туман органических жидкостей. Все органические продукты жидкие при комнатной температуре, за исключением хлорметана, который представляет собой газ.
Если вы использовали бром, вы могли либо смешать метан с парами брома, либо барботировать метан через жидкий бром — в любом случае, подвергая воздействию ультрафиолетового света. Первоначальная смесь газов, конечно, была бы красно-коричневой, а не зеленой. Никто не решился бы использовать эти реакции в качестве средства получения этих органических соединений в лаборатории, потому что смесь продуктов было бы слишком утомительно разделять. Механизмы реакций объясняются на отдельных страницах.
Крупные алканы и хлор
Вы снова получили бы смесь продуктов замещения, но стоит просто кратко взглянуть на то, что происходит, если замещается только один из атомов водорода (монозамещение) — просто чтобы показать, что все не всегда так просто, как кажется! Например, с пропаном вы можете получить один из двух изомеров:
Если бы единственным фактором был случай, вы бы ожидали получить в три раза больше изомера с хлором на конце. Есть 6 атомов водорода, которые могут быть заменены на концевых атомах углерода, по сравнению только с двумя в середине. На самом деле вы получаете примерно одинаковое количество каждого из двух изомеров. Если вы используете бром вместо хлора, большая часть продукта образуется там, где бром присоединен к центральному атому углерода.
На самом деле вы получаете примерно одинаковое количество каждого из двух изомеров. Если вы используете бром вместо хлора, большая часть продукта образуется там, где бром присоединен к центральному атому углерода.
Циклоалканы
Реакции циклоалканов, как правило, такие же, как и у алканов, за исключением очень малых, особенно циклопропана. В присутствии УФ-излучения циклопропан будет вступать в реакцию замещения с хлором или бромом точно так же, как нециклический алкан. Однако он также имеет способность реагировать в темноте. В отсутствие УФ-света циклопропан может вступать в реакции присоединения, в которых цикл разрывается. Например, с бромом циклопропан дает 1,3-дибромпропан.
Это все еще может происходить в присутствии света, но вы также получите реакции замещения. Кольцо сломано, потому что циклопропан сильно страдает от деформации кольца. Валентные углы в кольце составляют 60°, а не нормальное значение около 109,5°, когда углерод образует четыре одинарные связи. Перекрытие между атомными орбиталями при образовании углерод-углеродных связей хуже, чем обычно, и между связывающими парами существует значительное отталкивание. Система становится более стабильной, если кольцо разорвано.
Перекрытие между атомными орбиталями при образовании углерод-углеродных связей хуже, чем обычно, и между связывающими парами существует значительное отталкивание. Система становится более стабильной, если кольцо разорвано.
Авторы и ссылки
Джим Кларк (Chemguide.co.uk)
Уильям Ройш, почетный профессор (штат Мичиган, Университет штата Мичиган), виртуальный учебник органической химии
27.7: Reactions of Alkanes распространяется под лицензией CC BY-NC-SA 4.0, автор, ремикс и/или куратор LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- сжигание
3.2 Определение эмпирических и молекулярных формул – Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Вычислять процентный состав соединения
- Определите эмпирическую формулу соединения
- Определите молекулярную формулу соединения
В предыдущем разделе обсуждалась взаимосвязь между объемной массой вещества и числом содержащихся в нем атомов или молекул (молей). Зная химическую формулу вещества, можно определить количество вещества (молей) по его массе и наоборот. Но что, если химическая формула вещества неизвестна? В этом разделе те же самые принципы будут применяться для получения химических формул неизвестных веществ из экспериментальных измерений массы.
Процентный состав
Элементарный состав соединения определяет его химическую принадлежность, и химические формулы являются наиболее кратким способом представления этого элементного состава. Когда формула соединения неизвестна, измерение массы каждого из составляющих его элементов часто является первым шагом в процессе экспериментального определения формулы. Результаты этих измерений позволяют рассчитать процентный состав соединения, определяемый как массовая доля каждого элемента в соединении. Например, рассмотрим газообразное соединение, состоящее исключительно из углерода и водорода. Процентный состав этого соединения можно представить следующим образом:
Когда формула соединения неизвестна, измерение массы каждого из составляющих его элементов часто является первым шагом в процессе экспериментального определения формулы. Результаты этих измерений позволяют рассчитать процентный состав соединения, определяемый как массовая доля каждого элемента в соединении. Например, рассмотрим газообразное соединение, состоящее исключительно из углерода и водорода. Процентный состав этого соединения можно представить следующим образом:
%H=масса соединения Hmass×100%%H=масса соединения Hmass×100%
%C=масса Cмасса соединения×100%%C=масса Cмасса соединения×100%
Если анализ пробы этого газа весом 10,0 г показал, что он содержит 2,5 г H и 7,5 г C, процентный состав будет рассчитан как 25% H и 75% C:
%H=2,5 г · 20,0 г соединения × 100 % = 25 % %H = 2,5 г · 20,0 г соединения × 100 % = 25 %
%C=7,5 г C10,0 г соединения×100%=75%%C=7,5 г C10,0 г соединения×100%=75%
Пример 3,9
Расчет процентного состава
Анализ образца жидкого соединения, состоящего из углерода, водорода и азота, массой 12,04 г показал, что в нем содержится 7,34 г С, 1,85 г Н и 2,85 г N. Каков процентный состав этого соединения?
Каков процентный состав этого соединения?
Раствор
Чтобы рассчитать процентный состав, разделите экспериментально полученную массу каждого элемента на общую массу соединения, а затем переведите в процентное соотношение:
%C=7,34 г C12,04 г соединения×100 %=61,0 %%H=1,85 г h22,04 г соединения×100 %=15,4 %%N=2,85 г N12,04 г соединения×100 %=23,7 %%C= 7,34 г C12,04 г соединения × 100% = 61,0%% H = 1,85 г h22,04 г соединения × 100% = 15,4%% N = 2,85 г N12,04 г соединения × 100% = 23,7%
Результаты анализа показывают, что соединение представляет собой 61,0% С, 15,4% Н и 23,7% N по массе.
Проверьте свои знания
Образец газообразного соединения массой 24,81 г, содержащий только углерод, кислород и хлор, содержит 3,01 г углерода, 4,00 г кислорода и 17,81 г хлора. Каков процентный состав этого соединения?
Отвечать:
12,1% C, 16,1% O, 71,79% Cl
Определение процентного состава по молекулярным или эмпирическим формулам
Процентный состав также полезен для оценки относительного содержания данного элемента в различных соединениях известных формул. В качестве примера рассмотрим распространенные азотсодержащие удобрения аммиак (NH 3 ), нитрат аммония (NH 4 NO 3 ) и мочевину (CH 4 N 2 O). Элемент азота является активным ингредиентом для сельскохозяйственных целей, поэтому массовое процентное содержание азота в соединении представляет собой практическую и экономическую проблему для потребителей, выбирающих среди этих удобрений. Для таких приложений процентный состав соединения легко выводится из массы его формулы и атомных масс составляющих его элементов. Молекула NH 3 содержит один атом N с массой 14,01 а.е.м. и три атома H с общей массой (3 × × 1,008 а.е.м.) = 3,024 а.е.м. Таким образом, формула массы аммиака (14,01 а.е.м. + 3,024 а.е.м.) = 17,03 а.е.м., а его процентный состав:
В качестве примера рассмотрим распространенные азотсодержащие удобрения аммиак (NH 3 ), нитрат аммония (NH 4 NO 3 ) и мочевину (CH 4 N 2 O). Элемент азота является активным ингредиентом для сельскохозяйственных целей, поэтому массовое процентное содержание азота в соединении представляет собой практическую и экономическую проблему для потребителей, выбирающих среди этих удобрений. Для таких приложений процентный состав соединения легко выводится из массы его формулы и атомных масс составляющих его элементов. Молекула NH 3 содержит один атом N с массой 14,01 а.е.м. и три атома H с общей массой (3 × × 1,008 а.е.м.) = 3,024 а.е.м. Таким образом, формула массы аммиака (14,01 а.е.м. + 3,024 а.е.м.) = 17,03 а.е.м., а его процентный состав:
%N=14,01 а.е.м. N17,03 а.е.Nh4×100%=82,27%%H=3,024 а.е. 03amuNh4×100%=17,76%
Такой же подход можно применить к паре молекул, дюжине молекул или молю молекул и т. д. Последнее количество наиболее удобно и будет просто включать использование молярных масс вместо атомных и формульных масс, как показано в примере. 3.10. Пока известна молекулярная или эмпирическая формула рассматриваемого соединения, процентный состав может быть получен из атомных или молярных масс элементов соединения.
д. Последнее количество наиболее удобно и будет просто включать использование молярных масс вместо атомных и формульных масс, как показано в примере. 3.10. Пока известна молекулярная или эмпирическая формула рассматриваемого соединения, процентный состав может быть получен из атомных или молярных масс элементов соединения.
Пример 3.10
Определение процентного состава по молекулярной формуле
Аспирин представляет собой соединение с молекулярной формулой C 9 H 8 O 4 . Каков его процентный состав?
Раствор
Для расчета процентного состава необходимы массы C, H и O в известной массе C 9 H 8 O 4 . Удобно считать 1 моль C 9 H 8 O 4 и используйте его молярную массу (180,159 г/моль, определяемую по химической формуле), чтобы рассчитать процентное содержание каждого из его элементов:
%C=9моль C×молярная масса Cмолярная массаC9H8O4×100=9×12,01г/моль180,159г/моль×100=108,09г/моль180,159г/моль×100%C=60,00%C%C=9мольC× молярная масса Cмолярная масса C9H8O4×100=9×12,01 г/моль180,159 г/моль×100=108,09 г/моль180,159 г/моль×100%C=60,00%C
%H=8моль H×молярная масса Hмолярная массаC9H8O4×100 =8×1,008 г/моль180,159 г/моль×100=8,064 г/моль180,159 г/моль×100%H=4,476%H%H=8моль H×молярная масса Hмолярная массаC9H8O4×100=8×1,008 г/моль180,159 г/моль×100=8,064 г/моль180,159 г/моль×100%H=4,476%H
%O=4моль O×молярная масса Oмолярная массаC9H8O4×100=4× 16,00 г/моль180,159 г/моль×100=64,00 г/моль180,159 г/моль×100%O=35,52%%O=4моль O×молярная масса Oмолярная массаC9H8O4×100=4×16,00 г/моль180,159 г/моль× 100=64,00 г/моль 180,159 г/моль×100%O=35,52%
Обратите внимание, что эти проценты в сумме составляют 100,00% при соответствующем округлении.
Проверьте свои знания
До трех значащих цифр чему равна массовая доля железа в соединении Fe 2 О 3 ?
Отвечать:
69,9% Fe
Определение эмпирических формул
Как упоминалось ранее, наиболее распространенный подход к определению химической формулы соединения состоит в том, чтобы сначала измерить массы составляющих его элементов. Однако имейте в виду, что химические формулы представляют собой относительные числа , а не массы атомов в веществе. Следовательно, любые экспериментально полученные данные, касающиеся массы, должны использоваться для получения соответствующего числа атомов в соединении. Это достигается с помощью молярных масс для преобразования массы каждого элемента в число молей. Эти молярные количества используются для расчета целочисленных отношений, которые можно использовать для получения эмпирической формулы вещества. Рассмотрим образец соединения, который содержит 1,71 г C и 0,287 г H. Соответствующее количество атомов (в молях):
Рассмотрим образец соединения, который содержит 1,71 г C и 0,287 г H. Соответствующее количество атомов (в молях):
1,71 г C×1 моль C12,01 г C=0,142 моль C0,287 г H×1 моль h2,008 г H=0,284 моль h2,71 г C×1 моль C12,01 г C=0,142 моль C0,287 г H×1 моль h2,008 г H= 0,284 моль H
Таким образом, это соединение может быть представлено формулой C 0,142 H 0,284 . По соглашению формулы содержат целые индексы, что можно получить, разделив каждый индекс на меньший индекс:
.C0.1420.142H0.2840.142илиCh3C0.1420.142H0.2840.142илиCh3
(Напомним, что нижние индексы «1» не записываются, а скорее предполагаются, если нет другого числа.)
Эмпирическая формула для этого соединения, таким образом, CH 2 . Это может быть или не быть молекулярная формула соединения ; однако для принятия такого решения необходима дополнительная информация (как обсуждается далее в этом разделе).
Рассмотрим в качестве другого примера образец соединения, который содержит 5,31 г Cl и 8,40 г O. Следование тому же подходу дает предварительную эмпирическую формулу:
Следование тому же подходу дает предварительную эмпирическую формулу:
Cl0,150O0,525=Cl0,1500,150O0,5250,150=ClO3,5Cl0,150O0,525=Cl0,1500,150O0,5250,150=ClO3,5
В этом случае деление на наименьший нижний индекс по-прежнему оставляет нам десятичный нижний индекс в эмпирической формуле. Чтобы преобразовать это в целое число, умножьте каждый из нижних индексов на два, сохранив то же соотношение атомов и получив окончательную эмпирическую формулу Cl 2 O 7 .
Таким образом, эмпирические формулы выводятся из экспериментально измеренных масс элементов с помощью:
- Определение количества молей каждого элемента по его массе
- Разделение молярного количества каждого элемента на наименьшее молярное количество, чтобы получить индексы для предварительной эмпирической формулы
- Умножение всех коэффициентов на целое число, если необходимо, чтобы получить наименьшее целочисленное отношение индексов
На рис. 3.11 эта процедура показана в виде блок-схемы для вещества, содержащего элементы A и X.
3.11 эта процедура показана в виде блок-схемы для вещества, содержащего элементы A и X.
Рисунок 3.11 Эмпирическая формула соединения может быть получена из масс всех элементов в образце.
Пример 3.11
Определение эмпирической формулы соединения по массам его элементов
Образец черного минерала гематита (рис. 3.12), оксида железа, встречающегося во многих железных рудах, содержит 34,97 г железа и 15,03 г кислорода. Какова эмпирическая формула гематита?
Рисунок 3.12 Гематит — это оксид железа, используемый в ювелирных изделиях. (кредит: Мауро Катеб)
Решение
Эта задача дает массу в граммах каждого элемента. Начните с поиска родинок каждого:
34,97 г Fe(моль Fe55,85г)=0,6261моль Fe15,03г O(моль O16,00г)=0,9394моль O34,97г Fe(моль Fe55,85г)=0,6261моль Fe15,03г O(моль O16,00г) = 0,9394 моль O
Затем вычислите молярное отношение железа к кислороду, разделив его на меньшее число молей: 1,500 моль O
Отношение 1,000 моль железа к 1,500 моль кислорода (Fe 1 O 1,5 ). Наконец, умножьте это отношение на два, чтобы получить наименьшие возможные целые числовые индексы, сохраняя при этом правильное соотношение железа и кислорода:
Наконец, умножьте это отношение на два, чтобы получить наименьшие возможные целые числовые индексы, сохраняя при этом правильное соотношение железа и кислорода:
2(Fe1O1.5)=Fe2O32(Fe1O1.5)=Fe2O3
Эмпирическая формула Fe 2 O 3 .
Проверьте свои знания
Какова эмпирическая формула соединения, если образец содержит 0,130 г азота и 0,370 г кислорода?
Отвечать:
Н 2 О 5
Получение эмпирических формул из процентного состава
Наконец, что касается вывода эмпирических формул, рассмотрите случаи, когда доступен процентный состав соединения, а не абсолютные массы составляющих его элементов. В таких случаях процентный состав можно использовать для расчета массы элементов, присутствующих в любой удобной массе соединения; затем эти массы можно использовать для вывода эмпирической формулы обычным способом.
Пример 3.12
Определение эмпирической формулы из процентного состава
При бактериальном брожении зерна с образованием этанола образуется газ с процентным составом 27,29 % С и 72,71 % О (рис. 3.13). Какова эмпирическая формула этого газа?
Рисунок 3.13 Оксид углерода удаляется из этих бродильных чанов через большие медные трубы наверху. (кредит: «Dual Freq»/Wikimedia Commons)
Решение
Поскольку шкала для процентов равна 100, удобнее всего вычислять массу элементов, присутствующих в образце массой 100 г. Расчет «наиболее удобен», потому что, согласно определению процентного состава, масса данного элемента в граммах численно эквивалентна массовой доле элемента. Эта числовая эквивалентность является результатом определения единицы «процент», название которой происходит от латинской фразы per centum , означающей «на сто». Принимая во внимание это определение, предоставленные массовые проценты могут быть более удобными выражены в виде дробей:
Принимая во внимание это определение, предоставленные массовые проценты могут быть более удобными выражены в виде дробей:
27,29%C=27,29г C100г соединения72,71%O=72,71г O100г соединения27,29%C=27,29г C100г соединения72,71%O=72,71г O100г соединения
Молярные количества углерода и кислорода в 100- г образца рассчитывают путем деления массы каждого элемента на его молярную массу:
27,29 г C (моль C12,01 г) = 2,272 моль C72,71 г O (моль O 16,00 г) = 4,544 моль O 27,29 г C (моль C 12,01 г) )=2,272 моль C72,71 г O(моль O16,00 г)=4,544 моль O
Коэффициенты для предварительной эмпирической формулы получают путем деления каждого молярного количества на меньшее из двух:
2,272 моль C2,272 = 14,544 моль O2,272 = 22,272 моль C2,272 = 14,544 моль O2,272 = 2
Поскольку полученное соотношение составляет один углерод к двум атомам кислорода, эмпирическая формула CO 2 .
Проверьте свои знания
Какова эмпирическая формула соединения, содержащего 40,0 % С, 6,71 % Н и 53,28 % О?
Отвечать:
СН 2 О
Вывод молекулярных формул
Напомним, что эмпирические формулы — это символы, представляющие относительные номера элементов соединения. Определение абсолютных чисел атомов, составляющих одну молекулу ковалентного соединения, требует знания как его эмпирической формулы, так и его молекулярной или молярной массы. Эти величины могут быть определены экспериментально с помощью различных методов измерения. Молекулярную массу, например, часто получают из масс-спектра соединения (см. обсуждение этого метода в предыдущей главе об атомах и молекулах). Молярную массу можно измерить рядом экспериментальных методов, многие из которых будут представлены в следующих главах этого текста.
Определение абсолютных чисел атомов, составляющих одну молекулу ковалентного соединения, требует знания как его эмпирической формулы, так и его молекулярной или молярной массы. Эти величины могут быть определены экспериментально с помощью различных методов измерения. Молекулярную массу, например, часто получают из масс-спектра соединения (см. обсуждение этого метода в предыдущей главе об атомах и молекулах). Молярную массу можно измерить рядом экспериментальных методов, многие из которых будут представлены в следующих главах этого текста.
Молекулярные формулы получают путем сравнения молекулярной или молярной массы соединения с массой его эмпирической формулы. Как следует из названия, масса эмпирической формулы представляет собой сумму средних атомных масс всех атомов, представленных в эмпирической формуле. Если известна молекулярная (или молярная) масса вещества, ее можно разделить на массу эмпирической формулы, чтобы получить количество эмпирических формульных единиц на молекулу ( n ):
молекулярная или молярная масса(аму оргмоль)эмпирическая формула масса(аму оргмоль)=nформула единиц/молекуламолекулярная или молярная масса(аму оргмоль)эмпирическая формула масса(аму оргмоль)=nформула единиц/молекула
Молекулярная формула затем получается путем умножения каждого нижнего индекса в эмпирической формуле на n , как показано общей эмпирической формулой A x B y :
(AxBy)n=AnxBny(AxBy)n=AnxBny
Например, рассмотрим ковалентное соединение, эмпирическая формула которого определена как CH 2 O. Масса эмпирической формулы для этого соединения составляет приблизительно 30 а.е.м. (сумма 12 а.е.м. для одного атома C, 2 а.е.м. для двух атомов H и 16 а.е.м. для одного атома O). Если молекулярная масса соединения определена равной 180 а.е.м., это указывает на то, что молекулы этого соединения содержат в шесть раз больше атомов, чем представлено в эмпирической формуле:
Масса эмпирической формулы для этого соединения составляет приблизительно 30 а.е.м. (сумма 12 а.е.м. для одного атома C, 2 а.е.м. для двух атомов H и 16 а.е.м. для одного атома O). Если молекулярная масса соединения определена равной 180 а.е.м., это указывает на то, что молекулы этого соединения содержат в шесть раз больше атомов, чем представлено в эмпирической формуле:
180 а.е.м./молекула30 а.е.м. формульная единица = 6 формульных единиц/молекула180 а.е.м./молекула30 а.е.м. формульная единица = 6 формульных единиц/молекула
Молекулы этого соединения затем представлены молекулярными формулами, индексы которых в шесть раз больше, чем в эмпирической формуле:
(Ch3O)6=C6h22O6(Ch3O)6=C6h22O6
Обратите внимание, что этот же подход можно использовать, когда используется молярная масса (г/моль) вместо молекулярной массы (а.е.м.). В этом случае рассматривается один моль эмпирических формульных единиц и молекул, а не единичных единиц и молекул.
Пример 3.13
Определение молекулярной формулы никотина
Никотин, алкалоид растений семейства пасленовых, вызывающий привыкание к сигаретам, содержит 74,02 % С, 8,710 % Н и 17,27 % N. Если 40,57 г никотина содержат 0,2500 моль никотина, какова его молекулярная формула? ?
Раствор
Определение молекулярной формулы по предоставленным данным потребует сравнения массы эмпирической формулы соединения с его молярной массой. В качестве первого шага используйте процентный состав для получения эмпирической формулы соединения. Предположим, что 100-граммовый образец никотина дает следующие молярные количества его элементов:
(74,02 г C)(1 моль C12,01 г C)=6,163 моль C(8,710 г H)(1 моль ч2,008 г H)=8,641 моль H(17,27 г N)(1 моль N14,01 г N)=1,233 моль N (74,02 г C)(1 моль C12,01 г C)=6,163 моль C(8,710 г H)(1 моль ч2,008 г H)=8,641 моль H(17,27 г N)(1 моль N14,01 г N)=1,233 моль N
Затем рассчитайте молярные соотношения этих элементов относительно наименее распространенного элемента, N.


Leave A Comment