Задача по химии №474
Решение.
При наличии незавершенных внешних энергетических уровней атома он стремится к их заполнению путем химического взаимодействия и образования химической связи с другими атомами. В образовании химической связи участвуют валентные электроны, т. е. электроны незавершенного внешнего уровня. Химические связи могут быть 3-ех типов:
ковалентная, ионная и металлическая.
Ковалентная связь. Когда два атома приближаются друг к другу на близкое расстояние, электронные орбитали внешних незавершенных уровней перекрывают друг друга, притягивают ядра атомов и образуют общее электронное облако или ковалентную связь.
Если возникает одно общее электронное облако или ковалентная связь, то связь называется одинарной, если две пары электронов образуют связь – она называется двойной и т.д.
Итак, ковалентная связь это химическая связь, осуществляемая электронными парами. Это двухэлектронная и двухцентровая (удерживает два ядра) связь.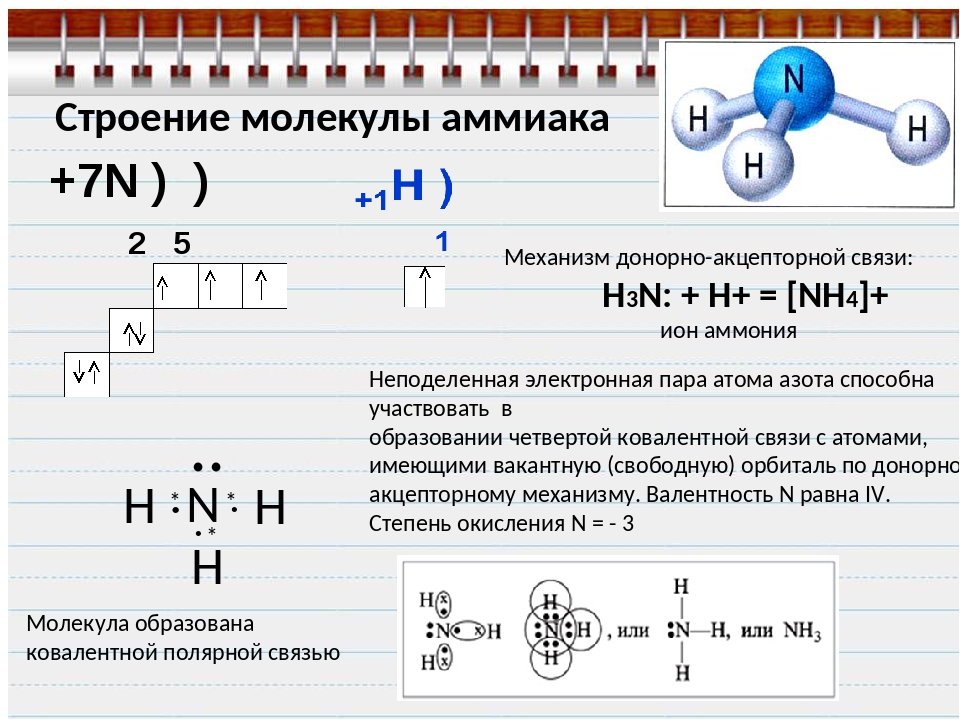
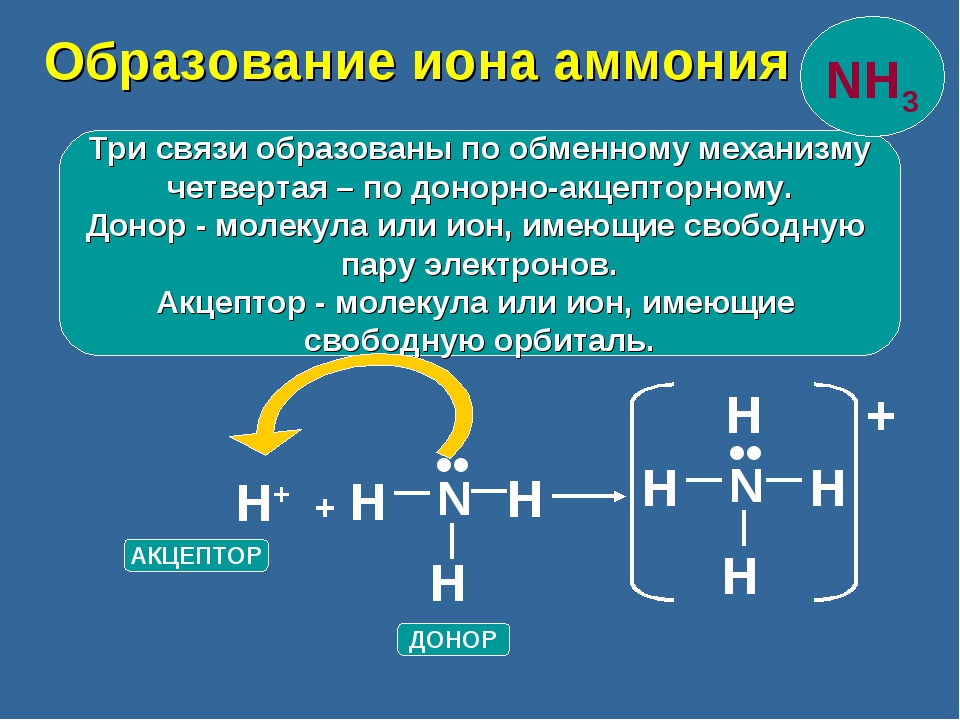
Разновидностью ковалентной связи является донорно-акцепторная связь. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома как в случае образования иона аммония Nh5+.
Строение атома N: N7 1s²/2s²2p3
|
|
|
2 уровень2s²2p3 |
Строение атома Н: 1s¹
В молекуле аммиака каждый из 3-ех p-электронов азота N участвует в образовании ковалентной связи с одним электроном атома водорода, образуется тройная связь. При этом у атома азота N осталась неподеленная пара s-электронов. У иона же водорода H+ имеется свободная 1s-орбиталь.
При этом у атома азота N осталась неподеленная пара s-электронов. У иона же водорода H+ имеется свободная 1s-орбиталь.
Атом, предоставляющий неподеленную пару электронов (в данном случае N), называется донором, атом, принимающий ее (в данном случае H) называется акцептором.
Схема образования связей в ионе BF4¯.
Строение атома B: B5 1s²/2s²2p¹
|
|
2 уровень2s²2p¹ |
Строение атома F: F9 1s²/2s²2p5
|
|
|
|
2 уровень2s²2p5 |
|
1 уровень1s²
|
Атом бора имеет на внешнем уровне один неспаренный p-электрон и два спаренных s- электрона
Атом фтора имеет на внешнем уровне два спаренных s-электрона, две пары спаренных p-электронов и один неспаренный p-электрон.
В образовании молекулы BF3 участвуют три электрона внешнего уровня атома бора и остается свободная p-орбиталь (т.к. из возможных 3-ех орбиталей на 2-ом подуровне занята лишь одна), а также по одному неспаренному p-электрону внешнего уровня от 3-ех атомов азота). В этом соединении фтор донор, бор акцептор.
Ион фтора F¯ образуется присоединением электрона к атому фтора, при этом на внешнем уровне атома фтора заполняется 3-ий последний подуровень 2 –ого уровня, свободной орбитали нет.
Далее в образовании иона фтора BF4¯ участвует пара электронов атома фтора и свободная орбиталь атома бора.
Связь ковалентная, донорно-акцепторная, донор – фтор F, акцептор – бор B.
Строение молекул. Химическая связь
Молекула — электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов.
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого.
Химическая связь может образовываться путем предоставления от каждого из атомов по одному или нескольким неспаренным электронам (кратные связи) с образованием электронных пар (ковалентная связь). В образовании химической связи участвуют только электроны внешней электронной оболочки, а внутренние электронные уровни не затрагиваются. В результате, при образовании химической связи у каждого атома образуется заполненная электронная оболочка внешнего электронного уровня, состоящая из двух (дуплет) или восьми (октет) электронов.
Химическая связь характеризуется длиной и энергией. Длина химической связи это расстояние между ядрами связанных атомов. Энергия химической связи показывает сколько необходимо затратить энергии на разведение двух атомов, между которыми существует химическая связь, на расстояние, при котором эта химическая связь будет разорвана.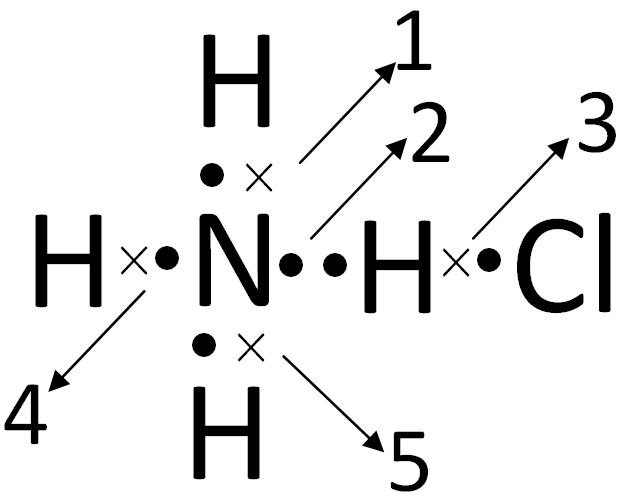
Виды химической связи
Ионная химическая связь
Результатом этого является образование соединения противоположно заряженных ионов:
Это притяжение ионов как разноимённо заряженных тел. Ионная связь — крайний случай поляризации ковалентной полярной связи.
Образуется между типичными металлом и неметаллом (Me + неМе).
При этом электроны у металла полностью переходят к неметаллу, образуются ионы (частицы, имеющие заряд).
Например, типичные металлы литий (Li), натрий (Na), калий (K), кальций (Ca), стронций (Sr), барий (Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.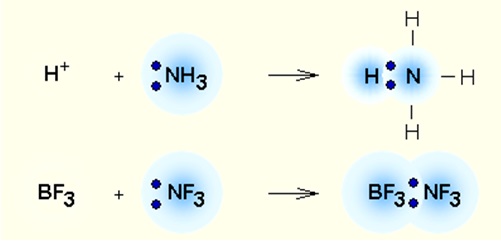
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия (NaOH) и сульфате натрия (Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи — ковалентные полярные).
Ковалентная химическая связь
Ковалентная полярная химическая связь образуется при взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому.
Электроотрицательность (ЭО) — способность атома химических элемента смещать к себе общие электронные пары, участвующие в образовании химической связи.
Ковалентная полярная связь образуется между разными неметаллами (неМе + неMe).
Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
Такая связь существует в молекулах следующих сложных веществ: Н2О, h3S, Nh4 и др.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония (Н3О+) и аммония (Nh5+).
Металлическая химическая связь
Связь в металлах и сплавах между атом-ионами посредством обобществленных электронов называется металлической.
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
Металлическая химическая связь образуется в простых веществах-металлах (Me).
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы.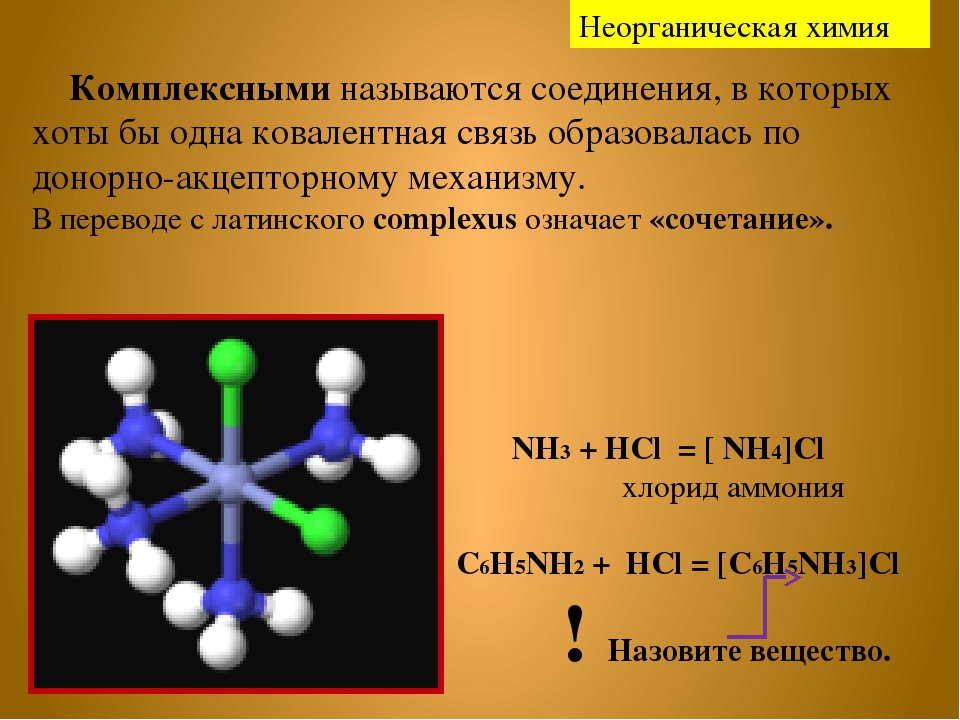 Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь, т.е. электроны как бы цементируют положительные ионы кристаллической решетки металлов.
Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь, т.е. электроны как бы цементируют положительные ионы кристаллической решетки металлов.
Металлическая связь существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3 электрона) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу.
В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные ионы, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ» , обеспечивающий связь между атомами металла.
Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью.
Металлическая связь возникает за счет обобществления атомами валентных электронов. Однако между этими видами связи есть существенное различие. Электроны, осуществляющие ковалентную связь, в основном пребывают в непосредственной близости от двух соединенных атомов.
В случае металлической связи электроны, осуществляющие связь, перемещаются по всему куску металла. Этим определяются общие признаки металлов: металлический блеск, хорошая проводимость теплоты и электричества, ковкость, пластичность и т. д.
Общим химическим свойством металлов является их относительно высокая восстановительная способность.
Обобщение материала
Типы химической связи
Полезные ссылки
Источник материала
Ионная связь и её характеристики (видео)
Ковалентная связь и её характеристики (видео)
Металлическая связь и её характеристики (видео)
Схемы образования веществ с различным типом связи (видео)
Разбор видов связи
Ионная химическая связь (видео)
Ковалентная неполярная химическая связь (видео)
Ковалентная полярная химическая связь (видео)
Металлическая химическая связь (видео)
Дополнительные материалы
Ковалентная и ионная химическая связь (видео)
Металлическая и водородная химические связи (видео)
Ионная связь (видео)
Ковалентная связь (видео)
Ковалентная полярная связь (видео)
Nh5, степень окисления азота в ионе аммония
Общие сведения об ионе аммония и степени окисления в Nh5
Атом азота имеет на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
7N 1s22s22p3;
Неспаренные 2з-электроны атома азота в молекуле аммиака образуют три электронные пары с электронами атомов водорода.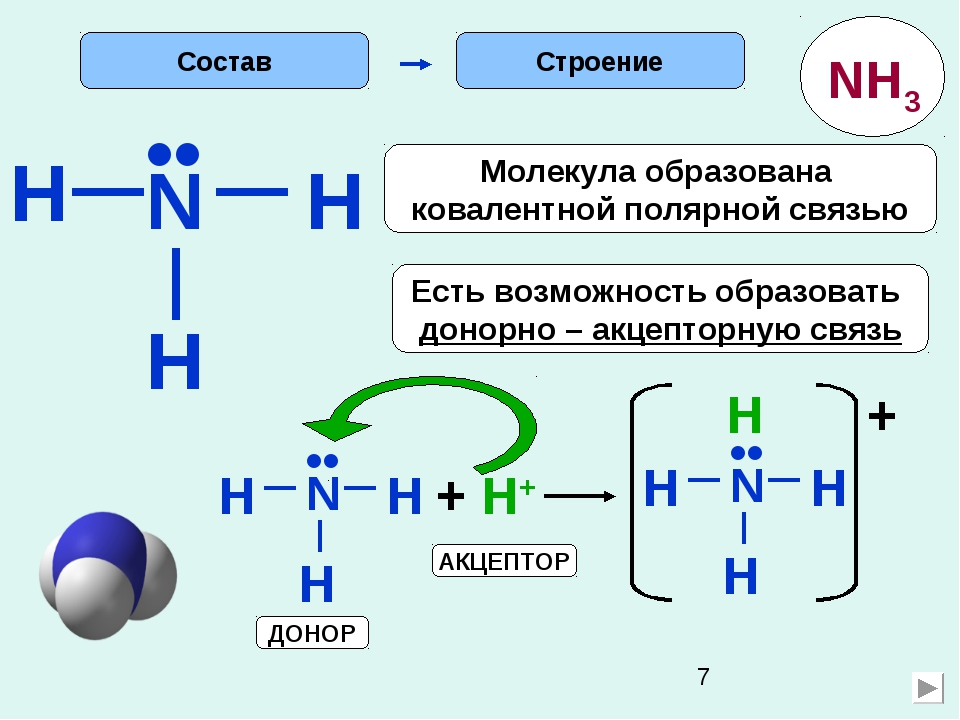 У атома азота остается неподеленная пара электронов 2s2, т.е. два электрона с антипараллельными спинами на одной атомной орбитали. Атомная орбиталь иона водорода не содержит электронов (вакантная орбиталь). При сближении молекулы аммиака и иона водорода происходит взаимодействие неподеленной пары электронов атома азота и вакантной орбитали иона водорода, возникает химическая связь по донорно-акцепторному механизму. Атом азота молекулы аммиака является донором, а ион водорода – акцептором. Обозначив неподеленную пару электронов двумя точками, вакантную орбиталь квадратом, а связи черточками, можно представить образование иона аммония схемой, изображенной на рис. 1.
У атома азота остается неподеленная пара электронов 2s2, т.е. два электрона с антипараллельными спинами на одной атомной орбитали. Атомная орбиталь иона водорода не содержит электронов (вакантная орбиталь). При сближении молекулы аммиака и иона водорода происходит взаимодействие неподеленной пары электронов атома азота и вакантной орбитали иона водорода, возникает химическая связь по донорно-акцепторному механизму. Атом азота молекулы аммиака является донором, а ион водорода – акцептором. Обозначив неподеленную пару электронов двумя точками, вакантную орбиталь квадратом, а связи черточками, можно представить образование иона аммония схемой, изображенной на рис. 1.
Рис. 1. Схема образования иона аммония.
Nh5, степени окисления элементов в нем
Из выше указанного ясно, что ион аммония имеет заряд (+). Чтобы определить степени окисления элементов, входящих в его состав, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Так как аммиак является гидридом азота, то степень окисления водорода в ионе аммония равна (+1). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 4×(+1) = -1;
x — 4 = -1;
x = -3.
Значит степень окисления азота в ионе аммония равна (-3):
(N-3H+14)—.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Образование ионной связи — урок. Химия, 8–9 класс.
Представим, что встретились два атома: атом щелочного металла и атом галогена. У атома металла на внешнем энергетическом уровне — единственный электрон, а атому неметалла как раз не хватает одного электрона, чтобы завершить свой внешний уровень.
У атома металла на внешнем энергетическом уровне — единственный электрон, а атому неметалла как раз не хватает одного электрона, чтобы завершить свой внешний уровень.
Атом металла легко отдаст свой слабо связанный с ядром валентный электрон атому неметалла, который предоставит ему свободное место на внешнем энергетическом уровне. Оба в результате получат заполненные внешние уровни.
Атом металла при этом приобретёт положительный заряд, а атом галогена превратится в отрицательно заряженную частицу. Такие частицы называются ионами.
Ионы — заряженные частицы, в которые превращаются атомы в результате отдачи или принятия электронов.
Образовавшиеся разноимённо заряженные ионы притягиваются друг к другу, и возникает химическая связь, которая называется ионной.
Ионная связь — связь между положительно и отрицательно заряженными ионами.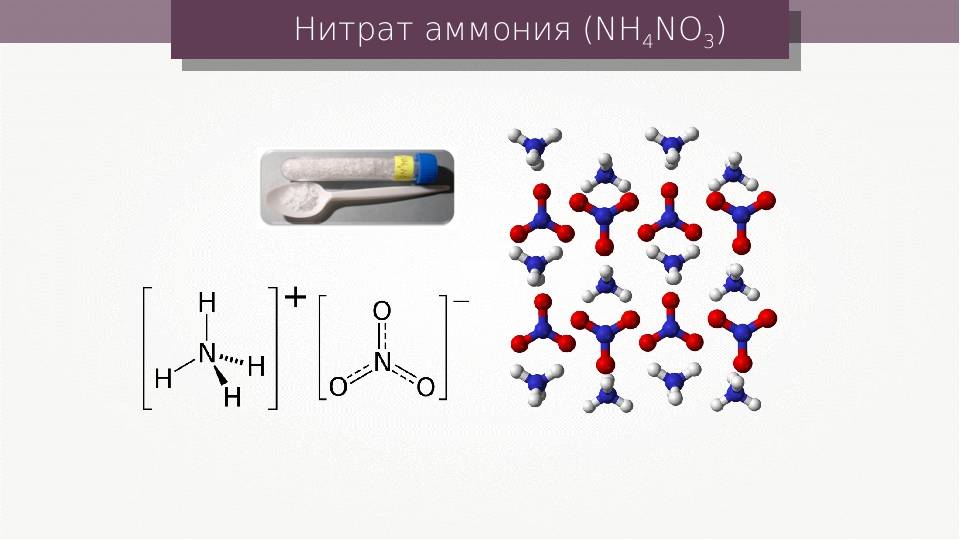
Рассмотрим механизм образования ионной связи на примере взаимодействия натрия и хлора.
Na0+Cl0→Na++Cl−→Na+Cl−
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов, электроотрицательности которых резко различаются.
Ионная связь образуется в сложных веществах, состоящих из атомов металлов и неметаллов.
Рассмотрим другие примеры образования ионной связи.Пример:
Взаимодействие кальция и фтора
1. Кальций — элемент главной подгруппы второй группы. Ему легче отдать два внешних электрона, чем принять недостающие.
2. Фтор — элемент главной подгруппы седьмой группы. Ему легче принять один электрон, чем отдать семь.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно \(2\). Определим число атомов фтора, которые примут два электрона от атома кальция: \(2\) \(:\) \(1\) \(=\) \(2\).
4. Составим схему образования ионной связи:
Ca0+2F0→Ca2+F2−.
Пример:
Взаимодействие натрия и кислорода
1. Натрий — элемент главной подгруппы первой группы. Он легко отдаёт один внешний электрон.
2. Кислород — элемент главной подгруппы шестой группы. Ему легче принять два электрона, чем отдать шесть.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно \(2\) \(:\) \(1\) \(=\) \(2\). Определим число атомов натрия, которые отдадут два электрона атому кислорода: \(2\).
4. Составим схему образования ионной связи:
2Na0+O0→Na2+O2−.
С помощью ионной связи образуются также соединения, в которых имеются сложные ионы:
Nh5+,NO3−,OH−,SO42−,PO43−,CO32−.
Значит, ионная связь существует также в солях и основаниях.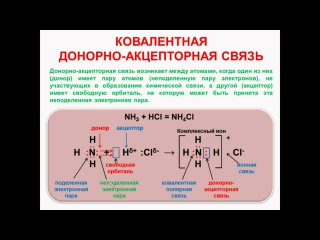
Обрати внимание!
Соли аммония Nh5NO3,Nh5Cl,Nh5SO42 не содержат металла, но образованы ионной связью.
Ионы создают вокруг себя электрическое поле, действующее во всех направлениях. Поэтому каждый ион окружён ионами противоположного знака. Такое соединение представляет собой огромную группу положительных и отрицательных частиц, расположенных в определённом порядке.
Рис. \(1\). Ионный кристалл
Притяжение между ионами довольно сильное, поэтому ионные вещества имеют высокие температуры кипения и плавления.
Обрати внимание!
Все ионные соединения при обычных условиях — твёрдые вещества.
Примеры веществ с ионной связью:
Рис. \(2\). Питьевая сода | Рис. \(3\). Железный купорос | Рис. \(4\). Поваренная соль |
Источники:
Рис. 1. Ионный кристалл https://upload.wikimedia.org/wikipedia/commons/e/eb/Sodium_chloride_crystal.png
1. Ионный кристалл https://upload.wikimedia.org/wikipedia/commons/e/eb/Sodium_chloride_crystal.png
Рис. 2. Питьевая сода https://pixabay.com/images/id-768950/ 8.06.2021
Рис. 3. Железный купорос https://upload.wikimedia.org/wikipedia/commons/thumb/a/ab/Iron%28II%29-sulfate-heptahydrate-sample.jpg/1280px-Iron%28II%29-sulfate-heptahydrate-sample.jpg
Рис. 4. Поваренная соль https://upload.wikimedia.org/wikipedia/commons/9/93/Chlorid_sodn%C3%BD.JPG
Аммиак. Физические и химические свойства аммиака, получение, применение. Соли аммония
Урок посвящен изучению темы «Аммиак». Вы узнаете о свойствах соединений азота, в которых он проявляет степень окисления -3, в какие химические реакции и при каких условиях вступает аммиак.
Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году, который назвал его «щелочной воздух» (англ. alkaline air). Через одиннадцать лет, в 1785 году К. Бертолле установил точный химический состав аммиака. С того времени в мире начались исследования по получению аммиака из азота и водорода.
С того времени в мире начались исследования по получению аммиака из азота и водорода.
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
I. Строение молекулы аммиака
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.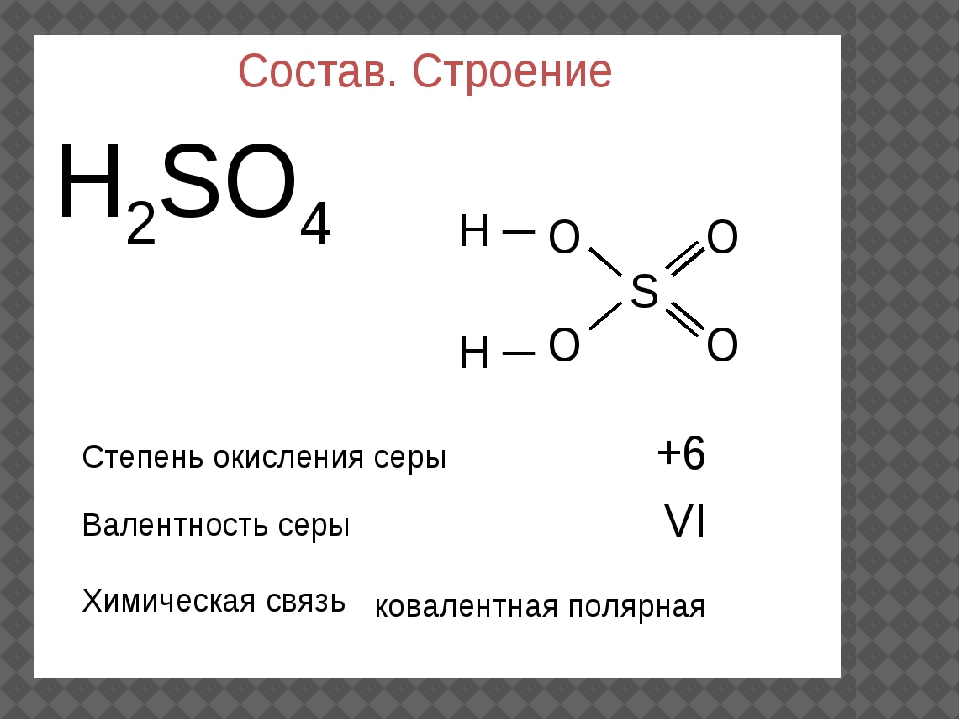
Вид химической связи: ковалентная полярная, три одинарные σ — сигма связи N-H.
II. Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
III. Получение аммиака
|
В лаборатории |
В промышленности |
|
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ + NaCl + H2O (NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4+ 2H2O Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH4OH ↔ NH3↑ + H2O При получении аммиака держите пробирку — приёмник дном кверху, так как аммиак легче воздуха: |
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж Условия:
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода) |
IV.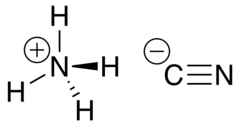 Химические свойства аммиака
Химические свойства аммиака
Для аммиака характерны реакции:
- C изменением степени окисления атома азота (реакции окисления)
- Без изменения степени окисления атома азота (присоединение)
1. Реакции с изменением степени окисления атома азота (реакции окисления)
N-3 → N0 → N+2
NH3 – сильный восстановитель
- Взаимодействие с кислородом
1.Горение
Опыт: “Горение аммиака”(при нагревании)
4NH3 + 3O2 → 2N2 + 6H20
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
Видео — эксперимент: «Окисление аммиака в присутствии оксида хрома»
- Взаимодействие с оксидами металлов
2NH3 + 3CuO = 3Cu + N2 + 3H2O
- Взаимодействие с сильными окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
- Аммиак – непрочное соединение, при нагревании разлагается
2NH3↔ N2 + 3H2
2. Реакции без изменения степени окисления атома азота (присоединение —Образование иона аммония NH4+ по донорно-акцепторному механизму)
Реакции без изменения степени окисления атома азота (присоединение —Образование иона аммония NH4+ по донорно-акцепторному механизму)
Видео — эксперимент: “Качественная реакция на аммиак”
Видео — эксперимент: “Взаимодействие аммиака с хлороводородом (дым без огня)”
Видео-эксперимент:“Взаимодействие аммиака с концентрированными кислотами”
Видео — эксперимент: «Фонтан»
Видео — эксперимент: «Растворение аммиака в воде»
V. Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3. Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
Для человека аммиак в такой дозе не опасен.
VI. Соли аммония
1. Составление формул солей аммония
Соли аммония — это сложные вещества, в состав которых входят ионы аммония Nh5+, соединённые с кислотными остатками.
Например,
Nh5Cl – хлорид аммония
(NH4)2SO4 — сульфат аммония
Nh5NO3 – нитрат аммония
(NH4)3PO4 – ортофосфат аммония
(NH4)2HPO4 – гидроортофосфат аммония
Nh5H2PO4 – дигидроортофосфат аммония
2. Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
3. Получение
1 способ: Аммиак + кислота: Nh4 + HNO3 → Nh5NO3
2 способ: Аммиачная вода + кислота: 2Nh5OH + h3SO4 → (Nh5)2SO4+ 2Н2O
4. Химические свойства
Химические свойства
Общие свойства
1. Сильные электролиты (диссоциируют в водных растворах полностью)
Nh5Cl → Nh5+ + Cl—
2. Взаимодействие с кислотами (реакция обмена)
(Nh5)2CO3 + 2НCl → 2Nh5Cl + Н2O + CO2
2Nh5+ + CO32- + 2H+ + 2Cl— → 2Nh5+ + 2Cl— + Н2O + CO2
CO32- + 2H+ → Н2O + CO2
Взаимодействие с солями (реакция обмена)
(Nh5)2SO4 + Ba(NO3)2 → BaSO4↓ + 2Nh5NO3
2Nh5+ + SO42- + Ba2+ + 2NO3— → BaSO4↓ + 2Nh5+ + 2NO3—
Ba2+ + SO42- → BaSO4↓
Спецефические свойства
1. Разложение при нагревании
a) если кислота летучая: Nh5Cl → Nh4 + HCl (при нагревании)
Nh5HCO3 → Nh4 + Н2O + CO2
youtube.com/embed/BXo0cNYvAbc» frameborder=»0″ allowfullscreen=»allowfullscreen»/>
б) если анион проявляет окислительные свойства: Nh5NO3 → N2O + 2Н2O (при нагревании)
(Nh5)2Cr2O7 → N2 + Cr2O3 + 4Н2O (при нагревании)
2. Качественная реакция на Nh5+ — ион аммония
При нагревании со щелочами выделяется газ аммиак
Nh5Cl + NaOH → NaCl + Nh4 + Н2O (при нагревании)
3. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
Nh5Cl + Н2O → Nh5OH + HCl
Nh5+ + Н2O → Nh5OH + H+
5. Применение
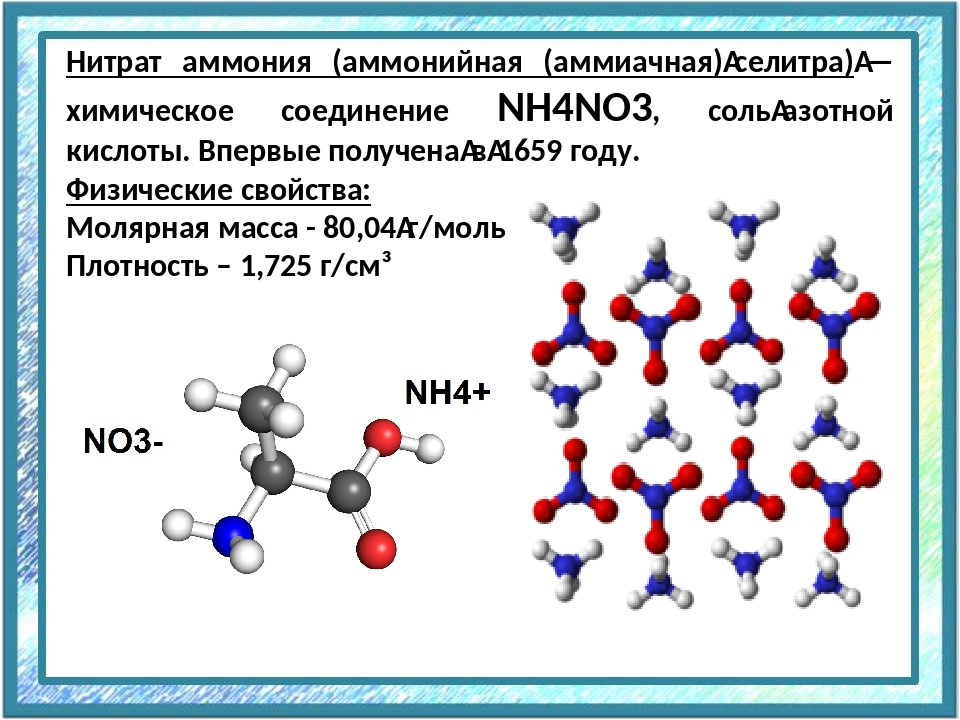
- Нитрат аммония (аммиачная селитра) Nh5NO3 применяют как азотное удобрение и для изготовления взрывчатых веществ — аммонитов;
- Сульфат аммония (Nh5)2SO4 — как дешёвое азотное удобрение;
- Гидрокарбонат аммония Nh5HCO3 и карбонат аммония (Nh5)2CO3 — в пищевой промышленности при производстве мучных кондитерских изделий в качестве химического разрыхлителя, при крашении тканей, в производстве витаминов, в медицине;
- Хлорид аммония Nh5Cl — в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии.

VII. Закрепление
Задание №1. Заполните таблицу – запишите молекулярные, полные и краткие ионные уравнения для следующих солей аммония:
|
Соли |
Химические свойства, общие с другими солями (1 – 3) |
Специфические свойства (1 – 2) |
|
1. Хлорид аммония |
|
|
|
2. Карбонат аммония |
|
|
|
3. Сульфид аммония |
|
|
|
4. Сульфат аммония |
|
|
|
5. |
|
|
Задание №2.
Ответьте на вопрос: Гидрокарбонат аммония иногда применяют при выпечке кондитерских изделий. Какие свойства гидрокарбоната при этом используют? Ответ подтвердите уравнениями реакций.
Задание №3. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
Задание №4. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
VIII. Тренажеры
Тренажёр №1: «Горение аммиака»
Тренажёр №2:«Химические свойства аммиака»
ЦОРы
Опыт: “Получение аммиака”
Опыт: “Горение аммиака”
Видео — Эксперимент: «Окисление аммиака в присутствии оксида хрома»
Анимация: “Донорно-акцепторнорный механизм”
Видео — Эксперимент: “Качественная реакция на аммиак”
Видео — Эксперимент: “Взаимодействие аммиака с хлороводородом (дым без огня)”
Видео — Эксперимент: “Взаимодействие аммиака с концентрированными кислотами”
Видео — Эксперимент: «Фонтан»
Видео — Эксперимент: «Растворение аммиака в воде»
Опыт: “Разложение карбоната аммония”
Опыт: “Качественная реакция на ион аммония”
Опыт:“Разложение дихромата аммония”
Координатное (дательное ковалентное) соединение
Ковалентная связь образована двумя атомами, разделяющими пару электронов. Атомы удерживаются вместе, потому что электронная пара притягивается обоими ядрами.
Атомы удерживаются вместе, потому что электронная пара притягивается обоими ядрами.
При образовании простой ковалентной связи каждый атом снабжает связь одним электроном, но это не обязательно. Координатная связь (также называемая дательной ковалентной связью) — это ковалентная связь (общая пара электронов), в которой оба электрона происходят от одного и того же атома.
В остальной части этой страницы мы будем использовать термин координационная связь — но если вы предпочитаете называть это дательной ковалентной связью, это не проблема!
Взаимодействие аммиака с хлороводородом
Если позволить этим бесцветным газам смешаться, образуется густой белый дым твердого хлорида аммония.
Ионы аммония, NH 4 + , образуются в результате переноса иона водорода от хлористого водорода к неподеленной паре электронов в молекуле аммиака.
Когда образуется ион аммония, NH 4 + , четвертый водород присоединяется посредством дательной ковалентной связи, потому что только ядро водорода передается от хлора к азоту.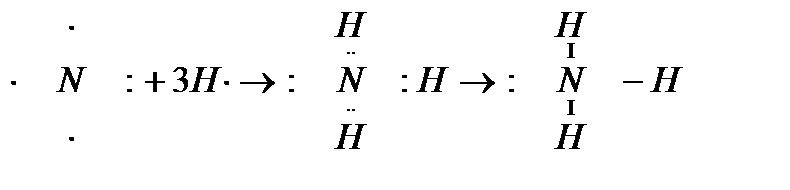 Электрон водорода остается на хлоре, образуя отрицательный ион хлорида.
Электрон водорода остается на хлоре, образуя отрицательный ион хлорида.
После образования иона аммония невозможно отличить дативную ковалентную связь от обычной ковалентной связи. Хотя электроны на схеме показаны по-разному, в действительности между ними нет никакой разницы.
Представляющие координатные облигации
На простых схемах координатная связь показана стрелкой. Стрелка указывает от атома, дающего неподеленную пару, к атому, принимающему ее.
Растворение хлористого водорода в воде для получения соляной кислоты
Происходит нечто подобное. Ион водорода (H + ) передается от хлора одной из неподеленных пар на атоме кислорода.
Ион H 3 O + по-разному называют ионом гидроксония, ионом гидроксония или ионом оксония.
Во вводном курсе химии (например, GCSE) всякий раз, когда вы говорили об ионах водорода (например, в кислотах), вы на самом деле говорили об ионе гидроксония. Необработанный ион водорода — это просто протон, и он слишком реактивен, чтобы существовать сам по себе в пробирке.
Необработанный ион водорода — это просто протон, и он слишком реактивен, чтобы существовать сам по себе в пробирке.
Если вы запишете ион водорода как H + (вод.) , « (вод.) » представляет молекулу воды, к которой присоединен ион водорода.Когда он вступает в реакцию с чем-либо (например, с щелочью), ион водорода просто снова отделяется от молекулы воды.
Обратите внимание, что как только координационная связь установлена, все атомы водорода, присоединенные к кислороду, в точности эквивалентны. Когда ион водорода снова отрывается, это может быть любой из трех.
Взаимодействие аммиака с трифторидом бора, BF 3
Если вы недавно читали страницу о ковалентном связывании, вы, возможно, помните трифторид бора как соединение, которое не имеет структуры благородного газа вокруг атома бора.Бор имеет только 3 пары электронов на уровне связи, тогда как там будет место для 4 пар. BF 3 описывается как электронодефицитный.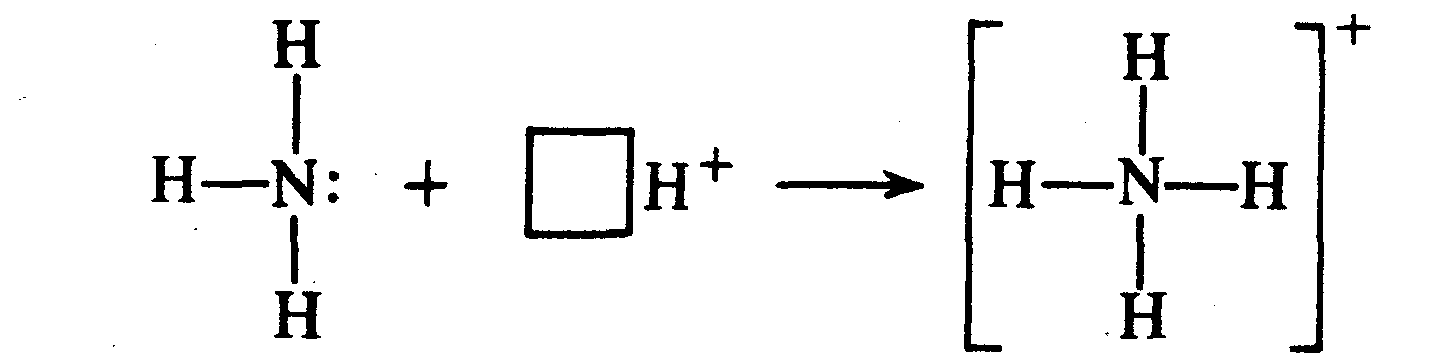
Неподеленная пара на азоте молекулы аммиака может быть использована для преодоления этого недостатка, и образуется соединение с координационной связью.
Используя линии для обозначения облигаций, это можно было бы проще изобразить как:
Вторая диаграмма показывает другой способ, которым вы можете найти координатные связи.Азотный конец связи стал положительным, потому что электронная пара переместилась от азота к бору, который, следовательно, стал отрицательным. Мы больше не будем использовать этот метод — он сбивает с толку больше, чем использование стрелки.
Структура хлорида алюминия
Хлорид алюминия возгоняется (превращается прямо из твердого вещества в газ) примерно при 180 ° C. Если бы он просто содержал ионы, у него была бы очень высокая температура плавления и кипения из-за сильного притяжения между положительными и отрицательными ионами.Подразумевается, что когда он сублимируется при этой относительно низкой температуре, он должен быть ковалентным.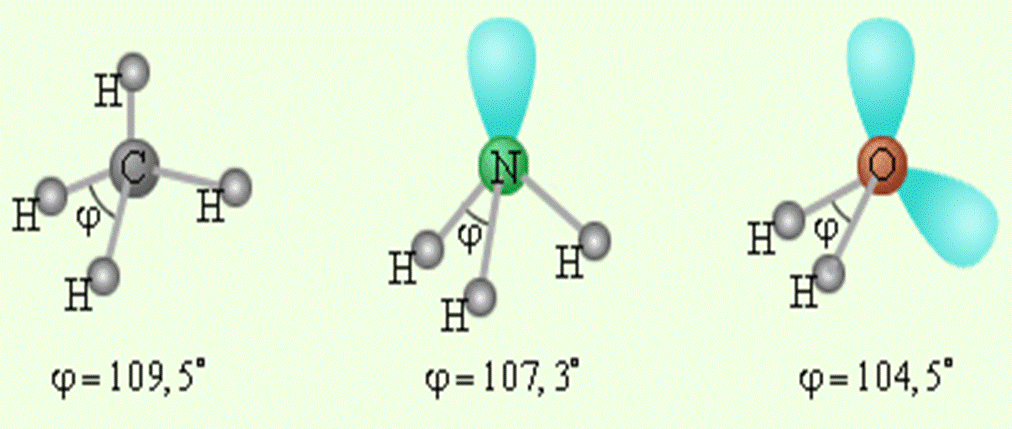 Диаграмма из точек и крестиков показывает только внешние электроны.
Диаграмма из точек и крестиков показывает только внешние электроны.
AlCl 3 , как и BF 3 , электронодефицитный. Вероятно, здесь есть сходство, потому что алюминий и бор находятся в той же группе Периодической таблицы, что и фтор и хлор.
Измерения относительной формульной массы хлорида алюминия показывают, что его формула в паре при температуре сублимации не AlCl 3 , а Al 2 Cl 6 .Он существует в виде димера (две молекулы, соединенные вместе). Связь между двумя молекулами координирована с использованием неподеленных пар на атомах хлора. У каждого атома хлора есть 3 неподеленные пары, но на линейной диаграмме показаны только две важные.
Координатная связь(дательный ковалентный) — Chemistry LibreTexts
Координатная связь (также называемая дативной ковалентной связью) — это ковалентная связь (общая пара электронов), в которой и электронов происходят от одного и того же атома. Ковалентная связь образована двумя атомами, разделяющими пару электронов. Атомы удерживаются вместе, потому что электронная пара притягивается обоими ядрами. При образовании простой ковалентной связи каждый атом снабжает связь одним электроном, но это не обязательно.
Ковалентная связь образована двумя атомами, разделяющими пару электронов. Атомы удерживаются вместе, потому что электронная пара притягивается обоими ядрами. При образовании простой ковалентной связи каждый атом снабжает связь одним электроном, но это не обязательно.
Реакция между аммиаком и хлористым водородом
Если позволить этим бесцветным газам смешаться, образуется густой белый дым твердого хлорида аммония.
Рисунок \ (\ PageIndex {1} \): газовая фаза, кислотно-основная реакция между аммиаком и соляной кислотойРеакция —
\ [\ ce {Nh4 (g) + HCl (g) \ rightarrow Nh5Cl (s)} \ nonumber \]
Ионы аммония, NH 4 + , образуются в результате переноса иона водорода (протона) от молекулы хлористого водорода к неподеленной паре электронов на молекуле аммиака.
Когда образуется ион аммония, NH 4 + , четвертый водород присоединяется посредством дательной ковалентной связи, потому что только ядро водорода передается от хлора к азоту.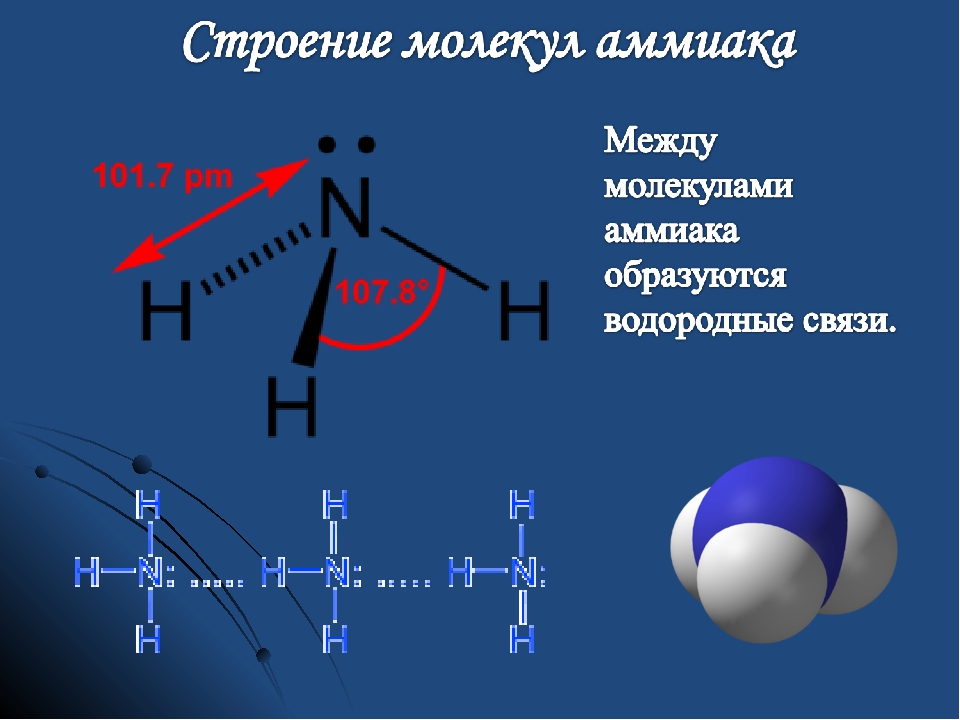 Электрон водорода остается на хлоре, образуя отрицательный ион хлорида. После образования иона аммония невозможно отличить дативную ковалентную связь от обычной ковалентной связи. Хотя электроны на схеме показаны по-разному, в действительности между ними нет никакой разницы.{+} (aq)} \), «\ (\ ce {(aq)} \)» представляет молекулу воды, к которой присоединен ион водорода. Когда он вступает в реакцию с чем-либо (например, с щелочью), ион водорода просто снова отделяется от молекулы воды. Обратите внимание, что как только координационная связь установлена, все атомы водорода, присоединенные к кислороду, в точности эквивалентны. Когда ион водорода снова отрывается, это может быть любой из трех.
Электрон водорода остается на хлоре, образуя отрицательный ион хлорида. После образования иона аммония невозможно отличить дативную ковалентную связь от обычной ковалентной связи. Хотя электроны на схеме показаны по-разному, в действительности между ними нет никакой разницы.{+} (aq)} \), «\ (\ ce {(aq)} \)» представляет молекулу воды, к которой присоединен ион водорода. Когда он вступает в реакцию с чем-либо (например, с щелочью), ион водорода просто снова отделяется от молекулы воды. Обратите внимание, что как только координационная связь установлена, все атомы водорода, присоединенные к кислороду, в точности эквивалентны. Когда ион водорода снова отрывается, это может быть любой из трех.
Взаимодействие аммиака и трифторида бора
Трифторид бора — это соединение, которое не имеет структуры благородного газа вокруг атома бора (печально известный «нарушитель октетов»).Бор имеет только три пары электронов на уровне связи, тогда как там будет место для четырех пар. \ (BF_3 \) описывается как электронодефицитный.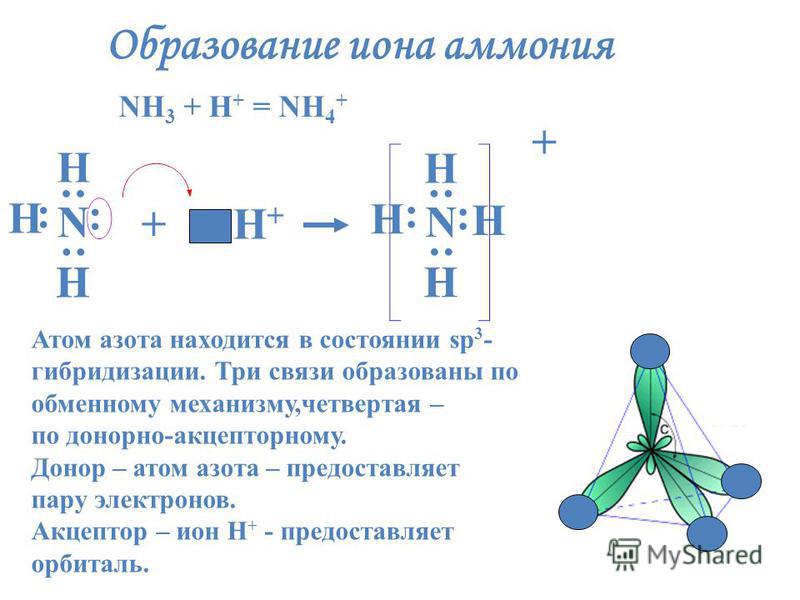 Неподеленная пара на азоте молекулы аммиака может быть использована для преодоления этого недостатка, и образуется соединение, включающее координационную связь.
Неподеленная пара на азоте молекулы аммиака может быть использована для преодоления этого недостатка, и образуется соединение, включающее координационную связь.
Используя линии для обозначения облигаций, это можно было бы проще изобразить как:
На второй диаграмме показан еще один способ рисования координатных связей.Азотный конец связи стал положительным, потому что электронная пара переместилась от азота к бору, который, следовательно, стал отрицательным. Мы больше не будем использовать этот метод — он запутывает больше, чем просто использование стрелки.
Структура хлорида алюминия
Хлорид алюминия возгоняется (фазовый переход от твердого состояния к газу) примерно при 180 ° C. Если бы он просто содержал ионы, у него была бы очень высокая температура плавления и кипения из-за сильного притяжения между положительными и отрицательными ионами.Подразумевается, что когда он сублимируется при этой относительно низкой температуре, он должен быть ковалентным.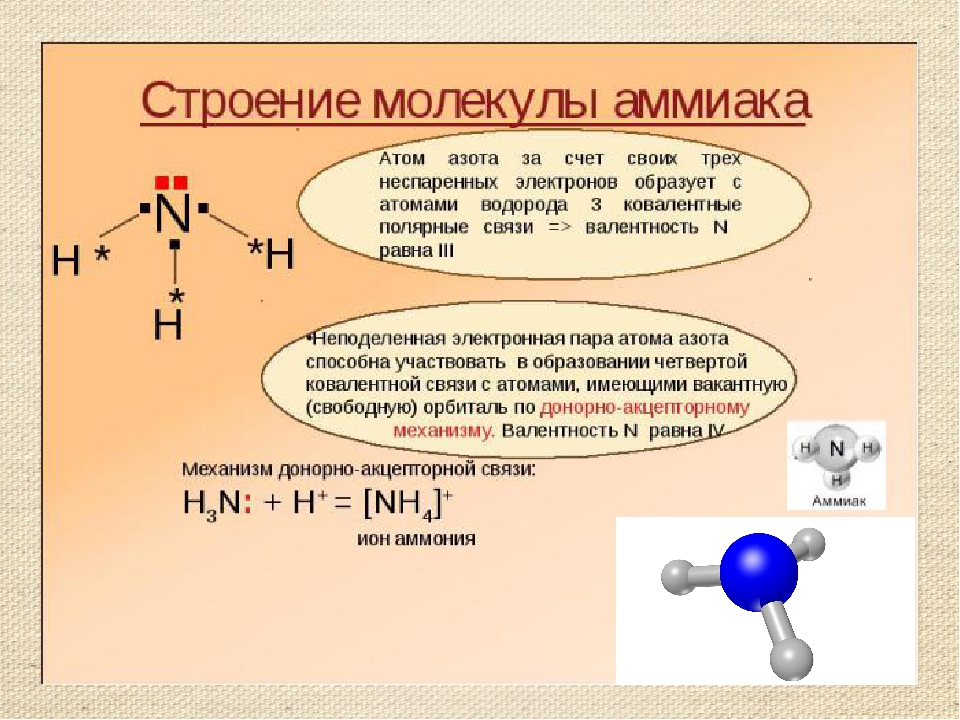 Диаграмма из точек и крестиков показывает только внешние электроны.
Диаграмма из точек и крестиков показывает только внешние электроны.
Точечная диаграмма Льюиса для \ (AlCl_3 \)
AlCl 3 , как и BF 3 , электронодефицитный. Вероятно, есть сходство, потому что алюминий и бор находятся в той же группе Периодической таблицы, как фтор и хлор.
Измерения относительной формульной массы хлорида алюминия показывают, что его формула в паре при температуре сублимации не AlCl 3 , а Al 2 Cl 6 .Он существует в виде димера (две молекулы, соединенные вместе). Связь между двумя молекулами является координационной с использованием неподеленных пар на атомах хлора. У каждого атома хлора есть 3 неподеленные пары, но на линейной диаграмме показаны только две важные.
Неинтересные электроны на хлоринах были выцветшими, чтобы лучше видны координационные связи. В этих двух отдельных одиноких парах нет ничего особенного — они просто указывают в правильном направлении.
Энергия высвобождается при образовании двух координатных связей, поэтому димер более энергетически стабилен, чем две отдельные молекулы AlCl 3 .
Связывание в гидратированных ионах металлов
Молекулы воды сильно притягиваются к ионам в растворе — молекулы воды группируются вокруг положительных или отрицательных ионов. Во многих случаях притяжение настолько велико, что возникают формальные связи, и это верно почти для всех положительных ионов металлов. Ионы с присоединенными молекулами воды описываются как гидратированные ионы.
Хотя хлорид алюминия является ковалентным соединением, при растворении в воде образуются ионы. Шесть молекул воды связываются с алюминием с образованием иона с формулой Al (H 2 O) 6 3+ . Он называется комплексным ионом гексаакваалюминия с шестью («гекса») молекулами воды («вода»), обернутыми вокруг иона алюминия. Связь в этом (и подобных ионах, образованных подавляющим большинством других металлов) является координационной (дательный ковалентный) с использованием неподеленных пар на молекулах воды.
Электронная конфигурация алюминия 1s 2 2s 2 2p 6 3s 2 3p x 1 . Когда он образует ион Al 3 + , он теряет трехуровневые электроны и оставляет 1s 2 2s 2 2p 6 . Это означает, что все трехуровневые орбитали теперь пусты. Алюминий реорганизует (гибридизирует) шесть из них (3s, три 3p и две 3d), чтобы произвести шесть новых орбиталей с одинаковой энергией.Эти шесть гибридных орбиталей принимают неподеленные пары от шести молекул воды.
Вы можете задаться вопросом, почему он предпочитает использовать шесть орбиталей, а не четыре, восемь или что-то еще. Шесть — это максимальное количество молекул воды, которое может поместиться вокруг иона алюминия (и большинства ионов других металлов). Создавая максимальное количество связей, он высвобождает больше энергии и является наиболее энергетически стабильным.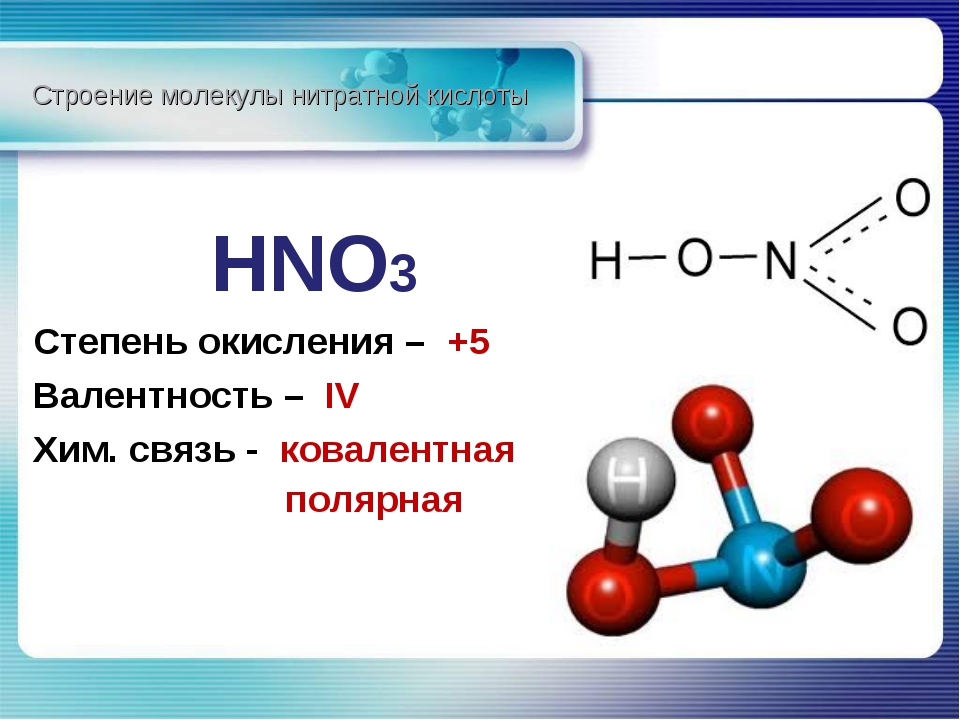
На каждой молекуле воды показана только одна неподеленная пара. Другая неподеленная пара направлена в сторону от алюминия и поэтому не участвует в склейке.Полученный ион выглядит так:
Из-за движения электронов к центру иона заряд 3+ больше не располагается полностью на алюминии, а распространяется по всему иону.
Пунктирные стрелки представляют собой неподеленные пары, исходящие от молекул воды за плоскостью экрана или бумаги. Стрелки в форме клина обозначают связи молекул воды перед плоскостью экрана или бумаги.
Пример \ (\ PageIndex {2} \): Окись углерода
Окись углерода, CO, может рассматриваться как имеющая две обычные ковалентные связи между углеродом и кислородом плюс координационная связь с использованием неподеленной пары на атоме кислорода.
Пример \ (\ PageIndex {3} \): азотная кислота
В азотной кислоте, HNO 3 , один из атомов кислорода можно представить как присоединенный к азоту через координационную связь с использованием неподеленной пары на атоме азота.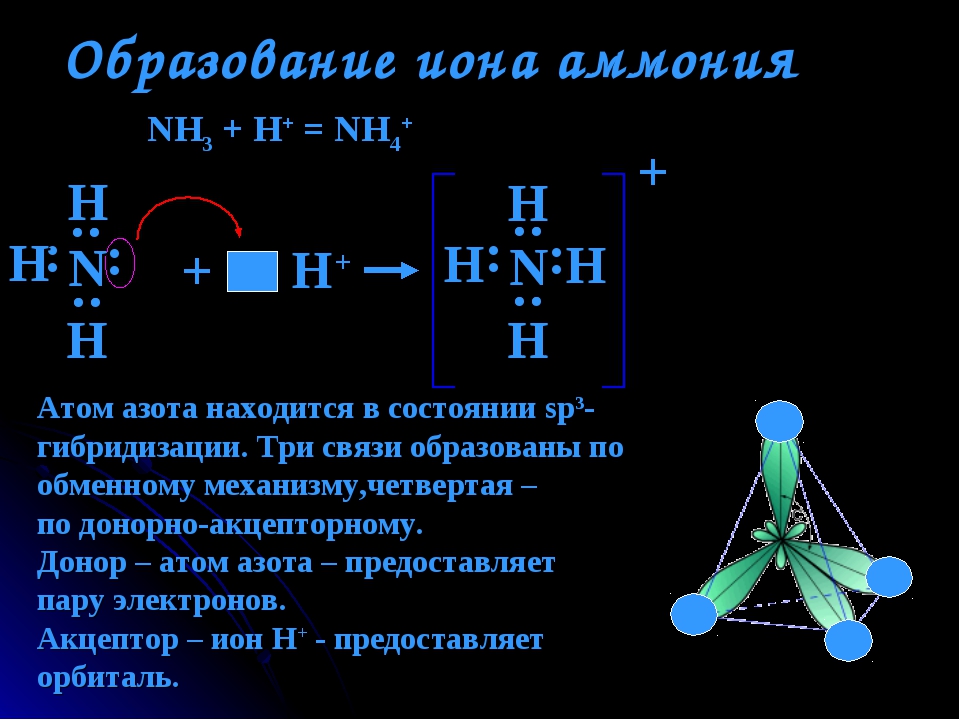
На самом деле эта структура вводит в заблуждение, поскольку предполагает, что два атома кислорода в правой части диаграммы соединены с азотом по-разному. Обе связи фактически идентичны по длине и силе, поэтому расположение электронов должно быть идентичным.Невозможно показать это с помощью изображения с точками и крестиками. Связь включает делокализацию.
Авторы и авторство
1.4 Представление структуры
Структуры Льюиса представляют валентные электроны атома точками. Используя структуры Льюиса, можно определить, обладают ли какие-либо атомы электронами из неподеленной пары или имеют формальный заряд. Например, вода и гидроксид-ион могут быть представлены структурами Льюиса, как показано ниже.
Валентные электроны, не используемые в связывании, называются несвязывающими электронами или электронами неподеленной пары. Положительный или отрицательный заряд, присвоенный атому, называется формальным зарядом; Молекула воды не имеет формального заряда, но атом кислорода в гидроксид-ионе имеет формальный заряд -1.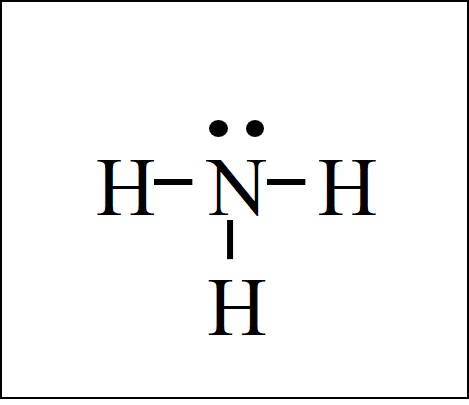
Азот имеет пять валентных электронов, и ниже показаны структуры Льюиса аммиака, иона аммония и аниона амида. Ион аммония имеет формальный заряд +1, а амид-анион имеет формальный заряд -1.
Углерод имеет четыре валентных электрона, и структуры Льюиса метана, метильного катиона, метильного аниона и метильного радикала показаны ниже.
Вид, содержащий положительно заряженный атом углерода, называется карбокатионом , а вид, содержащий отрицательно заряженный атом углерода, называется карбанионом . Вид, содержащий атом с одним неспаренным электроном, называется радикалом или свободным радикалом .
Водород имеет один валентный электрон, а каждый галоген (F, Cl, Br, I) имеет семь валентных электронов, поэтому следующие разновидности имеют указанные формальные заряды:
Пара общих электронов также может быть показана как линия между двумя атомами. Водород имеет одну ковалентную связь и не имеет неподеленной пары. Галогены имеют одну ковалентную связь и три неподеленные пары. Кислород воды имеет две ковалентные связи и две неподеленные пары. Азот аммиака имеет три ковалентные связи и одну неподеленную пару.У каждого атома есть полный октет, кроме водорода, который полностью заполнил внешнюю оболочку.
Водород имеет одну ковалентную связь и не имеет неподеленной пары. Галогены имеют одну ковалентную связь и три неподеленные пары. Кислород воды имеет две ковалентные связи и две неподеленные пары. Азот аммиака имеет три ковалентные связи и одну неподеленную пару.У каждого атома есть полный октет, кроме водорода, который полностью заполнил внешнюю оболочку.
Структуры Кекуле представляют связывающие электроны в виде линий, а электроны неподеленной пары обычно полностью не учитываются, если только они не нужны для построения механизма химической реакции.
Иногда некоторые ковалентные связи в структуре соединения опускаются для упрощения. Эти типы структур называются конденсированными структурами .
Является ли (nh5) 2so4 ионной или ковалентной связью?
Является ли (nh5) 2so4 ионной или ковалентной связью? Вопрос: Является ли (nh5) 2so4 ионной или ковалентной связью?Ответ: (nh5) 2so4 ( сульфат аммония) ионная связь
Что такое химическая связь, ионная связь, ковалентная связь?
Химическая связь
Химическая связь — это длительное притяжение между атомами, ионами или молекулами, которое позволяет образовывать химические соединения.
 Связь может быть результатом электростатической силы притяжения между противоположно заряженными ионами, как в ионных связях; или через обмен электронами, как в ковалентных связях.
Связь может быть результатом электростатической силы притяжения между противоположно заряженными ионами, как в ионных связях; или через обмен электронами, как в ковалентных связях. https://en.wikipedia.org/wiki/Chemical_bond
Ионная связь
Ионная связь — это тип химической связи, которая включает электростатическое притяжение между противоположно заряженными ионами и является основным взаимодействием, происходящим в ионных соединениях. . Ионы — это атомы, которые приобрели один или несколько электронов (известные как анионы, которые имеют отрицательный заряд), и атомы, которые потеряли один или несколько электронов (известные как катионы, которые имеют положительный заряд).
https://en.wikipedia.org/wiki/Ionic_bonding
Ковалентная связь
Ковалентная связь, также называемая молекулярной связью, представляет собой химическую связь, которая включает обмен электронными парами между атомами. Эти электронные пары известны как общие пары или связывающие пары, а стабильный баланс сил притяжения и отталкивания между атомами, когда они разделяют электроны, известен как ковалентная связь.

https://en.wikipedia.org/wiki/Covalent_bond
ПЕРЕЧЕНЬ IONIC
MgF2
Rb2O
BaCl2
LiF
CaF2
Mg3N2
CaBr2
NaO3 CuO3
CaO3 9050 Al 9050 BaO3
CaO3 9050 KF50
SrO
Na2S
Nh5NO3
K2S
NaHCO3
MgBr2
RbCl
гипохлорит натрия
MgSO 4
CaSO4
оксида бария
NaBr
KCl
Na2O
Nh5Cl
NaI
калия йодида
Al2S3
К.И.
FeCl3
NaOH
K3PO4
магния нитрид
сульфат натрия
Na3PO4
K2O
BaS
сульфид алюминия
карбонат натрия
SrCl2
нитрат кальция
KOH
KNO3
agno3
CaS
CaCl2
kbr2
оксид магния
CSO2
сульфат магния
KSO2
сульфат магния
KSO2 хлорид калия
бромид аммония
фосфат серебра
libr
Li2O
CuSO4
(nh5) 2so4 9035 0 сульфат аммония
FeSO4
йодид магния
сульфат алюминия
бикарбонат натрия
оксид натрия
хлорид кальция
Nh5
йодид натрия
AgCl
гидроксид аммония
MgO
нитрат аммония
лицил калия
карбонат калия
кмно4 бикарбонат калия
NaNh3
Nh5OH
CsF
бромид натрия
оксид алюминия
медь
нитрат калия
NO3-1
йодистый водород
MnO2
NaF
гидроксид натрия
na
оксид кальция
оксид магния
фторид железа
фторид железа
фосфорная кислота
оксид железа
alf3
хлорид магния
нах
хлорид аммония
хлорид серебра
пищевая сода
хлорид лития
магний
фторид натрия
фторид лития
лих хлорид алюминия
bef3
Litium CO ЛОР-СВЯЗЬ / МОЛЕКУЛЯРНАЯ СВЯЗЬ
Ch4OH
SCl2
CS2
CF4
NF3
NO
icl
PCL3
PBr3
Cl2
clo2
NCl3
O2
SiO3
HBr HBr HBr
SiO3 HBr масло
Nh4
NO2
Ch5
h3S
этанол
PCl5
пятиокись азота
N2O5
CCL4
P4
треххлористый фосфор
трехокись азота
C6h22O3
метанол
CH450 углекислый газ пентахлорид фосфора
SO2
P2O5
SiF4
Ph4
азота трибромид
кремния тетрафторид
метана
четыреххлористый углерод
двуокись азота
Br2
хай
P4O10
h3
С6Н6
декстрозы
TiBr4
глицерина
Н2О2
нафталин
h3SO3
XeF4
толуол
аспирин
ацетон
h3SO4
SiC l4
бензойная кислота
CO
стеариновая кислота
CO2
азот
дистиллированная вода
FCl
BCl3
бромистоводородная кислота
диоксид кремния
SO3
N2O
фруктоза
салициловая кислота
c12h32450 азот
салициловая
N2O4 HCN
циклогексан
пятиокись фосфора
перекись водорода
i2
C2h5
лимонная кислота
h3o2
парафиновый воск
gacl3
Ch4Ch4
уксус
HF3
хлор бромид
OF350 OF350 хлор бромистого водорода
OF350 PFO3
хлор бромид
PF3
s8
монооксид углерода
тетрахлорид кремния
f2
диоксид титана
бромистый азот
кукурузный крахмал
серная кислота
кислород
аммиак
соляная кислота
hcl
h3o
AlCl3
фторхлорид
хлорид алюминия
водород
AlCl3
хлорид алюминия
Содержит как (ионный, так и ковалентный)
ацетат натрия
Caco3
BaSO4
na2so4
нитрат магния
карбонат кальция
AlBr3
Мы получаем ответы от
Ресурсы
www.
 quora.com
quora.com answers.yahoo.com
answers.com
www.quia.com
quizlet.com
www.reference.com
socratic.org
https://en.wikipedia.org
https: // en. wikipedia.org/wiki/Ionic_bonding
https://en.wikipedia.org/wiki/Covalent_bond
https://en.wikipedia.org/wiki/Chemical_bond
pubchem.ncbi.nlm.nih.gov
Если ответ неверный. Прокомментируйте ниже или свяжитесь с нами.
Вопрос: Является ли (nh5) 2so4 ( сульфат аммония) ионной или ковалентной связью ?
Ответ: (nh5) 2so4 ( сульфат аммония) ионная связь Ионный или ковалентный
Какой тип связи присутствует в левой Nh5 правой 2CO3 химии класса 11 CBSE
Подсказка: Ионная связь включает силу притяжения между противоположными зарядами.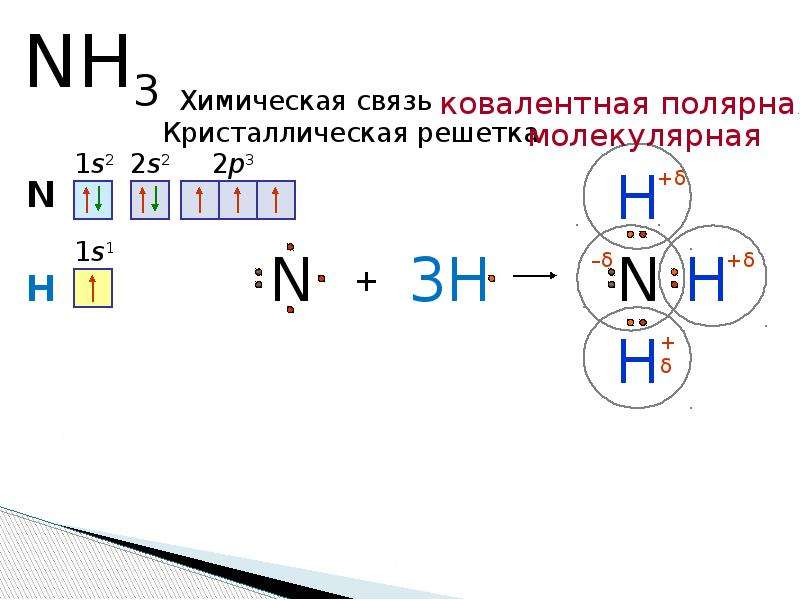 {+}} \ right) $ и образует ион аммония.
{+}} \ right) $ и образует ион аммония.Следовательно, в карбонате аммония присутствуют все три связи.
Итак, правильный ответ — «Вариант А».
Примечание: Карбонат аммония легко разлагается до газообразного аммиака и диоксида углерода при нагревании.
— Он также известен как пекарский аммиак и был предшественником более современных разрыхлителей, пищевой соды и разрыхлителя. Он также используется как разрыхлитель.
Вы в одном шаге от ответа!
Подпишитесь бесплатно!
Регистрируясь, вы также получаете доступ к тысячам решенных вопросов, викторин
и загружаемым PDF-файлам БЕСПЛАТНО!
AS Химическая координата или дательное ковалентное связывание Nh5 + Al2Cl6 CO h4O +
Презентация на тему: «Химическая координата AS или дательное ковалентное связывание Nh5 + Al2Cl6 CO h4O +» — стенограмма презентации:
1 Химическая координата AS или дательное ковалентное связывание Nh5 + Al2Cl6 CO h4O +
2 Нарисуйте точечную и крестообразную диаграмму, чтобы показать, как Nh4 связывается с H +, образуя Nh5 +
3 Ион аммония: Nh5 +. H N + H + H + N H Nh4 + H + Nh5 +
H N + H + H + N H Nh4 + H + Nh5 +
Что необычного в образующейся ковалентной связи?
4 Координатная (дательная ковалентная) связь
= ковалентная связь, образованная, когда оба общих электрона обеспечиваются только одним атомом. Общая электронная пара происходит от неподеленной пары на донорном атоме, например N из Nh4, O из h3O. Атом, принимающий неподеленную пару, должен иметь неполный внешний энергетический уровень, например, H +, Al в AlCl3, C в CO
5 (отличается только способ формирования).
Дативные физически и химически идентичны обычным ковалентным связям (отличается только способ образования). Представлен X: Y вместо X Y
6 Нарисуйте точечную и поперечную диаграмму, чтобы показать соединение в h4O +
7 Ион гидроксония: h4O +. . . H O + H + . . H O +
. . H O + H + . . H O +
Почему маловероятно образование h5O2 + из h4O +?
8 h5O2 + вряд ли образуется через вторую неподеленную пару, потому что;
второй H + отталкивается от h4O +
9 Нарисуйте точечную и поперечную диаграмму, чтобы показать связь в димере Al2Cl6
10 Димер хлорида алюминия, Al2Cl6
.Cl Al Al2Cl6
11 Нарисуйте точечную и поперечную диаграмму, чтобы показать связь в монооксиде углерода CO
12 C O N Окись углерода, CO Изоэлектроника с N2:
Что означает изоэлектроника?
13 Почему Nh4 легко реагирует с BF3 с образованием стабильного соединения?
14 . N B H F N Nh4 имеет неподеленную пару на атоме N.
N B H F N Nh4 имеет неподеленную пару на атоме N.
Атом B в BF3 имеет неполный энергетический уровень и может образовывать дативную связь с атомом N. . H N F B ВСЕ атомы теперь имеют конфигурацию благородного газа 14
15 Конец
Является ли фосфат аммония ((Nh5) 3PO4) ионной или ковалентной связью?
Связь фосфата аммония ((Nh5) 3PO4) ионная или ковалентная?Фосфат аммония ((Nh5) 3PO4) is Ionic
Я расскажу вам список ионных или ковалентных связей ниже.
Если вы хотите быстро найти слово, которое хотите найти, используйте Ctrl + F, затем введите слово, которое хотите найти.
Список ионных или ковалентных связей
| СПИСОК IONIC | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| (Nh5) 2CO3 | Ионный | ||||||||||
| (nh5) 2so4 | 9025(nh5) 2so4 | 9025agno3 | Ионный | ||||||||
| Al2 (CO3) 3 (Карбонат алюминия) | Ионный | ||||||||||
| Al2O3 | Ионный | ||||||||||
| Al2S3 | |||||||||||
| Al2S3 | Алюминий | Гидроксид | 908 (Al (OH) 3)Ионный | ||||||||
| Нитрат алюминия | Ионный | ||||||||||
| оксид алюминия | Ионный | ||||||||||
| сульфат алюминия | Ионный | ||||||||||
| сульфид алюминия | |||||||||||
| ионный | |||||||||||
| бромид аммония | ионный | ||||||||||
| Карбонат аммония ((Nh5) 2CO3) | Ионный | ||||||||||
| хлорид аммония | Ионный | ||||||||||
| гидроксид аммония | Ионный | ||||||||||
| Фосфат аммония | |||||||||||
| 8 Нитрат аммония | 8 ) 3PO4) | Ионный | |||||||||
| сульфат аммония | Ионный | ||||||||||
| Ba (ClO4) 2 | Ионный | ||||||||||
| Ba (OH) 2 | Ионный | ||||||||||
| пищевая сода | Ионная | ||||||||||
| BaO | Ионная | ||||||||||
| Бромид бария (BaBr2) | Ионный | ||||||||||
| Бромид бария | |||||||||||
| Бромид бария (BaBr2 Ionic8 | Фторид бария | Ионный | |||||||||
| Гидроксид бария (Ba (OH) 2) | Ионный | ||||||||||
| Нитрат бария (Ba (NO3) 2) | Ионный | ||||||||||
| оксид бария | Ионный | ||||||||||
| Сульфат бария | Ионный | Сульфат бария | Ионный | Сульфат бария | |||||||
| bef2 | Ионный | ||||||||||
| Оксид бериллия (BeO) | Ионный | ||||||||||
| отбеливатель | Ионный | ||||||||||
| Ca (NO3) 2 | Ca (NO3) 2 | Ca (NO3) 2 | Ca (NO3) 2 | Гидроксид) | Ионный | ||||||
| Ca3 (PO4) 2 (трикальцийфосфат) | Ионный | ||||||||||
| CaBr2 (бромид кальция) | Ионный | ||||||||||
| CaCl2 | 908|||||||||||
| cah3 | Ионный | ||||||||||
| CaI2 | Ионный | ||||||||||
| Ацетат кальция (Ca (C2h4O2) 2) | Ионный | ||||||||||
| Хлорид кальция | Ионный | ||||||||||
| Фторид кальция | Ионный | ||||||||||
| Нитрат кальция | Ионный | ||||||||||
| 8 оксид кальция Ionic | 908|||||||||||
| Сульфид кальция (CaS) | Ионный | ||||||||||
| CaO | Ионный | ||||||||||
| CaS | Ионный | ||||||||||
| СаСО4 | Ионный | Conic | |||||||||
| Хром (III) Фторид (CrF3) | Ионный | ||||||||||
| Нитрат кобальта (II) | Ионный | ||||||||||
| CoCl2 | Ионный | ||||||||||
| Медь II | ) Сульфид)Ионный | ||||||||||
| CsBr (бромид цезия) | Ионный | ||||||||||
| CsCl (хлорид цезия) | Ионный | ||||||||||
| CsF (фторид цезия) | Ионный | ||||||||||
| CsI (иодид цезия) | Ионный | ||||||||||
| CuCl (хлорид меди (I)) | Ионный | ||||||||||
| CuCl2 | Ионный | ||||||||||
| CuO | Ионный | ||||||||||
| CuSO4 908 | Ионный | ||||||||||
| Fe2O3 | Ионный | ||||||||||
| FeCl3 | Ионный | ||||||||||
| FeCO3 (Карбонат железа (II)) | Ионный | ||||||||||
| Ионный | |||||||||||
| Иодистый водород | Ионный | ||||||||||
| Хлорид железа (II) (FeCl2) | 9 0824 Ионный|||||||||||
| Бромид железа (III) (FeBr3) | Ионный | ||||||||||
| железо iii | Ионный | ||||||||||
| Оксид железа III | |||||||||||
| Ионный | |||||||||||
| K2O | Ионический | ||||||||||
| K2S | Ионный | ||||||||||
| K2SO4 | Ионный | ||||||||||
| K3PO24 908 | K2SO4 | Ионный | |||||||||
| K3PO24 908 Ионный | |||||||||||
| KF | Ионный | ||||||||||
| KI | Ионный | ||||||||||
| Kl | Ионный | ||||||||||
| kmno4 | Ионный | ||||||||||
| kmno4 | Ionic | ||||||||||
| Сульфат свинца (II) (PbSO4) | Ионный | ||||||||||
| Сульфид свинца (II) (PbS) | Ионный | ||||||||||
| Li2O (оксид лития) | Ионный | ||||||||||
| libr (бромид лития) | Ионный | Ионный | литий-ионный | литий-ионный | Ионный | ||||||
| литий хлорид алюминия | Ионный | ||||||||||
| LiI (иодид лития) | Ионный | ||||||||||
| ацетат лития | Карбонатный | литий | Ионный | 908 хлорид литияИонный | |||||||
| фторид лития | Ионный | ||||||||||
| Гидроксид лития (LiOH) | Ионный | ||||||||||
| Нитрат лития (LiNO3) | Нитрат лития (LiNO3) | хлорид магния | Ионный | ||||||||
| магн. йодид езия | Ионный | ||||||||||
| нитрид магния | Ионный | ||||||||||
| оксид магния | Ионный | ||||||||||
| Фосфат магния (Mg3 (PO4) 2) | Ионный сульфат магния | Ионный | |||||||||
| мг | Ионный | ||||||||||
| Mg (NO3) 2 | Ионный | ||||||||||
| Mg3N2 | Ионный | ||||||||||
| MgBr2 (бромистый магний) 16 | MgBr2 (бромид магния) | 902 MgF2Ионный | |||||||||
| MgO | Ионный | ||||||||||
| MgS (сульфид магния) | Ионный | ||||||||||
| MgSO4 | Ионный | MgSO4 | MgO16 | Mg | |||||||
| Na2CO3 | Ионный | ||||||||||
| Na2O | Ионный | ||||||||||
| Na2S | Ионный | ||||||||||
| Na3PO4 | Ионный | ||||||||||
| NaBr | Ионный | ||||||||||
| NaClonic | |||||||||||
| n | |||||||||||
| nahco3 (гидрокарбонат натрия) | Ионный | ||||||||||
| NaI | Ионный | ||||||||||
| NaNh3 | Ионический | ||||||||||
| NaNO3 9024 | |||||||||||
| NaNO3 9024 NaNO3 9025 | NaNO3 (натрий 9025|||||||||||
| NaOH | Ионный | ||||||||||
| Nh5 | Ионический | ||||||||||
| Nh5Cl | Ионный | ||||||||||
| Nh5ClO3 | |||||||||||
| Nh5ClO3 | Ионный | Nh5ClO3Ионный | Nh5ClO3Ионный | Ионный||||||||
| Nh5NO3 9082 5 | Ионный | ||||||||||
| Nh5OH | Ионный | ||||||||||
| NiCl2 (Хлорид никеля (II)) | Ионный | ||||||||||
| no3 | Ионный | фосфорный||||||||||
| Ионный | |||||||||||
| Ацетат калия (KC2h4O2) | Ионный | ||||||||||
| Бромид калия | Ионный | ||||||||||
| Ионный калий 9025 | 908 Ионный хлорид | 908 | |||||||||
| Хромат калия (K2CrO4) | Ионный | ||||||||||
| Цианид калия (KCN) | Ионный | ||||||||||
| Дихромат калия (K2Cr2O7) | Ионный | Иодный | Иодный | Ионный | Ионный | ||||||
| оксид калия 9082 5 | Ионный | ||||||||||
| Фосфат калия (K3PO4) | Ионный | ||||||||||
| Rb2O | Ионный | ||||||||||
| RbCl | Рубиновый | RbCl | Ионный | S-образная соль S-образной кислоты Ионный | |||||||
| хлорид серебра | Ионный | ||||||||||
| фосфат серебра | Ионный | ||||||||||
| натрий-алюминийфосфат | Ионный | ||||||||||
| бикарбонат натрия | |||||||||||
| бикарбонат натрия 6 | бикарбонат натрия 6 | бромид натрия | Ионный | ||||||||
| карбонат натрия | Ионный | ||||||||||
| Хлорид натрия | Ионный | ||||||||||
| цитрат натрия | Ионный | фтористый натрий | 0824 Ионный | ||||||||
| гипохлорит натрия | Ионный | ||||||||||
| Иодид натрия | Ионный | ||||||||||
| оксид натрия | Ионный | ||||||||||
| Сульфат натрия 9025 | |||||||||||
| сульфат натрия | SrCl2 (хлорид стронция) | Ионный | |||||||||
| SrO (оксид стронция) | Ионный | ||||||||||
| Фторид стронция (SrF2) | Ионный | Ионный | Iод гексафторид | Ионный | |||||||
| V2S3 (Сульфид ванадия (III)) | Ионный | ||||||||||
| Бромид цинка (ZnBr2) | Ионный | ||||||||||
| 6 Iod824 | |||||||||||
| ZnIod824 | |||||||||||
| ПЕРЕЧЕНЬ КОВАЛЕНТНАЯ СВЯЗЬ | |||||||||||
| уксусная кислота | Ковалентная связь | ||||||||||
| ацетон | Ковалентная связь | ||||||||||
| AlCl3 | Ковалентная связь | ||||||||||
| карбид алюминия 9024 ) | Ковалентная связь | ||||||||||
| Хлорид алюминия | Ковалентная связь | ||||||||||
| аммиак | Ковалентная связь | ||||||||||
| аспирин | Ковалентная связь | B824 908 Covale | |||||||||
| бекл2 (хлорид бериллия) | Ковалентная связь | ||||||||||
| бензойная кислота | Ковалентная связь | ||||||||||
| bf3 (трифторид бора) | |||||||||||
| трехвалентная связь бора | |||||||||||
| Ковалентная связь | |||||||||||
| Ковалентная связь 908 0816 | Br2 | Ковалентная связь | |||||||||
| BrCl | Ковалентная связь | ||||||||||
| BrCl | Ковалентная связь | ||||||||||
| brf | Ковалентная связь | bb Ковалентная связь | |||||||||
| c12h32o11 | Ковалентная связь | ||||||||||
| C2h5 | Ковалентная связь | ||||||||||
| c2h5oh | Ковалентная связь | ||||||||||
| c2h5oh | Ковалентная связь | Cov | Cov | Cov | 908 Cov0825 | 908 248 | |||||
| C6H6 | Ковалентная связь | ||||||||||
| диоксид углерода | Ковалентная связь | ||||||||||
| монооксид углерода | Ковалентная связь | ||||||||||
| четыреххлористый углерод | C | 908 четыреххлористый углерод | C 908 четыреххлористый углерод | 908 связь | |||||||
| CBr4 | Ковалентная связь | ||||||||||
| CCl | Ковалентная связь | ||||||||||
| CCL4 | Ковалентная связь | ||||||||||
| CF4 | CovalentCF4 | Covale Ch4Ch4Ковалентная связь | |||||||||
| Ch4COOH (уксусная кислота) | Ковалентная связь | ||||||||||
| ch4li | Ковалентная связь | ||||||||||
| Ch4Nh3 908 | Ch4Nh3 | Covalent 908 Cov16 | Ковалентная связь | ||||||||
| ch5o | Ковалентная связь | ||||||||||
| CHCl3 | Ковалентная связь | ||||||||||
| хлор | Ковалентная связь | Covвалентная связь 908 Citric25 | Cl 908 16Cl2O (дихлор монооксид) | Ковалентная связь | |||||||
| clf | Ковалентная связь | ||||||||||
| clo2 | Ковалентная связь | ||||||||||
| CO | CO | кукурузный крахмал | Ковалентная связь | ||||||||
| CS2 | Ковалентная связь | ||||||||||
| циклогексан | Ковалентная связь | ||||||||||
| декстроза | Ковалентная связь | Динокс | Динокс | Ковалентная связь | |||||||
| Пятиоксид диазота | Ковалентная связь | ||||||||||
| Триоксид диазота | Ковалентная связь | ||||||||||
| дистиллированная вода | Ковалентная связь | ||||||||||
| 8 Ковалентная связь | |||||||||||
| 8 825 | Ковалентная связь | ||||||||||
| FCl | Ковалентная связь | ||||||||||
| FeO | Ковалентная связь | ||||||||||
| фруктоза | Ковалентная связь | ||||||||||
| глюкалентная связь | глюкоза | ||||||||||
| глицерин | Ковалентная связь | ||||||||||
| графит | Ковалентная связь | ||||||||||
| h3 | Ковалентная связь | ||||||||||
| h30 | Ковалентная связь | ||||||||||
| h3S | Ковалентная связь | ||||||||||
| h3SO3 | Ковалентная связь | ||||||||||
| h3SO4 | Ковалентная связь | 908 HBO2 908 HB24 908 HB24 908 HBO2 908 HB2 908 248 HBO2 | 908 16hcl | Ковалентная связь | |||||||
| гексан (C6h24) | Ковалентная связь | ||||||||||
| hf (плавиковая кислота) | Ковалентная связь | ||||||||||
| hi | |||||||||||
| hi-кислота | Ковалентная связь | ||||||||||
| Бромистоводородная кислота | Ковалентная связь | ||||||||||
| соляная кислота | Ковалентная связь | ||||||||||
| бромистый водород | Ковалентная связь фторсодержащая | ||||||||||
| Хлорид водорода | 8 | Ковалентная связь | |||||||||
| перекись водорода | Ковалентная связь | ||||||||||
| сероводород | Ковалентная связь | ||||||||||
| i2 | Ковалентная связь | Ковалентная связь | icl816824 908 pFluent ) 90 825Ковалентная связь | ||||||||
| йод | Ковалентная связь | ||||||||||
| изопропиловый спирт (C3H8O) | Ковалентная связь | ||||||||||
| Металл с молочной связью (C3H6O3 | |||||||||||
| метан | Ковалентная связь | ||||||||||
| метанол | Ковалентная связь | ||||||||||
| N2 | Ковалентная связь | ||||||||||
| N2O | Ковалентная связь 902 | N | 908 Ковалентная связь | ||||||||
| N2O4 HCN | Ковалентная связь | ||||||||||
| N2O5 | Ковалентная связь | ||||||||||
| нафталин | Ковалентная связь N2O5 | Covalent | 908 Coval | ||||||||
| NF3 | Ковалентная связь | ||||||||||
| Nh4 | Ковалентная связь | ||||||||||
| NI3 (трииодид азота) | Ковалентная связь | ||||||||||
| азотная кислота | бромид азота | Ковалентная связь | |||||||||
| диоксид азота | Ковалентная связь | ||||||||||
| Трибромид азота | Ковалентная связь | ||||||||||
| треххлористый азот | Ковалентная связь | ||||||||||
| Ковалентная связь | |||||||||||
| NO2 | Ковалентная связь | ||||||||||
| O2 | Ковалентная связь | ||||||||||
| OCl2 | Ковалентная дифторная связь | ||||||||||
| OF825 824 кислород | Ковалентная связь | ||||||||||
| озон (O3) | Ковалентная связь | ||||||||||
| P2O5 | Ковалентная связь | ||||||||||
| P4 | Ковалентная связь | ||||||||||
| Covalent | |||||||||||
| Covalent | воск | Ковалентная связь | |||||||||
| PBr3 (Трибромид фосфора) | Ковалентная связь | ||||||||||
| PCL3 | Ковалентная связь | ||||||||||
| PCl5 | |||||||||||
| Ковалентная связь PCl5 | Ковалентная связь 908 Pv. | Ковалентная связь | |||||||||
| Пентахлорид фосфора | Ковалентная связь | ||||||||||
| Пентоксид фосфора | Ковалентная связь | ||||||||||
| Треххлористая связь фосфора | Треххлористая связь фосфора | Треххлористая связь фосфора | Ковалентная связь C | Covalent 908 824 PO4 (фосфат) | Ковалентная связь | ||||||
| многоатомные ионы | Ковалентная связь | ||||||||||
| полиэтилен | Ковалентная связь | ||||||||||
| пиридоксина гидрохлорид | салициловая кислота | Ковалентная связь | |||||||||
| SCl2 | Ковалентная связь | ||||||||||
| SCl4 (четыреххлористая сера) | Ковалентная связь | ||||||||||
| диоксида углерода | диоксид C | Связь | |||||||||
| SF6 | Ковалентная связь | ||||||||||
| SiCl4 | Ковалентная связь | ||||||||||
| SiF4 | Ковалентная связь | ||||||||||
| Sih5 | карбид Covalex | Ковалентная связь 9 0825 | |||||||||
| диоксид кремния | Ковалентная связь | ||||||||||
| Тетрахлорид кремния | Ковалентная связь | ||||||||||
| Тетрафторид кремния | Ковалентная связь | ||||||||||
| SiO2 | |||||||||||
| SiO2 | |||||||||||
| SO3 | Ковалентная связь | ||||||||||
| so4 | Ковалентная связь | ||||||||||
| стеариновая кислота | Ковалентная связь | ||||||||||
| сахароза | Сера диоксидная связь | Ковалентная связь | |||||||||
| трехокись серы | Ковалентная связь | ||||||||||
| серная кислота | Ковалентная связь | ||||||||||
| водопроводная вода | Ковалентная связь | 908 C 4 диоксид титана (TiO2) | Ковалентная связь | ||||||||
| толуол | Ковалентная связь | ||||||||||
| мочевина | Ковалентная связь | ||||||||||
| растительное масло | |||||||||||
| Ковалентная связь | |||||||||||
| Ковалентная связь | вода | Ковалентная связь | |||||||||
| xef4 | Ковалентная связь | ||||||||||
| Триоксид ксенона (XeO3) | Ковалентная связь | ||||||||||
| 9198 9198 | 9198 9198 | ) | |||||||||
| AlBr3 | |||||||||||
| BaSO4 | |||||||||||
| Caco3 | |||||||||||
| карбонат кальция | |||||||||||
| нитрат магния | 25 | ||||||||||
| 25 |
Мы получаем ответы от
Ресурсы:
ответы.

 Нитрат аммония
Нитрат аммония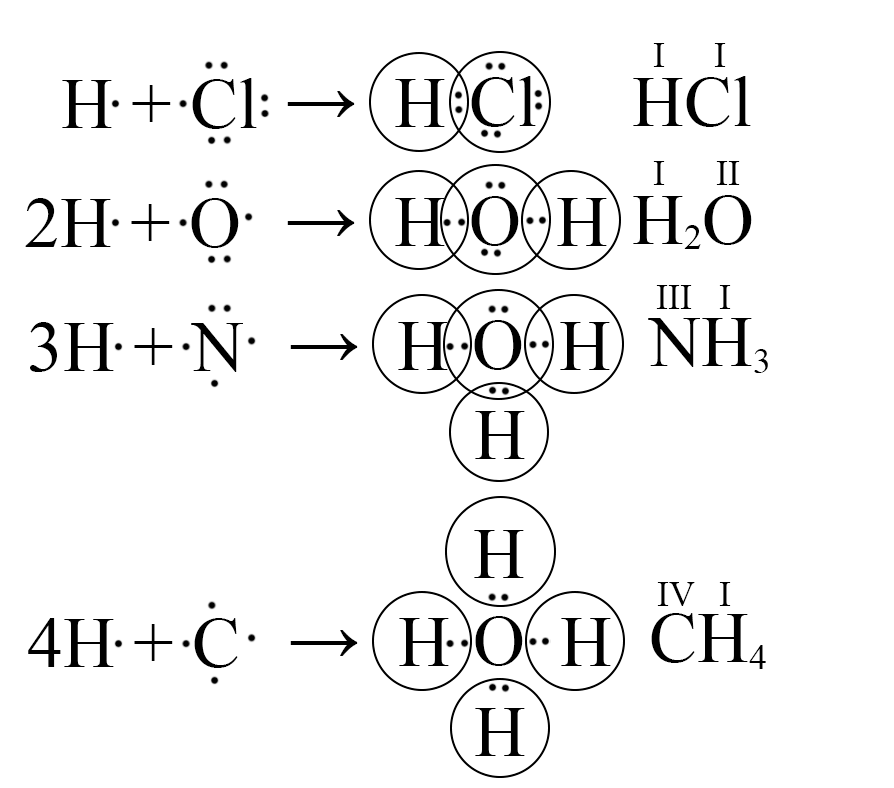
Leave A Comment