Сколько хромосом клетках морского ежа?
А куда попадёт макрота, если её проглотить(7 баллов)А. В лёгкие Б. В желудок
У животных (собак, кошек) переворачивание на спину и открытие брюшной стенки демонстрирует состояние незащищённости и выражение полного доверия своему … хозяину. Также это может быть признанием силы вожака, демонстрация готовности подчинения вожаку. Для человека, как прямоходящего существа, открытость брюшной стенки для травмы — постоянное состояние. Удар тупым предметом в эпигастральную область (область чуть ниже мечевидного отростка грудины) приводит к спастическому сокращению мышц брюшной стенки, межрёберных мышц, спастическому сокращению мускулатуры кишечника. Это сопровождается целым набором неприятных ощущений: боль, остановка дыхания, возможна потеря сознания. Почему так происходит? Как интенсивность болевых ощущений связана с нервной регуляцией перистальтических движений желудочно-кишечного тракта? Ответ необходимо пояснить.
Как называются факторы живой природы? 1) абиотические 2) биотические 3) все экологические факторы 4) антропогенные
Расположи животных в последовательности, отражающей усложнение их нервной системы в процессе эволюции (Запиши буквы в соответствующем порядке без проб
… елов):
М) ящерица;
А) гидра;
Р) орёл;
Г) ланцетник;
З) аксолотль.
Возможно ли, чтобы даже при достаточном количестве молекул фермента его переваривающее действие было ослаблено?
Помогите пожалуйста, срочно надо. Задание:Знайдіть зайву картинку з чотирьох. Чому ви вважаєте, що саме вона-зайва? Яким загальним поняттям можна на … звати три останні рослини?
30 Балов срочно у людини ген короткозоррсті домінує над геном нормального зору. Чи можна в родині де чоловік та жінка мають короткозорність очікувати … дітей з номальним зором
Кто знает что за птица и чьи птенцы
Здравствуйте. Помогите пожалуйста с домашней практической по биологии.
чтто будет если выпить апельсиновый сок при псориазе?
Число хромосом у разных видов
| Вид | 2n |
| Человек (Homo sapiens) | 46 |
| Горилла | 48 |
| Макака (Macaca mulatta) | 42 |
| домашние животные | |
| Кошка (Felis domesticus) | 38 |
| Собака (Canis familiaris) | 78 |
| Кролик | 44 |
| Лошадь | 64 |
| Корова (Bovis domesticus) | 120 |
| Курица (Gallus domesticus) | 78 |
| Утка | 80 |
| Свинья | 40 |
| Овца | 54 |
| лабораторные животные | |
Плодовая мушка (D.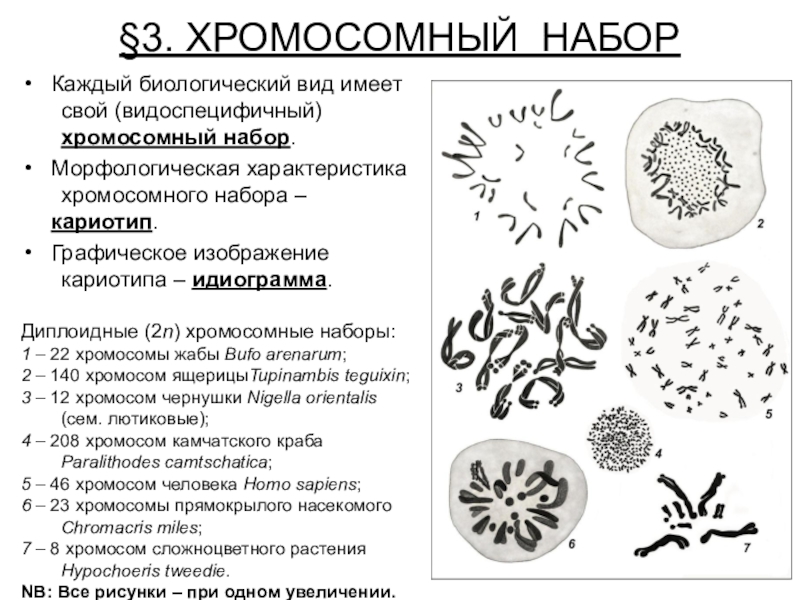 | 8 |
| Морской еж (Strongylocentrotus purpuratus) | 42 |
| Шпорцевая лягушка (Xenopus laevis) | 36 |
| Мышь (Mus musculus) | 40 |
| Дрожжи (S.cerevisiae) | 32 |
| Нематода | 22/24 |
| Крыса | 42 |
| Морская свинка | 16 |
| позвоночные | |
| Еж | 96 |
| Лиса | 34 |
| Голубь | 16 |
| Карп | 104 |
| Минога | 174 |
| Лягушка (Rana pipiens | 26 |
| Cазан | 104 |
| растения | |
| Клевер | 14 |
| Тополь | 38 |
| Кукуруза (Zea mays) | 20 |
| Горох | 14 |
| Береза | 84 |
| Ель | 24 |
| Лук (Allium cepa) | 16 |
| Арабидопсис (Arabidopsis thaliana) | 10 |
Картошка (S. tuberosum) tuberosum) | 48 |
| Ужовник | 48 |
| лилия | 24 |
| Хвощ | 216 |
| Томат | 24 |
| Крыжовник | 16 |
| Вишня | 32 |
| Рожь | 14 |
| Пшеница | 42 |
| Папоротник | ~1200 |
| беспозвоночные | |
| Миксомицеты | 14 |
| Трипаносома | ? |
| Бабочка | 380 |
| Шелкопряд | 56 |
| Протей (Necturus maculosis) | 38 |
| Рак (Cambarus clarkii) | 200 |
| Гидра | 30 |
| Аскарида | 2 |
| Пчела | 16 |
| Муравей ( | 2 |
| Виноградная улитка | 24 |
| Земляной червь | 36 |
| Речной рак | 116 |
| Малярийный плазмодий | 2 |
| Радиолярия | 1600 |
Наименьшее число хромосом: самки подвида муровьев Myrmecia pilosula имеют пару хромосом на клетку. Самцы имеют только 1 хрососому в каждой клетке.
Самцы имеют только 1 хрососому в каждой клетке.
Наибольшее число: вид папоротников Ophioglossum reticulatum имеет около 630 пар хромосом, или 1260 хромосом на клетку
Нет верхнего предела ограничивающего количество хромосом: бабочка Lysandra nivescens n=140-141 хромосома.
Существует минимальная масса хромосомы необходимая для расхождения хромосом в митозе — критическая масса. Наличие такой массы может частично объяснить избыточность ДНК.
Задание 3 из ЕГЭ по биологии
За это задание вы можете получить 1 балл на ЕГЭ в 2021 году
Задание 3 ЕГЭ по биологии посвящено метаболизму клетки. Составитель тестов – Федеральный институт педагогических измерений – предлагает такие темы экзаменационных билетов: «Фотосинтез», «Энергетический обмен», «Пластический обмен».
Составитель тестов – Федеральный институт педагогических измерений – предлагает такие темы экзаменационных билетов: «Фотосинтез», «Энергетический обмен», «Пластический обмен».
Вопросы билетов, посвященные фотосинтезу клетки, затрагивают превращение энергии солнечного света в химическую энергию внутри клетки, работу нитрифицирующих и хемосинтезирующих бактерий, также вы должны будете знать, что такое автотрофы, гетеротрофы, хемотрофы, эукариоты, прокариоты и какие живые организмы относятся к каждому из этих классов. Несколько вариантов билетов посвящено отличию фотосинтеза от хемосинтеза и других процессов. Строение теста простое – вопрос и четыре варианта ответов, из которых вы выбираете один – тот, что считаете правильным.
Варианты задания №3 ЕГЭ по биологии на тему «Энергетический обмен», построены по такому же принципу и могут содержать в себе вопросы типа «Поглощение чего происходит в процессе пиноцитоза? Жидкости, твердых веществ, газов, комочков пищи» или «В процессе дыхания происходит превращение энергии: из химической в тепловую, из тепловой в химическую, из механической в тепловую, из тепловой в механическую».
«Пластический обмен» — тема еще одной части задания № 3 ЕГЭ по биологии. Обычно эти тесты вызывают трудности у выпускников, так как наряду с простыми вопросами типа «Кто из перечисленных живых организмов питается готовыми органическими веществами? Грибы, водоросли, папоротники, мхи» в экзаменационном билете можно встретить и более сложные, например, «Сколько аминокислот кодирует девять сотен нуклеотидов?» или «В основе взаимодействия каких веществ лежит принцип комплементарности (дополнительности)?».
ЯЙЦО | Энциклопедия Кругосвет
Содержание статьи Даже некоторые одноклеточные протисты, у которых в процессе размножения происходит слияние двух клеток, функционируют подобно сперматозоиду или яйцу. Применительно к микроскопическому яйцу растений, а также млекопитающих и многих других животных часто используют термин «яйцеклетка».
Даже некоторые одноклеточные протисты, у которых в процессе размножения происходит слияние двух клеток, функционируют подобно сперматозоиду или яйцу. Применительно к микроскопическому яйцу растений, а также млекопитающих и многих других животных часто используют термин «яйцеклетка».РАЗНООБРАЗИЕ ЯИЦ
Яйца животных, принадлежащих к разным группам, крайне разнообразны по величине, форме и окраске; не меньшие различия наблюдаются и в количестве яиц, производимых разными видами. Так, зрелое яйцо морского ежа красного цвета, достигает 70–80 мкм в диаметре, и одна самка продуцирует миллионы яиц; самка комара откладывает от 100 до 200 яиц, а пресноводная японская рыбка оризия, или медака (Orysius latipes), – всего 10–30. Величина и количество яиц мало зависят от размеров животного, а определяются в основном стратегией размножения.
См. также РАЗМНОЖЕНИЕ.
Среди млекопитающих самые крупные яйца свойственны яйцекладущим – утконосу и ехидне. Диаметр яйца утконоса – 4,4 мм, ехидны – 3 мм. Зрелая яйцеклетка человека имеет примерно 100 мкм (0,1 мм) в диаметре, макака-резуса – 118 мкм, морской свинки – 76 мкм, кролика – 160 мкм, а мыши – 80 мкм.
Диаметр яйца утконоса – 4,4 мм, ехидны – 3 мм. Зрелая яйцеклетка человека имеет примерно 100 мкм (0,1 мм) в диаметре, макака-резуса – 118 мкм, морской свинки – 76 мкм, кролика – 160 мкм, а мыши – 80 мкм.
Величину птичьих яиц обычно оценивают по их массе (что точнее). Самое маленькое яйцо – всего 0,5 г – у колибри Trochilus colubris, а самое крупное яйцо в современном животном мире – у страуса Struthio camelus: оно достигает 1400 г. Коренные жители Африки использовали скорлупу яиц страуса как сосуды для воды. Однако, по-видимому, самое большое яйцо принадлежало вымершей птице – эпиорнису (Aepyornis), жившему на Мадагаскаре; его емкость превышала 9 л. Яйцо курицы породы леггорн имеет массу 58 г. По форме яйца бывают сферическими, эллипсоидными, коническими и продолговатыми.
Число яиц в кладке тоже варьирует. Например, пингвины откладывают по одному яйцу, голуби – по два, куропатки – до 20 яиц в кладку.
Яйца дрозда синевато-зеленые. У домашних кур яйца бывают белые, желтые или различных оттенков коричневого. Сообщалось о породе кур, откладывающих сине-зеленые яйца. Размеры, форма и окраска яиц иногда варьируют у разных представителей одного вида.
СТРОЕНИЕ И РАЗВИТИЕ
Процесс, ведущий к формированию женской гаметы, или зрелого яйца, называют оогенезом. Его подразделяют на две фазы: генеративную и вегетативную. Генеративная фаза начинается с размножения первичных половых клеток – они обособляются на ранних стадиях эмбрионального развития и предназначены для образования гамет. Эти клетки дают начало оогониям, каждый из которых образует затем т.н. ооцит.
В вегетативной фазе ооцит вступает в период роста, характеризующийся увеличением массы его цитоплазмы. Затем он накапливает желток и претерпевает особое клеточное деление – мейоз. Мейоз завершается образованием зрелого яйца.
См. также ЭМБРИОЛОГИЯ.
У млекопитающих вегетативная фаза инициируется фолликулостимулирующим гормоном, вырабатываемым гипофизом. У насекомых оогенез стимулируется ювенильным гормоном, который вырабатывается прилежащими телами – парными железами, расположенными в голове.
У насекомых оогенез стимулируется ювенильным гормоном, который вырабатывается прилежащими телами – парными железами, расположенными в голове.
Во время генеративной фазы и в ранний период вегетативной фазы будущее яйцо мало отличается от клетки любого другого типа, т.е. у него нет тех специфических признаков, которые характерны для яйца. На этой стадии молодой ооцит окружен мембраной, называемой оолеммой. Его ядро погружено в цитоплазму, содержащую специализированные структуры – органеллы. У многих организмов оогенез протекает при участии фолликулярных клеток и трофоцитов.
Ядро.
Молодой ооцит содержит ядро с крупным ядрышком и диплоидным набором хромосом, т.е. хромосом у него столько же, сколько в любой другой клетке данного организма. Переход от диплоидного набора хромосом к гаплоидному (т.е. уменьшенному вдвое) набору происходит в результате мейоза. Гаплоидное число хромосом свойственно только гаметам.
У всех изученных яиц ядро окружено ядерной оболочкой, пронизанной порами, расположенными на некотором расстоянии друг от друга. У многих животных в яйце во время оогенеза образуется мембранная система, известная под названием annulate lamella: она возникает из ядерной оболочки.
У многих животных в яйце во время оогенеза образуется мембранная система, известная под названием annulate lamella: она возникает из ядерной оболочки.
Цитоплазма.
Ооциты содержат большое количество цитоплазмы, имеющей сложную структуру. В ней присутствуют множество митохондрий, необходимых для обеспечения клетки энергией; мембранная система эндоплазматического ретикулума и многочисленные рибосомы, на которых происходит синтез белка; комплекс Гольджи и лизосомы – ферменты последних осуществляют внутриклеточное переваривание и даже могут инициировать разрушение яйца.
В молодых ооцитах насекомых обнаружены также микротрубочки, которые, по-видимому, участвуют в движении цитоплазмы. В яйцах других беспозвоночных и у позвоночных они встречаются редко.
Помимо этого набора органелл, свойственных и другим клеткам, цитоплазма яйца во многих случаях содержит т.н. кортикальные гранулы, или тельца, которые у ряда животных играют важную роль в оплодотворении. Однако важнейшая ее особенность – наличие желтка, необходимого для питания зародыша.
Существует по крайней мере три возможных способа образования желтка. Во-первых, его могут продуцировать органеллы ооцита. Во-вторых, предшественники желтка, т.е. вещества, из которых он образуется, могут вырабатываться не в ооците, а в других клетках и поступать в ооцит путем эндоцитоза. Наконец, возможно сочетание этих двух процессов.
См. также КЛЕТКА.
Оолемма.
На ранних стадиях развития оолемма гладкая, но позднее на ней образуются пальцевидные выросты, называемые микроворсинками. Наружная поверхность оолеммы покрыта рыхлым слоем, который считают частью этой оболочки.
Фолликулярные клетки.
У многих организмов яйцо бывает окружено слоем фолликулярных клеток, в цитоплазме которых имеются органеллы, сходные с органеллами ооцита. Пока ооцит развивается, цитоплазма фолликулярных клеток образует выросты, которые иногда смыкаются с микроворсинками ооцита. Функция фолликулярных клеток у многих животных остается неизвестной. Однако у таких насекомых, как стрекозы и плодовые мушки, фолликулярные клетки вырабатывают материал, используемый для формирования вокруг яйца вторичной оболочки.
Трофоциты, или питающие клетки.
У некоторых беспозвоночных, например гребневиков и насекомых, у одного из полюсов яйца находится группа трофоцитов. Установлено, что синтез дезоксирибонуклеиновой кислоты (ДНК) и рибонуклеиновой кислоты (РНК) начинается в трофоцитах, и РНК вместе с рибосомами переносится в ооцит по цитоплазматическим мостикам. У губок ооцит целиком поглощает (фагоцитирует) эти клетки.
Созревание.
Яйцо может выйти из яичника, находясь на разных стадиях созревания; это означает, что его ядро может быть при этом либо диплоидным (в этом случае процесс мейоза завершается во время оплодотворения), либо уже гаплоидным. Так, у многих червей и моллюсков, а также у ряда млекопитающих (собаки, лисицы, лошади) мейоз к моменту оплодотворения находится на стадии профазы, т.е. в яйце еще сохраняется крупное диплоидное ядро (зародышевый пузырек). У других моллюсков, например у обычной мидии (Mytilus edulis), и многих насекомых зрелое яйцо находится в метафазе первого митотического деления; у большинства позвоночных – в метафазе второго мейотического деления; у кишечнополостных и морских ежей мейоз в зрелом яйце завершен и ядро гаплоидное. Ряд животных трудно отнести к какой-либо из указанных четырех групп. Например, яйца морской звезды Asterias при некоторых условиях можно оплодотворить в разные сроки после их откладки, когда они находятся на разных стадиях созревания.
Ряд животных трудно отнести к какой-либо из указанных четырех групп. Например, яйца морской звезды Asterias при некоторых условиях можно оплодотворить в разные сроки после их откладки, когда они находятся на разных стадиях созревания.
ЯЙЦО ПТИЦ
Строение яйца птиц целиком соответствует его назначению – яйцо содержит все необходимое для полного развития нового организма. Непосредственно перед выходом в яйцевод оно представляет собой одну клетку, заполненную жидким материалом – желтком; ее ядро расположено на участке, называемом бластодиском. После того как яйцо поступило в яйцевод, становится возможным оплодотворение. По мере продвижения яйца по яйцеводу расположенные в стенке яйцевода железы выделяют вещества, из которых образуются вспомогательные структуры, в том числе белок, подскорлупковые оболочки и скорлупа. Прохождение яйца по яйцеводу занимает примерно 22 ч. Если яйцо было оплодотворено, то к моменту откладки его нельзя считать одной клеткой, так как в нем уже началось дробление и образовался плоский двойной слой клеток, называемый бластодермой.
Питание зародыша обеспечивает желток. Существует два типа желтка – белый и желтый; они располагаются в яйце чередующимися концентрическими слоями. Большую часть желтка составляет желтый желток, содержащий по крайней мере два белка – фосфовитин и липовителлин, – а также некоторые липиды и углеводы. Основная часть белого желтка, называемая латеброй, расположена в центре яйца; она имеет вид колбы, горлышко которой тянется до поверхности желтка. Поверхностный участок белого желтка носит название ядра Пандера; непосредственно над ним лежит бластодерма.
Желток заключен в т.н. вителлиновую мембрану и окружен белком. Белок яйца имеет желтоватый оттенок, создаваемый пигментом овофлавином, но после коагуляции (свертывания) он становится белым. Часть белка образует вокруг желтка спиралевидную структуру – халазу, поддерживающую желток во взвешенном состоянии.
Содержимое яйца окружено двумя подскорлупковыми оболочками, внутренней и наружной, похожими на пергамент. Над ними лежит скорлупа, состоящая главным образом из карбоната кальция. После откладки яйца на его тупом конце подскорлупковые оболочки начинают отделяться одна от другой, и в этом месте образуется воздушная камера. По размерам камеры обычно можно судить о свежести яйца: если поместить свежее яйцо в слабый солевой раствор, то оно опустится на дно, так как воздушная камера мала, а несвежее яйцо всплывет, так как эта камера увеличилась в объеме.
После откладки яйца на его тупом конце подскорлупковые оболочки начинают отделяться одна от другой, и в этом месте образуется воздушная камера. По размерам камеры обычно можно судить о свежести яйца: если поместить свежее яйцо в слабый солевой раствор, то оно опустится на дно, так как воздушная камера мала, а несвежее яйцо всплывет, так как эта камера увеличилась в объеме.
Бывают случаи, когда созревают сразу две или три яйцеклетки. Проходя одновременно по яйцеводу, они могут покрыться белком и скорлупой вместе, так что получится яйцо, содержащее два или три желтка.
ОПЛОДОТВОРЕНИЕ
Оплодотворение – многоступенчатый процесс. Он начинается со взаимодействия и последующего слияния яйца и сперматозоида, а завершается объединением двух наборов хромосом – одного от материнского, а другого от отцовского организма. При этом объединении не только восстанавливается диплоидное число хромосом, но и создаются новые генетические комбинации. Рыбы и многие земноводные выделяют сперматозоиды и яйца (икру) в воду, так что оплодотворение у них наружное, т. е. происходит вне тела животного; то же свойственно и многим морским беспозвоночным. У наземных беспозвоночных, а также у остальных позвоночных оплодотворение внутреннее, т.е. слияние сперматозоида с яйцом происходит в репродуктивной системе самки.
е. происходит вне тела животного; то же свойственно и многим морским беспозвоночным. У наземных беспозвоночных, а также у остальных позвоночных оплодотворение внутреннее, т.е. слияние сперматозоида с яйцом происходит в репродуктивной системе самки.
См. также РАЗМНОЖЕНИЕ.
Остается неизвестным, каким образом сперматозоиды данного вида вступают в контакт с яйцами своего, а не какого-то другого вида даже в тех случаях, когда самец выделяет сперму в обширные водные пространства. Как полагают некоторые исследователи, яйцо выделяет специфичное для данного вида вещество, привлекающее соответствующие сперматозоиды благодаря их способности к хемотаксису – движению по градиенту концентрации распознаваемого химического вещества. Некоторые сперматозоиды активно ищут яйцо, продвигаясь к нему с помощью длинного жгутика. У ряда беспозвоночных сперматозоиды перемещаются подобно амебам.
У многих животных сперматозоид проникает в яйцо в любой точке на его поверхности, но у насекомых и рыб – только через специальное отверстие (микропиле). По-видимому, сперматозоиды, способные проникнуть в яйцо в любом месте, делают это, размягчив участок яйцевых оболочек с помощью ферментов, содержащихся в их акросоме. (См. также СПЕРМАТОЗОИД.) В результате непосредственного контакта сперматозоида и яйца их оболочки сливаются, образуя одну непрерывную оболочку, объединяющую эти две клетки.
По-видимому, сперматозоиды, способные проникнуть в яйцо в любом месте, делают это, размягчив участок яйцевых оболочек с помощью ферментов, содержащихся в их акросоме. (См. также СПЕРМАТОЗОИД.) В результате непосредственного контакта сперматозоида и яйца их оболочки сливаются, образуя одну непрерывную оболочку, объединяющую эти две клетки.
На этой стадии процесса оплодотворения у очень многих животных происходит изменение поверхностного слоя яйца за счет того, что кортикальные гранулы, содержащиеся в цитоплазме яйца, быстро выделяют свое содержимое под яйцевую оболочку; выделенные вещества оводняются, увеличивая занимаемый объем, что приводит к отделению оболочки от цитоплазмы: между ними появляется т.н. перивителлиновое пространство, и, кроме того, изменяются свойства яйцевой оболочки. В итоге вокруг оплодотворенного яйца возникает благоприятная среда и создается препятствие для проникновения дополнительных сперматозоидов. Однако активность кортикальных гранул – не единственный фактор, ответственный за то, что у большинства животных в яйцо может проникнуть лишь один сперматозоид.
После того как сперматозоид попал в яйцо, оболочка его ядра распадается, а высвободившийся хроматин (вещество, из которого состоят хромосомы) оказывается в цитоплазме яйца и с этих пор находится под ее контролем.
Дальнейшие события могут протекать по-разному. Например, у морского ежа Arbacia ядерная оболочка сперматозоида распадается сразу же после его проникновения в яйцо, и вслед за этим происходит дисперсия компактной массы хроматина. Затем хроматин вновь отделяется от цитоплазмы яйца в результате восстановления ядерной оболочки.
У некоторых животных ядра сперматозоида и яйца, оказавшись в общей цитоплазме, немедленно вступают в контакт; их оболочки сливаются, и образуется единое диплоидное ядро в единой клетке – зиготе.
У других животных, например у кролика, ядра сперматозоида и яйца сближаются, после чего обе ядерные оболочки разрушаются. Затем два гаплоидных набора хромосом выстраиваются в одну линию, так что зигота может начать делиться; диплоидное число хромосом в ней восстановилось.
После оплодотворения, наружного или внутреннего, начинается процесс дробления зиготы и развитие зародыша.
ПАРТЕНОГЕНЕЗ
Многим беспозвоночным и низшим позвоночным свойственно партеногенетическое (девственное) размножение, т.е. их яйца могут развиваться без оплодотворения. (См. также РАЗМНОЖЕНИЕ.) В некоторых случаях, например у рыб, для этого требуется предварительный контакт яиц со сперматозоидами особей другого вида: при этом происходит активация яйца (побуждающая его к дроблению), но не оплодотворение. Аналогичную активацию яиц (как беспозвоночных, так и низших позвоночных) удается вызвать в лабораторных условиях. Для этого используют такие способы, как укол иглой, смоченной кровью, выдерживание яиц при повышенной или пониженной температуре, либо в кислой или щелочной среде, либо в гипертоническом солевом растворе (т.е. в растворе с более высокой концентрацией солей, чем в клетке), либо в растворе стрихнина или сапонина. Если в результате таких воздействий удается получить диплоидный организм, то обычно это происходит за счет подавления одного из делений мейоза либо одного из первых дроблений яйца. Однако при искусственном партеногенезе далеко не всегда удается достичь полного развития нового организма – чаще всего развитие зародыша останавливается на ранних стадиях. Поэтому в большинстве случаев остается неясным, соответствуют ли эти искусственно вызванные процессы нормальному развитию. Показано, однако, что у морского ежа Arbacia punctulata активация яиц гипертоническим раствором, а именно морской водой с повышенным содержанием некоторых солей, индуцирует процессы, сходные с наблюдаемыми при оплодотворении.
Однако при искусственном партеногенезе далеко не всегда удается достичь полного развития нового организма – чаще всего развитие зародыша останавливается на ранних стадиях. Поэтому в большинстве случаев остается неясным, соответствуют ли эти искусственно вызванные процессы нормальному развитию. Показано, однако, что у морского ежа Arbacia punctulata активация яиц гипертоническим раствором, а именно морской водой с повышенным содержанием некоторых солей, индуцирует процессы, сходные с наблюдаемыми при оплодотворении.
Удалось также получить полное и массовое (из подавляющего большинства яиц) партеногенетическое развитие тутового шелкопряда, используя для этого различные физические (в частности, температурные) и химические воздействия. Оказалось, что при достаточно сильном воздействии на неоплодотворенные яйца в них происходит торможение мейотического деления, и в дальнейшем из таких яиц выводятся только самки. Такое же, но более слабое воздействие, не тормозящее мейоз, но активирующее яйца, приводит к развитию только самцов. Таким образом, с помощью искусственного партеногенеза можно не только культивировать этот вид, но и регулировать соотношение полов в разводимой популяции, что немаловажно, так как самцы продуцируют больше шелка, чем самки. Этот метод партеногенетического разведения тутового шелкопряда получил практическое применение.
Таким образом, с помощью искусственного партеногенеза можно не только культивировать этот вид, но и регулировать соотношение полов в разводимой популяции, что немаловажно, так как самцы продуцируют больше шелка, чем самки. Этот метод партеногенетического разведения тутового шелкопряда получил практическое применение.
Любопытные эксперименты были проведены на лягушках. Из яйцеклетки лягушки удаляли ядро и вместо него вводили ядро соматической клетки. Как уже говорилось, ядра всех соматических клеток, как эмбриональных, так и взятых от взрослого организма, содержат диплоидный набор хромосом, в отличие от ядра гаплоидных яйцеклеток. В серии таких экспериментов в ооциты шпорцевой лягушки (Xenopus laevis) переносили диплоидные ядра из клеток бластулы, гаструлы или из головного мозга взрослой особи. Оказалось, что цитоплазма ооцита способна изменить характер активности пересаженного ядра, регулируя ее таким образом, чтобы она соответствовала активности цитоплазмы. В результате из ооцита с пересаженным диплоидным ядром может развиться взрослая лягушка.
См. также КЛОНИРОВАНИЕ.
О яйце млекопитающих см. РЕПРОДУКЦИЯ ЧЕЛОВЕКА.
Новости | Наука и жизнь
Новости | Наука и жизньНавязчивые мелодии, которые остаются с нами даже во сне, не дают мозгу отдохнуть. В некоторых случаях иммунитет активируется от одного взгляда на больного. Ионы цинка действуют на нервы, эпителий и мышцы кровеносных сосудов, заставляя их расслабиться. Электрические импульсы, посылаемые в мозг по электродам, помогают больным с синдромом Паркинсона управлять собственными мышцами и повышают эффективность дофаминовых лекарств. Проведя в вечной мерзлоте около 24 тысяч лет, коловратки проснулись и начали размножаться.
 Услышав от соседа предупреждение об опасности, кукши не слишком-то пугаются – они знают, что сосед, скорее всего, хочет их обмануть. Слишком сильные положительные эмоции и слишком сильные отрицательные на слух неотличимы друг от друга. Пугливость детей зависит от их кишечной микрофлоры. Гибридные молекулы из двух частей с настраиваемой активностью могут стать эффективным средством против грибков, которые стали устойчивыми к прежним лекарствам. Химический датчик позволяет вовремя определить у телёнка респираторную инфекцию. Пещерный медведь, чей череп нашли в башкирской пещере, был убит ударом копья в голову.
Услышав от соседа предупреждение об опасности, кукши не слишком-то пугаются – они знают, что сосед, скорее всего, хочет их обмануть. Слишком сильные положительные эмоции и слишком сильные отрицательные на слух неотличимы друг от друга. Пугливость детей зависит от их кишечной микрофлоры. Гибридные молекулы из двух частей с настраиваемой активностью могут стать эффективным средством против грибков, которые стали устойчивыми к прежним лекарствам. Химический датчик позволяет вовремя определить у телёнка респираторную инфекцию. Пещерный медведь, чей череп нашли в башкирской пещере, был убит ударом копья в голову. Автомобильные шины и покрышки после измельчения и обработки марганцовкой можно смешать со строительными бетонами. Некоторые из древних евразийских лошадей решили вернуться в Северную Америку около 200–50 тысяч лет назад. Нейроны-картографы запоминают несколько разных ландшафтов разного размера. Уровень кислорода в пресноводных водоёмах снижается быстрее, чем в океанах. Вероятность повторной инфекции коронавирусом составляет доли процента. В три с половиной года мы уже начинаем прислушиваться к чужому мнению. Мутации в нейронном рецепторе могут добавить молодым людям семнадцать лишних килограммов.
Автомобильные шины и покрышки после измельчения и обработки марганцовкой можно смешать со строительными бетонами. Некоторые из древних евразийских лошадей решили вернуться в Северную Америку около 200–50 тысяч лет назад. Нейроны-картографы запоминают несколько разных ландшафтов разного размера. Уровень кислорода в пресноводных водоёмах снижается быстрее, чем в океанах. Вероятность повторной инфекции коронавирусом составляет доли процента. В три с половиной года мы уже начинаем прислушиваться к чужому мнению. Мутации в нейронном рецепторе могут добавить молодым людям семнадцать лишних килограммов. Глиома зрительного нерва растёт тем сильнее, чем активнее работает сам зрительный нерв. После бессонной ночи кофеин стимулирует внимание, но не помогает в более сложной умственной работе.
Глиома зрительного нерва растёт тем сильнее, чем активнее работает сам зрительный нерв. После бессонной ночи кофеин стимулирует внимание, но не помогает в более сложной умственной работе. Число хромосом андромерогонов морского ежа на раннем этапе развития
ВВЕДЕНИЕ
Фрагменты яйцеклетки морского ежа без женского пронуклеуса могут развиваться после оплодотворения спермой (Morgan, 1896), а некоторые даже могут развиться в личинки (Boveri, 1889). Такие фрагменты яйцеклетки, развивающиеся только с мужским ядром, «андромерогоны», активно изучаются с конца 19-го и начала 20-го веков с точки зрения их способности к развитию или роли ядра в наследственности.
В те дни фрагменты яиц получали встряхиванием неоплодотворенных яиц в пробирке, содержащей небольшое количество морской воды, для исследования мерогонов (Hertwig and Hertwig, 1887; Boveri, 1889; Morgan, 1896), а затем путем разрезания их на две половинки (Уитакер, 1929).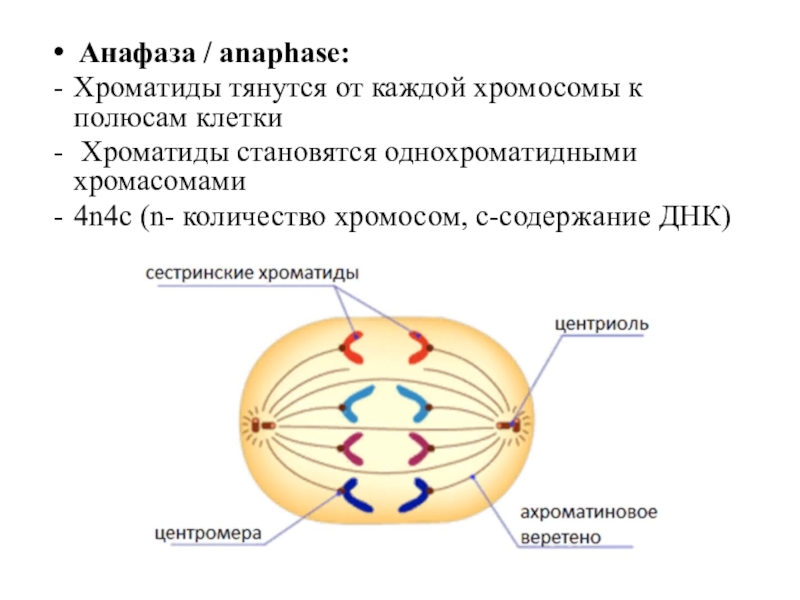 Встряхивание, однако, приводило к образованию неядерных фрагментов различного размера, и разрез не мог предоставить достаточное количество безъядерных фрагментов. С другой стороны, уже началось изучение стратификации яиц путем легкого центрифугирования неоплодотворенных яиц (Lyon, 1907).При дальнейшем центрифугировании яйца разделялись на половинки или четверти, а неядерные фрагменты располагались в зоне центрифугирования (Harvey, 1932, 1940, 1956). Таким образом, можно было постоянно получать многие безъядерные фрагменты яиц, и стало возможным их детальное исследование, включая их разработку.
Встряхивание, однако, приводило к образованию неядерных фрагментов различного размера, и разрез не мог предоставить достаточное количество безъядерных фрагментов. С другой стороны, уже началось изучение стратификации яиц путем легкого центрифугирования неоплодотворенных яиц (Lyon, 1907).При дальнейшем центрифугировании яйца разделялись на половинки или четверти, а неядерные фрагменты располагались в зоне центрифугирования (Harvey, 1932, 1940, 1956). Таким образом, можно было постоянно получать многие безъядерные фрагменты яиц, и стало возможным их детальное исследование, включая их разработку.
Считается, что андромерогоны развиваются только с гаплоидным числом хромосом (Morgan, 1896), поскольку гаплоидный набор хромосом и митотический центр доставляются к ненуклеатным фрагментам из сперматозоидов через оплодотворение.Морган (1896), подсчитывая количество хромосом на стадии двух или четырех клеток в парафиновых срезах, фактически сообщил, что нормальные эмбрионы Echinus (Psammechinus) miliaris имеют 22 хромосомы в качестве диплоидного числа и что их андромерогоны имеют от 8 до 12 хромосом. Однако, по словам Коломбера (1974), количество хромосом у нескольких видов, о которых сообщалось в начале 20 века, отличается от числа хромосом, полученного с помощью метода сквоша, разработанного в середине века. Поскольку число хромосом, указанное Морганом, также слишком низкое, необходимо повторное исследование для уточнения числа хромосом андромерогонов.
Однако, по словам Коломбера (1974), количество хромосом у нескольких видов, о которых сообщалось в начале 20 века, отличается от числа хромосом, полученного с помощью метода сквоша, разработанного в середине века. Поскольку число хромосом, указанное Морганом, также слишком низкое, необходимо повторное исследование для уточнения числа хромосом андромерогонов.
Харви (1940) указал на существование многоядерных форм во фрагментах Arbacia punctulata, поскольку большое количество более тяжелых гранулированных материалов мешает плоскостям спайности. Фон Ледебур-Виллигер (1972) сообщил, что партеногенетические зародыши Paracentrotus lividus имели диплоидное и тетраплоидное число хромосом за счет внутриядерного деления. Более того, неправильное число хромосом, вызванное митотическим нарушением, также было обнаружено у мерогонных зародышей Тритона (Fankhauzer, 1934).Из этих сообщений все еще остается возможность, что андромерогоны морского ежа могут иметь диплоидное и анеуплоидное число хромосом.
Целью настоящей работы является определение того, развиваются ли андромерогоны с гаплоидным числом хромосом, путем точного подсчета их числа хромосом с помощью метода воздушной сушки (Saotome, 1982a, 1987). Я использовал модифицированный метод центрифугирования, чтобы получить большое количество андромерогонов, из которых можно было проанализировать большое количество метафазных пластинок.
МАТЕРИАЛЫ И МЕТОДЫ В качестве материала использовали
Hemicentrotus pulcherrimus. Взрослые особи H. pulcherrimus были собраны на морской биологической станции Мисаки Токийского университета и в Манадзуру, префектура Канагава. Яйца и сперму получали путем инъекции 0,05 мл 0,01 М хлорида ацетилхолина в полость тела взрослых взрослых. Было использовано более 20 пар самок и самцов.
Получение безъядерных фрагментов яйца
Безъядерные фрагменты яйца получали центрифугированием неоплодотворенных яиц в ступенчатом градиенте плотности сахарозы по методу Харви (1932, 1956) со следующими модификациями: 1) четыре слоя ступенчатого Градиент плотности создавали путем смешивания 1 М сахарозы и морской воды в соотношениях 1: 2, 1: 1, 2: 1 и 1: 0 сверху вниз в центрифужной пробирке объемом 50 мл (рис. 1а), 2) 0,5 мл суспензии неоплодотворенных яиц (4–10 × 10 4 яиц / мл) с желе наслаивали по градиенту, и 3) яйца центрифугировали при 21000 × г (в середине трубка) в течение 20 мин при 13 ° C (15 000 об / мин, RPR 20–2 угловой ротор, Hitachi CR20B2). Неядерные фрагменты яиц, расположенные на полосе 2 на рис. 1b, были удалены тонкой пипеткой и перенесены в чашку диаметром 45 мм, а затем трижды промыты морской водой. Фрагменты оплодотворяли путем добавления раствора спермы (примерно 4 × 10 6 сперматозоидов / мл в конечной концентрации), который в 10–20 раз более концентрирован, чем раствор, используемый при обычном оплодотворении.3-Амино-1,2,4-триазол (Sigma Chemical Co., Сент-Луис, Миссури, США) добавляли в чашки до конечной концентрации 0,1 мг / мл сразу после оплодотворения, чтобы предотвратить затвердевание мембраны оплодотворения ( Шоумен и Фёдер, 1979).
1а), 2) 0,5 мл суспензии неоплодотворенных яиц (4–10 × 10 4 яиц / мл) с желе наслаивали по градиенту, и 3) яйца центрифугировали при 21000 × г (в середине трубка) в течение 20 мин при 13 ° C (15 000 об / мин, RPR 20–2 угловой ротор, Hitachi CR20B2). Неядерные фрагменты яиц, расположенные на полосе 2 на рис. 1b, были удалены тонкой пипеткой и перенесены в чашку диаметром 45 мм, а затем трижды промыты морской водой. Фрагменты оплодотворяли путем добавления раствора спермы (примерно 4 × 10 6 сперматозоидов / мл в конечной концентрации), который в 10–20 раз более концентрирован, чем раствор, используемый при обычном оплодотворении.3-Амино-1,2,4-триазол (Sigma Chemical Co., Сент-Луис, Миссури, США) добавляли в чашки до конечной концентрации 0,1 мг / мл сразу после оплодотворения, чтобы предотвратить затвердевание мембраны оплодотворения ( Шоумен и Фёдер, 1979).
Рис. 1
Разделение яиц в градиенте плотности сахарозы под действием центробежной силы. (а) Четыре слоя (L1, L2, L3 и L4) были созданы путем смешивания 1 М сахарозы и морской воды. Подробности описаны в разделе «Методы». (б) Схема разделения фрагментов яйца.Три основных диапазона обозначены B1, B2 и B3. (в) Фазовый контраст сжатых фрагментов от каждой полосы. Маленькая стрелка указывает на ядро.
(а) Четыре слоя (L1, L2, L3 и L4) были созданы путем смешивания 1 М сахарозы и морской воды. Подробности описаны в разделе «Методы». (б) Схема разделения фрагментов яйца.Три основных диапазона обозначены B1, B2 и B3. (в) Фазовый контраст сжатых фрагментов от каждой полосы. Маленькая стрелка указывает на ядро.
Рис. 2
Распределение диаметров в безъядерных фрагментах яиц из B2 (–▮–) и B3 (–▯–), а также в целых яйцах (–▒–).
Хромосомный препарат
Колхицин (Sigma Chemical Co., Сент-Луис, Миссури, США) добавляли в конечной концентрации 0,5 мг / мл в чашки на стадиях двух, восьми клеток, морулы, вылупляющейся бластулы и плавающей бластулы чтобы запретить следующее деление.Эмбрионы собирали центрифугированием и суспендировали в 1 М мочевине или морской воде, не содержащей Ca-Mg (NaCl 31 г, KCl 0,8 г, NaHCO 3 0,5 г на литр дистиллированной воды). Удаление оплодотворяющей мембраны и диссоциация эмбрионов на составляющие их бластомеры проводились одновременно с помощью пипетки. Диссоциированные бластомеры собирали центрифугированием и затем обрабатывали 0,075 М KCl или 7% цитратом натрия в течение 10 мин. Набухшие бластомеры фиксировали метанол-уксусной кислотой (3: 1) и трижды промывали фиксатором.Хромосомные препараты были созданы методом воздушной сушки (Саотоме, 1982, 1987). Хромосомы окрашивали в течение 10 мин 3% -ным раствором Гимза (Merck, N.J., США), разбавленным 0,1 М фосфатным буфером (pH 6,8).
Диссоциированные бластомеры собирали центрифугированием и затем обрабатывали 0,075 М KCl или 7% цитратом натрия в течение 10 мин. Набухшие бластомеры фиксировали метанол-уксусной кислотой (3: 1) и трижды промывали фиксатором.Хромосомные препараты были созданы методом воздушной сушки (Саотоме, 1982, 1987). Хромосомы окрашивали в течение 10 мин 3% -ным раствором Гимза (Merck, N.J., США), разбавленным 0,1 М фосфатным буфером (pH 6,8).
РЕЗУЛЬТАТЫ
Получение безъядерных фрагментов яйца
Пошаговый градиент плотности сахарозы в настоящей работе состоит из четырех слоев (L1, L2, L3, L4), как показано на рис. 1a. При центрифугировании неоплодотворенных яиц в градиенте были получены три полосы (рис. 1b): первая полоса (B1) располагалась в верхней части L2; вторая полоса (B2) в пограничной области между L2 и L3; и третья полоса (B3) в нижней части L3.В то время как B1 и B2 были резкими полосами, B3 был слабым. Было установлено, что фрагменты из B1 являются зародышами, имеющими ядра (маленькая стрелка на рис. 1c), а фрагменты из B2 и B3 были определены как неядерные, наблюдая слегка раздавленные фрагменты яйца с помощью фазово-контрастного микроскопа (рис. 1c).
1c), а фрагменты из B2 и B3 были определены как неядерные, наблюдая слегка раздавленные фрагменты яйца с помощью фазово-контрастного микроскопа (рис. 1c).
На рис. 2 показано распределение диаметров фрагментов яиц из B2 и B3, а также целых яиц. Диаметр B2 варьировал от 38 до 72 мкм, B3 — от 23 до 42 мкм, а диаметр целых яиц — от 92 до 104 мкм.Диаметр фрагментов B2 неоднороден и всегда больше, чем у B3. Объем фрагментов из B2 составлял от 1/10 до 1/4 объема цельного яйца, а объем фрагментов из B3 составлял примерно 1/50. Фрагменты яиц из B3 имели тенденцию вызывать цитолиз после того, как их поместили в чашки и промыли морской водой. Фрагменты яиц из B2 использовали в этом исследовании в качестве неядерных в отношении размера объема и стабильности фрагментов. Извлечение безъядерных фрагментов составило 10–30%, а из 2–5 × 10 4 яиц в центрифужной пробирке было получено 1000–5000 фрагментов.Загрязнение ядросодержащими фрагментами яиц в неядерниках составляло менее 0,1%.
Развитие андромерогонов
Когда неядерные фрагменты яйцеклетки из B 2 оплодотворялись раствором спермы, аналогичной концентрации, используемой при нормальном оплодотворении, скорость расщепления фрагментов составляла от 10 до 25%. Показатель увеличивается до 60–90% при оплодотворении раствором спермы, в 10–20 раз превышающим тот, который используется при обычном оплодотворении. Разница (60–90%) в проценте скорости дробления зависела от партии яиц.Более того, скорость расщепления увеличивалась при использовании более концентрированного раствора спермы, в то время как полиспермия одновременно происходила с более высокой частотой.
Целые эмбрионы с нормальными мужскими и женскими ядрами были использованы в этой статье в качестве «контроля» для сравнения с развитием андромерогонов. На рис. 3 показано развитие контрольных эмбрионов (A-F) и андромерогонов (a-f). Андромерогоны последовательно расщепились на два (рис. 3а), четыре и восемь бластомеров, развились до стадии морулы (рис.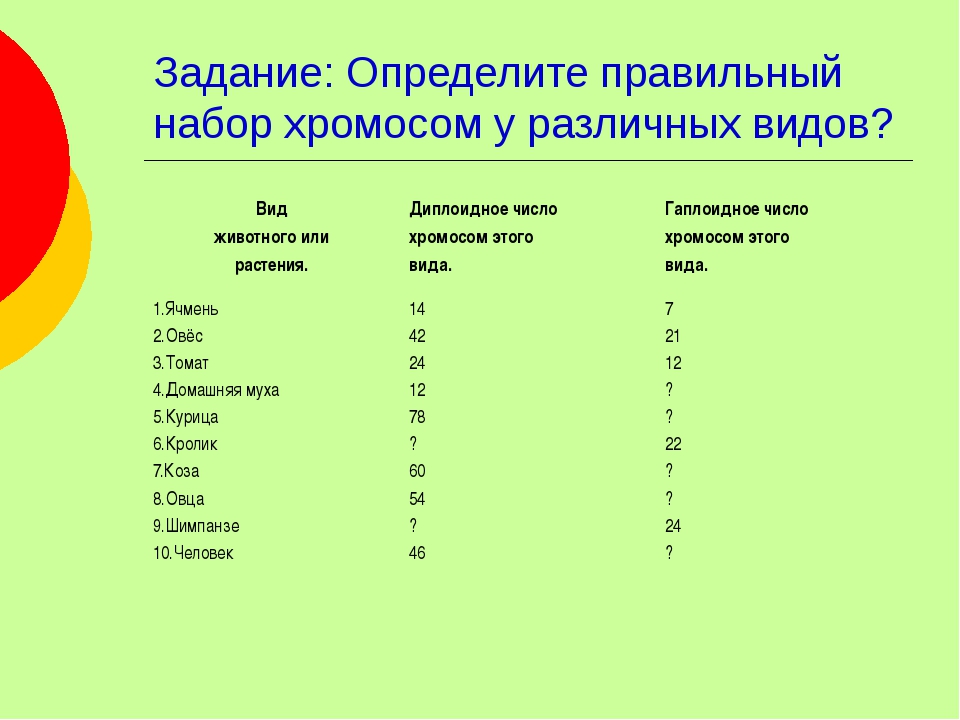 3б), а затем вылупились и поплыли.Хотя андромерогоны имели такую же скорость развития, как и контрольные эмбрионы (рис. 3A, B) на ранних стадиях, задержка развития андромерогонов становилась значительной после вылупления. Бластулы с небольшими бластоцелями и толстыми стенками формировались через сутки при 13 ° C (рис. 3c). В то время как контрольные эмбрионы стали гаструлами через два дня после оплодотворения (рис. 3D), некоторые андромерогоны начали инвагинировать (рис. 3d-1), хотя большинство из них все еще оставались бластулами с более крупными бластоцелями и тонкими стенками (рис. 3d-2), а остальные представляли собой бластулы, содержащие много клеток в бластоцеле (рис.3д-3). Андромерогоны все еще находились на стадии призмы или бластулы (рис. 3e-1, 2, 3), даже когда контрольные эмбрионы достигли стадии раннего плутония (рис. 3E). Когда через 5 дней контроль превратился в плютеус (рис. 3F), в морфологии андромерогонов в основном наблюдались следующие два типа: 1) маленькие плутеи с дифференцированными клетками кишечника и пигментными клетками, у которых формирование скелета почти нормальное (рис.
3б), а затем вылупились и поплыли.Хотя андромерогоны имели такую же скорость развития, как и контрольные эмбрионы (рис. 3A, B) на ранних стадиях, задержка развития андромерогонов становилась значительной после вылупления. Бластулы с небольшими бластоцелями и толстыми стенками формировались через сутки при 13 ° C (рис. 3c). В то время как контрольные эмбрионы стали гаструлами через два дня после оплодотворения (рис. 3D), некоторые андромерогоны начали инвагинировать (рис. 3d-1), хотя большинство из них все еще оставались бластулами с более крупными бластоцелями и тонкими стенками (рис. 3d-2), а остальные представляли собой бластулы, содержащие много клеток в бластоцеле (рис.3д-3). Андромерогоны все еще находились на стадии призмы или бластулы (рис. 3e-1, 2, 3), даже когда контрольные эмбрионы достигли стадии раннего плутония (рис. 3E). Когда через 5 дней контроль превратился в плютеус (рис. 3F), в морфологии андромерогонов в основном наблюдались следующие два типа: 1) маленькие плутеи с дифференцированными клетками кишечника и пигментными клетками, у которых формирование скелета почти нормальное (рис. 3f). -1) или неправильной формы (рис. 3f-2,3), и 2) постоянные бластулы, имеющие большие бластоцели с множеством клеток или без них (рис.3f-4). Ставка первых всегда была выше, чем вторых.
3f). -1) или неправильной формы (рис. 3f-2,3), и 2) постоянные бластулы, имеющие большие бластоцели с множеством клеток или без них (рис.3f-4). Ставка первых всегда была выше, чем вторых.
Рис. 3
Развитие целых зародышей (A – F) и андромерогонов (a – f). (А, а) — двухклеточная стадия; (Б, б) — стадия морулы; (В, в) — стадия плавательной бластулы; (D) стадия гаструлы; (E) — стадия раннего плевеуса и (F) — стадия плода. Пруток, 100 мкм.
Число хромосом андромерогонов на ранней стадии развития
Метафазная пластинка с диплоидным числом хромосом 42 из целых эмбрионов на ранней стадии бластулы показана на рис.4а. На рис. 4b показана типичная метафазная пластинка андромрогонов, и можно подсчитать число хромосом, равное 21.
Рис. 4
Метафазные хромосомы целых эмбрионов (а) и андромерогоны (б). Пруток, 5 мкм.
На рис. 5а – д представлены гистограммы числа хромосом у андромерогонов, исследованных на 5 этапах. Доля клеток с числом гаплоидной хромосомы 21 составила 73% в 86 клетках на стадии двух клеток, 84% в 87 клетках на стадии 8 клеток, 75% в 115 клетках на стадии морулы, 76% в 201 клетке на стадии морулы. стадия вылупления бластулы и 87% в 46 клетках на стадии плавательной бластулы.Когда в этой статье общее количество клеток с числом хромосом 19, 20, 22 и 23 определяется как анеуплоид с числом гаплоидных хромосом, доля анеуплоидов составляла 16, 13, 13, 8 и 4% на соответствующих стадиях. упомянутое выше. Доля клеток с диплоидным числом 42 хромосом составляла 5% на стадии двух клеток, 0% на стадии 8 клеток, 2% на стадии морулы, 2% на стадии вылупления бластулы и 4% на стадии плавающей бластулы. . При усреднении по всем исследованным клеткам этот показатель составлял 2%.Режим числа хромосом оказался 21 на всех стадиях.
стадия вылупления бластулы и 87% в 46 клетках на стадии плавательной бластулы.Когда в этой статье общее количество клеток с числом хромосом 19, 20, 22 и 23 определяется как анеуплоид с числом гаплоидных хромосом, доля анеуплоидов составляла 16, 13, 13, 8 и 4% на соответствующих стадиях. упомянутое выше. Доля клеток с диплоидным числом 42 хромосом составляла 5% на стадии двух клеток, 0% на стадии 8 клеток, 2% на стадии морулы, 2% на стадии вылупления бластулы и 4% на стадии плавающей бластулы. . При усреднении по всем исследованным клеткам этот показатель составлял 2%.Режим числа хромосом оказался 21 на всех стадиях.
Рис. 5
Гистограмма количества хромосом андромерогонов на раннем этапе развития. (a) стадия двух клеток, (b) стадия 8 клеток, (c) стадия морулы, (d) стадия вылупления бластулы и (e) стадия плавающей бластулы.
ОБСУЖДЕНИЕ
Яйца H. pulcherrimus были разделены на три полосы под действием сильной центробежной силы (21000 × г, в течение 20 минут), как показано на рис. 1b, а неядерные фрагменты можно было получить из Band2 (B2) с чистота 99.9%. Харви (1956) разделил половинки яйца после длительного центрифугирования (10 000 × г, в течение 20–30 мин) на четверти: прозрачную, митохондриальную, желточную и пигментную. Хотя эти результаты нельзя точно сравнить с моими из-за разницы в системе центрифугирования и видов морских ежей, изучение размера фрагментов и содержания в них яиц позволяет предположить, что фрагменты из B2 в этой статье соответствуют желточной четверти Харви ( 1956).
1b, а неядерные фрагменты можно было получить из Band2 (B2) с чистота 99.9%. Харви (1956) разделил половинки яйца после длительного центрифугирования (10 000 × г, в течение 20–30 мин) на четверти: прозрачную, митохондриальную, желточную и пигментную. Хотя эти результаты нельзя точно сравнить с моими из-за разницы в системе центрифугирования и видов морских ежей, изучение размера фрагментов и содержания в них яиц позволяет предположить, что фрагменты из B2 в этой статье соответствуют желточной четверти Харви ( 1956).
Диаметр фрагментов яиц из B2 был неоднородным по сравнению с диаметром целых яиц или диаметром фрагментов яиц из B3 (рис.2), что указывает на то, что точки сужения сильно различаются между B1 и B2 в зависимости от отдельных яиц. B2 иногда разделяется еще на две полосы. Поскольку эти полосы не появляются в результате изменения количества яиц, а зависят от людей в одних и тех же условиях центрифуги (данные не показаны), считается, что эта картина связана с различием в способе сужения яиц в зависимости от их партий. Фрагменты обеих полос были безъядерными, и их развитие было похоже на развитие фрагментов из B2 после оплодотворения.
Фрагменты обеих полос были безъядерными, и их развитие было похоже на развитие фрагментов из B2 после оплодотворения.
Бовери (1889) сообщил, что идеальных карликовых личинок из безъядерных фрагментов можно получить встряхиванием. Харви (1932, 1940, 1956) заявил, что несколько красных полуяйц без ядер, полученных центрифугированием, после оплодотворения превратились в нормальных личинок с решетчатым скелетом, и что личинки были очень сильно пигментированы и были намного меньше, чем личинки из целых яиц. В то время как митохондриальные и пигментные четверти, подготовленные Харви (1956), превратились в плавающую бластулу без дальнейшего развития, четверти желтка сформировали плютеус с пигментом и неправильным скелетом.Большинство андромерогонов в настоящем исследовании превратились в личинок с дифференцированными кишечниками, пигментными клетками и различными типами скелета, а остальные превратились в постоянные бластулы. Морфология личинок зависит от их скелета: достаточное образование скелета дает начало почти нормальным личинкам (рис. 3f-1), а неправильное формирование скелета вызывает аномальные (рис. 3f-2, 3). Развитие фрагментов из B 2 в этой статье было похоже на развитие четвертинков желтка Харви (1956).
3f-1), а неправильное формирование скелета вызывает аномальные (рис. 3f-2, 3). Развитие фрагментов из B 2 в этой статье было похоже на развитие четвертинков желтка Харви (1956).
Диплоидное число H. pulcherrimus равно 42, как показано на рис. 4а (Саотоме, 1987). Поскольку зарегистрированные числа хромосом морских ежей составляют в основном 42, 44, 46 (Colombera, 1974; Saotome, 1982a, 1987, 1989, 1991), число хромосом 22 у Echinus (Psammechinus) milialis, указанное Морганом (1896), слишком низкое. . Считается, что такое низкое значение вызвано методом секционирования, который использовался в то время, потому что у морских ежей много маленьких хромосом. Хромосомы, расширяющиеся в монослой, могут быть получены путем точного подсчета андромерогонов с помощью метода сушки на воздухе (рис.4б). Хотя число хромосом можно было исследовать до стадии бластулы, на стадии гаструлы или плютеуса это невозможно из-за низкой частоты митоза. Было обнаружено, что тип распределения числа хромосом равен 21 на всех стадиях, исследованных у андромрогонов, что указывает на то, что большинство андромерогонов развиваются с гаплоидным числом хромосом до стадии плавающей бластулы.
Фрагменты из B1 имели ядра, как показано на рис. 1, и составляли около 60–70% от общего объема яйца. Хотя оплодотворенные ядерные фрагменты превратились в бластулы, их дальнейшее развитие в одних случаях было почти нормальным, а в других — ненормальным.Они показали диплоидное число хромосом в 70% из 195 клеток (данные не показаны).
Клетки с диплоидным числом хромосом у андромерогонов наблюдались на уровне 0–5% на исследуемых стадиях. Поскольку загрязнение нуклеатными фрагментами неядерными составляет менее 0,1%, это значение не может быть объяснено только наличием нуклеатных фрагментов. Таким образом, рассматриваются следующие две возможности: 1) только несколько хорошо развитых эмбрионов получают диплоидное число за счет дублирования хромосом во время раннего развития и 2) многоядерные клетки встречаются в небольшом количестве андромерогонов, в которых гранулярный материал препятствует расщеплению.Анализ хромосом, полученных из одного почти нормального андромерогона во время развития, необходим для выяснения возможности дупликации. Препараты хромосом в этом исследовании сделаны из диссоциированных бластомеров многих эмбрионов, чтобы получить множество хороших метафазных пластинок, в которых хромосомы расширяются в монослой. Хотя метод приготовления из одного целого эмбриона методом воздушной сушки важен для прояснения различий между эмбрионами или между участками одного эмбриона, проба подготовки из одного целого эмбриона еще не увенчалась успехом из-за недостаточного расширения хромосомы.Вторая возможность (Harvey, 1940) не считается возможной, потому что полные борозды дробления наблюдались от 2 до 16 клеточных стадий на ранних стадиях H. pulcherrimus. Это может произойти на более поздней стадии, если возникнет интерференция расщепления.
Препараты хромосом в этом исследовании сделаны из диссоциированных бластомеров многих эмбрионов, чтобы получить множество хороших метафазных пластинок, в которых хромосомы расширяются в монослой. Хотя метод приготовления из одного целого эмбриона методом воздушной сушки важен для прояснения различий между эмбрионами или между участками одного эмбриона, проба подготовки из одного целого эмбриона еще не увенчалась успехом из-за недостаточного расширения хромосомы.Вторая возможность (Harvey, 1940) не считается возможной, потому что полные борозды дробления наблюдались от 2 до 16 клеточных стадий на ранних стадиях H. pulcherrimus. Это может произойти на более поздней стадии, если возникнет интерференция расщепления.
Хотя количество клеток с анеуплоидной хромосомой составляет 4–16% (рис. 5), предполагается, что следующие три причины объясняют его существование: 1) неравномерное распределение хромосом, 2) полиспермия и 3) технические ошибки.Поскольку аномальные числа хромосом известны у мерогонов, развившихся в аномальные эмбрионы у Тритона (Fankhauzer, 1934), постоянные бластулы в этой статье могут иметь анеуплоидные хромосомы. Эта возможность должна быть решена путем анализа хромосом из аномально развитых постоянных бластул. Морган (1896) указал, что полиспермия может иметь место в мерогонах. Аномальное расщепление, вызванное полиспермией, иногда наблюдалось в этой работе из-за использования концентрированного раствора спермы для повышения скорости оплодотворения.Это число анеуплоидов можно объяснить полиспермией, поскольку известно, что хромосомы ненормально разделены полиполярным делением (Saotome, 1982b). Однако техническая ошибка также возможна, поскольку количество клеток, имеющих анеуплоид с диплоидным числом хромосом, варьировалось от 6% для самого низкого числа у Scaphechinus mirabilis до 21% для максимального значения у Temnopleurus hardwickii даже при нормальном развитии (Saotome, 1987). . Хотя количество клеток с гипоплоидными числами, как правило, больше, чем с гиперплоидными, из-за оттока хромосом во время сушки на воздухе из-за технической ошибки, тенденция была аналогична той, что наблюдалась в этом исследовании.
Эта возможность должна быть решена путем анализа хромосом из аномально развитых постоянных бластул. Морган (1896) указал, что полиспермия может иметь место в мерогонах. Аномальное расщепление, вызванное полиспермией, иногда наблюдалось в этой работе из-за использования концентрированного раствора спермы для повышения скорости оплодотворения.Это число анеуплоидов можно объяснить полиспермией, поскольку известно, что хромосомы ненормально разделены полиполярным делением (Saotome, 1982b). Однако техническая ошибка также возможна, поскольку количество клеток, имеющих анеуплоид с диплоидным числом хромосом, варьировалось от 6% для самого низкого числа у Scaphechinus mirabilis до 21% для максимального значения у Temnopleurus hardwickii даже при нормальном развитии (Saotome, 1987). . Хотя количество клеток с гипоплоидными числами, как правило, больше, чем с гиперплоидными, из-за оттока хромосом во время сушки на воздухе из-за технической ошибки, тенденция была аналогична той, что наблюдалась в этом исследовании.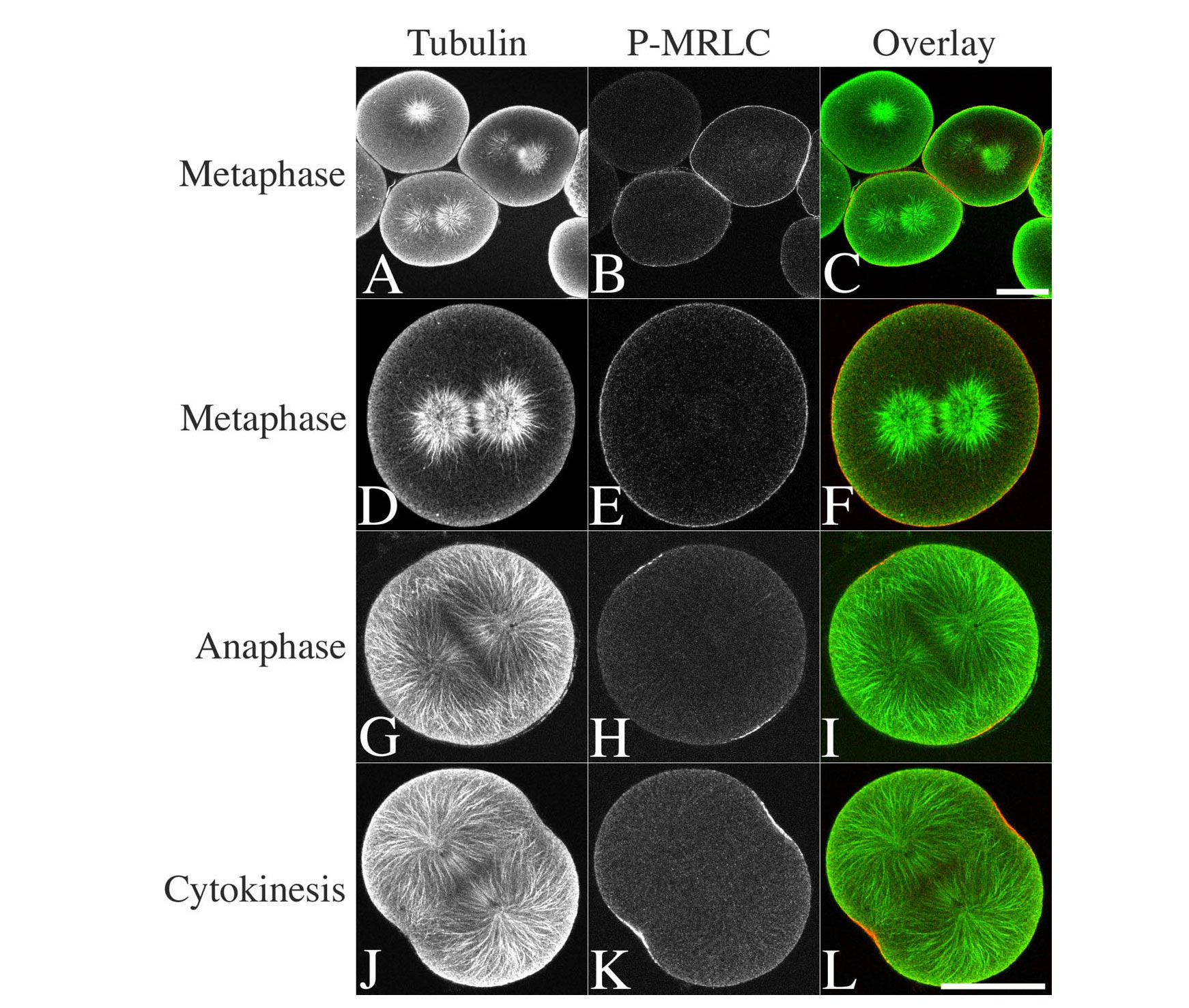 Эти результаты показывают, что наличие анеуплоидии можно объяснить полиспермией и технической ошибкой.
Эти результаты показывают, что наличие анеуплоидии можно объяснить полиспермией и технической ошибкой.
Благодарности
Автор выражает благодарность сотрудникам морской биологической станции Мисаки при Токийском университете за любезно предоставленные материалы.
ССЫЛКИ
1.
Т. Бовери 1889. Ein geschlechtlich erzeugter organus ohne mütterliche eigenschaften. Sitz Gesel Morph Physiol München 5: 73–83. Переведено Т.Х. Морган 1893 г., as. «Организм, произведенный половым путем без характеристик матери» Amer Nat 27: 222–232. Google Scholar2.
Д. Коломбера 1974. Эволюция хромосом в филуме иглокожих. Z zool Syst Evolut-forsch 12: 299–308. Google Scholar3.
Г. Фанкхаузер 1934. Цитологические исследования фрагментов яиц саламандры Тритон. V. Число хромосом и индивидуальность хромосом в митозах расщепления мерогонных фрагментов.J Exp Zool 68: 1–57. Google Scholar 4.
5.
Э. Б. Харви 1940. Сравнение развития ядросодержащих и безъядерных яиц Arbacia punctulata. Biol Bull 79: 166–187. Google Scholar6.
Э.Б. Харви 1956. Методы, стратификация яичных гранул, разработка центрифугированных яиц и фракций. В «Американской арбации и других морских ежах». Эд Э. Б. Харви , редактор. Издательство Принстонского университета. Принстон, Нью-Джерси. С. 121–127.138–146. Google Scholar7.
О. Хертвиг и Р. Хертвиг . 1887. Über den befructungs-und teilungsvorgang des tierischen eies unter dem einflusses äusserer Agenttien. Jenaische Z Naturwiss 20: 120–241.Google Scholar8.
Э. П. Лион 1907. Результаты центрифугирования яиц. Arch Entwickelungsmech 23: 151–173. Google Scholar 9.
10.
К. Саотоме 1982а. Способ хромосомной подготовки зародышей морского ежа.Пятно Технол 57: 103–105. Google Scholar11.
К. Саотоме 1982b. Аномалия дробления и разделения хромосом у эмбрионов морского ежа. 15-е ежегодное собрание по биологии развития Резюме, на японском языке. 77. Google Scholar12.
К. Саотоме 1987. Хромосомные числа 8 японских видов морских ежей. Zool Sci 4: 483–487. Google Scholar13.
К.Саотомэ 1989. Хромосомное число морского ежа Strongylocentrotus intermediateus. Chrom Infor Serv 46: 11–12. Google Scholar14.
К. Саотоме 1991. Число хромосом и области-организаторы ядрышка неправильного морского ежа Peronella japonica. Chrom Infor Serv 50: 32–34. Google Scholar 15.
16.
М. фон Ледебур-Виллигер 1972. Цитология и синтез нуклеиновых кислот партеногенетически активированных яиц морского ежа. Exp Cell Res 72: 285–308. Google Scholar17.
Д. М. Уитакер 1929. Скорость расщепления фрагментов центрифугированных яиц Arbacia. Biol Bull 57: 159–171. Google ScholarИспользование гамет и зигот морского ежа для исследования дупликации центросом
Greenfield Sluder
Кафедра клеточной биологии и биологии развития, Медицинская школа Массачусетского университета, S6-212, 55 Lake Avenue North, Worcester, MA 01655 USA
Департамент клеточной биологии и биологии развития, Медицинская школа Массачусетского университета, S6-212, 55 Lake Avenue North, Worcester, MA 01655 USA
Автор, отвечающий за переписку.
Поступило 5 марта 2016 г .; Принято 20 апреля 2016 г.
Открытый доступ Эта статья распространяется на условиях Международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии вы должным образом указываете первоначального автора (авторов) и источник, предоставляете ссылку на лицензию Creative Commons и указываете, были ли внесены изменения. Отказ от лицензии Creative Commons Public Domain Dedication (http: // creativecommons.org / publicdomain / zero / 1.0 /) применяется к данным, представленным в этой статье, если не указано иное. Эта статья цитировалась в других статьях PMC.Abstract
Структура и функция центриолей в зиготе морского ежа параллельны таковым в соматических клетках млекопитающих. Здесь я кратко представляю свойства и атрибуты системы морского ежа, которые делают ее привлекательной платформой для изучения центросомы и дупликации центриолей. Эти атрибуты применимы ко всем иглокожим, которые можно легко приобрести у коммерческих поставщиков: морским ежам, песчаным долларам и морским звездам.Я перечисляю некоторые практические аспекты системы, которые делают ее рентабельной и эффективной по времени системой для экспериментальной работы, а затем перечисляю свойства, которые представляют собой «набор инструментов», который можно использовать для проведения исследований, которые не были бы практичными или нецелесообразными. в некоторых случаях это невозможно с соматическими клетками млекопитающих. Поскольку центриоли организуют и локализуют перицентриолярный материал, который образует ядра астральных массивов микротрубочек (Bobinnec et al. В J Cell Biol 143 (6): 1575–1589, 1998), паттерн дупликации звездочки в течение нескольких клеточных циклов может использоваться как надежный показатель удвоения центриолей (Sluder и Rieder в J Cell Biol 100 (3): 887–896, 1985).Описания методов, которые моя лаборатория использовала для обработки и визуализации зигот иглокожих, даны в Sluder et al.
Эти атрибуты применимы ко всем иглокожим, которые можно легко приобрести у коммерческих поставщиков: морским ежам, песчаным долларам и морским звездам.Я перечисляю некоторые практические аспекты системы, которые делают ее рентабельной и эффективной по времени системой для экспериментальной работы, а затем перечисляю свойства, которые представляют собой «набор инструментов», который можно использовать для проведения исследований, которые не были бы практичными или нецелесообразными. в некоторых случаях это невозможно с соматическими клетками млекопитающих. Поскольку центриоли организуют и локализуют перицентриолярный материал, который образует ядра астральных массивов микротрубочек (Bobinnec et al. В J Cell Biol 143 (6): 1575–1589, 1998), паттерн дупликации звездочки в течение нескольких клеточных циклов может использоваться как надежный показатель удвоения центриолей (Sluder и Rieder в J Cell Biol 100 (3): 887–896, 1985).Описания методов, которые моя лаборатория использовала для обработки и визуализации зигот иглокожих, даны в Sluder et al. (Методы Cell Biol 61: 439–472, 1999). Также включена библиография статей, в которых описаны дополнительные методы.
(Методы Cell Biol 61: 439–472, 1999). Также включена библиография статей, в которых описаны дополнительные методы.
Ключевые слова: Центриоль, Центросома, Дупликация, Иглокожие, Яйцо, Морской еж, Сперма, Зигота
Фон
Сперма и яйцеклетка
Сперма морского ежа содержит два центриоля. Один из них служит базальным телом жгутика и имеет заметную электронно-плотную крышку на проксимальном конце, где он прочно закреплен в лопатке у основания ядра сперматозоида (рис.а, б). В поперечном сечении базальное тело имеет каноническое девятитриплетное строение. Вторая центриоль, расположенная между митохондрией и ядром (рис. А, б), также имеет каноническую девятитриплетную структуру, заключенную в электронно-плотную кольцевую матрицу (рис. В). Эта дистальная центриоль в номенклатуре [4] короткая, с соотношением сторон, напоминающим конфету «Спасатель жизни».
Ультраструктура базальных тел и дистальных центриолей сперматозоидов морского ежа. a Продольный разрез головки сперматозоида.В основании головы видны базальное тело — жгутиковый аппарат, митохондрия и короткая дистальная центриоль, лежащая между митохондрией и ядром. Здесь дистальная центриоль в тангенциальном сечении выглядит как электронно-плотное пятно на левом базального тела ( стрелка ). Шкала 1 мкм. b Продольный срез головки сперматозоида, обработанного глюконат-глициновым буфером. Плотный колпачок на проксимальном конце базального тела находится там, где он механически прикреплен к ложе в основании ядра.Митохондрия переместилась в сторону ядра вместе с дистальной центриолью, видимой в продольном сечении ( стрелка ). Шкала 1 мкм. c Поперечное сечение изолированной дистальной центриоли. Масштабная линейка 0,1 мкм
a Продольный разрез головки сперматозоида.В основании головы видны базальное тело — жгутиковый аппарат, митохондрия и короткая дистальная центриоль, лежащая между митохондрией и ядром. Здесь дистальная центриоль в тангенциальном сечении выглядит как электронно-плотное пятно на левом базального тела ( стрелка ). Шкала 1 мкм. b Продольный срез головки сперматозоида, обработанного глюконат-глициновым буфером. Плотный колпачок на проксимальном конце базального тела находится там, где он механически прикреплен к ложе в основании ядра.Митохондрия переместилась в сторону ядра вместе с дистальной центриолью, видимой в продольном сечении ( стрелка ). Шкала 1 мкм. c Поперечное сечение изолированной дистальной центриоли. Масштабная линейка 0,1 мкм
Когда самку морского ежа заставляют нереститься, икра откладывается в постмейотическом состоянии с гаплоидным интерфазным ядром. Считается, что неоплодотворенное яйцо лишено центриолей, поскольку в ультраструктурных исследованиях об этом не сообщалось.Когда клеточный цикл активируется в неоплодотворенных яйцах, нет активности, которая организует дублирующуюся центросому, и центриоли не собираются [5]. Наследование центросом у иглокожих происходит по отцовской линии; обе центриоли в сперматозоиде вносят вклад в зиготу и после дупликации организуют центросомы, используемые в развитии.
Считается, что неоплодотворенное яйцо лишено центриолей, поскольку в ультраструктурных исследованиях об этом не сообщалось.Когда клеточный цикл активируется в неоплодотворенных яйцах, нет активности, которая организует дублирующуюся центросому, и центриоли не собираются [5]. Наследование центросом у иглокожих происходит по отцовской линии; обе центриоли в сперматозоиде вносят вклад в зиготу и после дупликации организуют центросомы, используемые в развитии.
Зигота
Примерно через 15–30 минут после оплодотворения две центриоли сперматозоидов организовали сперматозоиды и дублируются в это время синтеза ДНК [6].Женский пронуклеус движется к фокусу сперматозоида и сливается с мужским пронуклеусом, образуя ядро зиготы. Позже пары центриолей мать-дочь организуют звездочки, которые отделяются от ядра зиготы перед первым митозом. Во время первых эмбриональных митозов все центриоли имеют каноническую девятитриплетную структуру (рис. B) и иногда кажутся немного отдельными внутри облака фиброзернистого перицентриолярного материала во время митоза (см. Серию серийных секций в [2, 7]). .Во время ранних митозов зигот нет никаких указаний на то, что перицентриолярный материал преимущественно накапливается вокруг более старой или материнской центриоли, как в случае соматических клеток млекопитающих. Во время митоза центриоли мать-дочь не всегда обнаруживают плотное ортогональное расположение, что поднимает вопросы о степени, в которой они механически и функционально задействованы в этой точке клеточного цикла. В телофазе центросома уплощается и синтез ДНК быстро начинается — даже до того, как все кариомеры (отдельные хромосомы или группы хромосом, вокруг которых собираются ядерные оболочки) слились, чтобы сформировать интерфазное ядро [8].Центриоли в это время дублируются [9].
Серию серийных секций в [2, 7]). .Во время ранних митозов зигот нет никаких указаний на то, что перицентриолярный материал преимущественно накапливается вокруг более старой или материнской центриоли, как в случае соматических клеток млекопитающих. Во время митоза центриоли мать-дочь не всегда обнаруживают плотное ортогональное расположение, что поднимает вопросы о степени, в которой они механически и функционально задействованы в этой точке клеточного цикла. В телофазе центросома уплощается и синтез ДНК быстро начинается — даже до того, как все кариомеры (отдельные хромосомы или группы хромосом, вокруг которых собираются ядерные оболочки) слились, чтобы сформировать интерфазное ядро [8].Центриоли в это время дублируются [9].
a Энуклеированная зигота морского ежа, за которой наблюдали in vivo для характеристики дупликации центросомы. Каждая дублированная центросома организует двойную лучепреломляющую звезду, как это видно с помощью поляризационного микроскопа. Двулучепреломление и появление звездочек указывают на то, что эта энуклеированная зигота находилась в митозе, когда была сделана фотография. Преломляющая сфера, немного не в фокусе в центре ячейки, представляет собой каплю минерального масла, используемого для закрытия микропипетки, используемой для энуклеации зиготы.Деления шкалы удалены друг от друга на 10 мкм. b Эта конкретная зигота была извлечена из препарированного, фиксированного и серийного полутолстого среза. Показано поперечное сечение центриоли в одной из центросом. Другая центриоль была найдена в другом разделе. Шкала 0,1 мкм
Двулучепреломление и появление звездочек указывают на то, что эта энуклеированная зигота находилась в митозе, когда была сделана фотография. Преломляющая сфера, немного не в фокусе в центре ячейки, представляет собой каплю минерального масла, используемого для закрытия микропипетки, используемой для энуклеации зиготы.Деления шкалы удалены друг от друга на 10 мкм. b Эта конкретная зигота была извлечена из препарированного, фиксированного и серийного полутолстого среза. Показано поперечное сечение центриоли в одной из центросом. Другая центриоль была найдена в другом разделе. Шкала 0,1 мкм
Практические соображения
Морские ежи и другие иглокожие представляют собой экономичную экспериментальную систему. У одного или нескольких организмов можно собрать большое количество яйцеклеток и спермы для выделения органелл и биохимических исследований.Гаметы и зиготы живут в морской воде; они функционируют в атмосферных условиях; и они не требуют стерильных условий.
 Необходимо культивировать зиготы при температуре, аналогичной той, при которой живет этот конкретный вид, — обычно это ниже нормальной комнатной температуры.
Необходимо культивировать зиготы при температуре, аналогичной той, при которой живет этот конкретный вид, — обычно это ниже нормальной комнатной температуры.Яйца крупные (~ 70–140 мкм в диаметре в зависимости от организма). Во время ранних митозов веретена и астры большие по сравнению с соматическими клетками. Яйца некоторых видов оптически прозрачны и поэтому хорошо подходят для визуализации in vivo с использованием поляризационной или дифференциально-интерференционной контрастной оптики.Важно отметить, что можно проследить поведение веретен и центросом in vivo без флуоресцентных зондов с помощью поляризационного микроскопа (рис. А,). Так как центриоли образуют перицентриолярный материал, образующий ядра звезд, образец удвоения звезд может использоваться как мера количества и удвоения центриолей. Например, центросома, содержащая две нормальные центриоли, точно удваивается от одного клеточного цикла к другому. Центросома, содержащая одну центриоль, не удваивается в первом клеточном цикле, но затем удваивается между всеми последующими циклами (см.
 [2]).
[2]).Второй митоз зиготы Lytechinus pictus . На этом изображении показано использование поляризационного микроскопа для изображения веретен и звездочек в живых зиготах морского ежа с оптически прозрачными яйцами. Шпиндели имеют отрицательную компенсацию и кажутся темными. Квадранты звездочки яркие, потому что микротрубочки в этих квадрантах ориентированы под прямым углом к таковым центрального веретена. Деления шкалы находятся на расстоянии 10 мкм друг от друга
Можно проследить отдельные зиготы in vivo, а затем восстановить каждую для корреляционной световой микроскопии фиксированных клеток или электронной микроскопии (рис.а, б). Чтобы точно охарактеризовать количество и пространственное расположение центриолей в зиготах, необходимо использовать анализ серийных полутолстых сечений (см. [10]). Метод восстановления и фиксации для электронной микроскопии отдельных зигот, ранее наблюдавшихся in vivo в препаратах для микроинъекций, описан в [7]. Подробные сведения о препаратах для микроинъекций / микроманипуляций с закрытыми или открытыми поверхностями см.
 В [3].
В [3].Клеточный цикл зиготы является быстрым и примерно синхронным для популяции яйцеклеток, оплодотворенных в одно и то же время.Для обычно используемых иглокожих с естественной температурой от 13 до 22 ℃ продолжительность клеточного цикла составляет от 40 минут до 1,5 часов в зависимости от температуры. Поскольку исследование дупликации центросомы / центриоли часто требует отслеживания клеток в течение нескольких клеточных циклов, зиготы иглокожих позволяют проводить эксперимент утром или днем, а не в несколько дней, необходимых для соматических клеток. Поскольку эксперименты обычно длятся несколько часов, исследователь может постоянно присутствовать у микроскопа, чтобы проследить / детально отобразить 5 или более зигот за цикл.При использовании поляризационной или дифференциальной интерференционной оптики вращающийся столик позволяет выровнять каждую зиготу для оптимизации контраста. Простые системы покадровой микроскопии без компьютерно запрограммированного фокуса и положения предметного столика позволяют отслеживать одновременно только несколько клеток, часто без правильной ориентации в поле.

Зигота морского ежа устойчива и выдерживает экспериментальные воздействия, которые останавливают гибель нетрансформированных соматических клеток. Зиготы могут быть механически фрагментированы и лучше выживают при микроманипуляциях, чем культивируемые клетки.Кроме того, зиготы обладают конечной, но гораздо большей устойчивостью к воздействию синего и ближнего УФ-света, чем нетрансформированные соматические клетки. Например, воздействие на нетрансформированные человеческие клетки (RPE1) светом 488 нм, доставляемым по обычному пути эпифлуоресценции, приводит к дозозависимой остановке клеточного цикла или гибели клеток (Douthwright and Sluder, представлено). Зиготы морского ежа переносят эквивалентное воздействие света с длиной волны 366 нм, даже если он более энергичный. В связи с этим следует предостеречь: при визуализации метафазных хромосом морского ежа, окрашенных по Хехсту, в канале DAPI флуоресцентного микроскопа, необходимо соблюдать осторожность, чтобы ограничить воздействие возбуждающего света.
 Более длительное воздействие может привести к слипанию сестринских хромосом, и когда клетка входит в анафазу, происходит сращивание и отсутствие расхождения хромосом.
Более длительное воздействие может привести к слипанию сестринских хромосом, и когда клетка входит в анафазу, происходит сращивание и отсутствие расхождения хромосом.Несмотря на то, что яйца и зиготы не поддаются трансфекции, существуют хорошо зарекомендовавшие себя методы микроинъекции яиц и зигот до отслеживания их поведения in vivo.
Геномы S. purpuratus и L. variegatus секвенированы, что дает исследователю доступ к специфическим последовательностям ДНК центриолярных белков.Экспрессия новых специфических белков в зиготах может быть подавлена инъекцией сконструированных антисмысловых морфолиноолигонуклеотидов (см. Обзор [11]). Недавно сообщалось о редактировании генома в отдельных зиготах морского ежа с помощью системы CRISPR / Cas9 [12].
Набор инструментов
Ниже перечислены некоторые характеристики зиготы морского ежа, которые оказались полезными инструментами при изучении дупликации центросом.
Дупликация центросом и прогрессирование клеточного цикла не зависят от транскрипции.Когда ядро зиготы удаляется, дупликация центросомы / центриоли постоянно происходит в надлежащей координации с циклами сборки / разборки астральных микротрубочек и попытками расщепления [7].
Еще до оплодотворения яйцо морского ежа содержит обильные пулы всех субъединиц, необходимых для поддержки повторяющейся дупликации центросом для образования множества центросом. Дупликация центросомы / центриоли происходит в зиготах, по крайней мере, в течение нескольких часов, когда синтез белка полностью заблокирован [13].Присутствие относительно стабильных пулов центриолей / субъединиц центросомы может ограничивать применимость морфолиноолигонуклеотидов и подходов CRISPR / Cas9 к снижению уровней специфических центросомных белков, по крайней мере, на ранней стадии развития.
Центросомы многократно дублируются, когда зигота задерживается в S фазе [14]. Для Lytechinus pictus период редупликации составляет в среднем 148 мин (диапазон 40–257 мин) [15].
Зиготы можно разделить на части, пропустив их через пластиковую сетку вскоре после удаления оболочки для удобрения.Поскольку это делается до слияния пронуклеусов, получают смесь жизнеспособных циклически энуклеированных клеточных фрагментов; фрагменты, содержащие только мужской или женский пронуклеус, или фрагменты с обоими пронуклеусами [5]. Центросома (и) остается ассоциированной с мужским пронуклеусом.
Клеточный цикл неоплодотворенных яиц может быть искусственно активирован множеством агентов. Один из самых простых и контролируемых методов — временно повысить их внутренний pH с помощью аммонизированной морской воды [16].Такие активированные яйца или экспериментально полученные фрагменты оплодотворенных яиц, которые содержат только женский пронуклеус, организуют в митозе единый радиальный массив микротрубочек (монастер) на месте женского пронуклеуса. Однако этот монастырь не дублируется и становится все менее хорошо организованным от одного митоза к другому [5]. На ультраструктурном уровне монастырь состоит из полой фенестрированной сферы из электронно-плотного материала, из которой выходят наружу микротрубочки. Анализ серийных срезов показал отсутствие морфологических центриолей [5].Эта система может быть использована для изучения свойств и состава перицентриолярного материала, свободного от центриолей.
Партеногенез: Начиная с конца 1800-х годов, были описаны методы индукции образования центросом de novo в искусственно активированных неоплодотворенных яйцах, ведущих к партеногенетическому развитию. Короче говоря, активированное яйцо временно обезвоживается гипертонической морской водой или морской водой, содержащей глюкозу или D 2 O во время первого клеточного цикла.Собирающиеся центросомы (называемые цитастерами) содержат центриоли [17]. При тщательно подобранном лечении одна или две центросомы собираются в каждом яйце и поддерживают нормальное раннее развитие гаплоидных или диплоидных эмбрионов ([18]; ранняя работа, рассмотренная в [19]). При более сильном лечении собирается много цитастеров на яйцо, некоторые с множественными центриолями [17, 20]. Оплодотворение также можно использовать для активации яйца, а условия дегидратации будут вызывать сборку лишних цитастеров, которые дублируются в каждом клеточном цикле (Sluder and Lewis, неопубликовано).Быстрый клеточный цикл и способность иметь большое количество примерно синхронных яиц могут дать преимущества для использования современных методов изучения этого малоизученного феномена, который также встречается в трансформированных и нетрансформированных клетках человека [21, 22].
7.
Сперма морских ежей представляет собой подходящую систему для выделения центриолей, учитывая, что природа удалила из этих клеток почти всю цитоплазму. Можно собрать большие количества сперматозоидов, а лизис детергента в глюконат-глициновом буфере (см. [3]) позволяет собирать короткие дистальные центриоли (рис.) из супернатанта, хотя и с некоторым загрязнением аксонем и митохондриальных остатков (см. также [23]). Когда эти изолированные дистальные центриоли вводят в оплодотворенные яйца морских ежей, они организуют звездочки в зависимости от дозы (Sluder, неопубликовано). Можно также осаждать ядра сперматозоидов с прочно прикрепленным базальным телом — жгутиковым аппаратом.
Электронная микрофотография среза гранулы дистальных центриолей, выделенных из спермы морского ежа. Шкала шкалы 0.5 мкм
Базальные тельца
Систему морского ежа можно также использовать для исследования биологии базального тела. Центриоли функционируют как базальные тельца в сперматозоидах и развиваются, начиная с стадии мерцательной бластулы. На сегодняшний день работа над базальными телами в этой системе в значительной степени ограничена обычными ультраструктурными характеристиками тонких срезов. Тем не менее, эмбрион морского ежа обеспечивает то, что может быть уникальным средством изучения повторяющегося взаимного преобразования центриолей в базальные тельца [24].На раннем этапе развития эмбрион превращается в полый клеточный шар — бластулу. Незадолго до того, как эмбрион вылупляется из оболочки оплодотворения, каждая клетка собирает единственную подвижную ресничку. Интересно, что клетки все еще размножаются. После митоза пара центриолей мать-дочь перемещается в апикальную кору клетки, а более старая или материнская центриоль действует как базальное тело, чтобы организовать сборку аксонемы ресничек. В то время как в этой конфигурации центриоли дублируются, и незадолго до вступления в митоз аксонема быстро втягивается обратно в клетку и отделяется от материнской центриоли.Во время митоза две пары центриолей мать / дочь организуют полюса митотического веретена. Эта последовательность событий повторяется в следующем клеточном цикле.
Выводы
Гаметы и зиготы морского ежа оказались полезной экспериментальной системой, на основе которой была получена основная информация о дупликации центросом. Некоторые из важных исследований с культивированными клетками не были бы практичными или даже невозможными. Хотя использование этой системы в биологии центросом в последние годы не применялось широко, ее несколько практических преимуществ делают ее широко открытой для новых и творческих подходов с использованием современных инструментов молекулярной биологии.
Благодарности
Автор благодарит доктора Юми Уэтаке за неоценимую помощь в подготовке рисунков и форматировании ссылок. Он также благодарит доктора Боба Морриса за предоставленную полную копию статьи Масуда и Сато. Исследования автора, упомянутые в этом обзоре, были поддержаны NIH GM30758.
Конкурирующие интересы
У автора нет конкурирующих интересов.
Ссылки
1. Бобиннек Ю., Ходжаков А., Мир Л.М., Ридер К.Л., Эдде Б., Борненс М. Разборка центриолей in vivo и ее влияние на структуру и функцию центросом в клетках позвоночных.J Cell Biol. 1998. 143 (6): 1575–1589. DOI: 10.1083 / jcb.143.6.1575. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 3. Слудер Дж., Миллер Ф.Дж., Хинчклифф Э. Использование гамет морского ежа для изучения митоза. Методы Cell Biol. 1999; 61: 439–472. DOI: 10.1016 / S0091-679X (08) 61993-7. [PubMed] [CrossRef] [Google Scholar] 4. Лонго Ф. Дж., Андерсон Э. Тонкая структура развития и слияния пронуклеусов у морского ежа, Arbacia punctulata . J Cell Biol. 1968. 39 (2): 339–368. DOI: 10,1083 / JCB.39.2.339. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 5. Sluder G, Miller FJ, Rieder CL. Репродуктивная способность центросом морского ежа без центриолей. Cell Motil Cytoskelet. 1989. 13 (4): 264–273. DOI: 10,1002 / см. 970130405. [PubMed] [CrossRef] [Google Scholar] 6. Лонго Ф. Дж., Планкетт В. Начало синтеза ДНК и его связь с морфогенетическими событиями пронуклеусов в активированных яйцах морского ежа, Arbacia punctulata . Dev Biol. 1973; 30 (1): 56–67. DOI: 10.1016 / 0012-1606 (73)-1.[PubMed] [CrossRef] [Google Scholar] 7. Sluder G, Miller FJ, Rieder CL. Воспроизведение центросом: ядерный против цитоплазматического контроля. J Cell Biol. 1986; 103 (5): 1873–1881. DOI: 10.1083 / jcb.103.5.1873. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Hinegardner RT, Rao B, Feldman DE. Синтетический период ДНК во время раннего развития яйца морского ежа. Exp Cell Res. 1964; 36: 53–61. DOI: 10.1016 / 0014-4827 (64) -4. [PubMed] [CrossRef] [Google Scholar] 9. Мазия Д., Харрис П.Дж., Бибринг Т.Множественность митотических центров и время их удвоения и разделения. J Biophys Biochem Cytol. 1960; 7 (1): 1–20. DOI: 10.1083 / jcb.7.1.1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 10. Rieder CL, Rupp G, Bowser S. Электронная микроскопия полутолстых срезов: преимущества для биомедицинских исследований. J Electron Microsc Tech. 1985; 2: 11–28. DOI: 10.1002 / jemt.1060020103. [CrossRef] [Google Scholar] 11. Хисман Дж. Морфолино-олиго: понимание антисмысла? Dev Biol. 2002. 243 (2): 209–214.DOI: 10.1006 / dbio.2001.0565. [PubMed] [CrossRef] [Google Scholar] 12. Лин CY, Su YH. Редактирование генома эмбрионов морского ежа с помощью системы CRISPR / Cas9. Dev Biol0. 2016. 409 (2): 420–428. DOI: 10.1016 / j.ydbio.2015.11.018. [PubMed] [CrossRef] [Google Scholar] 13. Sluder G, Miller FJ, Cole R, Rieder CL. Синтез белка и клеточный цикл: воспроизведение центросом в яйцах морских ежей не находится под трансляционным контролем. J Cell Biol. 1990; 110 (6): 2025–2032. DOI: 10.1083 / jcb.110.6.2025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14.Слудер Г., Льюис К. Взаимосвязь между синтезом ядерной ДНК и воспроизводством центросом в яйцах морских ежей. J Exp Zool. 1987. 244 (1): 89–100. DOI: 10.1002 / jez.1402440111. [PubMed] [CrossRef] [Google Scholar] 15. Hinchcliffe EH, Cassels GO, Rieder CL, Sluder G. Координация воспроизводства центросом с ядерными событиями клеточного цикла в зиготе морского ежа. J Cell Biol. 1998. 140 (6): 1417–1426. DOI: 10.1083 / jcb.140.6.1417. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Мазия Д.Хромосомные циклы включаются в неоплодотворенных яйцах морских ежей, подвергшихся воздействию NH 4 OH. Proc Natl Acad Sci USA. 1974. 71 (3): 690–693. DOI: 10.1073 / pnas.71.3.690. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 17. Kallenbach RJ, Mazia D. Происхождение и созревание центриолей в связи с ядерной оболочкой в яйцах морских ежей, подвергшихся гипертоническому стрессу. Eur J Cell Biol. 1982. 28 (1): 68–76. [PubMed] [Google Scholar] 18. фон Ледебур-Виллигер М. Цитология и синтез нуклеиновых кислот партеногенетически активированных яиц морского ежа.Exp Cell Res. 1972. С. 72 (1): 285–308. DOI: 10.1016 / 0014-4827 (72)
-5. [PubMed] [CrossRef] [Google Scholar] 19. Уилсон ЭБ. Клетка в развитии и наследственности. Нью-Йорк: Макмиллан; 1925. [Google Scholar] 20. Курияма Р., Борисы Г.Г. Цитастеры, индуцированные в неоплодотворенных яйцах морских ежей. J Cell Sci. 1983; 61: 175–189. [PubMed] [Google Scholar] 21. La Terra S, English CN, Hergert P, McEwen BF, Sluder G, Khodjakov A. Путь сборки центриолей de novo в клетках HeLa: развитие клеточного цикла и сборка / созревание центриолей.J Cell Biol. 2005. 168 (5): 713–722. DOI: 10.1083 / jcb.200411126. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Хамагучи Ю., Курияма Р. Образование звездочек в яйцах морских ежей путем микроинъекции кальциевых буферов и центриолярных комплексов, выделенных из спермы морских звезд. Exp Cell Res. 1982. 141 (2): 450–454. DOI: 10.1016 / 0014-4827 (82)Использование гамет и зигот морского ежа для исследования дупликации центросом
Greenfield Sluder
Департамент клеточной биологии и биологии развития, Медицинская школа Университета Массачусетса, S6-212, 55 Lake Avenue North, Worcester, MA 01655 USA
Департамент клеточной биологии и биологии развития, Медицинская школа Массачусетского университета, S6-212, 55 Lake Avenue North, Worcester, MA 01655 USA
Автор, отвечающий за переписку.Поступило 5 марта 2016 г .; Принято 20 апреля 2016 г.
Открытый доступ Эта статья распространяется на условиях Международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии вы должным образом указываете первоначального автора (авторов) и источник, предоставляете ссылку на лицензию Creative Commons и указываете, были ли внесены изменения. Отказ от лицензии Creative Commons Public Domain Dedication (http: // creativecommons.org / publicdomain / zero / 1.0 /) применяется к данным, представленным в этой статье, если не указано иное. Эта статья цитировалась в других статьях PMC.Abstract
Структура и функция центриолей в зиготе морского ежа параллельны таковым в соматических клетках млекопитающих. Здесь я кратко представляю свойства и атрибуты системы морского ежа, которые делают ее привлекательной платформой для изучения центросомы и дупликации центриолей. Эти атрибуты применимы ко всем иглокожим, которые можно легко приобрести у коммерческих поставщиков: морским ежам, песчаным долларам и морским звездам.Я перечисляю некоторые практические аспекты системы, которые делают ее рентабельной и эффективной по времени системой для экспериментальной работы, а затем перечисляю свойства, которые представляют собой «набор инструментов», который можно использовать для проведения исследований, которые не были бы практичными или нецелесообразными. в некоторых случаях это невозможно с соматическими клетками млекопитающих. Поскольку центриоли организуют и локализуют перицентриолярный материал, который образует ядра астральных массивов микротрубочек (Bobinnec et al. В J Cell Biol 143 (6): 1575–1589, 1998), паттерн дупликации звездочки в течение нескольких клеточных циклов может использоваться как надежный показатель удвоения центриолей (Sluder и Rieder в J Cell Biol 100 (3): 887–896, 1985).Описания методов, которые моя лаборатория использовала для обработки и визуализации зигот иглокожих, даны в Sluder et al. (Методы Cell Biol 61: 439–472, 1999). Также включена библиография статей, в которых описаны дополнительные методы.
Ключевые слова: Центриоль, Центросома, Дупликация, Иглокожие, Яйцо, Морской еж, Сперма, Зигота
Фон
Сперма и яйцеклетка
Сперма морского ежа содержит два центриоля. Один из них служит базальным телом жгутика и имеет заметную электронно-плотную крышку на проксимальном конце, где он прочно закреплен в лопатке у основания ядра сперматозоида (рис.а, б). В поперечном сечении базальное тело имеет каноническое девятитриплетное строение. Вторая центриоль, расположенная между митохондрией и ядром (рис. А, б), также имеет каноническую девятитриплетную структуру, заключенную в электронно-плотную кольцевую матрицу (рис. В). Эта дистальная центриоль в номенклатуре [4] короткая, с соотношением сторон, напоминающим конфету «Спасатель жизни».
Ультраструктура базальных тел и дистальных центриолей сперматозоидов морского ежа. a Продольный разрез головки сперматозоида.В основании головы видны базальное тело — жгутиковый аппарат, митохондрия и короткая дистальная центриоль, лежащая между митохондрией и ядром. Здесь дистальная центриоль в тангенциальном сечении выглядит как электронно-плотное пятно на левом базального тела ( стрелка ). Шкала 1 мкм. b Продольный срез головки сперматозоида, обработанного глюконат-глициновым буфером. Плотный колпачок на проксимальном конце базального тела находится там, где он механически прикреплен к ложе в основании ядра.Митохондрия переместилась в сторону ядра вместе с дистальной центриолью, видимой в продольном сечении ( стрелка ). Шкала 1 мкм. c Поперечное сечение изолированной дистальной центриоли. Масштабная линейка 0,1 мкм
Когда самку морского ежа заставляют нереститься, икра откладывается в постмейотическом состоянии с гаплоидным интерфазным ядром. Считается, что неоплодотворенное яйцо лишено центриолей, поскольку в ультраструктурных исследованиях об этом не сообщалось.Когда клеточный цикл активируется в неоплодотворенных яйцах, нет активности, которая организует дублирующуюся центросому, и центриоли не собираются [5]. Наследование центросом у иглокожих происходит по отцовской линии; обе центриоли в сперматозоиде вносят вклад в зиготу и после дупликации организуют центросомы, используемые в развитии.
Зигота
Примерно через 15–30 минут после оплодотворения две центриоли сперматозоидов организовали сперматозоиды и дублируются в это время синтеза ДНК [6].Женский пронуклеус движется к фокусу сперматозоида и сливается с мужским пронуклеусом, образуя ядро зиготы. Позже пары центриолей мать-дочь организуют звездочки, которые отделяются от ядра зиготы перед первым митозом. Во время первых эмбриональных митозов все центриоли имеют каноническую девятитриплетную структуру (рис. B) и иногда кажутся немного отдельными внутри облака фиброзернистого перицентриолярного материала во время митоза (см. Серию серийных секций в [2, 7]). .Во время ранних митозов зигот нет никаких указаний на то, что перицентриолярный материал преимущественно накапливается вокруг более старой или материнской центриоли, как в случае соматических клеток млекопитающих. Во время митоза центриоли мать-дочь не всегда обнаруживают плотное ортогональное расположение, что поднимает вопросы о степени, в которой они механически и функционально задействованы в этой точке клеточного цикла. В телофазе центросома уплощается и синтез ДНК быстро начинается — даже до того, как все кариомеры (отдельные хромосомы или группы хромосом, вокруг которых собираются ядерные оболочки) слились, чтобы сформировать интерфазное ядро [8].Центриоли в это время дублируются [9].
a Энуклеированная зигота морского ежа, за которой наблюдали in vivo для характеристики дупликации центросомы. Каждая дублированная центросома организует двойную лучепреломляющую звезду, как это видно с помощью поляризационного микроскопа. Двулучепреломление и появление звездочек указывают на то, что эта энуклеированная зигота находилась в митозе, когда была сделана фотография. Преломляющая сфера, немного не в фокусе в центре ячейки, представляет собой каплю минерального масла, используемого для закрытия микропипетки, используемой для энуклеации зиготы.Деления шкалы удалены друг от друга на 10 мкм. b Эта конкретная зигота была извлечена из препарированного, фиксированного и серийного полутолстого среза. Показано поперечное сечение центриоли в одной из центросом. Другая центриоль была найдена в другом разделе. Шкала 0,1 мкм
Практические соображения
Морские ежи и другие иглокожие представляют собой экономичную экспериментальную систему. У одного или нескольких организмов можно собрать большое количество яйцеклеток и спермы для выделения органелл и биохимических исследований.Гаметы и зиготы живут в морской воде; они функционируют в атмосферных условиях; и они не требуют стерильных условий. Необходимо культивировать зиготы при температуре, аналогичной той, при которой живет этот конкретный вид, — обычно это ниже нормальной комнатной температуры.
Яйца крупные (~ 70–140 мкм в диаметре в зависимости от организма). Во время ранних митозов веретена и астры большие по сравнению с соматическими клетками. Яйца некоторых видов оптически прозрачны и поэтому хорошо подходят для визуализации in vivo с использованием поляризационной или дифференциально-интерференционной контрастной оптики.Важно отметить, что можно проследить поведение веретен и центросом in vivo без флуоресцентных зондов с помощью поляризационного микроскопа (рис. А,). Так как центриоли образуют перицентриолярный материал, образующий ядра звезд, образец удвоения звезд может использоваться как мера количества и удвоения центриолей. Например, центросома, содержащая две нормальные центриоли, точно удваивается от одного клеточного цикла к другому. Центросома, содержащая одну центриоль, не удваивается в первом клеточном цикле, но затем удваивается между всеми последующими циклами (см. [2]).
Второй митоз зиготы Lytechinus pictus . На этом изображении показано использование поляризационного микроскопа для изображения веретен и звездочек в живых зиготах морского ежа с оптически прозрачными яйцами. Шпиндели имеют отрицательную компенсацию и кажутся темными. Квадранты звездочки яркие, потому что микротрубочки в этих квадрантах ориентированы под прямым углом к таковым центрального веретена. Деления шкалы находятся на расстоянии 10 мкм друг от друга
Можно проследить отдельные зиготы in vivo, а затем восстановить каждую для корреляционной световой микроскопии фиксированных клеток или электронной микроскопии (рис.а, б). Чтобы точно охарактеризовать количество и пространственное расположение центриолей в зиготах, необходимо использовать анализ серийных полутолстых сечений (см. [10]). Метод восстановления и фиксации для электронной микроскопии отдельных зигот, ранее наблюдавшихся in vivo в препаратах для микроинъекций, описан в [7]. Подробные сведения о препаратах для микроинъекций / микроманипуляций с закрытыми или открытыми поверхностями см. В [3].
Клеточный цикл зиготы является быстрым и примерно синхронным для популяции яйцеклеток, оплодотворенных в одно и то же время.Для обычно используемых иглокожих с естественной температурой от 13 до 22 ℃ продолжительность клеточного цикла составляет от 40 минут до 1,5 часов в зависимости от температуры. Поскольку исследование дупликации центросомы / центриоли часто требует отслеживания клеток в течение нескольких клеточных циклов, зиготы иглокожих позволяют проводить эксперимент утром или днем, а не в несколько дней, необходимых для соматических клеток. Поскольку эксперименты обычно длятся несколько часов, исследователь может постоянно присутствовать у микроскопа, чтобы проследить / детально отобразить 5 или более зигот за цикл.При использовании поляризационной или дифференциальной интерференционной оптики вращающийся столик позволяет выровнять каждую зиготу для оптимизации контраста. Простые системы покадровой микроскопии без компьютерно запрограммированного фокуса и положения предметного столика позволяют отслеживать одновременно только несколько клеток, часто без правильной ориентации в поле.
Зигота морского ежа устойчива и выдерживает экспериментальные воздействия, которые останавливают гибель нетрансформированных соматических клеток. Зиготы могут быть механически фрагментированы и лучше выживают при микроманипуляциях, чем культивируемые клетки.Кроме того, зиготы обладают конечной, но гораздо большей устойчивостью к воздействию синего и ближнего УФ-света, чем нетрансформированные соматические клетки. Например, воздействие на нетрансформированные человеческие клетки (RPE1) светом 488 нм, доставляемым по обычному пути эпифлуоресценции, приводит к дозозависимой остановке клеточного цикла или гибели клеток (Douthwright and Sluder, представлено). Зиготы морского ежа переносят эквивалентное воздействие света с длиной волны 366 нм, даже если он более энергичный. В связи с этим следует предостеречь: при визуализации метафазных хромосом морского ежа, окрашенных по Хехсту, в канале DAPI флуоресцентного микроскопа, необходимо соблюдать осторожность, чтобы ограничить воздействие возбуждающего света.Более длительное воздействие может привести к слипанию сестринских хромосом, и когда клетка входит в анафазу, происходит сращивание и отсутствие расхождения хромосом.
Несмотря на то, что яйца и зиготы не поддаются трансфекции, существуют хорошо зарекомендовавшие себя методы микроинъекции яиц и зигот до отслеживания их поведения in vivo.
Геномы S. purpuratus и L. variegatus секвенированы, что дает исследователю доступ к специфическим последовательностям ДНК центриолярных белков.Экспрессия новых специфических белков в зиготах может быть подавлена инъекцией сконструированных антисмысловых морфолиноолигонуклеотидов (см. Обзор [11]). Недавно сообщалось о редактировании генома в отдельных зиготах морского ежа с помощью системы CRISPR / Cas9 [12].
Набор инструментов
Ниже перечислены некоторые характеристики зиготы морского ежа, которые оказались полезными инструментами при изучении дупликации центросом.
Дупликация центросом и прогрессирование клеточного цикла не зависят от транскрипции.Когда ядро зиготы удаляется, дупликация центросомы / центриоли постоянно происходит в надлежащей координации с циклами сборки / разборки астральных микротрубочек и попытками расщепления [7].
Еще до оплодотворения яйцо морского ежа содержит обильные пулы всех субъединиц, необходимых для поддержки повторяющейся дупликации центросом для образования множества центросом. Дупликация центросомы / центриоли происходит в зиготах, по крайней мере, в течение нескольких часов, когда синтез белка полностью заблокирован [13].Присутствие относительно стабильных пулов центриолей / субъединиц центросомы может ограничивать применимость морфолиноолигонуклеотидов и подходов CRISPR / Cas9 к снижению уровней специфических центросомных белков, по крайней мере, на ранней стадии развития.
Центросомы многократно дублируются, когда зигота задерживается в S фазе [14]. Для Lytechinus pictus период редупликации составляет в среднем 148 мин (диапазон 40–257 мин) [15].
Зиготы можно разделить на части, пропустив их через пластиковую сетку вскоре после удаления оболочки для удобрения.Поскольку это делается до слияния пронуклеусов, получают смесь жизнеспособных циклически энуклеированных клеточных фрагментов; фрагменты, содержащие только мужской или женский пронуклеус, или фрагменты с обоими пронуклеусами [5]. Центросома (и) остается ассоциированной с мужским пронуклеусом.
Клеточный цикл неоплодотворенных яиц может быть искусственно активирован множеством агентов. Один из самых простых и контролируемых методов — временно повысить их внутренний pH с помощью аммонизированной морской воды [16].Такие активированные яйца или экспериментально полученные фрагменты оплодотворенных яиц, которые содержат только женский пронуклеус, организуют в митозе единый радиальный массив микротрубочек (монастер) на месте женского пронуклеуса. Однако этот монастырь не дублируется и становится все менее хорошо организованным от одного митоза к другому [5]. На ультраструктурном уровне монастырь состоит из полой фенестрированной сферы из электронно-плотного материала, из которой выходят наружу микротрубочки. Анализ серийных срезов показал отсутствие морфологических центриолей [5].Эта система может быть использована для изучения свойств и состава перицентриолярного материала, свободного от центриолей.
Партеногенез: Начиная с конца 1800-х годов, были описаны методы индукции образования центросом de novo в искусственно активированных неоплодотворенных яйцах, ведущих к партеногенетическому развитию. Короче говоря, активированное яйцо временно обезвоживается гипертонической морской водой или морской водой, содержащей глюкозу или D 2 O во время первого клеточного цикла.Собирающиеся центросомы (называемые цитастерами) содержат центриоли [17]. При тщательно подобранном лечении одна или две центросомы собираются в каждом яйце и поддерживают нормальное раннее развитие гаплоидных или диплоидных эмбрионов ([18]; ранняя работа, рассмотренная в [19]). При более сильном лечении собирается много цитастеров на яйцо, некоторые с множественными центриолями [17, 20]. Оплодотворение также можно использовать для активации яйца, а условия дегидратации будут вызывать сборку лишних цитастеров, которые дублируются в каждом клеточном цикле (Sluder and Lewis, неопубликовано).Быстрый клеточный цикл и способность иметь большое количество примерно синхронных яиц могут дать преимущества для использования современных методов изучения этого малоизученного феномена, который также встречается в трансформированных и нетрансформированных клетках человека [21, 22].
7.
Сперма морских ежей представляет собой подходящую систему для выделения центриолей, учитывая, что природа удалила из этих клеток почти всю цитоплазму. Можно собрать большие количества сперматозоидов, а лизис детергента в глюконат-глициновом буфере (см. [3]) позволяет собирать короткие дистальные центриоли (рис.) из супернатанта, хотя и с некоторым загрязнением аксонем и митохондриальных остатков (см. также [23]). Когда эти изолированные дистальные центриоли вводят в оплодотворенные яйца морских ежей, они организуют звездочки в зависимости от дозы (Sluder, неопубликовано). Можно также осаждать ядра сперматозоидов с прочно прикрепленным базальным телом — жгутиковым аппаратом.
Электронная микрофотография среза гранулы дистальных центриолей, выделенных из спермы морского ежа. Шкала шкалы 0.5 мкм
Базальные тельца
Систему морского ежа можно также использовать для исследования биологии базального тела. Центриоли функционируют как базальные тельца в сперматозоидах и развиваются, начиная с стадии мерцательной бластулы. На сегодняшний день работа над базальными телами в этой системе в значительной степени ограничена обычными ультраструктурными характеристиками тонких срезов. Тем не менее, эмбрион морского ежа обеспечивает то, что может быть уникальным средством изучения повторяющегося взаимного преобразования центриолей в базальные тельца [24].На раннем этапе развития эмбрион превращается в полый клеточный шар — бластулу. Незадолго до того, как эмбрион вылупляется из оболочки оплодотворения, каждая клетка собирает единственную подвижную ресничку. Интересно, что клетки все еще размножаются. После митоза пара центриолей мать-дочь перемещается в апикальную кору клетки, а более старая или материнская центриоль действует как базальное тело, чтобы организовать сборку аксонемы ресничек. В то время как в этой конфигурации центриоли дублируются, и незадолго до вступления в митоз аксонема быстро втягивается обратно в клетку и отделяется от материнской центриоли.Во время митоза две пары центриолей мать / дочь организуют полюса митотического веретена. Эта последовательность событий повторяется в следующем клеточном цикле.
Выводы
Гаметы и зиготы морского ежа оказались полезной экспериментальной системой, на основе которой была получена основная информация о дупликации центросом. Некоторые из важных исследований с культивированными клетками не были бы практичными или даже невозможными. Хотя использование этой системы в биологии центросом в последние годы не применялось широко, ее несколько практических преимуществ делают ее широко открытой для новых и творческих подходов с использованием современных инструментов молекулярной биологии.
Благодарности
Автор благодарит доктора Юми Уэтаке за неоценимую помощь в подготовке рисунков и форматировании ссылок. Он также благодарит доктора Боба Морриса за предоставленную полную копию статьи Масуда и Сато. Исследования автора, упомянутые в этом обзоре, были поддержаны NIH GM30758.
Конкурирующие интересы
У автора нет конкурирующих интересов.
Ссылки
1. Бобиннек Ю., Ходжаков А., Мир Л.М., Ридер К.Л., Эдде Б., Борненс М. Разборка центриолей in vivo и ее влияние на структуру и функцию центросом в клетках позвоночных.J Cell Biol. 1998. 143 (6): 1575–1589. DOI: 10.1083 / jcb.143.6.1575. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 3. Слудер Дж., Миллер Ф.Дж., Хинчклифф Э. Использование гамет морского ежа для изучения митоза. Методы Cell Biol. 1999; 61: 439–472. DOI: 10.1016 / S0091-679X (08) 61993-7. [PubMed] [CrossRef] [Google Scholar] 4. Лонго Ф. Дж., Андерсон Э. Тонкая структура развития и слияния пронуклеусов у морского ежа, Arbacia punctulata . J Cell Biol. 1968. 39 (2): 339–368. DOI: 10,1083 / JCB.39.2.339. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 5. Sluder G, Miller FJ, Rieder CL. Репродуктивная способность центросом морского ежа без центриолей. Cell Motil Cytoskelet. 1989. 13 (4): 264–273. DOI: 10,1002 / см. 970130405. [PubMed] [CrossRef] [Google Scholar] 6. Лонго Ф. Дж., Планкетт В. Начало синтеза ДНК и его связь с морфогенетическими событиями пронуклеусов в активированных яйцах морского ежа, Arbacia punctulata . Dev Biol. 1973; 30 (1): 56–67. DOI: 10.1016 / 0012-1606 (73)-1.[PubMed] [CrossRef] [Google Scholar] 7. Sluder G, Miller FJ, Rieder CL. Воспроизведение центросом: ядерный против цитоплазматического контроля. J Cell Biol. 1986; 103 (5): 1873–1881. DOI: 10.1083 / jcb.103.5.1873. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Hinegardner RT, Rao B, Feldman DE. Синтетический период ДНК во время раннего развития яйца морского ежа. Exp Cell Res. 1964; 36: 53–61. DOI: 10.1016 / 0014-4827 (64) -4. [PubMed] [CrossRef] [Google Scholar] 9. Мазия Д., Харрис П.Дж., Бибринг Т.Множественность митотических центров и время их удвоения и разделения. J Biophys Biochem Cytol. 1960; 7 (1): 1–20. DOI: 10.1083 / jcb.7.1.1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 10. Rieder CL, Rupp G, Bowser S. Электронная микроскопия полутолстых срезов: преимущества для биомедицинских исследований. J Electron Microsc Tech. 1985; 2: 11–28. DOI: 10.1002 / jemt.1060020103. [CrossRef] [Google Scholar] 11. Хисман Дж. Морфолино-олиго: понимание антисмысла? Dev Biol. 2002. 243 (2): 209–214.DOI: 10.1006 / dbio.2001.0565. [PubMed] [CrossRef] [Google Scholar] 12. Лин CY, Su YH. Редактирование генома эмбрионов морского ежа с помощью системы CRISPR / Cas9. Dev Biol0. 2016. 409 (2): 420–428. DOI: 10.1016 / j.ydbio.2015.11.018. [PubMed] [CrossRef] [Google Scholar] 13. Sluder G, Miller FJ, Cole R, Rieder CL. Синтез белка и клеточный цикл: воспроизведение центросом в яйцах морских ежей не находится под трансляционным контролем. J Cell Biol. 1990; 110 (6): 2025–2032. DOI: 10.1083 / jcb.110.6.2025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14.Слудер Г., Льюис К. Взаимосвязь между синтезом ядерной ДНК и воспроизводством центросом в яйцах морских ежей. J Exp Zool. 1987. 244 (1): 89–100. DOI: 10.1002 / jez.1402440111. [PubMed] [CrossRef] [Google Scholar] 15. Hinchcliffe EH, Cassels GO, Rieder CL, Sluder G. Координация воспроизводства центросом с ядерными событиями клеточного цикла в зиготе морского ежа. J Cell Biol. 1998. 140 (6): 1417–1426. DOI: 10.1083 / jcb.140.6.1417. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Мазия Д.Хромосомные циклы включаются в неоплодотворенных яйцах морских ежей, подвергшихся воздействию NH 4 OH. Proc Natl Acad Sci USA. 1974. 71 (3): 690–693. DOI: 10.1073 / pnas.71.3.690. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 17. Kallenbach RJ, Mazia D. Происхождение и созревание центриолей в связи с ядерной оболочкой в яйцах морских ежей, подвергшихся гипертоническому стрессу. Eur J Cell Biol. 1982. 28 (1): 68–76. [PubMed] [Google Scholar] 18. фон Ледебур-Виллигер М. Цитология и синтез нуклеиновых кислот партеногенетически активированных яиц морского ежа.Exp Cell Res. 1972. С. 72 (1): 285–308. DOI: 10.1016 / 0014-4827 (72)
-5. [PubMed] [CrossRef] [Google Scholar] 19. Уилсон ЭБ. Клетка в развитии и наследственности. Нью-Йорк: Макмиллан; 1925. [Google Scholar] 20. Курияма Р., Борисы Г.Г. Цитастеры, индуцированные в неоплодотворенных яйцах морских ежей. J Cell Sci. 1983; 61: 175–189. [PubMed] [Google Scholar] 21. La Terra S, English CN, Hergert P, McEwen BF, Sluder G, Khodjakov A. Путь сборки центриолей de novo в клетках HeLa: развитие клеточного цикла и сборка / созревание центриолей.J Cell Biol. 2005. 168 (5): 713–722. DOI: 10.1083 / jcb.200411126. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Хамагучи Ю., Курияма Р. Образование звездочек в яйцах морских ежей путем микроинъекции кальциевых буферов и центриолярных комплексов, выделенных из спермы морских звезд. Exp Cell Res. 1982. 141 (2): 450–454. DOI: 10.1016 / 0014-4827 (82)Использование гамет и зигот морского ежа для исследования дупликации центросом
Greenfield Sluder
Департамент клеточной биологии и биологии развития, Медицинская школа Университета Массачусетса, S6-212, 55 Lake Avenue North, Worcester, MA 01655 USA
Департамент клеточной биологии и биологии развития, Медицинская школа Массачусетского университета, S6-212, 55 Lake Avenue North, Worcester, MA 01655 USA
Автор, отвечающий за переписку.Поступило 5 марта 2016 г .; Принято 20 апреля 2016 г.
Открытый доступ Эта статья распространяется на условиях Международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии вы должным образом указываете первоначального автора (авторов) и источник, предоставляете ссылку на лицензию Creative Commons и указываете, были ли внесены изменения. Отказ от лицензии Creative Commons Public Domain Dedication (http: // creativecommons.org / publicdomain / zero / 1.0 /) применяется к данным, представленным в этой статье, если не указано иное. Эта статья цитировалась в других статьях PMC.Abstract
Структура и функция центриолей в зиготе морского ежа параллельны таковым в соматических клетках млекопитающих. Здесь я кратко представляю свойства и атрибуты системы морского ежа, которые делают ее привлекательной платформой для изучения центросомы и дупликации центриолей. Эти атрибуты применимы ко всем иглокожим, которые можно легко приобрести у коммерческих поставщиков: морским ежам, песчаным долларам и морским звездам.Я перечисляю некоторые практические аспекты системы, которые делают ее рентабельной и эффективной по времени системой для экспериментальной работы, а затем перечисляю свойства, которые представляют собой «набор инструментов», который можно использовать для проведения исследований, которые не были бы практичными или нецелесообразными. в некоторых случаях это невозможно с соматическими клетками млекопитающих. Поскольку центриоли организуют и локализуют перицентриолярный материал, который образует ядра астральных массивов микротрубочек (Bobinnec et al. В J Cell Biol 143 (6): 1575–1589, 1998), паттерн дупликации звездочки в течение нескольких клеточных циклов может использоваться как надежный показатель удвоения центриолей (Sluder и Rieder в J Cell Biol 100 (3): 887–896, 1985).Описания методов, которые моя лаборатория использовала для обработки и визуализации зигот иглокожих, даны в Sluder et al. (Методы Cell Biol 61: 439–472, 1999). Также включена библиография статей, в которых описаны дополнительные методы.
Ключевые слова: Центриоль, Центросома, Дупликация, Иглокожие, Яйцо, Морской еж, Сперма, Зигота
Фон
Сперма и яйцеклетка
Сперма морского ежа содержит два центриоля. Один из них служит базальным телом жгутика и имеет заметную электронно-плотную крышку на проксимальном конце, где он прочно закреплен в лопатке у основания ядра сперматозоида (рис.а, б). В поперечном сечении базальное тело имеет каноническое девятитриплетное строение. Вторая центриоль, расположенная между митохондрией и ядром (рис. А, б), также имеет каноническую девятитриплетную структуру, заключенную в электронно-плотную кольцевую матрицу (рис. В). Эта дистальная центриоль в номенклатуре [4] короткая, с соотношением сторон, напоминающим конфету «Спасатель жизни».
Ультраструктура базальных тел и дистальных центриолей сперматозоидов морского ежа. a Продольный разрез головки сперматозоида.В основании головы видны базальное тело — жгутиковый аппарат, митохондрия и короткая дистальная центриоль, лежащая между митохондрией и ядром. Здесь дистальная центриоль в тангенциальном сечении выглядит как электронно-плотное пятно на левом базального тела ( стрелка ). Шкала 1 мкм. b Продольный срез головки сперматозоида, обработанного глюконат-глициновым буфером. Плотный колпачок на проксимальном конце базального тела находится там, где он механически прикреплен к ложе в основании ядра.Митохондрия переместилась в сторону ядра вместе с дистальной центриолью, видимой в продольном сечении ( стрелка ). Шкала 1 мкм. c Поперечное сечение изолированной дистальной центриоли. Масштабная линейка 0,1 мкм
Когда самку морского ежа заставляют нереститься, икра откладывается в постмейотическом состоянии с гаплоидным интерфазным ядром. Считается, что неоплодотворенное яйцо лишено центриолей, поскольку в ультраструктурных исследованиях об этом не сообщалось.Когда клеточный цикл активируется в неоплодотворенных яйцах, нет активности, которая организует дублирующуюся центросому, и центриоли не собираются [5]. Наследование центросом у иглокожих происходит по отцовской линии; обе центриоли в сперматозоиде вносят вклад в зиготу и после дупликации организуют центросомы, используемые в развитии.
Зигота
Примерно через 15–30 минут после оплодотворения две центриоли сперматозоидов организовали сперматозоиды и дублируются в это время синтеза ДНК [6].Женский пронуклеус движется к фокусу сперматозоида и сливается с мужским пронуклеусом, образуя ядро зиготы. Позже пары центриолей мать-дочь организуют звездочки, которые отделяются от ядра зиготы перед первым митозом. Во время первых эмбриональных митозов все центриоли имеют каноническую девятитриплетную структуру (рис. B) и иногда кажутся немного отдельными внутри облака фиброзернистого перицентриолярного материала во время митоза (см. Серию серийных секций в [2, 7]). .Во время ранних митозов зигот нет никаких указаний на то, что перицентриолярный материал преимущественно накапливается вокруг более старой или материнской центриоли, как в случае соматических клеток млекопитающих. Во время митоза центриоли мать-дочь не всегда обнаруживают плотное ортогональное расположение, что поднимает вопросы о степени, в которой они механически и функционально задействованы в этой точке клеточного цикла. В телофазе центросома уплощается и синтез ДНК быстро начинается — даже до того, как все кариомеры (отдельные хромосомы или группы хромосом, вокруг которых собираются ядерные оболочки) слились, чтобы сформировать интерфазное ядро [8].Центриоли в это время дублируются [9].
a Энуклеированная зигота морского ежа, за которой наблюдали in vivo для характеристики дупликации центросомы. Каждая дублированная центросома организует двойную лучепреломляющую звезду, как это видно с помощью поляризационного микроскопа. Двулучепреломление и появление звездочек указывают на то, что эта энуклеированная зигота находилась в митозе, когда была сделана фотография. Преломляющая сфера, немного не в фокусе в центре ячейки, представляет собой каплю минерального масла, используемого для закрытия микропипетки, используемой для энуклеации зиготы.Деления шкалы удалены друг от друга на 10 мкм. b Эта конкретная зигота была извлечена из препарированного, фиксированного и серийного полутолстого среза. Показано поперечное сечение центриоли в одной из центросом. Другая центриоль была найдена в другом разделе. Шкала 0,1 мкм
Практические соображения
Морские ежи и другие иглокожие представляют собой экономичную экспериментальную систему. У одного или нескольких организмов можно собрать большое количество яйцеклеток и спермы для выделения органелл и биохимических исследований.Гаметы и зиготы живут в морской воде; они функционируют в атмосферных условиях; и они не требуют стерильных условий. Необходимо культивировать зиготы при температуре, аналогичной той, при которой живет этот конкретный вид, — обычно это ниже нормальной комнатной температуры.
Яйца крупные (~ 70–140 мкм в диаметре в зависимости от организма). Во время ранних митозов веретена и астры большие по сравнению с соматическими клетками. Яйца некоторых видов оптически прозрачны и поэтому хорошо подходят для визуализации in vivo с использованием поляризационной или дифференциально-интерференционной контрастной оптики.Важно отметить, что можно проследить поведение веретен и центросом in vivo без флуоресцентных зондов с помощью поляризационного микроскопа (рис. А,). Так как центриоли образуют перицентриолярный материал, образующий ядра звезд, образец удвоения звезд может использоваться как мера количества и удвоения центриолей. Например, центросома, содержащая две нормальные центриоли, точно удваивается от одного клеточного цикла к другому. Центросома, содержащая одну центриоль, не удваивается в первом клеточном цикле, но затем удваивается между всеми последующими циклами (см. [2]).
Второй митоз зиготы Lytechinus pictus . На этом изображении показано использование поляризационного микроскопа для изображения веретен и звездочек в живых зиготах морского ежа с оптически прозрачными яйцами. Шпиндели имеют отрицательную компенсацию и кажутся темными. Квадранты звездочки яркие, потому что микротрубочки в этих квадрантах ориентированы под прямым углом к таковым центрального веретена. Деления шкалы находятся на расстоянии 10 мкм друг от друга
Можно проследить отдельные зиготы in vivo, а затем восстановить каждую для корреляционной световой микроскопии фиксированных клеток или электронной микроскопии (рис.а, б). Чтобы точно охарактеризовать количество и пространственное расположение центриолей в зиготах, необходимо использовать анализ серийных полутолстых сечений (см. [10]). Метод восстановления и фиксации для электронной микроскопии отдельных зигот, ранее наблюдавшихся in vivo в препаратах для микроинъекций, описан в [7]. Подробные сведения о препаратах для микроинъекций / микроманипуляций с закрытыми или открытыми поверхностями см. В [3].
Клеточный цикл зиготы является быстрым и примерно синхронным для популяции яйцеклеток, оплодотворенных в одно и то же время.Для обычно используемых иглокожих с естественной температурой от 13 до 22 ℃ продолжительность клеточного цикла составляет от 40 минут до 1,5 часов в зависимости от температуры. Поскольку исследование дупликации центросомы / центриоли часто требует отслеживания клеток в течение нескольких клеточных циклов, зиготы иглокожих позволяют проводить эксперимент утром или днем, а не в несколько дней, необходимых для соматических клеток. Поскольку эксперименты обычно длятся несколько часов, исследователь может постоянно присутствовать у микроскопа, чтобы проследить / детально отобразить 5 или более зигот за цикл.При использовании поляризационной или дифференциальной интерференционной оптики вращающийся столик позволяет выровнять каждую зиготу для оптимизации контраста. Простые системы покадровой микроскопии без компьютерно запрограммированного фокуса и положения предметного столика позволяют отслеживать одновременно только несколько клеток, часто без правильной ориентации в поле.
Зигота морского ежа устойчива и выдерживает экспериментальные воздействия, которые останавливают гибель нетрансформированных соматических клеток. Зиготы могут быть механически фрагментированы и лучше выживают при микроманипуляциях, чем культивируемые клетки.Кроме того, зиготы обладают конечной, но гораздо большей устойчивостью к воздействию синего и ближнего УФ-света, чем нетрансформированные соматические клетки. Например, воздействие на нетрансформированные человеческие клетки (RPE1) светом 488 нм, доставляемым по обычному пути эпифлуоресценции, приводит к дозозависимой остановке клеточного цикла или гибели клеток (Douthwright and Sluder, представлено). Зиготы морского ежа переносят эквивалентное воздействие света с длиной волны 366 нм, даже если он более энергичный. В связи с этим следует предостеречь: при визуализации метафазных хромосом морского ежа, окрашенных по Хехсту, в канале DAPI флуоресцентного микроскопа, необходимо соблюдать осторожность, чтобы ограничить воздействие возбуждающего света.Более длительное воздействие может привести к слипанию сестринских хромосом, и когда клетка входит в анафазу, происходит сращивание и отсутствие расхождения хромосом.
Несмотря на то, что яйца и зиготы не поддаются трансфекции, существуют хорошо зарекомендовавшие себя методы микроинъекции яиц и зигот до отслеживания их поведения in vivo.
Геномы S. purpuratus и L. variegatus секвенированы, что дает исследователю доступ к специфическим последовательностям ДНК центриолярных белков.Экспрессия новых специфических белков в зиготах может быть подавлена инъекцией сконструированных антисмысловых морфолиноолигонуклеотидов (см. Обзор [11]). Недавно сообщалось о редактировании генома в отдельных зиготах морского ежа с помощью системы CRISPR / Cas9 [12].
Набор инструментов
Ниже перечислены некоторые характеристики зиготы морского ежа, которые оказались полезными инструментами при изучении дупликации центросом.
Дупликация центросом и прогрессирование клеточного цикла не зависят от транскрипции.Когда ядро зиготы удаляется, дупликация центросомы / центриоли постоянно происходит в надлежащей координации с циклами сборки / разборки астральных микротрубочек и попытками расщепления [7].
Еще до оплодотворения яйцо морского ежа содержит обильные пулы всех субъединиц, необходимых для поддержки повторяющейся дупликации центросом для образования множества центросом. Дупликация центросомы / центриоли происходит в зиготах, по крайней мере, в течение нескольких часов, когда синтез белка полностью заблокирован [13].Присутствие относительно стабильных пулов центриолей / субъединиц центросомы может ограничивать применимость морфолиноолигонуклеотидов и подходов CRISPR / Cas9 к снижению уровней специфических центросомных белков, по крайней мере, на ранней стадии развития.
Центросомы многократно дублируются, когда зигота задерживается в S фазе [14]. Для Lytechinus pictus период редупликации составляет в среднем 148 мин (диапазон 40–257 мин) [15].
Зиготы можно разделить на части, пропустив их через пластиковую сетку вскоре после удаления оболочки для удобрения.Поскольку это делается до слияния пронуклеусов, получают смесь жизнеспособных циклически энуклеированных клеточных фрагментов; фрагменты, содержащие только мужской или женский пронуклеус, или фрагменты с обоими пронуклеусами [5]. Центросома (и) остается ассоциированной с мужским пронуклеусом.
Клеточный цикл неоплодотворенных яиц может быть искусственно активирован множеством агентов. Один из самых простых и контролируемых методов — временно повысить их внутренний pH с помощью аммонизированной морской воды [16].Такие активированные яйца или экспериментально полученные фрагменты оплодотворенных яиц, которые содержат только женский пронуклеус, организуют в митозе единый радиальный массив микротрубочек (монастер) на месте женского пронуклеуса. Однако этот монастырь не дублируется и становится все менее хорошо организованным от одного митоза к другому [5]. На ультраструктурном уровне монастырь состоит из полой фенестрированной сферы из электронно-плотного материала, из которой выходят наружу микротрубочки. Анализ серийных срезов показал отсутствие морфологических центриолей [5].Эта система может быть использована для изучения свойств и состава перицентриолярного материала, свободного от центриолей.
Партеногенез: Начиная с конца 1800-х годов, были описаны методы индукции образования центросом de novo в искусственно активированных неоплодотворенных яйцах, ведущих к партеногенетическому развитию. Короче говоря, активированное яйцо временно обезвоживается гипертонической морской водой или морской водой, содержащей глюкозу или D 2 O во время первого клеточного цикла.Собирающиеся центросомы (называемые цитастерами) содержат центриоли [17]. При тщательно подобранном лечении одна или две центросомы собираются в каждом яйце и поддерживают нормальное раннее развитие гаплоидных или диплоидных эмбрионов ([18]; ранняя работа, рассмотренная в [19]). При более сильном лечении собирается много цитастеров на яйцо, некоторые с множественными центриолями [17, 20]. Оплодотворение также можно использовать для активации яйца, а условия дегидратации будут вызывать сборку лишних цитастеров, которые дублируются в каждом клеточном цикле (Sluder and Lewis, неопубликовано).Быстрый клеточный цикл и способность иметь большое количество примерно синхронных яиц могут дать преимущества для использования современных методов изучения этого малоизученного феномена, который также встречается в трансформированных и нетрансформированных клетках человека [21, 22].
7.
Сперма морских ежей представляет собой подходящую систему для выделения центриолей, учитывая, что природа удалила из этих клеток почти всю цитоплазму. Можно собрать большие количества сперматозоидов, а лизис детергента в глюконат-глициновом буфере (см. [3]) позволяет собирать короткие дистальные центриоли (рис.) из супернатанта, хотя и с некоторым загрязнением аксонем и митохондриальных остатков (см. также [23]). Когда эти изолированные дистальные центриоли вводят в оплодотворенные яйца морских ежей, они организуют звездочки в зависимости от дозы (Sluder, неопубликовано). Можно также осаждать ядра сперматозоидов с прочно прикрепленным базальным телом — жгутиковым аппаратом.
Электронная микрофотография среза гранулы дистальных центриолей, выделенных из спермы морского ежа. Шкала шкалы 0.5 мкм
Базальные тельца
Систему морского ежа можно также использовать для исследования биологии базального тела. Центриоли функционируют как базальные тельца в сперматозоидах и развиваются, начиная с стадии мерцательной бластулы. На сегодняшний день работа над базальными телами в этой системе в значительной степени ограничена обычными ультраструктурными характеристиками тонких срезов. Тем не менее, эмбрион морского ежа обеспечивает то, что может быть уникальным средством изучения повторяющегося взаимного преобразования центриолей в базальные тельца [24].На раннем этапе развития эмбрион превращается в полый клеточный шар — бластулу. Незадолго до того, как эмбрион вылупляется из оболочки оплодотворения, каждая клетка собирает единственную подвижную ресничку. Интересно, что клетки все еще размножаются. После митоза пара центриолей мать-дочь перемещается в апикальную кору клетки, а более старая или материнская центриоль действует как базальное тело, чтобы организовать сборку аксонемы ресничек. В то время как в этой конфигурации центриоли дублируются, и незадолго до вступления в митоз аксонема быстро втягивается обратно в клетку и отделяется от материнской центриоли.Во время митоза две пары центриолей мать / дочь организуют полюса митотического веретена. Эта последовательность событий повторяется в следующем клеточном цикле.
Выводы
Гаметы и зиготы морского ежа оказались полезной экспериментальной системой, на основе которой была получена основная информация о дупликации центросом. Некоторые из важных исследований с культивированными клетками не были бы практичными или даже невозможными. Хотя использование этой системы в биологии центросом в последние годы не применялось широко, ее несколько практических преимуществ делают ее широко открытой для новых и творческих подходов с использованием современных инструментов молекулярной биологии.
Благодарности
Автор благодарит доктора Юми Уэтаке за неоценимую помощь в подготовке рисунков и форматировании ссылок. Он также благодарит доктора Боба Морриса за предоставленную полную копию статьи Масуда и Сато. Исследования автора, упомянутые в этом обзоре, были поддержаны NIH GM30758.
Конкурирующие интересы
У автора нет конкурирующих интересов.
Ссылки
1. Бобиннек Ю., Ходжаков А., Мир Л.М., Ридер К.Л., Эдде Б., Борненс М. Разборка центриолей in vivo и ее влияние на структуру и функцию центросом в клетках позвоночных.J Cell Biol. 1998. 143 (6): 1575–1589. DOI: 10.1083 / jcb.143.6.1575. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 3. Слудер Дж., Миллер Ф.Дж., Хинчклифф Э. Использование гамет морского ежа для изучения митоза. Методы Cell Biol. 1999; 61: 439–472. DOI: 10.1016 / S0091-679X (08) 61993-7. [PubMed] [CrossRef] [Google Scholar] 4. Лонго Ф. Дж., Андерсон Э. Тонкая структура развития и слияния пронуклеусов у морского ежа, Arbacia punctulata . J Cell Biol. 1968. 39 (2): 339–368. DOI: 10,1083 / JCB.39.2.339. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 5. Sluder G, Miller FJ, Rieder CL. Репродуктивная способность центросом морского ежа без центриолей. Cell Motil Cytoskelet. 1989. 13 (4): 264–273. DOI: 10,1002 / см. 970130405. [PubMed] [CrossRef] [Google Scholar] 6. Лонго Ф. Дж., Планкетт В. Начало синтеза ДНК и его связь с морфогенетическими событиями пронуклеусов в активированных яйцах морского ежа, Arbacia punctulata . Dev Biol. 1973; 30 (1): 56–67. DOI: 10.1016 / 0012-1606 (73)-1.[PubMed] [CrossRef] [Google Scholar] 7. Sluder G, Miller FJ, Rieder CL. Воспроизведение центросом: ядерный против цитоплазматического контроля. J Cell Biol. 1986; 103 (5): 1873–1881. DOI: 10.1083 / jcb.103.5.1873. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Hinegardner RT, Rao B, Feldman DE. Синтетический период ДНК во время раннего развития яйца морского ежа. Exp Cell Res. 1964; 36: 53–61. DOI: 10.1016 / 0014-4827 (64) -4. [PubMed] [CrossRef] [Google Scholar] 9. Мазия Д., Харрис П.Дж., Бибринг Т.Множественность митотических центров и время их удвоения и разделения. J Biophys Biochem Cytol. 1960; 7 (1): 1–20. DOI: 10.1083 / jcb.7.1.1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 10. Rieder CL, Rupp G, Bowser S. Электронная микроскопия полутолстых срезов: преимущества для биомедицинских исследований. J Electron Microsc Tech. 1985; 2: 11–28. DOI: 10.1002 / jemt.1060020103. [CrossRef] [Google Scholar] 11. Хисман Дж. Морфолино-олиго: понимание антисмысла? Dev Biol. 2002. 243 (2): 209–214.DOI: 10.1006 / dbio.2001.0565. [PubMed] [CrossRef] [Google Scholar] 12. Лин CY, Su YH. Редактирование генома эмбрионов морского ежа с помощью системы CRISPR / Cas9. Dev Biol0. 2016. 409 (2): 420–428. DOI: 10.1016 / j.ydbio.2015.11.018. [PubMed] [CrossRef] [Google Scholar] 13. Sluder G, Miller FJ, Cole R, Rieder CL. Синтез белка и клеточный цикл: воспроизведение центросом в яйцах морских ежей не находится под трансляционным контролем. J Cell Biol. 1990; 110 (6): 2025–2032. DOI: 10.1083 / jcb.110.6.2025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14.Слудер Г., Льюис К. Взаимосвязь между синтезом ядерной ДНК и воспроизводством центросом в яйцах морских ежей. J Exp Zool. 1987. 244 (1): 89–100. DOI: 10.1002 / jez.1402440111. [PubMed] [CrossRef] [Google Scholar] 15. Hinchcliffe EH, Cassels GO, Rieder CL, Sluder G. Координация воспроизводства центросом с ядерными событиями клеточного цикла в зиготе морского ежа. J Cell Biol. 1998. 140 (6): 1417–1426. DOI: 10.1083 / jcb.140.6.1417. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Мазия Д.Хромосомные циклы включаются в неоплодотворенных яйцах морских ежей, подвергшихся воздействию NH 4 OH. Proc Natl Acad Sci USA. 1974. 71 (3): 690–693. DOI: 10.1073 / pnas.71.3.690. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 17. Kallenbach RJ, Mazia D. Происхождение и созревание центриолей в связи с ядерной оболочкой в яйцах морских ежей, подвергшихся гипертоническому стрессу. Eur J Cell Biol. 1982. 28 (1): 68–76. [PubMed] [Google Scholar] 18. фон Ледебур-Виллигер М. Цитология и синтез нуклеиновых кислот партеногенетически активированных яиц морского ежа.Exp Cell Res. 1972. С. 72 (1): 285–308. DOI: 10.1016 / 0014-4827 (72)
-5. [PubMed] [CrossRef] [Google Scholar] 19. Уилсон ЭБ. Клетка в развитии и наследственности. Нью-Йорк: Макмиллан; 1925. [Google Scholar] 20. Курияма Р., Борисы Г.Г. Цитастеры, индуцированные в неоплодотворенных яйцах морских ежей. J Cell Sci. 1983; 61: 175–189. [PubMed] [Google Scholar] 21. La Terra S, English CN, Hergert P, McEwen BF, Sluder G, Khodjakov A. Путь сборки центриолей de novo в клетках HeLa: развитие клеточного цикла и сборка / созревание центриолей.J Cell Biol. 2005. 168 (5): 713–722. DOI: 10.1083 / jcb.200411126. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Хамагучи Ю., Курияма Р. Образование звездочек в яйцах морских ежей путем микроинъекции кальциевых буферов и центриолярных комплексов, выделенных из спермы морских звезд. Exp Cell Res. 1982. 141 (2): 450–454. DOI: 10.1016 / 0014-4827 (82)Использование гамет и зигот морского ежа для исследования дупликации центросом
Greenfield Sluder
Департамент клеточной биологии и биологии развития, Медицинская школа Университета Массачусетса, S6-212, 55 Lake Avenue North, Worcester, MA 01655 USA
Департамент клеточной биологии и биологии развития, Медицинская школа Массачусетского университета, S6-212, 55 Lake Avenue North, Worcester, MA 01655 USA
Автор, отвечающий за переписку.Поступило 5 марта 2016 г .; Принято 20 апреля 2016 г.
Открытый доступ Эта статья распространяется на условиях Международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии вы должным образом указываете первоначального автора (авторов) и источник, предоставляете ссылку на лицензию Creative Commons и указываете, были ли внесены изменения. Отказ от лицензии Creative Commons Public Domain Dedication (http: // creativecommons.org / publicdomain / zero / 1.0 /) применяется к данным, представленным в этой статье, если не указано иное. Эта статья цитировалась в других статьях PMC.Abstract
Структура и функция центриолей в зиготе морского ежа параллельны таковым в соматических клетках млекопитающих. Здесь я кратко представляю свойства и атрибуты системы морского ежа, которые делают ее привлекательной платформой для изучения центросомы и дупликации центриолей. Эти атрибуты применимы ко всем иглокожим, которые можно легко приобрести у коммерческих поставщиков: морским ежам, песчаным долларам и морским звездам.Я перечисляю некоторые практические аспекты системы, которые делают ее рентабельной и эффективной по времени системой для экспериментальной работы, а затем перечисляю свойства, которые представляют собой «набор инструментов», который можно использовать для проведения исследований, которые не были бы практичными или нецелесообразными. в некоторых случаях это невозможно с соматическими клетками млекопитающих. Поскольку центриоли организуют и локализуют перицентриолярный материал, который образует ядра астральных массивов микротрубочек (Bobinnec et al. В J Cell Biol 143 (6): 1575–1589, 1998), паттерн дупликации звездочки в течение нескольких клеточных циклов может использоваться как надежный показатель удвоения центриолей (Sluder и Rieder в J Cell Biol 100 (3): 887–896, 1985).Описания методов, которые моя лаборатория использовала для обработки и визуализации зигот иглокожих, даны в Sluder et al. (Методы Cell Biol 61: 439–472, 1999). Также включена библиография статей, в которых описаны дополнительные методы.
Ключевые слова: Центриоль, Центросома, Дупликация, Иглокожие, Яйцо, Морской еж, Сперма, Зигота
Фон
Сперма и яйцеклетка
Сперма морского ежа содержит два центриоля. Один из них служит базальным телом жгутика и имеет заметную электронно-плотную крышку на проксимальном конце, где он прочно закреплен в лопатке у основания ядра сперматозоида (рис.а, б). В поперечном сечении базальное тело имеет каноническое девятитриплетное строение. Вторая центриоль, расположенная между митохондрией и ядром (рис. А, б), также имеет каноническую девятитриплетную структуру, заключенную в электронно-плотную кольцевую матрицу (рис. В). Эта дистальная центриоль в номенклатуре [4] короткая, с соотношением сторон, напоминающим конфету «Спасатель жизни».
Ультраструктура базальных тел и дистальных центриолей сперматозоидов морского ежа. a Продольный разрез головки сперматозоида.В основании головы видны базальное тело — жгутиковый аппарат, митохондрия и короткая дистальная центриоль, лежащая между митохондрией и ядром. Здесь дистальная центриоль в тангенциальном сечении выглядит как электронно-плотное пятно на левом базального тела ( стрелка ). Шкала 1 мкм. b Продольный срез головки сперматозоида, обработанного глюконат-глициновым буфером. Плотный колпачок на проксимальном конце базального тела находится там, где он механически прикреплен к ложе в основании ядра.Митохондрия переместилась в сторону ядра вместе с дистальной центриолью, видимой в продольном сечении ( стрелка ). Шкала 1 мкм. c Поперечное сечение изолированной дистальной центриоли. Масштабная линейка 0,1 мкм
Когда самку морского ежа заставляют нереститься, икра откладывается в постмейотическом состоянии с гаплоидным интерфазным ядром. Считается, что неоплодотворенное яйцо лишено центриолей, поскольку в ультраструктурных исследованиях об этом не сообщалось.Когда клеточный цикл активируется в неоплодотворенных яйцах, нет активности, которая организует дублирующуюся центросому, и центриоли не собираются [5]. Наследование центросом у иглокожих происходит по отцовской линии; обе центриоли в сперматозоиде вносят вклад в зиготу и после дупликации организуют центросомы, используемые в развитии.
Зигота
Примерно через 15–30 минут после оплодотворения две центриоли сперматозоидов организовали сперматозоиды и дублируются в это время синтеза ДНК [6].Женский пронуклеус движется к фокусу сперматозоида и сливается с мужским пронуклеусом, образуя ядро зиготы. Позже пары центриолей мать-дочь организуют звездочки, которые отделяются от ядра зиготы перед первым митозом. Во время первых эмбриональных митозов все центриоли имеют каноническую девятитриплетную структуру (рис. B) и иногда кажутся немного отдельными внутри облака фиброзернистого перицентриолярного материала во время митоза (см. Серию серийных секций в [2, 7]). .Во время ранних митозов зигот нет никаких указаний на то, что перицентриолярный материал преимущественно накапливается вокруг более старой или материнской центриоли, как в случае соматических клеток млекопитающих. Во время митоза центриоли мать-дочь не всегда обнаруживают плотное ортогональное расположение, что поднимает вопросы о степени, в которой они механически и функционально задействованы в этой точке клеточного цикла. В телофазе центросома уплощается и синтез ДНК быстро начинается — даже до того, как все кариомеры (отдельные хромосомы или группы хромосом, вокруг которых собираются ядерные оболочки) слились, чтобы сформировать интерфазное ядро [8].Центриоли в это время дублируются [9].
a Энуклеированная зигота морского ежа, за которой наблюдали in vivo для характеристики дупликации центросомы. Каждая дублированная центросома организует двойную лучепреломляющую звезду, как это видно с помощью поляризационного микроскопа. Двулучепреломление и появление звездочек указывают на то, что эта энуклеированная зигота находилась в митозе, когда была сделана фотография. Преломляющая сфера, немного не в фокусе в центре ячейки, представляет собой каплю минерального масла, используемого для закрытия микропипетки, используемой для энуклеации зиготы.Деления шкалы удалены друг от друга на 10 мкм. b Эта конкретная зигота была извлечена из препарированного, фиксированного и серийного полутолстого среза. Показано поперечное сечение центриоли в одной из центросом. Другая центриоль была найдена в другом разделе. Шкала 0,1 мкм
Практические соображения
Морские ежи и другие иглокожие представляют собой экономичную экспериментальную систему. У одного или нескольких организмов можно собрать большое количество яйцеклеток и спермы для выделения органелл и биохимических исследований.Гаметы и зиготы живут в морской воде; они функционируют в атмосферных условиях; и они не требуют стерильных условий. Необходимо культивировать зиготы при температуре, аналогичной той, при которой живет этот конкретный вид, — обычно это ниже нормальной комнатной температуры.
Яйца крупные (~ 70–140 мкм в диаметре в зависимости от организма). Во время ранних митозов веретена и астры большие по сравнению с соматическими клетками. Яйца некоторых видов оптически прозрачны и поэтому хорошо подходят для визуализации in vivo с использованием поляризационной или дифференциально-интерференционной контрастной оптики.Важно отметить, что можно проследить поведение веретен и центросом in vivo без флуоресцентных зондов с помощью поляризационного микроскопа (рис. А,). Так как центриоли образуют перицентриолярный материал, образующий ядра звезд, образец удвоения звезд может использоваться как мера количества и удвоения центриолей. Например, центросома, содержащая две нормальные центриоли, точно удваивается от одного клеточного цикла к другому. Центросома, содержащая одну центриоль, не удваивается в первом клеточном цикле, но затем удваивается между всеми последующими циклами (см. [2]).
Второй митоз зиготы Lytechinus pictus . На этом изображении показано использование поляризационного микроскопа для изображения веретен и звездочек в живых зиготах морского ежа с оптически прозрачными яйцами. Шпиндели имеют отрицательную компенсацию и кажутся темными. Квадранты звездочки яркие, потому что микротрубочки в этих квадрантах ориентированы под прямым углом к таковым центрального веретена. Деления шкалы находятся на расстоянии 10 мкм друг от друга
Можно проследить отдельные зиготы in vivo, а затем восстановить каждую для корреляционной световой микроскопии фиксированных клеток или электронной микроскопии (рис.а, б). Чтобы точно охарактеризовать количество и пространственное расположение центриолей в зиготах, необходимо использовать анализ серийных полутолстых сечений (см. [10]). Метод восстановления и фиксации для электронной микроскопии отдельных зигот, ранее наблюдавшихся in vivo в препаратах для микроинъекций, описан в [7]. Подробные сведения о препаратах для микроинъекций / микроманипуляций с закрытыми или открытыми поверхностями см. В [3].
Клеточный цикл зиготы является быстрым и примерно синхронным для популяции яйцеклеток, оплодотворенных в одно и то же время.Для обычно используемых иглокожих с естественной температурой от 13 до 22 ℃ продолжительность клеточного цикла составляет от 40 минут до 1,5 часов в зависимости от температуры. Поскольку исследование дупликации центросомы / центриоли часто требует отслеживания клеток в течение нескольких клеточных циклов, зиготы иглокожих позволяют проводить эксперимент утром или днем, а не в несколько дней, необходимых для соматических клеток. Поскольку эксперименты обычно длятся несколько часов, исследователь может постоянно присутствовать у микроскопа, чтобы проследить / детально отобразить 5 или более зигот за цикл.При использовании поляризационной или дифференциальной интерференционной оптики вращающийся столик позволяет выровнять каждую зиготу для оптимизации контраста. Простые системы покадровой микроскопии без компьютерно запрограммированного фокуса и положения предметного столика позволяют отслеживать одновременно только несколько клеток, часто без правильной ориентации в поле.
Зигота морского ежа устойчива и выдерживает экспериментальные воздействия, которые останавливают гибель нетрансформированных соматических клеток. Зиготы могут быть механически фрагментированы и лучше выживают при микроманипуляциях, чем культивируемые клетки.Кроме того, зиготы обладают конечной, но гораздо большей устойчивостью к воздействию синего и ближнего УФ-света, чем нетрансформированные соматические клетки. Например, воздействие на нетрансформированные человеческие клетки (RPE1) светом 488 нм, доставляемым по обычному пути эпифлуоресценции, приводит к дозозависимой остановке клеточного цикла или гибели клеток (Douthwright and Sluder, представлено). Зиготы морского ежа переносят эквивалентное воздействие света с длиной волны 366 нм, даже если он более энергичный. В связи с этим следует предостеречь: при визуализации метафазных хромосом морского ежа, окрашенных по Хехсту, в канале DAPI флуоресцентного микроскопа, необходимо соблюдать осторожность, чтобы ограничить воздействие возбуждающего света.Более длительное воздействие может привести к слипанию сестринских хромосом, и когда клетка входит в анафазу, происходит сращивание и отсутствие расхождения хромосом.
Несмотря на то, что яйца и зиготы не поддаются трансфекции, существуют хорошо зарекомендовавшие себя методы микроинъекции яиц и зигот до отслеживания их поведения in vivo.
Геномы S. purpuratus и L. variegatus секвенированы, что дает исследователю доступ к специфическим последовательностям ДНК центриолярных белков.Экспрессия новых специфических белков в зиготах может быть подавлена инъекцией сконструированных антисмысловых морфолиноолигонуклеотидов (см. Обзор [11]). Недавно сообщалось о редактировании генома в отдельных зиготах морского ежа с помощью системы CRISPR / Cas9 [12].
Набор инструментов
Ниже перечислены некоторые характеристики зиготы морского ежа, которые оказались полезными инструментами при изучении дупликации центросом.
Дупликация центросом и прогрессирование клеточного цикла не зависят от транскрипции.Когда ядро зиготы удаляется, дупликация центросомы / центриоли постоянно происходит в надлежащей координации с циклами сборки / разборки астральных микротрубочек и попытками расщепления [7].
Еще до оплодотворения яйцо морского ежа содержит обильные пулы всех субъединиц, необходимых для поддержки повторяющейся дупликации центросом для образования множества центросом. Дупликация центросомы / центриоли происходит в зиготах, по крайней мере, в течение нескольких часов, когда синтез белка полностью заблокирован [13].Присутствие относительно стабильных пулов центриолей / субъединиц центросомы может ограничивать применимость морфолиноолигонуклеотидов и подходов CRISPR / Cas9 к снижению уровней специфических центросомных белков, по крайней мере, на ранней стадии развития.
Центросомы многократно дублируются, когда зигота задерживается в S фазе [14]. Для Lytechinus pictus период редупликации составляет в среднем 148 мин (диапазон 40–257 мин) [15].
Зиготы можно разделить на части, пропустив их через пластиковую сетку вскоре после удаления оболочки для удобрения.Поскольку это делается до слияния пронуклеусов, получают смесь жизнеспособных циклически энуклеированных клеточных фрагментов; фрагменты, содержащие только мужской или женский пронуклеус, или фрагменты с обоими пронуклеусами [5]. Центросома (и) остается ассоциированной с мужским пронуклеусом.
Клеточный цикл неоплодотворенных яиц может быть искусственно активирован множеством агентов. Один из самых простых и контролируемых методов — временно повысить их внутренний pH с помощью аммонизированной морской воды [16].Такие активированные яйца или экспериментально полученные фрагменты оплодотворенных яиц, которые содержат только женский пронуклеус, организуют в митозе единый радиальный массив микротрубочек (монастер) на месте женского пронуклеуса. Однако этот монастырь не дублируется и становится все менее хорошо организованным от одного митоза к другому [5]. На ультраструктурном уровне монастырь состоит из полой фенестрированной сферы из электронно-плотного материала, из которой выходят наружу микротрубочки. Анализ серийных срезов показал отсутствие морфологических центриолей [5].Эта система может быть использована для изучения свойств и состава перицентриолярного материала, свободного от центриолей.
Партеногенез: Начиная с конца 1800-х годов, были описаны методы индукции образования центросом de novo в искусственно активированных неоплодотворенных яйцах, ведущих к партеногенетическому развитию. Короче говоря, активированное яйцо временно обезвоживается гипертонической морской водой или морской водой, содержащей глюкозу или D 2 O во время первого клеточного цикла.Собирающиеся центросомы (называемые цитастерами) содержат центриоли [17]. При тщательно подобранном лечении одна или две центросомы собираются в каждом яйце и поддерживают нормальное раннее развитие гаплоидных или диплоидных эмбрионов ([18]; ранняя работа, рассмотренная в [19]). При более сильном лечении собирается много цитастеров на яйцо, некоторые с множественными центриолями [17, 20]. Оплодотворение также можно использовать для активации яйца, а условия дегидратации будут вызывать сборку лишних цитастеров, которые дублируются в каждом клеточном цикле (Sluder and Lewis, неопубликовано).Быстрый клеточный цикл и способность иметь большое количество примерно синхронных яиц могут дать преимущества для использования современных методов изучения этого малоизученного феномена, который также встречается в трансформированных и нетрансформированных клетках человека [21, 22].
7.
Сперма морских ежей представляет собой подходящую систему для выделения центриолей, учитывая, что природа удалила из этих клеток почти всю цитоплазму. Можно собрать большие количества сперматозоидов, а лизис детергента в глюконат-глициновом буфере (см. [3]) позволяет собирать короткие дистальные центриоли (рис.) из супернатанта, хотя и с некоторым загрязнением аксонем и митохондриальных остатков (см. также [23]). Когда эти изолированные дистальные центриоли вводят в оплодотворенные яйца морских ежей, они организуют звездочки в зависимости от дозы (Sluder, неопубликовано). Можно также осаждать ядра сперматозоидов с прочно прикрепленным базальным телом — жгутиковым аппаратом.
Электронная микрофотография среза гранулы дистальных центриолей, выделенных из спермы морского ежа. Шкала шкалы 0.5 мкм
Базальные тельца
Систему морского ежа можно также использовать для исследования биологии базального тела. Центриоли функционируют как базальные тельца в сперматозоидах и развиваются, начиная с стадии мерцательной бластулы. На сегодняшний день работа над базальными телами в этой системе в значительной степени ограничена обычными ультраструктурными характеристиками тонких срезов. Тем не менее, эмбрион морского ежа обеспечивает то, что может быть уникальным средством изучения повторяющегося взаимного преобразования центриолей в базальные тельца [24].На раннем этапе развития эмбрион превращается в полый клеточный шар — бластулу. Незадолго до того, как эмбрион вылупляется из оболочки оплодотворения, каждая клетка собирает единственную подвижную ресничку. Интересно, что клетки все еще размножаются. После митоза пара центриолей мать-дочь перемещается в апикальную кору клетки, а более старая или материнская центриоль действует как базальное тело, чтобы организовать сборку аксонемы ресничек. В то время как в этой конфигурации центриоли дублируются, и незадолго до вступления в митоз аксонема быстро втягивается обратно в клетку и отделяется от материнской центриоли.Во время митоза две пары центриолей мать / дочь организуют полюса митотического веретена. Эта последовательность событий повторяется в следующем клеточном цикле.
Выводы
Гаметы и зиготы морского ежа оказались полезной экспериментальной системой, на основе которой была получена основная информация о дупликации центросом. Некоторые из важных исследований с культивированными клетками не были бы практичными или даже невозможными. Хотя использование этой системы в биологии центросом в последние годы не применялось широко, ее несколько практических преимуществ делают ее широко открытой для новых и творческих подходов с использованием современных инструментов молекулярной биологии.
Благодарности
Автор благодарит доктора Юми Уэтаке за неоценимую помощь в подготовке рисунков и форматировании ссылок. Он также благодарит доктора Боба Морриса за предоставленную полную копию статьи Масуда и Сато. Исследования автора, упомянутые в этом обзоре, были поддержаны NIH GM30758.
Конкурирующие интересы
У автора нет конкурирующих интересов.
Ссылки
1. Бобиннек Ю., Ходжаков А., Мир Л.М., Ридер К.Л., Эдде Б., Борненс М. Разборка центриолей in vivo и ее влияние на структуру и функцию центросом в клетках позвоночных.J Cell Biol. 1998. 143 (6): 1575–1589. DOI: 10.1083 / jcb.143.6.1575. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 3. Слудер Дж., Миллер Ф.Дж., Хинчклифф Э. Использование гамет морского ежа для изучения митоза. Методы Cell Biol. 1999; 61: 439–472. DOI: 10.1016 / S0091-679X (08) 61993-7. [PubMed] [CrossRef] [Google Scholar] 4. Лонго Ф. Дж., Андерсон Э. Тонкая структура развития и слияния пронуклеусов у морского ежа, Arbacia punctulata . J Cell Biol. 1968. 39 (2): 339–368. DOI: 10,1083 / JCB.39.2.339. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 5. Sluder G, Miller FJ, Rieder CL. Репродуктивная способность центросом морского ежа без центриолей. Cell Motil Cytoskelet. 1989. 13 (4): 264–273. DOI: 10,1002 / см. 970130405. [PubMed] [CrossRef] [Google Scholar] 6. Лонго Ф. Дж., Планкетт В. Начало синтеза ДНК и его связь с морфогенетическими событиями пронуклеусов в активированных яйцах морского ежа, Arbacia punctulata . Dev Biol. 1973; 30 (1): 56–67. DOI: 10.1016 / 0012-1606 (73)-1.[PubMed] [CrossRef] [Google Scholar] 7. Sluder G, Miller FJ, Rieder CL. Воспроизведение центросом: ядерный против цитоплазматического контроля. J Cell Biol. 1986; 103 (5): 1873–1881. DOI: 10.1083 / jcb.103.5.1873. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Hinegardner RT, Rao B, Feldman DE. Синтетический период ДНК во время раннего развития яйца морского ежа. Exp Cell Res. 1964; 36: 53–61. DOI: 10.1016 / 0014-4827 (64) -4. [PubMed] [CrossRef] [Google Scholar] 9. Мазия Д., Харрис П.Дж., Бибринг Т.Множественность митотических центров и время их удвоения и разделения. J Biophys Biochem Cytol. 1960; 7 (1): 1–20. DOI: 10.1083 / jcb.7.1.1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 10. Rieder CL, Rupp G, Bowser S. Электронная микроскопия полутолстых срезов: преимущества для биомедицинских исследований. J Electron Microsc Tech. 1985; 2: 11–28. DOI: 10.1002 / jemt.1060020103. [CrossRef] [Google Scholar] 11. Хисман Дж. Морфолино-олиго: понимание антисмысла? Dev Biol. 2002. 243 (2): 209–214.DOI: 10.1006 / dbio.2001.0565. [PubMed] [CrossRef] [Google Scholar] 12. Лин CY, Su YH. Редактирование генома эмбрионов морского ежа с помощью системы CRISPR / Cas9. Dev Biol0. 2016. 409 (2): 420–428. DOI: 10.1016 / j.ydbio.2015.11.018. [PubMed] [CrossRef] [Google Scholar] 13. Sluder G, Miller FJ, Cole R, Rieder CL. Синтез белка и клеточный цикл: воспроизведение центросом в яйцах морских ежей не находится под трансляционным контролем. J Cell Biol. 1990; 110 (6): 2025–2032. DOI: 10.1083 / jcb.110.6.2025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14.Слудер Г., Льюис К. Взаимосвязь между синтезом ядерной ДНК и воспроизводством центросом в яйцах морских ежей. J Exp Zool. 1987. 244 (1): 89–100. DOI: 10.1002 / jez.1402440111. [PubMed] [CrossRef] [Google Scholar] 15. Hinchcliffe EH, Cassels GO, Rieder CL, Sluder G. Координация воспроизводства центросом с ядерными событиями клеточного цикла в зиготе морского ежа. J Cell Biol. 1998. 140 (6): 1417–1426. DOI: 10.1083 / jcb.140.6.1417. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Мазия Д.Хромосомные циклы включаются в неоплодотворенных яйцах морских ежей, подвергшихся воздействию NH 4 OH. Proc Natl Acad Sci USA. 1974. 71 (3): 690–693. DOI: 10.1073 / pnas.71.3.690. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 17. Kallenbach RJ, Mazia D. Происхождение и созревание центриолей в связи с ядерной оболочкой в яйцах морских ежей, подвергшихся гипертоническому стрессу. Eur J Cell Biol. 1982. 28 (1): 68–76. [PubMed] [Google Scholar] 18. фон Ледебур-Виллигер М. Цитология и синтез нуклеиновых кислот партеногенетически активированных яиц морского ежа.Exp Cell Res. 1972. С. 72 (1): 285–308. DOI: 10.1016 / 0014-4827 (72)
-5. [PubMed] [CrossRef] [Google Scholar] 19. Уилсон ЭБ. Клетка в развитии и наследственности. Нью-Йорк: Макмиллан; 1925. [Google Scholar] 20. Курияма Р., Борисы Г.Г. Цитастеры, индуцированные в неоплодотворенных яйцах морских ежей. J Cell Sci. 1983; 61: 175–189. [PubMed] [Google Scholar] 21. La Terra S, English CN, Hergert P, McEwen BF, Sluder G, Khodjakov A. Путь сборки центриолей de novo в клетках HeLa: развитие клеточного цикла и сборка / созревание центриолей.J Cell Biol. 2005. 168 (5): 713–722. DOI: 10.1083 / jcb.200411126. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Хамагучи Ю., Курияма Р. Образование звездочек в яйцах морских ежей путем микроинъекции кальциевых буферов и центриолярных комплексов, выделенных из спермы морских звезд. Exp Cell Res. 1982. 141 (2): 450–454. DOI: 10.1016 / 0014-4827 (82)Использование гамет и зигот морского ежа для исследования дупликации центросом
Greenfield Sluder
Департамент клеточной биологии и биологии развития, Медицинская школа Университета Массачусетса, S6-212, 55 Lake Avenue North, Worcester, MA 01655 USA
Департамент клеточной биологии и биологии развития, Медицинская школа Массачусетского университета, S6-212, 55 Lake Avenue North, Worcester, MA 01655 USA
Автор, отвечающий за переписку.Поступило 5 марта 2016 г .; Принято 20 апреля 2016 г.
Открытый доступ Эта статья распространяется на условиях Международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии вы должным образом указываете первоначального автора (авторов) и источник, предоставляете ссылку на лицензию Creative Commons и указываете, были ли внесены изменения. Отказ от лицензии Creative Commons Public Domain Dedication (http: // creativecommons.org / publicdomain / zero / 1.0 /) применяется к данным, представленным в этой статье, если не указано иное. Эта статья цитировалась в других статьях PMC.Abstract
Структура и функция центриолей в зиготе морского ежа параллельны таковым в соматических клетках млекопитающих. Здесь я кратко представляю свойства и атрибуты системы морского ежа, которые делают ее привлекательной платформой для изучения центросомы и дупликации центриолей. Эти атрибуты применимы ко всем иглокожим, которые можно легко приобрести у коммерческих поставщиков: морским ежам, песчаным долларам и морским звездам.Я перечисляю некоторые практические аспекты системы, которые делают ее рентабельной и эффективной по времени системой для экспериментальной работы, а затем перечисляю свойства, которые представляют собой «набор инструментов», который можно использовать для проведения исследований, которые не были бы практичными или нецелесообразными. в некоторых случаях это невозможно с соматическими клетками млекопитающих. Поскольку центриоли организуют и локализуют перицентриолярный материал, который образует ядра астральных массивов микротрубочек (Bobinnec et al. В J Cell Biol 143 (6): 1575–1589, 1998), паттерн дупликации звездочки в течение нескольких клеточных циклов может использоваться как надежный показатель удвоения центриолей (Sluder и Rieder в J Cell Biol 100 (3): 887–896, 1985).Описания методов, которые моя лаборатория использовала для обработки и визуализации зигот иглокожих, даны в Sluder et al. (Методы Cell Biol 61: 439–472, 1999). Также включена библиография статей, в которых описаны дополнительные методы.
Ключевые слова: Центриоль, Центросома, Дупликация, Иглокожие, Яйцо, Морской еж, Сперма, Зигота
Фон
Сперма и яйцеклетка
Сперма морского ежа содержит два центриоля. Один из них служит базальным телом жгутика и имеет заметную электронно-плотную крышку на проксимальном конце, где он прочно закреплен в лопатке у основания ядра сперматозоида (рис.а, б). В поперечном сечении базальное тело имеет каноническое девятитриплетное строение. Вторая центриоль, расположенная между митохондрией и ядром (рис. А, б), также имеет каноническую девятитриплетную структуру, заключенную в электронно-плотную кольцевую матрицу (рис. В). Эта дистальная центриоль в номенклатуре [4] короткая, с соотношением сторон, напоминающим конфету «Спасатель жизни».
Ультраструктура базальных тел и дистальных центриолей сперматозоидов морского ежа. a Продольный разрез головки сперматозоида.В основании головы видны базальное тело — жгутиковый аппарат, митохондрия и короткая дистальная центриоль, лежащая между митохондрией и ядром. Здесь дистальная центриоль в тангенциальном сечении выглядит как электронно-плотное пятно на левом базального тела ( стрелка ). Шкала 1 мкм. b Продольный срез головки сперматозоида, обработанного глюконат-глициновым буфером. Плотный колпачок на проксимальном конце базального тела находится там, где он механически прикреплен к ложе в основании ядра.Митохондрия переместилась в сторону ядра вместе с дистальной центриолью, видимой в продольном сечении ( стрелка ). Шкала 1 мкм. c Поперечное сечение изолированной дистальной центриоли. Масштабная линейка 0,1 мкм
Когда самку морского ежа заставляют нереститься, икра откладывается в постмейотическом состоянии с гаплоидным интерфазным ядром. Считается, что неоплодотворенное яйцо лишено центриолей, поскольку в ультраструктурных исследованиях об этом не сообщалось.Когда клеточный цикл активируется в неоплодотворенных яйцах, нет активности, которая организует дублирующуюся центросому, и центриоли не собираются [5]. Наследование центросом у иглокожих происходит по отцовской линии; обе центриоли в сперматозоиде вносят вклад в зиготу и после дупликации организуют центросомы, используемые в развитии.
Зигота
Примерно через 15–30 минут после оплодотворения две центриоли сперматозоидов организовали сперматозоиды и дублируются в это время синтеза ДНК [6].Женский пронуклеус движется к фокусу сперматозоида и сливается с мужским пронуклеусом, образуя ядро зиготы. Позже пары центриолей мать-дочь организуют звездочки, которые отделяются от ядра зиготы перед первым митозом. Во время первых эмбриональных митозов все центриоли имеют каноническую девятитриплетную структуру (рис. B) и иногда кажутся немного отдельными внутри облака фиброзернистого перицентриолярного материала во время митоза (см. Серию серийных секций в [2, 7]). .Во время ранних митозов зигот нет никаких указаний на то, что перицентриолярный материал преимущественно накапливается вокруг более старой или материнской центриоли, как в случае соматических клеток млекопитающих. Во время митоза центриоли мать-дочь не всегда обнаруживают плотное ортогональное расположение, что поднимает вопросы о степени, в которой они механически и функционально задействованы в этой точке клеточного цикла. В телофазе центросома уплощается и синтез ДНК быстро начинается — даже до того, как все кариомеры (отдельные хромосомы или группы хромосом, вокруг которых собираются ядерные оболочки) слились, чтобы сформировать интерфазное ядро [8].Центриоли в это время дублируются [9].
a Энуклеированная зигота морского ежа, за которой наблюдали in vivo для характеристики дупликации центросомы. Каждая дублированная центросома организует двойную лучепреломляющую звезду, как это видно с помощью поляризационного микроскопа. Двулучепреломление и появление звездочек указывают на то, что эта энуклеированная зигота находилась в митозе, когда была сделана фотография. Преломляющая сфера, немного не в фокусе в центре ячейки, представляет собой каплю минерального масла, используемого для закрытия микропипетки, используемой для энуклеации зиготы.Деления шкалы удалены друг от друга на 10 мкм. b Эта конкретная зигота была извлечена из препарированного, фиксированного и серийного полутолстого среза. Показано поперечное сечение центриоли в одной из центросом. Другая центриоль была найдена в другом разделе. Шкала 0,1 мкм
Практические соображения
Морские ежи и другие иглокожие представляют собой экономичную экспериментальную систему. У одного или нескольких организмов можно собрать большое количество яйцеклеток и спермы для выделения органелл и биохимических исследований.Гаметы и зиготы живут в морской воде; они функционируют в атмосферных условиях; и они не требуют стерильных условий. Необходимо культивировать зиготы при температуре, аналогичной той, при которой живет этот конкретный вид, — обычно это ниже нормальной комнатной температуры.
Яйца крупные (~ 70–140 мкм в диаметре в зависимости от организма). Во время ранних митозов веретена и астры большие по сравнению с соматическими клетками. Яйца некоторых видов оптически прозрачны и поэтому хорошо подходят для визуализации in vivo с использованием поляризационной или дифференциально-интерференционной контрастной оптики.Важно отметить, что можно проследить поведение веретен и центросом in vivo без флуоресцентных зондов с помощью поляризационного микроскопа (рис. А,). Так как центриоли образуют перицентриолярный материал, образующий ядра звезд, образец удвоения звезд может использоваться как мера количества и удвоения центриолей. Например, центросома, содержащая две нормальные центриоли, точно удваивается от одного клеточного цикла к другому. Центросома, содержащая одну центриоль, не удваивается в первом клеточном цикле, но затем удваивается между всеми последующими циклами (см. [2]).
Второй митоз зиготы Lytechinus pictus . На этом изображении показано использование поляризационного микроскопа для изображения веретен и звездочек в живых зиготах морского ежа с оптически прозрачными яйцами. Шпиндели имеют отрицательную компенсацию и кажутся темными. Квадранты звездочки яркие, потому что микротрубочки в этих квадрантах ориентированы под прямым углом к таковым центрального веретена. Деления шкалы находятся на расстоянии 10 мкм друг от друга
Можно проследить отдельные зиготы in vivo, а затем восстановить каждую для корреляционной световой микроскопии фиксированных клеток или электронной микроскопии (рис.а, б). Чтобы точно охарактеризовать количество и пространственное расположение центриолей в зиготах, необходимо использовать анализ серийных полутолстых сечений (см. [10]). Метод восстановления и фиксации для электронной микроскопии отдельных зигот, ранее наблюдавшихся in vivo в препаратах для микроинъекций, описан в [7]. Подробные сведения о препаратах для микроинъекций / микроманипуляций с закрытыми или открытыми поверхностями см. В [3].
Клеточный цикл зиготы является быстрым и примерно синхронным для популяции яйцеклеток, оплодотворенных в одно и то же время.Для обычно используемых иглокожих с естественной температурой от 13 до 22 ℃ продолжительность клеточного цикла составляет от 40 минут до 1,5 часов в зависимости от температуры. Поскольку исследование дупликации центросомы / центриоли часто требует отслеживания клеток в течение нескольких клеточных циклов, зиготы иглокожих позволяют проводить эксперимент утром или днем, а не в несколько дней, необходимых для соматических клеток. Поскольку эксперименты обычно длятся несколько часов, исследователь может постоянно присутствовать у микроскопа, чтобы проследить / детально отобразить 5 или более зигот за цикл.При использовании поляризационной или дифференциальной интерференционной оптики вращающийся столик позволяет выровнять каждую зиготу для оптимизации контраста. Простые системы покадровой микроскопии без компьютерно запрограммированного фокуса и положения предметного столика позволяют отслеживать одновременно только несколько клеток, часто без правильной ориентации в поле.
Зигота морского ежа устойчива и выдерживает экспериментальные воздействия, которые останавливают гибель нетрансформированных соматических клеток. Зиготы могут быть механически фрагментированы и лучше выживают при микроманипуляциях, чем культивируемые клетки.Кроме того, зиготы обладают конечной, но гораздо большей устойчивостью к воздействию синего и ближнего УФ-света, чем нетрансформированные соматические клетки. Например, воздействие на нетрансформированные человеческие клетки (RPE1) светом 488 нм, доставляемым по обычному пути эпифлуоресценции, приводит к дозозависимой остановке клеточного цикла или гибели клеток (Douthwright and Sluder, представлено). Зиготы морского ежа переносят эквивалентное воздействие света с длиной волны 366 нм, даже если он более энергичный. В связи с этим следует предостеречь: при визуализации метафазных хромосом морского ежа, окрашенных по Хехсту, в канале DAPI флуоресцентного микроскопа, необходимо соблюдать осторожность, чтобы ограничить воздействие возбуждающего света.Более длительное воздействие может привести к слипанию сестринских хромосом, и когда клетка входит в анафазу, происходит сращивание и отсутствие расхождения хромосом.
Несмотря на то, что яйца и зиготы не поддаются трансфекции, существуют хорошо зарекомендовавшие себя методы микроинъекции яиц и зигот до отслеживания их поведения in vivo.
Геномы S. purpuratus и L. variegatus секвенированы, что дает исследователю доступ к специфическим последовательностям ДНК центриолярных белков.Экспрессия новых специфических белков в зиготах может быть подавлена инъекцией сконструированных антисмысловых морфолиноолигонуклеотидов (см. Обзор [11]). Недавно сообщалось о редактировании генома в отдельных зиготах морского ежа с помощью системы CRISPR / Cas9 [12].
Набор инструментов
Ниже перечислены некоторые характеристики зиготы морского ежа, которые оказались полезными инструментами при изучении дупликации центросом.
Дупликация центросом и прогрессирование клеточного цикла не зависят от транскрипции.Когда ядро зиготы удаляется, дупликация центросомы / центриоли постоянно происходит в надлежащей координации с циклами сборки / разборки астральных микротрубочек и попытками расщепления [7].
Еще до оплодотворения яйцо морского ежа содержит обильные пулы всех субъединиц, необходимых для поддержки повторяющейся дупликации центросом для образования множества центросом. Дупликация центросомы / центриоли происходит в зиготах, по крайней мере, в течение нескольких часов, когда синтез белка полностью заблокирован [13].Присутствие относительно стабильных пулов центриолей / субъединиц центросомы может ограничивать применимость морфолиноолигонуклеотидов и подходов CRISPR / Cas9 к снижению уровней специфических центросомных белков, по крайней мере, на ранней стадии развития.
Центросомы многократно дублируются, когда зигота задерживается в S фазе [14]. Для Lytechinus pictus период редупликации составляет в среднем 148 мин (диапазон 40–257 мин) [15].
Зиготы можно разделить на части, пропустив их через пластиковую сетку вскоре после удаления оболочки для удобрения.Поскольку это делается до слияния пронуклеусов, получают смесь жизнеспособных циклически энуклеированных клеточных фрагментов; фрагменты, содержащие только мужской или женский пронуклеус, или фрагменты с обоими пронуклеусами [5]. Центросома (и) остается ассоциированной с мужским пронуклеусом.
Клеточный цикл неоплодотворенных яиц может быть искусственно активирован множеством агентов. Один из самых простых и контролируемых методов — временно повысить их внутренний pH с помощью аммонизированной морской воды [16].Такие активированные яйца или экспериментально полученные фрагменты оплодотворенных яиц, которые содержат только женский пронуклеус, организуют в митозе единый радиальный массив микротрубочек (монастер) на месте женского пронуклеуса. Однако этот монастырь не дублируется и становится все менее хорошо организованным от одного митоза к другому [5]. На ультраструктурном уровне монастырь состоит из полой фенестрированной сферы из электронно-плотного материала, из которой выходят наружу микротрубочки. Анализ серийных срезов показал отсутствие морфологических центриолей [5].Эта система может быть использована для изучения свойств и состава перицентриолярного материала, свободного от центриолей.
Партеногенез: Начиная с конца 1800-х годов, были описаны методы индукции образования центросом de novo в искусственно активированных неоплодотворенных яйцах, ведущих к партеногенетическому развитию. Короче говоря, активированное яйцо временно обезвоживается гипертонической морской водой или морской водой, содержащей глюкозу или D 2 O во время первого клеточного цикла.Собирающиеся центросомы (называемые цитастерами) содержат центриоли [17]. При тщательно подобранном лечении одна или две центросомы собираются в каждом яйце и поддерживают нормальное раннее развитие гаплоидных или диплоидных эмбрионов ([18]; ранняя работа, рассмотренная в [19]). При более сильном лечении собирается много цитастеров на яйцо, некоторые с множественными центриолями [17, 20]. Оплодотворение также можно использовать для активации яйца, а условия дегидратации будут вызывать сборку лишних цитастеров, которые дублируются в каждом клеточном цикле (Sluder and Lewis, неопубликовано).Быстрый клеточный цикл и способность иметь большое количество примерно синхронных яиц могут дать преимущества для использования современных методов изучения этого малоизученного феномена, который также встречается в трансформированных и нетрансформированных клетках человека [21, 22].
7.
Сперма морских ежей представляет собой подходящую систему для выделения центриолей, учитывая, что природа удалила из этих клеток почти всю цитоплазму. Можно собрать большие количества сперматозоидов, а лизис детергента в глюконат-глициновом буфере (см. [3]) позволяет собирать короткие дистальные центриоли (рис.) из супернатанта, хотя и с некоторым загрязнением аксонем и митохондриальных остатков (см. также [23]). Когда эти изолированные дистальные центриоли вводят в оплодотворенные яйца морских ежей, они организуют звездочки в зависимости от дозы (Sluder, неопубликовано). Можно также осаждать ядра сперматозоидов с прочно прикрепленным базальным телом — жгутиковым аппаратом.
Электронная микрофотография среза гранулы дистальных центриолей, выделенных из спермы морского ежа. Шкала шкалы 0.5 мкм
Базальные тельца
Систему морского ежа можно также использовать для исследования биологии базального тела. Центриоли функционируют как базальные тельца в сперматозоидах и развиваются, начиная с стадии мерцательной бластулы. На сегодняшний день работа над базальными телами в этой системе в значительной степени ограничена обычными ультраструктурными характеристиками тонких срезов. Тем не менее, эмбрион морского ежа обеспечивает то, что может быть уникальным средством изучения повторяющегося взаимного преобразования центриолей в базальные тельца [24].На раннем этапе развития эмбрион превращается в полый клеточный шар — бластулу. Незадолго до того, как эмбрион вылупляется из оболочки оплодотворения, каждая клетка собирает единственную подвижную ресничку. Интересно, что клетки все еще размножаются. После митоза пара центриолей мать-дочь перемещается в апикальную кору клетки, а более старая или материнская центриоль действует как базальное тело, чтобы организовать сборку аксонемы ресничек. В то время как в этой конфигурации центриоли дублируются, и незадолго до вступления в митоз аксонема быстро втягивается обратно в клетку и отделяется от материнской центриоли.Во время митоза две пары центриолей мать / дочь организуют полюса митотического веретена. Эта последовательность событий повторяется в следующем клеточном цикле.
Выводы
Гаметы и зиготы морского ежа оказались полезной экспериментальной системой, на основе которой была получена основная информация о дупликации центросом. Некоторые из важных исследований с культивированными клетками не были бы практичными или даже невозможными. Хотя использование этой системы в биологии центросом в последние годы не применялось широко, ее несколько практических преимуществ делают ее широко открытой для новых и творческих подходов с использованием современных инструментов молекулярной биологии.
Благодарности
Автор благодарит доктора Юми Уэтаке за неоценимую помощь в подготовке рисунков и форматировании ссылок. Он также благодарит доктора Боба Морриса за предоставленную полную копию статьи Масуда и Сато. Исследования автора, упомянутые в этом обзоре, были поддержаны NIH GM30758.
Конкурирующие интересы
У автора нет конкурирующих интересов.
Ссылки
1. Бобиннек Ю., Ходжаков А., Мир Л.М., Ридер К.Л., Эдде Б., Борненс М. Разборка центриолей in vivo и ее влияние на структуру и функцию центросом в клетках позвоночных.J Cell Biol. 1998. 143 (6): 1575–1589. DOI: 10.1083 / jcb.143.6.1575. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 3. Слудер Дж., Миллер Ф.Дж., Хинчклифф Э. Использование гамет морского ежа для изучения митоза. Методы Cell Biol. 1999; 61: 439–472. DOI: 10.1016 / S0091-679X (08) 61993-7. [PubMed] [CrossRef] [Google Scholar] 4. Лонго Ф. Дж., Андерсон Э. Тонкая структура развития и слияния пронуклеусов у морского ежа, Arbacia punctulata . J Cell Biol. 1968. 39 (2): 339–368. DOI: 10,1083 / JCB.39.2.339. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 5. Sluder G, Miller FJ, Rieder CL. Репродуктивная способность центросом морского ежа без центриолей. Cell Motil Cytoskelet. 1989. 13 (4): 264–273. DOI: 10,1002 / см. 970130405. [PubMed] [CrossRef] [Google Scholar] 6. Лонго Ф. Дж., Планкетт В. Начало синтеза ДНК и его связь с морфогенетическими событиями пронуклеусов в активированных яйцах морского ежа, Arbacia punctulata . Dev Biol. 1973; 30 (1): 56–67. DOI: 10.1016 / 0012-1606 (73)-1.[PubMed] [CrossRef] [Google Scholar] 7. Sluder G, Miller FJ, Rieder CL. Воспроизведение центросом: ядерный против цитоплазматического контроля. J Cell Biol. 1986; 103 (5): 1873–1881. DOI: 10.1083 / jcb.103.5.1873. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Hinegardner RT, Rao B, Feldman DE. Синтетический период ДНК во время раннего развития яйца морского ежа. Exp Cell Res. 1964; 36: 53–61. DOI: 10.1016 / 0014-4827 (64) -4. [PubMed] [CrossRef] [Google Scholar] 9. Мазия Д., Харрис П.Дж., Бибринг Т.Множественность митотических центров и время их удвоения и разделения. J Biophys Biochem Cytol. 1960; 7 (1): 1–20. DOI: 10.1083 / jcb.7.1.1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 10. Rieder CL, Rupp G, Bowser S. Электронная микроскопия полутолстых срезов: преимущества для биомедицинских исследований. J Electron Microsc Tech. 1985; 2: 11–28. DOI: 10.1002 / jemt.1060020103. [CrossRef] [Google Scholar] 11. Хисман Дж. Морфолино-олиго: понимание антисмысла? Dev Biol. 2002. 243 (2): 209–214.DOI: 10.1006 / dbio.2001.0565. [PubMed] [CrossRef] [Google Scholar] 12. Лин CY, Su YH. Редактирование генома эмбрионов морского ежа с помощью системы CRISPR / Cas9. Dev Biol0. 2016. 409 (2): 420–428. DOI: 10.1016 / j.ydbio.2015.11.018. [PubMed] [CrossRef] [Google Scholar] 13. Sluder G, Miller FJ, Cole R, Rieder CL. Синтез белка и клеточный цикл: воспроизведение центросом в яйцах морских ежей не находится под трансляционным контролем. J Cell Biol. 1990; 110 (6): 2025–2032. DOI: 10.1083 / jcb.110.6.2025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14.Слудер Г., Льюис К. Взаимосвязь между синтезом ядерной ДНК и воспроизводством центросом в яйцах морских ежей. J Exp Zool. 1987. 244 (1): 89–100. DOI: 10.1002 / jez.1402440111. [PubMed] [CrossRef] [Google Scholar] 15. Hinchcliffe EH, Cassels GO, Rieder CL, Sluder G. Координация воспроизводства центросом с ядерными событиями клеточного цикла в зиготе морского ежа. J Cell Biol. 1998. 140 (6): 1417–1426. DOI: 10.1083 / jcb.140.6.1417. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Мазия Д.Хромосомные циклы включаются в неоплодотворенных яйцах морских ежей, подвергшихся воздействию NH 4 OH. Proc Natl Acad Sci USA. 1974. 71 (3): 690–693. DOI: 10.1073 / pnas.71.3.690. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 17. Kallenbach RJ, Mazia D. Происхождение и созревание центриолей в связи с ядерной оболочкой в яйцах морских ежей, подвергшихся гипертоническому стрессу. Eur J Cell Biol. 1982. 28 (1): 68–76. [PubMed] [Google Scholar] 18. фон Ледебур-Виллигер М. Цитология и синтез нуклеиновых кислот партеногенетически активированных яиц морского ежа.Exp Cell Res. 1972. С. 72 (1): 285–308. DOI: 10.1016 / 0014-4827 (72)
-5. [PubMed] [CrossRef] [Google Scholar] 19. Уилсон ЭБ. Клетка в развитии и наследственности. Нью-Йорк: Макмиллан; 1925. [Google Scholar] 20. Курияма Р., Борисы Г.Г. Цитастеры, индуцированные в неоплодотворенных яйцах морских ежей. J Cell Sci. 1983; 61: 175–189. [PubMed] [Google Scholar] 21. La Terra S, English CN, Hergert P, McEwen BF, Sluder G, Khodjakov A. Путь сборки центриолей de novo в клетках HeLa: развитие клеточного цикла и сборка / созревание центриолей.J Cell Biol. 2005. 168 (5): 713–722. DOI: 10.1083 / jcb.200411126. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Хамагучи Ю., Курияма Р. Образование звездочек в яйцах морских ежей путем микроинъекции кальциевых буферов и центриолярных комплексов, выделенных из спермы морских звезд. Exp Cell Res. 1982. 141 (2): 450–454. DOI: 10.1016 / 0014-4827 (82)митозов и центросом | Морские ежи для образования
РЕЗЮМЕ: Разделение эукариотической клетки на две нетривиально. Эта страница дает информацию, выходящую за рамки того, что обычно обсуждается, и предназначена в качестве дополнения к обычному курсу обучения.
Центросома — это клеточная органелла, которой не уделяется должного внимания, но она абсолютно необходима для деления эукариотических клеток и структурной организации клеток.
ИГРОКОВ
Кальций — обычно в форме Ca + 2.Кальций играет решающую роль в передаче сигналов клетками. Некоторые белки реагируют на присутствие кальция, чтобы включать и выключать другие белки в клетке. Концентрация кальция имеет решающее значение для всего митотического цикла. Кальций поступает в цитоплазму в нужное время из внутренних запасов везикул, связанных с митотическим аппаратом.
Centrosome — обеспечивает организационную матрицу для сохранения всех игроков в строю. См. ЦЕНТРОСОМА ниже.
Хромосомы — конденсированная ДНК, несущая генетическую информацию клетки.Важно, чтобы правильные хромосомы попадали в каждую половину делящейся клетки.
Цитоплазма — много споров относительно того, является ли цитоплазма жидкой или гелевой, или какой-то их комбинацией. В этом случае мы имеем в виду ионы, белки и другие компоненты клетки в растворе вокруг митотического аппарата.
Kineticore — место прикрепления на хромосоме, посредством которого микротрубочки соединяются с хромосомами, позволяя им тянуться к полюсам.
Микротрубочки — структура из нескольких единиц, построенная из глобулярного белка, называемого тубулином.
Ядерная оболочка — пористая мембрана, окружающая ядро большую часть клеточного цикла. Ядерная оболочка позволяет отделить то, что происходит в ядре, от того, что происходит в цитоплазме.
Белки — построены из 23 аминокислот в полимеры поразительного разнообразия. Белки обладают каталитической активностью как ферменты, как структурные компоненты, как ионные каналы и множество других применений.
ЭТАПОВ
G0 — состояние стаза неоплодотворенного яйца, ожидание сигнала на активацию.G0 не существует в нормальных соматических клетках.
G1 — обычно называется фазой «роста» соматических клеток. ДНК «тиха», но клетка увеличивает объем, воспроизводя митохондрии и другие структуры.
S — время синтеза ДНК. (также синтез центросом)
G2 — синтез ДНК завершен, ожидается сигнал о начале митоза.
Профаза — митоз инициируется, хромосомы конденсируются и прикрепляются к центросоме через микротрубочки и кинетикоры.
Метафаза — хромосомы выстроены и отсортированы в «пластине» между двумя центросомами
Анафаза — хромосомы перемещаются к двум полюсам митотического аппарата, установленному двумя центросомами.
Телофаза — физическое деление самой клетки. Ядерные оболочки формируются вокруг двух новых ядер.
На следующих рисунках показаны временные отношения хромосом (вверху) и центросом (внизу).
АНИМАЦИИ
Митоз — это не статичное событие. Лучший способ увидеть и понять отношения между всеми компонентами — это добавить измерение ВРЕМЯ. Ниже приведены ссылки на анимации, созданные с помощью доктора Даниэля Мазиа:
Цикл хромосомы и центросомы показывает только взаимосвязь между хромосомами и центросомой.
Оплодотворение — показаны первые два деления развивающегося эмбриона морского ежа.
Неравное — показывает, как неравное деление клеток может происходить из-за неравного деления центросомы.
Насекомое — в яйце плодовой мушки митоз иной. Яйцо слишком велико, чтобы делиться на каждое деление, а плодовые мушки — протостомы. Они используют спиральное расщепление вместо радиального, как у морских ежей и людей.
Клетки — Клетка должна расти, чтобы делиться, но это не происходит одновременно в яйце / эмбрионе и в соматической клетке (клетке тела).
ЦЕНТРОСОМА
Центросома — это больше, чем организующий центр митоза, вполне возможно, что это САМЫЙ структурный организационный центр для всей клетки. Несмотря на всю важность, никто не знает, из чего он сделан. Есть белки, связанные с центросомой, и они были выделены и охарактеризованы, но фактический структурный компонент не идентифицирован. Подобно митохондриям, хлоропластам и другим компонентам клетки, центросома может быть пережитком более ранних симбиотических отношений с прокариотическим организмом.
Недавняя работа привела к появлению теорий о том, как центросома организует микротрубочки.

 Необходимо культивировать зиготы при температуре, аналогичной той, при которой живет этот конкретный вид, — обычно это ниже нормальной комнатной температуры.
Необходимо культивировать зиготы при температуре, аналогичной той, при которой живет этот конкретный вид, — обычно это ниже нормальной комнатной температуры. [2]).
[2]). В [3].
В [3].
 Более длительное воздействие может привести к слипанию сестринских хромосом, и когда клетка входит в анафазу, происходит сращивание и отсутствие расхождения хромосом.
Более длительное воздействие может привести к слипанию сестринских хромосом, и когда клетка входит в анафазу, происходит сращивание и отсутствие расхождения хромосом.
Leave A Comment