А5. К кислотным оксидам относится каждое из двух веществ: 1) СО2, СаО 2) SO2, СО 3) SO2,
Даны вещества: CaO, Н2SO4, CaCl2, FeCl3, Zn(OH)2, N2O5, Na2O, Ca(OH)2, CO2, N2O,МgO, SO3, Na2SO4, ВаO, CaCO3, Mn2O7, KOH, CO, Fe(OH)3, Al2O3,Выберите … из перечня формулы оксидов и распределите их на группы, согласно классификации. Оксиды
ПОЖАЛУЙСТА ПОМОГИТЕ СРОЧНО!!!!!!!!!!
СРОЧНО ПОМОГИТЕ ДАЮ 80 БАЛЛОВ! (ФОТО) Ответьте полностью!
помогите пожалуйста, срочно Типы химических реакций в органической химии
Унаслідок гідролізу сахарози утворилося 90 г глюкози. Яка маса сахарози вступила в реакцію? 3. Відомо, що в листі рослин у процесі фотосинтезу, який … відбувається під дією сонячного світла, утворюється глюкоза: 6CO2 + 6h3O → C6h22O6 + 6O2.Визначте, який об’єм (н. у.) карбон(IV) оксиду перетворився на глюкозу, якщо в навколишнє середовище виділилося 160 г кисню.4. Під дією ферментів дріжджів відбувається перетворення глюкози на етанол: C6h22O6 → 2C2H5OH + 2CO2↑. Яка маса глюкози перетворилася на етанол, якщо при цьому виділилося 33,6 л (н. у.) карбон(IV) оксиду?5. Одне дерево за добу здатне перетворювати на вуглеводи 55 г карбон(IV) оксиду. Скільки літрів кисню (н. у.) при цьому виділяється?6. Із перелічених формул виберіть формули вуглеводів: C3H8O, C5h20O5, C12h36, C12h32O11, C6h22O.7. Як відрізнити крохмаль від целюлози за хімічними властивостями?
Помогите, пожалуйста, с химией! Составьте уравнения химических реакции согласно цепочке превращений:1.С→С2Н6 →СО2 →Na2СO3 → СаСO3 t X ↑ → С … а(HCO3)22.С→MgC2 →СН4→оксид С (IV)→Li2СO3→ Х ↑→BaСО3
Обчисліть кількість теплоти (кДж), яка виділяється при спалюванні 18 г глюкози, якщо при спалюванні 1 моль глюкози виділяється 287 кДж теплоти .
Орієнтовний рецепт для приготування антисептика вдома включає наступні речовини: 680 г етилового спирту, 70 г гідроген пероксиду, 20 г гліцеролу 110 г
… дистильованої або охолодженої кип’яченої води.
Написать все формулы и названия по химии. (7 класс). Отдам 20 баллов, пожалуйста все, например:Водород (h3) и т.д
Допоможіть не ігнорте!!))) Будь ласка))
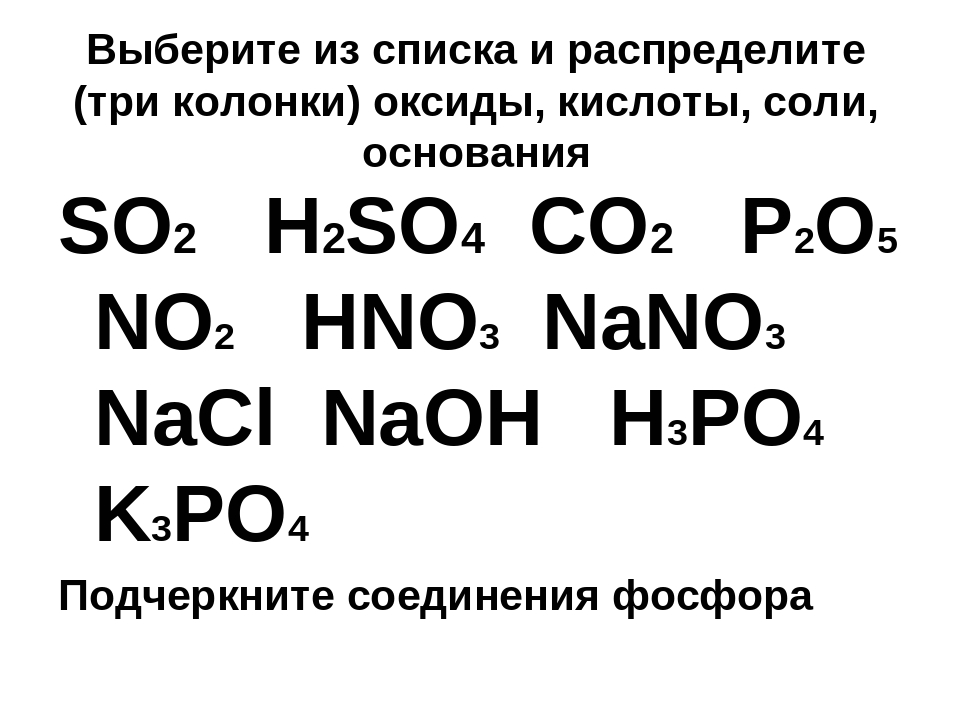
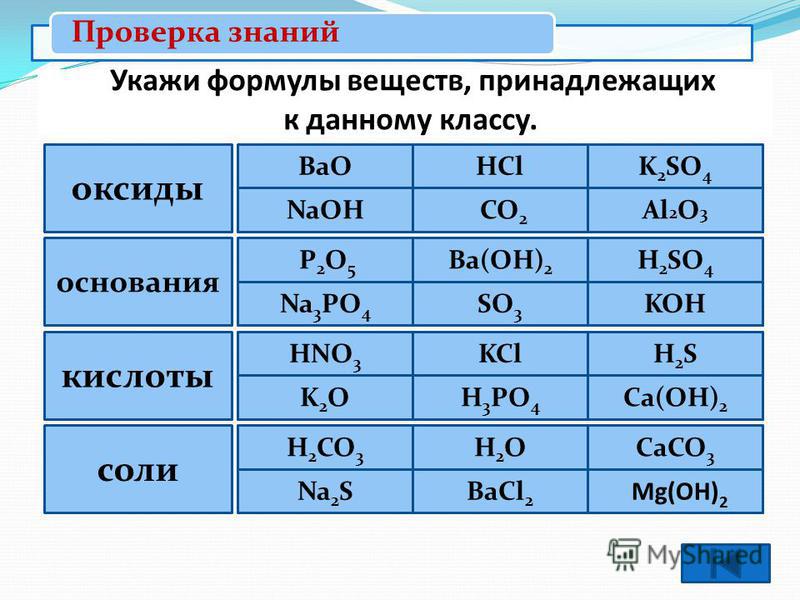
Задания 5. Простые и сложные вещества. Неорганические вещества
Химические свойства оснований и кислот
Химические свойства оснований и кислот 1. В реакцию с раствором гидроксида калия вступает 2. Раствор серной кислоты реагирует с раствором 3. Раствор серной кислоты не реагирует 4. Гидроксид меди(ii) реагирует
ПодробнееБанк заданий химия 9 класс
Банк заданий химия 9 класс 1. Элемент имеет три электрона на 2-м энергетическом уровне. Порядковый номер элемента 3 5 7 13 2. Сколько электронов находится на внешнем уровне элемента с порядковым номером
Задание 31 ЕГЭ по химии
Верное решение задания 31 должно содержать уравнения четырёх За верную запись каждого уравнения реакции можно получить 1 балл. Максимально за выполнение этого задания можно получить 4 балла. Каждое верное
ПодробнееБанк заданий 11 класс химия
Банк заданий 11 класс химия 1. Электронная конфигурация соответствует иону: 2. Одинаковую кофигурацию имеют частицы и и и и 3. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
СБОРНИК ТЕСТОВЫХ ЗАДАНИЙ ПО ХИМИИ
НАЧАЛЬНОЕ И СРЕДНЕЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАНИЕ Ю. М.ЕРОХИН СБОРНИК ТЕСТОВЫХ ЗАДАНИЙ ПО ХИМИИ Рекомендовано Федеральным государственным автономным учреждением «Федеральный институт развития образования»
М.ЕРОХИН СБОРНИК ТЕСТОВЫХ ЗАДАНИЙ ПО ХИМИИ Рекомендовано Федеральным государственным автономным учреждением «Федеральный институт развития образования»
Билеты по химии 6 класс
Билеты по химии 6 класс Билет 1 1. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости
Зачет по теме «Химическая связь» 11класс
Зачет по теме «Химическая связь» 11класс 1. В аммиаке и хлориде бария химическая связь соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и металлическая
ПодробнееРабочая программа по химии 9 «а» класс
Рабочая программа по химии 9 «а» класс (базовый уровень) Рабочая программа по химии для 9 класса составлена в соответствии с Федеральным компонентом Государственного стандарта основного общего образования,
Рабочая программа по химии 9 «в» класс
Рабочая программа по химии 9 «в» класс (базовый уровень) Рабочая программа по химии для 9 класса составлена в соответствии с Федеральным компонентом Государственного стандарта основного общего образования,
ПодробнееРабочая программа по химии 9 «б» класс
Рабочая программа по химии 9 «б» класс (базовый уровень) Рабочая программа по химии для 9 класса составлена в соответствии с Федеральным компонентом Государственного стандарта основного общего образования,
ПодробнееЗадания А3 по химии
Задания А3 по химии 1.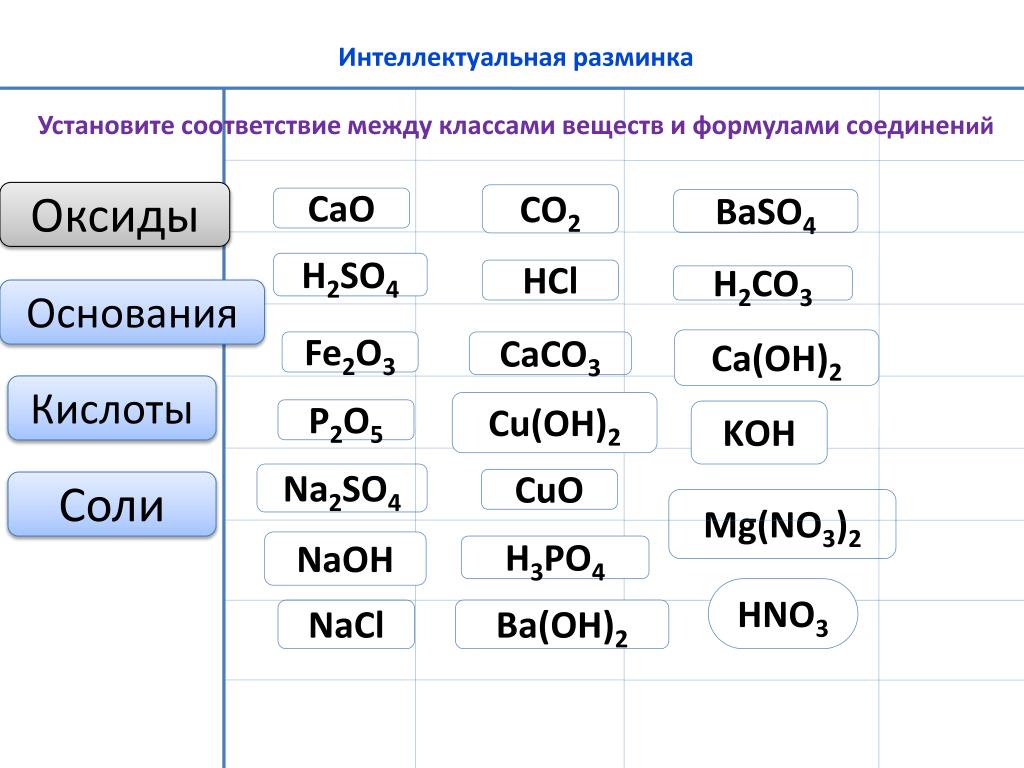 Верны ли следующие суждения о соединениях металлов? А. Степень окисления алюминия в высшем оксиде равна +3. Б. Оснóвные свойства оксида натрия выражены сильнее, чем у оксида алюминия
Верны ли следующие суждения о соединениях металлов? А. Степень окисления алюминия в высшем оксиде равна +3. Б. Оснóвные свойства оксида натрия выражены сильнее, чем у оксида алюминия
2018/2019 учебный год
УТВЕРЖДЕНО Приказ Министра образования Республики Беларусь 03.12.2018 836 Билеты для проведения экзамена в порядке экстерната при освоении содержания образовательной программы базового образования по учебному
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОР. МОСКВЫ
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОР. МОСКВЫ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ «МИСиС»
ПодробнееПрограмма курса «Неорганическая химия»
Программа курса «Неорганическая химия» Водород. Водород. Общая характеристика элемента. Положение водорода в ПСХЭ. Изотопы водорода. Получение диводорода в промышленности и в лаборатории. Применение диводорода.
Пояснительная записка
Пояснительная записка Основное общее образование вторая ступень общего образования. Одной из важнейших задач этого этапа является подготовка обучающихся к осознанному и ответственному выбору жизненного
Подробнее1) 2,24 л 2) 6,72 л 3) 8,96 л 4) 11,2 л. 1) F- 2) Ca2+ 3) P+5 4) Br- 1) Sr, Ca, Mg 2) Mg, Al, Si 3) Mg, Al, Ca 4) F, Cl, Br
Вариант демо14 стр. 1 из 9 Тест по химии Демонстрационный вариант 2014 г. ИНСТРУКЦИЯ Тест состоит из частей А и В. На его выполнение отводится 120 минут. Задания рекомендуем выполнять по порядку. Если
с.
 Веселая Лопань, 2015 год
Веселая Лопань, 2015 годМуниципальное общеобразовательное учреждение «Веселолопанская средняя общеобразовательная школа Белгородского района Белгородской области» Контрольное тестирование по химии 9 класс (промежуточный контроль)
ПодробнееРекомендации по выполнению и проверке работы: Итоговая контрольная работа
Примерная контрольная работа по разделу «Неорганическая химия»
специальность 060501 Сестринское дело
Рекомендации по выполнению и проверке работы:
Итоговая контрольная работа | |
Часть 1 | Каждое правильно выполненное задание части 1 оценивается 1 баллом. За выполнение задания с выбором ответа выставляется 1 балл при условии, если обведен только один номер верного ответа. Если обведены и не перечеркнуты два и более ответов, в том числе правильный, то ответ не засчитывается. |
Максимальное кол-во баллов за часть 1: | 11 баллов |
Часть 2 | Задание с кратким ответом считается выполненным верно, если правильно выбраны все варианты ответа. За полный правильный ответ – 2(там где 2 ответа) балла, 3(там где 3 ответа) балла, за 1 правильный ответ – 1 балл, за неверный ответ (или при его отсутствии) – 0 баллов. |
Максимальное кол-во баллов за часть 2: | 8 баллов |
Часть 3 | Задания части
3 оцениваются в зависимости от полноты
и правильности ответа. |
Максимальное кол-во баллов за часть 3: | 6 баллов |
Общее кол-во баллов | 25 баллов |
Критерии оценивания работы:
Кол-во баллов | % выполнения работы | Оценка | |
Итоговая контрольная работа | менее 8 баллов | менее 30 % | «2» |
8 – 13 баллов | 30 % — 52 % | «3» | |
14 — 21 балл | 53 % — 82 % | «4» | |
22 — 25 баллов | 83 % — 100 % | «5» |
Вариант 1.
Часть 1.
Внимательно
прочитайте каждое задание (А1 – А7) и
из 4 предложенных вариантов ответов
выберите один правильный. |
А1
К основным оксидам относится
1) оксид брома (VII) 2) оксид натрия 3) оксид серы (IV) 4) оксид алюминия
А2
Сумма коэффициентов в уравнении реакции между хлоридом алюминия и фосфорной кислотой равна
1) 6 2) 8 3) 10 4) 12
А3
Электрический ток проводит
1) водный раствор спирта 2) водный раствор глюкозы
3) расплав сахара 4) раствор хлорида натрия
А4
Практически необратимо протекает реакция ионного обмена между растворами
1) хлорида калия и нитрата меди (II) 2) серной кислоты и хлорида бария
3) сульфата натрия и гидроксида калия 4) нитрата натрия и хлорида железа (III)
А5
К кислотам относится каждое из двух веществ
1) H2S, Na2CO3 2)K2SO4, Na2SO4 3) Н3 РO4, НNO3 4) KOН, Н2SО3
А6
Гидроксиду меди(II) cоответствует формула
1) Си2O 2) Си(O Н)2 3) СиO 4) СиOН
А7
Распределение электронов по электронным слоям 2;8;1 соответствует атому
1) алюминия 2) магния 3) лития 4) натрия
А8
Среди приведенных ниже элементов наименьший радиус имеет атом
1) F 2) Сl 3) Br 4) I
А9
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Твердую щелочь нельзя брать
руками.
Твердую щелочь нельзя брать
руками.
Б. Чтобы определить газ по запаху необходимо наклониться над сосудом и глубоко
вдохнуть.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А10
Массовая доля кислорода в карбонате кальция равна
1) 15 % 2) 27 % 3) 48 % 4) 54 %
А11
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Нагреваемую пробирку нужно держать отверстием от себя.
Б. Для ускорения растворения твердых веществ в пробирке нужно закрыть ее
отверстие пальцем и встряхнуть.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
Часть 2
Ответом к заданию В1 является последовательность двух цифр, которая соответствует номерам правильных ответов. Запишите эти цифры в строку ответа. |
В1
Выберите уравнения реакций, в которых элемент азот является восстановителем.
1) N2 + O2 = 2NO 2) 2NO + O2 = 2NO2 3) N2 + 3H2 = 2NH3
4) N2 + 3Mg = Mg3N2 5) N2 + 6Li = 2Li3N
Ответ: ___________
В задании В2
на установление соответствия запишите
в таблицу цифры выбранных вами ответов. |
В2.
Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) SO2 + H2O 1) H2SO4
Б) SO3 + NaOH 2) H2SO3
В) H2SO4 + Na2O 3) SO3 + H2
4) Na2SO4 + H2O
5) Na2SO4 + H2
Ответ: ___________
В3.
При выполнении задания выберите два правильных ответа
В результате взаимодействия серной кислоты и нитрата бария образуются вещества, относящиеся к классам/группам
1. Кислотный оксид 2. Основный оксид 3. Кислота 4.Основание 5. Соль
С1. При выполнении задания подробно запишите ход его решения и полученный результат.
Какая масса карбоната кальция образуется при взаимодействии 21,2г карбоната натрия с избытком раствора гидроксида кальция?
С2.
Напишите уравнение гидролиза хлорида цинка
Вариант 2.
Часть 1.
Внимательно
прочитайте каждое задание (А1 – А7) и
из 4 предложенных вариантов ответов
выберите один правильный. |
А1
К кислотным оксидам относится
1) оксид бария 2) оксид калия 3) оксид фосфора (V) 4) оксид меди (II)
А2
Сумма коэффициентов в уравнении реакции между цинком и соляной кислотой равна
1) 5 2) 10 3) 11 4) 12
А3
Электрический ток не проводит
1) раствор соляной кислоты 2) раствор сахарозы 3) раствор гидроксида натрия 4) раствор гидроксида натрия
А4
Практически необратимо протекает реакция ионного обмена между растворами
1) хлорида натрия и нитрата серебра 2) серной кислоты и нитрата натрия
3) сульфата калия и хлорида меди (II) 4) соляной кислоты и сульфата натрия
А5
К солям относится каждое из двух веществ
1) К2S, Na2O 2)Н2SO4, NН3 3) Na2SiO3, КNO3 4) Са(OН)2, KСl
А6
При взаимодействии гидроксида калия с соляной кислотой образуются
1)соль и водород 2)соль и вода 3)оксид неметалла и основание 4)оксид металла и кислота
А7
Распределение электронов по электронным слоям в атоме кремния соответствует ряд чисел
1) 2;8;2 2) 2;6 3) 2;4 4) 2;8;4
А8
Среди приведенных ниже элементов наибольший радиус имеет атом
1)Li 2) H 3) K 4)Na
А9
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Нагреваемую пробирку нужно держать
отверстием от себя.
Нагреваемую пробирку нужно держать
отверстием от себя.
Б. Для ускорения растворения твердых веществ в пробирке нужно закрыть ее
отверстие пальцем и встряхнуть.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А10
Массовая доля кислорода в оксиде серы (VI) равна
1) 25 % 2) 44 % 3) 50 % 4) 60 %
А11
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Твердую щелочь нельзя брать руками.
Б. Чтобы определить газ по запаху необходимо наклониться над сосудом и глубоко
вдохнуть.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
Часть 2
Ответом к заданию В1 является последовательность двух цифр, которая соответствует номерам правильных ответов. Запишите эти цифры в строку ответа. |
В1
Выберите уравнения реакций, в которых элемент железо является окислителем.
1) 2Fe + 3Cl2 = 2FeCl3 2) FeO + H2 = Fe + H2O 3) Fe + H2O = FeO + H2
4) Fe3O4 + 4CO = 3Fe + 4CO2 5) Fe2O3 +3 H2 = 2Fe +3 НOH
Ответ: ___________
В задании В2
на установление соответствия запишите
в таблицу цифры выбранных вами ответов. |
В2.
Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Ca(OH)2 + CO2 1) CaCO3 + H2
Б) CaCO3 + HCl 2) CaCO3 + H2O
В) Ca + H2O 3) CaCl2 + H2O + CO2
4) CaO + H2
5) Ca(OH)2 + H2
Ответ: ___________
В3.
При выполнении задания 8 выберите два правильных ответа
В результате взаимодействия нитрата серебра и соляной кислоты и образуются вещества, относящиеся к классам/группам
1.Простое вещество 2. Кислота 3. Основание 4.Оксид 5. Соль
С1.
При выполнении задания подробно запишите ход его решения и полученный результат.
10.Какая масса нитрата алюминия образуется при взаимодействии 40,8г оксида алюминия с достаточным количеством азотной кислоты?
С2. Напишите уравнение гидролиза хлорида цинка
Ответы:
Вариант 1.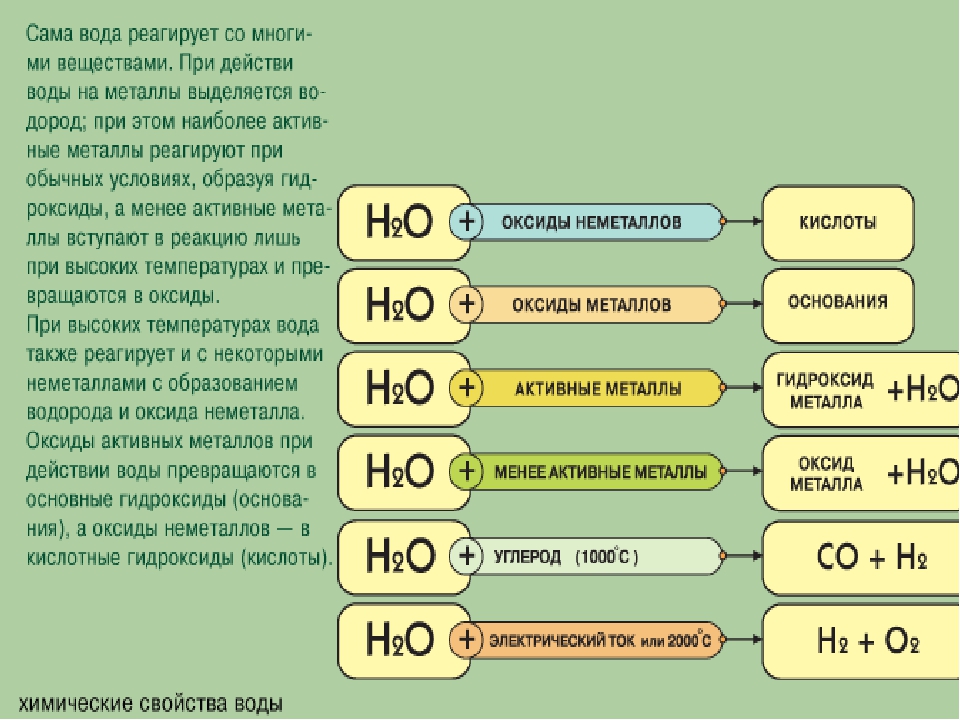
Ответы к заданиям с выбором ответа:
№ задания | ответ |
А1 | 2 |
А2 | 1 |
А3 | 4 |
А4 | 2 |
А5 | 3 |
А6 | 2 |
А7 | 4 |
А8 | 1 |
А9 | 4 |
А10 | 3 |
А11 | 4 |
Ответы к заданиям с кратким ответом:
№ задания | ответ |
В1 | 123 |
В2 | 254 |
В3 | 35 |
Вариант 2.
Ответы к заданиям с выбором ответа:
№ задания | Ответ |
А1 | 3 |
А2 | 1 |
А3 | 2 |
А4 | 1 |
А5 | 3 |
А6 | 2 |
А7 | 1 |
А8 | 3 |
А9 | 1 |
А10 | 3 |
А11 | 1 |
Ответы к заданиям с кратким ответом:
№ задания | ответ |
В1 | 245 |
В2 | 135 |
В3 | 25 |
Элементы ответа задания С1:
(допускаются иные формулировки ответа, не искажающие его смысла)
Контрольная работа по химии
ФИ_______________________________________ Класс______ Дата ___________
Контрольная работа №3
по теме «Основные классы неорганических соединений»
Вариант 1
1. К кислотам относится каждое из 2-х веществ:
К кислотам относится каждое из 2-х веществ:
а) H2S, Na2CO3 б) K2SO4, Na2SO4 в) H3PO4, HNO3 г) KOH, HCl
2. Гидроксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфата натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидрид магния б) гидрокарбонат натрия
в) гидроксид кальция г) гидроксохлорид меди
5. Какой из элементов образует кислотный оксид?
а) стронций б) сера в) кальций г) магний
6. К основным оксидам относится
а) ZnO б) SiO2 в) BaO г) Al2 О3
7. Оксид углерода (IV) реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и оксидом серы (IV)
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и водородом
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) Mg + HCl → | 1) MgCl2 |
б) Mg(OH)2 + CO2 → | 2) MgCl2 + H2 |
в) Mg(OH)2 + HCl → | 3) MgCl2 + H2O |
4) MgCO3 + H2 | |
5) MgCO3 + H2O |
9. Осуществите цепочку следующих превращений:
а) Fe→Fe2O3→FeCl3→Fe(OH)3 → Fe2O3
10. Какая масса сульфата калия образуется при взаимодействии 49 г серной кислоты с гидроксидом калия?
Какая масса сульфата калия образуется при взаимодействии 49 г серной кислоты с гидроксидом калия?
11. Записать формулы веществ по их названиям: оксид натрия, сульфат натрия, серная кислота, гидроксид бария, карбонат лития.
ФИ_______________________________________ Класс______ Дата ____________
Контрольная работа №3
по теме «Основные классы неорганических соединений»
Вариант 2
1. К основаниям относится каждое из 2-х веществ:
а) H2O, Na2O б) KOH, NaOH в) HPO3, HNO3 г) KOH, NaCl
2. Оксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфита натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидроксид бария б) гидроксокарбонат калия
в) гидрокарбонат меди г) гидрид кальция;
5. Какой из элементов может образовать амфотерный оксид?
а) натрий б) сера в) фосфор г) алюминий
6. К основным оксидам относится
а) MgO б) SO2 в) B2O3 г) Al2 О3
7. Оксид натрия реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и водородом
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и оксидом серы (IV)
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) Fe + HCl → | 1) FeCl2 |
б) Fe(OH)2 + CO2 → | 2) FeCl2 + H2 |
в) Fe(OH)2 + HCl → | 3) FeCl2 + H2O |
4) FeCO3 + H2 | |
5) FeCO3 + H2O |
9. Осуществите цепочку следующих превращений:
Осуществите цепочку следующих превращений:
а) Mg → MgO→MgCl2→Mg(OH)2 → MgO
10. Какая масса сульфата бария образуется при взаимодействии 30,6 г оксида бария с достаточным количеством серной кислоты?
11. Записать формулы веществ по их названиям: оксид калия, сульфит натрия, соляная кислота, гидроксид кальция, фосфат лития.
ФИ_______________________________________ Класс______ Дата _________
Контрольная работа №3
по теме «Основные классы неорганических соединений»
Вариант 3
1. К солям относится каждое из 2-х веществ:
а) H2S, Na2CO3 б) K2SO4, Na2SO4 в) H3PO4, HNO3 г) KOH, HCl
2. Гидроксиду меди (I) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфита натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ основной солью является
а) гидрид магния б) гидрокарбонат натрия
в) гидроксид кальция г) гидроксохлорид меди
5. Какой из элементов образует кислотный оксид?
а) калий б) фосфор в) кальций г) магний
6. К основным оксидам относится
а) ZnO б) SO2 в) СaO г) Al2 О3
7. Оксид серы (IV) реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и оксидом серы (IV)
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и водородом
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) Ва + HCl → | 1) ВаCl2 |
б) Ва(OH)2 + CO2 → | 2) ВаCl2 + H2 |
в) Ва(OH)2 + HCl → | 3) ВаCl2 + H2O |
4) ВаCO3 + H2 | |
5) ВаCO3 + H2O |
9. Осуществите цепочку следующих превращений:
Осуществите цепочку следующих превращений:
а) S → SO2 → SO3 → H2SO4 → FeSO4
10. Какая масса сульфата калия образуется при взаимодействии 9,8 г серной кислоты с оксидом калия?
11. Записать формулы веществ по их названиям: оксид магния, сульфид натрия, фосфорная кислота, гидроксид калия, силикат лития.
ФИ________________________________ Класс______ Дата ____________
Контрольная работа №3
по теме «Основные классы неорганических соединений»
Вариант 4
1. К щелочам относится каждое из 2-х веществ:
а) H2O, Na2O б) KOH, NaOH в) HPO3, HNO3 г) KOH, NaCl
2. Оксиду меди (I) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфида натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ основанной солью является
а) гидроксид бария б) гидроксокарбонат калия
в) гидрокарбонат меди г) гидрид кальция;
5. Какой из элементов может образовать амфотерный оксид?
а) натрий б) сера в) фосфор г) цинк
6. К основным оксидам относится
а) СаO б) SO3 в) B2O3 г) Al2 О3
7. Оксид калия реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и водородом
в) сульфитом лития и гидроксидом калия
г) серной кислотой и оксидом серы (IV)
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) Fe + HCl → | 1) FeCl3 |
б) Fe + Cl2 → | 2) FeCl2 + H2 |
в) Fe(OH)2 + HCl → | 3) FeCl2 + H2O |
4) FeCO3 + H2 | |
5) FeCO3 + H2O |
9. Осуществите цепочку следующих превращений:
Осуществите цепочку следующих превращений:
а) Cu → Cu O→ Cu Cl2→ Cu (OH)2 → Cu O
10. Какая масса хлорида бария образуется при взаимодействии 30,6 г оксида бария с достаточным количеством соляной кислоты?
11. Записать формулы веществ по их названиям: оксид цинка, сульфат алюминия, угольная кислота, гидроксид железа ( III), карбонат калия.
ФИ_______________________________________ Класс______ Дата ___________
Контрольная работа №3
по теме «Основные классы неорганических соединений»
Вариант 5
1. К одноосновным кислотам относится каждое из 2-х веществ:
а) H2S, Н2CO3 б) K2SO4, Na2SO4 в) H3PO4, HNO3 г) HNO2 , HCl
2. Гидроксиду железа (II) соответствует формула:
а) Fe 2O3 б) Fe(OH)2 в) Fe(OH)3 г) Fe O
3. Формула сульфида натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидрид цинка б) гидрокарбонат калия
в) гидроксид кальция г) гидроксохлорид меди
5. Какой из элементов образует кислотный оксид?
а) стронций б) углерод в) кальций г) магний
6. К амфотерным оксидам не тносится
а) ZnO б) SiO2 в) BеO г) Al2 О3
7. Оксид серы (IV) реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и оксидом серы (IV)
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и водородом
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) К + HCl → | 1) КCl |
б) КOH+ CO2 → | 2) КCl+ H2 |
в) КOH + HCl → | 3) КCl+ H2O |
4) К2CO3 + H2 | |
5) К2CO3 + H2O |
9. Осуществите цепочку следующих превращений:
Осуществите цепочку следующих превращений:
а) Fe→Fe2O3→FeCl3→Fe(OH)3 → Fe2O3
б) S → SO2 → SO3 → H2SO4 → ZnSO4
10. Какая масса сульфата калия образуется при взаимодействии 49 г серной кислоты с гидроксидом калия?
11. Записать формулы веществ по их названиям: оксид алюминия, сульфат калия, кремниевая кислота, гидроксид железа (II), нитрат бария.
ФИ_______________________________________ Класс______ Дата ______________
Контрольная работа №3
по теме «Основные классы неорганических соединений»
Вариант 6
1. К оксидам относится каждое из 2-х веществ:
а) H2O, Na2O б) KOH, NaOH в) HPO3, HNO3 г) KOH, NaCl
2. Оксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфита натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидроксид бария б) гидроксокарбонат калия
в) гидрокарбонат меди г) гидрид кальция;
5. Какой из элементов может образовать амфотерный оксид?
а) натрий б) сера в) фосфор г) бериллий
6. К основным оксидам относится
а) СuO б) SO3 в) B2O3 г) Fe2 О3
7. Оксид лития реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и водородом
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и оксидом серы (IV)
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) Fe + HCl → | 1) FeCl2 |
б) Fe(OH)2 + CO2 → | 2) FeCl2 + H2 |
в) Fe(OH)2 + HCl → | 3) FeCl2 + H2O |
4) FeCO3 + H2 | |
5) FeCO3 + H2O |
9. Осуществите цепочку следующих превращений:
Осуществите цепочку следующих превращений:
а) C → CO →CO2 → Na2CO3 → Na2SO4 → BaSO4
10. Какая масса сульфата кальция образуется при взаимодействии 56 г оксида кальция с достаточным количеством серной кислоты?
11. Записать формулы веществ по их названиям: оксид калия, сульфат натрия, плавиковая кислота, гидроксид алюминия, фосфат кальция.
ФИ_______________________________________ Класс______ Дата ____________
Контрольная работа №3
по теме «Основные классы неорганических соединений»
Вариант 7
1. К кислотам относится каждое из 2-х веществ:
а) H2S, HNO3 б) K2SO4, Na2SO4 в) H3PO4, КNO3 г) KOH, HCl
2. Оксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфита натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидрид калия б) гидрокарбонат калия
в) гидроксид калия г) гидроксохлорид меди
5. Какой из элементов образует кислотный оксид?
а) калия б) азот в) кальций г) барий
6. К основным оксидам относится
а) ВеO б) SO2 в) BaO г) Al2 О3
7. Оксид серы (IV) реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и оксидом серы (IV)
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и водородом
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) Mg + HCl → | 1) MgCl2 |
б) Mg(OH)2 + CO2 → | 2) MgCl2 + H2 |
в) Mg(OH)2 + HCl → | 3) MgCl2 + H2O |
4) MgCO3 + H2 | |
5) MgCO3 + H2O |
9. Осуществите цепочку следующих превращений:
Осуществите цепочку следующих превращений:
а) Fe→FeO→FeCl2→Fe(OH)2 → FeO
10. Какая масса сульфата натрия образуется при взаимодействии 4, 9 г серной кислоты с оксидом натрия?
11. Записать формулы веществ по их названиям: оксид магния, сульфит натрия, азотистая кислота, гидроксид бария, фосфат алюминия.
ФИ_______________________________________ Класс______ Дата __________
Контрольная работа №3
по теме «Основные классы неорганических соединений»
Вариант 8
1. К щелочам относится каждое из 2-х веществ:
а) H2O, Na2O б) KOH, NaOH в) HPO3, HNO3 г) KOH, NaCl
2. Оксиду меди (I) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфида натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ основной солью является
а) гидроксид бария б) гидроксокарбонат калия
в) гидрокарбонат меди г) гидрид кальция;
5. Какой из элементов может образовать амфотерный оксид?
а) натрий б) сера в) фосфор г) цинк
6. К основным оксидам относится
а)СО б) SO2 в) BаO г) Al2 О3
7. Оксид бария реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и водородом
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и оксидом серы (IV)
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) Fe + HCl → | 1) FeCl2 |
б) Fe(OH)2 + CO2 → | 2) FeCl2 + H2 |
в) Fe(OH)2 + HCl → | 3) FeCl2 + H2O |
4) FeCO3 + H2 | |
5) FeCO3 + H2O |
9. Осуществите цепочку следующих превращений:
Осуществите цепочку следующих превращений:
а) Mg → MgO→MgCl2→Mg(OH)2 → MgO
б) Cа → CаO → СaCO3 → СaSO4 → Сa(OН)2
10. Какая масса сульфата магния образуется при взаимодействии 60 г оксида магния с достаточным количеством серной кислоты?
11. Записать формулы веществ по их названиям: оксид калия, сульфит лития, азотная кислота, гидроксид алюминия, фосфат бария.
ФИ______________________________________ Класс______ Дата ____________
Контрольная работа №3
по теме «Основные классы неорганических соединений»
Вариант 9
1. К двухосновным кислотам относится каждое из 2-х веществ:
а) H2S, Н2CO3 б) K2SO4, Na2SO4 в) H3PO4, HNO3 г) H2O, HCl
2. Оксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфата натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидрид магния б) гидрокарбонат натрия
в) гидроксид кальция г) гидроксохлорид меди
5. Какой из элементов образует амфотерный оксид?
а) стронций б) цинк в) кальций г) магний
6. К основным оксидам относится
а) СO б) SiO2 в) СaO г) Al2 О3
7. Оксид кальция реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и оксидом серы (IV)
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и оксидом серы (IV)
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) Mg + HCl → | 1) MgCl2 |
б) Mg(OH)2 + CO2 → | 2) MgCl2 + H2 |
в) Mg(OH)2 + HCl → | 3) MgCl2 + H2O |
4) MgCO3 + H2 | |
5) MgCO3 + H2O |
9. Осуществите цепочку следующих превращений:
Осуществите цепочку следующих превращений:
а) Al→ Al 2O3→ Al Cl3→ Al (OH)3 → Al 2O3
10. Какая масса сульфата кальция образуется при взаимодействии 11,2 г. оксида кальция с серной кислотой ?
11. Записать формулы веществ по их названиям: оксид серебра, сульфат лития, кремниевая кислота, гидроксид алюминия, фосфат магния.
11. Записать формулы веществ по их названиям: оксид алюминия, сульфид калия, азотистая кислота, гидроксид бария, фосфат натрия.
ФИ____________________________________ Класс______ Дата _____________
Контрольная работа №3
по теме «Основные классы неорганических соединений»
Вариант 10
1. К оксидам относится каждое из 2-х веществ:
а) H2O, Na2O б) KOH, NaOH в) HPO3, HNO3 г) KOH, NaCl
2. Оксиду железа (II) соответствует формула:
а) Fe O б) Fe (OH)2 в) Fe (OH)3 г) Fe 2O3
3. Формула сульфита калия:
а) К2SO4 б) К2S в) К2SO3 г) К2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидроксид кальция б) гидроксокарбонат кальция
в) гидрокарбонат кальция г) гидрид кальция;
5. Какой из элементов может образовать амфотерный оксид?
а) натрий б) сера в) фосфор г) бериллий
6. К основным оксидам относится
а) СаO б) SO2 в) B2O3 г) Al2 О3
7. Оксид лития реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и водородом
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и оксидом серы (IV)
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) Fe + HCl → | 1) FeCl2 |
б) Fe(OH)2 + CO2 → | 2) FeCl2 + H2 |
в) Fe(OH)2 + HCl → | 3) FeCl2 + H2O |
4) FeCO3 + H2 | |
5) FeCO3 + H2O |
9. Осуществите цепочку следующих превращений:
а) Cu→ Cu O→ Cu Cl2→ Cu (OH)2 → Cu O
10. Какая масса сульфата калия образуется при взаимодействии 56 гидроксида калия с достаточным количеством серной кислоты?
11. Записать формулы веществ по их названиям: оксид калия, сульфит натрия, серовородная кислота, гидроксид алюминия, фосфат натрия.
Контрольная работа по химии | Тест по химии (8 класс) по теме:
Контрольная работа
по теме «Основные классы неорганических соединений»
Вариант 1
1. К кислотам относится каждое из 2-х веществ:
а) h3S, Na2CO3 б) K2SO4, Na2SO4 в) h4PO4, HNO3 г) KOH, HCl
2. Гидроксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфата натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидрид магния б) гидрокарбонат натрия
в) гидроксид кальция г) гидроксохлорид меди
5. Какой из элементов образует кислотный оксид?
а) стронций б) сера в) кальций г) магний
6. К основным оксидам относится
К основным оксидам относится
а) ZnO б) SiO2 в) BaO г) Al2 О3
7. Оксид углерода (IV) реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и оксидом серы (IV)
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и водородом
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) Mg + HCl → | 1) MgCl2 |
б) Mg(OH)2 + CO2 → | 2) MgCl2 + h3 |
в) Mg(OH)2 + HCl → | 3) MgCl2 + h3O |
4) MgCO3 + h3 | |
5) MgCO3 + h3O |
9. Осуществите цепочку следующих превращений:
а) Fe→Fe2O3→FeCl3→Fe(OH)3 → Fe2O3
б) S → SO2 → SO3 → h3SO4 → ZnSO4
10. Какая масса сульфата калия образуется при взаимодействии 49 г серной кислоты с гидроксидом калия?
Контрольная работа
по теме «Основные классы неорганических соединений»
Вариант 2
1. К основаниям относится каждое из 2-х веществ:
а) h3O, Na2O б) KOH, NaOH в) HPO3, HNO3 г) KOH, NaCl
2. Оксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфита натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидроксид бария б) гидроксокарбонат калия
в) гидрокарбонат меди г) гидрид кальция;
5. Какой из элементов может образовать амфотерный оксид?
а) натрий б) сера в) фосфор г) алюминий
6. К основным оксидам относится
а) MgO б) SO2 в) B2O3 г) Al2 О3
7. Оксид натрия реагирует с каждым из двух веществ:
Оксид натрия реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и водородом
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и оксидом серы (IV)
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) Fe + HCl → | 1) FeCl2 |
б) Fe(OH)2 + CO2 → | 2) FeCl2 + h3 |
в) Fe(OH)2 + HCl → | 3) FeCl2 + h3O |
4) FeCO3 + h3 | |
5) FeCO3 + h3O |
9. Осуществите цепочку следующих превращений:
а) Mg → MgO→MgCl2→Mg(OH)2 → MgO
б) C → CO2 → Na2CO3 → Na2SO4 → BaSO4
10. Какая масса сульфата бария образуется при взаимодействии 30,6 г оксида бария с достаточным количеством серной кислоты?
Таблица ответов.
1 вариант | 2 вариант |
1 в | 1б |
2 б | 2 г |
3 а | 3 в |
4 б | 4 в |
5 б | 5 г |
6 в | 6 а |
7 а | 7 г |
8 — 253 | 8 — 253 |
10- 87 г | 10 – 46,6 г |
Контрольные работы по химии для учащихся 8 класса
Вариант 1.
Часть 1.
Сумма коэффициентов в уравнении реакции между оксидом алюминия и серной кислотой равна
Практически необратимо протекает реакция ионного обмена между растворами
В реакцию с разбавленной серной кислотой вступает
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Твердую щелочь нельзя брать руками.
Твердую щелочь нельзя брать руками.
Б. Чтобы определить газ по запаху необходимо наклониться над сосудом и глубоко
вдохнуть.
Массовая доля кислорода в карбонате кальция равна
Ответ:
|
В4.
Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Ca(OH)2 + CO2 1) CaCO3 + H2
Б) CaCO3 + HCl 2) CaCO3 + H2O
В) Ca + H2O 3) CaCl2 + H2O + CO2
4) CaO + H2
5) Ca(OH)2 + H2
Ответ: ___________
Часть 3
C1. Рассчитайте массу осадка, который выпадет при взаимодействии избытка карбоната калия с 17,4 г раствора Ca(OH)2 с массовой долей последнего 15%.
Стандартизированная контрольная работа
8 класс
На выполнение контрольной работы отводится 45 минут. Работа состоит из 3 частей и включает 16 заданий.
Часть 1 включает 10 заданий базового уровня (А1-А10). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания — 1 балл.
Часть 2 состоит из 4 заданий повышенного уровня (В1-В4), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания — 2 балла.
Часть 3 содержит наиболее сложные объемные задания (С1-C2), которые требуют полного ответа. За выполнение задания ты можешь получить С1 – 4 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 22 балла.
Система оценивания работы:
|
|
|
|
8 класс ВАРИАНТ-1
Часть 1
|
А1. Число атомов всех химических элементов в молекуле серной кислоты равно:
А2. Элемент второго периода главной подгруппы III группы ПСХЭ — это:
|
|
|
|
А3. Число протонов, нейтронов и электронов в атоме фтора
|
|
|
|
А4. Группа формул веществ с ковалентным типом связи:
|
|
|
|
А5. Верны ли следующие высказывания?
А. В главной подгруппе неметаллические свойства атомов элементов с увеличением порядкового номера усиливаются.
Б. В главной подгруппе неметаллические свойства атомов элементов с увеличением порядкового номера ослабевают.
|
|
|
|
А6. Запись 3О2 означает:
|
|
|
|
А7. Ряд формул, в котором все вещества – оксиды:
|
|
|
|
А8. Формула сульфата железа (III):
|
|
|
|
А9. Сумма всех коэффициентов в уравнении реакции, схема которой
Al + O2 Al2O3 равна:
А10. Верны ли следующие высказывания?
А. Оксид фосфора (V) — кислотный оксид.
Б. Соляная кислота — одноосновная кислота.
|
|
|
|
Часть 2
|
В1. Установите соответствие между формулой вещества и классом соединения:
|
| |||
|
| |||
|
| |||
|
| |||
|
| |||
| ||||
| ||||
|
|
|
| |
|
В2. Уравнения реакции замещения:
|
|
|
|
|
|
Ответ: _____________
В3. С раствором гидроксида натрия реагируют:
|
|
|
|
|
|
Ответ: _____________
|
В4. Масса соли, содержащейся в 150 г 5 %-ного раствора соли, равна _____г. (Запиши число с точностью до десятых).
Часть 3
|
C1. Составьте уравнения химических реакций согласно схеме:
Fe(OH)3 → Fe2O3 → Fe → FeSO4
Назовите все сложные вещества, укажите тип реакции.
Стандартизированная контрольная работа
8 класс
На выполнение контрольной работы отводится 45 минут. Работа состоит из 3 частей и включает 16 заданий.
Часть 1 включает 10 заданий базового уровня (А1-А10). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания — 1 балл.
Часть 2 состоит из 4 заданий повышенного уровня (В1-В4), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания — 2 балла.
Часть 3 содержит наиболее сложные объемные задания (С1-C2), которые требуют полного ответа. За выполнение задания ты можешь получить С1 – 4 балла, С2 – 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 22 балла.
Система оценивания работы:
|
|
|
|
8 класс ВАРИАНТ-2
Часть 1
|
А1. Число атомов всех химических элементов в молекуле фосфорной кислоты равно:
А2. Элемент третьего периода главной подгруппы III группы ПСХЭ — это:
|
|
|
|
А3. Число протонов, нейтронов и электронов в атоме хлора
|
|
|
|
А4. Группа формул веществ с ионным типом химической связи:
|
|
|
|
А5. Верны ли следующие высказывания?
А. В периоде металлические свойства атомов элементов с увеличением порядкового номера усиливаются.
Б. В периоде металлические свойства атомов элементов с увеличением порядкового номера ослабевают.
|
|
|
|
А6. Запись 4N означает:
|
|
|
|
А7. Ряд формул, в котором все вещества – основания:
|
|
|
|
А8. Формула хлорида меди (II):
|
|
|
|
А9. Сумма вcех коэффициентов в уравнении реакции, схема которой Ca + HCl CaCl2 + H2, равна:
А10. Верны ли следующие высказывания?
А. Серная кислота – двухосновная.
Б. Оксид калия – основный оксид.
|
|
|
|
Часть 2
|
В1. Установите соответствие между формулой вещества и классом соединения:
|
|
|
|
|
|
|
|
|
|
| |
|
|
В2. Уравнения реакции разложения:
|
|
|
|
|
|
Ответ: _______
В3. В реакцию с раствором соляной кислоты вступают:
|
|
|
|
|
|
Ответ: _______
|
В4. В 450 г воды растворили 50 г соли. Массовая доля соли в полученном растворе равна_____%. (Запиши число с точностью до десятых).
Часть 3
|
C1. Составьте уравнения химических реакций согласно схеме
Na → NaOH → Cu(OH)2 → CuO.
Назовите все сложные вещества, укажите тип реакции.
Стандартизированная контрольная работа
9 класс
Контрольная работа по химии в IX классе проводится в форме, максимально приближенной к экзаменационной работе для проведения государственной итоговой аттестации выпускников IX классов общеобразовательных учреждений.
Система оценивания работы
| ||
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
|
| |
|
|
|
|
|
|
| |
|
|
| |
|
|
|
1
1) СО2, СаО 2) SO2, СО 3) SO2, Р2О5 4) Р2О5, Аl2О3 А6. Коэффициент перед, химия
А1. Атомы химических элементов бора и алюминия имеют одинаковое число
1)
заполненных электронных слоев
2)
протонов
3)
электронов во внешнем электронном слое
4)
нейтронов
А2. Изменение свойств от металлических к неметаллическим происходит в ряду
1)
Mg → Al → Si
2)
C → B → Li
3)
Ba → Mg → Ca
4)
Р → Si → Al
А3. Ионная связь характерна для
1)
оксида кремния
2)
бромида калия
3)
магния
4)
сероводорода
А4. В каком соединении степени окисления химических элементов равны
– 3 и + 1?
1) NF3
2) Ph4
3) N2O3
4) AlCl3
А5. К кислотным оксидам относится
1)
оксид натрия
2)
оксид цинка
3)
оксид углерода (II)
4)
оксид фосфора (V)
А6. Сумма коэффициентов в уравнении реакции между оксидом натрия и оксидом фосфора (V) равна
1) 6
2) 7
3) 9
4) 10
А7. Окислительно-восстановительной является реакция, уравнение которой
1)
2Fe(OH)3 = Fe2O3 + 3h3O
2)
CaO + h3O = Ca(OH)2
3)
NaOH + HI = NaI + h3O
4)
2Al + 3S = Al2S3
А8. К неэлектролитам относится
1)
карбонат натрия
2)
этиловый спирт
3)
хлороводород
4)
нитрат цинка
А9. С образованием катионов металла и анионов кислотного остатка диссоциирует
1)
сахароза
2)
гидроксид натрия
3)
бромид алюминия
4)
азотная кислота
А10. Какое сокращенное ионное уравнение соответствует реакции между нитратом бария и серной кислотой?
1)
Ba2+ + SO42- = BaSO4
2)
H+ + OH- = h3O
3)
H+ + NO3- = HNO3
4)
Ba2+ + 2NO3- = Ba(NO3)2
А11. При обычных условиях сера реагирует с
1) водой
2) натрием
3) оксидом калия
4) железом
А12. Оксид меди (II) взаимодействует с
1) Na2O
2) K2CO3
3) HNO3
4) h3SiO3
А13. С гидроксидом калия реагирует каждое из двух веществ
1)
оксид магния и гидроксид цинка
2)
оксид серы (VI) и угольная кислота
3)
сероводород и барий
4)
хлороводородная кислота и водород
А14. С каждым из двух веществ, формулы которых BaCl2 и Cu(OH)2, будет взаимодействовать
1)
соляная кислота
2)
кремниевая кислота
3)
азотная кислота
4)
фосфорная кислота
А15. С раствором нитратом меди (II) может взаимодействовать
1)
цинк
2)
гидроксид железа (III)
3)
оксид углерода (IV)
4)
углерод
А16. Число связей С-Н в молекуле этана равно
1)
5
2)
2
3)
3
4)
6
А17. Верны ли следующие суждения о чистых веществах и смесях?
А. Молоко является чистым веществом.
Б. Гранит является смесью веществ.
1)
верно только А
2)
верно только Б
3)
верны оба суждения
4)
оба суждения неверны
А18. С помощью фенолфталеина можно распознать
1)
хлорид серебра
2)
водород
3)
гидроксид лития
4)
азотную кислоту
А19. Массовая доля кислорода в силикате магния равна
1)
16%
2)
24%
3)
36%
4)
48%
Кислоты и основания — Кислоты и основания — Национальная 5 редакция химии
Шкала pH
Степень кислотности или щелочности вещества (pH вещества) можно измерить с помощью шкалы pH, непрерывный диапазон, который простирается от нуля ниже нуля. до более 14. Наиболее частые значения pH находятся в диапазоне от 0 до 14.
Кислоты имеют pH менее 7.
Щелочи имеют pH более 7.
Водные и нейтральные растворы имеют pH ровно 7.
pH — это мера концентрации ионов водорода в растворе.{} \]
Растворимые оксиды металлов при растворении в воде образуют щелочи.
Растворимые оксиды неметаллов при растворении в воде выделяют кислоты.
Источники кислотного дождя Деятельность человека является основной причиной кислотных дождей. За последние несколько десятилетий люди выпустили в воздух столько различных химикатов, что изменили состав газов в атмосфере.Электростанции выделяют большую часть диоксида серы и большую часть оксидов азота при сжигании ископаемого топлива, такого как уголь, для производства электроэнергии. Кроме того, выхлопные газы автомобилей, грузовиков и автобусов выделяют в воздух оксиды азота и диоксид серы. Эти загрязнители вызывают кислотные дожди. Кислотный дождь вызван реакциями в окружающей среде |
Оксиды | Введение в химию
Цель обучения
- Обсудите химические свойства оксидов.
Ключевые моменты
- Оксиды металлов обычно содержат анион кислорода в степени окисления -2.
- Благородные металлы (такие как золото или платина) ценятся, потому что они сопротивляются прямому химическому соединению с кислородом, а такие вещества, как оксид золота (III), должны образовываться косвенным путем.
- Поверхность большинства металлов состоит из оксидов и гидроксидов в присутствии воздуха.
- Металлы имеют тенденцию образовывать основные оксиды, неметаллы — кислые оксиды, а амфотерные оксиды образуются элементами, расположенными на границе между металлами и неметаллами (металлоидами).
Условия
- пассивация Самопроизвольное образование твердой нереактивной поверхностной пленки (обычно оксида или нитрида), которая препятствует дальнейшей коррозии.
- оксид — бинарное химическое соединение кислорода с другим химическим элементом.
- кокс Твердый остаток от обжига угля в коксовой печи; используется в основном в качестве топлива и при производстве стали, а ранее в качестве бытового топлива.
Химические свойства оксидов
Оксид — это химическое соединение, которое содержит по крайней мере один атом кислорода и еще один элемент в своей химической формуле. Оксиды металлов обычно содержат анион кислорода в степени окисления -2. Большая часть земной коры состоит из твердых оксидов в результате окисления элементов кислородом воздуха или воды.При сжигании углеводородов образуются два основных оксида углерода: монооксид углерода (CO) и диоксид углерода (CO 2 ). Даже материалы, которые считаются чистыми элементами, часто имеют оксидное покрытие. Например, алюминиевая фольга образует тонкую пленку из Al 2 O 3 (называемую пассивирующим слоем), которая защищает фольгу от дальнейшей коррозии.
Кислород демонстрирует высокую реактивность
Из-за своей электроотрицательности кислород образует прочные химические связи почти со всеми элементами с образованием соответствующих оксидов.Благородные металлы (такие как золото или платина) ценятся, потому что они сопротивляются прямому химическому соединению с кислородом, а такие вещества, как оксид золота (III), должны образовываться косвенными путями. Двумя независимыми путями коррозии элементов являются гидролиз и окисление кислородом. Сочетание воды и кислорода еще более агрессивно. Практически все элементы горят в атмосфере кислорода или богатой кислородом среде. В присутствии воды и кислорода (или просто воздуха) некоторые элементы, например натрий, быстро и даже опасно реагируют с образованием гидроксидных продуктов.Отчасти по этой причине щелочные и щелочноземельные металлы не встречаются в природе в их металлической форме. Цезий настолько реактивен с кислородом, что используется в качестве геттера в электронных лампах. Растворы калия и натрия используются для дезоксигенации и обезвоживания некоторых органических растворителей.
Пассивация
Поверхность большинства металлов состоит из оксидов и гидроксидов в присутствии воздуха. Как упоминалось выше, хорошо известным примером является алюминиевая фольга, покрытая тонкой пленкой оксида алюминия, которая пассивирует металл, замедляя дальнейшую коррозию.Слой оксида алюминия может быть увеличен до большей толщины с помощью процесса электролитического анодирования. Хотя твердые магний и алюминий медленно реагируют с кислородом в STP, они, как и большинство металлов, горят на воздухе, создавая очень высокие температуры.
Полимерные и мономерные молекулярные структуры
Оксиды большинства металлов имеют полимерную структуру с поперечными связями M-O-M. Поскольку эти поперечные связи являются прочными, твердые вещества, как правило, нерастворимы в растворителях, хотя они подвержены воздействию кислот и оснований.Формулы часто обманчиво просты. Многие из них являются нестехиометрическими соединениями. В этих оксидах координационное число оксидного лиганда составляет 2 для большинства электроотрицательных элементов и 3–6 для большинства металлов.
Диоксид кремния Диоксид кремния (SiO 2 ) — один из наиболее распространенных оксидов на поверхности Земли. Как и большинство оксидов, он имеет полимерную структуру.Хотя большинство оксидов металлов являются полимерными, некоторые оксиды являются мономерными молекулами. Самые известные молекулярные оксиды — это углекислый газ и окись углерода.Пятиокись фосфора — более сложный молекулярный оксид с обманчивым названием, формула которого P 4 O 10 . Некоторые полимерные оксиды (диоксид селена и триоксид серы) деполимеризуются с образованием молекул при нагревании. Тетроксиды редки, и известно только пять примеров: четырехокись рутения, четырехокись осмия, четырехокись гассия, четырехокись иридия и четырехокись ксенона. Известно много оксианионов, таких как полифосфаты и полиоксометаллаты. Оксикатионы встречаются реже, например, нитрозоний (NO + ).Конечно, известно много соединений как с оксидами, так и с другими группами. Для переходных металлов известно много оксо-комплексов, а также оксигалогенидов.
Кислотно-основные реакции
Оксиды подвержены действию кислот и оснований. Те, на кого воздействуют только кислоты, являются основными оксидами; те, на которые воздействуют только основания, являются кислыми оксидами. Оксиды, которые реагируют как с кислотами, так и с основаниями, являются амфотерными. Металлы имеют тенденцию образовывать основные оксиды, неметаллы — кислые оксиды, а амфотерные оксиды образуются элементами, расположенными на границе между металлами и неметаллами (металлоидами).
Другие окислительно-восстановительные реакции
Металлы «извлекаются» из оксидов путем химического восстановления. Распространенным и дешевым восстановителем является углерод в виде кокса. Наиболее ярким примером является выплавка железной руды.
Оксиды, такие как оксид железа (III) (или ржавчина, состоящая из гидратированных оксидов железа (III) Fe 2 O 3 · nH 2 O и оксид-гидроксид железа (III) FeO (OH), Fe (OH) 3 ), образуются при соединении кислорода с железом.
Оксиды металлов можно восстанавливать органическими соединениями.Этот окислительно-восстановительный процесс является основой многих важных преобразований в химии, таких как детоксикация лекарств ферментами P450 и производство этиленоксида, который превращается в антифриз. В таких системах металлический центр передает оксидный лиганд органическому соединению с последующей регенерацией оксида металла, часто кислородом воздуха.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
2.6 Молекулярные и ионные соединения — химия
Цели обучения
К концу этого раздела вы сможете:
- Определите ионные и молекулярные (ковалентные) соединения
- Предсказать тип соединения, образованного из элементов, на основе их расположения в периодической таблице.
- Определите формулы простых ионных соединений
В обычных химических реакциях ядро каждого атома (и, следовательно, идентичность элемента) остается неизменным.Однако электроны могут быть добавлены к атомам путем передачи от других атомов, потеряны при передаче другим атомам или совместно с другими атомами. Передача и обмен электронами между атомами определяют химию элементов. Во время образования некоторых соединений атомы приобретают или теряют электроны и образуют электрически заряженные частицы, называемые ионами (рис. 1).
Рис. 1. (a) Атом натрия (Na) имеет равное количество протонов и электронов (11) и не заряжен. (b) Катион натрия (Na + ) потерял электрон, поэтому он имеет на один протон (11) больше, чем электронов (10), что дает ему общий положительный заряд, обозначенный знаком плюса в верхнем индексе.Вы можете использовать периодическую таблицу, чтобы предсказать, образует ли атом анион или катион, и вы часто можете предсказать заряд образовавшегося иона. Атомы многих металлов основной группы теряют достаточно электронов, чтобы у них осталось то же количество электронов, что и у атома предыдущего благородного газа. Например, атом щелочного металла (группа 1) теряет один электрон и образует катион с зарядом 1+; щелочноземельный металл (группа 2) теряет два электрона и образует катион с зарядом 2+ и так далее.Например, нейтральный атом кальция с 20 протонами и 20 электронами легко теряет два электрона. В результате получается катион с 20 протонами, 18 электронами и зарядом 2+. Он имеет такое же количество электронов, что и атомы предшествующего благородного газа, аргона, и обозначается как Ca 2+ . Название иона металла совпадает с названием атома металла, из которого он образуется, поэтому Ca 2+ называется ионом кальция.
Когда атомы неметаллических элементов образуют ионы, они обычно получают достаточно электронов, чтобы дать им такое же количество электронов, как у атома следующего благородного газа в периодической таблице.Атомы группы 17 получают один электрон и образуют анионы с зарядом 1−; атомы группы 16 получают два электрона и образуют ионы с зарядом 2− и так далее. Например, нейтральный атом брома с 35 протонами и 35 электронами может получить один электрон, чтобы обеспечить ему 36 электронов. В результате получается анион с 35 протонами, 36 электронами и зарядом 1−. Он имеет такое же количество электронов, что и атомы следующего благородного газа, криптона, и обозначается Br — . (Обсуждение теории, подтверждающей предпочтительный статус числа электронов благородных газов, отраженное в этих правилах прогнозирования образования ионов, приводится в следующей главе этого текста.)
Обратите внимание на полезность периодической таблицы в предсказании вероятного образования и заряда иона (рис. 2). Двигаясь слева направо в периодической таблице, элементы основной группы имеют тенденцию образовывать катионы с зарядом, равным номеру группы. То есть элементы группы 1 образуют ионы 1+; элементы группы 2 образуют 2+ иона и т. д. Двигаясь справа налево в периодической таблице, элементы часто образуют анионы с отрицательным зарядом, равным количеству групп, перемещенных влево от благородных газов.Например, элементы группы 17 (одна группа слева от благородных газов) образуют ионы 1−; элементы группы 16 (две группы слева) образуют ионы 2− и так далее. Эту тенденцию можно использовать в качестве ориентира во многих случаях, но ее предсказательная ценность уменьшается по мере приближения к центру таблицы Менделеева. Фактически, переходные металлы и некоторые другие металлы часто имеют переменные заряды, которые нельзя предсказать по их расположению в таблице. Например, медь может образовывать ионы с зарядом 1+ или 2+, а железо может образовывать ионы с зарядом 2+ или 3+.
Рис. 2. Некоторые элементы демонстрируют правильную структуру ионного заряда, когда они образуют ионы.Пример 1
Состав ионов
Ион, содержащийся в некоторых соединениях, используемых в качестве антиперспирантов, содержит 13 протонов и 10 электронов. Что это за символ?
Решение
Поскольку количество протонов остается неизменным, когда атом образует ион, атомный номер элемента должен быть 13. Зная это, мы можем использовать периодическую таблицу, чтобы идентифицировать элемент как Al (алюминий).Атом Al потерял три электрона и, таким образом, имеет на три положительных заряда (13) больше, чем электронов (10). Это катион алюминия Al 3+ .
Проверьте свои знания
Дайте символ и название иона с 34 протонами и 36 электронами.
Ответ:
Se 2-, селенид-ион
Пример 2
Образование ионов
Магний и азот реагируют с образованием ионного соединения. Предскажите, что образует анион, который образует катион, и заряды каждого иона.Напишите символ для каждого иона и назовите их.
Раствор
Положение магния в периодической таблице (группа 2) говорит нам, что это металл. Металлы образуют положительные ионы (катионы). Атом магния должен потерять два электрона, чтобы иметь такое же количество электронов, как у атома предыдущего благородного газа, неона. Таким образом, атом магния образует катион с двумя электронами меньше, чем протонов, и с зарядом 2+. Символ для иона — Mg 2+ , и он называется ионом магния.
Позиция азота в периодической таблице (группа 15) показывает, что это неметалл. Неметаллы образуют отрицательные ионы (анионы). Атом азота должен получить три электрона, чтобы иметь такое же количество электронов, как и атом следующего благородного газа, неона. Таким образом, атом азота образует анион с тремя электронами больше, чем протонов, и зарядом 3−. Символ для иона — N 3-, и он называется нитрид-ионом.
Проверьте свои знания
Алюминий и углерод вступают в реакцию с образованием ионного соединения.Предскажите, что образует анион, который образует катион, и заряды каждого иона. Напишите символ для каждого иона и назовите их.
Ответ:
Al образует катион с зарядом 3+: Al 3+ , ион алюминия. Углерод образует анион с зарядом 4−: C 4−, карбид-ион.
Ионы, которые мы обсуждали до сих пор, называются одноатомными ионами , то есть они являются ионами, образованными только из одного атома. Мы также находим много многоатомных ионов .Эти ионы, которые действуют как дискретные единицы, представляют собой электрически заряженные молекулы (группа связанных атомов с общим зарядом). Некоторые из наиболее важных многоатомных ионов перечислены в Таблице 6. Оксианионы представляют собой многоатомные ионы, которые содержат один или несколько атомов кислорода. На этом этапе изучения химии вы должны запомнить названия, формулы и заряды наиболее распространенных многоатомных ионов. Поскольку вы будете использовать их неоднократно, они скоро станут вам знакомы.
Обратите внимание, что существует система именования некоторых многоатомных ионов; -ate и -ite суффиксы, обозначающие многоатомные ионы, содержащие больше или меньше атомов кислорода. Per- (сокращение от «гипер») и hypo- (что означает «ниже») — это префиксы, означающие больше атомов кислорода, чем -ate , и меньше атомов кислорода, чем -ite , соответственно. Например, перхлорат — это ClO 4 —, хлорат — это ClO 3 —, хлорит — это ClO 2 — и гипохлорит — ClO —.К сожалению, количество атомов кислорода, соответствующее данному суффиксу или префиксу, не согласуется; например, нитрат — это NO 3 —, а сульфат — это SO 4 2-. Более подробно это будет рассмотрено в следующем модуле по номенклатуре.
Природа сил притяжения, которые удерживают атомы или ионы вместе внутри соединения, является основой для классификации химических связей. Когда электроны переносятся и образуются ионы, образуются ионные связи .Ионные связи — это электростатические силы притяжения, то есть силы притяжения, испытываемые между объектами с противоположным электрическим зарядом (в данном случае катионами и анионами). Когда электроны «делятся» и образуются молекулы, получается ковалентных связи и . Ковалентные связи — это силы притяжения между положительно заряженными ядрами связанных атомов и одной или несколькими парами электронов, расположенными между атомами. Соединения классифицируются как ионные или молекулярные (ковалентные) на основе имеющихся в них связей.
Когда элемент, состоящий из атомов, которые легко теряют электроны (металл), реагирует с элементом, состоящим из атомов, которые легко приобретают электроны (неметалл), обычно происходит перенос электронов с образованием ионов. Соединение, образованное этим переносом, стабилизируется электростатическим притяжением (ионными связями) между ионами противоположного заряда, присутствующими в соединении. Например, когда каждый атом натрия в образце металлического натрия (группа 1) отдает один электрон для образования катиона натрия, Na + , и каждый атом хлора в образце газообразного хлора (группа 17) принимает один электрон на образуют хлорид-анион Cl —, полученное соединение NaCl состоит из ионов натрия и хлорид-ионов в соотношении один ион Na + на каждый ион Cl —.Точно так же каждый атом кальция (группа 2) может отдать два электрона и передать по одному каждому из двух атомов хлора с образованием CaCl 2 , который состоит из ионов Ca 2+ и Cl — в соотношении один Ион Ca 2+ на два иона Cl —.
Соединение, содержащее ионы и удерживаемое ионными связями, называется ионным соединением . Таблица Менделеева может помочь нам распознать многие соединения, которые являются ионными: когда металл объединяется с одним или несколькими неметаллами, соединение обычно является ионным.Это руководство хорошо подходит для прогнозирования образования ионных соединений для большинства соединений, которые обычно встречаются во вводном курсе химии. Однако это не всегда так (например, хлорид алюминия AlCl 3 не является ионным).
Вы часто можете распознать ионные соединения по их свойствам. Ионные соединения — это твердые вещества, которые обычно плавятся при высоких температурах и кипят при еще более высоких температурах. Например, хлорид натрия плавится при 801 ° C и кипит при 1413 ° C.(Для сравнения: вода с молекулярным соединением плавится при 0 ° C и закипает при 100 ° C.) В твердой форме ионное соединение не является электропроводным, потому что его ионы не могут течь («электричество» — это поток заряженных частиц ). Однако в расплавленном состоянии он может проводить электричество, потому что его ионы могут свободно перемещаться через жидкость (рис. 3).
Рисунок 3. Хлорид натрия плавится при 801 ° C и в расплавленном состоянии проводит электричество. (кредит: модификация работы Марка Блейзера и Мэтта Эванса)Посмотрите это видео, чтобы увидеть, как смесь солей плавится и проводит электричество.
В каждом ионном соединении общее количество положительных зарядов катионов равно общему количеству отрицательных зарядов анионов. Таким образом, ионные соединения в целом электрически нейтральны, даже если они содержат положительные и отрицательные ионы. Мы можем использовать это наблюдение, чтобы помочь нам написать формулу ионного соединения. Формула ионного соединения должна иметь такое соотношение ионов, чтобы количество положительных и отрицательных зарядов было равным.
Пример 3
Предсказание формулы ионного соединения
Драгоценный камень сапфир (рис. 4) в основном представляет собой соединение алюминия и кислорода, которое содержит катионы алюминия, Al 3+ , и анионы кислорода, O 2-.Какая формула этого соединения?
Раствор
Поскольку ионное соединение должно быть электрически нейтральным, оно должно иметь одинаковое количество положительных и отрицательных зарядов. Два иона алюминия, каждый с зарядом 3+, дадут нам шесть положительных зарядов, а три оксидных иона, каждый с зарядом 2−, дадут нам шесть отрицательных зарядов.Формула будет следующей: Al 2 O 3 .
Проверьте свои знания
Предскажите формулу ионного соединения, образованного катионом натрия Na + и сульфидным анионом S 2-.
Многие ионные соединения содержат многоатомные ионы (таблица 6) в виде катиона, аниона или того и другого. Как и простые ионные соединения, эти соединения также должны быть электрически нейтральными, поэтому их формулы можно предсказать, рассматривая многоатомные ионы как дискретные единицы.Мы используем круглые скобки в формуле для обозначения группы атомов, которые ведут себя как единое целое. Например, формула фосфата кальция, одного из минералов в наших костях, — Ca 3 (PO 4 ) 2 . Эта формула показывает, что на каждые две фосфатные (PO 4 3-) группы приходится три иона кальция (Ca 2+ ). Группы PO 4 3- представляют собой дискретные единицы, каждая из которых состоит из одного атома фосфора и четырех атомов кислорода и имеет общий заряд 3−.Соединение электрически нейтрально, и его формула показывает общее количество трех атомов Ca, двух P и восьми атомов O.
Пример 4
Предсказание формулы соединения с многоатомным анионом
Разрыхлитель содержит дигидрофосфат кальция, ионное соединение, состоящее из ионов Ca 2+ и H 2 PO 4 —. Какая формула этого соединения?
Раствор
Положительный и отрицательный заряды должны уравновешиваться, и это ионное соединение должно быть электрически нейтральным.Таким образом, у нас должны быть два отрицательных заряда, чтобы сбалансировать заряд 2+ иона кальция. Для этого требуется соотношение одного иона Ca 2+ к двум ионам H 2 PO 4 — . Мы обозначаем это, заключая формулу для иона дигидрофосфата в скобки и добавляя нижний индекс 2. Формула: Ca (H 2 PO 4 ) 2 .
Проверьте свои знания
Предскажите формулу ионного соединения, образованного между ионом лития и ионом пероксида, O 2 2- (Подсказка: используйте периодическую таблицу, чтобы предсказать знак и заряд иона лития. .)
Поскольку ионное соединение не состоит из отдельных дискретных молекул, его нельзя правильно обозначить с помощью молекулярной формулы . Вместо этого ионные соединения должны быть обозначены формулой, указывающей относительные числа и составляющих их ионов. Для соединений, содержащих только одноатомные ионы (например, NaCl), и для многих соединений, содержащих многоатомные ионы (например, CaSO 4 ), эти формулы являются всего лишь эмпирическими формулами, введенными ранее в этой главе.Однако формулы для некоторых ионных соединений, содержащих многоатомные ионы, не являются эмпирическими формулами. Например, ионное соединение оксалат натрия состоит из ионов Na + и C 2 O 4 2-, объединенных в соотношении 2: 1, и его формула записывается как Na 2 C 2 О 4 . Индексы в этой формуле не являются наименьшими из возможных целых чисел, так как каждое из них можно разделить на 2, чтобы получить эмпирическую формулу NaCO 2 .Однако это не общепринятая формула оксалата натрия, поскольку она неточно представляет многоатомный анион соединения, C 2 O 4 2-.
Многие соединения не содержат ионов, а состоят исключительно из дискретных нейтральных молекул. Эти молекулярные соединения (ковалентные соединения) образуются, когда атомы делятся, а не передают (приобретают или теряют) электроны. Ковалентное связывание — важное и обширное понятие в химии, и оно будет подробно рассмотрено в одной из последующих глав этого текста.Мы часто можем идентифицировать молекулярные соединения на основе их физических свойств. В нормальных условиях молекулярные соединения часто существуют в виде газов, низкокипящих жидкостей и легкоплавких твердых веществ, хотя существует много важных исключений.
В то время как ионные соединения обычно образуются при соединении металла и неметалла, ковалентные соединения обычно образуются при соединении неметаллов. Таким образом, таблица Менделеева может помочь нам распознать многие ковалентные соединения. Хотя мы можем использовать положения элементов соединения в периодической таблице, чтобы предсказать, является ли оно ионным или ковалентным на данном этапе нашего изучения химии, вы должны знать, что это очень упрощенный подход, который не учитывает ряд факторов. интересные исключения.Между ионными и молекулярными соединениями существуют оттенки серого, о которых вы узнаете позже.
Пример 5
Предсказание типа связи в соединениях
Предскажите, являются ли следующие соединения ионными или молекулярными:
(a) KI, соединение, используемое в качестве источника йода в поваренной соли
(b) H 2 O 2 , отбеливатель и дезинфицирующее средство перекись водорода
(c) CHCl 3 , анестезирующий хлороформ
(d) Li 2 CO 3 , источник лития в антидепрессантах
Раствор
(a) Калий (группа 1) — металл, а йод (группа 17) — неметалл; KI предположительно будет ионным.
(b) Водород (группа 1) — неметалл, а кислород (группа 16) — неметалл; H 2 O 2 предполагается молекулярным.
(c) Углерод (группа 14) — неметалл, водород (группа 1) — неметалл, а хлор (группа 17) — неметалл; Предполагается, что CHCl 3 будет молекулярным.
(d) Литий (группа 1) — металл, а карбонат — многоатомный ион; Предполагается, что Li 2 CO 3 будет ионным.
Проверьте свои знания
Используя таблицу Менделеева, предскажите, являются ли следующие соединения ионными или ковалентными:
(а) СО 2
(б) CaF 2
(в) № 2 H 4
(г) Al 2 (SO 4 ) 3
Ответ:
(а) молекулярный; (б) ионный; (в) молекулярный; (г) ионный
Металлы (особенно в группах 1 и 2) имеют тенденцию терять количество электронов, которое оставило бы их с тем же количеством электронов, что и в предыдущем благородном газе в периодической таблице.Таким образом образуется положительно заряженный ион. Точно так же неметаллы (особенно в группах 16 и 17 и, в меньшей степени, в группе 15) могут получить количество электронов, необходимое для обеспечения атомов таким же количеством электронов, как и в следующем благородном газе в периодической таблице. . Таким образом, неметаллы имеют тенденцию образовывать отрицательные ионы. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы — анионами. Ионы могут быть одноатомными (содержащими только один атом) или многоатомными (содержащими более одного атома).
Соединения, содержащие ионы, называются ионными соединениями. Ионные соединения обычно образуются из металлов и неметаллов. Соединения, которые не содержат ионы, а вместо этого состоят из атомов, прочно связанных в молекулы (незаряженные группы атомов, которые ведут себя как единое целое), называются ковалентными соединениями. Ковалентные соединения обычно образуются из двух неметаллов.
Химия: упражнения в конце главы
- Используя таблицу Менделеева, предскажите, являются ли следующие хлориды ионными или ковалентными: KCl, NCl 3 , ICl, MgCl 2 , PCl 5 и CCl 4 .
- С помощью таблицы Менделеева предскажите, являются ли следующие хлориды ионными или ковалентными: SiCl 4 , PCl 3 , CaCl 2 , CsCl, CuCl 2 и CrCl 3 .
- Для каждого из следующих соединений укажите, является ли оно ионным или ковалентным. Если он ионный, напишите символы для участвующих ионов:
(а) НФ 3
(б) BaO,
(в) (NH 4 ) 2 CO 3
(г) Sr (H 2 PO 4 ) 2
(e) IBr
(е) Na 2 O
- Для каждого из следующих соединений укажите, является ли оно ионным или ковалентным, и, если оно ионное, напишите символы для соответствующих ионов:
(а) KClO 4
(б) MgC 2 H 3 O 2
(в) H 2 S
(г) Ag 2 S
(e) N 2 Класс 4
(f) Co (NO 3 ) 2
- Для каждой из следующих пар ионов напишите символ формулы соединения, которое они будут образовывать:
(а) Ca 2+ , S 2-
(б) NH 4 + , SO 4 2-
(в) Al 3+ , Br —
(г) Na + , HPO 4 2-
(д) Mg 2+ , PO 4 3-
- Для каждой из следующих пар ионов напишите символ формулы соединения, которое они будут образовывать:
(а) К + , О 2-
(б) NH 4 +, PO 4 3-
(в) Al 3+ , O 2-
(г) Na + , CO 3 2-
(д) Ba 2+ , PO 4 3-
Глоссарий
- ковалентная связь
- сила притяжения между ядрами атомов молекулы и парами электронов между атомами
- ковалентное соединение
- (также молекулярное соединение), состоящее из молекул, образованных атомами двух или более различных элементов
- ионная связь
- электростатические силы притяжения между противоположно заряженными ионами ионного соединения
- ионное соединение
- Соединение, состоящее из катионов и анионов, объединенных в соотношении с образованием электрически нейтрального вещества
- молекулярное соединение
- (также ковалентное соединение), состоящее из молекул, образованных атомами двух или более различных элементов
- одноатомный ион
- ион, состоящий из одного атома
- оксианион
- многоатомный анион, состоящий из центрального атома, связанного с атомами кислорода
- многоатомный ион
- ион, состоящий из более чем одного атома
Решения
Ответы на упражнения в конце главы по химии
1.Ионный: KCl, MgCl 2 ; Ковалентные: NCl 3 , ICl, PCl 5 , CCl 4
3. (а) ковалентный; (б) ионный, Ba 2+ , O 2-; (в) ионный, NH 4 + , CO 3 2-; (г) ионный, Sr 2+ , H 2 PO 4 — ; (д) ковалентный; (е) ионная, Na + , O 2-
5. (а) CaS; б) (NH 4 ) 2 SO 4 ; c) AlBr 3 ; d) Na 2 HPO 4 ; (e) Mg 3 (PO 4 ) 2
pH и изменение цвета | Глава 6: Химические изменения
Добавьте универсальный индикаторный раствор к кислоте и основанию, спрятанным в «пустых» стаканах, чтобы продемонстрировать, как кислота и основание могут изменить цвет индикатора pH.
Материалы для демонстрации
- 3 прозрачных пластиковых стакана
- Лимонная кислота
- Карбонат натрия
- Универсальное индикаторное решение
- Вода
Примечание. Водопроводная вода из вашего местного водопровода, скорее всего, подойдет для демонстрации и занятий в этом уроке. Если приготовленный вами индикаторный раствор не зеленого цвета, это означает, что ваша вода либо кислая, либо щелочная. В этом случае используйте дистиллированную воду, которая продается в супермаркетах и аптеках.
Подготовка учителей
- Сделать индикаторное решение для студенческих групп
- Приготовьте разбавленный универсальный индикаторный раствор для этой демонстрации и для каждой студенческой группы, смешав 250 мл воды с 10 мл универсального индикаторного раствора.
- Налейте около 25 мл этого разбавленного раствора универсального индикатора в чистую чашку для каждой группы учащихся.
Примечание. В этом задании учащиеся заполнят 12 лунок универсальным индикаторным раствором.Убедитесь, что достаточно 25 мл раствора. Для демонстрации вам потребуется около 50 мл индикаторного раствора. Если 250 мл раствора недостаточно, приготовьте еще в тех же пропорциях.
Подготовка к демонстрации
Налейте около 50 мл индикаторного раствора в прозрачную пластиковую чашку для демонстрации.
- Используя две пустые прозрачные пластиковые чашки, добавьте примерно чайной ложки лимонной кислоты в одну чашку и чайной ложки карбоната натрия в другую.Не говорите студентам, что вы что-то добавили в чашки.
Процедура
Налейте примерно ⅓ раствора индикатора в чашку с лимонной кислотой и в чашку с карбонатом натрия. Оставьте ⅓ в индикаторной чашке.
Ожидаемые результаты
Лимонная кислота меняет цвет индикатора с зеленого на красноватый. Карбонат натрия меняет цвет индикатора с зеленого на фиолетовый.
Скажите студентам, что вы положили что-то в чашки заранее.
Спросите студентов:
- Как вы думаете, это была химическая реакция? Почему или почему нет?
- Изменение цвета часто является признаком химической реакции. Таким образом, изменение цвета в каждой чашке, вероятно, является результатом химической реакции. (Об этом говорится в главе 6, урок 6.)
- Вы бы сказали, что вещества, которые находились в чашках до того, как была добавлена жидкость, были одинаковыми или разными? Почему?
- Жидкость в каждой чашке во время реакции меняла цвет.Поскольку вещества реагируют химически по-своему, а вещества реагируют по-разному, вещества в каждой чашке должны быть разными.
Сообщите студентам, что зеленый раствор был приготовлен путем добавления в воду вещества, называемого универсальным индикатором. Объясните, что вы добавляете небольшое количество вещества — кислоту и основание — в каждую чашку. Не говорите студентам, в какой чашке содержится кислота или щелочь.
Сообщите учащимся, что когда вы наливали универсальный индикаторный раствор в чашки, кислота и основание вступали в реакцию с индикатором и меняли его цвет.Обычно, когда два вещества смешиваются и происходит изменение цвета, это признак того, что произошла химическая реакция. Причина этого изменения цвета будет обсуждаться позже в этом уроке, когда учащиеся будут заниматься своими делами.
Сообщите учащимся, что они будут использовать кислоту, щелочь и универсальный индикаторный раствор, чтобы узнать, как кислоты и щелочи влияют на воду. Они также узнают, как измерить эффект с помощью цветов и чисел на шкале pH.
Попросите учащихся сравнить цвет растворов, приготовленных в демонстрации, с цветами на цветной диаграмме универсального индикатора pH.
Раздайте по одной цветовой шкале универсального индикатора pH каждой группе. Объясните, что на графике показан диапазон изменения цвета универсального индикатора при добавлении в индикатор кислотных или основных растворов. Обратите внимание на то, что каждому цвету соответствует номер, и что учащиеся узнают больше об этих числах позже на уроке. По мере того, как раствор становится более кислым, цвет меняется с зеленого на красный. По мере того, как раствор становится более основным, цвет меняется с зеленого на фиолетовый.
Поднимите чашки из демонстрации и задайте следующие вопросы:
- Какой цвет жидкости в каждой чашке говорит вам о веществе, которое уже было в чашке, когда был добавлен индикатор?
- Чашка, которая стала красноватой, изначально содержала кислоту, а чашка, которая стала пурпурной, изначально содержала основу.
- Что зеленый цвет индикатора говорит вам о воде в этой чашке? Он кислый, щелочной или ни то, ни другое?
- Зеленый индикатор, оставленный в чашке, не является ни кислотным, ни щелочным, поэтому он должен быть нейтральным.
Представьте кислоту и основание, использованные в демонстрации, и обсудите, как цвет универсального индикатора может измениться от других распространенных кислот и оснований.
Объясните, что перед занятием вы добавили небольшое количество лимонной кислоты в чашку, которая стала красной, и небольшое количество карбоната натрия в чашку, которая стала фиолетовой. Итак, лимонная кислота — это кислота, а карбонат натрия — это основание.
Кислоты и универсальный индикаторный раствор
Объясните, что лимонная кислота содержится в цитрусовых, таких как лимоны, лаймы и апельсины.
Спросите студентов:
- Какие еще распространенные примеры кислот?
- Студенты могут сказать, что уксус — это кислота. Вы можете указать, что существуют и более сильные кислоты, такие как серная кислота, используемая в автомобильных аккумуляторах.
- Какие цвета вы ожидали бы увидеть, если бы поместили какое-либо из этих веществ в универсальный индикатор?
- Цвет этих кислот может измениться на желтый, оранжевый или красный.
Базы и универсальный индикаторный раствор
Объясните, что карбонат натрия — одно из химикатов, обычно используемых в моющих средствах для посудомоечных машин.
Спросите студентов:
- Какие еще распространенные примеры баз?
- Студенты могут не знать никаких примеров основ, но вы можете сказать им, что мыло, нашатырный спирт и другие чистящие средства часто являются основаниями.
- Какие цвета вы ожидали бы увидеть, если бы поместили какое-либо из этих веществ в универсальный индикатор?
- Цвет может измениться на темно-зеленый, синий и фиолетовый для любой из этих баз.(Для универсального индикатора изменения цвета для оснований не такие разные, как для кислот.)
Сообщите учащимся, что затем они изучат изменение цвета универсального индикатора с небольшими количествами лимонной кислоты и карбоната натрия.
Раздайте каждому учащемуся рабочий лист.
Студенты будут записывать свои наблюдения и отвечать на вопросы о деятельности в листе действий. «Объясни это с помощью атомов и молекул» и «Возьми это». Дальнейшие разделы рабочего листа будут заполнены либо в классе, либо в группах, либо индивидуально, в зависимости от ваших инструкций.Чтобы найти ответы на листе занятий, перейдите в область загрузок в онлайн-версии этого урока.
Попросите учащихся подготовить решения для задания.
Объясните учащимся, что они сначала примут решения для задания. Либо пройдите с ними каждый шаг, либо попросите их следовать процедуре, описанной в их листе действий.
Подготовка учителей
Студентам потребуется небольшое количество карбоната натрия и лимонной кислоты для выполнения задания.
- Пометьте две небольшие пластиковые стаканчики с лимонной кислотой и карбонатом натрия для каждой группы.
- Налейте примерно ¼ чайной ложки лимонной кислоты и карбоната натрия в чашки с этикетками.
- Раздайте чашки с универсальным индикаторным раствором каждой группе учащихся.
Материалы для каждой группы
- 2 прозрачных пластиковых стакана
- 3 капельницы
- Малярная лента и ручка или перманентный маркер
- Универсальный индикатор в чашке
- Вода
- Градуированный цилиндр
- Карбонат натрия
- Лимонная кислота
- 2 плоские зубочистки
Процедура
Обозначьте свое оборудование
Используйте малярную ленту и ручку, чтобы промаркировать одну чашку раствора лимонной кислоты и другую чашку раствора карбоната натрия.
Используйте небольшой кусок малярной ленты и ручку, чтобы промаркировать одну пипетку с раствором лимонной кислоты, а другую — с раствором карбоната натрия.
Сделайте раствор лимонной кислоты
С помощью мерного цилиндра добавьте 5 мл воды в чашку с этикеткой лимонной кислоты.
Используйте плоскую зубочистку, чтобы собрать как можно больше лимонной кислоты на конце зубочистки, как показано на рисунке.
Добавьте эту лимонную кислоту в воду в чашке для лимонной кислоты. Осторожно перемешайте, пока лимонная кислота не растворится.
Приготовьте раствор карбоната натрия
С помощью мерного цилиндра добавьте 5 мл воды в чашку с надписью «карбонат натрия».
Используйте плоскую зубочистку, чтобы собрать как можно больше карбоната натрия на конце зубочистки.
Добавьте этот карбонат натрия в воду в чашке для карбоната натрия. Осторожно взбалтывайте, пока карбонат натрия не растворится.
Объясните, что студенты будут делать в следующем упражнении, и обсудите цель наличия контроля.
Объясните учащимся, что в этом упражнении они заполнят лунки каждого планшета универсальным индикаторным раствором.Затем в первом планшете они проверит, как разные концентрации лимонной кислоты влияют на цвет универсального индикаторного раствора. На другой пластине для точечных исследований они будут проверять, как различные концентрации карбоната натрия влияют на цвет универсального индикаторного раствора.
Сообщите учащимся, что на каждой планшете они ничего не будут добавлять к индикаторному раствору в первой лунке. Это потому, что первая скважина будет служить контролем.
Спросите студентов:
- Почему важно иметь контроль?
- Контроль оставляют в покое и не меняют, чтобы любые изменения цвета в других лунках можно было сравнить с исходным цветом в контроле.
Попросите учащихся проверить возрастающие концентрации раствора лимонной кислоты.
Вопрос для расследования
Как концентрация лимонной кислоты влияет на цвет универсального индикаторного раствора?
материалов для каждой группы
- Универсальное индикаторное решение
- Цветовая диаграмма pH
- Раствор лимонной кислоты
- Не менее 6 зубочисток
- Точечная пластина
- 2 капельницы
Процедура
Проверьте свой раствор лимонной кислоты
- Используйте одну из своих капельниц, чтобы заполнить почти 6 лунок вашего первого планшета с универсальным индикаторным раствором.Поместите цветовую диаграмму универсального индикатора pH перед пластиной для точечного анализа.
С помощью пипетки добавьте 1 каплю раствора лимонной кислоты во вторую лунку. Аккуратно перемешайте жидкость чистой зубочисткой.
- Сравните цвет жидкости с контролем и с цветовой диаграммой универсального индикатора pH. Запишите цвет индикатора, количество зубочисток с лимонной кислотой и число pH в таблице на листе активности для лунки 2.
Ожидаемые результаты
Цвет индикатора должен стать желто-зеленым или желтым. Если после добавления лимонной кислоты в зубочистку цвет не меняется, попросите учащихся добавить в раствор еще немного лимонной кислоты. Скажите им, чтобы они набрали как можно больше лимонной кислоты на кончик зубочистки.
Запись наблюдений
Помогите студентам заполнить таблицу на листе с заданиями.Студенты могут сказать, что раствор в лунке 2 имеет желтый или желто-зеленый цвет. Затем попросите учащихся присвоить номер pH. Скажите студентам, что если цвет в лунке кажется между двумя цветами на диаграмме, они должны назначить значение pH между ними.
Скажите студентам, что в следующей части упражнения они добавят немного больше лимонной кислоты в раствор лимонной кислоты. Это сделает раствор лимонной кислоты более концентрированным. Как и раньше, они добавят одну каплю раствора лимонной кислоты, но на этот раз раствор лимонной кислоты будет более концентрированным.
Попросите учащихся сделать прогноз:
Как вы думаете, изменится ли цвет, если вы добавите одну каплю более концентрированного раствора лимонной кислоты в универсальный индикатор в следующей лунке?
Процедура
- Проверить более концентрированный раствор лимонной кислоты
Добавьте еще одну мерную ложку лимонной кислоты зубочисткой в чашку с лимонной кислотой.Осторожно перемешайте, пока лимонная кислота не растворится.
Добавьте 1 каплю этого более концентрированного раствора лимонной кислоты в третью лунку. Аккуратно перемешайте раствор чистой зубочисткой.
- Сравните цвет раствора с контролем и с цветовой диаграммой универсального индикатора pH. Запишите цвет индикатора, количество ложек лимонной кислоты, добавленных зубочисткой, и число pH в диаграмме для лунки 3.
- Продолжайте добавлять зубочистки лимонной кислоты и тестировать раствор в последних трех лунках, чтобы увидеть, сколько разных цветов вы можете получить.
Ожидаемые результаты
По мере того, как раствор лимонной кислоты становится более концентрированным, цвет должен измениться на желто-зеленый, желтый, желто-оранжевый, оранжевый, оранжево-красный и красный. Полученные цвета будут отличаться от группы к группе из-за разного количества лимонной кислоты, которое студенты могут уловить на конце зубочистки.Студенты могут получить 4 или 5 разных цветов. Ответы и цвета, представленные в таблице ниже, могут отличаться.
Таблица 1. Цвет и pH различных концентраций лимонной кислоты Номер скважины Количество зубочисток лимонной кислоты, использованных в 5 мл воды Цвет pH 1 0 Зеленый 7 2 1 Желто-зеленый 6.5 3 2 желтый 6 4 3 Светло-оранжевый 5,5 5 4 персик 5 6 5 розовый 4 Спросите студентов:
- Как меняется цвет индикаторного раствора, когда раствор лимонной кислоты становится более концентрированным?
- По мере того, как раствор лимонной кислоты становится более концентрированным, цвет на цветовой диаграмме pH перемещается от зеленого к красному.
- Как изменяется число на шкале pH при увеличении концентрации раствора лимонной кислоты?
- По мере того, как раствор лимонной кислоты становится более концентрированным (более кислым), число на шкале pH уменьшается.
Попросите учащихся проверить увеличивающуюся концентрацию раствора карбоната натрия.
Примечание. Различия в цвете на основной стороне шкалы pH универсального индикатора не так очевидны, как на кислотной стороне.Студентам придется усерднее смотреть, чтобы увидеть разницу между зелено-синим, синим, сине-фиолетовым и фиолетовым.
Вопрос для расследования
Как концентрация карбоната натрия влияет на цвет универсального индикаторного раствора?
материалов для каждой группы
- Универсальное индикаторное решение
- Цветовая диаграмма pH
- Раствор карбоната натрия
- Не менее 6 зубочисток
- Точечная пластина
- 2 капельницы
Процедура
Проверьте свой раствор карбоната натрия
- Используйте пипетку, чтобы почти заполнить 6 лунок в другом планшете для точечных проб универсальным индикаторным раствором.Больше ничего в первую лунку не добавишь.
Добавьте 1 каплю раствора карбоната натрия во вторую лунку. Аккуратно перемешайте раствор чистой зубочисткой.
- Сравните цвет раствора с контролем и с цветовой диаграммой универсального индикатора pH. Запишите цвет индикатора, количество зубочисток карбоната натрия, использованных для приготовления раствора, и значение pH в таблице для лунки 2.
Ожидаемые результаты
Цвет индикатора должен стать зелено-синим или синим.
Попросите учащихся сделать прогноз:
Как вы думаете, изменится ли цвет, если вы добавите одну каплю более концентрированного раствора карбоната натрия в универсальный индикатор в следующей лунке?
Сообщите студентам, что если вы добавите больше основы в такое же количество воды, концентрация основы возрастет.
Испытание более концентрированного раствора карбоната натрия
Добавьте еще одну зубочистку с карбонатом натрия в чашку с карбонатом натрия.Осторожно взбалтывайте, пока карбонат натрия не растворится.
- Добавьте 1 каплю раствора карбоната натрия в следующую лунку. Аккуратно перемешайте жидкость чистой зубочисткой.
- Сравните цвет жидкости с контролем и с цветовой диаграммой универсального индикатора pH. Запишите цвет индикатора, количество использованных зубочисток с карбонатом натрия и значение pH в таблице для лунки 3.
- Продолжайте добавлять зубочистки карбоната натрия и тестировать раствор в последних трех лунках, чтобы увидеть, сколько разных цветов или оттенков вы можете сделать.
Ожидаемые результаты
Более концентрированный раствор карбоната натрия должен изменить цвет на темно-синий, переходящий в пурпурный. Ответы и цвета в таблице ниже могут отличаться.
Таблица 2. Цвет и pH различных концентраций карбоната натрия Номер скважины Количество зубочисток лимонной кислоты, использованных в 5 мл воды Цвет pH 1 0 Зеленый 7 2 1 Зелено-синий 8 3 2 Синий 8.5 4 3 Сине-фиолетовый 9 5 4 фиолетовый 9,5 6 5 фиолетовый 10 Спросите студентов:
- Как меняется цвет индикаторного раствора, когда раствор карбоната натрия становится более концентрированным?
- По мере того, как раствор карбоната натрия становится более концентрированным, цвет на цветовой диаграмме pH меняется от зеленого к пурпурному.
- Как изменяется число на шкале pH при увеличении концентрации основания?
- По мере того, как раствор карбоната натрия становится более концентрированным (более щелочным), число на шкале pH увеличивается.
Объясните, как молекулы воды взаимодействуют друг с другом, образуя ионы.
Сообщите студентам, что pH имеет отношение к тому, как кислоты и основания взаимодействуют с водой.Объясните, что сначала вы покажете студентам, как молекулы воды взаимодействуют друг с другом, прежде чем будет добавлена кислота или основание.
Спроектируйте анимацию «Перенос протона в воде».
Воспроизвести первую часть анимации.
Напомните студентам, что каждый атом водорода в молекуле воды имеет и протон, и электрон. Атомы водорода делятся своими электронами с атомом кислорода.
Щелкните «Далее», чтобы показать, как молекулы воды становятся ионами.
Молекулы воды непрерывно движутся и сталкиваются друг с другом. Иногда, когда две молекулы воды соединяются, протон одного атома водорода покидает молекулу воды и становится частью другой молекулы воды. Движется только положительно заряженный протон; отрицательно заряженный электрон остается. Итак, эти две молекулы H 2 O становятся ионами H 3 O + и OH — .
Щелкните «Далее» еще раз, чтобы показать, как ионы снова становятся молекулами воды.
Объясните: когда эти ионы сталкиваются друг с другом, протон из H 3 O + может перемещаться к иону OH —, снова образуя две обычные молекулы воды. Поскольку протоны непрерывно движутся вперед и назад между молекулами воды или между ионами, в воде всегда есть одно и то же количество ионов H 3 O + и OH ⅛ .
Проектируйте иллюстрацию «Молекулы воды», торгующие протонами.
На этой иллюстрации показаны химические уравнения, объясняющие, как молекулы воды могут становиться ионами и как ионы могут снова становиться молекулами воды.
Объясните студентам: первое химическое уравнение показывает соединение двух молекул воды. Укажите химическую формулу каждой молекулы воды, H 2 O.
Объясните образование иона H
3 O + .После переноса протона молекула воды, которая теперь имеет дополнительный протон, называется ионом H 3 O + . Причина, по которой количество атомов водорода изменилось с двух (нижний индекс в H 2 ) на три (нижний индекс в H 3 ), заключается в том, что наличие дополнительного протона похоже на наличие дополнительного атома водорода, даже если электрон не смирись с этим.Поскольку был добавлен один протон, на один протон больше, чем электронов, что делает его положительным ионом.
Объясните образование иона OH
— .Молекула воды, потерявшая протон, теперь имеет дополнительный электрон, поэтому она называется ионом ОН — . Причина, по которой количество атомов водорода изменилось с двух (индекс в H 2 ) до одного (отсутствие индекса после H означает 1 водород), заключается в том, что потеря протона аналогична потере атома водорода.Поскольку был перенесен только протон, на один электрон больше, чем на протон, что делает его отрицательным ионом.
Скажите студентам, что второе химическое уравнение показывает, что ион H 3 O + и ион OH — снова соединяются, чтобы снова стать молекулами воды.
Объясните преобразование двух молекул H
2 O.Объясните ученикам, что молекулы и ионы воды всегда сталкиваются.Когда ион H 3 O + и ион OH — сталкиваются друг с другом, протон может быть передан от иона H 3 O + к иону OH —, так что каждый ион снова становится молекулой H 2 O.
В любой момент времени в обычном образце воды небольшой процент молекул воды переносит протоны и становится ионами. Кроме того, ионы H 3 O + и OH — переносят протоны и снова становятся молекулами воды.
Объясните, как кислоты и щелочи вызывают изменение цвета индикатора.
Спроецируйте анимацию «Кислоты — дарят протоны».
Сообщите студентам, что когда кислота добавляется к раствору индикатора, кислота отдает протоны молекулам воды. Это увеличивает концентрацию ионов H 3 O + в растворе. Ионы H 3 O + отдают протоны молекулам индикатора, заставляя индикатор менять цвет в сторону красного.
Спроецировать анимацию «Базы принимают протоны».
Когда основание добавляется к раствору индикатора, оно принимает протоны от молекул воды, создавая ионы OH — . Ионы H 3 O + и молекулы индикатора отдают протоны ионам OH —, в результате чего индикатор меняет цвет в сторону пурпурного.
Попросите учащихся медленно влить оставшиеся кислотные и основные растворы в индикаторный раствор, чтобы представить идею о том, что кислоты и основания могут нейтрализовать друг друга.
Попросите учащихся сделать прогноз:
Как вы думаете, изменится ли цвет, если вы добавите небольшое количество каждого оставшегося раствора в универсальный индикаторный раствор?
материалов для каждой группы
- Универсальное индикаторное решение
- Цветовая диаграмма pH
- Раствор лимонной кислоты
- Раствор карбоната натрия
Процедура
- Налейте небольшое количество раствора лимонной кислоты или раствора карбоната натрия в индикаторный раствор.Прокрутите и сравните цвет с цветовой шкалой универсального индикатора pH.
- Налейте небольшое количество другого раствора в индикаторный раствор. Прокрутите и сравните цвет с вашей цветовой диаграммой.
Продолжайте вливать в индикатор небольшое количество растворов кислоты и основания, пока растворы не израсходуются.
Ожидаемые результаты
Цвет индикаторного раствора может быть разным, но учащиеся должны видеть, что смешанные вместе кислоты и основания вызывают изменение цвета индикатора в сторону нейтрального.
Попросите учащихся описать то, что они делали, и свои наблюдения. Затем объясните, что в главе 6, урок 9, они объединят кислоты и основания в индикаторном растворе, чтобы сделать pH конечного раствора нейтральным.
Разделение неизвестной смеси
Разделение неизвестной смеси Эксперимент 8 — Разделение неизвестной смеси кислотно-основной экстракциейЭкспериментальные цели : Цель этого упражнение заключается в разделении двухкомпонентной смеси с помощью экстракции методы, а затем идентифицировать изолированные компоненты с помощью определение их температур плавления.
Задачи экспериментального обучения: В конце в этом эксперименте вы должны уметь: (i) использовать делительная / капельная воронка; (ii) сушат органическую жидкость; (iii) использовать роторный испаритель; (iv) идентифицировать органическую фазу в несмешивающаяся органическая / водная смесь; (v) использовать кислотно-основные реакции повлиять на растворимость органических соединений и (vi) определить точки плавления.
Каждому студенту будет дана смесь двух веществ, которые принадлежат к двум из трех категорий, перечисленных ниже.
| Возможные карбоновые кислоты | бензойная кислота | 2-хлорбензойная кислота |
| Возможные фенолы | 4- трет -бутилфенол | 2-нафтол |
| Возможные нейтралы | 1,4-диметоксибензол | флуорен |
Справочная информация : Помимо чтения в лаборатории manual вам нужно будет сделать еще немного.Чтобы помочь вам понять химическую основу этого упражнения, вам следует пересмотреть Разделы 3.5 — 3.7 в Solomons & Fryhl, которые касаются свойства кислот и сопряженных с ними оснований. Платите особые внимание к использованию p K a значений. Ты также следует просмотреть соответствующие страницы в Mohrig и оплатить пристальное внимание во время лабораторного разговора, чтобы познакомиться с экстракция, промывка, осушители и перекристаллизация.
Общая информация : Извлечение — это
особенно полезные средства разделения органических соединений, если
соединение в смеси может быть химически превращено в ионное
форма.Ионная форма растворима в водном слое и может быть
извлекается в него. Другие, неионные органические соединения в
смесь останется растворенной в слое органического растворителя.
Разделение двух слоев приводит к разделению двух
соединения.
Степень, в которой кислотно-основная реакция протекает до
завершение зависит от относительной кислотности реагентов и
товары. Реакции протекают так, что более сильные кислоты и
основания превращаются в более слабое сопряженное основание и сопряжены
кислоты соответственно. P K значение
кислоты дает меру кислотности каждого соединения. Сильнее
кислоты имеют меньшие значения p K a и их сопряженные основания
слабее. Положение кислотно-щелочного равновесия тогда может быть
предсказано на основе знания p K значений кислот
вовлеченный.
Взгляните на следующие кислотно-основные реакции на рисунке 1, платя
особое внимание к положению равновесия и
его отношение к p K значения даны.
Рисунок 1:
Реакции карбоновой кислоты и фенол с бикарбонат-ионом. Обратите внимание, что карбоновая кислота имеет более низкий pKa, чем у сопряженной кислоты бикарбонат-иона (угольной кислота). Таким образом, реакция переходит в продукты. В реакция фенола, однако, благоприятствует реагентам, поскольку pKa фенола (10) больше, чем угольной кислоты (6.4). Кислотно-основные реакции отдают предпочтение стороне с более слабой кислотой (т. Е. они предпочитают сторону с большим pKa).Итак, извлекая смесь этих двух соединений с бикарбонатом приводит к ионизация и экстракция карбоновой кислоты в присутствии фенол, таким образом отделяя два соединения друг от друга.
Теперь посмотрим на реакцию на Рисунке 2, где мы используем более сильную база для реакции:
Рисунок 2:
Реакции карбоновой кислоты и фенол с гидроксид-ионом. Обратите внимание, что в обоих случаях реакции способствуют образованию продуктов.Следовательно, извлекая с гидроксид-ионом приведет к ионизации и экстракции обоих соединений одновременно.
Внимательный взгляд на эти два рисунка показывает, что разделение смесь карбоновой кислоты и фенола лучше всего сделать с использованием бикарбонат-иона, так как преобразуется только карбоновая кислота в его сопряженное основание бикарбонатом. Сопряженное основание карбоновая кислота, будучи ионной разновидностью, растворима в водный слой, в то время как фенол (левый неионизированный) останется растворяется в органическом слое.Однако, если бы мы извлекли с ионом гидроксида и карбоновая кислота, и фенол будут быть преобразованы в их сопряженные основания (см. рисунок 2). В сопряженные основания, опять же, оба являются ионными частицами и, следовательно, растворим в водном слое. Это означает, что оба соединения будут извлечены одновременно, что не приведет к разделению.
Нейтральное соединение не будет реагировать ни с бикарбонат-ионом, ни с гидроксид-ион, поскольку нейтральное соединение не имеет протонов достаточно кислый, чтобы его можно было удалить этими основаниями.Поэтому такой соединение останется растворенным в органическом слое, независимо от того, какая база добавлена. Например, смесь нейтрального соединения и карбоновая кислота может быть разделена с использованием бикарбонат-иона так как только карбоновая кислота будет ионизирована бикарбонатом ион.
После экстракции карбоновая кислота и фенол могут быть восстанавливается добавлением HCl к водным растворам. Карбоксилат ион и феноксид будут протонированы HCl, что приведет к образование исходной карбоновой кислоты и фенола, ни из которых растворяется в воде, поэтому они выпадают в осадок из раствора.Затем твердое вещество можно выделить фильтрованием. На рисунке 3 показано это химия для вас.
Рисунок 3:
Реакции карбоксилат-иона и феноксид-ион с HCl. Поскольку HCl является более сильной кислотой, чем любой другой из конъюгированных кислот продукты предпочтительны в обоих случаях. Эти продукты, карбоновая кислота и фенол, не растворяются в водные растворы и осадок из раствора. Результирующий твердые вещества могут быть изолированы и определены их температуры плавления.
Процедура, которую вы будете использовать в этом упражнении, использует
только что описанная разница в кислотности и растворимости.
- (а) вы растворите свое неизвестное в этилацетате (органический растворитель). Все возможные соединения растворимы в этиловом эфире. ацетат.
- (b) вы экстрагируете бикарбонатом натрия, чтобы удалить все карбоновая кислота, которая присутствует.
- (c) вы экстрагируете гидроксидом натрия, чтобы удалить все фенол, который присутствует.
- (d) вы подкисите оба полученных водных раствора до вызвать выпадение в осадок любых экстрагированных соединений.
Процедура экстракции:
Общие примечания: Для измерения малых объемов, требуемых в этой процедуре их удобно измерять в мерный цилиндр градуированный. Убедитесь, что вы пометили все, чтобы вы могли определить, какой слой вы кладете в каждую колбу правильно — промаркируйте одну колбу Эрленмейера на 125 мл «бикарбонат», второй как «гидроксид» и 50 мл Колба Эрленмейера «этилацетат». Мы используем этил ацетат в этой лаборатории, поэтому избегайте чрезмерного воздействия. Будь уверен, что ты ознакомьтесь с приведенной ниже процедурой перед запуском лаборатории.
- Собрать неизвестное и записать неизвестный номер. Без это число, мы не сможем оценить ваш отчет.Этикетка три Эрленмейера колбу, как указано выше.
- Растворите примерно 1,0 г неизвестной смеси в 10 мл. этилацетата.
- Налейте раствор в чистую делительную воронку и добавьте 10 мл 10% водного раствора бикарбоната натрия, найденного на вашей скамейке.
- Закройте воронку и переверните ее. Медленно откройте кран, чтобы сбросьте любое накопившееся давление, затем закройте запорный кран ( Рисунок 4 ).
- Осторожно встряхните делительную воронку для тщательного перемешивания. растворов и эффект экстракции соединения из органическая смесь.( Осторожно: При встряхивании смесь может развивать давление; не забудьте периодически его продувать).
- Зажмите делительную воронку на стойке реторты и дайте смесь разделить на два слоя ( Рисунок 5, ).
- Снимите пробку и соберите водный слой (нижний слой) в колбе Эрленмейера на 125 мл с надписью «бикарбонат».
- Повторите шаги 3-7 еще два раза, сливая каждую порцию. последовательно в ту же колбу.В конце этой последовательности вы будет экстрагировать органический раствор тремя 10 мл порции 10% водного раствора бикарбоната натрия.
- Отложите колбу Эрленмейера с надписью «бикарбонат» в сторону. надежное место. Позже вы выделите любое соединение, которое было извлекается бикарбонатом. Вы помните, какой функционал группа что бы?
- Добавьте 10 мл 5% водного NaOH в делительную воронку с оставшийся этилацетат.
- Закройте воронку и переверните ее. Медленно откройте кран, чтобы Сбросьте накопившееся давление, затем закройте запорный кран.
- Осторожно встряхните делительную воронку для тщательного перемешивания. растворов и эффект экстракции соединения из органическая смесь.
- Зажмите делительную воронку на стойке реторты и дайте смесь разделить на два слоя.
- Снимите пробку и соберите водный слой в 125 Колбу Эрленмейера мл с надписью «гидроксид».
- Повторите шаги 10-14 еще два раза, сливая каждую порцию. последовательно в ту же колбу. В конце этой последовательности вы будет экстрагировать органический раствор тремя 10 мл порции 5% водного гидроксида натрия.
- Отложите колбу Эрленмейера с надписью «гидроксид» в сторону в сейфе. место. Позже вы выделите любое соединение, которое было извлечено гидроксид. Вы помните, какая функциональная группа быть?
Остальные шаги, описанные в этом разделе, позволят необходимо выделить любое соединение, оставшееся в этилацетатном слое.Напомним, это будет нейтральное соединение, если оно у вас есть.
- Добавить 5 мл насыщенного водного NaCl и 5 мл дистиллированной H 2 O к этилацетатному слою в делительной воронке.
- Отделить и отложить нижний водный слой.
- Перелейте органический слой в колбу Эрленмейера на 50 мл и высушите. с безводным Na 2 SO4.
- Отфильтровать высушенный органический раствор в сухую предварительно взвешенную 50 в круглодонной колбе и удалите этилацетат на роторной колбе. испаритель.Если твердое вещество остается после испарения этил ацетат, это нейтральное вещество, и вы определите его вес и температура плавления.
Следуют инструкции по выделению карбоновой кислоты и / или фенол из водных слоев, помещаемых в колбы Эрленмейера обозначены как «бикарбонат» и «гидроксид» соответственно.
- Возьмите колбу Эрленмейера с надписью «бикарбонат» и осторожно подкисляют водный раствор по каплям добавление 6М HCl.( ВНИМАНИЕ: Раствор бикарбоната будет
при нейтрализации HCl сильно выделяет углекислый газ —
то есть будет много пузырей). Убедитесь, что решение
кислая с голубой лакмусовой бумажкой.
- Если выпадает твердый осадок, добавить кипящий камень, а затем осторожно нагрейте раствор, чтобы вернуть в раствор большую часть твердого вещества. Медленно охладите до комнатной температуры, а затем используйте ледяную / водяную баню для завершить осадки.Если твердых осадков не выпадает, ваш unknown не содержит карбоновой кислоты. В этом случае пропустите шаги 3-4.
- Когда раствор остынет, выделите твердый осадок. путем всасывающей фильтрации.
- Отфильтровать, промыть твердое вещество ледяной водой и определить диапазон веса и температуры плавления карбонового кислота.
Теперь мы будем следовать той же процедуре, чтобы изолировать фенол от колба Эрленмейера с надписью «гидроксид».
- Возьмите колбу Эрленмейера с надписью «гидроксид» и осторожно подкисляют водный раствор в центрифужная пробирка по каплям добавление 6М HCl. ( ВНИМАНИЕ: Гидроксид раствор станет горячим при нейтрализации HCl). Проверить на Убедитесь, что раствор кислый, с помощью голубой лакмусовой бумаги.
- Если выпадает твердый осадок, добавить кипящий камень, а затем осторожно нагрейте раствор, чтобы вернуть в раствор большую часть твердого вещества.Медленно охладите в комнату температуры, а затем используйте баню лед / вода для завершения осаждения. Если нет твердого осадки, ваше неизвестное не содержало фенола. В этом случае пропустите шаги 3-4.
- Когда раствор остынет, выделите твердый осадок. путем всасывающей фильтрации.
- Отфильтровать, промыть твердое вещество ледяной водой и определить диапазон веса и температуры плавления фенола на следующей неделе.
Указания по безопасности
Вы должны всегда носить защитные очки.В случае, если любой реагент, использованный в этом исследовании, вступает в контакт с вашим кожу или глаза, немедленно промойте пораженный участок большим количеством вода. Сообщите своему инструктору.
Избегайте чрезмерного воздействия всех органических растворителей.
Кислоты и щелочи могут вызвать сильные ожоги.
При этом в лаборатории не должно быть пламени. эксперимент.
Блок-схема кислотно-щелочной экстракции
ССЫЛКИ
Л.М. Харвуд и К. 1. Муди, Experimental Organic Химия — принципы и практика , Blackwell Scientific Публикации.
C.A. MacKenzie, Experimental Organic Chemistry , Прентис-Холл. 4-е издание
Дж. А. Мур и Д. Л. Далримпл, Experimental Methods in Organic Chemistry , Saunders Golden Sunburst Series, W. B. Компания Сондерс.
К. Ф. Уилкокс и М. Ф. Уилкокс, Experimental Organic Химия — маломасштабный подход , Прентис-Холл.2-й Версия.
О. Р. Родиг, К. Э. Белл-младший и А. К. Кларк, Organic лаборатория химии — стандартные и микроскопические эксперименты , Издательство колледжа Сондерс.
J.R. Mohrig, C.N. Хаммонд и П.Ф. Schatz, Техники в Органическая химия , Freeman Publishers, 2nd Edition.
Copyright © 2009-2014 Отделение химии UWI, Ямайка, все права защищены.
Создано и поддерживается профессором Робертом Дж.Ланкашир,Кафедра химии Вест-Индского университета,
Кампус Мона, Кингстон 7, Ямайка. Создан в октябре 2009 г. Ссылки проверены и / или последние изменен 30 октября 2014 г.
URL http://wwwchem.uwimona.edu.jm/lab_manuals/c1901exp8.html
— щелочно-кислотный основной или амфотерный
Это означает, что если мы приготовим раствор основного оксида и воды и окунем в него красную лакмусовую бумажку, он станет синим. Какое утверждение об оксиде углерода и оксиде алюминия является правильным? По мере продвижения вниз по группе кислотная природа оксидов уменьшается, а основная — увеличивается.CaO Basic. A: В данном вопросе мы должны уравновесить химическую реакцию термического разложения твердого бис … Q: Используйте интерактив, чтобы наблюдать за изменением температуры, которое возникает в результате сжигания различных видов топлива в b … A: Вопросы, связанные с интерпретацией : Магнитное квантовое число указывает; Квасцы при крашении одежды используются как; Когда два атома хлора соединяются с образованием одной молекулы газообразного хлора; 100 мл HCl + 35 мл… спросил 28 января 2020 г. в химии от AmanYadav (55,5 тыс. Баллов) jee main 2020; 0 голосов.Предскажите, является ли каждый из следующих оксидов кислотным, основным, амфотерным или нейтральным: CO2, NO2, Al2O3, CaO. В прошлые века многие люди верили в статичную Вселенную, которая существовала вечно, мало меняясь, и которая будет существовать вечно, более или менее, как сегодня. Предскажите, является ли каждый из следующих оксидов кислотным, основным, амфотерным или нейтральным: (a) NO2, (b) CO2, (c) Al2O3, (d) CaO. Основные оксиды — это те, которые образуют основание при реакции с водой и в основном состоят из металлов, таких как Na2O, CaO, BaO. Нейтральные оксиды не образуют солей при взаимодействии с кислотой или основаниями.Таким образом, для группы V оксиды имеют кислотность NO 2 (кислая), P 2 O 3 (кислая), As 2 O 3 (амфотерная). Эти пи-связи скручены. Основность имеет тенденцию увеличиваться вниз по периодической группе. Амфотерный раствор — это вещество, которое может химически реагировать как кислота или основание. Однако эта тенденция применима только к оксидам отдельных элементов в наивысших степенях окисления этих элементов. Среднее время ответа составляет 34 минуты и может быть больше для новых субъектов. View Notes — Лекция 14 Глава 20 из SO 3 в Калифорнийском университете в Сан-Диего.3 и 6 должны быть амфотерными. Амфотерная кислота Al 2 O 3 (в первую очередь) B. Амфотерное вещество может действовать и как кислота, и как основание. Амфотерные оксиды могут реагировать как с кислотами, так и с щелочами с образованием солей и воды. Оксиды металлоидов (наполовину металлические и наполовину неметаллические) должны быть амфотерными — могут быть кислотными или щелочными в зависимости от pH раствора. Спирты — это органические соединения, которые … В: Рассчитайте объем в миллилитрах 6,4 М раствора нитрата серебра, который содержит 375 ммоль сил… A: Дано: металлы образуют основные оксиды (CaO). Неметаллы образуют кислые оксиды (SO3). Металлоиды образуют амфотерные оксиды (As2O3). Они расположены на диагональной линии между металлами и неметаллами. Оксиды активных металлов (элементы 1 и 2 группы) — основные, неметаллические оксиды — кислые. Ответ: (а) Сильно основной Объяснение: Гидроксид цезия или гидроксид цезия (CsOH) — это химическое соединение, состоящее из ионов цезия и гидроксид-ионов. Например, к основным оксидам относятся следующие: K 2 O (оксид калия), CaO (оксид кальция A) элемент B) смесь C) молекула D) ионное соединение.Основные оксиды. Когда вещество вступает в химическую реакцию в форме основания или кислоты, оно называется амфотерным раствором. Оксиды неметаллов. Соединения этого типа проявляют в основном ковалентные связи и обычно существуют в виде газов. Основываясь на их кислотно-основных характеристиках, оксиды классифицируются как кислотные, основные, амфотерные или нейтральные: Предскажите, будет ли каждый из следующих оксидов кислотным, основным, амфотерным или нейтральным: (a) NO2, (b) CO2, (c) Al2O3 , (г) CaO. Что это в милях / час? Основное различие — амфипротический и амфотерный.A: Молярность: количество молей растворенного вещества, присутствующего в данном растворе. JEE Main 2020: Кислотные, основные и амфотерные оксиды соответственно: (A) Cl2O, CaO, P4O10 (B) N2O3, Li2O, Al2O3 (C) Na2O, SO3, Al2O3 (D) M b) Кислотный оксид — CO2 , CO, SO2 и N2O: Основной оксид — Na2O, MgO; Нейтральный оксид — h3O. образуют кислые растворы. Оксиды металлоидов (наполовину металлические и наполовину неметаллические) должны быть амфотерными — могут быть кислотными или щелочными в зависимости от pH раствора. В: Сколько миллилитров 0.Для нейтрализации 14,2 мл 0,141 М h4PO4 требуется 105 M NaOH. Оксиды неметаллов. Соединения этого типа проявляют в основном ковалентные связи и обычно существуют в виде газов. Основной оксид — это оксид, который в сочетании с водой дает основу. Al 2 O 3 амфотерный. Амфотерные оксиды проявляют как кислотные, так и основные свойства. h3O (l) ⇌H + (водн.) + OH- (водн.) CaO, BaO и Na2O — основные оксиды металлов N2O3 — неметаллический кислый оксид h3O + N2O3 → 2 HNO2 (азотистая кислота) N2O3 определенно неметаллический оксид.Оксид, образующий основание в воде, известен как основной оксид. CaO является основным соединением … а именно, он будет реагировать с кислотами или соединениями, способными отдавать протон … это означает, например, вода- CaO + h3O-Ca (OH) 2 В этой реакции основное соединение реагирует с амфотерным веществом-водой … так что нет, это основное. Одна из причин, по которой спектроскописты изучают возбужденные состояния, состоит в том, чтобы получить информацию об энергиях орбиталей, которые не заняты в основном состоянии атома. K2O 2NaOH K2O + h3O — — -> KOH MgO + h3O — — -> Mg (OH) 2 CaO + h3O — — -> Ca (OH) 2 SO2 + h3O ⇄ h3SO3 SO3 + h3O — — -> h3SO4.образуют кислые растворы. Нейтральный оксид — это оксид, который не имеет ни кислотных, ни основных характеристик. Опишите pH следующих солей? Определите набор оксидов, которые состоят из кислотного, основного, нейтрального и амфотерного оксида соответственно a. SO3, CaO, h3O, Al3O3 b.

 Ответ правильный
и полный – 3 балла. Правильно записаны
2 элемента ответа – 2 балла. Правильно
записан один элемент – 1 балл. Все
элементы ответа записаны неверно –
0 баллов.
Ответ правильный
и полный – 3 балла. Правильно записаны
2 элемента ответа – 2 балла. Правильно
записан один элемент – 1 балл. Все
элементы ответа записаны неверно –
0 баллов.
 Получившуюся последовательность цифр
запишите в строку ответа.
Получившуюся последовательность цифр
запишите в строку ответа.
 Получившуюся последовательность цифр
запишите в строку ответа.
Получившуюся последовательность цифр
запишите в строку ответа.
Leave A Comment