|
Решение: Если электроотрицательность атомов различная, то электронная пара смещается в сторону более электроотрицательного атома. В этом случае центры (+) и (-) зарядов не совпадают, и возникает система (электрический диполь) из двух равных по величине, но противоположных по знаку зарядов (d+ и d-), расстояние между которыми (l) называют длиной диполя. Подобные ковалентные связи называют полярными. Степень полярности такой связи оценивается значением электрического момента диполя- m, равного произведению эффективного заряда на длину диполя Наконец, если разница электроотрицательностей (Dc) превышает 1,9, то образуется ионная связь – предельный случай ковалентной полярной связи. 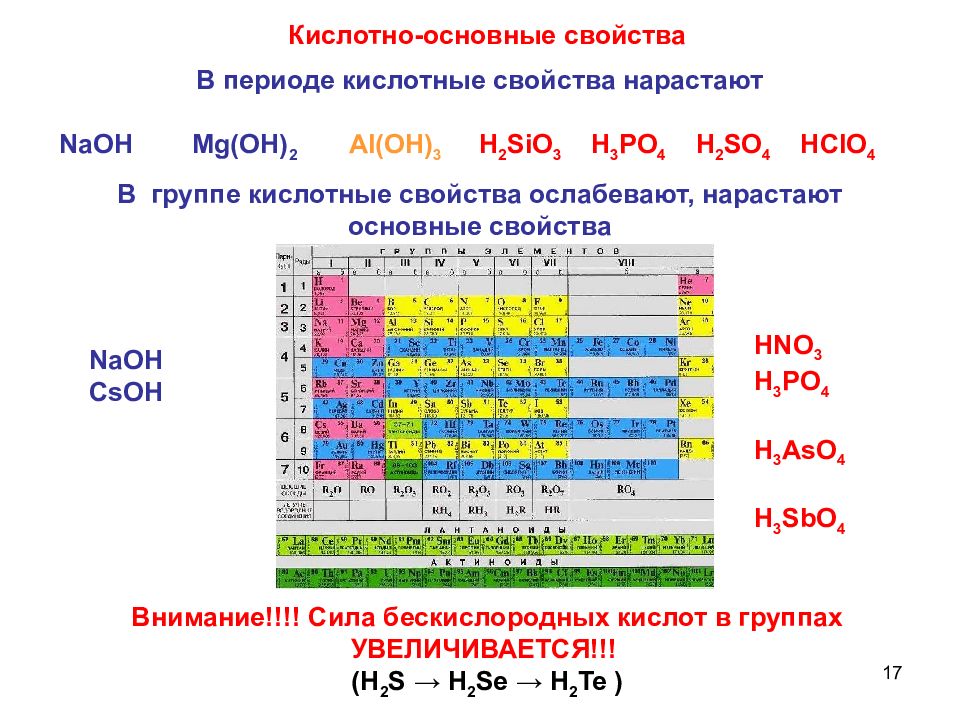 Её можно рассматривать как электростатическое притяжение, возникающее между разноименно заряженными ионами. Её можно рассматривать как электростатическое притяжение, возникающее между разноименно заряженными ионами.Ионная связь, в отличие от ковалентной, является ненаправленной, ненасыщенной, а координационные числа в ионных соединениях определяются соотношением радиусов взаимодействующих ионов (Dc) Мg О =3,44 -1,31 =2,13 — связь ионная (Dc) Аl2 О3 =3,44 – 1,61 =1,83 связь ковалентная полярная (Dc) SiО2 = 3,44-1,90 = 1,54 связь ковалентная полярная (Dc) Р2О5 = 3,44 -2,19 =1,25 связь ковалентная полярная (Dc)SОх = 3,44 -2,58 =0,86 связь ковалентная полярная (Dc)СlхОх = 3,44 -3,16 = 0,28 связь ковалентная неполярная ((Dc)<0,4)
|
Высший оксид — элемент — Большая Энциклопедия Нефти и Газа, статья, страница 1
Высший оксид — элемент
Cтраница 1
Высший оксид элемента, который с водородом образует соединение Н2Э, содержит 60 % кислорода. [1]
Высший оксид элемента, который с водоро дом образует соединение Н2Э, содержит 38 3 % кислорода. [2]
Высший оксид элемента побочной подгруппы имеет состав Э03 и содержит 0 33 массовых долей кислорода. [3]
Как изменяются кислотные свойства высших оксидов элементов главной подгруппы IV группы с увеличением порядковых номеров. [4]
Как изменяются кислотные свойства высших оксидов элементов главной подгруппы IV группы
Проследите, как меняются свойства высших оксидов элементов III периода. Какие соединения образуются при их взаимодействии с водой. [7]
Объясните, как и почему изменяется характер связи с кислородом в высших оксидах элементов третьего периода. [8]
[8]
Зная, что в начале периода располагаются типичные металлы, можно предсказать, что высшие оксиды элементов главных подгрупп I
Как изменяются кислотные свойства высших оксидов элементов главной подгруппы IV группы с увеличением порядковых номеров. [10]
Важное практическое значение имеет реакция горения веществ в атмосфере. При горении вещества взаимодействуют с кислородом, в процессе чего выделяется большое количество энергии в виде теплоты и света и образуются
Температура сушки и прокалки агломерированных флюсов находится в пределах 400 — 950 С. С повышением температуры прокалки улучшаются технологические свойства большинства керамических флюсов и резко снижается их гигроскопичность. Однако повышение температуры прокалки ограничено возможностью протекания в флюсе в процессе термообработки нежелательных реакций окисления легирующих компонентов, разложения карбонатов и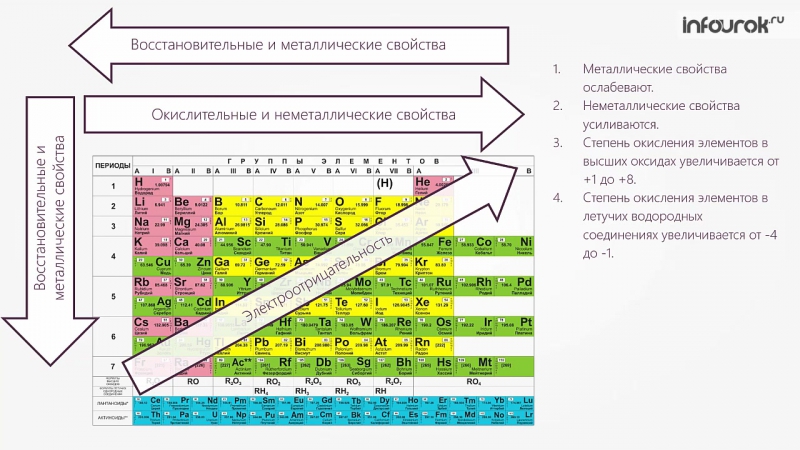 [13]
[13]
Страницы: 1
Тест на периодические зависимости свойств элементов и их соединений.
Задание №1
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания заряда ядра атома
- 1. K
- 2. Fe
- 3. Zn
- 4. Li
- 5. Na
Задание №2
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке увеличения числа электронных слоев в атоме
- 1. He
- 2. Ca
- 3. Sr
- 4. Cu
- 5. Be
Задание №3
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке убывания числа электронов на внешнем энергетическом уровне
- 1. As
- 2. B
- 3. P
- 4. Ne
- 5. Li
Задание №4
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания атомного радиуса
- 1. Cs
- 2. Ba
- 3. I
- 4. Na
- 5. K
Задание №5
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке убывания восстановительных свойств соответствующих простых веществ
- 1. F
- 2. O
- 3. N
- 4. I
- 5. Br
Задание №6
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания окислительных свойств соответствующих простых веществ
- 1. Ga
- 2. Se
- 3. Ba
- 4. I
- 5. Br
Задание №7
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения высшей степени окисления, проявляемой ими в соединениях
- 1.
 Mg
Mg - 2. S
- 3. Si
- 4. C
- 5. He
Задание №8
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке увеличения валентности, проявляемой ими в водородных соединениях
- 1. Kr
- 2. S
- 3. Ge
- 4. Si
- 5. Cl
Задание №9
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления металлических свойств
- 1. O
- 2. N
- 3. Te
- 4. B
- 5. Se
Задание №10
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке ослабления неметаллических свойств
- 1. С
- 2. Al
- 3. Sn
- 4. Si
- 5. Mg
Задание №11
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке усиления кислотных свойств высших оксидов
- 1. B
- 2. Be
- 3. N
- 4. Mg
- 5. Si
Задание №12
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке ослабления кислотных свойств образованных ими водородных соединений
- 1. I
- 2. Mn
- 3. F
- 4. Cl
- 5. Se
Задание №13
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения заряда ядра атома
- 1. Al
- 2. Ga
- 3. Mg
- 4. Si
- 5. B
Задание №14
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения числа электронных слоев в атоме
- 1. N
- 2. Sb
- 3. O
- 4.
 Te
Te - 5. Bi
Задание №15
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания числа электронов на внешнем энергетическом уровне
- 1. Ge
- 2. C
- 3. B
- 4. N
- 5. Pb
Задание №16
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке убывания атомного радиуса
- 1. K
- 2. Ag
- 3. Li
- 4. Au
- 5. Cs
Задание №17
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания восстановительных свойств соответствующих простых веществ
- 1. F
- 2. Mo
- 3. W
- 4. Cl
- 5. Br
Задание №18
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке убывания окислительных свойств соответствующих простых веществ
- 1. As
- 2. N
- 3. P
- 4. V
- 5. Mn
Задание №19
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания высшей степени окисления, проявляемой ими в соединениях
- 1. Al
- 2. Na
- 3. K
- 4. Cl
- 5. F
Задание №20
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения валентности, проявляемой ими в водородных соединениях
РешениеЗадание №21
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке ослабления металлических свойств
- 1. B
- 2. In
- 3. N
- 4. Be
- 5. Tl
Задание №22
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления неметаллических свойств
- 1.
 Mg
Mg - 2. F
- 3. Br
- 4. Se
- 5. I
Задание №23
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения кислотных свойств высших оксидов
- 1. P
- 2. Mn
- 3. Cl
- 4. N
- 5. S
Задание №24
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления кислотных свойств образованных ими водородных соединений
- 1. Te
- 2. Cr
- 3. W
- 4. O
- 5. S
Задание №25
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания заряда ядра атома
- 1. Al
- 2. Ar
- 3. B
- 4. Cl
- 5. Zn
Задание №26
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке увеличения числа электронных слоев в атоме
- 1. F
- 2. Br
- 3. Cl
- 4. N
- 5. O
Задание №27
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке убывания числа электронов на внешнем энергетическом уровне
- 1. Br
- 2. Kr
- 3. K
- 4. Cl
- 5. C
Задание №28
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания атомного радиуса
- 1. Be
- 2. F
- 3. S
- 4. P
- 5. O
Задание №29
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке убывания восстановительных свойств соответствующих простых веществ
- 1. As
- 2. Br
- 3. P
- 4. Ca
- 5. Cs
Задание №30
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания окислительных свойств соответствующих простых веществ
- 1.
 Pb
Pb - 2. Bi
- 3. N
- 4. C
- 5. Si
Задание №31
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке убывания высшей степени окисления, проявляемой ими в соединениях
- 1. K
- 2. Ca
- 3. Na
- 4. Si
- 5. P
Задание №32
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке увеличения валентности, проявляемой ими в водородных соединениях
РешениеЗадание №33
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке усиления металлических свойств
- 1. S
- 2. Al
- 3. Se
- 4. Te
- 5. Mg
Задание №34
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке ослабления неметаллических свойств
- 1. K
- 2. Li
- 3. Ca
- 4. Se
- 5. S
Задание №35
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления кислотных свойств высших оксидов
- 1. Bi
- 2. H
- 3. He
- 4. N
- 5. P
Задание №36
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке ослабления кислотных свойств образованных ими водородных соединений
- 1. O
- 2. Na
- 3. N
- 4. S
- 5. C
Задание №37
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения заряда ядра атома
- 1. Fe
- 2. K
- 3. Zn
- 4. Li
- 5. Na
Задание №38
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения числа электронных слоев в атоме
- 1.
 He
He - 2. Ca
- 3. Cu
- 4. Sr
- 5. Be
Задание №39
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке увеличения числа электронов на внешнем энергетическом уровне
- 1. As
- 2. B
- 3. Ne
- 4. P
- 5. Li
Задание №40
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения атомного радиуса
- 1. Cs
- 2. Ba
- 3. I
- 4. K
- 5. Na
Задание №41
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания восстановительных свойств соответствующих простых веществ
- 1. Br
- 2. O
- 3. N
- 4. I
- 5. F
Задание №42
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения окислительных свойств соответствующих простых веществ
- 1. I
- 2. Se
- 3. Ba
- 4. Ga
- 5. Br
Задание №43
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания высшей степени окисления, проявляемой ими в соединениях
- 1. Mg
- 2. S
- 3. He
- 4. C
- 5. Si
Задание №44
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения валентности, проявляемой ими в водородных соединениях
- 1. Ag
- 2. Cl
- 3. Ge
- 4. Si
- 5. S
Задание №45
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке ослабления металлических свойств
- 1.
 B
B - 2. N
- 3. Te
- 4. O
- 5. Se
Задание №46
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления неметаллических свойств
- 1. С
- 2. Mg
- 3. Sn
- 4. Si
- 5. Al
Задание №47
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения кислотных свойств высших оксидов
- 1. B
- 2. Be
- 3. Si
- 4. Mg
- 5. N
Задание №48
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления кислотных свойств образованных ими водородных соединений
- 1. Se
- 2. Mn
- 3. F
- 4. Cl
- 5. I
Задание №49
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения заряда ядра атома
- 1. Al
- 2. Ga
- 3. B
- 4. Si
- 5. Mg
Задание №50
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания числа электронных слоев в атоме
- 1. N
- 2. Bi
- 3. O
- 4. Te
- 5. Sb
Задание №51
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания числа электронов на внешнем энергетическом уровне
- 1. C
- 2. Ge
- 3. B
- 4. N
- 5. Pb
Задание №52
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания атомного радиуса
- 1. K
- 2. Ag
- 3. Rb
- 4. Au
- 5. Cs
Задание №53
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения восстановительных свойств соответствующих простых веществ
- 1.
 F
F - 2. W
- 3. Mo
- 4. Cl
- 5. Br
Задание №54
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления окислительных свойств соответствующих простых веществ
- 1. N
- 2. As
- 3. V
- 4. P
- 5. Fe
Задание №55
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения высшей степени окисления, проявляемой ими в соединениях
- 1. Al
- 2. K
- 3. Na
- 4. F
- 5. Cl
Задание №56
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания валентности, проявляемой ими в водородных соединениях
- 1. N
- 2. F
- 3. C
- 4. P
- 5. Cs
Задание №57
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке усиления металлических свойств
- 1. B
- 2. In
- 3. N
- 4. Be
- 5. Tl
Задание №58
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке ослабления неметаллических свойств
- 1. Mg
- 2. I
- 3. Br
- 4. Se
- 5. Cl
Задание №59
Выберите три элемента-неметалла, находящихся в одном периоде Периодической системы, и расположите их в порядке усиления кислотных свойств высших гидроксидов
- 1. Si
- 2. Mn
- 3. Cl
- 4. S
- 5. N
Задание №60
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке ослабления кислотных свойств образованных ими водородных соединений
- 1. Te
- 2.
 Cr
Cr - 3. Mo
- 4. Se
- 5. S
Задание №61
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания заряда ядра атома
- 1. Cs
- 2. Cu
- 3. Zn
- 4. K
- 5. Na
Задание №62
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке увеличения числа электронных слоев в атоме
- 1. Ne
- 2. Ca
- 3. Sr
- 4. Ag
- 5. Be
Задание №63
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке убывания числа электронов на внешнем энергетическом уровне
- 1. Sb
- 2. B
- 3. P
- 4. Ne
- 5. Be
Задание №64
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания атомного радиуса
- 1. Cs
- 2. Ba
- 3. F
- 4. Rb
- 5. K
Задание №65
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке убывания восстановительных свойств соответствующих простых веществ
- 1. Cl
- 2. P
- 3. N
- 4. F
- 5. Br
Задание №66
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания окислительных свойств соответствующих простых веществ
- 1. Ca
- 2. Se
- 3. Ba
- 4. I
- 5. Br
Задание №67
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке убывания высшей степени окисления, проявляемой ими в соединениях
- 1. Na
- 2. S
- 3.
 Si
Si - 4. Sn
- 5. He
Задание №68
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке увеличения валентности, проявляемой ими в водородных соединениях
- 1. Li
- 2. S
- 3. Ge
- 4. Si
- 5. Cl
Задание №69
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления металлических свойств
- 1. S
- 2. Mn
- 3. Te
- 4. B
- 5. Se
Задание №70
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке ослабления неметаллических свойств
- 1. Pb
- 2. Bi
- 3. Sn
- 4. Si
- 5. Mg
Задание №71
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке усиления кислотных свойств высших гидроксидов
- 1. Li
- 2. Be
- 3. N
- 4. Mg
- 5. Si
Задание №72
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке ослабления кислотных свойств образованных ими водородных соединений
- 1. Br
- 2. Mg
- 3. F
- 4. Cl
- 5. Se
Задание №73
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения заряда ядра атома
- 1. Tl
- 2. Ga
- 3. Mo
- 4. Si
- 5. B
Задание №74
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения числа электронных слоев в атоме
- 1. P
- 2. Sb
- 3. Si
- 4. Te
- 5.
 Bi
Bi
Задание №75
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания числа электронов на внешнем энергетическом уровне
- 1. Sn
- 2. C
- 3. Be
- 4. N
- 5. Pb
Задание №76
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения атомного радиуса
- 1. Rb
- 2. Ag
- 3. Li
- 4. Cu
- 5. Cs
Задание №77
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания восстановительных свойств соответствующих простых веществ
- 1. I
- 2. Na
- 3. W
- 4. Cl
- 5. Br
Задание №78
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке убывания окислительных свойств соответствующих простых веществ
- 1. As
- 2. Sb
- 3. P
- 4. Cu
- 5. Mg
Задание №79
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания высшей степени окисления, проявляемой ими в соединениях
- 1. Mg
- 2. Na
- 3. K
- 4. Cl
- 5. Ne
Задание №80
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения валентности, проявляемой ими в водородных соединениях
РешениеЗадание №81
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке ослабления металлических свойств
- 1. Al
- 2. In
- 3. As
- 4. Be
- 5. Tl
Задание №82
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления неметаллических свойств
- 1.
 Mn
Mn - 2. Cl
- 3. Br
- 4. Se
- 5. I
Задание №83
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения кислотных свойств высших оксидов
- 1. Si
- 2. Ag
- 3. Cl
- 4. F
- 5. S
Задание №84
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления кислотных свойств образованных ими водородных соединений
- 1. Se
- 2. Br
- 3. As
- 4. O
- 5. S
Задание №85
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания заряда ядра атома
- 1. Mg
- 2. Ar
- 3. Be
- 4. Cl
- 5. Zn
Задание №86
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке увеличения числа электронных слоев в атоме
- 1. I
- 2. Br
- 3. Cl
- 4. N
- 5. O
Задание №87
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке убывания числа электронов на внешнем энергетическом уровне
- 1. Se
- 2. Kr
- 3. K
- 4. Na
- 5. Cd
Задание №88
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания атомного радиуса
- 1. Li
- 2. F
- 3. S
- 4. Al
- 5. O
Задание №89
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке убывания восстановительных свойств соответствующих простых веществ
- 1. As
- 2. Br
- 3. Sb
- 4. Ca
- 5. Na
Задание №90
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания окислительных свойств соответствующих простых веществ
- 1.
 Sn
Sn - 2. B
- 3. N
- 4. C
- 5. Si
Задание №91
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке убывания высшей степени окисления, проявляемой ими в соединениях
- 1. Fe
- 2. Ca
- 3. Na
- 4. Al
- 5. P
Задание №92
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке увеличения валентности, проявляемой ими в водородных соединениях
- 1. N
- 2. Si
- 3. S
- 4. Be
- 5. P
Задание №93
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке усиления металлических свойств
- 1. S
- 2. P
- 3. Se
- 4. Te
- 5. Na
Задание №94
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке ослабления неметаллических свойств
- 1. As
- 2. Li
- 3. Ca
- 4. Se
- 5. S
Задание №95
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления кислотных свойств высших оксидов
- 1. Sb
- 2. He
- 3. Ne
- 4. N
- 5. P
Задание №96
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке ослабления кислотных свойств образованных ими водородных соединений
- 1. O
- 2. Mg
- 3. N
- 4. Se
- 5. C
Задание №97
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения заряда ядра атома
- 1. F
- 2. Cs
- 3. Zn
- 4. Li
- 5. Na
Задание №98
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения числа электронных слоев в атоме
- 1.
 Ne
Ne - 2. Ca
- 3. Cd
- 4. Sr
- 5. Ba
Задание №99
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке увеличения числа электронов на внешнем энергетическом уровне
- 1. Ar
- 2. Be
- 3. Ne
- 4. P
- 5. Li
Задание №100
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения атомного радиуса
- 1. Rb
- 2. Be
- 3. I
- 4. K
- 5. Na
Задание №101
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления восстановительных свойств соответствующих простых веществ
- 1. Cl
- 2. O
- 3. P
- 4. I
- 5. F
Задание №102
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения окислительных свойств соответствующих простых веществ
- 1. F
- 2. Se
- 3. Be
- 4. Ga
- 5. Br
Задание №103
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания высшей степени окисления, проявляемой ими в соединениях
- 1. Na
- 2. S
- 3. Rb
- 4. C
- 5. Si
Задание №104
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения валентности, проявляемой ими в водородных соединениях
- 1. Br
- 2. Cl
- 3. Ge
- 4. Si
- 5. S
Задание №105
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке ослабления металлических свойств
- 1.
 Ba
Ba - 2. Na
- 3. Te
- 4. O
- 5. Se
Задание №106
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления неметаллических свойств
- 1. Ge
- 2. Mn
- 3. Sn
- 4. Si
- 5. Al
Задание №107
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения кислотных свойств высших оксидов
- 1. B
- 2. Be
- 3. Si
- 4. Mg
- 5. Li
Задание №108
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления кислотных свойств образованных ими водородных соединений
- 1. S
- 2. Mg
- 3. F
- 4. Cl
- 5. I
Задание №109
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения заряда ядра атома
- 1. Ar
- 2. Ge
- 3. B
- 4. Si
- 5. Mg
Задание №110
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания числа электронных слоев в атоме
- 1. P
- 2. Bi
- 3. S
- 4. Te
- 5. Sb
Задание №111
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания числа электронов на внешнем энергетическом уровне
- 1. Ne
- 2. Ga
- 3. B
- 4. N
- 5. Pb
Задание №112
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке возрастания атомного радиуса
- 1. Na
- 2. Ag
- 3. K
- 4. Au
- 5.
 Cs
Cs
Задание №113
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке уменьшения восстановительных свойств соответствующих простых веществ
- 1. I
- 2. Fe
- 3. Mo
- 4. Cl
- 5. Br
Задание №114
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке усиления окислительных свойств соответствующих простых веществ
- 1. Bi
- 2. As
- 3. Cr
- 4. P
- 5. Fe
Задание №115
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке уменьшения высшей степени окисления, проявляемой ими в соединениях
- 1. Mg
- 2. K
- 3. Na
- 4. F
- 5. Cl
Задание №116
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке возрастания валентности, проявляемой ими в водородных соединениях
- 1. N
- 2. O
- 3. C
- 4. S
- 5. Cs
Задание №117
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке усиления металлических свойств
- 1. Li
- 2. In
- 3. N
- 4. Be
- 5. Ti
Задание №118
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке ослабления неметаллических свойств
- 1. Mn
- 2. F
- 3. Br
- 4. Se
- 5. Cl
Задание №119
Выберите три элемента, находящихся в одном периоде Периодической системы, и расположите их в порядке усиления кислотных свойств высших оксидов
- 1. P
- 2. Mo
- 3. Cl
- 4. S
- 5. N
Задание №120
Выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы, и расположите их в порядке ослабления кислотных свойств образованных ими водородных соединений
- 1.
 N
N - 2. Cr
- 3. Mo
- 4. As
- 5. P
кислотное основание — диоксид кремния более кислый, чем оксиды азота?
Думаю, ваш вопрос сводится к:
Что означает кислотная сила оксидов? Как определить кислотную силу оксидов?
В общем, электроположительный характер центрального атома оксида определяет, является ли оксид кислотным или основным. Чем более электроположен центральный атом, тем щелочнее его оксид. Чем электроотрицательнее центральный атом, тем кислотнее его оксид.
Электроположительный символ уменьшается слева направо по периодической таблице и увеличивается вниз по группе. Тенденция кислотно-основного поведения — от сильноосновных оксидов слева к сильнокислым справа, через амфотерный оксид (например, оксид алюминия) в середине.
Эта тенденция применима только к оксидам отдельных элементов в наивысших степенях окисления этих элементов. Для других оксидов картина несколько менее ясна.
Кислотность оксида неметалла определяется как кислотные растворы, образующиеся в результате реакции (реакций) с водой. Например, триоксид серы реагирует с водой с образованием серной кислоты.
Обычно кислые оксиды — это оксиды неметаллов, а основные оксиды — это оксиды неметаллов.
Примечание: Есть три оксида неметаллов из верхней правой части таблицы Менделеева: $ \ ce {CO} $, $ \ ce {NO} $ и $ \ ce {N2O} $, которые имеют низкое значение (не максимально возможное) степени окисления для центрального атома, что дает нейтральные водные растворы.
Поскольку кислотность катиона быстро повышается с зарядом, элементы d-блока, которые проявляют большое разнообразие степеней окисления, могут иметь один или несколько оксидов, которые проявляют только основные свойства, и один или несколько оксидов, которые проявляют только кислотные свойства.
В целом, чем выше степень окисления, тем более кислый соответствующий оксид (аналогично, обратная тенденция для основных свойств оксидов). Хром является здесь достойным примером, так как он проявляет множество степеней окисления.2 -} $ ионов.
Хром является здесь достойным примером, так как он проявляет множество степеней окисления.2 -} $ ионов.
Эти два соединения могут реагировать с образованием $ \ ce {CaSiO3} $.
Кислотно-основные свойства оксидов | Химия [Магистр]
Основные и амфотерные гидроксиды
Некоторые гидроксиды металлов являются амфотерными или способны действовать как кислота или основание.
Задачи обучения
Укажите условия, при которых амфотерные гидроксиды действуют как кислоты.
Ключевые выводы
Ключевые моменты
- Амфотерные молекулы могут действовать как кислоты или основания.
- Гидроксиды с сильно заряженными катионами металлов часто являются амфотерными.
- Амфотерные гидроксиды действуют как основания Бренстеда-Лоури (принимающие протоны) или кислоты Льюиса (принимающие электронную пару), в зависимости от условий реакции.
Ключевые термины
- основание : акцептор протонов или донор электронной пары
- Кислота Льюиса
До сих пор в нашем обсуждении кислот и оснований гидроксиды всегда были синонимами оснований.Теперь мы рассмотрим амфотерные гидроксиды, то есть соли гидроксидов, которые могут действовать как кислота или основание, в зависимости от условий реакции. Начнем с известного случая, когда гидроксид действует как основание.
Реакция амфотерных гидроксидов в кислом растворе
Одним из наиболее распространенных и известных примеров амфотерного гидроксида является гидроксид алюминия, Al (OH) 3 . Из наших правил растворимости мы знаем, что Al (OH) 3 в значительной степени нерастворим в нейтральной воде; однако в сильнокислом растворе ситуация меняется.Например, рассмотрим реакцию Al (OH) 3 с HCl:
[латекс] \ text {HCl} (\ text {aq}) + \ text {Al} (\ text {OH}) _ 3 (\ text {aq}) \ rightarrow \ text {AlCl} _3 (\ text {aq }) + 3 \ text {H} _2 \ text {O} (\ text {l}) [/ latex]
Это классическая реакция кислотно-щелочной нейтрализации: HCl полностью протонирует все три гидроксида на моль Al (OH) 3 , давая чистую воду и соль AlCl 3 . Исходя из того, что мы знаем об основных свойствах гидроксидов до сих пор, это именно то, что мы ожидали — так как же гидроксид может действовать как кислота?
Исходя из того, что мы знаем об основных свойствах гидроксидов до сих пор, это именно то, что мы ожидали — так как же гидроксид может действовать как кислота?
Гидроксид алюминия : Гидроксид алюминия может действовать как основание Бренстеда-Лоури, принимая протоны из кислого раствора, или как кислота Льюиса, принимая электронную пару от гидроксид-ионов в основном растворе.- (\ text {aq}) [/ latex]
Здесь гидроксид алюминия захватывает ион гидроксида из раствора, тем самым действуя как кислота Льюиса. Как это возможно? Рассмотрим структуру Льюиса для Al (OH) 3.
Центральный атом алюминия электронодефицитный — он образует только три связи, и правило октета не выполняется; таким образом, Al 3+ вполне счастлив принять пару электронов и образовать еще одну связь при правильных условиях. В щелочном растворе он образует связь с ионом OH — , вытягивая его из раствора и понижая pH раствора.
Заключение
Гидроксиды металлов с сильно заряженным центральным атомом металла могут быть амфотерными. Помимо алюминия, такие металлы, как цинк, олово, свинец и бериллий, также могут образовывать амфотерные оксиды или гидроксиды. Ведут себя такие гидроксиды как кислоты или основания, зависит от pH окружающего раствора.
Оксиды углерода, кремния, германия, олова и свинца
Оксиды элементов в верхней части группы 4 являются кислыми, но кислотность оксидов падает по мере того, как вы спускаетесь по группе.Ближе к нижней части группы оксиды становятся более основными, хотя при этом полностью не теряют своих кислотных свойств.
Оксид, который может проявлять как кислотные, так и основные свойства, называется амфотерным .
Таким образом, наблюдается тенденция от кислых оксидов в верхней части группы к амфотерным в нижней части.
Оксиды углерода и кремния
Окись углерода
С монооксидом углерода обычно обращаются как с нейтральным оксидом, но на самом деле он очень и очень слабокислый.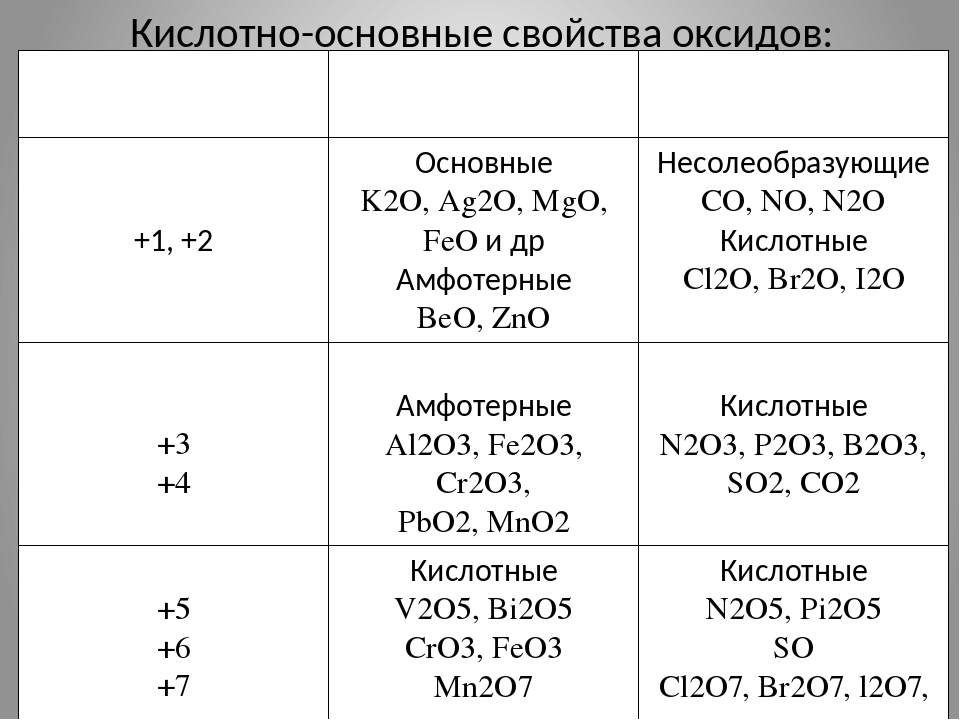 Он не реагирует с водой, но он будет реагировать с горячим концентрированным раствором гидроксида натрия с образованием раствора метаноата натрия.
Он не реагирует с водой, но он будет реагировать с горячим концентрированным раствором гидроксида натрия с образованием раствора метаноата натрия.
Тот факт, что окись углерода реагирует с основным гидроксид-ионом, показывает, что он должен быть кислым.
Диоксид углерода и кремния
Оба они слабокислые.
С водой
Диоксид кремния не реагирует с водой из-за сложности разрушения гигантской ковалентной структуры.
Двуокись углерода в некоторой степени реагирует с водой с образованием ионов водорода (строго говоря, ионов гидроксония) и ионов гидрокарбоната.
Всего эта реакция:
Раствор диоксида углерода в воде иногда называют угольной кислотой, но на самом деле только около 0,1% диоксида углерода фактически прореагировало. Положение равновесия находится намного левее.
С основанием
Двуокись углерода реагирует с раствором гидроксида натрия на холоде с образованием карбоната натрия или раствора гидрокарбоната натрия — в зависимости от соотношения реагирующих веществ.
Диоксид кремния также вступает в реакцию с раствором гидроксида натрия, но только если он горячий и концентрированный. Образуется раствор силиката натрия.
Вы также можете быть знакомы с одной из реакций, происходящих при извлечении железа в доменной печи — в которой оксид кальция (из известняка, который является одним из сырьевых материалов) реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция. Это также пример реакции кислого диоксида кремния с основанием.
Оксиды германия, олова и свинца
Окиси
Все эти оксиды амфотерные — они проявляют как основные, так и кислотные свойства.
Основная природа оксидов
Все эти оксиды реагируют с кислотами с образованием солей.
Например, все они реагируют с концентрированной соляной кислотой. Это можно резюмировать как:
Это можно резюмировать как:
.. . где X может быть Ge и Sn, но, к сожалению, требует небольшой модификации для свинца.
Хлорид свинца (II) практически нерастворим в воде, и вместо получения раствора он образует нерастворимый слой над оксидом свинца (II), если вы используете разбавленную соляную кислоту , что остановит реакцию.
Однако в этом примере мы говорим об использовании концентрированной соляной кислоты.
Большой избыток хлорид-ионов в концентрированной кислоте реагирует с хлоридом свинца (II) с образованием растворимых комплексов, таких как PbCl 4 2- .Эти ионные комплексы растворимы в воде, и проблема исчезает.
К сожалению, это означает, что вам нужно больше помнить!
Химия поверхности оксида церия (Журнальная статья)
Маллинс, Дэвид Р. Химия поверхности оксида церия . США: Н. П., 2015.
Интернет. DOI: 10.1016 / j.surfrep.2014.12.001.
Маллинз, Дэвид Р. Химия поверхности оксида церия . Соединенные Штаты. https://doi.org/10.1016/j.surfrep.2014.12.001
Маллинз, Дэвид Р. Чт.
«Химия поверхности оксида церия». Соединенные Штаты. https://doi.org/10.1016/j.surfrep.2014.12.001. https://www.osti.gov/servlets/purl/1185722.
@article {osti_1185722,
title = {Химия поверхности оксида церия},
author = {Маллинз, Дэвид Р.},
abstractNote = {В нашем обзоре рассмотрены структура и химические реакции на четко определенных поверхностях оксида церия. Церий или смешанные оксиды, содержащие оксид церия, являются критическими компонентами в автомобильных трехкомпонентных катализаторах из-за их хорошо известной способности накапливать кислород. Церий также становится важным материалом в ряде других каталитических процессов, особенно тех, которые включают органические оксигенаты и реакцию конверсии воды и газа. Кислотно-основные свойства церия и, следовательно, его каталитическое поведение тесно связаны со структурой его поверхности, где на структурных гранях с низким показателем преломления присутствуют различные окружения анионов кислорода и катионов церия.Фактическая структура этих различных лиц была предметом ряда теоретических и экспериментальных исследований. Церий также легко восстанавливается с CeO2 до CeO2-X. Присутствие кислородных вакансий на поверхности часто резко изменяет адсорбцию и последующие реакции различных адсорбатов либо на чистой поверхности, либо на металлических частицах, нанесенных на поверхность. Мы проводили поверхностные исследования на поверхности тонких пленок, а не на поверхности массивных монокристаллических оксидов.Также исследуются рост, характеристики и свойства этих тонких пленок.},
Церий также становится важным материалом в ряде других каталитических процессов, особенно тех, которые включают органические оксигенаты и реакцию конверсии воды и газа. Кислотно-основные свойства церия и, следовательно, его каталитическое поведение тесно связаны со структурой его поверхности, где на структурных гранях с низким показателем преломления присутствуют различные окружения анионов кислорода и катионов церия.Фактическая структура этих различных лиц была предметом ряда теоретических и экспериментальных исследований. Церий также легко восстанавливается с CeO2 до CeO2-X. Присутствие кислородных вакансий на поверхности часто резко изменяет адсорбцию и последующие реакции различных адсорбатов либо на чистой поверхности, либо на металлических частицах, нанесенных на поверхность. Мы проводили поверхностные исследования на поверхности тонких пленок, а не на поверхности массивных монокристаллических оксидов.Также исследуются рост, характеристики и свойства этих тонких пленок.},
doi = {10.1016 / j.surfrep.2014.12.001},
url = {https://www.osti.gov/biblio/1185722},
journal = {Surface Science Reports},
issn = {0167-5729},
число = 1,
объем = 70,
place = {United States},
год = {2015},
месяц = {1}
}
Какие факторы делают амфотерные оксиды способными реагировать как с кислотами, так и с щелочами?
Основные оксиды
Металлический характер увеличивается справа налево и сверху вниз в Периодической таблице.
Самые металлические элементы образуют самые основные оксиды.
Даже если оксиды нерастворимы в воде, мы все равно называем их основными оксидами, потому что они вступают в реакцию с кислотами.
# «MgO (s) + 2HCl (водн.) → MgCl» _2 «(водн.)» + «H» _2 «O» (l) «#
Кислые оксиды
Неметаллический символ увеличивается слева направо и снизу вверх в Периодической таблице.
Самые неметаллические элементы образуют наиболее кислые оксиды.
Они реагируют с водой с образованием оксокислот. Например,
# «SO» _2 «(вод.)» + «H» _2 «O (l)» → «H» _2 «SO» _3 «(вод.)» #
Даже если оксид нерастворим в воде, мы все равно относим его к кислому, если он реагирует с основаниями с образованием солей. Например,
# «TeO» _2 «(s)» + «2NaOH (вод.)» → «Na» _2 «TeO» _3 «(вод.)» + «H» _2 «O (l)» #
Амфотерные оксиды
Некоторые оксиды реагируют как с кислотами, так и с основаниями, то есть они амфотерные .»-» «(водн.)» #
Более легкие элементы групп 2 и 13, некоторые из # «d» # — блочных элементов и более тяжелые элементы групп 14 и 15 содержат амфотерные оксиды.
Самые основные оксиды находятся в нижнем левом углу Периодической таблицы, а самые кислые оксиды — в верхнем правом углу, поэтому неудивительно, что граница между кислотными и основными оксидами проходит по диагонали.
Амфотеризм и степени окисления
Амфотеризм зависит от степени окисления оксида.
Нет простого способа предсказать, какие элементы будут амфотерными.
Амфотерный характер оксида, вероятно, отражает способность металла поляризовать окружающие ионы оксида, то есть придавать значительный ковалентный характер связи # «M-O» #.
Эта способность увеличивается с увеличением степени окисления, поскольку положительный характер центрального атома увеличивается.
Однако в группе 15 амфотерными являются только оксиды с более низкой степенью окисления.
Оксиды с более высокой степенью окисления слишком кислые, чтобы быть амфотерными.
Многие переходные металлы образуют амфотерные оксиды, но трудно предсказать, какой из их оксидов будет амфотерным.
Можно сказать, что амфотерная природа оксида сильно зависит от степени окисления металла.
Кислотность катиона быстро повышается с увеличением заряда, поэтому переходные металлы с различными степенями окисления могут иметь кислые, основные или амфотерные оксиды.»-» #
Применение оксида железа в качестве pH-зависимого индикатора для улучшения пищевой ценности
Clin Nutr Res. 2016 июл; 5 (3): 172–179.
, 1 , 1 , 2 и 1Xiangpeng Meng
1 Департамент пищевых наук и технологий, Университет Седжон, Сеул 05006, Корея.
Джина Рю
1 Департамент пищевых наук и технологий, Университет Седжон, Сеул 05006, Корея.
Бумсик Ким
2 Школа пищевых наук, Университет Кюнгил, Кёнсан 38428, Корея.
Сангхун Ко
1 Департамент пищевых наук и технологий, Университет Седжон, Сеул 05006, Корея.
1 Департамент пищевых наук и технологий, Университет Седжон, Сеул 05006, Корея.
2 Школа пищевых наук, Университет Кюнгил, Кёнсан 38428, Корея.
Автор, ответственный за переписку.Переписка с Сангхун Ко. Департамент пищевых наук и технологий, Университет Седжон, 209 Neungdong-ro, Gwangjin-gu, Сеул 05006, Корея. Тел .: + 82-2-3408-3260, Факс: + 82-2-3408-4319, rk.ca.gnojes@oknoohgnasПолучено 30 июня 2016 г .; Пересмотрено 12 июля 2016 г .; Принято 16 июля 2016 г.
Авторские права © Корейское общество клинического питания, 2016 г. Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution (http://creativecommons.org/licenses/by-nc/3.0 /), который разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитируется в других статьях PMC.Abstract
Кислотные пищевые индикаторы могут использоваться в качестве индикаторов pH для оценки качества и свежести ферментированных продуктов в течение всего процесса распределения. Частицы оксида железа почти не взвешиваются в воде, а частично или полностью агломерируются. Степень агломерации частиц оксида железа зависит от pH.Зависимая от pH агломерация или дисперсия частиц может быть полезна для контроля кислотности пищевых продуктов. Дзета-потенциал оксида железа демонстрировал тенденцию к снижению по мере увеличения pH от 2 до 8, в то время как точка нулевого заряда (PZC) наблюдалась примерно при pH 6,0-7,0. Эти результаты предполагают, что на размер частиц оксида железа влияет изменение уровня pH. В результате размер частиц оксида железа был меньше при более низком pH, чем при нейтральном pH. Кроме того, агломерация частиц оксида железа увеличивалась при увеличении pH от 2 до 7.В тесте на агрегацию, зависящую от времени, средний размер частиц составлял 730,4 нм и 1340,3 нм при pH 2 и 7 соответственно. Эти свойства частиц оксида железа могут быть использованы для разработки идеального кислотного индикатора для pH пищевых продуктов и для мониторинга качества пищевых продуктов, помимо красителя или питательного вещества для улучшения питания и сенсорного стимулирования в пищевой промышленности.
Ключевые слова: Оксид железа, частицы, pH, кислотный пищевой индикатор
ВВЕДЕНИЕ
pH является основным и важным фактором как в пищевой промышленности, так и в распределении пищевых продуктов, поскольку он влияет не только на химические свойства пищевых материалов, но и на статус роста микробов во внутренней и внешней среде пищевой системы [1,2,3].Кислотные пищевые индикаторы могут использоваться в качестве индикаторов pH для оценки качества и свежести ферментированных пищевых продуктов в процессе распределения [4]. Несколько экстрактов фруктов и овощей, содержащих чувствительные к pH пигменты, такие как антоцианы, использовались в качестве пищевых индикаторов pH. Однако коммерческое применение кислотных пищевых индикаторов на основе антоцианов ограничено, поскольку они чувствительны к теплу, свету, pH, кислороду и некоторым ферментам, таким как полифенолоксидаза.
Железо — обычный элемент, существующий в земле, и компонент всех живых клеток [5].Кроме того, это важный микроэлемент для поддержания здоровья [6]. Тем не менее, дефицит железа по-прежнему часто встречается в мире как дефицит одного питательного вещества. Железодефицитная анемия может быть вызвана потерей железа из организма и недостаточным потреблением или абсорбцией железа с пищей [7]. Оксиды железа широко используются в быту (например, железные руды, пигменты, катализаторы, термит, гемоглобин) [8,9]. В последнее время они также используются в качестве красителя или питательного вещества в колбасных оболочках, конфетах, жевательных резинках, косметике и некоторых лекарствах в различных отраслях промышленности, включая пищевую [10].Использование оксидов железа в пищевых продуктах разрешено Общим стандартом на пищевые добавки, установленным Комитетом Кодекса по пищевым добавкам и загрязняющим веществам. В одном исследовании сообщалось, что наночастицы оксида железа, содержащие нанокомпозитные пленки, были приняты в качестве биосенсора для определения уровня глюкозы, но нет исследований, сообщающих о его применении в качестве индикатора pH [11]. Оксид железа обычно используется для получения красного цвета, но его степень покраснения зависит от концентрации частиц, pH и других факторов [12].Частицы оксида железа практически не взвешиваются в воде; вместо этого они частично или полностью агломерированы [13]. Степень агломерации частиц оксида железа варьируется в зависимости от pH. Зависимая от pH агломерация или дисперсия частиц может быть полезна для обозначения кислых пищевых продуктов. Это свойство можно использовать для индикации концентрации углекислого газа (CO 2 ) в пищевых продуктах. Визуальный индикатор, отражающий концентрацию CO 2 , может предоставить неподготовленным потребителям эффективный и простой способ контроля качества пищевых продуктов.Такой индикатор предназначен для изменения своего внешнего вида в зависимости от изменения pH водной суспензии за счет равновесия между растворенным CO 2 и образовавшейся угольной кислотой [14]. Частицы оксида железа в кислотном растворе диспергируются, но агломерируются по мере увеличения pH до 7 и выше. Изменение агломерации частиц оксида железа при образовании H + из угольной кислоты можно использовать в качестве системы визуальной индикации. Механизм в основном можно объяснить следующим образом: количество H + , образованное из CO 2 , растворенного в пище, снижает pH суспензии, содержащей частицы оксида железа, что приводит к постепенному диспергированию агломерированных частиц при низком pH. .В предыдущих исследованиях сообщалось о применении системы индикации, основанной на изменении pH в интеллектуальной упаковке [15,16,17]. По этой причине частицы оксида железа в суспензии можно использовать для определения качества пищевых продуктов в зависимости от концентрации CO 2 . дает краткую иллюстрацию этого механизма. Хилти [18] сообщил, что наноструктурированный оксид железа может улучшить растворимость железа в кислотах и сенсорные характеристики пищевых продуктов. Кроме того, многие из предыдущих исследований доказали, что антибактериальная активность наночастиц оксида железа может быть использована против микробов, таких как Escherichia coli [19].Наночастицы оксида железа в пище могут замедлять нейродегенерацию и старение у дрозофилы [20]. Все эти предыдущие отчеты могут свидетельствовать о том, что оксид железа безопасен в качестве пищевой добавки и имеет биологическое содержание в микробиоме или других организмах.
Иллюстрация процесса индикации наночастиц железа как индикатора CO 2 при pH 2 и pH 7.
Целями этого исследования было определение физико-химических свойств частиц оксида железа и изучение их потенциального использования в качестве визуального индикатора для кислых, подкисленных и ферментированных пищевых продуктов.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Оксид железа (III) MP 99,9% (<10 мкм) был приобретен у American Elements, США. Безводный гидрофосфат динатрия особой чистоты (Na 2 HPO 4 ) и дигидрофосфат натрия (NaH 2 PO 4 ) были получены от Daejung Chemical Co., Корея. Цитрат натрия, лимонная кислота, экстракт желчи, липаза, панкреатин и бикарбонат натрия (NaHCO 3 ) были получены от Sigma-Aldrich, США.
Сканирующая электронная микроскопия (SEM)
Оксид железа MP 99,9% (<10 мкм) исследовали с помощью автоэмиссионного сканирующего электронного микроскопа (FE-SEM, S-4300, Hitachi, Токио, Япония) для проверки его размера. . Для каждого образца использовалось ускоряющее напряжение 15,0 кВ.
Измерение распределения частиц по размерам
Распределение частиц по размерам определяли на анализаторе размера частиц (Delsa Nano C, Beckman Coulter, Inc., Фуллертон, Калифорния, США) с использованием метода динамического светорассеяния (DLS).Fe 2 O 3 порошок (0,1 г) суспендировали в 100 мл деионизированной воды и перемешивали с помощью магнитной мешалки (Wisestir MS-MP4, DAIHAN Scientific Co., Ltd., Сеул, Корея) при комнатной температуре, 500 мл. об / мин в течение 1 часа. Затем суспендированный образец подвергали обработке ультразвуком с использованием ультразвукового процессора (VCX-750, Sonics & Materials, Newtown, CT, USA) при мощности 38% с использованием зонда диаметром 6 мм в течение 20 минут. После предварительной обработки образца средние диаметры частиц были измерены на основе интенсивности с использованием анализатора размера частиц.Суспензию выливали в кювету, и размер ее частиц измеряли при 25 ° C с фиксированным углом рассеяния 165 °. Каждый образец анализировали не менее трех раз.
Дзета-потенциал при различных уровнях pH
Дзета-потенциал измеряли с помощью анализатора размера частиц с использованием метода электрофоретического рассеяния света. Образцы разбавляли в 10 раз деионизированной водой. Затем pH доводили до 2,0, 4,0, 6,0, 8,0, 10,0 и 12,0 с помощью HCl или NaOH. Затем в проточную ячейку вводили 1 мл образца с установленным pH.Дзета-потенциал измеряли в пяти точках ячейки, а именно. 0,7, 0,35, 0, –0,35 и –0,7. Все образцы были измерены трижды при фиксированной температуре и угле 25 ° C и 15 ° соответственно.
Зависящая от времени агломерация при различных уровнях pH
Зависящая от времени агломерация частиц оксида железа (III) была измерена анализатором размера частиц с использованием метода DLS. Для зависящей от времени агрегации оксида железа (III) при pH 2,0 и 7,0 изменение размера частиц измеряли при 37 ° C в течение 1 часа с 2-секундными интервалами.
Статистика
Все данные были измерены трижды, а обработка исходных данных и графиков осуществляется с помощью версии Simplot 10.0 (Systat Software, Inc., Сан-Хосе, Калифорния, США).
РЕЗУЛЬТАТЫ
Физико-химические свойства порошка оксида железа с помощью сканирующей электронной микроскопии
Типичная микрофотография, полученная с помощью SEM, ясно показывает трехмерную форму порошков оксида железа, иллюстрирующую морфологию поверхности частиц оксида железа (). Частицы оксида железа имели стабильную и единую структуру.Изображение SEM показывает частицы нанометрового размера с предполагаемым размером частиц от 200 до 250 нм, что указывает на неоднородность распределения частиц по размерам. Частицы оксида железа имели агломерированную и кластерную морфологию. Распределение частиц оксида железа по размерам измеряли с помощью DLS, как показано на. Средний размер частиц оксида железа составлял приблизительно 300 нм.
Изображение частиц оксида железа.
(A) Нормальный график порошка оксида железа невооруженным глазом, (B) Микрофотографии частиц оксида железа с помощью SEM (масштабные полосы слева направо: 500 нм).
Гранулометрический состав частиц оксида железа.
Дзета-потенциалы оксида железа при разных уровнях pH
Дзета-потенциалы оксида железа при различных значениях pH показаны на. Дзета-потенциал указывает на стабильность дисперсии частиц в коллоидах. Дзета-потенциалы оксидов железа варьировали в диапазоне от 32,5 мВ до -19,4 мВ. Дзета-потенциал оксидов железа демонстрировал тенденцию к снижению при увеличении pH от 2 до 8, в то время как PZC наблюдалась примерно при pH 6-7.Эти результаты предполагают, что агрегация частиц будет происходить, когда pH близок к нейтральному.
Дзета-потенциал частиц оксида железа при различных уровнях pH.
Агрегация в зависимости от времени при различных уровнях pH
Изменения размера частиц оксида железа при различных уровнях pH показаны на. Начальный размер частиц при pH 2,0 составлял 446,5 нм, и размер частиц изменялся от 315,6 нм до 1295,6 нм с течением времени. Средний размер частиц 730,4 нм. Начальный размер частиц при pH 7.0 составлял 1440,5 нм, а размер частиц варьировался от 1101,4 нм до 1496,5 нм. Средний размер частиц составлял 1340,3 нм. Эти результаты подтвердили, что уровень pH влияет на размер частиц оксида металла. При pH 2,0 суспензия была стабильной и не наблюдалось осаждения, тогда как осаждение постепенно наблюдалось при значениях pH, близких к 7. Эти результаты также доказали, что размер наночастиц зависит от pH. Таким образом, более низкие значения pH приводят к меньшему размеру частиц оксида железа [21,22,23], что может быть важным фактором для разработки индикатора кислоты.
DLS с временным разрешением суспензий частиц оксида железа при различных значениях pH: (A) pH 2,0 и (B) pH 7,0.
ОБСУЖДЕНИЕ
Значения DLS для частиц оксида железа показали, что частицы были агрегированы в воде, и их размер был больше, чем размер первичных наночастиц (100 нм), полученный из изображений SEM. Таким образом, средний размер частиц был немного больше, чем размер, определенный с помощью SEM, потому что частицы были агломерированы, когда порошок оксида железа был диспергирован в дистиллированной воде [24].Измерение дзета-потенциала оксидов железа показало, что PZC оксидов железа находится примерно при pH 6,0-7,0. Эти результаты подтвердили, что агрегация частиц будет происходить, когда pH близок к нейтральному. При дзета-потенциале от 0 до ± 5 мВ суспензия была настолько нестабильной, что частицы могли быстро агломерироваться или коагулироваться. Однако дзета-потенциал оксида железа при pH 2 был выше, чем при pH 7,0. Обычно частицы с дзета-потенциалом более ± 30 мВ были умеренно стабильными, тогда как частицы с дзета-потенциалом менее ± 30 мВ демонстрировали начальное осаждение.Эта агрегация на основе pH идеально подходит для использования в кислотном индикаторе для индикации pH в пищевых системах. Как указано в предыдущих исследованиях, различные уровни pH влияют на степень агрегации, стабилизации и биодоступность наночастиц [25,26]. Это явление связано с постепенным изменением, и поэтому оно может быть полезно для создания индикаторов потенциальных пищевых продуктов для мониторинга питательного качества и безопасности кислых пищевых продуктов во время обработки и распределения пищевых продуктов. Кроме того, оксиды железа широко применяются в области клинического питания и лечения, например, при создании системы доставки лекарств, они используются в качестве носителей в магнитном нацеливании лекарств для лечения рака и других приложений, таких как восстановление тканей и покрытие из полимера и белка. и так далее [23,27,28].Кроме того, дефицит железа по-прежнему считается наиболее распространенным дефицитом питательных веществ в мире. Таким образом, результат этого исследования предлагает полезную информацию об исследованиях продуктов и фармацевтических препаратов, обогащенных железом.
ЗАКЛЮЧЕНИЕ
Степень агломерации и размер частиц оксида железа зависели от уровней pH. Размер частиц был меньше при более низком pH, чем при нейтральном pH, потому что агломерация увеличивалась при изменении pH от 2,0 до 7,0. Это объясняется изменением дзета-потенциала частиц оксида железа в зависимости от pH.Этот механизм можно использовать для разработки идеального кислотного индикатора для мониторинга pH и качества пищевых продуктов посредством агломерации или диспергирования частиц оксида железа в зависимости от pH. Кроме того, оксид железа также является разновидностью красителя или питательного вещества, которое используется для улучшения питания и сенсорного стимулирования в пищевой промышленности. Поэтому необходимы дальнейшие исследования для изучения линейной зависимости между агломерацией частиц и такими факторами, как концентрация CO 2 , образование кислоты и рост микробов, которые могут влиять на pH пищевых систем.Кроме того, необходимо еще одно исследование для использования пищевой матрицы для подтверждения этих результатов и проверки приемлемости для потребителей путем сенсорной оценки.
Сноски
Финансирование: Это исследование было поддержано программой Центра сельскохозяйственных исследований (ARC, 710003-03-3-SB120) Министерства продовольствия, сельского хозяйства, лесного хозяйства и рыболовства, Корея.
Конфликт интересов: У авторов нет потенциальных конфликтов интересов, которые следует раскрывать.
Вклад авторов: Сянпэн Мэн составил рукопись и проверил физико-химические свойства частиц оксида железа.Джина Рю проанализировала данные. Бумсик Ким внесла свой вклад в интерпретацию результатов. Сангхун Ко разработал исследование, интерпретировал результаты и составил рукопись.
Ссылки
1. Фонтоин Н, Сосье С., Тейсседр П.Л., Глориес Ю. Влияние pH, этанола и кислотности на терпкость и горечь олигомеров танина виноградных косточек в модельном винном растворе. Еда Qual Prefer. 2008; 19: 286–291. [Google Scholar] 2. Висмер-Педерсен Дж. Качество свинины в зависимости от скорости посмертного изменения pH.J Food Sci. 1959; 24: 711–727. [Google Scholar] 3. Гибсон AM, Братчелл Н., Робертс Т.А. Прогнозирование роста микробов: реакция роста сальмонелл в лабораторной среде в зависимости от pH, хлорида натрия и температуры хранения. Int J Food Microbiol. 1988. 6: 155–178. [PubMed] [Google Scholar] 4. Хун С.И., Парк WS. Использование цветных индикаторов в качестве активной системы упаковки для оценки ферментации кимчи. J Food Eng. 2000. 46: 67–72. [Google Scholar] 5. Neilands JB. Поглощение и транспорт железа в микроорганизмах.Анну Рев Нутр. 1981; 1: 27–46. [PubMed] [Google Scholar] 8. Neves MC, Pascoal Neto C, Trindade T. Экологичные гибридные пигменты на основе оксидов целлюлозы и железа. J Nanosci Nanotechnol. 2012; 12: 6817–6821. [PubMed] [Google Scholar] 9. Шимоджо Ф., Накано А., Калия Р.К., Вашишта П. Электронные процессы в быстрых химических реакциях термитов: исследование молекулярной динамики из первых принципов. Phys Rev E Stat Nonlin Soft Matter Phys. 2008; 77: 066103. [PubMed] [Google Scholar] 10. Чаудри К., Касл Л. Применение нанотехнологий в пищевых продуктах: обзор возможностей и проблем для развивающихся стран.Trends Food Sci Technol. 2011; 22: 595–603. [Google Scholar] 11. Баалуша М. Агрегация и дезагрегация наночастиц оксида железа: влияние концентрации частиц, pH и естественного органического вещества. Sci Total Environ. 2009; 407: 2093–2101. [PubMed] [Google Scholar] 12. Чан Т, Верма МС, Гу FX. Оптимизация суперпарамагнитного магнетитового биосенсора с полидиацетиленовым покрытием для колориметрического обнаружения биомаркеров. J Nanosci Nanotechnol. 2015; 15: 2628–2633. [PubMed] [Google Scholar] 13. Морильо Д., Перес Дж., Валиенте М.Эффективное удаление мышьяка (V) и мышьяка (III) из кислых растворов с помощью суперпарамагнитных наночастиц оксида железа Novel Forager Sponge. J Colloid Interface Sci. 2015; 453: 132–141. [PubMed] [Google Scholar] 14. Meng X, Lee K, Kang TY, Ko S. Индикатор необратимой спелости для мониторинга концентрации CO 2 в свободном пространстве упакованного кимчи во время хранения. Food Sci Biotechnol. 2015; 24: 91–97. [Google Scholar] 15. Юнг Дж., Пулигундла П., Ко С. Доказательство концепции индикатора углекислого газа на основе хитозана для упаковки пищевых продуктов.Food Chem. 2012; 135: 2170–2174. [PubMed] [Google Scholar] 16. Lee K, Meng X, Kang TY, Ko S. Индикатор CO 2 на основе хитозана с добавлением красителя для мониторинга качества пищевых продуктов с упором на качество макколи во время хранения. Food Sci Biotechnol. 2015; 24: 905–912. [Google Scholar] 17. Юнг Дж., Ли К., Пулигундла П., Ко С. Индикатор углекислого газа на основе хитозана для сообщения о начале созревания кимчи. Lebensm Wiss Technol. 2013; 54: 101–106. [Google Scholar] 18. Hilty FM, Knijnenburg JT, Teleki A, Krumeich F, Hurrell RF, Pratsinis SE, Zimmermann MB.Включение Mg и Ca в наноструктурированный Fe2O3 улучшает растворимость Fe в разбавленной кислоте и улучшает сенсорные характеристики пищевых продуктов. J Food Sci. 2011; 76: N2–10. [PubMed] [Google Scholar] 19. Гордон Т., Перлштейн Б., Хубара О., Фелнер И., Банин Е., Маргель С. Синтез и характеристика композитных наночастиц цинка / оксида железа и их антибактериальных свойств. Коллоиды Surf A Physicochem Eng Asp. 2011; 374: 1–8. [Google Scholar] 20. Чжан Ю., Ван З., Ли Х, Ван Л., Инь М., Ван Л., Чен Н., Фан С., Сонг Х. Наночастицы оксида железа в пище замедляют старение и улучшают нейродегенерацию у дрозофилы.Adv Mater. 2016; 28: 1387–1393. [PubMed] [Google Scholar] 21. Салех Н., Ким Х.Дж., Фенрат Т., Матыяшевски К., Тилтон Р.Д., Лоури Г.В. Ионная сила и состав влияют на подвижность наночастиц Fe0 с модифицированной поверхностью в колонках водонасыщенного песка. Environ Sci Technol. 2008. 42: 3349–3355. [PubMed] [Google Scholar] 22. Навроцкий А., Мазеина Л., Майзлан Дж. Структурная и термодинамическая сложность оксидов железа, обусловленная размером. Наука. 2008; 319: 1635–1638. [PubMed] [Google Scholar] 23. Гупта А.К., Гупта М. Синтез и инженерия поверхности наночастиц оксида железа для биомедицинских приложений.Биоматериалы. 2005; 26: 3995-4021. [PubMed] [Google Scholar] 24. Чжан Ю., Чен Ю., Вестерхофф П., Христовски К., Криттенден Дж. Стабильность наночастиц промышленных оксидов металлов в воде. Water Res. 2008. 42: 2204–2212. [PubMed] [Google Scholar] 25. Домингос Р.Ф., Туфенкджи Н., Уилкинсон К.И. Агрегация наночастиц диоксида титана: роль фульвокислоты. Environ Sci Technol. 2009. 43: 1282–1286. [PubMed] [Google Scholar] 26. Французский RA, Jacobson AR, Kim B, Isley SL, Penn RL, Baveye PC. Влияние ионной силы, pH и валентности катионов на кинетику агрегации наночастиц диоксида титана.Environ Sci Technol. 2009. 43: 1354–1359. [PubMed] [Google Scholar] 27. Берри CC, Curtis AS. Функционализация магнитных наночастиц для приложений в биомедицине. J Phys D Appl Phys. 2003; 36: R198–206. [Google Scholar] 28. Chomoucka J, Drbohlavova J, Huska D, Adam V, Kizek R, Hubalek J. Магнитные наночастицы и направленная доставка лекарств. Pharmacol Res. 2010. 62: 144–149. [PubMed] [Google Scholar]Что такое кислотный дождь? | Кислотный дождь
Кислотный дождь или кислотное осаждение — это широкий термин, который включает любую форму осадков с кислотными компонентами, такими как серная или азотная кислота, которые выпадают на землю из атмосферы во влажной или сухой форме.Это может быть дождь, снег, туман, град или даже кислая пыль.
Что вызывает кислотный дождь?
Это изображение иллюстрирует путь кислотных дождей в нашей окружающей среде: (1) Выбросы SO 2 и NO x выбрасываются в воздух, где (2) загрязнители превращаются в частицы кислоты, которые могут переноситься на большие расстояния. . (3) Эти кислотные частицы затем падают на землю в виде влажных и сухих отложений (пыль, дождь, снег и т. Д.) И (4) могут оказывать вредное воздействие на почву, леса, ручьи и озера.
Кислотный дождь возникает, когда диоксид серы (SO 2 ) и оксиды азота (NO X ) выбрасываются в атмосферу и переносятся ветром и воздушными потоками. SO 2 и NO X реагируют с водой, кислородом и другими химическими веществами с образованием серной и азотной кислот. Затем они смешиваются с водой и другими материалами, прежде чем упасть на землю.
Хотя небольшая часть SO 2 и NO X , вызывающих кислотные дожди, поступает из естественных источников, таких как вулканы, большая их часть происходит от сжигания ископаемого топлива.Основными источниками SO 2 и NO X в атмосфере являются:
- Сжигание ископаемого топлива для выработки электроэнергии. Две трети SO 2 и одна четверть NO X в атмосфере поступают от генераторов электроэнергии.
- Транспортные средства и тяжелая техника.
- Обрабатывающая, нефтеперерабатывающая и другие отрасли промышленности.
Ветры могут дуть SO 2 и NO X на большие расстояния и через границы, делая кислотные дожди проблемой для всех, а не только для тех, кто живет рядом с этими источниками.
Начало страницы
Формы кислотного осаждения
Мокрое осаждение
Влажное осаждение — это то, что мы чаще всего называем кислотным дождем . Образовавшиеся в атмосфере серная и азотная кислоты падают на землю вместе с дождем, снегом, туманом или градом.
Сухое осаждение
Кислые частицы и газы могут также осаждаться из атмосферы в отсутствие влаги, как сухое осаждение .Кислые частицы и газы могут быстро осаждаться на поверхности (водоемы, растительность, здания) или могут реагировать во время атмосферного переноса с образованием более крупных частиц, которые могут быть вредными для здоровья человека. Когда накопленные кислоты смываются с поверхности следующим дождем, эта кислая вода течет по земле и через нее и может нанести вред растениям и животным, таким как насекомые и рыбы.
Уровень кислотности в атмосфере, которая оседает на землю в результате сухого осаждения, зависит от количества осадков, выпадающих на данной территории.Например, в пустынных районах соотношение сухих и влажных отложений выше, чем в районах, где ежегодно выпадает несколько дюймов дождя.
Начало страницы
Измерение кислотного дождя
Кислотность и щелочность измеряются по шкале pH, для которой 7,0 является нейтральным. Чем ниже pH вещества (менее 7), тем оно более кислое; чем выше pH вещества (более 7), тем оно более щелочное. Нормальный дождь имеет pH около 5,6; он слабокислый, потому что в нем растворяется углекислый газ (CO 2 ), образуя слабую угольную кислоту.

 Mg
Mg Te
Te Mg
Mg Pb
Pb He
He B
B F
F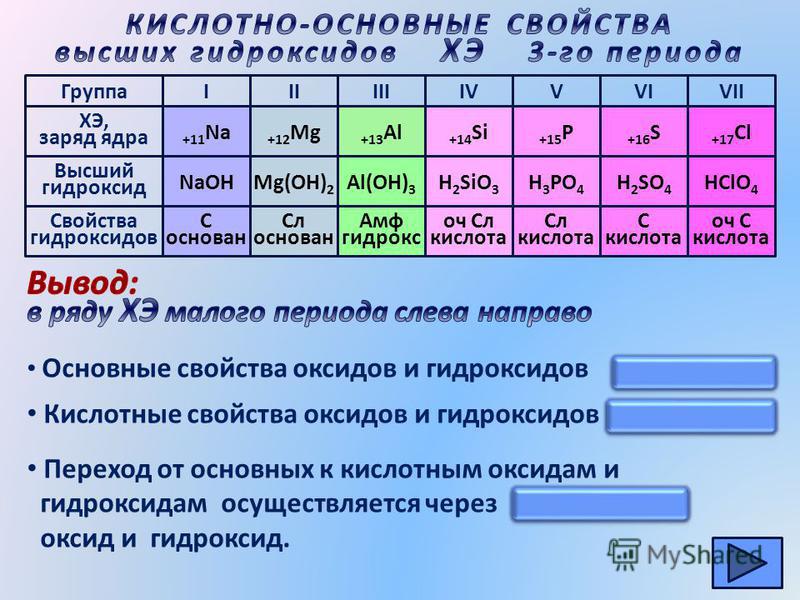 Cr
Cr Si
Si Bi
Bi Mn
Mn Sn
Sn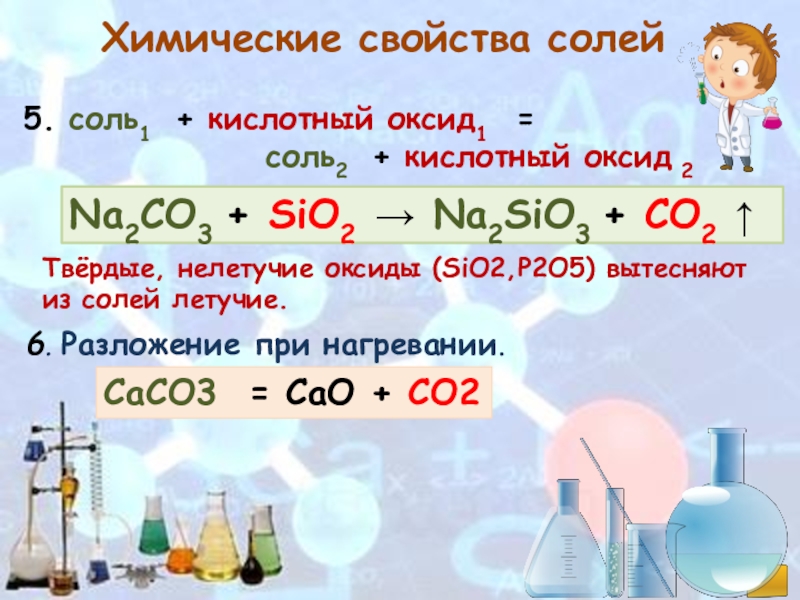 Ne
Ne Ba
Ba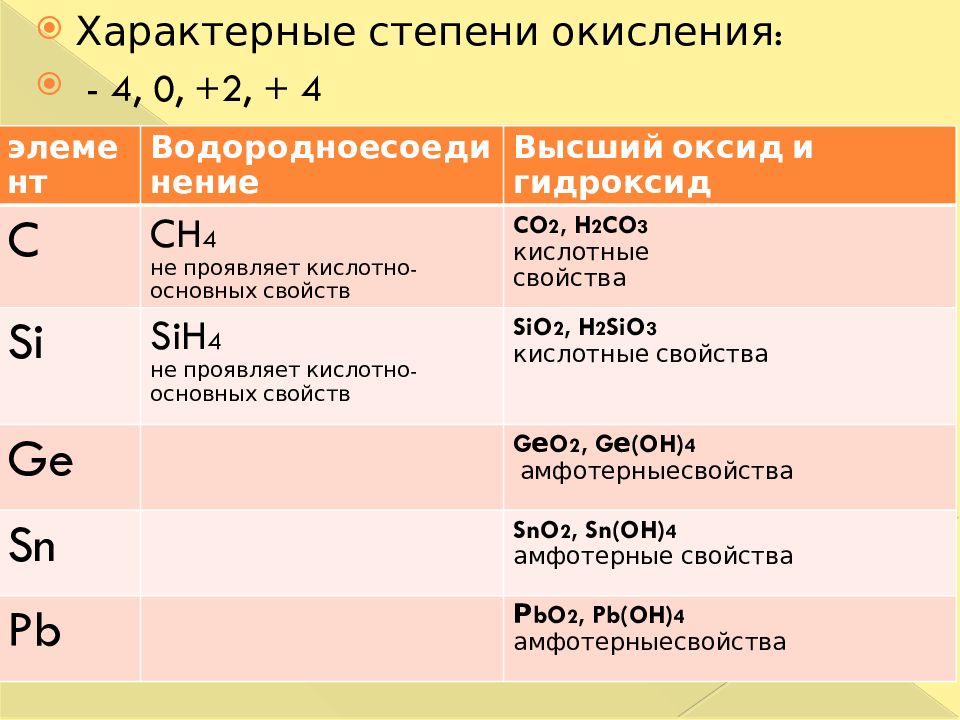 Cs
Cs N
N
Leave A Comment