1.3. Таблица Менделеева — Азбука химии
[МУЗЫКА] [МУЗЫКА] [МУЗЫКА] Я думаю, что если у десяти случайных прохожих спросить, с чем у них ассоциируется химия, то девять однозначно ответят: с периодической системой Дмитрия Ивановича Менделеева. Давайте познакомимся с этой таблицей подробнее. Итак, сейчас известно 118 элементов, и все они имеют свои названия. Последние элементы получили названия в конце 2016 года. Все элементы расположены в периодической системе в порядке возрастания заряда ядра. Однако Менделеев изначально располагал элементы в порядке возрастания атомных масс элементов. Однако уже при жизни Менделеева были открыты инертные газы, которые не имели в первоначальном варианте таблицы своего положения. Эту проблему очень легко разрешил Дмитрий Иванович: он сказал, что необходимо добавить еще одну группу и пошел на нарушение своего собственного принципа — он расположил аргон, имеющего атомную массу 40, перед калием, у которого атомная масса 39. Дело в том, что Менделеев ориентировался не только на атомный вес, но также еще и на сходство химических свойств. Как же устроена периодическая система? Мы ее называем периодической, поскольку в ней есть периоды. Период — это последовательность химических элементов по возрастанию заряда ядра их атома, в которых происходит заполнение внешних электронных оболочек. Существуют два варианта периодической системы в зависимости от того, как изображены периоды. Длинный периодный вариант, рекомендованный IUPAC, в нем все элементы одного периода располагаются в одну строчку. Или короткопериодный вариант — этот вариант особенно популярен на территории России. В этом варианте один период может записываться в две строки. Такая табличка получается более компактной и в чем-то даже более удобной для использования. Кроме того, в периодической системе есть еще и группы. Группы — это тоже последовательность атомов по возрастанию заряда ядра, однако эти атомы обладают однотипным электронным строением. То есть в них происходит заполнение однотипных атомных орбиталей. В короткопериодном варианте периодической системы группы дополнительно разделяются на главную и побочную подгруппу.
Как же устроена периодическая система? Мы ее называем периодической, поскольку в ней есть периоды. Период — это последовательность химических элементов по возрастанию заряда ядра их атома, в которых происходит заполнение внешних электронных оболочек. Существуют два варианта периодической системы в зависимости от того, как изображены периоды. Длинный периодный вариант, рекомендованный IUPAC, в нем все элементы одного периода располагаются в одну строчку. Или короткопериодный вариант — этот вариант особенно популярен на территории России. В этом варианте один период может записываться в две строки. Такая табличка получается более компактной и в чем-то даже более удобной для использования. Кроме того, в периодической системе есть еще и группы. Группы — это тоже последовательность атомов по возрастанию заряда ядра, однако эти атомы обладают однотипным электронным строением. То есть в них происходит заполнение однотипных атомных орбиталей. В короткопериодном варианте периодической системы группы дополнительно разделяются на главную и побочную подгруппу. Дело в том, что в главной подгруппе заполняются только s- или p-электроны, а в побочных подгруппах также d-электроны. Некоторые группы элементов имеют собственные групповые названия. Так, первая A группа, то есть главная подгруппа первой группы периодической системы, или просто первая в длиннопериодном варианте периодической таблицы, имеет название «Щелочные металлы». Там расположены элементы металлы, которые могут образовывать сильные основания — щелочи. Вторая A группа, то есть главная подгруппа второй группы, — это щелочно-земельные элементы. Пятая A группа, или 15-я группа в длиннопериодном варианте, — это элементы пниктогены. Однако такое название редко используется. Шестая A группа, или 16-я группа в длиннопериодном варианте — это элементы халькогены, то есть рождающие руду. Седьмая A группа — галогены, то есть рождающие соли. И наконец восьмая A группа — это инертные, или благородные, газы. Помимо разделения элементов на группы и периоды, можно выделять еще и отдельные семейства элементов.
Дело в том, что в главной подгруппе заполняются только s- или p-электроны, а в побочных подгруппах также d-электроны. Некоторые группы элементов имеют собственные групповые названия. Так, первая A группа, то есть главная подгруппа первой группы периодической системы, или просто первая в длиннопериодном варианте периодической таблицы, имеет название «Щелочные металлы». Там расположены элементы металлы, которые могут образовывать сильные основания — щелочи. Вторая A группа, то есть главная подгруппа второй группы, — это щелочно-земельные элементы. Пятая A группа, или 15-я группа в длиннопериодном варианте, — это элементы пниктогены. Однако такое название редко используется. Шестая A группа, или 16-я группа в длиннопериодном варианте — это элементы халькогены, то есть рождающие руду. Седьмая A группа — галогены, то есть рождающие соли. И наконец восьмая A группа — это инертные, или благородные, газы. Помимо разделения элементов на группы и периоды, можно выделять еще и отдельные семейства элементов. Самым естественным разделением элементов на семейства является разделение их по электронному строению. Так, можно выделить электронное семейство s-элементов, p-элементов, d-элементов и f-элементов. Особенно ярко они появляются в длиннопериодном варианте таблицы, потому что здесь эти элементы занимают отдельные прямоугольные блоки. В короткопериодном варианте эти элементы начинают пересекаться, однако при определенной сноровке и тренировке вы сможете легко отличить s- и p-элементы от d-элементов в периодической системе в короткопериодной ее форме. По общности химических свойств часто объединяют некоторые и другие элементы. Например, выделяют триаду железа, которая содержит железо, кобальт и никель. И платиновые металлы: рутений, родий, палладий, осмий, иридий и платина. Если к ним добавить серебро и золото, то такое семейство можно назвать благородные металлы. Переходными металлами называют d-элементы за исключением последних d-элементов. Всего можно выделить несколько переходных рядов.
Самым естественным разделением элементов на семейства является разделение их по электронному строению. Так, можно выделить электронное семейство s-элементов, p-элементов, d-элементов и f-элементов. Особенно ярко они появляются в длиннопериодном варианте таблицы, потому что здесь эти элементы занимают отдельные прямоугольные блоки. В короткопериодном варианте эти элементы начинают пересекаться, однако при определенной сноровке и тренировке вы сможете легко отличить s- и p-элементы от d-элементов в периодической системе в короткопериодной ее форме. По общности химических свойств часто объединяют некоторые и другие элементы. Например, выделяют триаду железа, которая содержит железо, кобальт и никель. И платиновые металлы: рутений, родий, палладий, осмий, иридий и платина. Если к ним добавить серебро и золото, то такое семейство можно назвать благородные металлы. Переходными металлами называют d-элементы за исключением последних d-элементов. Всего можно выделить несколько переходных рядов. Первый переходный ряд — это элементы от скандия до меди, а второй — от иттрия до серебра, третий — от лантана до золота. Это обусловлено тем, что у них некоторые особые свойства, которые отличают их от свойств непереходных элементов. С этими свойствами мы будем знакомиться в нашем курсе. Наконец можно выделить трансурановые элементы. Общим для них является то, что это искусственные элементы. Они все сильно радиоактивны и крайне неустойчивы. Как же связано строение атома в его положением в периодической системе? Химические элементы расположены в таблице не хаотично, а в строгом соответствии со строением их атомов. Так, количество электронных уровней определяет номер периода, а количество электронов на валентных подуровнях определяет номер группы. Последний по правилам заполнения электрон определяет принадлежность элемента к определенному электронному семейству. Давайте проиллюстрируем эти правила на нескольких примерах. Возьмем, например, натрий: это 11-й по счету элемент.
Первый переходный ряд — это элементы от скандия до меди, а второй — от иттрия до серебра, третий — от лантана до золота. Это обусловлено тем, что у них некоторые особые свойства, которые отличают их от свойств непереходных элементов. С этими свойствами мы будем знакомиться в нашем курсе. Наконец можно выделить трансурановые элементы. Общим для них является то, что это искусственные элементы. Они все сильно радиоактивны и крайне неустойчивы. Как же связано строение атома в его положением в периодической системе? Химические элементы расположены в таблице не хаотично, а в строгом соответствии со строением их атомов. Так, количество электронных уровней определяет номер периода, а количество электронов на валентных подуровнях определяет номер группы. Последний по правилам заполнения электрон определяет принадлежность элемента к определенному электронному семейству. Давайте проиллюстрируем эти правила на нескольких примерах. Возьмем, например, натрий: это 11-й по счету элемент. Всего в электронной оболочке атомов натрия три электронных уровня, поэтому натрий расположен в третьем периоде. Его электронная конфигурация 1s2 2s2 2p6 3s1. На внешнем электронном слое один электрон, 3s1 — внешний электронный слой. Поэтому натрий расположен в первой группе. Этот электрон относится к s-электронам, поэтому натрий относится к s-электронному семейству элементов. Это щелочной металл. Кислород — это восьмой по счету элемент. Его электронная конфигурация — 1s2 2s2 2p4. Всего два электронных уровня, поэтому кислород располагается во втором периоде. На внешнем слое у кислорода шесть электронов 2s2 2p4, поэтому кислород принадлежит к шестой группе элементов. И последний по правилам заполнения электрон — это p-электрон, поэтому кислород относится к p-электронному семейству элементов. Железо. Железо расположено в четвертом периоде. Его электронная конфигурация (я назову ее в краткой форме): это [Ar] 4s2 3d6. Всего у железа четыре электронных уровня, на которых есть электроны, поэтому железо находится в четвертом периоде.
Всего в электронной оболочке атомов натрия три электронных уровня, поэтому натрий расположен в третьем периоде. Его электронная конфигурация 1s2 2s2 2p6 3s1. На внешнем электронном слое один электрон, 3s1 — внешний электронный слой. Поэтому натрий расположен в первой группе. Этот электрон относится к s-электронам, поэтому натрий относится к s-электронному семейству элементов. Это щелочной металл. Кислород — это восьмой по счету элемент. Его электронная конфигурация — 1s2 2s2 2p4. Всего два электронных уровня, поэтому кислород располагается во втором периоде. На внешнем слое у кислорода шесть электронов 2s2 2p4, поэтому кислород принадлежит к шестой группе элементов. И последний по правилам заполнения электрон — это p-электрон, поэтому кислород относится к p-электронному семейству элементов. Железо. Железо расположено в четвертом периоде. Его электронная конфигурация (я назову ее в краткой форме): это [Ar] 4s2 3d6. Всего у железа четыре электронных уровня, на которых есть электроны, поэтому железо находится в четвертом периоде. На внешнем электронном слое восемь электронов 4s2 3d6, поэтому железо находится в восьмой группе. Ну и последний по правилам заполнения электрон — это d-электрон, поэтому и железо тоже — d-элемент. Дмитрий Иванович Менделеев сформулировал свой закон следующим образом: «Свойства простых тел, а также формы и свойства соединения элементов, а потому и свойства образуемых или простых и сложных тел стоят в периодической зависимости от их атомного веса». Пользуясь этим законом, Дмитрий Иванович Менделеев предсказал свойства неизвестных на тот момент элементов. Эти элементы — некоторые из них — были открыты уже при жизни самого Дмитрия Ивановича Менделеева, которые подтвердили верность его закона. Именно это отличает открытие Дмитрия Ивановича Менделеева от попыток других многочисленных ученых систематизировать химические элементы. Однако, конечно, в XX веке ученым удалось раскрыть строение атома, и в этот периодический закон пришлось внести одну, но очень важную, существенную корректировку.
На внешнем электронном слое восемь электронов 4s2 3d6, поэтому железо находится в восьмой группе. Ну и последний по правилам заполнения электрон — это d-электрон, поэтому и железо тоже — d-элемент. Дмитрий Иванович Менделеев сформулировал свой закон следующим образом: «Свойства простых тел, а также формы и свойства соединения элементов, а потому и свойства образуемых или простых и сложных тел стоят в периодической зависимости от их атомного веса». Пользуясь этим законом, Дмитрий Иванович Менделеев предсказал свойства неизвестных на тот момент элементов. Эти элементы — некоторые из них — были открыты уже при жизни самого Дмитрия Ивановича Менделеева, которые подтвердили верность его закона. Именно это отличает открытие Дмитрия Ивановича Менделеева от попыток других многочисленных ученых систематизировать химические элементы. Однако, конечно, в XX веке ученым удалось раскрыть строение атома, и в этот периодический закон пришлось внести одну, но очень важную, существенную корректировку. Все-таки свойства простых тел, а также формы и свойства соединения элементов находятся в периодической зависимости не от атомного веса, а от заряда ядер атомов химических элементов. Какие же свойства находятся в такой периодической зависимости? Давайте разберем некоторые из них. Одно из главнейших свойств — это радиус атомов элементов. Радиус атомов увеличивается в группах и уменьшается в периодах. Уменьшение радиуса атомов в периодах связано с тем, что количество энергетических уровней не изменяется, тогда как заряд ядра возрастает. Это означает, что внешние электроны начинают с большей силой притягиваться к ядру, и поэтому радиус атома уменьшается, а в группах происходит нарастание количества энергетических уровней. Мы помним, что номер энергетического уровня, то есть главное квантовое число, связано с размером атомной орбитали: чем больше номер, тем больше размер. Поэтому в группах радиус атомов увеличивается. Очень важное свойство химических элементов — это электроотрицательность, то есть способность атомов химических элементов притягивать к себе свои собственные электроны, а также электроны химических связей.
Все-таки свойства простых тел, а также формы и свойства соединения элементов находятся в периодической зависимости не от атомного веса, а от заряда ядер атомов химических элементов. Какие же свойства находятся в такой периодической зависимости? Давайте разберем некоторые из них. Одно из главнейших свойств — это радиус атомов элементов. Радиус атомов увеличивается в группах и уменьшается в периодах. Уменьшение радиуса атомов в периодах связано с тем, что количество энергетических уровней не изменяется, тогда как заряд ядра возрастает. Это означает, что внешние электроны начинают с большей силой притягиваться к ядру, и поэтому радиус атома уменьшается, а в группах происходит нарастание количества энергетических уровней. Мы помним, что номер энергетического уровня, то есть главное квантовое число, связано с размером атомной орбитали: чем больше номер, тем больше размер. Поэтому в группах радиус атомов увеличивается. Очень важное свойство химических элементов — это электроотрицательность, то есть способность атомов химических элементов притягивать к себе свои собственные электроны, а также электроны химических связей. Наибольшей электроотрицательностью обладает атом фтора, а наименьшей — цезий и рубидий. Электроотрицательность увеличивается в периодах и уменьшается в группах. Способность атомов притягивать к себе электроны обуславливает их многие химические свойства. Так, элементы-галогенам, которым недостает до заполнения своей электронной конфигурации всего лишь одного электрона, то есть до получения ими электронной конфигурации инертного газа, обладают высокой электроотрицательностью, высокой способностью притянуть к себе еще один хотя бы электрончик. А вот щелочным металлам гораздо проще избавиться от своего единственного электрона, чтобы принять очень устойчивую электронную конфигурацию инертного газа. Поэтому у щелочных газов наименьшая электроотрицательность. Другие важные свойства — это металлические и неметаллические свойства. Металлические, или восстановительные, свойства возрастают в группах и уменьшаются в периодах. Это означает, что наиболее выраженными металлическими свойствами обладают элементы, расположенные в левом нижнем углу периодической системы.
Наибольшей электроотрицательностью обладает атом фтора, а наименьшей — цезий и рубидий. Электроотрицательность увеличивается в периодах и уменьшается в группах. Способность атомов притягивать к себе электроны обуславливает их многие химические свойства. Так, элементы-галогенам, которым недостает до заполнения своей электронной конфигурации всего лишь одного электрона, то есть до получения ими электронной конфигурации инертного газа, обладают высокой электроотрицательностью, высокой способностью притянуть к себе еще один хотя бы электрончик. А вот щелочным металлам гораздо проще избавиться от своего единственного электрона, чтобы принять очень устойчивую электронную конфигурацию инертного газа. Поэтому у щелочных газов наименьшая электроотрицательность. Другие важные свойства — это металлические и неметаллические свойства. Металлические, или восстановительные, свойства возрастают в группах и уменьшаются в периодах. Это означает, что наиболее выраженными металлическими свойствами обладают элементы, расположенные в левом нижнем углу периодической системы. А вот, напротив, неметаллические, или окислительные, свойства возрастают в периодах и уменьшаются в группах. Это означает, что наиболее характерные элементы-неметаллы расположены в правой верхней части периодической системы. Можно провести условную диагональ металличности/неметалличности в периодической системе. Тогда выше этой диагонали будут расположены элементы-неметаллы, а ниже — элементы-металлы. Вдоль такой диагонали будут расположены амфотерные элементы. Поэтому такую диагональ часто называют диагональ амфотерности. Итак, как же реагируют элементы друг с другом? Они вступают во взаимодействие, которое непременно приводит к тому, что электроны, принадлежащие атомам, становятся общими электронами. В этом заключается основной принцип образования химических связей. Давайте рассмотрим это в следующей лекции.
А вот, напротив, неметаллические, или окислительные, свойства возрастают в периодах и уменьшаются в группах. Это означает, что наиболее характерные элементы-неметаллы расположены в правой верхней части периодической системы. Можно провести условную диагональ металличности/неметалличности в периодической системе. Тогда выше этой диагонали будут расположены элементы-неметаллы, а ниже — элементы-металлы. Вдоль такой диагонали будут расположены амфотерные элементы. Поэтому такую диагональ часто называют диагональ амфотерности. Итак, как же реагируют элементы друг с другом? Они вступают во взаимодействие, которое непременно приводит к тому, что электроны, принадлежащие атомам, становятся общими электронами. В этом заключается основной принцип образования химических связей. Давайте рассмотрим это в следующей лекции.
история открытия, интересные факты и байки – Москва 24, 24.10.2012
Фото: ИТАР-ТАСС
Открытие таблицы периодических химических элементов стало одной из важных вех в истории развития химии как науки. Первооткрывателем таблицы стал российский ученый Дмитрий Менделеев. Неординарный ученый с широчайшим научным кругозором сумел объединить все представления о природе химических элементов в единую стройную концепцию.
Первооткрывателем таблицы стал российский ученый Дмитрий Менделеев. Неординарный ученый с широчайшим научным кругозором сумел объединить все представления о природе химических элементов в единую стройную концепцию.
Об истории открытия таблицы периодических элементов, интересных фактах, связанных с открытием новых элементов, и народных байках, которые окружали Менделеева и созданную им таблицу химических элементов, М24.RU расскажет в этой статье.
История открытия таблицы
К середине XIX века было открыто 63 химических элемента, и ученые всего мира не раз предпринимали попытки объединить все существовавшие элементы в единую концепцию. Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
В 1863 году свою теорию предложил химик и музыкант Джон Александр Ньюленд, который предложил схему размещения химических элементов, схожую с той, что открыл Менделеев, но работа ученого не была принята всерьез научным сообществом из-за того, что автор увлекся поисками гармонии и связью музыки с химией.
В 1869 году Менделеев опубликовал свою схему периодической таблицы в журнале Русского химического общества и разослал извещение об открытии ведущим ученым мира. В дальнейшем химик не раз дорабатывал и улучшал схему, пока она не приобрела привычный вид.
Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов, свойства начинают повторяться. Так, калий похож на натрий, фтор — на хлор, а золото схоже с серебром и медью.
В 1871 году Менделеев окончательно объединил идеи в периодический закон. Ученые предсказал открытие нескольких новых химических элементов и описал их химические свойства. В дальнейшем расчеты химика полностью подтвердились — галлий, скандий и германий полностью соответствовали тем свойствам, которые им приписал Менделеев.
Байки о Менделееве
Гравюра, на которой изображен Менделеев. Фото: ИТАР-ТАСС
Об известном ученом и его открытиях ходило немало баек.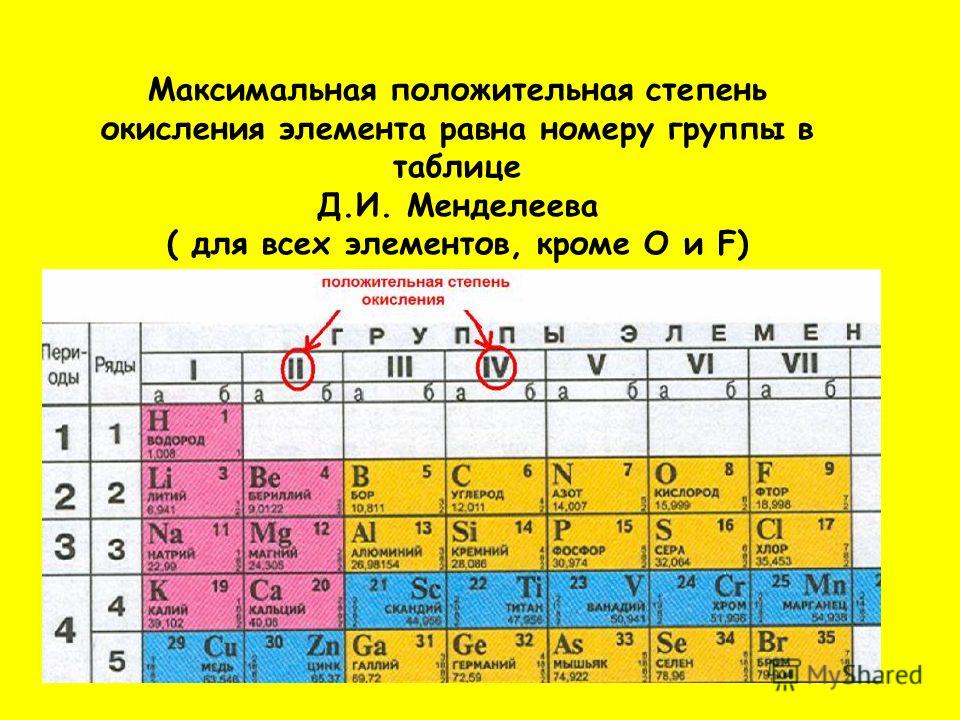 Люди в то время слабо представляли себе химию и считали, что занятия химией — это что-то вроде поедания супа из младенцев и воровства в промышленных масштабах. Поэтому деятельность Менделеева быстро обросла массой слухов и легенд.
Люди в то время слабо представляли себе химию и считали, что занятия химией — это что-то вроде поедания супа из младенцев и воровства в промышленных масштабах. Поэтому деятельность Менделеева быстро обросла массой слухов и легенд.
Одна из легенд гласит, что Менделеев открыл таблицу химических элементов во сне. Случай не единственный, точно также говорил о своем открытии Август Кекуле, которому приснилась формула бензольного кольца. Однако Менделеев только смеялся над критиками. «Я над ней, может быть, двадцать лет думал, а вы говорите: сидел и вдруг … готово!», — как-то сказал ученый о своем открытии.
Другая байка приписывает Менделееву открытие водки. В 1865 году великий ученый защитил диссертацию на тему «Рассуждение о соединении спирта с водою», и это сразу дало повод для новой легенды. Современники химика посмеивались, мол ученый «неплохо творит под действием спирта, соединенного с водой», а следующие поколения уже называли Менделеева первооткрывателем водки.
Посмеивались и над образом жизни ученого, а особенно над тем, что Менделеев оборудовал свою лабораторию в дупле огромного дуба.
Также современники подтрунивали над страстью Менделеева к чемоданам. Ученый в пору своего невольного бездействия в Симферополе вынужден был коротать время за плетением чемоданов. В дальнейшем он самостоятельно мастерил для нужд лаборатории картонные контейнеры. Несмотря на явно «любительский» характер этого увлечения, Менделеева часто называли «чемоданных дел мастером».
Открытие радия
Одна из наиболее трагичных и в то же время известных страниц в истории химии и появления новых элементов в таблице Менделеева связана с открытием радия. Новый химический элемент был открыт супругами Марией и Пьером Кюри, которые обнаружили, что отходы, остающиеся после выделения урана из урановой руды, более радиоактивны, чем чистый уран.
Поскольку о том, что такое радиоактивность, тогда еще никто не знал, то новому элементу молва быстро приписала целебные свойства и способность излечивать чуть ли не от всех известных науке болезней. Радий включили в состав пищевых продуктов, зубной пасты, кремов для лица.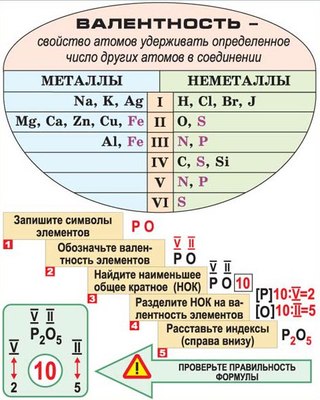 Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для улучшения потенции и снятия стресса.
Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для улучшения потенции и снятия стресса.
Подобное «производство» продолжалось целых двадцать лет — до 30-х годов двадцатого века, когда ученые открыли истинные свойства радиоактивности и выяснили насколько губительно влияние радиации на человеческий организм.
Мария Кюри умерла в 1934 году от лучевой болезни, вызванной долговременным воздействием радия на организм.
Небулий и короний
Фото: ИТАР-ТАСС
Таблица Менделеева не только упорядочила химические элементы в единую стройную систему, но и позволила предсказать многие открытия новых элементов. В то же время некоторые химические «элементы» были признаны несуществующими на основании того, что они не укладывались в концепцию периодического закона. Наиболее известна история с «открытием» новых элементов небулия и корония.
При исследовании солнечной атмосферы астрономы обнаружили спектральные линии, которые им не удалось отождествить ни с одним из известных на земле химических элементов.
Спустя несколько лет астрономы сделали еще одно открытие, изучая спектры газовых туманностей. Обнаруженные линии, которые снова не удалось отождествить ни с чем земным, приписали другому химическому элементу — небулию.
Открытия подверглись критике, поскольку в периодической таблице Менделеева уже не оставалось места для элементов, обладающих свойствами небулия и корония. После проверки обнаружилось, что небулий является обычным земным кислородом, а короний — сильно ионизированное железо.
Отметим, что сегодня в московском Центральном доме ученых РАН торжественно присвоят имена двум химическим элементам, открытым учеными из подмосковной Дубны.
Материал создан на основе информации из открытых источников. Подготовил Василий Макагонов @vmakagonov
Химические элементы, названные в честь российских ученых и топонимов.
 Досье — Биографии и справки
Досье — Биографии и справкиТАСС-ДОСЬЕ. 30 ноября Международный союз теоретической и прикладной химии (The International Union of Pure and Applied Chemistry, IUPAC) объявил об утверждении названий новооткрытых элементов периодической таблицы Менделеева.
113-й элемент получил имя нихониум (символ — Ni, в честь Японии), 115-й — московием (Mc, в честь Московской обл.), 117 — теннесином (Ts, в честь штата Теннеси) и 118-й — оганессоном (Og, в честь российского ученого Юрия Оганесяна).
Редакция ТАСС-ДОСЬЕ подготовила список других химических элементов, названных в честь российских ученых и топонимов.
Рутений
Рутений (Ruthenium, символ — Ru) — химический элемент с атомным номером 44. Представляет собой переходный металл платиновой группы серебристого цвета. Используется в электронике, химии, для создания износостойких электрических контактов, резисторах. Добывается из платиновой руды.
Был открыт в 1844 г. профессором Казанского университета Карлосом Клаусом, который решил назвать элемент в честь России (Ruthenia — один из вариантов средневекового латинского названия Руси).
Самарий
Самарий (Samarium, Sm) — химический элемент с атомным номером 62. Представляет собой редкоземельный металл из группы лантаноидов. Широко используется для изготовления магнитов, в медицине (для борьбы с раком), для изготовления аварийных регулирующих кассет в ядерных реакторах.
Был открыт в 1878-1880 гг. французским и швейцарским химиками Полем Лекоком де Буабодраном и Жаном Галиссар де Мариньяком. Они обнаружили новый элемент в найденном в Ильменских горах минерале самарските и назвали его самарием (как производное от минерала).
Однако сам минерал, в свою очередь, был назван по имени русского горного инженера, начальника штаба Корпуса горных инженеров Василия Самарского-Быховца, который передал его иностранным химикам для изучения.
Менделевий
Менделевий (Mendelevium, Md) — синтезированный химический элемент с атомным номером 101. Представляет собой высокорадиоактивный металл.
Наиболее из стабильных изотопов элемента имеет период полураспада 51,5 суток. Может быть получен в лабораторных условиях при бомбардировке атомов эйнштейния ионами гелия. Был открыт в 1955 г. американскими учеными из Национальной лаборатории имени Лоуренса в Беркли (США).
Может быть получен в лабораторных условиях при бомбардировке атомов эйнштейния ионами гелия. Был открыт в 1955 г. американскими учеными из Национальной лаборатории имени Лоуренса в Беркли (США).
Несмотря на то, что в это время США и СССР находились в состоянии холодной войны, первооткрыватели элемента, среди которых был один из основателей ядерной химии, Гленн Сиборг, предложили назвать его в честь создателя периодической таблицы — русского ученого Дмитрия Менделеева. Правительство США согласилось с этим, в том же году IUPAC присвоил элементу название Менделевий.
Дубний
Дубний (Dubnium, Db) — синтезированный химический элемент с атомным номером 105, радиоактивный металл. Наиболее стабильный из изотопов имеет период полураспада около 1 часа. Получается при бомбардировке ядер амереция ионами неона. Был открыт в 1970 г. в ходе независимых экспериментов физиками Лаборатории ядерных реакций Объединенного института ядерных исследований в Дубне и лаборатории в Беркли.
После более чем 20-летнего спора о первенстве в открытии, IUPAC в 1993 г. принял решение признать оба коллектива первооткрывателями элемента и назвать его в честь Дубны (при этом в Советском Союзе предлагали назвать его нильсборием в честь датского физика — Нильса Бора).
Флеровий
Флеровий (Flerovium, Fl) — синтезированный химический элемент с атомным номером 114. Сильнорадиоактивное вещество с периодом полураспада не более 2,7 секунд. Впервые был получен группой физиков Объединенного института ядерных исследований в Дубне под руководством Юрия Оганесяна с участием ученых из Ливермоской национальной лаборатории США) путем слияния ядер кальция и плутония.
Назван по предложению российских ученых в честь одного из основателей института в Дубне, Георгия Флерова.
Московий и оганессон
8 июня комитет Международного союза теоретической и прикладной химии рекомендовал назвать 115-й элемент таблицы Менделеева московием в честь Московской области, где находится Объединенный институт ядерных исследований (город Дубна).
118-й элемент организация предложила называть оганессоном в честь его первооткрывателя, академика РАН Юрия Оганесяна.
Оба химических элементов являются синтезированными с периодом полураспада, не превышающим несколько долей секунд. Были открыты в Лаборатории ядерных реакций Объединенного института ядерных исследований в Дубне в ходе экспериментов в 2002-2005 гг. Предложенные IUPAC названия прошли публичное обсуждение и были утверждены им же 28 ноября 2016 г.
Также до 1997 г. в СССР и России синтезированный элемент с атомным номером 104 носил название курчатовий, в честь физика Игоря Курчатова, однако IUPAC принял решение назвать его в честь британского физика Эрнеста Резерфорда — резерфордием.
Урок №58. Периодическая таблица химических элементов (короткая форма): А- и Б-группы, периоды
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Графическим изображением периодического закона
является периодическая таблица. Она содержит 7 периодов и 8 групп.
Короткая форма таблицы Д.И. Менделеева.
Полудлинный вариант таблицы Д.И. Менделеева.
Существует ещё и длинный вариант таблицы, он похож на полудлинный, но только лантаноиды и актиноиды не вынесены за пределы таблицы.
Оригинал таблицы Д. И. Менделеева
1. Период – химические элементы, расположенные в строчку (1 – 7)
Малые (1, 2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) – состоят из двух рядов – чётного и нечётного
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом, а заканчиваются благородным газом.
Во всех периодах с увеличением относительных атомных
масс элементов наблюдается усиление неметаллических и ослабление металлических
свойств. В больших периодах переход свойств от активного металла к благородному
газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах
(через 8 элементов). Кроме того, в малых периодах слева направо
валентность в соединениях с кислородом возрастает от 1 до 7 (например, от Na до Cl). В больших периодах вначале
валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к
рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у
серебра, потом снова возрастает.
В больших периодах переход свойств от активного металла к благородному
газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах
(через 8 элементов). Кроме того, в малых периодах слева направо
валентность в соединениях с кислородом возрастает от 1 до 7 (например, от Na до Cl). В больших периодах вначале
валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к
рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у
серебра, потом снова возрастает.
2. Группы — вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные (А) и побочные подгруппы (Б).
Главные подгруппы состоят из элементов малых и больших периодов.
Побочные подгруппы состоят из элементов только больших периодов.
В главных подгруппах сверху вниз металлические
свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных
групп сильно отличаются по свойствам.
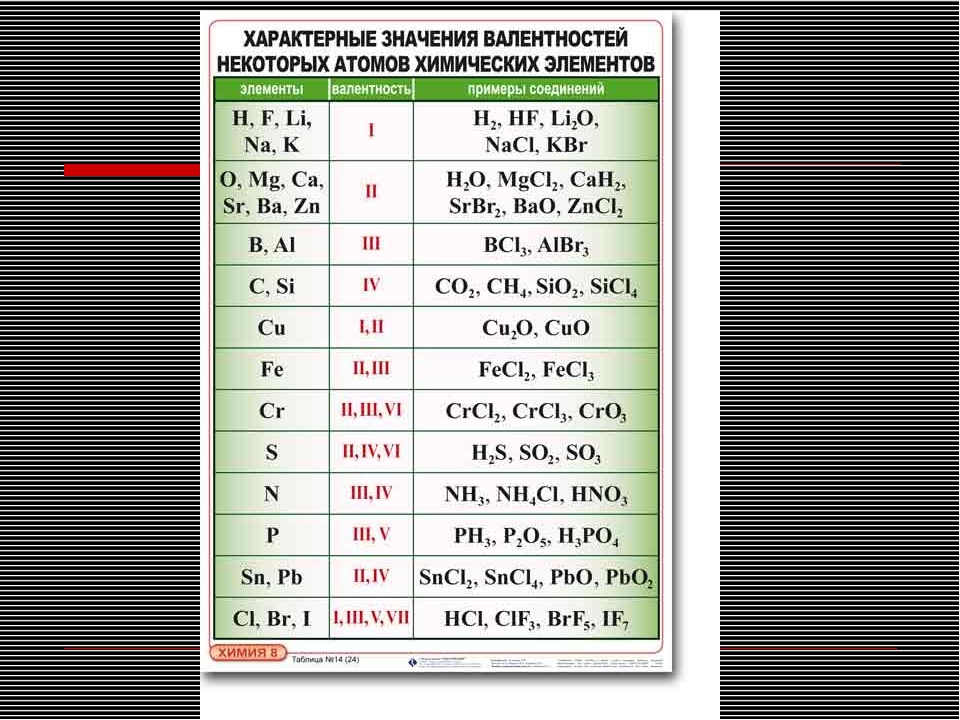
Номер группы показывает высшую валентность элемента (кроме N, O, F).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I — III групп (кроме бора) преобладают основные свойства, с IV по VIII — кислотные.
Группа | I | II | III | IV | V | VI | VII | VIII (кроме инертных газов) |
Высший оксид | Э2О | ЭО | Э2О3 | ЭО2 | Э2О5 | ЭО3 | Э2О7 | ЭО4 |
Гидрат высшего оксида | ЭОН | Э(ОН)2 | Э(ОН)3 | Н2ЭО3 | Н3ЭО4 | Н2ЭО4 | НЭО4 | Н4ЭО4 |
Для элементов главных подгрупп общими
являются формулы водородных соединений. Элементы главных подгрупп I — III групп образуют твердые вещества —
гидриды (водород в степени окисления — 1), а IV — VII групп — газообразные. Водородные
соединения элементов главных подгрупп IV группы (ЭН4) — нейтральны, V группы (ЭН3) —
основания, VI
и VII
групп (Н2Э и НЭ) — кислоты.
Элементы главных подгрупп I — III групп образуют твердые вещества —
гидриды (водород в степени окисления — 1), а IV — VII групп — газообразные. Водородные
соединения элементов главных подгрупп IV группы (ЭН4) — нейтральны, V группы (ЭН3) —
основания, VI
и VII
групп (Н2Э и НЭ) — кислоты.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ • Большая российская энциклопедия
ПЕРИОДИ́ЧЕСКАЯ СИСТЕ́МА ХИМИ́ЧЕСКИХ ЭЛЕМЕ́НТОВ, упорядоченное множество химич. элементов и их естеств. классификация. Является табличным представлением периодического закона, открытого Д. И. Менделеевым. Прообразом П. с. х. э. служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленная Менделеевым в 1869 (рис. 1). По мере совершенствования этой таблицы Менделеев развил представления о периодах и группах элементов и о месте каждого элемента в системе. К 1871 в кн. «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классич. короткая форма П. с. х. э. Опираясь на неё, Менделеев выполнил впоследствии оправдавшийся прогноз существования и свойств неизвестных в то время элементов (Ga, Sc, Ge).
К 1871 в кн. «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классич. короткая форма П. с. х. э. Опираясь на неё, Менделеев выполнил впоследствии оправдавшийся прогноз существования и свойств неизвестных в то время элементов (Ga, Sc, Ge).
Рис. 1. Таблица, составленная Д. И. Менделеевым 1. 3.1869.
Физич. смысл периодичности в свойствах элементов стал ясен после появления планетарной модели атома (Э. Резерфорд, 1911) и было показано (нидерл. физик А. ван ден Брук и Г. Мозли, 1913–14), что порядковый номер элемента в П. с. х. э. равен положительному заряду (Z) ядра атома. Теория П. с. х. э. в осн. создана Н. Бором (1913–21) на базе квантовой модели атома. Бор разработал схему построения электронных конфигураций атомов по мере возрастания Z, опирающуюся на определённую последовательность заполнения электронами оболочек и подоболочек в атомах с ростом числа Z.
Совр. П. с. х. э. включает более ста химич. элементов. Наиболее тяжёлые элементы получены ядерным синтезом. Порядок заполнения электронами уровней в атомах определяется правилами, совокупность которых называют «принципом построения»: заполнение атомных орбиталей (АО) происходит в порядке увеличения энергии орбиталей: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 6d и т. д.; согласно Паули принципу, каждая АО (характеризуется квантовыми числами n, l, m) может содержать не более 2 электронов; АО с одинаковыми l и n заполняются так, чтобы суммарный спин электронов был максимален (т. е. заполняется макс. число АО с разными m по Хунда правилу).
Рис. 2. Короткий вариант периодической системы химических элементов Д. И. Менделеева (в соответствии с данными ИЮПАК на 1973).
Согласно (n+l)-правилу Клечковского, построение электронных конфигураций гл.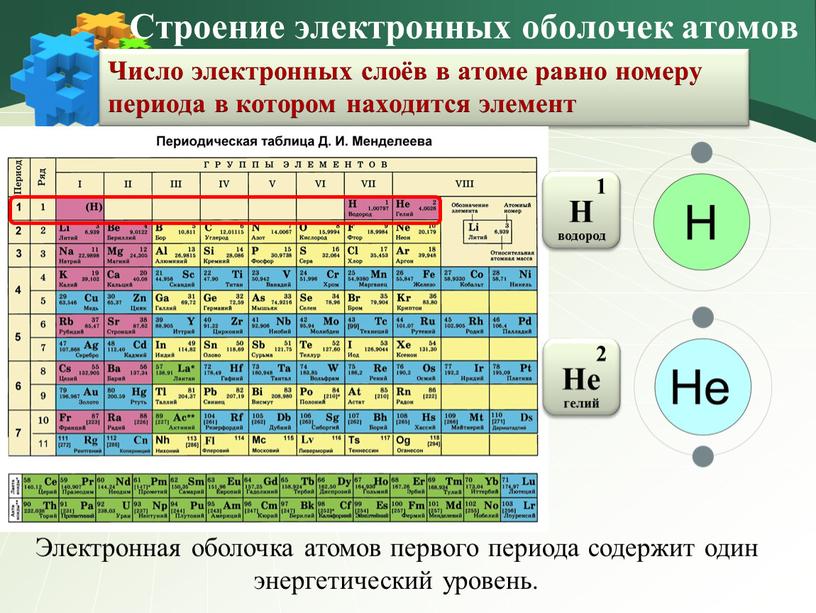 обр. происходит в соответствии с последовательным увеличением суммы (n+l). При этом в пределах каждой такой суммы сначала заполняются подоболочки с бóльшими l и меньшими n, затем с меньшими l и бóльшими n.
обр. происходит в соответствии с последовательным увеличением суммы (n+l). При этом в пределах каждой такой суммы сначала заполняются подоболочки с бóльшими l и меньшими n, затем с меньшими l и бóльшими n.
Опубликовано св. 500 вариантов П. с. х. э., что связано с попытками поиска решения некоторых частных проблем её структуры. Наиболее распространены две табличные формы П. с. х. э.: короткая (рис. 2) и длинная (разрабатывалась Д. И. Менделеевым, усовершенствована в 1905 А. Вернером; рис. 3). В структуре П. с. х. э. выделяют периоды (горизонтальные ряды) и группы (вертикальные столбцы) элементов.
Рис. 3. Длинная форма периодической системы химических элементов (в соответствии с данными ИЮПАК на 2013).
Совр. форма П. с. х. э. (в 1989 ИЮПАК рекомендована длинная форма П. с. х. э.) состоит из 7 периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма П. с. х. э. – из 8 групп. Число элементов в периодах, начиная со второго, попарно повторяется: 8, 8, 18, 18, 32, 32,… (первый период содержит два элемента). Номер группы элементов короткого варианта П. с. х. э. соответствует числу валентных электронов во внешней электронной оболочке атомов. В длиннопериодном варианте П. с. х. э. номер группы в бoльшей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химич. свойствам, их атомы характеризуются одинаковым строением внешних электронных оболочек. Элементы некоторых групп имеют собств.
э.) состоит из 7 периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма П. с. х. э. – из 8 групп. Число элементов в периодах, начиная со второго, попарно повторяется: 8, 8, 18, 18, 32, 32,… (первый период содержит два элемента). Номер группы элементов короткого варианта П. с. х. э. соответствует числу валентных электронов во внешней электронной оболочке атомов. В длиннопериодном варианте П. с. х. э. номер группы в бoльшей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химич. свойствам, их атомы характеризуются одинаковым строением внешних электронных оболочек. Элементы некоторых групп имеют собств. тривиальные названия: щелочные металлы (группа 1 длинной формы П. с. х. э.), щёлочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В П. с. х. э. для каждого элемента указывается его символ, название, порядковый номер и значение относит. атомной массы.
тривиальные названия: щелочные металлы (группа 1 длинной формы П. с. х. э.), щёлочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В П. с. х. э. для каждого элемента указывается его символ, название, порядковый номер и значение относит. атомной массы.
Первый период содержит два элемента – Н и Не. Водород имеет некоторое сходство как со щелочными элементами, так и с галогенами. В связи с этим символ Н помещают либо в подгруппу Iа, либо в подгруппу VIIa короткого варианта П. с. х. э., либо в обе одновременно.
Второй и третий периоды (Li – Ne; Na – Ar) содержат по 8 элементов, причём характер изменения химич. свойств вертикальных аналогов во многом близок. Элементы первых трёх периодов относятся к гл. подгруппам короткого варианта периодич. системы химич. элементов.
Элементы групп 1 и 2 длинной формы называются s-элементами, групп 13–18 – p-элементами, групп 3–12 – d-элементами; d-элементы (за исключением цинка, кадмия и ртути) называют также переходными элементами.
Четвёртый период (K–Kr) содержит 18 элементов. После K и Са (s-элементы) следует ряд из десяти (Sc – Zn) 3d-элементов (побочные подгруппы короткого варианта П. с. х. э.). Переходные элементы проявляют высшие степени окисления, в осн. равные номеру группы короткого варианта П. с. х. э. (исключая Co, Ni и Cu). Элементы от Ga до Kr относятся к гл. подгруппам (р-элементы).
Пятый период (Rb – Xe) построен аналогично четвёртому; в нём также имеется «вставка» из десяти переходных 4d-элементов (Y – Cd). Особенности изменения свойств в этом периоде: в триаде Ru – Rh – Pd рутений проявляет макс. степень окисления +8, родий +6, палладий +5; все элементы гл.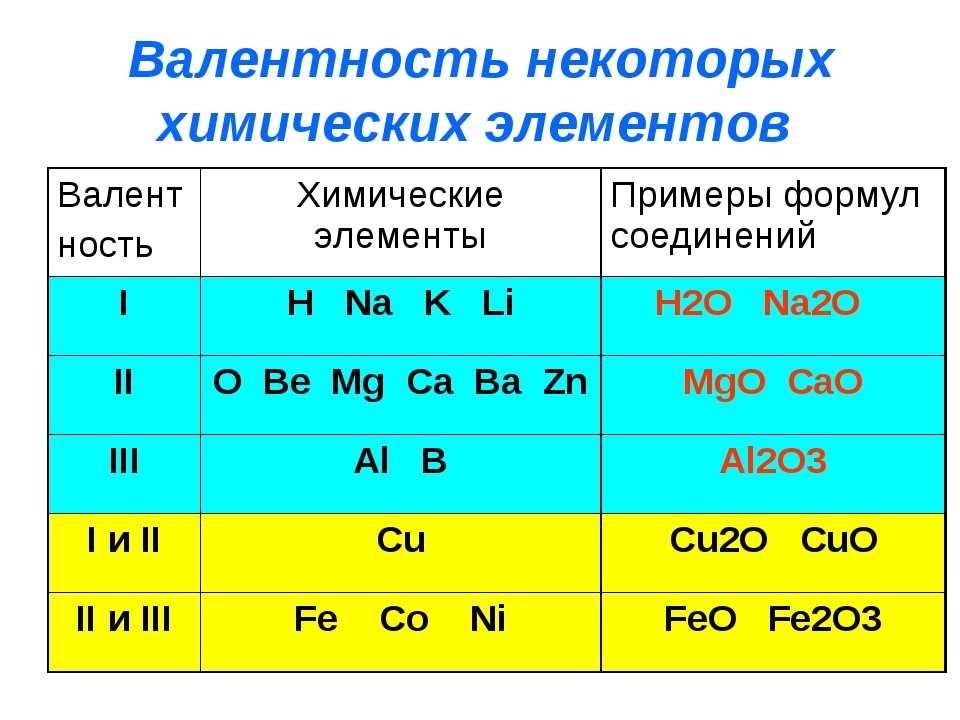 подгрупп, включая Хе, проявляют высшие степени окисления, равные номеру группы.
подгрупп, включая Хе, проявляют высшие степени окисления, равные номеру группы.
Шестой период (Сs – Rn) содержит 32 элемента. В него, помимо десяти 5d-элементов (La, Hf – Hg), входит семейство из четырнадцати 4f-элементов – лантаноидов (лантанидов, Ln). В степени окисления +3, +4 они являются химич. аналогами актиноидов, в степени окисления +2 – щёлочноземельных элементов. Лантаноиды размещены в группе 3 длинной формы, клетка La, и для удобства вынесены под таблицу. Особенностью элементов шестого периода является то, что в триаде Os – Ir – Pt два элемента – осмий и иридий – проявляют степень окисления +8, платина +6 (для Ir – данные 2010).
Седьмой период, подобно шестому, содержит 32 элемента. Актиний – аналог лантана. После Ас следует семейство из четырнадцати 5f-элементов – актиноидов (актинидов, An) (Z= 90–103). В П. с. х. э. их размещают в клетке Ас и, подобно Ln, записывают отд. строкой под таблицей. Этот приём предполагает наличие существенного химич. сходства элементов двух f-семейств. Именно на этом основывалась «актинидная концепция» Г. Сиборга (1944), сыгравшая ведущую роль при разработке методов разделения продуктов деления урана и поиске новых элементов. Однако эта концепция справедлива лишь для трёх- и четырёхвалентных An. Актиноиды же проявляют степени окисления от +2 до +7 (последняя характерна для Np, Pu, Am) и +8 (для плутония). Для наиболее тяжёлых An характерна стабилизация низших степеней окисления (+2 или даже +1 для Md).
их размещают в клетке Ас и, подобно Ln, записывают отд. строкой под таблицей. Этот приём предполагает наличие существенного химич. сходства элементов двух f-семейств. Именно на этом основывалась «актинидная концепция» Г. Сиборга (1944), сыгравшая ведущую роль при разработке методов разделения продуктов деления урана и поиске новых элементов. Однако эта концепция справедлива лишь для трёх- и четырёхвалентных An. Актиноиды же проявляют степени окисления от +2 до +7 (последняя характерна для Np, Pu, Am) и +8 (для плутония). Для наиболее тяжёлых An характерна стабилизация низших степеней окисления (+2 или даже +1 для Md).
Эксперим. оценки химии элементов с Z=104 (резерфордий) и Z=105 (дубний) позволили заключить, что они являются аналогами соответственно Hf и Та, т. е. 6d-элементами (должны располагаться в IVб и Vб подгруппах короткой формы). Химич. идентификация элементов с Z=106–118 не проводилась из-за слишком коротких «времён жизни» синтезированных изотопов, но в соответствии со структурой П. с. х. э. можно считать, что элементы Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn относятся к 6d-элементам, элементы c Z=113–118 близки соответственно вертикальным аналогам. Это же следует из совр. квантовохимич. расчётов.
Химич. идентификация элементов с Z=106–118 не проводилась из-за слишком коротких «времён жизни» синтезированных изотопов, но в соответствии со структурой П. с. х. э. можно считать, что элементы Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn относятся к 6d-элементам, элементы c Z=113–118 близки соответственно вертикальным аналогам. Это же следует из совр. квантовохимич. расчётов.
П. с. х. э. является важным звеном эволюции атомно-молекулярного учения, способствует уточнению представлений о простых веществах и соединениях, оказала значит. влияние на разработку теории строения атомов. С П. с. х. э. связана постановка проблемы прогнозирования в химии, что проявилось в предсказании как существования неизвестных элементов и их свойств, так и особенностей химич. поведения известных элементов. П. с. х. э. – основа неорганич. химии; служит задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, в частности сверхпроводников и полупроводников, подбору специфич. катализаторов для разл. химич. процессов и др. П. с. х. э. – науч. база преподавания общей и неорганич. химии, а также некоторых разделов атомной физики.
катализаторов для разл. химич. процессов и др. П. с. х. э. – науч. база преподавания общей и неорганич. химии, а также некоторых разделов атомной физики.
Группа периодической системы — это… Что такое Группа периодической системы?
Группа периодической системы химических элементов — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением.
Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома.
В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы. Подгруппы также имеют названия по элементу с наименьшим зарядом ядра (как правило, по элементу второго периода для главных подгрупп и элементу четвёртого периода для побочных подгрупп). Элементы одной подгруппы обладают сходными химическими свойствами.
Элементы одной подгруппы обладают сходными химическими свойствами.
С возрастанием заряда ядра у элементов одной группы из-за увеличения числа электронных оболочек увеличиваются атомные радиусы, вследствие чего происходит снижение электроотрицательности, усиление металлических и ослабление неметаллических свойств элементов, усиление восстановительных и ослабление окислительных свойств образуемых ими веществ.
Несмотря на то, что в России и в большинстве стран мира признаётся, что Дмитрий Иванович Менделеев изобрел периодическую таблицу, еще до «холодной войны» в США сформировалось мнение, что первооткрываетелем является Уильям Олдинг.
Нумерация групп
С 1989 года Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного варианта периодической системы утверждена длиннопериодная форма[1]. В связи с этим IUPAC рекомендует сплошную нумерацию групп: арабскими цифрами от 1 до 18.
Несмотря на это, продолжают применяться ставшие традиционными системы нумерации с использованием римских цифр и латинских букв, отличающиеся для Америки и Европы.
Современная система нумерации содержит следующие группы (старые системы, Европейская и Американская, приведены в скобках):
- Группа 1 (IA, IA): щелочные металлы
- Группа 2 (IIA, IIA): щёлочноземельные металлы
- Группа 3 (IIIB, IIIA): подгруппа скандия
- Группа 4 (IVB, IVA): подгруппа титана
- Группа 5 (VB, VA): подгруппа ванадия
- Группа 6 (VIB, VIA): подгруппа хрома
- Группа 7 (VIIB, VIIA): подгруппа марганца
- Группа 8 (VIIIВ, VIIIA): подгруппа железа
- Группа 9 (VIIIВ, VIIIA): подгруппа кобальта
- Группа 10 (VIIIВ, VIIIA): подгруппа никеля
- Группа 11 (IB, IB): подгруппа меди
- Группа 12 (IIB, IIB): подгруппа цинка
- Группа 13 (IIIA, IIIB): подгруппа бора
- Группа 14 (IVA, IVB): подгруппа углерода
- Группа 15 (VA, VB): подгруппа азота
- Группа 16 (VIA, VIB): подгруппа кислорода (халькогены)
- Группа 17 (VIIA, VIIB): галогены
- Группа 18 (VIIIA, VIIIB)[2]: инертные газы
Примечания
- ↑ Сайфуллин Р.
 С., Сайфуллин А.Р. Новая таблица Менделеева // Химия и жизнь.— 2003.— № 12.— С. 14—17.
С., Сайфуллин А.Р. Новая таблица Менделеева // Химия и жизнь.— 2003.— № 12.— С. 14—17. - ↑ Подгруппа гелия (инертные газы) иногда, особенно в старых изданиях, обозначается цифрой 0.
Периодическая система химических элементов Д. И. Менделеева. Группы
Периодическая система химических элементов Д. И. Менделеева. Группы☰
Группами называют вертикальные колонки периодической системы химических элементов. В коротком варианте таблицы выделяют восемь групп. Номер группы совпадает с высшей валентностью химического элемента, которую он может проявлять в оксидах. Так, углерод, находясь в IV группе, проявляет в соединении с кислородом высшую валентность IV (CO2). Кальций же валентен II (CaO), так как находится во второй группе.
В коротком варианте таблицы каждую группу делят на две подгруппы — главную и побочную. В побочную подгруппу входят только элементы больших периодов — переходные металлы.
В длинном варианте периодической системы подгрупп нет, а количество групп равно 18.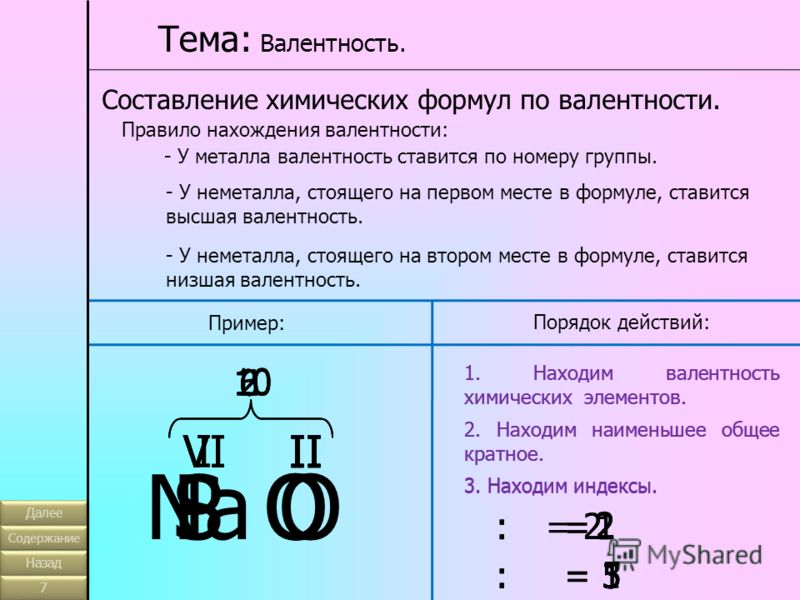
В коротком варианте таблицы группы обозначают римскими цифрами, а подгруппы буквами A (главная) и B (побочная). В длинном варианте группы обозначаются арабскими цифрами.
В подгруппах (рассматриваем короткий вариант) химические элементы имеют сходные свойства. Например, элементы подгруппы IA — это щелочные металлы, а подгруппы VIIA — галогены. Как известно, у всех щелочных металлов есть похожие свойства, галогены также сходны между собой. Однако в подгруппах свойства элементов закономерно изменяются сверху вниз (с увеличением относительной атомной массы). В главных подгруппах сверху вниз увеличиваются металлические свойства простых веществ соответствующих химических элементов. Неметаллические свойства соответственно убывают. Так, в подгруппе IIIA бор (B) не металл, а расположенный под ним в третьем периоде алюминий (Al) уже является металлом. В следующей главной подгруппе — IVA — неметаллами являются углерод, кремний и германий, а вот расположенные под ними олово и свинец — металлы.
В разных подгруппах одной группы свойства элементов различаются. Однако у них одинаковая высшая валентность, равная номеру группы.
Copyright © 2019. All Rights Reserved
Современная периодическая таблица: периоды и группы
Цели обучения
- Опишите организацию современной таблицы Менделеева.
Как английский словарь менялся с течением времени?
Язык меняется со временем. Новые слова входят в язык, а старые слова часто исчезают из-за отсутствия использования. Словари публикуются, чтобы люди могли успевать за изменениями в языке и знать, как правильно использовать слова.
Эти публикации могут быть печатными или электронными.Словари можно найти в Интернете, а приложения доступны для смартфонов. Словари неоценимы для хорошего и надежного общения.
Периодическая таблица Менделеева и Мозли претерпела значительные изменения. Было открыто много новых элементов, а другие синтезированы искусственно. Каждый правильно вписывается в группу элементов с аналогичными свойствами. Периодическая таблица представляет собой расположение элементов в порядке их атомных номеров, так что элементы с аналогичными свойствами появляются в одном вертикальном столбце или группе.
Каждый правильно вписывается в группу элементов с аналогичными свойствами. Периодическая таблица представляет собой расположение элементов в порядке их атомных номеров, так что элементы с аналогичными свойствами появляются в одном вертикальном столбце или группе.
На рисунке ниже показана наиболее часто используемая форма таблицы Менделеева. Каждый квадрат показывает химический символ элемента вместе с его названием. Обратите внимание, что некоторые символы кажутся не связанными с названием элемента: Fe для железа, Pb для свинца и т. Д. Большинство из этих элементов известны с древних времен и имеют символы, основанные на их латинских названиях. Атомный номер каждого элемента написан над символом.
Период — горизонтальная строка периодической таблицы.В периодической таблице есть семь периодов, каждый из которых начинается в крайнем левом углу. Новый период начинается, когда новый основной энергетический уровень начинает заполняться электронами.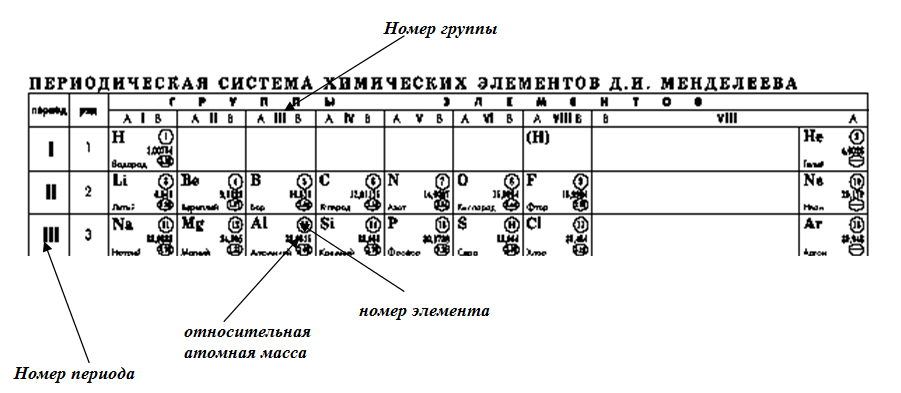 В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 — 8 элементов. Периоды 4 и 5 содержат 18 элементов. Периоды 6 и 7 содержат 32 элемента, потому что две нижние строки, которые отделены от остальной части таблицы, принадлежат этим периодам. Их выдвигают, чтобы сама таблица умещалась на одной странице.
В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 — 8 элементов. Периоды 4 и 5 содержат 18 элементов. Периоды 6 и 7 содержат 32 элемента, потому что две нижние строки, которые отделены от остальной части таблицы, принадлежат этим периодам. Их выдвигают, чтобы сама таблица умещалась на одной странице.
Группа представляет собой вертикальный столбец периодической таблицы, основанный на организации электронов внешней оболочки. Всего насчитывается 18 групп. Есть две разные системы нумерации, которые обычно используются для обозначения групп, и вы должны быть знакомы с обеими. Традиционная система, используемая в Соединенных Штатах, включает использование букв A и B. Первые две группы — это 1A и 2A, а последние шесть групп — от 3A до 8A. Средние группы используют B в своих названиях. К сожалению, в Европе действовала несколько иная система.Чтобы избежать путаницы, Международный союз теоретической и прикладной химии (IUPAC) решил, что официальная система нумерации групп будет простой от 1 до 18 слева направо.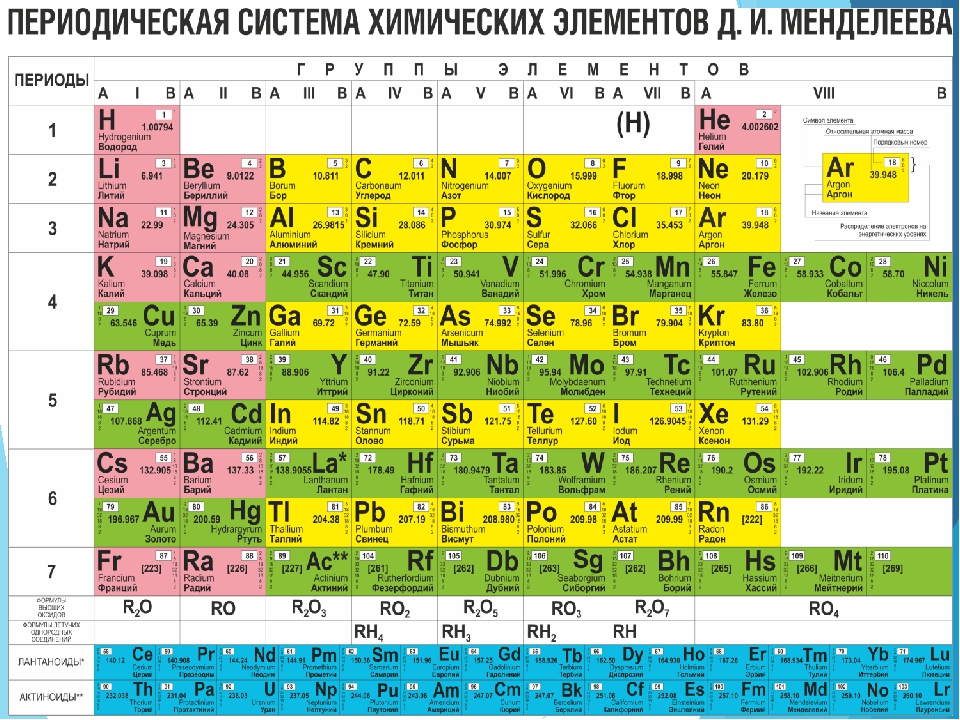 Многие периодические таблицы показывают обе системы одновременно.
Многие периодические таблицы показывают обе системы одновременно.
Сводка
- Таблица Менделеева расположена в порядке атомного номера .
- Период — это горизонтальная строка периодической таблицы.
- Группа представляет собой вертикальный ряд периодической таблицы Менделеева.
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http: // pontotriplo.org / triplepoint / 2007/05 / the_best_55_online_periodic_tables.html
- Выберите периодическую таблицу из столбца «лучший», который вам больше всего нравится. Почему вы выбрали этот стол?
- Какая таблица Менделеева из «конкретного» раздела вам больше всего нравится? Почему?
- Какая из «забавных» периодических таблиц вам нравится больше всего? Почему?
Обзор
- Чем сегодняшняя таблица Менделеева отличается от той, которую опубликовал Менделеев?
- Все ли элементы современной таблицы Менделеева встречаются в природе? Поясните свой ответ.

- Что такое «период?» Что это собой представляет?
- Что такое «группа»? Что это собой представляет?
- Почему для групп используются две разные системы нумерации?
Глоссарий
- группа: Элементы с аналогичными химическими свойствами появляются через определенные промежутки времени в вертикальных столбцах.
- период: Период — это горизонтальная строка периодической таблицы.
Определение группы по химии.
Примеры группы в следующих темах:
Функциональные группы
- Функциональные группы представляют собой атомы или небольшие группы атомов (от двух до четырех), которые проявляют характерную реакционную способность при обработке определенными реагентами.
- Определенная функциональная группа почти всегда проявляет свое характерное химическое поведение, когда она присутствует в соединении.

- Из-за их важности для понимания органической химии функциональные группы имеют характерные названия, которые часто переносятся в наименования отдельных соединений, включающих определенные группы .
- В следующей таблице атомы каждой функциональной группы окрашены в красный цвет, а характерный суффикс номенклатуры ИЮПАК, который обозначает некоторые (но не все) функциональные группы , также окрашен.
Функциональные группы
- В органической химии функциональная группа — это особая группа атомов или связей в соединении, которая отвечает за характерные химические реакции этого соединения.
- Функциональные группы также играют важную роль в номенклатуре органических соединений; объединение названий функциональных групп с названиями исходных алканов обеспечивает способ различать соединения.
- Функциональные группы играют важную роль в управлении органическими реакциями.

- Спирты представляют собой общую функциональную группу (-ОН).
- Определите термин «функциональная группа » применительно к органическим молекулам.
По функциональной группе
- Функциональные группы представляют собой атомы или небольшие группы атомов (обычно от двух до четырех), которые проявляют характерную реакционную способность при обработке определенными реагентами.
- Определенная функциональная группа почти всегда проявляет свое характерное химическое поведение, когда она присутствует в соединении.
- Из-за этого обсуждение органических реакций часто организовано в соответствии с функциональными группами .
- В следующей таблице обобщено общее химическое поведение общих функциональных групп .
- Для справки: алканы обеспечивают фон поведения в отсутствие более локализованных функциональных групп .
Групповые частоты
- Подробная информация об инфракрасном поглощении, наблюдаемом для различных связанных атомов и групп , обычно представлена в табличной форме.

- В следующей таблице представлены такие данные для наиболее распространенных функциональных групп .
- Данные инфракрасного поглощения для некоторых функциональных групп , не перечисленных в предыдущей таблице, приведены ниже.
- Подробная информация об инфракрасном поглощении, наблюдаемом для различных связанных атомов и групп , обычно представлена в табличной форме.
Родственные производные карбонила
- Другие функциональные группы , комбинации с карбонильной группой могут быть получены из карбоновых кислот и обычно рассматриваются как родственные производные.
- Как и в случае аминов, амиды классифицируются как 1º, 2º или 3º, в зависимости от количества алкильных групп , связанных с азотом.
- Функциональные группы такого типа встречаются во многих видах натуральных продуктов.
- Некоторые примеры показаны ниже с функциональной группой , окрашенной в красный цвет.
- Греческая буква определяет расположение азота относительно карбонильной группы амида.

Номенклатура карбоновых кислот
- Карбоксильная функциональная группа , которая характеризует карбоновые кислоты, необычна тем, что она состоит из двух функциональных групп , описанных ранее в этом тексте.
- Как видно из приведенной ниже формулы, карбоксильная группа состоит из гидроксильной группы , связанной с карбонильной группой .
- Другие комбинации функциональных групп были описаны ранее, и были описаны значительные изменения в химическом поведении в результате взаимодействий между группами и (например, фенол и анилин).
- Как и в случае с альдегидами, карбоксильная группа должна располагаться в конце углеродной цепи.
- Для этой группы соединений одна такая фраза: «О, мой такой хороший яблочный пирог».
Реакции спирта
- Функциональная группа спиртов представляет собой гидроксильную группу , –OH.

- В отличие от алкилгалогенидов, эта группа имеет две реактивные ковалентные связи, связь C – O и связь O – H.
- Следовательно, ковалентные связи этой функциональной группы поляризованы, так что кислород богат электронами, а углерод и водород являются электрофильными, как показано на рисунке ниже.
- Действительно, диполярная природа связи O – H такова, что спирты являются гораздо более сильными кислотами, чем алканы (примерно в 1030 раз), и почти настолько же сильнее, чем простые эфиры (замещенные кислородом алканы, не содержащие группы O – H ). ).
- Наиболее реактивным участком в молекуле спирта является гидроксильная группа , несмотря на то, что прочность связи O – H значительно выше, чем у связей C – C, C – H и C – O, что еще раз демонстрирует разницу между термодинамической и химической стабильностью.
- Функциональная группа спиртов представляет собой гидроксильную группу , –OH.
Спирты
- Спирты представляют собой функциональные группы , характеризующиеся наличием группы -ОН .

- Спирты — это органические соединения, в которых гидроксильная функциональная группа (-ОН) связана с атомом углерода.
- Наличие групп -ОН позволяет образовывать водородные связи с другими группами -ОН , атомами водорода и другими молекулами.
- Гидроксильные группы сами по себе не считаются хорошими, оставляя группы .
- Спирты характеризуются присутствием группы -ОН , которая обычно имеет изогнутую форму, как у воды.
- Спирты представляют собой функциональные группы , характеризующиеся наличием группы -ОН .
Алканы
- Примеры некоторых распространенных алкильных групп приведены в следующей таблице.
- Обратите внимание, что суффикс «ane» заменяется на «yl» в названии группы .
- Символ R используется для обозначения родовой (неуказанной) алкильной группы .
- Пронумеруйте цепь последовательно, начиная с конца, ближайшего к заместителю группы .
- Обозначьте расположение каждого заместителя группы соответствующим номером и именем.

Изменение физических свойств внутри группы
- В химии группа представляет собой вертикальный столбец в периодической таблице химических элементов.
- Различные группы демонстрируют разные тенденции в температурах кипения и плавления.
- Для групп 1 и 2 точки кипения и плавления уменьшаются по мере продвижения вниз по группе .
- В основной группе элементов семейства бора и углерода (группы 13 и 14) уменьшаются в своих температурах кипения и плавления по мере продвижения вниз по группе , тогда как семейства азота, кислорода и фтора (группы ) 15, 16 и 17) имеют тенденцию к увеличению в обоих случаях.
- Благородные газы (группа , 18) понижаются в своих температурах кипения и плавления до группы .
Определение группы по химии.
Примеры группы в следующих темах:
Функциональные группы
- Функциональные группы представляют собой атомы или небольшие группы атомов (от двух до четырех), которые проявляют характерную реакционную способность при обработке определенными реагентами.

- Определенная функциональная группа почти всегда проявляет свое характерное химическое поведение, когда она присутствует в соединении.
- Из-за их важности для понимания органической химии функциональные группы имеют характерные названия, которые часто переносятся в наименования отдельных соединений, включающих определенные группы .
- В следующей таблице атомы каждой функциональной группы окрашены в красный цвет, а характерный суффикс номенклатуры ИЮПАК, который обозначает некоторые (но не все) функциональные группы , также окрашен.
- Функциональные группы представляют собой атомы или небольшие группы атомов (от двух до четырех), которые проявляют характерную реакционную способность при обработке определенными реагентами.
Функциональные группы
- В органической химии функциональная группа — это особая группа атомов или связей в соединении, которая отвечает за характерные химические реакции этого соединения.
- Функциональные группы также играют важную роль в номенклатуре органических соединений; объединение названий функциональных групп с названиями исходных алканов обеспечивает способ различать соединения.

- Функциональные группы играют важную роль в управлении органическими реакциями.
- Спирты представляют собой общую функциональную группу (-ОН).
- Определите термин «функциональная группа » применительно к органическим молекулам.
По функциональной группе
- Функциональные группы представляют собой атомы или небольшие группы атомов (обычно от двух до четырех), которые проявляют характерную реакционную способность при обработке определенными реагентами.
- Определенная функциональная группа почти всегда проявляет свое характерное химическое поведение, когда она присутствует в соединении.
- Из-за этого обсуждение органических реакций часто организовано в соответствии с функциональными группами .
- В следующей таблице обобщено общее химическое поведение общих функциональных групп .
- Для справки: алканы обеспечивают фон поведения в отсутствие более локализованных функциональных групп .

Групповые частоты
- Подробная информация об инфракрасном поглощении, наблюдаемом для различных связанных атомов и групп , обычно представлена в табличной форме.
- В следующей таблице представлены такие данные для наиболее распространенных функциональных групп .
- Данные инфракрасного поглощения для некоторых функциональных групп , не перечисленных в предыдущей таблице, приведены ниже.
Родственные производные карбонила
- Другие функциональные группы , комбинации с карбонильной группой могут быть получены из карбоновых кислот и обычно рассматриваются как родственные производные.
- Как и в случае аминов, амиды классифицируются как 1º, 2º или 3º, в зависимости от количества алкильных групп , связанных с азотом.
- Функциональные группы такого типа встречаются во многих видах натуральных продуктов.

- Некоторые примеры показаны ниже с функциональной группой , окрашенной в красный цвет.
- Греческая буква определяет расположение азота относительно карбонильной группы амида.
Номенклатура карбоновых кислот
- Карбоксильная функциональная группа , которая характеризует карбоновые кислоты, необычна тем, что она состоит из двух функциональных групп , описанных ранее в этом тексте.
- Как видно из приведенной ниже формулы, карбоксильная группа состоит из гидроксильной группы , связанной с карбонильной группой .
- Другие комбинации функциональных групп были описаны ранее, и были описаны значительные изменения в химическом поведении в результате взаимодействий между группами и (например, фенол и анилин).
- Как и в случае с альдегидами, карбоксильная группа должна располагаться в конце углеродной цепи.
- Для этой группы соединений одна такая фраза: «О, мой такой хороший яблочный пирог».

Реакции спирта
- Функциональная группа спиртов представляет собой гидроксильную группу , –OH.
- В отличие от алкилгалогенидов, эта группа имеет две реактивные ковалентные связи, связь C – O и связь O – H.
- Следовательно, ковалентные связи этой функциональной группы поляризованы, так что кислород богат электронами, а углерод и водород являются электрофильными, как показано на рисунке ниже.
- Действительно, диполярная природа связи O – H такова, что спирты являются гораздо более сильными кислотами, чем алканы (примерно в 1030 раз), и почти настолько же сильнее, чем простые эфиры (замещенные кислородом алканы, не содержащие группы O – H ). ).
- Наиболее реактивным участком в молекуле спирта является гидроксильная группа , несмотря на то, что прочность связи O – H значительно выше, чем у связей C – C, C – H и C – O, что еще раз демонстрирует разницу между термодинамической и химической стабильностью.

Спирты
- Спирты представляют собой функциональные группы , характеризующиеся наличием группы -ОН .
- Спирты — это органические соединения, в которых гидроксильная функциональная группа (-ОН) связана с атомом углерода.
- Наличие групп -ОН позволяет образовывать водородные связи с другими группами -ОН , атомами водорода и другими молекулами.
- Гидроксильные группы сами по себе не считаются хорошими, оставляя группы .
- Спирты характеризуются присутствием группы -ОН , которая обычно имеет изогнутую форму, как у воды.
Алканы
- Примеры некоторых распространенных алкильных групп приведены в следующей таблице.
- Обратите внимание, что суффикс «ane» заменяется на «yl» в названии группы .
- Символ R используется для обозначения родовой (неуказанной) алкильной группы .

- Пронумеруйте цепь последовательно, начиная с конца, ближайшего к заместителю группы .
- Обозначьте расположение каждого заместителя группы соответствующим номером и именем.
Изменение физических свойств внутри группы
- В химии группа представляет собой вертикальный столбец в периодической таблице химических элементов.
- Различные группы демонстрируют разные тенденции в температурах кипения и плавления.
- Для групп 1 и 2 точки кипения и плавления уменьшаются по мере продвижения вниз по группе .
- В основной группе элементов семейства бора и углерода (группы 13 и 14) уменьшаются в своих температурах кипения и плавления по мере продвижения вниз по группе , тогда как семейства азота, кислорода и фтора (группы ) 15, 16 и 17) имеют тенденцию к увеличению в обоих случаях.
- Благородные газы (группа , 18) понижаются в своих температурах кипения и плавления до группы .

Определение репрезентативного элемента | Sciencing
Периодическая таблица элементов в том виде, в котором она известна сегодня, была разработана русским химиком Дмитрием Менделеевым и впервые представлена в немецком химическом издании Zeitschrift f? R Chemie в 1869 году.Менделеев изначально создал свою «Периодическую систему», записав свойства элементов на кусочки карточек и расположив их в порядке увеличения атомного веса. Менделеев также определил, что относительная атомная масса некоторых элементов была рассчитана неправильно. Исправив это, он смог разместить элементы на их правильных местах в таблице. Менделеев также оставил места для элементов, которые еще не были обнаружены. По состоянию на июнь 2010 года периодическая таблица Менделеева содержит 118 подтвержденных элементов.
В периодической таблице элементов столбцы элементов определяют группы элементов, которые имеют много общих свойств. В периодической таблице есть два набора групп. Первый набор — это элементы группы А, также известные как репрезентативные элементы. Второй набор — это элементы группы B, также известные как переходные металлы. Репрезентативные элементы — это самые распространенные элементы на Земле.
Первый набор — это элементы группы А, также известные как репрезентативные элементы. Второй набор — это элементы группы B, также известные как переходные металлы. Репрезентативные элементы — это самые распространенные элементы на Земле.
Типичные элементы и структура периодической таблицы
В Периодической таблице элементов элементы расположены в столбцах, известных как «группы», и строках, известных как «периоды».\ «Группы содержат элементы со схожими свойствами, которые имеют одинаковое расположение электронов в их внешних оболочках, известные как \» валентные электроны \ «, которые определяют свойства элемента и его химическую реакционную способность, а также то, как он будет участвовать в химической связи. Римские цифры над каждой группой обозначают обычное количество валентных электронов.
Группы далее делятся на типичные элементы и переходные металлы. Группы 1A и 2A слева и 3A — 8A справа классифицируются как репрезентативные элементы, в то время как эти элементы промежуточные классифицируются как переходные металлы. Типичные элементы также известны как «Группа A», «Блочные элементы S и P» или «Элементы основной группы».
Типичные элементы также известны как «Группа A», «Блочные элементы S и P» или «Элементы основной группы».
Значение компоновки
Компоновка периодической таблицы демонстрирует повторяющиеся химические свойства . Элементы перечислены в порядке возрастания атомного номера (числа протонов в атомном ядре) и расположены так, что элементы с аналогичными свойствами попадают в одни и те же столбцы. Элементы перечислены с, среди прочего, их символом элемента, атомным номером и атомной массой.
Список типичных элементов в блоке S
Элементы блока S или элементы в столбцах 1A и 2A слева от периодической таблицы включают водород (H), литий (Li), натрий (Na), калий (K) . Рубидий (Rb), цезий (Cs), франций (Fr), бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Список типичных элементов в блоке P
Элементы блока P или элементы в столбцах с 3A по 8A справа периодической таблицы включают:
- Бор (B)
- Алюминий (Al)
- Галлий (Ga)
- Индий (In)
- Таллий (Tl)
- Углерод (C)
- Кремний (Si)
- Германий (Ge)
- Олово (Sn)
- Pb)
- Унунквадиум (Uuq)
- Азот (N)
- Фосфор (P)
- Мышьяк (As)
- Сурьма (Sb)
- Висмут )
- Сера (S)
- Селен (Se)
- Теллур (Te)
- Полоний (Po)
- Фторид (F)
- Хлор (Cl)
- Йод (I)
- Астатин (At)
- Гелий (He)
- Неон (Ne)
- Аргон (Ar)
- Криптон (Kr)
- Радон (Rn)
90 694
Использование Периодической таблицы
Одним из основных применений периодической таблицы является предсказание химических свойств элемента на основе его местоположения. Менделеев использовал тенденции в своей таблице, чтобы предсказать свойства пяти элементов, которые еще не были обнаружены в то время, когда он построил свою таблицу. Размер атома, способность образовывать химическую связь и энергия, необходимая для удаления электрона, уменьшаются при движении слева направо через период и увеличиваются при движении вниз по столбцу.
Менделеев использовал тенденции в своей таблице, чтобы предсказать свойства пяти элементов, которые еще не были обнаружены в то время, когда он построил свою таблицу. Размер атома, способность образовывать химическую связь и энергия, необходимая для удаления электрона, уменьшаются при движении слева направо через период и увеличиваются при движении вниз по столбцу.
элементов
элементов Элементы расположены в периодической таблице по реакционной способности.
Элементы с аналогичной реакционной способностью помещаются в один столбец или группу . У некоторых из этих групп есть особые названия. Элементы в группе IA называются щелочными металлами .
Элементы в группе IIA называются щелочноземельными металлами , .
Элементы в группе VIIA называются галогенами , и галогенами. Элементы в группе VIIIA называются благородными газами или инертными газами .
Металлы в группе IB (медь, серебро и золото) иногда называют металлами. чеканка металлов .Колонны
с B (с IB по VIIIB) называются переходными элементами .
Столбцы с буквой A (от IA до VIIIA) называются основной группой .
элементы .
Элементы в группе VIIIA называются благородными газами или инертными газами .
Металлы в группе IB (медь, серебро и золото) иногда называют металлами. чеканка металлов .Колонны
с B (с IB по VIIIB) называются переходными элементами .
Столбцы с буквой A (от IA до VIIIA) называются основной группой .
элементы .
Элементы также можно разделить на две основные группы: металлы и неметаллы. Металлы обычно имеют металлический блеск (блестящие), пластичны (сгибаются) и проводят электричество. Неметаллы обычно не проявляют этих свойств. Есть некоторые элементы, которые показывают некоторые, но не все, металлические характеристики. Эти элементы называются металлоидами и обозначаются здесь как полупроводники.
Электроны — это клей, который скрепляет атомы в соединениях.
Электроны внешней оболочки образуют эти связи между
атомы. Первые два квантовых числа n (оболочка) и l (подоболочка) оба важны в
понимание связи. В этом
класс мы ориентируемся на оболочку.В
оболочки соответствуют орбитам модели Бора.
(См. Лекцию 10.3)
В этом
класс мы ориентируемся на оболочку.В
оболочки соответствуют орбитам модели Бора.
(См. Лекцию 10.3)
Первая оболочка самая маленькая, поэтому она может содержать максимум 2 электрона. Вторая оболочка может содержать максимум 8 электронов. Третья оболочка может содержать не более 18 электронов, но она особенно стабилен на 8 электронах.
Поскольку реагируют внешние оболочки, нас больше всего интересуют электроны внешней оболочки. Мы можем обозначьте количество электронов во внешней оболочке точками. Внешняя оболочка получила название валентных электронов. Официально валентные электроны — это электроны на внешней оболочке незаряженный атом. Хлор имеет 7 электронов в его внешней оболочке и поэтому может представить его как Cl с семью точки вокруг него.
становится . Обратите внимание, как 2 электрона в
первая оболочка и 8 электронов во второй являются электронами внутренней оболочки и являются
не написано точками. Вот
диаграмма основных элементов группы и их точечные символы Льюиса.
Обратите внимание, что для элементов основной группы количество валентных электронов равно равняется номеру группы.
номер группы таблицы Менделеева
На этом уровне все, что мы делаем в дополнение к элементам в этой части Периодической таблицы, — это более подробно рассматриваем целые группы 1, 2, 14, 17 и 18. Но мы фактически игнорируем другие элементы в этой части Периодической таблицы. центр стола.
Почему я не использую систему IUPAC?
На это есть две причины:
В учебных программах Великобритании, которые я отслеживаю, он не используется на момент написания (октябрь 2012 г.).Хотя Chemguide используется во всем мире, моя целевая аудитория состоит из студентов, сдающих экзамены уровня A (и эквивалентные) в Великобритании.
Даже если бы они использовали систему IUPAC, я был бы недоволен ее использованием. Я думаю, что это вызывает серьезные проблемы при обучении химии на начальном уровне.
 Подробнее об этом позже.
Подробнее об этом позже.
Я использую упрощенную версию старой системы. Обозначение, которое я использую для части Периодической таблицы, показанной выше:
Это также система, используемая нынешними экзаменаторами Великобритании.
В этой системе основные группы (показаны красным и зеленым) пронумерованы от 1 до 8 (или от 1 до 7, а затем 0 — благородные газы иногда описываются как Группа 8, иногда как Группа 0).
Элементам d-блока (показаны синим) не нужно давать номера групп на этом уровне, потому что мы практически никогда не смотрим ни на один из них, кроме элементов в первой строке.
Традиционно, попытка дать номера групп элементов d-блока приводила к совершенно запутанной системе нумерации, включающей подгруппы A и B, с такими именами, как группа VIA и IVB (это 6A и 4B) и так далее.
Это было еще хуже, потому что использование букв A и B в США было полностью противоположным тому, что было в Европе.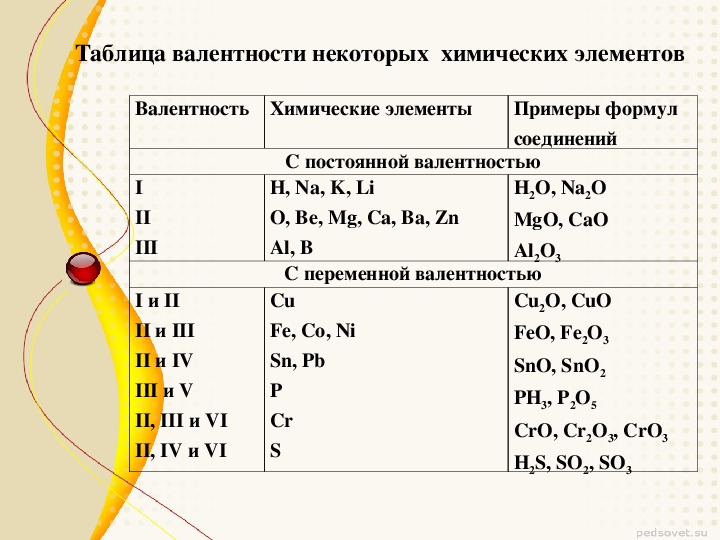 И поэтому IUPAC разобрал все, пронумеровав все от 1 до 18.
И поэтому IUPAC разобрал все, пронумеровав все от 1 до 18.
Основной недостаток использования системы IUPAC
Так почему же, если система ИЮПАК намного аккуратнее, не все ее используют?
Система ИЮПАК искажает то, как Периодическая таблица Менделеева впервые была представлена как важный инструмент в изучении химии.
Обучение электронной структуре первых 20 элементов (вплоть до Ca) напрямую связано с Периодической таблицей. Студенты могут видеть, что элементы в одной группе имеют одинаковое количество внешних электронов (за одним исключением гелия).
И, более того, количество внешних электронов совпадает с номером группы — до тех пор, пока вы не используете текущую систему IUPAC.
Итак, если элемент находится в группе 2, у него есть 2 внешних электрона. Таким образом, даже если вы не можете определить полную структуру, вы знаете, что у бария есть 2 внешних электрона.Точно так же, если вы обнаружите, что йод находится в группе 7, вы знаете, что у него 7 внешних электронов.
За исключением элементов в группах 1 и 2, это явно не работает, если вы используете версию IUPAC.
Наличие простого способа определения количества внешних электронов напрямую связано с возможностью легко вычислить заряды многих простых ионов, что логически приводит к написанию химических формул.
Таким образом, простой факт наличия групповых номеров, равных количеству внешних электронов, делает в остальном утомительный и загадочный процесс разработки формул относительно простым и понятным.
Наверное, нет смысла во всем преподавании химии полностью отвлечь учащихся от предмета, чем введение в атомную структуру и формулы. Система нумерации IUPAC просто усложняет задачу.
Есть ли недостатки в использовании метода нумерации, отличного от IUPAC, на этом уровне?
«… на этом уровне»? По сути, это все, что ниже степени.
Нет, минусов нет. Нумерация IUPAC позволяет вам четко прикреплять номера к группам d-блоков. Но нам никогда не нужно этого делать.
Но нам никогда не нужно этого делать.
За всю жизнь преподавания химии ученикам в возрасте до 18 лет я никогда не исследовал групповые тенденции в элементах d-блока. Фактически, очень мало элементов, которые даже упоминаются за пределами первой строки.
На самом деле, не глядя, я даже не знаю, какие элементы лежат под железом, например, в Периодической таблице! И это в равной степени верно для всех групп d-блока, кроме двух (я могу делать группы меди и цинка!).Меня это беспокоит? Ни в коей мере — ученикам безразлично, что я пытаюсь помочь.
И хотя я посмотрел на старую систему нумерации на примере из химии для 14-16-летних, она все еще актуальна на следующем этапе. По-прежнему полезно иметь возможность найти, скажем, фосфор в Периодической таблице и знать (не задумываясь), что, поскольку он находится в группе 5, он имеет 5 внешних электронов, а затем продолжить оттуда.
Нумерация ИЮПАК может упорядочить жизнь университетских людей, но делает беспорядок важным инструментом обучения для остальных из нас. Мне это не кажется хорошей сделкой.
Мне это не кажется хорошей сделкой.
Элементы основной группы — определение и важность
Элементы основной группы — это группы 1, 2 и 13-18 периодической таблицы.Элементы основной группы — это химические элементы, принадлежащие s-блоку и p-блоку в периодической таблице. Это элементы в группе 1 и группе 2 (s-блок) и группах с 13 по 18 (p-блок). В старых системах нумерации групп IUPAC основными элементами группы являются группы IA, IIA и от IIIA до VIIIA.Когда периодическая таблица разделена таким образом, другими основными категориями элементов являются переходные металлы и внутренние переходные металлы.
Элементы s-блока — это щелочные и щелочноземельные металлы. Элементами p-блока являются основные металлы, металлоиды, неметаллы, галогены и благородные газы. Примеры элементов основной группы включают гелий, литий, бор, углерод, азот, кислород, фтор и неон.
Элементы, которые являются элементами основной группы , а не , — это переходные металлы (такие как титан, медь и золото), лантаноиды (такие как лантан и эрбий) и актиниды (такие как актиний и плутоний). Некоторые люди не включают сверхтяжелые элементы от мейтнерия (атомный номер 109) до оганессона (атомный номер 118), потому что было синтезировано слишком мало атомов, чтобы проверить их свойства, и потому что эти свойства сильно зависят от релятивистских эффектов. Иногда элемент водород (атомный номер 1) исключается как элемент основной группы.
Некоторые люди не включают сверхтяжелые элементы от мейтнерия (атомный номер 109) до оганессона (атомный номер 118), потому что было синтезировано слишком мало атомов, чтобы проверить их свойства, и потому что эти свойства сильно зависят от релятивистских эффектов. Иногда элемент водород (атомный номер 1) исключается как элемент основной группы.
Другие элементы основной группы
Некоторые ученые считают, что элементы группы 12 (цинк, кадмий и ртуть) должны быть включены в качестве элементов основной группы, потому что они имеют общие свойства с элементами справа от них в таблице.Некоторые ученые включают элементы 3 группы (скандий и иттрий), а иногда и лантаноиды и актиниды.
Свойства элемента основной группы
Свойства элемента основной группы зависят от того, являются ли они элементами s-блока или p-блока:
Свойства элемента S-блока
- Элементы s-блока имеют одну степень окисления.
- Их общая валентная конфигурация — Их общая валентная конфигурация — n s 1-2 .

- Элементы группы 1 (щелочные металлы) имеют степень окисления +1.Элементы 2 группы (щелочноземельные металлы) имеют степень окисления +2.
- Все элементы s-блока, за исключением гелия, обладают высокой реакционной способностью.
- Металлы s-блока обычно мягкие, с низкими температурами плавления и кипения.
- Металлы S-образных блоков обладают высокой электроположительностью. Они образуют ионные соединения с неметаллами.
- Большинство элементов s-block придают цвет пламени.
Свойства элемента P-блока
- Элементы p-блока характеризуются наличием нескольких степеней окисления, часто разделенных двумя единицами.Например, степени окисления серы: -2 , 0, +2 , +4 и +6 .
- Но степень окисления и другие свойства зависят от группы. Элементы группы 17 (галогены) имеют степень окисления -1, а элементы группы 18 (благородные газы) имеют степень окисления 0.
- Общая степень окисления металлов p-блока составляет n s 2 n p 1–6 .
 Их валентный электрон находится на р-орбитали.
Их валентный электрон находится на р-орбитали. - Элементы P-блока включают неметаллы, металлоиды и металлы, поэтому их свойства зависят от их группы.
Важность элементов основной группы
Элементы основной группы важны по нескольким причинам:
- Элементы основной группы, наряду с несколькими легкими переходными металлами, являются наиболее распространенными элементами во Вселенной и на Земле. Они составляют 80% земной коры. По этой причине элементы основной группы также называются репрезентативными элементами .
- Эти элементы имеют решающее значение для поддержания жизни. Биологическим молекулам необходимы элементы основных групп, особенно углерод, кислород, водород, азот, сера и фосфор.
- Элементы основной группы и их соединения относятся к наиболее экономически важным элементам. Большинство выпускаемых продуктов содержат эти элементы.
Ссылки
- IUPAC (2004). Номенклатура неорганической химии .


 С., Сайфуллин А.Р. Новая таблица Менделеева // Химия и жизнь.— 2003.— № 12.— С. 14—17.
С., Сайфуллин А.Р. Новая таблица Менделеева // Химия и жизнь.— 2003.— № 12.— С. 14—17.
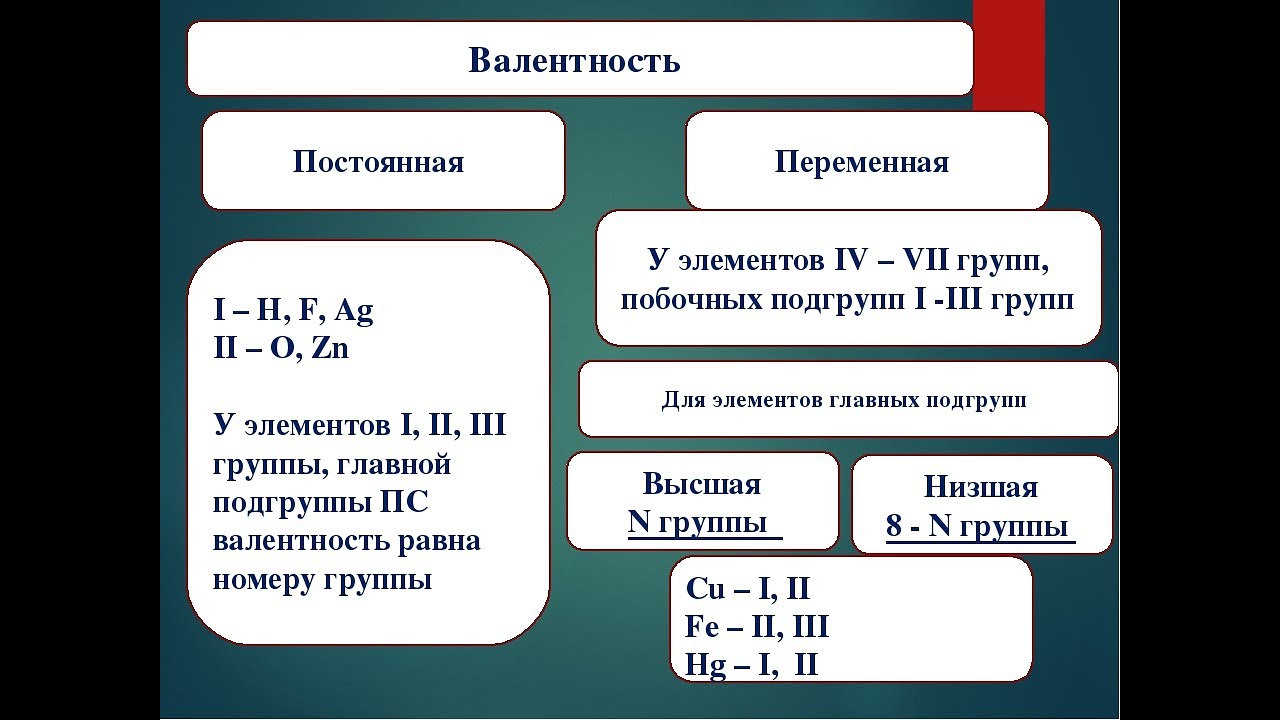



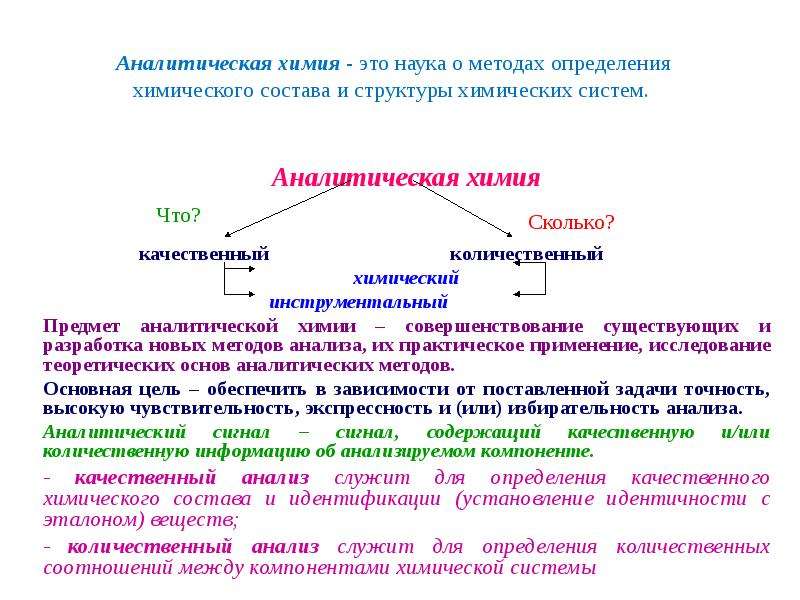

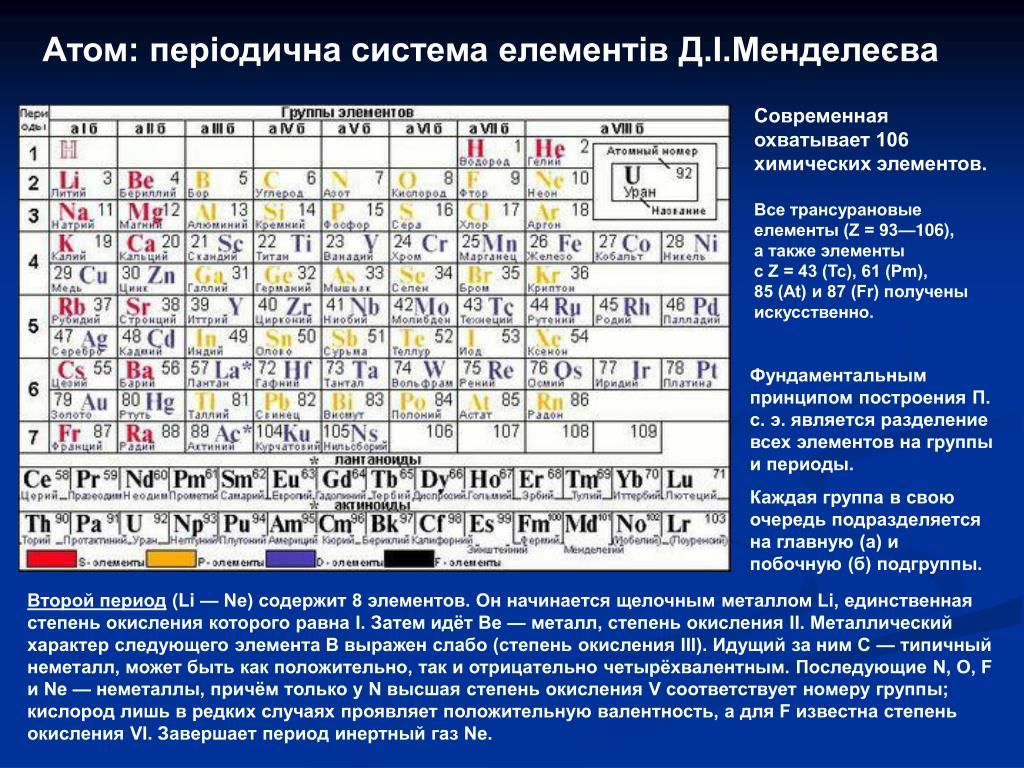

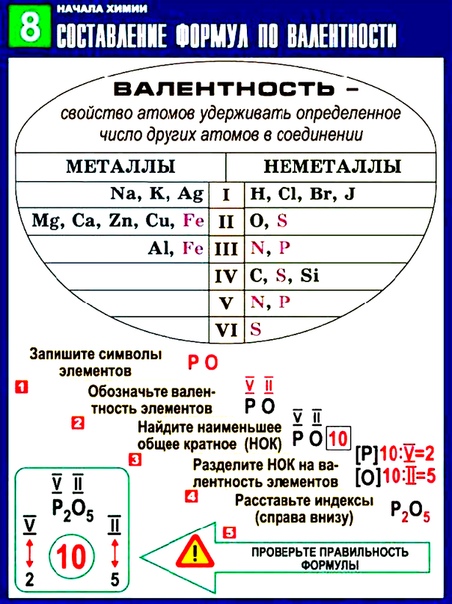






 Подробнее об этом позже.
Подробнее об этом позже.
 Их валентный электрон находится на р-орбитали.
Их валентный электрон находится на р-орбитали.
Leave A Comment