синтез глицина + уравнения реакций и много формул
Синтез аминокислоты глицина постоянно происходит в организме человека, обеспечивая расходным материалом для производства белков, гормонов, биологически-активных молекул. Прочитайте статью до конца, и вы узнаете механизмы реакций, протекающих в организме для синтеза глицина. Из чего образуется глицин, где он образуется и какие дополнительные компоненты необходимы для синтеза глицина. С вами Галина Батуро и аминокислота глицин.
Синтез глицина

Аминокислота глицин является заменимой протеиногенной аминокислотой. Это значит, что глицин входит в состав белков. Он присутствует в больших количествах в желатине, в виде амида он является составной частью гормонов вазопрессина и окситоцина. Вазопрессин, как явствует из его названия, это гормон, сужающий сосуды и поднимающий артериальное давление. Окситоцин – это гормон, способствующий сокращению гладкой мускулатуры, в большом количестве он выделяется во время родов, заставляя сокращаться матку и выталкивать плод из чрева.
Глицин входит в состав глутатиона, гиппуровой и гликохолевой кислот. В организме человека также вырабатывается N-метил-производное глицина – саркозин. Это производное холина и аминокислоты метионина.
Глицин является источником таких важных метаболитов, как креатин, пуриновые основания и порфирины, из которых образуется белок крови гемоглобин.
Будучи заменимой аминокислотой, глицин может легко синтезироваться в организме. Он образуется в процессе следующих реакций: расщепление аминокислоты серина, синтез из воды и аммиака, аминирование глиоксиловой кислоты, деметилирование саркозина.
Синтез глицина из серина
90% глицина синтезируется в организме из аминокислоты серин, тоже заменимой и протеиногенной. Углеродный скелет серин получает от 3-фосфоглицерата, промежуточного продукта распада глюкозы, а аминную голову предоставляет глутаминовая кислота. Казалось бы, при таких делах организм не должен бы испытывать недостаток глицина: глюкозу мы всегда получаем в избытке, и глутаминовая кислота, которая глутамат, обильно представлена в рационе. Однако засада подстерегает, где не ждешь. И называется она витамин B9, иначе говоря, фолиевая кислота, которую по идее мы должны получать со свежими листьями и травками. В нашей полосе, где девять месяцев зима, это особенно актуально.
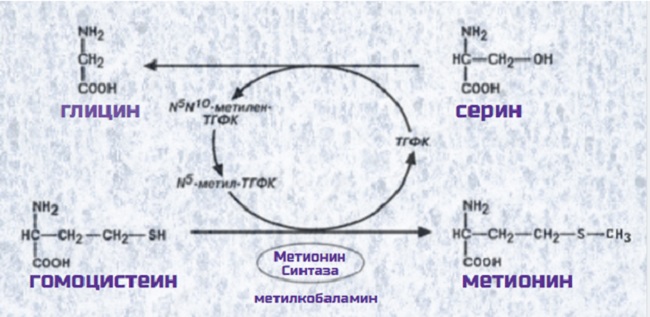
В синтезе глицина задействована активная форма витамина B9 (фолиевой кислоты) – Н4-Фолат, он же ТетраГидроФолиевая Кислота (ТГФК).

Образование ТГФК из фолиевой кислоты происходит в печени, это сложный каскад реакций, в которых задействованы особые ферменты, коферментом которых выступает НАДФ. Образовавшаяся ТГФК вступает в реакцию с серином при участии фермента СеринОксиМетилТрансфераза.

ТГФК принимает на себя метильную группу CH3, находящуюся в β-положении, и превращается N5N10МетиленН4Фолат, а спиртовая группа отщепляется в виде воды. Что значит это зубодробительное название? Фолат – это сокращенно фолиевая кислота, ибо соединение имеет гидроксильный хвост COOH. Метилен – означает, что соединение приняло на себя метильную группу CH2, причем приняли ее молекулы азота N в положении 5 и 10.

Реакция легко обратима, т.е. глицин может стать источником серина. В этом случае N5N10МетиленН4Фолат отдает метильную группу глицину, а вода станет источником спиртовой группы для серина. N5N10МетиленН4Фолат, образующийся вместе с глицином, быстренько превращается в N5 МетилН4Фолат, который задействован в обезвреживании страшного гомоцистеина, превращая его в нужную аминокислоту метионин. В реакции принимает участие активная форма витамина B12 метилкобаламин.
Чем опасен гомоцистеин можно узнать: Дмитрий Быков: ожидаемый исход метаболического синдрома
Синтез глицина из треонина
Долгое время считалось, что распад треонина с образованием глицина идет в клетках печени (гепатоцитах) под воздействием фермента ТреонинАльдолазы. В учебниках рисовали красивое уравнение реакции, приведенное ниже. Не обманывайтесь, насчет обратимости реакции. Уже тогда подчеркивалось, что реакция в живых организмах преимущественно идет в сторону распада треонина с образованием глицина и ацетальдегида. Обратный синтез треонина в живых организмах не наблюдался.

В настоящее время стало известно, что фермент ТреонинАльдолаза расщепляет с образованием глицина не L-треонин, содержащийся в белках, а стереоизомер алло-треонин, который в синтезе белков не участвует (1).
Образование глицина при распаде треонина долгое время считался возможным в митохондриях под воздействием фермента ТреонинДегидрогеназы, активность которого зависит от НАД. В результате образуется аминоацетон, который окисляется до α-АминоАцетоУксусной Кислоты, а та, в свою очередь является предшественницей глицина. Следует отметить, что человек в процессе эволюции утратил способность к синтезу ТреонинДегидрогеназы, следовательно образование глицина из треонина в человеческом организме не возможно (2).
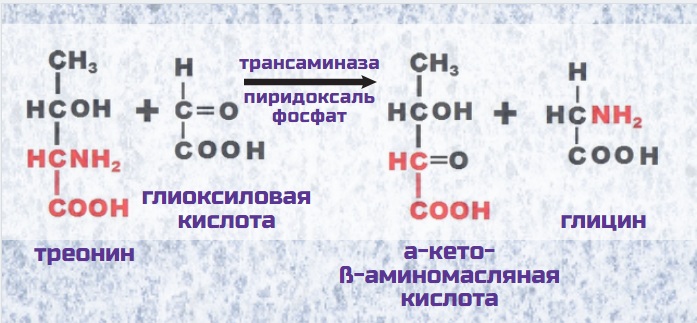
В печени человека в процессе обезвреживания глиоксиловой кислоты (о чем дальше), треонин может переаминироваться под воздействием фермента КинуренинАминоТрансферазы, который оказался идентичным СеринПируватАминоТрансферазе и АланинГлиоксилАминоТрансферазе. В пероксисомах печени в присутствии ПиридоксальФосфата (активная форма витамина В 6) треонин соединяется с глиоксиловой кислотой, в результате чего образуется глицин и α-Кето-β-АминоМасляная кислота.
Синтез глицина из углекислого газа и аммиака
В печени позвоночных (и человека) при участии фермента ГлицинСинтазы глицин может образовываться из углекислого газа, аммиака, а также активной формы витамина В9 — N5N10МетиленН4Фолат (см. реакцию 1) и НАДН+Н. Реакция обратима, т.е. глицин может деградировать до углекислого газа и аммиака с образованием метилированной формы Фолата и НАДН+Н. Реакция идет в присутствии активной формы витамина B6 пиридоксальфосфата. Таким образом, для синтеза глицина нужно два витамина: фолиевая кислота (B9) и пиридоксин (B6). Фолиевая кислота содержится в свежей зелени, а также в печени, но вот беда, при тепловой обработке она разрушается. Пиридоксин содержится в семенах подсолнечника, отрубном хлебе, фасоли, красной морской рыбе и других продуктах.

Синтез глицина из глиоксиловой кислоты
Глиоксиловая кислота — это жуткий яд, угнетающий тканевое дыхание. В больших количествах она содержится в незрелых фруктах, именно поэтому их не следует употреблять в пищу, особенно при проблемах с печенью и поджелудочной. В 30-е годы, когда в Среднем Поволжье разразился голод, мой двоюродный дед, будучи подростком, умер, поев незрелых яблок. Незрелые яблоки оказались соблазнительной пищей, с которой истощенный организм не справился. В другой раз чуть не отправился в кроличий рай мой домашний питомец, который дорвался до незрелых яблок, а я не сразу сообразила, что это не самая подходящая для него пища. Откачав крола, и вспомнив печальную историю двоюродного деда, я крепко-накрепко уяснила, что незрелые яблоки есть ни в коем случае нельзя. Теперь я знаю, почему – из-за высокого содержания глиоксиловой кислоты.
Глиоксиловая кислота также образуется в процессе биотрансформации этиленгликоля – яда, который добавляют в антифризы – жидкости-незамерзайки. При случайном (а иногда и не случайном) попадании внутрь, печень пытается обезвредить этиленгликоль, но в результате получаются соединения еще более ядовитые, и одним из них является глиоксиловая кислота.
В небольших количествах глиоксиловая кислота образуется, как побочный продукт, на пути образования холина из серина. Холин нам нужен, ибо из него получается нейромедиатор ацетилхолин.
Фермент декарбоксилаза откусывает у серина карбоксильный хвост, в результате чего получается аминоспирт 2-аминоэтанол и выделяется углекислый газ.

2-аминоэтанол может пойти на синтез холина и далее на синтез нейромедиатора ацетилхолина, а может превратиться в гликолевый альдегид, лишившись аминной головы в ходе окислительного дезаминирования.

Гликолевый альдегид – ядовитое вещество, которое надо немедленно обезвредить. Образуется он не только из 2-аминоэтанола на пути превращения серина, но также при распаде пуриновых оснований (каркаса молекул ДНК и РНК – генетических матриц клеток) и при альтернативном пути гликолиза – распаде сахаров с выходом энергии. Таким образом, имеется 3 источника естественного образования гликолевого альдегида:
- превращение аминокислоты серин с образованием 2-аминоэтанола, который дает гликолевый альдегид
- распад пуринов: ксантин преобразуется в соль мочевой кислоты, которая декарбоксилируется, т.е. теряет карбоновый хвост, превращаясь в аллантоин и аллантоиновую кислоты, а те гидролизируются до мочевины и гликолевого альдегида
- альтернативный гликолиз: глюкоза превращается во фруктозу-1,6-бисфосфат, а ту фермент кетолаза превращает в гликолевый альдегид.
Гликолевый альдегид образуется также при переработке этиленгликоля в печени, при отравлении этим соединением, причем парадоксально, продукты метаболизма опаснее самого яда.
Гликолевый альдегид окисляется ферментом АльдегидОксидазой до гликолевой кислоты, а та, в свою очередь окисляется ферментом ЛактатДегидрогеназой до глиоксиловой кислоты.

Все эти вещества являются ядами, угнетающими тканевое дыхание и синтез белка, они блокируют митохондриальный транспорт электронов, разобщают окисление и фосфорилирование, т.е. химическая энергия, выделяющаяся при сгорании органических молекул, рассеивается в виде тепла, а не используется на работу биохимического конвейера.
Организм очень хитро придумал, преобразовывать яды в полезное вещество глицин. Этим занимаются печеночные клетки в особых органеллах – микротельцах (пероксисомах).

Основная реакция обезвреживания глиоксиловой кислоты – это соединение с аланином.
Донором аминной группы в этой реакции выступает аминокислота аланин, которая превращается в пируват. Реакция идет при участии фермента АланинГлиоксилатАминоТрансферазы в сопровождении активной формы витамина В6 – ПиридоксальФосфаста.

Глиоксиловая кислота и орнитин
Другой реакцией обезвреживания глиоксиловой кислоты является соединение с орнитином, и на выходе получается глицин и γ-полуальдегид глутамиловой кислоты. Реакция активно идет в печени.

Где взять орнитин? Орнинин образуется из аргинина в процессе обезвреживания мочевины.
Прямой синтез глицина из глиоксиловой кислоты
Глицин может образовываться прямым синтезом из глиоксиловой кислоты. В этом случае аминную голову он берет у всевездесущего глутамата, который переходит в α-кетоглутарат. Реакция идет при участии фермента ГлицинАминоТрансферазы. Обратите внимание, что реакция обратима, т.е. глицин вполне может выступать источником глиоксиловой кислоты, и это не есть айс.

Глицин, таким образом, синтезируется, как конечный метаболит на пути обезвреживания гликолевого альдегида, гликолевой кислоты и глиоксиловой кислоты. Коль речь зашла об отравлении, надо сказать, что глиоксиловая кислота может превращаться в щавелевую кислоту, а та, поймав кальций, выпадает в осадок, образуя оксалаты – кальциевые соли щавелевой кислоты. Оксалаты представляют собой игольчатые кристаллы, они травмируют мочевыводящие протоки, образуют почечные камни. Образование большого количества оксалатов приводит к нарушению функции почек при отравлении этиленгликолем.
К чему это я? А к тому, что в некоторых случаях глицин выступает источником глиоксиловой кислоты, со всеми последствиями в виде образования в почках осксалатных камней.
Синтез глицина из саркозина
Саркозин – важный участник биохимического конвейера, в котором он задействован, как донор одноуглеродной группы в реакциях транметилирования, т.е. обмена метильными остатками CH3. Саркозин образуется в процессе распада холина. Превращения саркозина тесно связаны с глицином. Саркозин образуется из глицина, как непосредственно, так и через длинную биохимическую цепочку, в начале которой глицин превращается в серин, дальше через ряд соединений образуется холин, а из того при распаде получается саркозин.
У млекопитающихся (и человека) обнаружена размещенная в митохондриях ферментная система, которая разлагает саркозин с образованием глицина. 90% саркозина разлагается в митохондриях печени, а 10% — в почках. Реакция идет под действием фермента СаркозинДегидрогеназы, причем фермент работает при содействии апофермента, связанного с мембраной митохондрий. Его активность проявляется только в присутствии специфического флавопротеида ФАД (активной формы витамина В2 – рибофлавина), необходимого для переноса электронов. Эта реакция может идти как в присутствии, так и без ТетраГидроФолата (ТГФК – активной формы витамина В9 – фолиевой кислоты). В анаэробных условиях, т.е. без кислорода, ТГФК в реакции не участвует, в результате образуется свободный формальдегид, ядовитое вещество, которое срочно требуется обезвредить. В присутствии кислорода в реакцию вступает ТГФК, который забирает углеродный остаток СН3 у формальдегида, превращаясь в уже известный N5N10МетиленН4Фолат с выделением воды.
Точный механизм реакции не известен. Общая схема выглядит следующим образом:

Реакция в бескислородной среде протекает в два этапа. При участии кислорода и ТГФК – в три.
Первый этап: перенос водорода с N-метильной группы саркозина на ФАД, что позволяет воде атаковать образовавшийся положительно-заряженный карбокатион, с образованием промежуточного соединения. Происходит отсечение метильной головы, иначе говоря, деметилирование N-метильной группы на саркозине. Восстановленный на первой стадии ФАД Н— окисляется кислородом с образованием перекиси водорода.

Промежуточное соединение без ТГФК окисляется в глицин с выходом формальдегида.

На третьем этапе происходит обезвреживание формальдегида, для чего нужна ТГФК (активная форма фолиевой кислоты – витамина В9). ТГФК принимает на себя одноуглеродный остаток от формальдегида и превращается в N5,N10-МетиленТетраГидроФолат.
Превращение происходит в четыре этапа с выделением воды.


Заключение
Глицин – активный участник биохимического конвейера, задействованный в переносе одноуглеродного остатка CH3, т.е. в реакциях метилирования. Обмен глицина тесно связан с обменом другой аминокислоты – серина и активной формы витамина B9 – фолиевой кислоты ТГФК. Биологический смысл данных процессов в передаче одноуглеродного остатка по биохимическому конвейеру, при этом глицин выступает источником одноуглеродного остатка, а ТГФК – передающим звеном, при этом обезвреживается образующийся в процессе биосинтеза опасный гомоцистеин с образованием безопасной аминокислоты метионин.
Глицин является конечным безопасным продуктом при обезвреживании клеточных ядов, имеющих как биосинтетическое происхождение, т.е. образующихся внутри организма при работе биохимического конвейера, так и пищевое происхождение, т.е. поступающих в организм извне, с пищей. Это гликолевый альдегид, гликолевая кислота и глиоксиловая кислота. В результате преобразований, происходящих в печени, клеточные яды превращаются в безопасный глицин.
Глицин также является конечным безопасным продуктом при утилизации холина и саркозина, в процессе которой образуются клеточный яд – формальдегид.
Распад биологически-активных молекул приводит к образованию опасных для организма веществ, требующих обезвреживания. Организм затрачивает усилия в виде энергии и работы ферментов и витаминов для того, чтобы запустить вторичное использование отработанных молекул, превращая яды в глицин. Глицин в свою очередь связывает обмен аминокислот, пуриновых оснований, порфиринов и, через аминокислоту серин, подпитывает углеводный обмен, давая организму энергию.
- Стр. 6. Малиновский А.В. «Переаминирование треонина»
- Стр. 15. Малиновский А.В. «Переаминирование треонина»
ClCh3COOH + Nh4 = ? уравнение реакции
В результате взаимодействия хлоруксусной кислоты с аммиаком (ClCh3COOH + Nh4 = ?) образуется аминокислота глицин (аминоуксусная) и средняя соль хлорид аммония. Молекулярное уравнение реакции имеет вид:
Аминокислоты — органические бифункциональные сединения, в состав которых входят карбоксильная группа и аминогруппа . Это твердые кристаллические вещества, хорошо растворимые в воде. Они плавятся при высоких температурах с разложением.
Наиболее часто аминокислоты получают путем замещения галогена на аминогруппу в галогензамещенных карбоновых кислотах:
Аминокислоты – амфотерные соединения. Они реагируют как с кислотами, так и с основаниями:
При растворении аминокислот в воде аминогруппа и карбоксильная группа взаимодействуют друг с другом с образованием соединений, называемых внутренними солями. Молекулу внутренней соли аминокислоты называют биполярным ионом.
Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью :
Какая реакция получения глицина из хлоруксусной кислоты?
В 1827 году 1827 г. датскому химику и фармацевту Вильяму Цейзе понадобилось получить тетрахлороплатинат калия K2[PtCl4]. Эту соль получают из хлорида калия и платинохлористоводородной кислоты h3[PtCl4]. Цейзе знал, что продукт реакции хорошо растворяется в воде и плохо в этиловом спирте. Потому для полноты осаждения продукта он решил провести синтез не в водном растворе, а в спиртом. Однако, прилив к спиртовому раствору кислоты он добавил водный раствор хлорида калия, то вместо ожидаемого красно-коричневого осадка выпал осадок желтого цвета. Его анализ показал, что это не известное ранее вещество, которое имеет необычный состав: KCl∙PtCl2∙C2h5∙h3O, то есть неорганическое соединение содержит молекулу этилена! Было понятно, что этилен получился из спирта, но механизм этой реакции и строение желтого вещества были выяснены только спустя сто лет. Было показано, что образуется комплексная соль, в которой молекула этилена координационно связана с атомов платины. А уравнение реакции такое:
Это взаимодействие кислоты с основанием, в результате чего образуется соль и вода
HCl+ NaOH=NaCl +h3O
Действительно, на конкретном примере было бы проще разобраться в данных реакциях. В принципе, Вы могли бы просто выложить в пояснении к вопросу нужное задание и кто-то из авторов дал бы точный ответ.
Энергетический задаваемый профиль реакции зависит от самого нуклеофильного замещения, так как является мономолекулярным. Также известно, что нуклеофильность вообще влияет лишь на скорость создаваемой реакции. Ну вот видео, на котором всё отражено подробно и очень понятно, вполне можно разобраться и применить к любому заданию, которое Вам было дано в вузе или другом учебном заведении. Но если нужен конкретный ответ, то лучше напишите пояснение хотя бы под вопросом в комментариях
Сэм Ким — автор процитированного отрывка его книги — далек от спелеологии и химии. Пещер в природе много и они классифицируются по происхождению на:
карстовые, тектонические, эрозионные, эрозионные, вулканические, ледниковые и др. Карстовые пещеры, о происхождении которых и говорил Сэм Ким, произошли от растворения горных пород в подземных водах. Этих пещер наибольшее количество среди всех остальных. Эти пещеры наиболее часто посещают туристы, которых завораживают сталактиты — сосульки, которые по мере стекания по ним воды удлиняются в толстые стержни, а навстречу им снизу поднимаются сталагмиты: они образуются из воды, падающей на дно пещеры.
Подземные воды, насыщенные углекислым газом, просачиваются сквозь пласты известняков СаСОз, постепенно растворяют их, образуя пещеры. При этом нерастворимые карбонаты кальция превращаются в растворимые гидрокарбонаты по уравнению: СаСОз + СО2+Н2О = Са(НСОз)2. Эта реакция обратима и гидрокарбонаты вновь образуют известняк — карбонат кальция. Таким образом никаких взрывов, никакого металлического кальция. Все эти превращения учащиеся средней школы производят в пробирках.
Ничего не будет, потому что, когда кола и ментос попадают в желудок, вызванные реакцией газы, там не задерживаются. Максимум у вас может быть метеоризм и вздутие желудка. А как происходит взрывная реакция на открытом воздухе можно посмотреть на видео
Хлоруксусная кислота, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий неметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
ГЛИЦИН | Использует | Польза для здоровья | Источники питания | Исследования
Восстановление тканей
Глицин — важная аминокислота против старения. Примерно треть коллагена состоит из глицина. Коллаген — это незаменимый белок, который организм использует для сохранения эластичности и упругости соединительных тканей и кожи. В отсутствие глицина организм не может восстанавливать поврежденные ткани.
Кроме того, исследования показали, что эта аминокислота помогает защитить организм от шока в результате кровопотери.Это также помогает предотвратить образование свободных радикалов и гипоксию 8 .
Регламент по гормонам
Эта аминокислота может быть метилирована в диметилглицин (DMG). DMG играет важную роль в одноуглеродном пути, который необходим для биосинтеза стероидов, таких как эстрогенные и андрогенные гормоны. Эта аминокислота также помогает стимулировать секрецию гормона роста человека.
Купите самую продаваемую добавку глицина на Amazon.com
Лечение рака
Предварительные исследования показали, что эта аминокислота может играть роль в лечении некоторых видов рака.Это включает предотвращение образования раковой меланомы. Результаты исследования на мышах показали, что пищевой глицин ингибирует ангиогенез, останавливая рост опухолей 9 .
Дефицит глицина
Это необычно. Однако этот тип дефицита может возникать у людей, которые недоедают или страдают такими заболеваниями, как рак и СПИД. Люди, страдающие расстройствами пищеварения, усталостью или низким уровнем энергии, также могут иметь недостаточную концентрацию этой аминокислоты.
Диетические источники

Купите самые продаваемые добавки глицина на Amazon.com
Хотя организм может производить глицин, эта аминокислота также может быть получена из многих продуктов с высоким содержанием белка. В частности, богатыми источниками глицина являются рыба, мясо и молочные продукты.
Вегетарианские источники включают соевые бобы, шпинат, капусту, цветную капусту, капусту, тыкву, банан, киви, огурцы и бобы.
Вы также можете найти добавки глицина в форме порошков или капсул.Они могут быть полезны при таких заболеваниях, как проблемы с простатой, плохая память, инсульт и шизофрения. Другие добавки, содержащие глицин, доступны для лечения синдрома хронической усталости, анемии и гипогликемии. Эти добавки могут помочь повысить уровень энергии и общее самочувствие.
Более широкое применение глицина
Вы можете встретить эту аминокислоту в продуктах питания и напитках как усилитель вкуса и подсластитель. Он также используется в качестве добавки к корму для животных, буферного агента в косметике, антацидах, растворах для орошения и сельскохозяйственных удобрениях.Во многих коммерческих приложениях используется синтетическая версия этой аминокислоты, полученная с использованием аммиака для обработки хлоруксусной кислоты.
Заключение
содержится в человеческих белках, поэтому неудивительно, что это простое соединение выполняет так много функций в организме. Эта аминокислота особенно важна для поддержания здоровья пищеварительной и нервной систем.
Он также важен для производства гормонов роста человека и креатина. В результате эта аминокислота стала ценной для спортсменов, желающих нарастить мышечную массу и силу.
Он также полезен для людей, страдающих нервно-поведенческими расстройствами, диабетом, хронической усталостью и некоторыми видами рака. По мере того, как проводится больше исследований и клинических испытаний, вполне вероятно, что эта аминокислота будет продолжать играть важную роль в лечении ряда заболеваний. Поддержание здорового сбалансированного питания поможет поддержать организм и дополнит внутренний биосинтез глицина.
.Хлоруксусная кислота | 79-11-8
Хлоруксусная кислота Химические свойства, использование, производство
Химические свойства
бесцветные или белые кристаллыХимические свойства
Хлоруксусная кислота представляет собой кристаллическое твердое вещество от бесцветного до белого цвета. Обладает сильным запахом уксуса и запахом. Порог 0,15 миллиграмма на кубический метр.использует
Гербицид, консервант, бактериостат, промежуточный продукт в производстве карбоксиметилцеллюлозы; этил хлорацетат, глицин, синтетический кофеин, саркозин, тиогликолевая кислота, ЭДТА, 2,4-Д, 2,4,5-Т.использует
Хлоруксусная кислота ведет себя как очень сильная одноосновная кислота и используется в качестве сильного кислотного катализатора для различных реакций. Функция Cl может быть замещена в реакциях, катализируемых основанием.Определение
Бесцветный кристалл твердое вещество, полученное путем замены одного из атомов водорода атомы метильной группы этановая кислота с хлором, используя красный фосфор. Это более сильная кислота, чем этановая кислота из-за электроноакцепторных действие атома хлора.Дихлорэтановая кислота (дихлоруксусная кислота, CHCl 2 COOH) и трихлорэтановая кислоты (трихлоруксусная кислота, CCl 3 COOH) являются сделано таким же образом. Кислотная сила увеличивается с увеличением количества хлора присутствуют атомы.Методы производства
Хлоруксусная кислота может быть синтезирована радикальным хлорированием уксусной кислоты, обработкой трихлорэтилена концентрированным h3SO4, окислением 1,2-дихлорэтана или хлорацетальдегида, замещением амина из глицина или хлорированием кетена.Определение
ChEBI: хлоркарбоновая кислота, представляющая собой уксусную кислоту, содержащую 2-хлор-заместитель.Общее описание
Хлоруксусная кислота, раствор представляет собой бесцветный раствор белого кристаллического твердого вещества. Концентрация кислоты может достигать 80%. Используется в производстве красителей и в медицине. Хлоруксусная кислота токсична при вдыхании, проглатывании и контакте с кожей. Хлоруксусная кислота вызывает коррозию металлов и тканей. Хлоруксусная кислота используется как гербицид, консервант и бактериостат.Реакции воздуха и воды
Вода.Профиль реактивности
Эти органические соединения отдают ионы водорода, если присутствует основание, принимающее их. Таким образом они реагируют со всеми основаниями, как органическими (например, амины), так и неорганическими. Их реакции с основаниями, называемые «нейтрализациями», сопровождаются выделением значительного количества тепла. Нейтрализация между кислотой и основанием дает воду плюс соль.Растворимые карбоновые кислоты до некоторой степени диссоциируют в воде с образованием ионов водорода. Следовательно, pH растворов карбоновых кислот составляет менее 7,0. Карбоновые кислоты в водном растворе и жидких или расплавленных карбоновых кислотах могут реагировать с активными металлами с образованием газообразного водорода и соли металла. Такие реакции в принципе происходят и для твердых карбоновых кислот, но протекают медленно, если твердая кислота остается сухой. Даже «нерастворимые» карбоновые кислоты могут поглощать достаточно воды из воздуха и растворяться в хлоруксусной кислоте в достаточной степени, чтобы разъедать или растворять железные, стальные и алюминиевые детали и контейнеры.Карбоновые кислоты, как и другие кислоты, реагируют с цианидными солями с образованием газообразного цианистого водорода. В случае сухих твердых карбоновых кислот реакция протекает медленнее. Воспламеняющиеся и / или токсичные газы и тепло образуются при реакции карбоновых кислот с диазосоединениями, дитиокарбаматами, изоцианатами, меркаптанами, нитридами и сульфидами. Карбоновые кислоты, особенно в водном растворе, также реагируют с сульфитами, нитритами, тиосульфатами (с образованием h3S и SO3), дитионитами (SO2) с образованием легковоспламеняющихся и / или токсичных газов и тепла.В результате их реакции с карбонатами и бикарбонатами образуется безвредный газ (углекислый газ), но все же тепло. Как и другие органические соединения, карбоновые кислоты могут окисляться сильными окислителями и восстанавливаться сильными восстановителями. Эти реакции выделяют тепло. Возможен широкий выбор продуктов. Как и другие кислоты, карбоновые кислоты могут инициировать реакции полимеризации; как и другие кислоты, они часто катализируют (увеличивают скорость) химические реакции.Опасность
Использование в пищевых продуктах, запрещенных FDA.Раздражает и разъедает кожу. Верхние дыхательные пути раздражитель. Сомнительный канцероген.Опасность для здоровья
Вдыхание вызывает раздражение слизистой оболочки. Контакт с жидкостью вызывает сильное раздражение и ожоги глаз, раздражение и ожоги кожи. Проглатывание вызывает ожоги рта и желудка.Пожарная опасность
Особые опасности продуктов сгорания: Могут образовываться токсичные газы, такие как хлористый водород, фосген и окись углерода.Профиль безопасности
Яд при приеме внутрь, ингаляционные, подкожные и внутривенные маршруты. Едкая кожа, глаза и слизистые мембранный раздражитель. Сомнительный канцероген с экспериментальными канцерогенными данными. Сообщены данные о мутации. Горючая жидкость при воздействии тепла или пламени. Бороться огонь, используйте водяную струю, туман, туман, сухой химикат, пену. При нагревании до разложения выделяет токсичные пары Cl-. Смотрите также ХЛОРИДЫ.Возможное воздействие
Эта галогенуксусная кислота может быть побочным продуктом дезинфекции питьевой воды и может увеличить риск рак.Монохлоруксусная кислота используется в основном как химическое вещество. промежуточное соединение в синтезе натрийкарбоксиметилцеллюлозы; и такие другие разнообразные вещества, как этилхлорацетат, глицин, синтетический кофеин, саркозин, тиогликолевая кислота и различные красители. Следовательно, рабочие в этих районах пострадали. это также используется как гербицид. Следовательно, составители рецептур и аппликаторы таких гербицидов подвергаются воздействию.Доставка
UN1750 (жидкость) и UN1751 (твердый) Хлоруксусная кислота кислота, твердая или жидкая, Класс опасности: 6.1; Ярлыки: 6.1-Poison Опасность при вдыхании, 8-Коррозийный материал.Методы очистки
Кристаллизовать кислоту из CHCl3, CCl4, * бензола или воды. Сушат над P2O5 или концентрируют h3SO4 в вакуумном эксикаторе. Дальнейшая очистка осуществляется дистилляцией от MgSO4 и фракционной кристаллизацией из расплава. Хранить в вакууме или в сухом N2. [Bernasconi et al. J Am Chem Soc 107 3621 1985, Beilstein 2 IV 474.]Несовместимость
Соединения карбоксильной группы реагируют со всеми основаниями, как неорганическими, так и органическими (т.е., амины) выделяя значительное количество тепла, воды и соли, которые могут быть вредны. Несовместим с соединениями мышьяка (высвобождает газообразный цианистый водород), диазосоединения, дитиокарбаматы, изоцианаты, меркаптаны, нитриды, сульфиды (высвобождая тепловые, токсичные и, возможно, легковоспламеняющиеся газы), тиосульфаты, и дитиониты (с выделением гидросульфата и оксидов серы). Раствор в воде — сильная кислота. Связаться с сильные окислители, сильные основания; и сильные восстановители такие как гидриды, могут вызывать бурные реакции.хЛОРУКСУСНОЙ кислота разлагается при нагревании с образованием токсичных и едких хлористый водород, фосген и угарный газ. Агрессивно в отношении металлов в присутствии влаги.Вывоз мусора
Сжигание, желательно после смешивание с другим горючим топливом; необходимо проявлять осторожность, чтобы обеспечить полное сгорание, чтобы предотвратить образование фосгена; кислотный скруббер необходим для удаления произведенные галоидные кислоты.Продукты и сырье для получения хлороуксусной кислоты
Сырье
Препараты
,Польза для здоровья и потенциальная опасность
Глицин — незаменимая аминокислота. Это вещество содержится в различных белках и биологически активных соединениях в организме человека. Эта аминокислота вырабатывается естественным путем в организме человека, и некоторое количество ее человек получает с пищей. Искусственный глицин получают путем гидролиза, то есть взаимодействия с водой посредством химического синтеза. Во втором случае образуется белое порошкообразное вещество. Он ничего не имеет вкуса и имеет сладкий аромат.Поэтому эту аминокислоту называют «глицис» — греческое слово, обозначающее «сладкий».
Это вещество также считается аминокислотой-нейромедиатором и действует двояко. Рецепторы глицина находятся в разных частях головного и спинного мозга. Связываясь с ними, глицин замедляет работу нейронов и снижает выработку ими «возбуждающих» аминокислот. Таким образом тело человека расслабляется. Глицин подавляет функции мотонейронов спинного мозга, поэтому его используют в неврологии для снижения повышенного мышечного тонуса.
Причины использования глицина
Глицин
Глицин оказывает комплексное воздействие на человеческий организм, подавляя работу нервной системы и повышая активность нейронов головного мозга. Эта аминокислота применяется в следующих случаях:
- Эмоциональные расстройства;
- Постоянные умственные нагрузки;
- Восстановление после травм и операций;
- Нейроинфекция;
- Снижение трудоспособности;
- Ухудшение памяти;
- Бессонница;
- Проблемные проблемы и негативные модели в поведении детей.
Польза глицина для здоровья
Основная функция глицина заключается в улучшении функционирования CES и стабилизации умственной деятельности. Повышенное потребление этой аминокислоты помогает снять стресс, возникающий из-за длительных умственных и физических перегрузок. Это помогает улучшить общее самочувствие, а также дает следующие результаты:
- Активизация умственной деятельности;
- Устранение умственного напряжения;
- Улучшение настроения;
- Нормализация режима сна;
- Ликвидация нарушений функционирования головного мозга;
- Устранение агрессии;
- Устранение вегетативно-сосудистых нарушений.
Глицин напрямую участвует в образовании антител и иммуноглобулинов. Эта аминокислота необходима для нормального функционирования иммунной системы. Глицин также действует как основа для создания креатина. Это незаменимый усилитель энергии, который обеспечивает правильную работу всех мышц человеческого тела.
Глицин также используется во многих лечебных комплексах, предназначенных для снижения кислотности желудочного сока, а также для нейтрализации воздействия алкоголя на организм человека и снижения уровня сахара в крови.Ученые доказали, что эта аминокислота снижает желание употреблять алкоголь. Глицин также используется для облегчения похмелья. Стимулирует выведение токсичных веществ из организма человека и предотвращает крупномасштабное разрушение клеток мозга.


Leave A Comment