Бутадиен – 1,3
Казанский Государственный Технологический Университет
им. Кирова
Реферат на тему: «Бутадиен 1,3»
Выполнила студентка
2 курса группы 3151-84
Казакова Резеда
Проверила
Климентова Е. Ю.
2007 год.
Оглавление
Получение3
Физические свойства4
Химические свойства4
Применение8
Литература8
Бутадиен-1,3 относится к диеновым углеводородам, т.е. содержащим в углеродной цепи молекулы две двойные связи.
- Строение бутадиена:
а) молекулярное
C 4 H 6 бутадиен
CH 2 = CH CH = CH 2 бутадиен-1,3
Вид гибридизации
CH 2 = CH CH = CH 2
бутадиен-1,3
Атомы углерода в молекуле бутадиена-1,3 находятся в состоянии sp 3 -гибридизации. За счет гибридных sp 3 -орбиталей, оси симметрии которых лежат в одной плоскости, в молекуле возникают s -связи между всеми атомами углерода и s -связи углерод водород. Центры всех атомов в молекуле бутадиена-1,3 лежат в одной плоскости. Негибридные p-орбитали атомов углерода (по одной у каждого атома) расположены перпендикулярно к плоскости молекулы и перекрываются не только между атомами 1,2 и 3,4, но и между атомами 2,3. Электроны на таких орбиталях образуют общую p -электронную систему однако перекрывание p
Взаимодействие двух соседних пи-связей способствует процессу взаимного влияния атомов в такой системе(эффект сопряжения). Это приводит к снижению общей энергии молекулы. В результате повышается её устойчивость. В то же время молекула дивинила при химических реакциях ведет себя намного активнее, чем обычный алкен. Особенно это проявляется в реакциях присоединения.
Из диеновых углеводородов особое значение имеют дивинил (бута-диен-1,3) и изопрен (2-метилбутадиен-1,3). Рассмотрим основные способы получения этих диенов.
1. Основным промышленным способом получения дивинила является дегидрирование соответствующих бутан-бутиленовых смесей над катализатором (Сг20з):
Исходные вещества (сырье) выделяют из продуктов нефтепереработки или попутных газов.
2. Впервые дивинил был получки по методу С.В.Лебедева (18741934) из этилового спирта. затем этот метод был положен в основу промышленного синтеза (1932). И качестве катализатора были
предложены оксиды алюминия и цинка, способствующие одновременной дегидратации (отщеплению воды) и дегидрированию (отщеплению водорода):
3. Дивинил в небольших количествах выделяют из продуктов пиролиза нефти.
Физические свойства
Бутадиен-1,3 (Дивинил) бесцветный газ с неприятным запахом, температурой плавления 4,5 °C, температура кипения 4,5 °C, оптическая плотность 0,627. Практически нерастворим в воде.
Химические свойства
Диены, содержащие в молекуле несопряженные (изолированные) двойные связи, ведут себя как обычные алкены. В то же время диены с сопряженными двойными связями обладают высокой реакционной способностью и отличаются рядом особенностей. Однако для тex и других характерны прежде всего реакции присоединения
Реакции присоединения. Присоединение водорода (гидрирование), галогенов (галогенирование), галогеноводородов (гидрогалогенирование) может протекать не только по месту одной или двух отдельных двойных связей (1,2-присоединение), но и к крайним углеродным атомам (1,4-рисоединение):
Из этих примеров видно, что в зависимости от характера присоединения (1,2- или 1,4-) образуются различные продукты.
Присоединение в 1,2- положение не требует особого объяснения оно вытекает из общих свойств алкенов: в результате присоединения происходит обычный разрыв одной или двух двойных связей. Иначе идет присоединение в 1,4-положение. Известно, что молекула диена представляет собой систему, в которой происходит взаимодействие двух соседних двойных связей с образованием единого пи-электронного облака. Под влиянием атакующего реагента такая система поляризуется с перераспределением электронной
плотности. В результате на противоположных концах молекулы под влиЯНИем динамического эффекта сопряжения возникают противоположные частичные заряды:
К этим концам молекулы и стремятся противоположно заряженные частицы реагента:
Таким образом, в результате присоединения к диенам вначале происходит разрыв двух двойных связей, а затем присоединение атомов реагента к крайним ненасыщенным углеродным атомам (C1 и C4). Между атомами С2 и Сз устанавливается двойная связь. Это осуществляется за счет расспаривания 2р-орбита-лей двойных связей. Две из этих орбиталей (принадлежащие атомам C1 и С4) создают обычные «сигма-связи с атомами реагента, а две другие (у атомов С2 и Сз), перекрываясь между собой еще в большей степени, образуют новую двойную связь.
Выход продуктов 1,4- или 1,2-присоединения зависит от характера реагента и от условий проведения реакции. Например, водород в момент выделения (при взаимодействии цинка с соляной кислотой) присоединяется в положение 1,4, а газообразный водород (над катализатором Ni) — в положение 1,2 или гидрирует диен полностью до бутана:
Если присоединение НВг идет при -80 °С, то образуется 80 % продукта присоединения в положении 1,2 и 20 % в положение 1,4; если же реакцию проводить при 40 °С, то соотношение продуктов будет обратным.
Диеновые синтезы. Этот вид реакций заключается в 1,4-присоединении нлконя или алкина (ацетиленового углеводорода) к диену С сопряженными двойными связями. Например:
Такие реакции используют для получения многих циклических орга нических соединений. Непредельные соединения, вступающие в реак цию с диенами, называют диенофилами.
Реакции полимеризации. Диеновые углеводороды обладают исключительно важной особенностью: они легко вступают в реакции полимеризации с образованием каучукоподобных высокомоле кулярных продуктов. Реакции полимеризации протекают с присоеди нением молекул друг с другом в 1,4- или 1,2-положении, а также с одновременным присоединением в 1,4- и 1,2-положения. Вот как выг лядит фрагмент формулы продукта полимеризации дивинила (бута-диена-1,3), если присоединение молекул друг к другу идет в положе ние 1,4:
Этот фрагмент полимера можно представить в сокращенной форме:
В общем виде формулу полиизопрена записывают так
Применение
Бутадиен применяется при производстве каучуков.
Бутадиеновые каучуки получают полимеризацией бутадиена-1,3 на стереоскопических катализаторах. Бутадиеновый каучук относится к каучукам общего назначения. Обладает высокой износо- и морозостойкостью. Устойчив к многократным деформациям. В сочетании с другими каучуками его применяют в шинном производстве, а также в производстве обуви и других изделий.
Бутадиен-стирольные каучуки получают совместной полимеризацией бутадиена и стирола. Эти каучуки отличаются высокой прочностью и применяются для изготовления протекторов автомобильных шин, кабелей, а также в обувной промышленности. Недостатком этого каучука является нестойкость к маслам и органическим растворителям.
Полимеризацией бутадиена также получают бутадиеннитрильные каучуки, изопреновые каучуки и хлорпреновые каучуки.
Литература
1 А.И. Артеменко, Органическая химия, М.:Высшая школа 1998, 535 с.
2 Б.Д. Степин, А.А.Цветков, Органическая химия, М.:Высшая школа 1994, 605 с.
3 http://chem..edu.ru
Алкины и алкадиены
Алкины
Общая формула: CnH2n-2.
Гибридизация
Атомы углерода, участвующие в образовании тройной связи находятся в состоянии sp-гибридизации, остальные атомы углерода находятся в состоянии sp3-гибридизации.
Виды изомерии: изомерия цепи, изомерия положения тройной связи, межклассовая изомерия с алкадиенами.
Номенклатура
Название алкинов образуется из названия алкильного радикала с суффиксом -ин с указанием положения тройной связи.
Физические свойства
Физические свойства алкинов практически не отличаются от свойств соответствующих алканов и алкенов (С2–С4 – газы, С4–С16 – жидкости при нормальных условиях, далее – твердые вещества). Температуры кипения алкинов несколько выше, чем у соответствующих алкенов (несмотря на несколько меньшую молекулярную массу). Это также связано с большей полярностью связей, образованных sp-гибридизованными атомами углерода.
Химические свойства
По своим химическим свойствам алкины похожи на алкены. Для них также наиболее характерными являются реакции электрофильного присоединения. Для несимметричных алкинов, как и для алкенов, действует правило Марковникова. Существенным отличием является меньшая реакционная способность тройных связей по сравнению с двойными. Поскольку в результате присоединения обаразуется замещенный алкен (с более реакционно-способной связью), то при избытке присоединяющегося реагента реакция, как правило, идет дальше и образуется замещенный алкан:
| или |
| Алкин | Замещеный алкен | Замещеный алкан |
Гидрирование
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая p-связь), а затем алканов (разрывается вторая p-связь):
| Пропин | Пропен | Пропан |
При использовании менее активного катализатора гидрирование останавливается на стадии образования алкенов.
Галогенирование
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая p-связь разрывается труднее, чем вторая). Алкины обесцвечивают бромную воду:
| Ацетилен | 1,2-Дибромэтилен | 1,1,2,2-Тетробромэтилен |
Гидрогалогенирование
Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова [7]:
| Пропин | 2-Бромпропен | 2,2-Дибромпропан |
Гидрохлорирование
Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида. Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
Гидратация (реакция Кучерова)
Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена) или в кетон (в случае других алкинов).
Полимеризация
1.Димеризация под действием водно-аммиачного раствора CuCl.
2.Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского).
Возможно образование молекул, содержащих большее число звеньев ацетилена как циклического, так и линейного строения
… –СН=СН–СН=СН–СН=СН–…
(такие полимеры обладают полупроводниковыми свойствами).
Следует также отметить, что высокомолекулярное вещество – карбин (третья аллотропная модификация углерода) – образуется не в результате полимеризации ацетилена, а при окислительной поликонденсации ацетилена в присутствии CuCl.
Получение
Получение алкинов чаще всего производится по следующим реакциям:
| Карбид кальция | Ацетилен |
Алкины могут быть получены из соответствующих галогензамещенных алканов и алкенов.
| 2,2-Дибромбутан | 2-Бромбутен-2 | Бутин-2 |
| Бутен-1 | 1,2-Дибромбутан | Бутин-1 |
Применение
Ранее (а иногда и сейчас) ацетилен широко применялся для создания высокотемпературного пламени при газовой сварке. Сейчас на первый план вышло его применение для целей органического синтеза. Получение растворителей. При присоединении хлора к ацетилену получается тетрахлорэтан:
СН≡СН+2Сl2 = СНСl2–СНСl2,
а отщеплением от последнего молекулы хлороводорода – 1,1,2-трихлорэтен:
СНСl2–СНСl2 = СНСl=ССl2+НСl.
Алкадиены
Алкадиены также называют ненасыщенными углеводородами, так как присутствуют две двойных связи.
Общая формула:CnH2n-2.
Гибридизация
Атомы углерода, участвующие в образовании двойных связей находятся в состоянии sp2-гибридизации, остальные атомы углерода находятся в состоянии sp3-гибридизации.
Виды изомерии: изомерия цепи, изомерия положения двойных связей, межклассовая изомерия с циклоалкенами и алкинами. В зависимости от взаимного расположения двойных связей выделяют следующие алкадиены:
1.С изолированными двойными связями. Разделены в цепи двумя или более s-связями: СН2=СН–СН2–СН=СН2.
Такие двойные связи не оказывают друг на друга взаимного влияния, так как разделенны sp3-атомами углерода, и вступают в те же реакции, что и двойная связь в алкенах. Таким образом, алкадиены этого типа проявляют химические свойства, характерные для алкенов.
2.С кумулированными двойными связями, которые расположены у одного атома углерода: СН2=С=СН2 (аллен).
Подобные диены (аллены) относятся к довольно редкому типу соединений.
3.С сопряженными двойными связями, которые разделены одной s-связью: СН2=СН–СН=СН2.
Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью 4-х sp2-атомов углерода.
Номенклатура
Название алкдиенов образуется из названия алкильного радикала с суффиксом -диен. После суффикса через запятую указывают наименьшие номера атомов углерода, участвующие в образовании двойных связей.
Физические свойства
Бутадиен – газообразное вещество (температура кипения – 4,5 °С), изопрен является жидкостью, кипящей при 34 °С, диметилбутадиен – также жидкость, кипящая при 70 °C. Изопрен и другие диеновые углеводороды полимеризуются в каучук. Натуральный каучук в очищенном состоянии – это полимер с общей формулой (С5Н8)n и получается из млечного сока некоторых тропических растений.
Химические свойства
Для алкадиенов, как и для других ненасыщенных углеводородов, наиболее характерны реакции присоединения с разрывом π-связи.
Так же как и для других углеводородов характерны реакции окисления.
Алкадиены хорошо подвергаются реакциям полимеризации. Важнейшими представителями для промышленно получаемых каучуков являются изопрен и бутадиен-1,3.
Применение
Широко используются в производстве синтетических каучуков и различных органических веществ отдельные представители этих диенов.
Алкадиены, подготовка к ЕГЭ по химии
Алкадиены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С. Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда — пропадиен — CH2=C=CH2. Общая формула их гомологического ряда — CnH2n-2.
Номенклатура и изомерия алкадиенов
Названия алкенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.

Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.

Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В зависимости от того, как чередуются двойные связи в молекуле алкадиена, они подразделяются на следующие типы:
- Кумулированные двойные связи
- Сопряженные двойные связи
- Изолированные двойные связи
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
Пример — пропадиен-1,2 (аллен) — CH2=C=CH2
В молекуле аллена все атомы углерода находятся в состоянии sp2гибридизации.
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией плоскости (линией, соединяющей центры атомов).

Пример — бутадиен-1,3 — CH2=CH-CH=CH2
В случае, если две двойные связи разделены двумя и более одинарными связями.
Пример — пентадиен-1,4 — CH2=CH-CH2-CH=CH2
Получение алкадиенов
Алкадиены получают несколькими способами:
- Дегидрогалогенирование дигалогеналканов
- Синтез С.В. Лебедева
- Дегидрирование алканов
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.

Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из этилового спирта.
2CH3-CH2-OH → (450 °C, кат. ZnO) CH2=CH-CH=CH2 + 2H2O + H2
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.

В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит при повышенной температуре и в присутствии катализатора.

Химические свойства алкадиенов
Алкадиены — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны. Наличие сопряженных двойных связей увеличивает реакционную способность молекулы и обуславливает необычный механизм некоторых реакций.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу.
В случае, если двойные связи находятся в сопряжении, выход продуктов во многом зависит от температуры. Например, в ходе галогенирования бутадиена-1,3 при -80°C преимущественно получается продукт 1,2-присоединения, а при +60°C — продукт 1,4-присоединения.

Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.

При горении алкадиены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление.
2CH2=CH-CH=CH2 + 11O2 → 8CO2 + 6H2O
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
| 1. Укажите число сигма-связей в молекуле 1.3-бутадиена: | |
| 2. Молярная масса алкадиена равна 82 г/моль. Сколько атомов водорода содержится в молекуле алкадиена: | |
| 3. В какой паре оба вещества по отношению друг к другу являются изомерами: | |
| а) изопрен и 1,3-бутадиен | б) винилхлорид и поливинилхлорид |
| в) изопрен и пентадиен-1,3 | г) хлоропрен и винилхлорид |
| 4. В молекуле алкадиена 6 атомов углерода. Укажите значение относительной молекулярной массы алкадиена: | |
| 5. Какой продукт преимущественно образуется при взаимодействии 1 моль 1,3-бутадиена с 1 моль брома при комнатной температуре: | |
| а) 1,4-дибром-2-бутен | б) 1,2-дибром-1-бутен |
| в) 3.4-дибром-1-бутен | г) 1,2,3,4-тетрабромбутан |
| 6. При полном гидрировании бутадиена-1,3 образуется: | |
| 7. Реакцией Лебедева называется реакция получения: | |
| а) 1,3-бутадиена из этилена | б) 1,3-бутадиена из винилхлорида |
| в) 1,3-бутадиена из бутана | г) 1,3-бутадиена из этанола |
| 8. Изопрен можно получить при дегидрировании: | |
| в) 2-метилбутана | г) 1,3-бутадиена |
| 9. При взаимодействии 1 моль водорода и 1 моль бутадиена-1,3 при комнатной температуре преимущественно образуется: | |
| 10. Бутадиеновый каучук образуется в результате реакции: | |
| а) дегидрирования бутана | б) полимеризации бутена-1 |
| в) дегидратации и дегидрирования этанола | г) полимеризации 1.3-бутадиена |
Итоговое тестирование по химии 10 класс
Итоговое тестирование по химии 10 класс
Пояснительная записка
Итоговое контрольное тестирование составлено в соответствии с действующей программой по химии на основании государственного образовательного стандарта и предназначена для подведения итога по химии в 10 классе.
Тест состоит из части А (13 вопросов) и части В (3 задания). На выполнение работы отводится 45 минут. К каждому заданию части А даны несколько ответов, из которых только один верный. Часть В состоит из 3 заданий на установление соответствия. На задание части В, нужно дать ответ из последовательность букв. Контрольная работа оценивается в процентном соотношении.
Вариант 1
Часть А
1. Вещества, имеющие формулы СН3 – О – СН3 и СН3 – СН2 – ОН, являются
1) гомологами; 2) изомерами; 3) полимерами; 4) пептидами.
2. Углеводород, в молекуле которого атомы углерода имеют sp3 гибридизацию
1) бутен-1; 2) бутан; 3) бутадиен-1,2; 4) бутин-1.
3. Продуктом гидратации этилена является:
1) спирт; 2) кислота; 3) альдегид; 4) алкан.
4. Только в одну стадию может протекать гидрирование этого углеводорода:
1) бутадиен-1,3; 2) бутен-1; 3) бензол; 4) бутин-2.
5. Количество атомов водорода в циклогексане:
1) 12; 2) 8; 3) 10; 4) 14.
6. Реакция среды в водном растворе глицина:
1) нейтральная; 2) кислая; 3) соленая; 4) щелочная.
7. В промышленности ароматические углеводороды получают из…
1) природного газа; 2) нефти; 3) остатков горных пород; 4) торфа.
8. Уксусная кислота не вступает во взаимодействие с веществом
1) оксид кальция 3) медь
2) метанол 4) пищевая сода
9. Ацетилен принадлежит к гомологическому ряду:
1) алканов; 2) алкинов; 3) аренов; 4) алкенов
10. Полипропилен получают из вещества, формула которого
1) СН2 = СН2; 2) СН СН; 3) СН3 – СН2 – СН3; 4) СН2 = СН – СН3.
11. К ядовитым веществам относится:
1) метанол; 2) этанол; 3) пропанол; 4) бутанол.
12. Фенол нельзя использовать для получения
1) красителей 3) пищевых добавок
2) капрона 4) взрывчатых веществ
13. Формалин – это водный раствор
1) уксусного альдегида 3) муравьиного альдегида
2) уксусной кислоты 4) этилового спирта
Часть В
Установите соответствие между названием вещества и числом -связей в его молекуле.
Название вещества число пи — связей
1) этан а) ноль
2) бутадиен-1,3 б) одна
3) пропен-1 в) две
4) ацетилен г) три
д) четыре
Установите соответствие между названием вещества и его нахождением в природе:
вещество нахождение в природе
1) Глюкоза а) в соке сахарной свеклы
2) Крахмал б) в зерне
3) Сахароза в) в виноградном сахаре
4) Целлюлоза г) в древесине
Установите соответствие между названием вещества и его формулой.
Название вещества Формула
1) этан а) СН3-СН3
2) метанол б) СН3-ОН
3) пропановая кислота в) СН=СН
4) ацетилен г) СН3-СН2-СОН
д) СН3-СН2-СООН
Вариант 2
Часть А
1. Изомером 2-метилбутена-1 является
1) бутен-1; 2) 2-метилпентен-1; 3) пентан; 4) пентен -1.
2. В молекуле пропена гибридизация орбиталей атомов углерода:
1) sp2; 2) sp3; 3) sp; 4) sp3 и sp.
3. Продуктом присоединения хлороводорода к этену является: 1) 2-хлорпропан; 2) 1-хлорэтан; 3) 2,2-дихлорпропан;
4) 1,1-дихлорэтан.
4. С каждым из веществ: бромоводород, водород, вода – будет взаимодействовать:
1) пропан; 2) этен; 3) этан; 4) фенол.
5. К соединениям, имеющим общую формулу Сnh3n, относится
1) бензол; 2) гексен; 3) гексан; 4) гексин.
6. К какому классу веществ принадлежат белки:
1) сложные эфиры; 2) полинуклеотиды; 3) простые эфиры;
4) полиамиды.
7. Промышленным способом получения углеводородов является:
1) гидрирование; 2) изомеризация; 3) гидролиз; 4) крекинг.
8. Реакцию «серебряного зеркала» дает:
1) фенол; 2) муравьиная кислота
3) глицерин; 4) бензол
9. Пропаналь принадлежит к гомологическому ряду:
1) фенолы; 2) сахариды; 3) амины; 4) альдегиды
10. Полимер состава (СН2СН2)n получен из:
1) этилена; 2) этана; 3) бутана; 4) этина.
11. К наркотическим веществам относится:
1) этанол; 2) пропанол; 3) метанол; 4) бутанол.
12. Глицерин нельзя использовать для получения
1) взрывчатых веществ 3) лекарств
2) этилового спирта 4) кремов и мазей в парфюмерии
13. Подсолнечное, льняное, хлопковое масла относятся к классу:
1) углеводы 3) жиры
2) белки 4) фенолы
Часть В
Установите соответствие между названием вещества и классом соединений.
Название вещества Класс органических соединений
1) пропин а) альдегиды
2) этаналь б) алкины
3) толуол в) карбоновые кислоты
4) ацетилен г) арены
д) алкены
2. Установите соответствие между реагентами и типом реакции.
Реагенты Тип реакции
1) С2Н4+ Н2О а) галогенирование
2) С2Н2+ Н2 б) гидратация
3) 2СН3Сl + Zn в) гидрирование
4) С2Н4+ Cl2 г) гидрогалогенирование
д) синтез Вюрца.
3. Установить соответствие между функциональной группой и классом вещества:
функциональная группа класс вещества
1) – COOH а) спирты
2) – OH б) фенолы
3) – Nh3 в) кетоны
4) – COH г) карбоновые кислоты
5) — C=O д) альдегиды
е) амины
Ключ ответов
Вариант 1
Часть А
1
2
3
4
5
6
7
8
9
10
11
12
13
2
2
1
2
1
1
2
3
2
4
1
3
3
Часть В
В1
В2
В3
авбв
вбаг
абдв
Вариант 2
Часть А
1
2
3
4
5
6
7
8
9
10
11
12
13
4
1
2
2
2
2
4
2
4
1
1
2
3
Часть В
В1
В2
В3
багб
бвда
гаедв
Бутадиен — Википедия переиздано // WIKI 2
«Дивинил» перенаправляет сюда. Для группы, см. Дивинилы.
| |||
| |||
| имен | |||
|---|---|---|---|
| Предпочтительное имя IUPAC | |||
Другие имена
| |||
| идентификаторов | |||
| 605258 | |||
| ЧЕБИ | |||
| ЧЕМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003,138 | ||
| ЕС номер | |||
| 25198 | |||
| КЕГ | |||
| номер RTECS | |||
| UNII | |||
| номер ООН | 1010 | ||
| |||
| свойства | |||
| C 4 H 6 | |||
| Молярная масса | 54.0916 г / моль | ||
| Внешний вид | Бесцветный газ или охлажденная жидкость | ||
| Запах | Мягкий аромат или бензиноподобный | ||
| Плотность |
| ||
| Точка плавления | −108,9 ° C (−164,0 ° F; 164,2 К) | ||
| Точка кипения | −4.4 ° C (24,1 ° F; 268,8 К) | ||
| 1,3 г / л при 5 ℃, 735 мг / л при 20 ℃ | |||
| Растворимость | |||
| Давление пара | 2,4 атм (20 ° С) [2] | ||
| 1,4292 | |||
| Вязкость | 0,25 сП при 0 ° C | ||
| опасностей | |||
| Основные опасности | Легковоспламеняющийся, раздражающий, канцероген | ||
| Паспорт безопасности | См .: страница данных ECSC 0017 | ||
| пиктограмм СГС |   | ||
| СГС Сигнальное слово | Опасность | ||
| х320 , х440 , х450 | |||
P201 , P202 , P210 , P281 , P308 + 313 , P377 , P381 , P403 , P405| , P340 | | ||
| NFPA 704 (огненный алмаз) |  | ||
| Точка воспламенения | -85 ° C (-121 ° F; 188 К) температура вспышки жидкости [2] | ||
| 420 ° C (788 ° F; 693 К) | |||
| Взрывоопасные пределы | 2–12% | ||
| Смертельная доза или концентрация (LD, LC): | |||
| 548 мг / кг (крыса, перорально) | |||
| |||
| 250 000 ч / млн (кролик, 30 мин) [3] | |||
| NIOSH (пределы воздействия на здоровье США): | |||
| TWA 1 ppm ST 5 ppm [2] | |||
| потенциальный профессиональный канцероген [2] | |||
| 2000 ppm [2] | |||
| Родственные соединения | |||
| Изопрен Хлоропрен | |||
Родственные соединения | бутан | ||
| Страница дополнительных данных | |||
| Показатель преломления ( n ), Диэлектрическая проницаемость (ε r ) и т. Д. | |||
Термодинамические данные | Фазовое поведение твердый – жидкость – газ | ||
| УФ, ИК, ЯМР, МС | |||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
 Y проверить (что такое Y проверить (что такое  Y Y  N ?) N ?) | |||
| ссылок Infobox | |||
1,3-бутадиен представляет собой органическое соединение с формулой (CH 2 = CH) 2 .Это бесцветный газ, который легко конденсируется в жидкость. Это важно в промышленности как мономер в производстве синтетического каучука. Молекула может рассматриваться как объединение двух винильных групп. Это самый простой сопряженный диен.
Хотя бутадиен быстро распадается в атмосфере, он тем не менее обнаруживается в атмосферном воздухе городских и пригородных районов вследствие его постоянного выброса из автотранспорта. [4]
Название бутадиен может также относиться к изомеру 1,2-бутадиена, который представляет собой кумулированный диен со структурой H 2 C = C = CH-CH 3 .Этот аллен не имеет промышленного значения.
История
В 1863 году французский химик Э. Каванту выделил бутадиен из пиролиза амилового спирта. [5] Этот углеводород был идентифицирован как бутадиен в 1886 году, после того как Генри Эдвард Армстронг выделил его из продуктов пиролиза нефти. [6] В 1910 году российский химик Сергей Лебедев полимеризовал бутадиен и получил материал с каучукоподобными свойствами. Однако этот полимер оказался слишком мягким, чтобы заменить натуральный каучук во многих областях применения, особенно в автомобильных шинах.
Бутадиеновая промышленность возникла в годы, предшествовавшие Второй мировой войне. Многие из воюющих стран поняли, что в случае войны они могут быть отрезаны от каучуковых плантаций, контролируемых Британской империей, и попытались уменьшить свою зависимость от натурального каучука. [7] В 1929 году Эдуард Чункер и Вальтер Бок, работающие на компанию IG Farben в Германии, создали сополимер стирола и бутадиена, который можно использовать в автомобильных шинах. Произошло быстрое производство по всему миру: бутадиен производился из зернового спирта в Советском Союзе и США, а также из ацетилена, полученного из угля, в Германии.
Производство
В Соединенных Штатах, Западной Европе и Японии бутадиен производится как побочный продукт процесса парового крекинга, используемого для производства этилена и других алкенов. При смешивании с паром и кратковременном нагревании до очень высоких температур (часто свыше 900 ° С) алифатические углеводороды выделяют водород, образуя сложную смесь ненасыщенных углеводородов, включая бутадиен. Количество производимого бутадиена зависит от углеводородов, используемых в качестве сырья. Легкие корма, такие как этан, дают в первую очередь этилен при крекинге, но более тяжелые корма способствуют образованию более тяжелых олефинов, бутадиена и ароматических углеводородов.
Бутадиен обычно выделяют из других четырехуглеродных углеводородов, полученных в крекинге с водяным паром путем экстрактивной дистилляции с использованием полярного апротонного растворителя, такого как ацетонитрил, N -метил-2-пирролидон, фурфурол или диметилформамид, из которого он затем удаляется. перегонкой. [8]
от дегидрирования н -бутан
Бутадиен также может быть получен каталитическим дегидрированием нормального бутана ( н -бутан).Первый такой послевоенный коммерческий завод, производящий 65 000 тонн бутадиена в год, начал свою работу в 1957 году в Хьюстоне, штат Техас. [9] До этого, в 1940-х годах компания Rubber Reserve, входящая в правительство Соединенных Штатов, построила несколько заводов в Боргере, Техас, Толедо, Огайо и Эль-Сегундо, Калифорния, для производства синтетического каучука для военных действий. в рамках Программы синтетического каучука США. [10] Общая пропускная способность составила 68 км / т (килограмм метрических тонны в год).
В настоящее время бутадиен из н -бутан коммерчески практикуется с использованием процесса Гудри Катадиена , который был разработан во время Второй мировой войны. Это связано с обработкой бутана оксидом алюминия и хромом при высоких температурах. [11]
из этанола
В других частях света, включая Южную Америку, Восточную Европу, Китай и Индию, бутадиен также производится из этанола. Несмотря на неконкурентоспособность парового крекинга для производства больших объемов бутадиена, более низкие капитальные затраты делают производство этанолом жизнеспособным вариантом для установок меньшей мощности.Два процесса были в использовании.
В одностадийном процессе, разработанном Сергеем Лебедевым, этанол превращается в бутадиен, водород и воду при 400–450 ° C на любом из разнообразных металлоксидных катализаторов: [12]
Этот процесс был основой для производства синтетического каучука в Советском Союзе во время и после Второй мировой войны, и он оставался ограниченным использованием в России и других частях Восточной Европы до конца 1970-х годов. В то же время этот тип производства был отменен в Бразилии.По состоянию на 2017 год бутадиен в промышленности не производился из этанола.
В другом двухстадийном процессе, разработанном русским химиком-эмиграцией Иваном Остромисленским, этанол окисляется до ацетальдегида, который реагирует с дополнительным этанолом на промотированном танталом катализаторе пористого кремнезема при 325–350 ° C с получением бутадиена: [12]
-

CH 3 CH 2 OH + CH 3 CHO → CH 2 = CH-CH = CH 2 + 2 H 2 O
Этот процесс был одним из трех, которые использовались в Соединенных Штатах для производства «правительственного каучука» во время Второй мировой войны, хотя он является менее экономичным, чем бутановые или бутеновые маршруты для больших объемов.Тем не менее, три завода с общей мощностью 200 кмт [, когда определяется как? ] были сконструированы в США (Институт, Западная Вирджиния, Луисвилл, Кентукки и Кобута, Пенсильвания), запуск которых был завершен в 1943 году, и завод в Луисвилле первоначально создавал бутадиен из ацетилена, вырабатываемого ассоциированным заводом карбида кальция. Процесс остается в использовании сегодня в Китае и Индии.
из бутенов
1,3-Бутадиентакже может быть получен путем каталитического дегидрирования нормальных бутенов.Этот метод также использовался Программой синтетического каучука США (СССРП) во время Второй мировой войны. Процесс был намного более экономичным, чем путь спирта или н-бутана, но конкурировал с авиационным бензином за доступные молекулы бутена (бутенов было много благодаря каталитическому крекингу). УСПП построил несколько заводов в Батон-Руж и Лейк-Чарльз, штат Луизиана; Хьюстон, Бэйтаун, и Порт Неш, Техас; и Торранс, Калифорния. [10] Общий годовой объем производства составил 275 тыс. Тонн в год.
В 1960-х годах компания из Хьюстона, известная как «Petro-Tex», запатентовала процесс производства бутадиена из обычных бутенов путем окислительного дегидрирования с использованием запатентованного катализатора.Неясно, практикуется ли эта технология в коммерческих целях. [13]
После Второй мировой войны производство бутенов стало основным видом производства в СССР.
Для лабораторного использования
1,3-Бутадиен неудобен для лабораторного использования, потому что это газ. Лабораторные процедуры были оптимизированы для его получения из негазированных предшественников. Он может быть получен путем реакции ретро-Дильса-Альдера циклогексена. [14] Сульфолин — удобный твердый источник 1,3-бутадиена, который можно хранить в лаборатории.При нагревании выделяет диен и диоксид серы.
Использует
Большая часть бутадиена полимеризуется с получением синтетического каучука. Сам полибутадиен представляет собой очень мягкий, почти жидкий материал, представляющий коммерческий интерес. Сополимеры, полученные из бутадиена и стирола и / или акрилонитрила, такие как акрилонитрил-бутадиен-стирол (ABS), нитрил-бутадиен (NBR) и стирол-бутадиен (SBR), являются жесткими и / или эластичными. SBR является материалом, наиболее часто используемым для производства автомобильных шин. [11]
Меньшие количества бутадиена используются для получения нейлонового промежуточного звена, адипонитрила, путем добавления молекулы цианистого водорода к каждой из двойных связей в процессе, называемом гидроцианированием, разработанным DuPont. Другие синтетические каучуковые материалы, такие как хлоропрен и растворитель сульфолан, также производятся из бутадиена. Бутадиен используется в промышленном производстве 4-винилциклогексена посредством реакции димеризации Дильса-Альдера. [15] Винилциклогексен является распространенной примесью, обнаруживаемой в бутадиене при хранении вследствие димеризации.Циклооктадиен и циклододекатриен получают посредством реакций димеризации и тримеризации, катализируемых никелем или титаном, соответственно. Бутадиен также полезен в синтезе циклоалканов и циклоалкенов, так как он реагирует с двойными и тройными углерод-углеродными связями посредством реакции Дильса-Альдера.
Структура, структура и стабильность

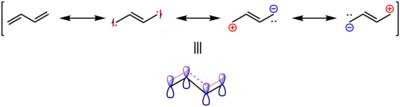
Сравнение бутадиена ( s-trans конформер) и этилена.
Наиболее стабильным конформером 1,3-бутадиена является конформация с — транс , в которой молекула плоская, с двумя парами двойных связей, обращенными в разные стороны.Эта конформация является наиболее стабильной, потому что орбитальное перекрытие между двойными связями максимизируется, обеспечивая максимальное сопряжение, в то время как стерические эффекты минимизированы. Обычно считается, что конформация s-trans имеет двугранный угол C 2 -C 3 180 °. Напротив, конформация с — цис , в которой двугранный угол равен 0 °, с парой двойных связей, обращенных в одном направлении, примерно на 16,5 кДж / моль (на 3,9 ккал / моль) выше из-за стерическое препятствие.Эта геометрия является локальным максимумом энергии, поэтому в отличие от геометрии s-trans она не является конформером. Геометрическая форма , в которой двойные связи геометрии s-cis скручены с образованием двугранного угла около 38 °, является вторым конформером, который на 12,0 кДж / моль (на 2,9 ккал / моль) выше в энергии, чем с-транс конформер. В целом между двумя конформерами существует барьер 24,8 кДж / моль (5,9 ккал / моль) для изомеризации. [16] Этот повышенный вращательный барьер и сильное общее предпочтение почти плоской геометрии свидетельствуют о делокализованной π-системе и небольшой степени частичного характера двойной связи в простой связи C-C, в соответствии с резонансной теорией.
Несмотря на высокую энергию конформации s-cis , 1,3-бутадиен должен принять эту конформацию (или одну очень похожую), прежде чем он сможет участвовать в качестве четырехэлектронного компонента в согласованных реакциях циклоприсоединения, таких как Дильс-Альдер реакция.
Аналогичным образом, совместное экспериментальное и компьютерное исследование показало, что двойная связь s-транс- бутадиена имеет длину 133,8 пм, а у этилена — 133,0 пм. Это было принято как свидетельство ослабления и удлинения π-связи в результате делокализации, как показано резонансными структурами, показанными ниже. [17]
Качественную картину молекулярных орбиталей 1,3-бутадиена легко получить, применяя теорию Хюккеля. (Статья по теории Хюккеля дает вывод для бутадиеновых орбиталей.)
1,3-Бутадиен также термодинамически стабилизирован. В то время как монозамещенная двойная связь выделяет около 30,3 ккал / моль тепла при гидрировании, 1,3-бутадиен выделяет немного меньше (57,1 ккал / моль), чем вдвое больше этой энергии (60,6 ккал / моль), что ожидается для двух изолированных двойных связей.Это подразумевает энергию стабилизации 3,5 ккал / моль. [18] Аналогичным образом, гидрирование концевой двойной связи 1,4-пентадиена высвобождает 30,1 ккал / моль тепла, тогда как гидрирование концевой двойной связи конъюгированного ( E ) -1,3-пентадиена высвобождает только 26,5 ккал / моль, что означает очень похожую величину 3,6 ккал / моль для энергии стабилизации. [19] Разницу в ~ 3,5 ккал / моль в этих теплотах гидрирования можно принять за энергию резонанса сопряженного диена.
Реакции
Промышленное использование иллюстрирует склонность бутадиена к полимеризации. Его восприимчивость к реакциям присоединения 1,4 иллюстрируется гидроцианированием. Как и многие диены, он подвергается Pd-катализируемым реакциям, которые протекают через аллильные комплексы. [20] Является партнером по реакциям Дильса-Альдера, например, с малеиновым ангидридом, чтобы получить тетрагидрофталевый ангидрид. [21]
Как и другие диены, бутадиен является лигандом для низковалентных комплексов металлов, e.грамм. производные Fe (бутадиен) (CO) 3 и Мо (бутадиен) 3 .
Здоровье и безопасность окружающей среды
Бутадиен имеет низкую острую токсичность. ЛК50 составляет 12,5-11,5 об.% Для ингаляций крысами и мышами. [11]
Длительное воздействие было связано с сердечно-сосудистыми заболеваниями, существует постоянная связь с лейкемией, а также значительная связь с другими видами рака. [23]
1,3-бутадиен был определен канцерогеном группы 1 («канцерогенно для человека») IARC, [24] , а также был включен в список канцерогенов Агентством по регистрации болезней токсичных веществ и Агентством по охране окружающей среды США. [25] [26] Американская конференция правительственных промышленных гигиенистов (ACGIH) называет это химическое вещество подозреваемым канцерогеном. [26] Совет по защите природных ресурсов (NRDC) перечисляет некоторые кластеры болезней, которые предположительно связаны с этим химическим веществом. [27] Некоторые исследователи пришли к выводу, что он является наиболее сильным канцерогеном в сигаретном дыме, вдвое сильнее, чем акрилонитрил, занявший второе место [28]
1,3-бутадиен также является подозреваемым человеческим тератогеном. [29] [30] [31] Длительное и чрезмерное воздействие может повлиять на многие области человеческого тела; кровь, мозг, глаза, сердце, почки, легкие, нос и горло, как было показано, реагируют на присутствие избыточного 1,3-бутадиена. [32] Данные, полученные на животных, показывают, что женщины имеют более высокую чувствительность к возможным канцерогенным воздействиям бутадиена на мужчин при воздействии химического вещества. Это может быть связано с воздействием рецепторов эстрогена. Хотя эти данные показывают важные последствия для риска воздействия бутадиена на человека, необходимы дополнительные данные для проведения окончательной оценки рисков.Также не хватает данных о воздействии бутадиена на репродуктивную функцию и развитие у мышей, но исследования на животных показали, что дыхание бутадиеном во время беременности может увеличить число врожденных дефектов, и у людей есть те же системы гормонов, что и у животных. [33]
1,3-бутадиен признан высокоактивным летучим органическим соединением (HRVOC) за его способность легко образовывать озон, и поэтому выбросы этого химического вещества строго регулируются TCEQ в некоторых частях озона Хьюстон-Бразория-Галвестон Non недостижения Area. веб-сайт EPA
Внешние ссылки
![The structure of (butadiene)iron tricarbonyl.[22]](/800/600/https/wiki2.org/s/i/modif.png) Последний раз эта страница редактировалась 6 июля 2020 года, в 11:18.
,
Последний раз эта страница редактировалась 6 июля 2020 года, в 11:18.
,1,3-БУТАДИЕН | 106-99-0
1,3-БУТАДИЕН Химические свойства, использование, производство
Описание
1,3-бутадиен представляет собой простой сопряженный диен. Это бесцветный газ с мягким ароматическим или похожим на бензин запахом, несовместимый с фенолом, диоксидом хлора, медью и кротоновым альдегидом. Газ тяжелее воздуха и может перемещаться по земле; возможно дистанционное зажигание. Это важный промышленный химикат, используемый в качестве мономера при производстве синтетического каучука.Большая часть бутадиена полимеризуется для получения синтетического каучука. Хотя сам полибутадиен является очень мягким, почти жидким материалом, полимеры, полученные из смесей бутадиена со стиролом или акрилонитрилом, такими как АБС, являются одновременно жесткими и эластичными. Стирол-бутадиеновый каучук является материалом, наиболее часто используемым для производства автомобильных шин. Меньшие количества бутадиена используются для получения нейлона через промежуточный адипонитрил, другие синтетические каучуковые материалы, такие как хлоропрен, и растворитель сульфолан.Бутадиен используется в промышленном производстве циклододекатриена посредством реакции тримеризации.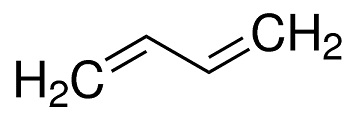
1,3-бутадиеновая структура
Физические свойства
Бесцветный газ с мягким, ароматическим или похожим на бензин запахом. Экспериментально определенное обнаружение и пороговые концентрации распознавания запаха составляли 1,0 мг / м 3 (0,45 ч / млн против ) и 2,4 мг / м 3 (1,1 ppmv) соответственно (Hellman and Small, 1974).Использует
1,3-бутадиен представляет собой нефтепродукт, полученный каталитическим крекингом нафты или светлого масла или дегидрированием бутенового бутана.Он используется для производства бутадиен-стирольного эластомера (для шин), синтетического каучука, термопластичных эластомеров, пищевых упаковочных материалов, а также в производстве адипонитрила. Он также используется для синтеза органики методом Дильса-Альдерконденсации.Использует
Синтетические эластомеры (стирол-бутадиен, полибутадиен, неопрен, нитрилы), смолы АБС, химическое промежуточное соединение.1,3-бутадиен может подвергаться четырехкомпонентной реакции сочетания с арильными реагентами Гриньяра и алкилфторидами в присутствии никелевого катализатора с образованием углеродного соединения 1,6-октадиена, замещенного алкильными и арильными группами в 3- и 8-положениях ,
1,3-бутадиен является полезным диеном для реакции Дильса-Альдера.
Это может быть использовано при синтезе следующего:
- 1-Силилзамещенные 1,3-бутадиены, путем [RuHCl (CO) (PCy3) 2] -катализированного силилирующего сочетания концевых (E) -1,3-диенов с винилсиланами.
- Синтетический каучук и термопластичные смолы.
- Дилилированные димеры путем взаимодействия с хлорсиланами.
- -окта-2,7-диен-1-ол посредством каталитической гидродимеризации с палладием.
Определение
ЧЕБИ: бутадиен с ненасыщенностью в положениях 1 и 3.Методы производства
За исключением небольшого количества бутадиена, производимого оксидегидрирование н-бутана, большая часть бутадиена производится коммерчески как побочный продукт производства этилена во время парового крекинга углеводородных потоков. это отделяется и очищается от других компонентов экстрактом перегонка с использованием ацетонитрила и диметилформамида в качестве растворители.Общее описание
Бутадиен, ингибированный, представляет собой бесцветный газ с ароматическим запахом.1,3-БУТАДИЕН поставляется в виде сжиженного газа под давлением пара. Контакт с жидкостью может вызвать обморожение. 1,3-БУТАДИЕН легко воспламеняется. Его пары тяжелее воздуха, и пламя может очень быстро вернуться к источнику утечки. 1,3-БУТАДИЕН может задыхаться при смещении воздуха. 1,3-БУТАДИЕН должен поставляться запрещенным, так как бутадиен подвержен полимеризации. Если в контейнере происходит полимеризация, 1,3-БУТАДИЕН может сильно разорваться. При длительном воздействии огня или сильной жары контейнеры могут сильно разорваться и взорваться.1,3-БУТАДИЕН используется для производства синтетического каучука и пластмасс, а также для производства других химических веществ.Реакции воздуха и воды
Легковоспламеняющиеся. При соприкосновении с воздухом бутадиен может образовывать взрывоопасные пероксиды, которые могут взорваться под действием слабого тепла или удара. Твердый бутадиен поглощает достаточное количество кислорода при давлении ниже атмосферного, чтобы заставить 1,3-БУТАДИЕН резко взорваться при нагревании чуть выше его температуры плавления [Ind. Eng. Химреагент 51: 733 1959].Реактивность профиля
Бесцветный газ 1,3-БУТАДИЕН может вступать в реакцию с окисляющими реагентами.При длительном воздействии воздуха 1,3-БУТАДИЕН образует взрывоопасные пероксиды. Они чувствительны к жаре или ударам; может произойти внезапная полимеризация [Scott, D.A., Chem. Eng. Известия, 1940, 18, с.404]. Полипероксиды бутадиена нерастворимы в сжиженном бутадиене (т. Пл. -113 ° С, б. Пл. -2,6 ° С) и постепенно отделяются, что приводит к повышению локальной концентрации. Самонагревание от самопроизвольного разложения приведет к взрыву [Hendry, D. G. et al., Ind. Eng. Chem., 1968, 7, с. 136, 1145]. Взрывается при контакте с тетрагидроборатом алюминия, потенциально взрывоопасной реакцией с диоксидом хлора (пероксид) и кротоновым альдегидом (выше 180 ° C).Реакция с нитритом натрия образует самовоспламеняющийся продукт [Sax, 9th ed., 1996, p. 539].Опасность
Подтвержденный канцероген. Раздражающий в высоком концентрация. Легковоспламеняющийся газ или жидкость, пределы взрываемости в воздухе 2–11%. Может образовывать взрывчатку перекиси на воздухе. Должен быть заблокирован во время хранения и отгрузки. Ингибиторы, часто используемые ди-н-бутиламин или фенил-β-нафтиламин. Хранение обычно находится под давлением или в изолированном танкиОпасность для здоровья
Было обнаружено, что токсичность 1,3-бутадиена очень низкая у людей и животных.Это удушающий. У людей малотоксичные эффекты могут наблюдаться при воздействии 2000 ч / млн в течение 7 часов. Симптомами могут быть галлюцинации, искаженное восприятие и раздражение глаз, носа и горла. Более высокие концентрации могут привести к сонливости, легкомысленности и наркозу. Высокие дозы 1,3-бутадиена токсичны для животных при вдыхании и контакте с кожей. Общие анестезирующие эффекты и дыхательная депрессия не отмечались. Концентрация 25–30% может привести к летальному исходу для крыс и кроликов. Контакт со сжиженным газом может вызвать ожог и обморожение.Воздействие 1,3-бутадиена вызвало рак желудка, легких и крови у крыс и мышей. Предполагается, что он является канцерогеном для человека. Это мутаген и тератоген.
Пожарная опасность
Поведение в огне: пары тяжелее воздуха и могут перемещаться на значительное расстояние к источнику возгорания и вспышки. Контейнеры могут взорваться при пожаре из-за полимеризации.Профиль безопасности
Подтвержденный канцероген с экспериментальным канцерогенным и новообразования.Экспериментальный тератогенным. Данные мутации сообщили. Вдыхание высоких концентраций может вызвать бессознательное состояние и смерть. Человек системные эффекты при вдыхании: кашель, галлюцинации, искаженное восприятие, изменения в поле зрения и др.Канцерогенность
Известно, что 1,3-бутадиен является канцерогеном для человека на основании достаточных доказательств канцерогенности в исследованиях на людях, включая эпидемиологические и механистические исследования. 1,3-бутадиен был впервые включен в пятый ежегодный доклад о канцерогенных веществах в 1989 году, поскольку разумно предполагалось, что он является канцерогеном для человека, основываясь на достаточных доказательствах канцерогенности в исследованиях на экспериментальных животных.Список был пересмотрен, чтобы стать канцерогеном для человека в Девятом докладе по канцерогенам в 2000 году.Источник
Schauer et al. (2001) измеряли скорости выбросов органических соединений для летучих органических соединений, газофазных полулетучих органических соединений и частиц органических соединений от жилого (каминного) сжигания сосны, дуба и эвкалипта. Газофазная эмиссия норма 1,3-бутадиена составила 177 мг / кг сожженной сосны. Нормы выбросов 1,3-бутадиена не были измеряется при сгорании дуба и эвкалипта.Экологическая Судьба
Поверхностная вода. Расчетный период полураспада улетучивания 1,3-бутадиена в модельной реке глубиной 1 м, скорость потока 1 м / с, а скорость ветра 3 м / с составляет 3,8 ч (Lyman et al., 1982).Фотолитик. Следующие константы скорости были сообщены для реакции 1,3-бутадиена и ОН радикалы в атмосфере: 6,9 х 10 -11 см 3 / молекула · сек (Аткинсон и др., 1979) и 6,7 х 10 -11 см 3 / молекула · сек (Sablji? and Güsten, 1990).Аткинсон и Картер (1984) сообщили о константе скорости 6,7–8,4 x 10 -11 см 3 / молекулу · сек для реакции 1,3-бутадиена и озона в атмосфере. Константы скорости фотоокисления составляли 2,13 × 10 -13 и 7,50 × 10 -18 см. 3 / молекулу · сек. сообщается о реакции 1,3-бутадиена и NO3 (Benter and Schindler, 1988; Sablji? and Гюстен, 1990). Период полураспада на воздухе для реакции 1,3-бутадиеновых и NO3 радикалов составляет 15 ч. (Аткинсон и др.1984a).
Химический / Физический. Полимеризуется в присутствии кислорода, если нет ингибитора (Hawley, 1981).
хранилище
1,3-Бутадиен хранится в прохладном и хорошо вентилируемом месте, отделенном от горючих и окисляющих веществ. Небольшое количество стабилизаторов, таких как о-дигидроксибензол, п-трет-бутилкатехол или алифатические меркаптаны, добавляют для предотвращения его полимеризации или образования пероксидов. Цилиндры хранятся в вертикальном положении и защищены от физических повреждений.1,3-БУТАДИЕН Подготовка продуктов и сырья
Сырье
Продукты для приготовления
Сшивающий агент Карбоксилат-бутадиеновый латекс метакрилнитрил 1-бутен Цис-1,2,3,6-тетрагидрофаллический ангидрид; > 98% модифицированный наполнитель SBR 5-этилиден-2-норборнен мускон N, N, N», N’-тетраметил-2-бутен-1,4-диамина 2- (2-хлорэтокси) бензолсульфонамид циклододекановое ВИТАМИН К4 Сульфолан бутадиен-стирольный латекс Поливинилпирролидон 4-винилциклогексен диоксид 3-SULFOLENE Кэптан витамин К3 Нитриловая резина NBR цис-1,2,3,6-тетрагидрофталевый ангидрид Малеиновый гидразид Адипонитрил 1,2,3,4-Tetrabromobutane ПОЛИБУТАДИЕНОВЫЙ ДИАКРИЛАТ 1,6-гександиамин 1,2,5,6,9,10-Гексабромциклододекан Бутадиен-стирольный каучук DOWEX (R) 1X8 Додекандиовая кислота 2,4,4-триметил-1-пентена ABS смолы 2-бутанол ТОПЛИВНОЕ НЕФТЬ Cyclododeca-1,5,9-триен ирон эмульсия бутадиеновой смолы LHYJ-DS50 Ti (Co) катализатор Циглера 1,4-гексадиен N-гидроксиметил-3,4,5,6-тетрагидрофталимид ,ЯрлыкA — Master Organic Chemistry
Ярлык для определения гибридизации атома в молекуле
Вот краткий обзор того, как определить гибридизацию атома в молекуле. Это сэкономит вам много времени.
— НАЧАТЬ КРАТКУЮ СТРАНИЦУ —
Вот что вы делаете:
- Посмотрите на атом.
- Подсчитайте количество атомов, связанных с ним (атомов — , а не связей!)
- Подсчитайте количество неподключенных пар, присоединенных к нему.
- Добавьте эти два числа вместе.
- Если это 4, ваш атом sp 3 .
- Если это 3, ваш атом sp 2 .
- Если это 2, ваш атом sp.
(если это 1, это, вероятно, водород!)
Это работает как минимум в 95% случаев, которые вы увидите в Org 1.
–END SHORTCUT–
Оглавление
- Несколько простых проработанных примеров сочетания клавиш гибридизации
- Как определить гибридизацию атома: два упражнения
- Существуют ли исключения?
- Исключение № 1: Одиночные пары, смежные с пи-связями
- Одиночные пары в P-орбиталях (в отличие от гибридных орбиталей) имеют лучшее перекрытие орбит с соседними системами Пи
- Исключение № 2.Геометрические ограничения
- «Геометрия определяет гибридизацию, а не наоборот»
- Примечания
1. Некоторые простые проработанные примеры сочетания клавиш гибридизации
sp 3 гибридизация : сумма присоединенных атомов + одиночные пары = 4
sp 2 гибридизация : сумма присоединенных атомов + одиночные пары = 3
sp гибридизация : сумма присоединенных атомов + одиночные пары = 2
Где можно начать получать немного сложнее работать с линейными диаграммами, содержащими неявные («скрытые») водороды и одинокие пары.Химикам так же, как и всем остальным, нравятся сокращающие время ярлыки, и обучение быстрой интерпретации линейных диаграмм столь же фундаментально для органической химии, как и изучение алфавита для письменного английского.
Помните:
- То, что одиночные пары не вовлечены в кислород, азот и фтор, не означает, что их там нет.
- Предположим полный октет для C, N, O и F со следующим одно исключение : положительный заряд углерода означает, что вокруг него всего шесть электронов.[Азот и кислород, несущие формальный заряд +1, все еще имеют полные октеты].
[ Дополнительно: краткое примечание об определении гибридизации атомов в некоторых странных случаях, таких как свободные радикалы, карбены и нитрены]
2. Как определить гибридизацию атома: два упражнения
Вот упражнение , Попробуйте выделить гибридизацию атомов в этой очень ядовитой молекуле, сделанную лягушкой в причудливой пижаме, внизу справа.
[Не беспокойтесь, если молекула выглядит немного сумасшедшей: просто сфокусируйтесь на отдельных атомах , на которые указывают стрелки (A, B, C, D, E).А и Б особенно. Если вы еще не освоили линейные диаграммы (и «скрытые» атомы водорода), возможно, попробуйте еще немного и вернитесь к этому позже.]
[Ответы здесь]
Вот еще несколько примеров.
[Ответы здесь.]
3. Есть ли исключения?
Конечно. Хотя, как и во многих других случаях, объяснение ярлыка занимает около 2 минут, а объяснение исключений — в 10 раз дольше.
Полезно, что эти исключения делятся на две основные категории.Следует отметить, что к тому времени, когда ваш курс объяснит, почему эти примеры являются исключениями, он, вероятно, выйдет далеко за пределы гибридизации.
Итог: , вероятно, их не будет на первом промежуточном этапе.
4. Исключение № 1: одиночные пары, примыкающие к пи-связям
Основное исключение касается атомов, несущих одинокие пары, которые соседствуют с пи-связями.
Быстрый ярлык: Одиночные пары, смежные с пи-связями (и пи-системами), как правило, находятся в негибридизованных p-орбиталях, а не в гибридизированных sp и орбитали.Таким образом, когда азот, который, как вы можете ожидать, является тригонально-пирамидальным sp 3 , соседствует с пи-связью, его гибридизация фактически является sp 2 (тригональный планар).
Почему? Быстрый ответ заключается в том, что снижение энергии от сопряжения более чем компенсирует любой прирост энергии за счет усиления стерических помех. [см. этот пост: «Спряжение и резонанс»]
Какой длинный ответ?
5. Одиночные пары в P-орбиталях (в отличие от гибридных орбиталей) имеют лучшее перекрытие орбит с соседними системами Pi
Давайте вспомним, почему атомы гибридизируются в первую очередь: минимизация отталкивания электронных пар.
Для первичного амина, такого как метиламин, принятие тетраэдрической (sp 3 ) геометрии азотом по сравнению с тригональной плоской (sp 2 ) геометрией стоит около 5 ккал / моль [примерно 20 кДж / моль]. Это может показаться не таким уж большим, но для двух видов в равновесии разница в энергии 5 ккал / моль представляет собой соотношение около 4400: 1]. [Откуда мы это знаем? См. Это (расширенное) примечание по инверсии азота]
Что, если бы был какой-то компенсирующий эффект, благодаря которому негибридизированная p-орбиталь в одиночной паре была фактически более стабильной, чем если бы она была на гибридизированной орбите?
Это оказывается случаем во многих ситуациях, когда одинокая пара соседствует с пи-связью! Наиболее распространенный и важный пример — это амиды, которые образуют связи между аминокислотами.Азот в амидах является плоским (sp. 2 ), а не тригонально-пирамидальным (sp. 3 ), что доказано рентгеновской кристаллографией.
Разница в энергии широко варьируется, но типичное значение составляет около 10 ккал / моль в пользу треугольной плоской геометрии. [Мы знаем это, потому что многие амиды имеют измеримый барьер для вращения — тема, о которой мы также говорили в посте «Сопряжение и резонанс»]
Почему тригональная плоская геометрия здесь предпочтительнее? Лучшее орбитальное перекрытие орбитали с пи-связью(гибридизированный) sp 3 орбитальный .
На рисунке ниже показано, как изменение гибридизации с sp 3 на sp 2 приближает p-орбиталь к смежным p-орбиталям pi-связи, обеспечивая лучшее перекрытие орбит. Улучшение орбитального перекрытия обеспечивает более сильную пи-связь между одиночной парой азота и карбонильной п-орбитали, что приводит к общему снижению энергии.
Можно думать, что это ведет к более сильной «частичной» связи C – N.Двумя важными последствиями этого взаимодействия являются ограниченное вращение в амидах, а также тот факт, что кислота реагирует с амидами на кислороде, а не на неподеленную пару азота (!). как и азот в енаминах и бесчисленное множество других примеров.
Как вы, вероятно, увидите в Org 2, некоторые из наиболее драматичных случаев — это случаи, когда «дегибридизированная» одиночная пара участвует в ароматической системе. Здесь энергетическая компенсация за изменение гибридизации от sp 3 до sp 2 действительно может быть очень большой — в некоторых случаях более 20 ккал / моль.
По этой причине самым основным местом пиррола является не одиночная пара азота, а углерод (C-2) (!).
6. Исключение № 2. Геометрические ограничения
Другой пример, где фактическая гибридизация отличается от того, что мы могли бы ожидать от ярлыка, — это случаи с геометрическими ограничениями. Например, в приведенном ниже фенильном катионе указанный углерод присоединен двумя двумя атомами и нулевыми парами. Что такое гибридизация?
Из нашего ярлыка можно ожидать, что гибридизация будет sp.
На самом деле геометрия вокруг атома гораздо ближе к sp 2 . Это потому, что угловая деформация с использованием линейной (sp) геометрии приведет к слишком большой угловой деформации, чтобы быть стабильной молекулой.
7. «Геометрия определяет гибридизацию, а не наоборот»
Цитата, переданная мне от Мэтта, кажется уместной:
«Геометрия определяет гибридизацию, а не наоборот»
Ну, это, вероятно, еще чем вы хотели узнать о том, как определить гибридизацию атомов.Достаточно сказать, что любое сообщение с этого сайта, содержащее ярлык в заголовке, является верной ставкой, в которой более 1000 слов и> 10 цифр.
Спасибо Мэтту Пирсу из Organic Chemistry Solutions за важный вклад в этот пост. Спросите Мэтта о планировании онлайн-обучения здесь.
Заметки
Ответы на Q1: A) sp 3 B) sp 3 C) sp D) sp 2 E) sp 3
Ответы на Q2: A) sp 3 B) sp 2 C) sp 2 D) sp 2 E) sp F) sp G) sp H) sp
Примечание 1.Несколько странных случаев.
Маловероятно, чтобы встретить их, но здесь идет:
Как насчет высших блочных элементов, таких как сера и фосфор?
Элементы третьего ряда, такие как фосфор и сера, могут превышать октет электронов путем включения d-орбиталей в гибрид. Это больше относится к области неорганической химии, поэтому я не хочу обсуждать это. Вот пример гибридизации SF4 из других источников. (sp 3 d орбиталей).
Примечание 2 : цифру 5 ккал / моль см. Здесь.[Tetrahedron Lett, 1971, , 37, , 3437].
Амин, связанный с тремя различными заместителями (R 1 R 2 и R 3 ), должен быть хиральным, поскольку он имеет всего 4 различных заместителя (включая неподеленную пару). Однако все ранние попытки получения энантиомерно чистых аминов потерпели неудачу. Позже было обнаружено, что амины подвергаются инверсии при комнатной температуре, подобно тому, как сильный ветер вынуждает зонт вывернуться наизнанку.
В переходном состоянии для инверсии азот является тригонально-плоским.Таким образом, можно измерить разницу в энергии между геометриями sp 3 и sp 2 , измерив активационный барьер для этого процесса (особенно в работе Курта Мислоу ( RIP )].
Примечание 3 : Забавным контрпримером может быть Coelenterazine
Не следует ожидать гибридизации обоих атомов азота sp 2 , потому что это приведет к циклической плоской сопряженной системе с 8 пи электронами: другими словами, антиароматические ,Я не могу найти кристаллическую структуру молекулы ядра, чтобы подтвердить (но приветствовал бы любую дополнительную информацию!)
ПРИМЕЧАНИЕ — (добавлено впоследствии) Если вы рисуете резонансную форму, где одиночная пара азота образует пи-связь с карбонильным углеродом тогда кольцевая система имеет 10 электронов и поэтому будет «ароматической».
Еще две реакции диенов: свободнорадикальное присоединение HBr к диенам и добавление Br 2 к диенам
В более ранней публикации мы рассмотрели 1,2 и 1,4 добавки к диенам, в частности, добавление сильной кислоты (например, HCl или HBr) к диенам.
Вы можете по праву спросить: «Это так?». Есть ли другие примеры реакций, которые дают «1,2» против «1,4» продуктов?
Почему да, спасибо, что спросили.Сегодня мы рассмотрим еще два: добавление HBr к диенам в свободном радикале и добавление Br2 к диенам.
Да, и мы также разберемся с тремя, а не с 1,4 дополнительными практическими проблемами.
Оглавление
- Резюме: «1,2» против «1,4» Добавление к диенам и «Кинетический контроль» по сравнению с «Термодинамическим контролем»
- Свободнорадикальное добавление HBr к диенам также При условии кинетического и термодинамического контроля
- При радикальном добавлении HBr к бутадиену 1,2-продукт является кинетическим продуктом, а 1,4-продукт является термодинамическим продуктом
- Добавление Br 2 (и других галогенов) к диенам
- 1,2- и 1,4- продукты в дополнение к Br 2 к бутадиену
- Роль температуры в определении соотношения продуктов 1,2- и 1,4- добавление Br 2 К бутадиену
- Другая рационализация того, почему 1,2-продукт является кинетическим продуктом: ионное соединение
- Думая через «кинетический» и «термодинамический» контроль — три практические проблемы
- Вопрос № 1.Циклопентадиен
- Вопрос № 2 (2,5-диметилгекса-2-4-диен)
- Вопрос № 3: 1-Метилциклогексадиен
- Заключение
- Примечания
1. Резюме: «1,2» против «1,4», добавление к диенам, и «кинетический контроль» против «термодинамического контроля»,
,. Напомним: в орг. 1 мы узнали, что добавление HCl и HBr к нормальным изолированным алкенам (таким как 1-бутен) дает только один продукт — продукт Марквоникова («1,2-сложение»), где Н и нуклеофил (т.е.грамм. Br-) находятся на соседних атомах углерода, а Br добавлен к наиболее замещенному атому углерода.
Однако добавление кислоты к диену приводит к резонансно стабилизированному карбокатиону , который может подвергаться атаке нуклеофилом в двух возможных положениях и, таким образом, может привести к двум различным продуктам.
Два разных продукта — это продукт с 1,2-присоединением, где H и Br находятся на соседних атомах углерода, и продукт с 1,4-присоединением, где атомы углерода, несущие H и Br, разделены двойным связь.
Температура играет ключевую роль в определении распределения продукта. При низких температурах реакция необратима, и продукт, который проходит через переходное состояние с наименьшей энергией (то есть продукт, который образуется быстрее всего!), Является предпочтительным. Мы рационализировали это, сказав, что атака произошла на углероде, лучше всего способном стабилизировать положительный заряд (то есть «резонансная форма» с наиболее стабильным карбокатионом). При более высоких температурах реакция становится обратимой, и предпочтительным продуктом будет продукт с наиболее замещенной двойной связью (мало чем отличающийся от правила Зайцева). Мы называем эти два условия соответственно кинетическим контролем и термодинамическим контролем.
Мы закончили пост с викториной, которую я здесь воспроизвожу.
Мы разберемся с ответами на эти вопросы внизу.
Но сначала, для полноты, давайте рассмотрим две другие реакции диенов, которые могут привести к 1,2- и 1,4-аддитивным продуктам.
- Добавление HBr к диенам в условиях свободных радикалов
- Добавление Br 2 (и других дигалогенов, таких как Cl 2 и I 2 ) к диенам.
Вполне возможно, что вы никогда не увидите этих реакций диенов в своем курсе. Таким образом, вы можете думать об этом как о бонусной теме.
2. Свободное радикальное добавление HBr к диенам также является предметом кинетического и термодинамического контроля. из HBr. В частности, нагревание HBr в присутствии инициатора свободных радикалов (такого как ди-трет-бутилпероксид, бензоилпероксид, AIBN или просто «пероксиды») приводит к образованию радикала брома Br •, который добавляет алкены в такой способ в пользу наиболее стабильного радикального промежуточного звена.[Просмотрите это здесь, если хотите]. На практике это приводит к «антимарковниковскому» добавлению к алкену, где Br • добавляет наименее замещенный углерод двойной связи, и радикал оказывается на наиболее замещенный (и, следовательно, наиболее стабильный) углерод. Когда Br • добавляет к диену , мы получаем резонанс-стабилизированный свободный радикал. Этот радикал будет иметь две важные резонансные формы, и потенциально могут образовываться два продукта, в зависимости от того, отводит ли радикал водород из H-Br на С-2 или С-4.
Ниже мы нарисовали, как это выглядит при добавлении Br • к бутадиену. (Для краткости мы пропустили выписывание механизма и шага радикального инициирования, но это описано в посте, указанном выше, если вам нужен освежитель.)
(обязательное напоминание: резонансные формы не находятся в равновесии. Они просто внести различный вклад в резонансный гибрид)
3. При радикальном добавлении HBr к бутадиену 1,2-продукт является кинетическим продуктом, а 1,4-продукт является термодинамическим продуктом
Обратите внимание, что атака Br • при C-1 бутадиен приводит к паре резонансных форм, мало чем отличающихся от резонансных форм, которые мы видели при добавлении HBr в нерадикальных условиях.Подобно карбокатионам, свободные радикалы увеличивают стабильность по мере увеличения числа присоединяемых атомов углерода. Поэтому следует ожидать, что верхняя резонансная форма (где радикал находится на вторичном углероде, C-2) будет основным вкладчиком в резонансный гибрид, и нижняя резонансная форма (где радикал находится на первичном углероде, C-4) ) быть второстепенным участником резонансного гибрида.
[Почему Br • атакует C-1 (или C-4, так как бутадиен симметричен)? Потому что это будет генерировать (стабилизированный) аллильный свободный радикал.Атака на С-2 или С-3 не дает резонанс-стабилизированного свободного радикала и поэтому менее благоприятна]
Поскольку 1,2-продукт образуется в переходном состоянии с более низкой энергией (то есть более стабильном), мы Можно ожидать, что это всегда будет основным продуктом. И действительно, при низких температурах, где реакция необратима, это так.
Однако вы можете вспомнить из правила Зайцева, что термодинамическая стабильность алкенов возрастает, когда С-Н-связи на алкене меняются местами для С-С-связей.Следовательно, 1,4-продукт (дизамещенный алкен) является более термодинамически стабильным, чем 1,2-продукт (монозамещенный алкен). При более высоких температурах, когда реакция становится обратимой, можно ожидать, что 1,4-продукт будет доминировать.
Это , кажется , чтобы создать ситуацию, подобную ситуации для добавления HBr к диенам в нерадикальных условиях, где мы имеем кинетический (1,2) продукт и термодинамический (1,4) продукт, и таким образом можем контролировать распределение продукта с помощью тепла.На практике, однако, трудно наблюдать «чистое» добавление радикалов без вмешательства карбокатионного пути, особенно при более высоких температурах.
4. Добавление Br 2 (и других галогенов) к диенам
Другим семейством электрофилов, которые могут выполнять 1,4 добавление к диенам, являются дигалогены, такие как Cl 2 , Br 2 и I 2
Вы можете вспомнить из Организации 1, что дигалогены добавляют к алкенам с образованием 1,2 дигалогенидов (также известных как «вицинальные» дигалогениды), и эта реакция протекает через заряженный 3-членный кольцевой интермедиат (например,грамм. «ион бромония»). Этот 3-членный кольцевой интермедиат, как правило, довольно стабилен, о чем свидетельствует тот факт, что стереохимия добавления обычно составляет против . [Если бы присутствовал свободный карбокатион, мы бы получили смеси син и анти, , поскольку карбокатион является плоским и может принимать нуклеофилы с двух сторон].
Второй этап этого процесса (атака Br-) можно представить как гибрид реакций S N 1 и S N 2.Подобно реакции S N 1, атака предпочтительна для углерода, который лучше всего стабилизирует положительный заряд (как правило, наиболее замещенный карбокатион). Как и реакция S N 2 (и в отличие от S N 1), атака происходит с инверсией конфигурации.
5. 1,2- И 1,4- Продукты в дополнение к Br 2 к бутадиену
Когда дигалоген, такой как Br 2 , добавляют к диену, такому как бутадиен, промежуточное соединение иона бромония образуется на одна из двойных связей.Атака нуклеофила может происходить в двух разных положениях. Атака на С-2 дает 1,2-произведение. Атака на С-4 дает 1,4-произведение.
Подождите! Вы могли бы хорошо спросить. Как это работает? У C-4 даже нет уходящей группы !!
Верно! Однако там — это хорошая уходящая группа на С-2 (Br), и — это пи-связь между С-3 и С-4. Таким образом, вы можете себе представить следующую цепочку происходящих событий:
- Br (-) атакует C-4, образуя C-Br,
- …, что приводит к разрыву пи-связи между C-3 и C-4 и образованию новая пи-связь между C-2 и C-3,
,- … которая вытесняет уходящую группу на C-2,
,
,. Другими словами, может быть полезно думать об этой промежуточной двойной связи как о нуклеофиле , который «выталкивает» Уходя из группы Br на C-2.
Этот процесс напоминает реакцию S N 2, , за исключением того, что между нуклеофилом и уходящей группой возникает двойная связь. По этой причине этот тип реакции часто называют реакцией S N 2 ‘(«SN2 prime»). На начальных курсах по органической химии это не так уж и много, но когда оно появляется, оно, как правило, на экзаменах!
Итак, какой продукт является предпочтительным?
6. Роль температуры в определении соотношения продукта 1,2- и 1,4- Добавление Br 2 к бутадиену
Давайте посмотрим на результаты, когда температура меняется.
- При низких температурах преобладает 1,2-добавление к бутадиену (60:40 при –15 ° C).
- При более высоких температурах 1,4-продукт является основным (90:10 при 60 ° C).
С бутадиеном мы снова имеем ситуацию, когда «1,2-аддитивный продукт» является «кинетическим продуктом», а «1,4-продукт» является термодинамическим продуктом (т.е. имеет более стабильную двойную связь ).
Кажется понятным, что 1,4-продукт является термодинамическим продуктом, поскольку он имеет наиболее замещенную двойную связь.
Но кажется немного странным, что 1,2-произведение будет кинетическим, . В конце концов, мы не имеем дело со свободным карбокатированием здесь.
Две мысли по этому поводу. Во-первых, это может помочь думать о том, что ион бромония находится в равновесии со свободным карбокатионом. Углерод, наиболее способный стабилизировать этот положительный заряд, представляет собой С-2, поскольку он вторично и , стабилизированный резонансом.
Если вы посмотрите на это так, то это приведет к «добавлению 1,2 в результате атаки на углерод, который лучше всего стабилизирует положительный заряд», как мы видели ранее.
7. Другое обоснование того, почему 1,2-продукт является кинетическим продуктом: ионное соединение
Существует второй способ взглянуть на это. «Кинетический продукт» также может быть результатом того, что Br (-) образует относительно плотную ионную пару с ионом бромония. Идея здесь заключается в том, что при низких температурах Br (-) удерживается близко к иону бромония посредством электростатического притяжения и, таким образом, атакует ближайший электрофил (C-2).
Так что же правильно? Происходит ли 1,2-присоединение быстрее, потому что углерод лучше всего способен стабилизировать положительный заряд, или это быстрее из-за ионного спаривания?
В этом примере рационализации «наиболее стабильный карбокатион» и «плотная ионная пара» дают один и тот же результат.К сожалению, эти рационализации могут дать разные результаты с некоторыми более сложными диенами, и учебники конфликтуют относительно того, какую рационализацию использовать.
Что приводит нас к нашей практике проблем.
8. Мышление через «кинетический» и «термодинамический» контроль — три практические проблемы или «термодинамический».- Относительная стабильность карбокатионов в промежуточном резонансе составляет
- Относительная стабильность двойных связей в конечных продуктах
Вот и все.Задача состоит в том, чтобы
- нарисовать промежуточный резонанс-стабилизированный карбокатион (ы), а
- нарисовать продукты, которые могут возникнуть в результате атаки нуклеофила на эти резонансные формы.
Давайте рассмотрим эти три примера.
9. Вопрос № 1. Циклопентадиен
Первый пример (циклопентадиен) — это вопрос с подвохом, хотя и довольно простой. Зачем?
Посмотрите, что произойдет, когда мы протонируем C-1. Мы получаем две идентичных резонансных форм.Это означает, что везде, где Br (-) атакует, это приведет к одному и тому же продукту.
Другими словами, 1,2- и 1,4-продукты абсолютно одинаковы! [Сноска]
10. Пример № 2 (2,5-диметилгекса-2-4-диен)
Это пример, который может дать два противоречивых «правильных» ответа в зависимости от того, какая рационализация для 1,2-сложения ваш учебник (или инструктор) предпочитает: «стабильность карбокатиона» или «ионное спаривание». Итак, вот несколько советов: если вы пишете экзамен по этой теме, проконсультируйтесь с вашим инструктором и / или учебником по этому вопросу, чтобы узнать, какой ответ они считают правильным.
(Конечно, на самом деле есть только один правильный ответ: что говорят нам эксперименты? Но эту информацию может быть трудно найти для конкретных примеров).
Интерпретация № 1: рационализация «более стабильного карбокатиона»
Давайте сначала разберемся с этим вопросом, используя структуру «более стабильного карбокатиона». Мне это нравится, потому что это хорошая практика для применения знакомых понятий в новых ситуациях.
Протонирование С-1 2,5-диметилгекса-2,4-диена приводит к резонансно-стабилизированному аллильному карбокатиону.Но посмотрите на то, где карбокатион находится в этих двух резонансных формах!
Резонансная форма, в которой карбокатион находится на С-2, будет менее важной, чем резонансная форма, где карбокатион находится на С-4, поскольку С-4 является более замещенным углеродом.
Поэтому мы ожидаем, что 1,4-продукт будет кинетическим продуктом .
Кроме того, когда мы смотрим на два возможных алкеновых продукта, 1,2-продукт имеет более замещенную (и, следовательно, более стабильную) двойную связь!
Это означает, что 1,2-продукт будет термодинамическим продуктом .
Суть в том, что какой продукт является «кинетическим продуктом», а какой — «термодинамическим продуктом», зависит от структуры исходного диена. Бутадиен и 2,5-диметилгекса-2,4-диен дают противоположные результаты, но принципы, которые используются, идентичны.
Это пример, где применение концепций, а не просто запоминание приносит дивиденды. Вот почему мне так нравится эта проблема.
Интерпретация № 2: Рационализация «Tight Ion Pair»
Учебники Лоудона и Кляйна (и, возможно, другие) поддерживают идею рационализации того, что продукт из 9,203 с 1,2-компонентами всегда
всегда приводит к низким температурам из-за ионного спаривания.
- Относительная стабильность карбокатионов в промежуточном резонансе составляет
- Относительная стабильность двойных связей в конечных продуктах
В этом случае 1,2-продукт будет доминировать как при низкой температуре (из-за ионного спаривания), так и при более высокой температуре (поскольку он имеет наиболее стабильную двойную связь). Следовательно, нагревание реакции до индукции обратной реакции не изменит распределение продукта.
[Что эксперименты говорят нам? Я не могу найти добавление HCl или HBr к 2,5-диметилгекса-2,4-диену, но хлорирование с помощью Cl2 дает 1,2-продукт, поддерживающий рационализацию ионной пары в этом случае].
11. Пример № 3: 1-метилциклогексадиен
Давайте рассмотрим третий (на мой взгляд, самый сложный) пример: 1-метилциклогексадиен.
Ключ к получению правильного ответа здесь зависит от выбора наиболее стабильного резонансно-стабилизированного карбокатиона, который может быть образован протонированием.
Это проблема, потому что 1-метилциклогексадиен не является симметричным!
Протонирование в С-1 приводит к стабилизированному резонансом карбокатиону с двумя резонансными формами, каждая из которых несет вторичный карбокатион.Это кажется относительно стабильным, верно?
Тем не менее, протонирование в C-4 приводит к резонансно-стабилизированному карбокатиону с двумя резонансными формами, одна из которых несет вторичный карбокатион, а одна из которых имеет третичный карбокатион! Это будет значительно более стабильно и, следовательно, внесет больший вклад в резонансный гибрид.
Это означает, что протонирование на C-4 — лучший ответ здесь.
Если мы затем двинемся вперед из этих двух резонансных форм, мы получим ситуацию, не похожую на ситуацию для 2,5-диметилгекса-2,4-диена, описанную выше.
Если вы используете рационализацию «какой углерод может лучше всего стабилизировать положительный заряд», то можно ожидать, что продукт присоединения 1,4 будет доминировать при низкой температуре (так как он возникнет в результате атаки на третичный С-1) и 1,2 -добавление будет доминирующим продуктом при высокой температуре (поскольку оно имеет наиболее стабильную двойную связь).
Конечно, если рационализация «ионной пары» является предпочтительной, тогда 1,2-продукт доминирует как при низких, так и при высоких температурах, поскольку он имеет тризамещенную двойную связь, а 1,4-продукт имеет ди -замещенная двойная связь.
Опять же, посоветуйтесь с вашим учебником / инструктором, чтобы увидеть, какую рационализацию они используют .
12. Заключение
Таким образом, это, вероятно, больше, чем большинство людей когда-либо хотят знать или заботиться о 1,2-1,4-дополнение к диенам. Но если вы хотите подготовиться к экзамену — и многие из вас читают это! — стоит понять принципы, лежащие в основе этих реакций на более глубоком уровне.
В следующем посте мы перейдем от полярных пошаговых добавок к диенам к некоторым относительно неполярным , согласованным добавкам к диенам.Это заставит нас обсуждать, пожалуй, самую мощную и разностороннюю реакцию, когда-либо обнаруженную.
Спасибо Тому Струблу и Мэтту Пирсу за полезный вклад в этот пост.
Примечания
Сноска. Этот пример был вдохновлен экзаменационным вопросом, который я однажды увидел от преподавателя / университета, которого я предпочел не упомянуть, который дал добавление «1,4» в качестве термодинамического продукта и «добавление 1,2» в качестве кинетического продукта. Без шуток.

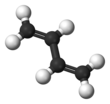


Leave A Comment