Строение, изомерия и гомологический ряд спиртов
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n
По числу гидроксильных групп:
- одноатомные спирты — содержат одну группу -ОН. Общая формула CnH2n+1OH или CnH2n+2O.
- двухатомные — содержат две группы ОН. Общая формула CnH2n(OH)2 или CnH2n+2O2.
- трехатомные спирты — содержат три группы ОН. Общая формула CnH2n-1(OH)3 или CnH2n+2O3

Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH)2 или R-C(OH)3 неустойчивы, от них легко отрывается вода и образуется карбонильное соединение.
Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
- Первичные спирты – группа ОН соединена с первичным атомом углерода. Например, этанол СН3–СН2–ОН.
- Вторичные спирты – группа ОН соединена с вторичным атомом углерода. Например, пропанол-2: СН3–СН(СН3)–ОН.
- Третичные спирты – группа ОН соединена с третичным атомом углерода. Например, 2-метилпропанол-2: (СН
- Метанол не относится ни к первичным, ни к вторичным, ни к третичным спиртам.

Классификация по строению углеводородного радикала
- Предельные спирты – группа ОН соединена с предельным радикалом. Например, пропанол-1: СН3–СН2–СН2–ОН.
- Непредельные спирты – группа ОН соединена с непредельным радикалом. Например, алкенолы: СН2=СН–СН2–ОН.
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы
- Ароматические спирты – содержат в радикале ароматическое кольцо, не связанное непосредственно с группой ОН. Например, бензиловый спирт.

В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:

| Атом кислорода в спиртах находится в состоянии sp3-гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.

Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:

Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5оС). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:

| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-ОЛ» и цифру, указывающую номер атома углерода, к которому присоединена гидроксильная группа.
Нумерация ведется от ближайшего к ОН-группе конца цепи.

- По радикально-функциональной номенклатуре названия спиртов составляют от названий углеводородных радикалов, соединенных с группой ОН, с добавлением слова «спирт».
Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
- В названиях многоатомных спиртов количество групп ОН указывают суффиксами -диол в при наличии двух ОН-групп, -триол при наличии трех ОН-групп и т.д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
Например, пропандиол-1,2 (пропиленгликоль):

Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
| Например. Формуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета |
| Бутанол-1 | 2-Метилпропанол-1 |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О: этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Изомерия спиртов
Оптические изомеры пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение (как левая рука относится к правой).
Оптическая изомерия характерна для соединений, в молекулах которых отсутствует плоскость симметрии (зеркальная плоскость), делящаяя молекулу на две идентичные части. Обычно эти соединения содержат тетраэдрический атом углерода, связанный с четырьмя различными атомами или атомными группами (асимметрический атом C*). Например:
бутанол-2
Одной структурной формуле бутанола-2 соответствуют два оптических изомера (зеркальных антипода).
Для просмотра виртуальных (VRML) моделей оптических изомеров (88 Kb) щелкните здесь.
Предлагаемая VRML-модель оптических изомеров интерактивна: Вы можете заставить приблизиться правую молекулу к левой и убедиться, что они несовместимы в пространстве (сравните положения желтых и зеленых шариков). Кроме того, можно рассматривать молекулы изомеров с трех точек зрения (вид из 3-х камер).
В химической литературе оптическая изомерия называется энантиомерией (от греч. enantios противоположный и meros часть), а оптические изомеры энантиомерами.
Энантиомеры оптически активны, они вращают плоскость поляризации света на один и тот же угол, но в противоположные стороны: (+)-изомер вправо, ()-изомер влево. Смесь равных количеств энантиомеров, называемая рацематом, оптически недеятельна и обозначается символом (±).
Измерение оптической активности
Итоговая контрольная работа по химии за 10 класс
Итоговый тест по органической химии для 10 класса.
1 вариант
Часть А Выбрать правильный ответ
1. К алканам относится вещество, имеющее общую формулу
1) Cnh3n 2) Cnh3n-2 3) Cnh3n+2 4) Cnh3n-6
2. Изомером октана является
1) 2–метил–3–этилпентан 2) 2,3–диметилпентан 3) 3–этилгептан 4) 3–метилоктан
3. Структурная формула вещества 2 – метилпентен – 1 — это
1) СН3 – СН(СН3) – СН2 – СН = СН2 3) СН3 – СН2 – СН2 – С(СН3) = СН2
2) СН2 = С(СН3) – СН2 – СН(СН3) – СН3 4) СН2 = С(СН3) – СН3
4. Этин и ацетилен – это
1) гомологи 2) изомеры 3) одно и то же вещество 4) разные вещества
5. С каким из перечисленных веществ реагирует бензол
1) NaOH 2) HNO3 3) CO2 4) CaO
6. Изомером этанола является
1) метанол 2) диэтиловый эфир 3) диметиловый эфир 4) этилацетат
7. Название, несоответствующее реакции СН3 – СОН + Н2 → С2Н5ОН
1) присоединение 2) гидрирование 3) гидратация 4) восстановление
8. Реакция образования сложных эфиров называется
1) крекинг 2) этерификация 3) дегидратация 4) поликонденсация
9. Оцените правильность суждений.
А. И этан, и этилен могут реагировать с бромом..
Б. И этанол, и фенол могут реагировать с раствором гидроксида натрия.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
10. Формула ацетальдегида
1) СН3ОН 2) СН3СООН 3) НСОН 4) СН3СОН
Часть В (Задания на соотнесение)
11. Установите соответствие между исходными веществами и продуктом реакции
ИСХОДНЫЕ ВЕЩЕСТВА ОСНОВНОЙ ПРОДУКТ РЕАКЦИИ
А) Ch3 = CH – Ch4 + НBr → 1) Ch3Br – Ch3 – Ch4
Б) C2H5Br + NaOH(спирт.р.) → 2) Ch4 – CHBr – Ch4
B) Ch4Br + 2Na → 3) Ch3Br – Ch3Br
Г) C2h5 + Br2 → 4) CHBr2 – Ch4
5) C2h5
6) C2H6
12. Установите соответствие между типом реакции и исходными веществами
ИСХОДНЫЕ ВЕЩЕСТВА ТИП РЕАКЦИИ
А) С6Н6 + Br2 → (в присутствии FeBr3) 1) реакция замещения
Б) C4h20 + Br2 → 2) реакция присоединения
В) C3H8 → 3) реакция окисления
Г) C2h5 + Н2O → 4) реакция дегидрирования
13. Установите соответствие между формулой вещества и классом, к которому оно относится.
ФОРМУЛА ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) С2Н5ОН 1) арены
Б) С6Н6 2) алкины
В) НСОН 3) одноатомные спирты
Г) СН2ОН—СН2ОН 4) многоатомные спирты
5) альдегиды
6) карбоновые кислоты
14. Установите соответствие между названием вещества и реактивом, с помощью которого его можно обнаружить.
НАЗВАНИЕ ВЕЩЕСТВА РЕАКТИВ
А) фенол 1) Cu(OH)2
Б) этилен 2) HCl
В) формальдегид 3) CuO
Г) глицерин 4) Br2
5) Ch5
Часть С
15. Написать уравнения реакций, с помощью которых можно осуществить превращения
метан → ацетилен → этаналь → уксусная кислота→ этиловый эфир уксусной кислоты
Используйте только структурные формулы органических веществ.
Итоговый тест по органической химии для 10 класса.
2 вариант
Часть А Выбрать правильный ответ
1. Общая формула гомологического ряда алкенов
1) Cnh3n 2) Cnh3n-2 3) Cnh3n+2 4) Cnh3n-6
2. Вещество СН2 – СН2 – СН2 – СН – СН2 – СН2 называется
│ │ │
СН3 СН3 СН3
1) 1,4,6 – тримемилгексан 2) 1,3,6 – триметилгексан 3) 1,3 – диметилгептан 4) 4 – метилоктан
3. Алкины не вступают в реакции
1) гидрирования 2) галогенирования 3) дегидратации 4) гидратации
4. В схеме превращений СН4 → Х → С6Н6 веществом Х является
1) С2Н6 2) С2Н4 3) С2Н2 4) С6Н12
5. С каким из перечисленных веществ не реагирует бензол
1) Cl2 2) HNO3 3) h3 4) h3O
6. Изомером пропанола-1 является
1) этанол 2) метилэтиловый эфир 3) диметиловый эфир 4) этилформиат
7. Продуктом окисления этанола оксидом меди (II) является
1) этаналь 2) муравьиная кислота 3) этиловый эфир уксусной кислоты 4) уксусная кислота
8. Жир образуется в результате взаимодействия
1) стеариновой кислоты и метанола 2) олеиновой кислоты и этиленгликоля
3) ацетальдегида и глицерина 4) глицерина и пальмитиновой кислоты
9. Оцените правильность суждений.
А.И этилен, и ацетилен могут вступать в реакцию гидратации.
Б. Для обнаружения альдегидов и кетонов можно использовать свежеприготовленный осадок Cu(OH)2.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
10. Формула муравьиной кислоты
1) НСООН 2) СН3СООН 3) НСОН 4) СН3СОН
Часть В (Задания на соотнесение)
11. Установите соответствие между исходными веществами и продуктами реакции
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) С2Н6 → 1) → СО2 + 2Н2О
Б) С2Н6 + Cl2 → 2) → Ch4Cl + HCl
B) Ch5 + 2Cl2 → 3) → C2h5 + h3
Г) C4h20 → 4) → Ch3Cl2 + 2HCl
5) → C2H5Cl + HCl
6) → C2H6 + C2h5
12. Установите соответствие между типом реакции и исходными веществами
ИСХОДНЫЕ ВЕЩЕСТВА ТИП РЕАКЦИИ
А) С6Н6 + Cl2 → (при условии УФ-свет) 1) реакция замещения
Б) C3H6 → 2) реакция присоединения
В) C3H8 + Br2 → 3) реакция окисления
Г) C4H8 + Н2О → 4) реакция дегидрирования
13. Установите соответствие между формулой вещества и классом, к которому оно относится.
ФОРМУЛА ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) НСООН 1) алкены
Б) СН 2ОН–СНОН–СН 2ОН 2) алкины
В) С2Н2 3) одноатомные спирты
Г) СН3СОН 4) многоатомные спирты
5) альдегиды
6) карбоновые кислоты
14. Установите соответствие между названием вещества и реактивом, с помощью которого его можно обнаружить.
НАЗВАНИЕ ВЕЩЕСТВА РЕАКТИВ
А) фенол 1) Na2CO3
Б) этилен 2) HCl
В) ацетальдегид 3) KMnO4
Г) уксусная кислота 4) FeCl3
5) Ag2O (аммиачный раствор)
Часть С
15.Написать уравнения реакций, с помощью которых можно осуществить превращения
этилен → этанол → этаналь → уксусная кислота → метиловый эфир уксусной кислоты
Используйте только структурные формулы органических веществ.
Ключ Итоговая контрольная работа 10 класс «Базовый уровень»
№ | Вариант 1 | Балл | № | Вариант 2 | Балл |
1 | 3 | 1 | 1 | 1 | 1 |
2 | 1 | 1 | 2 | 4 | 1 |
3 | 3 | 1 | 3 | 3 | 1 |
4 | 3 | 1 | 4 | 3 | 1 |
5 | 2 | 1 | 5 | 4 | 1 |
6 | 3 | 1 | 6 | 2 | 1 |
7 | 3 | 1 | 7 | 1 | 1 |
8 | 2 | 1 | 8 | 4 | 1 |
9 | 1 | 1 | 9 | 1 | 1 |
10 | 4 | 1 | 10 | 1 | 1 |
11 | 2563 | 2 | 11 | 3546 | 2 |
12 | 1142 | 2 | 12 | 2412 | 2 |
13 | 3154 | 2 | 13 | 6425 | 2 |
14 | 4411 | 2 | 14 | 4351 | 2 |
15 | 1) 2Сh5→CH≡CH+3h3 2) CH≡CH+h3O→Ch4—C=O │ H 3) Ch4—C=O+2Cu(OH)2→ │ H Ch4—C=O + Cu2O+2h3O │ OH 4) Ch4—C=O +C2H5OH → │ OH → Ch4—C=O + h3O │ OC2H5 | 4 | 15 | 1) Ch3=Ch3+h3O→C2H5OH 2) C2H5OH+CuO→ Ch4—C=O + │ H + Cu + h3O 3) ) Ch4—C=O+2Cu(OH)2→ │ H Ch4—C=O + Cu2O+2h3O │ OH 4) Ch4—C=O +Ch4OH → │ OH → Ch4—C=O + h3O │ OCh4 | 4 |
| Всего | 22 |
|
| 22 |
| Критерий оценки 0-9 = 2 10-14 = 3 15-19 = 4 20 – 22 = 5 | ||||
Задание №1
EAD643
Изомером этилового спирта является
1) диметиловый эфир
2) этановая кислота
3) этиленгликоль
4) этаналь
РешениеОтвет: 1
Пояснение:
Изомерами являются вещества с одинаковым качественным и количественным составом, т.е. одинаковой молекулярной формулой.
Формула этилового спирта (этанола) – CH3-CH2-OH
Изомером этилового спирта является диметиловый эфир – CH3-O-CH3.
Качественный и количественный состав этилового спирта и диметилового эфира идентичен.
Задание №2
49CFF1
Метилциклопропан и бутен-2 являются
1) межклассовыми изомерами
2) одним и тем же веществом
3) гомологами
4) геометрическими изомерами
РешениеОтвет: 1
Пояснение:
Структурные формулы метилциклопропана и бутена-2 соответственно:
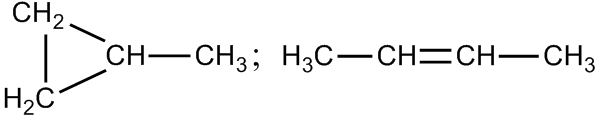
Межклассовые изомеры – это вещества с различным положением и сочетанием атомов в молекулах, имеющие одинаковую молекулярную формулу, но принадлежащие разным классам. Общая молекулярная формула метилциклопропана и бутена-2 – C4H8. Метилциклопропан относится к классу циклоалканов, бутен-2 – к классу алкенов.
Геометрическая изомерия является разновидностью пространственной и характерна для циклических соединений и соединений с двойными связями. В молекулах таких веществ заместители располагаются либо по одну, либо по разные стороны плоскости.
Гомологами называются вещества, принадлежащие к одному классу, сходные по составу, строению и свойствам, но различающиеся на одну или несколько групп CH2 (группа CH2 называется гомологической разностью).
Задание №3
937BF6
Гомологом формальдегида является
1) пропаналь
2) этилацетат
3) пропанол
4) этанол
РешениеОтвет: 1
Пояснение:
Гомологами называются вещества, принадлежащие к одному классу, сходные по составу, строению и свойствам, но различающиеся на одну или несколько групп CH2 (группа CH2 называется гомологической разностью).
Формальдегид относится к классу альдегидов, его гомологом из предложенных вариантов является пропаналь (различаются на две CH2 группы).
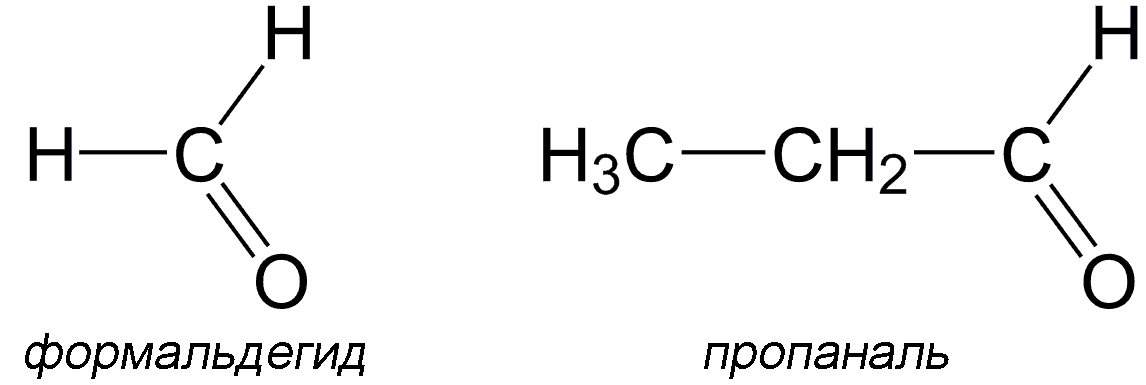
Задание №4
EFD9FB
В молекуле CH3-CHO имеются
1) 4σ- и 2π-связи
2) 6σ- и 1π-связи
3) 3σ- и 2π-связи
4) 2σ- и 3π-связи
РешениеОтвет: 2
Пояснение:
σ-связи (сигма-связи) – связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи.
π-связи (пи-связи) – связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии связи, т.е. в двух областях.
В молекуле пропаналя имеются четыре связи C-H, одна связь C-C и одна двойная связь C=O.
Связи C-H являются σ-связями, образованы в результате перекрывания гибридных sp3-орбиталей атомов углерода с s-орбиталями атомов водорода.
Связи C-C также являются σ-связями, образованы в результате перекрывания гибридных sp3-орбиталей атомов углерода друг с другом.
Связь C=O – двойная, представлена σ- и π-связями.
Таким образом, в молекуле этаналя 6σ- и 1π-связей.
Задание №5
8DC3F8
Верны ли следующие суждения об углеводородах?
А. Пропан и бутан являются гомологами.
Б. Общая формула гомологического ряда алканов – CnH2n.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
РешениеОтвет: 1
Пояснение:
Гомологи — это вещества, принадлежащие к одному классу, сходные по составу, строению и свойствам, но различающиеся на одну или несколько групп CH2 (группа CH2 называется гомологической разностью).
CH3-CH2-CH3 – пропан, CH3-CH2-CH2-CH3 – бутан
Следовательно, пропан и бутан являются гомологами, поскольку оба относятся к классу алканов и различаются на одну CH2 группу.
Общая формула гомологического ряда алканов CnH2n+2.
Таким образом, в молекуле пропаналя 6σ- и 1π-связей.
Задание №6
4B1904
Метилформиат и метиловый эфир муравьиной кислоты являются
1) структурными изомерами
2) одним и тем же веществом
3) гомологами
4) геометрическими изомерами
РешениеОтвет: 2
Пояснение:
Метилформиат и метиловый эфир муравьиной (метановой) кислоты являются одним и тем же веществом, структурная формула которого:
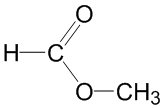
Структурные изомеры – это соединения, отличающиеся друг от друга порядком связи атомов в молекуле.
Стереоизомеры (в том числе геометрические изомеры) – это соединения, отличающиеся расположением атомов в пространстве при одинаковом порядке связей между ними.
Задание №7
DAC008
Двойная связь между атомами углерода и кислорода присутствует в молекуле
1) диэтилового эфира
2) этиленгликоля
3) бутилацетата
4) бутанола-2
РешениеОтвет: 3
Пояснение:
Структурные формулы указанных в списке соединений:
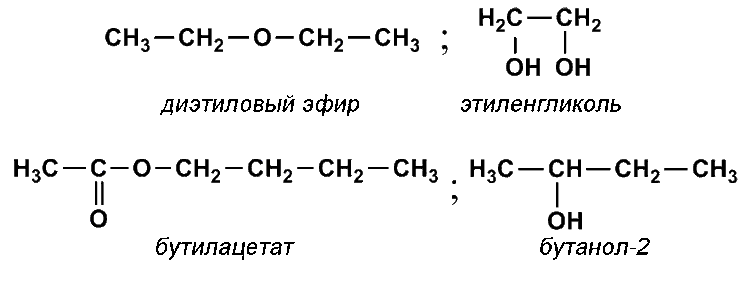
Таким образом двойная связь углерод-кислород есть только в молекуле бутилацетата.
Задание №8
EE0903
Изомером уксусной кислоты является
1) этановая кислота
2) метилацетат
3) метилформиат
4) муравьиная кислота
РешениеОтвет: 3
Пояснение:
Изомерами называют вещества, имеющие одинаковую молекулярную формулу, но различное строение молекул.
Следует отметить, что этановая кислота и уксусная кислота – это одно и то же вещество. Структурные и молекулярные формулы всех указанных в задании веществ представлены в следующей таблице:
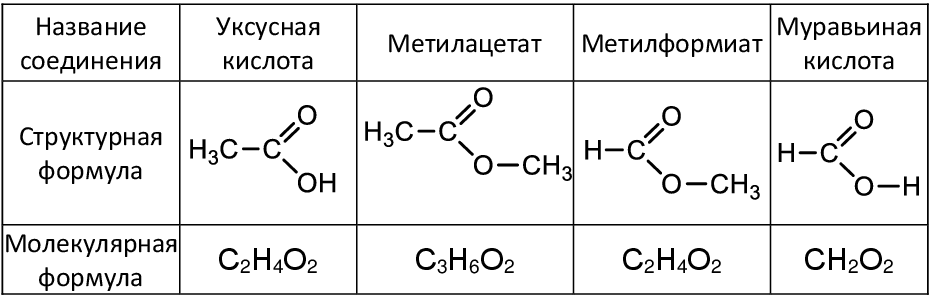
Таким образом, из представленной таблицы видно, что изомером уксусной кислоты является метилформиат.
Задание №9
FEAC76
Межклассовых изомеров не имеют
1) алкены
2) алканы
3) алкины
4) спирты
РешениеОтвет: 2
Пояснение:
Изомерами являются вещества с одинаковым качественным и количественным составом, т.е. одинаковой молекулярной формулой.
Межклассовыми изомерами алкенов являются циклоалканы, оба эти классы органических соединений имеют общую молекулярную формулу CnH2n.
Межклассовыми изомерами алкинов являются алкадиены, они имеют общую молекулярную формулу CnH2n-2.
Межклассовыми изомерами спиртов являются простые эфиры. Их общая молекулярная формула CnH2n+2O.
Задание №10
C70EC5
Структурными изомерами являются
1) этилбензоат и фенилформиат
2) метилциклопропан и метилциклобутан
3) пентанол-1 и пентаналь
4) циклопентан и пентен-2
РешениеОтвет: 4
Пояснение:
Структурные изомеры – вещества с одинаковым качественным и количественным составом, но отличающиеся строением или порядком связывания атомов в пространстве и, следовательно, свойствами.
Этилбензоат (C6H5-COOC2H5) и фенилформиат (HCOOC6H5) имеют разное количество атомов углерода, водорода и кислорода в молекулах, следовательно, не являются структурными изомерами.
Метилциклопропан (CH3-C3H5) и метилциклобутан (CH3-C4H7) принадлежат одному классу органических соединений – циклоалканов, не являются изомерами, так как имеют разное количество атомов в молекулах.
Пентанол-1 (CH3-CH2-CH2OH) и пентаналь (CH3-CH2-CHO) принадлежат к разным классам – одноатомным спиртам и альдегидами соответственно. Не являются изомерами, так как различаются количеством атомов в молекулах.
Циклопентан (C5H10) и пентен-2 (CH3-CH=CH-CH2-CH3) принадлежат к классам циклоалканов и алкенов соответственно, имеют одинаковый качественный и количественный состав, но разную структуру, следовательно, являются изомерами.
Задание №11
C8727A
π-связь имеется в молекуле
1) изобутана
2) пропанола
3) бутена
4) бутана
РешениеОтвет: 3
Пояснение:
Структурные формулы веществ, предложенных в задании, следующие:

В молекуле бутена между двумя атомами углерода имеется двойная связь, которая представлена δ- и π-связями.
Спирты, подготовка к ЕГЭ по химии
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH. Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы OH — глицерины) и т.д.
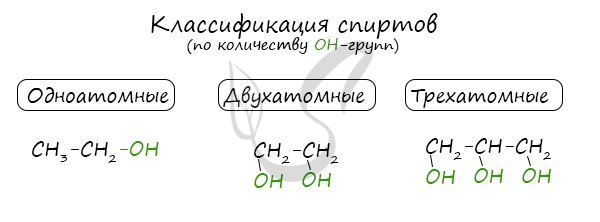
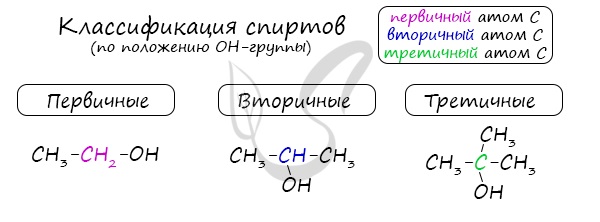
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
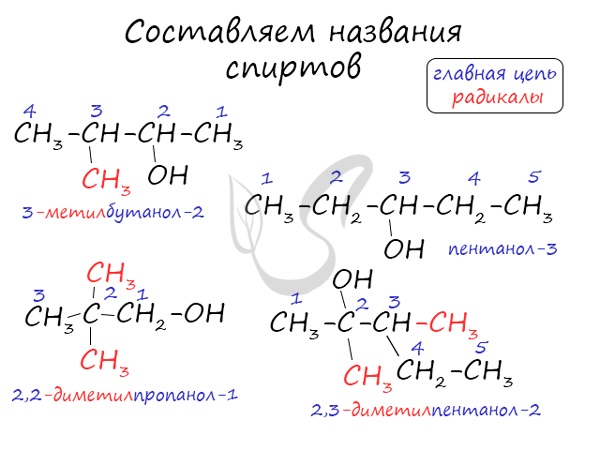
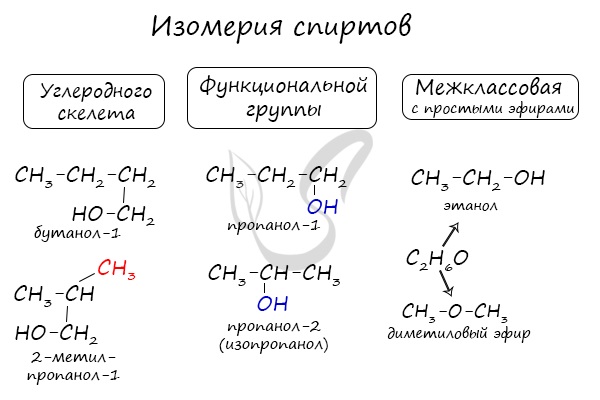
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
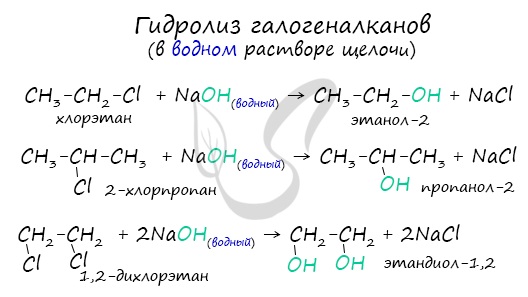
- Гидролиз галогеналканов водным раствором щелочи
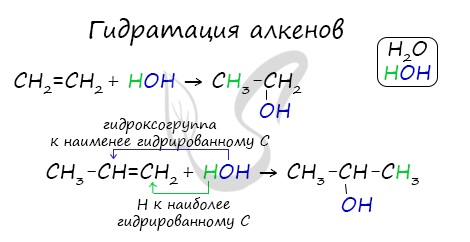
- Гидратация алкенов
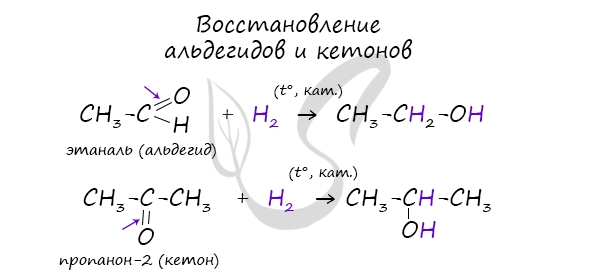
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
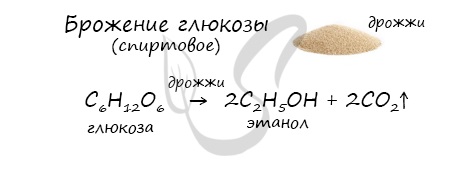
- Получение этанола брожением глюкозы
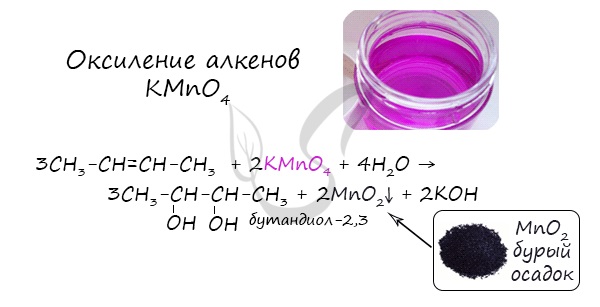
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПиртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором щелочи образуются спирты.
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
- Окисление спиртов
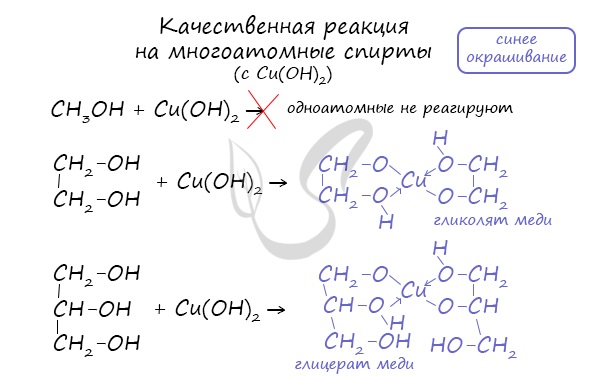
- Качественная реакция на многоатомные спирты
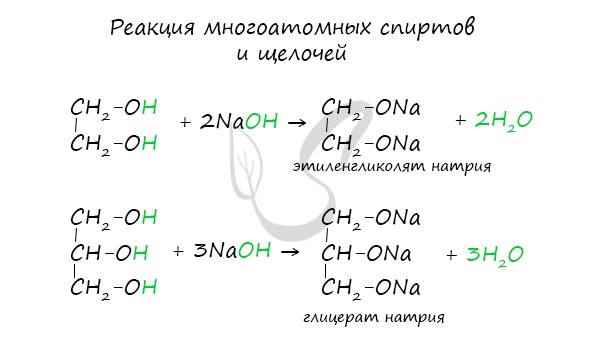
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.
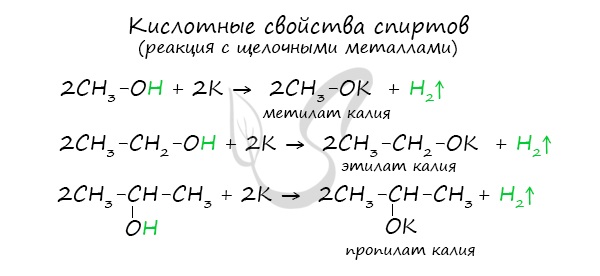
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
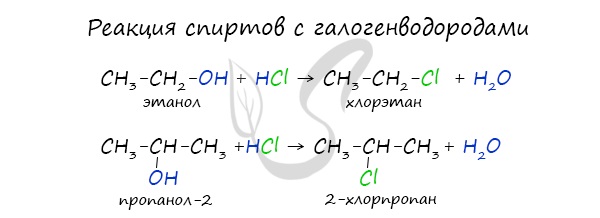
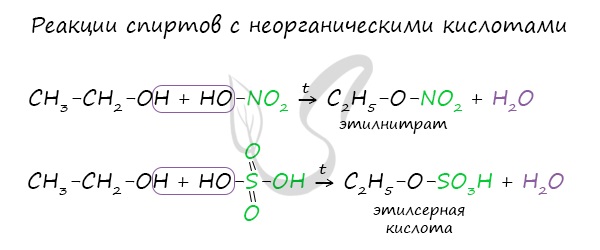
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
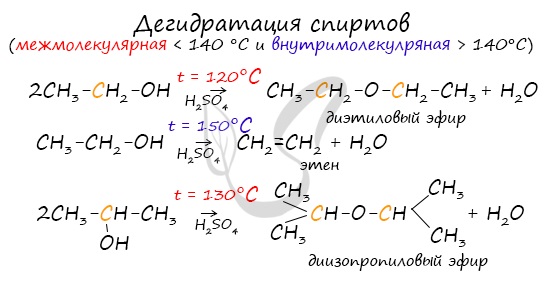
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:
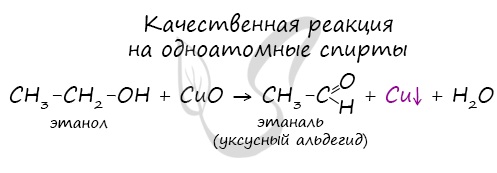
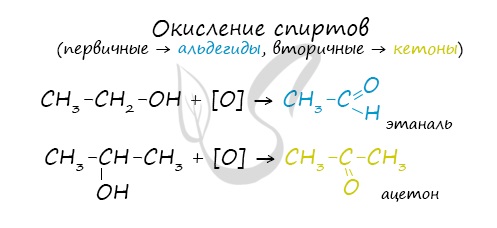
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
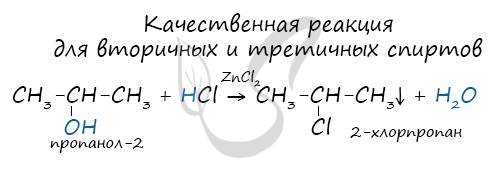
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Одноатомные спирты (алкоголи) – это производные алканов, молекула которых имеет одну функциональную гидроксильную группу. Она связана с насыщенным атомом углерода.
В учебниках химии можно встретить определение спиртов – это обширный класс химических соединений, выполняющих важнейшие функции в живых организмах. Рассматриваемые вещества широко применяются в промышленном производстве и повседневной жизни.
Описание и общая формула одноатомных спиртов
В таких спиртах атом водорода замещается гидроксильной группой ОН. Они имеют формулу CnH2n+1OH.
В современной номенклатуре их названия связаны с гомологическим рядом предельных алканов с суффиксом –ол (этанол, пропанол, бутанол, пропанол, гексанол и проч).
В зависимости от размещения группы ОН, существует классификация алкоголей:
-
первичные –группа ОН присоединена к первому атому С;
-
вторичные – гидроксильная группа присоединена ко второму атому этого элемента;
-
третичные – группа ОН присоединена к третьему атому углерода.
Изомерия одноатомных спиртов
Для этих веществ характерны разные виды изомерии:
-
Структурная – изменение расположения ОН начиная с соединений, содержащих 3 атома углерода. Так, существует пропанол 1 (н-пропиловый) и пропанол-2 (изопропиловый).
-
Изомерия углеродного звена – изменение положения гидроксильной группы, начиная с веществ, молекула которых содержит 4 углеродных атома. Так, бутанолу соответствует четыре разных изомера.
-
Межклассовая изомерия (с эфирами). Этиловому алкоголю с формулой СН3CH2–OH соответствует диметиловый эфир CH3–O–CH3.
-
Пространственная, или зеркальная изомерия.
Физические свойства
Вещества с количеством атомов углерода до 15 являются летучими жидкостями с резким запахом. Соединения с числом атомов углерода свыше 15 являются твердыми веществами.
Начальный член гомологического ряда (метанол) чрезвычайно токсичен для человека.
Чем выше спирт, тем и выше его температура кипения. Различия между каждым членом гомологического ряда составляет примерно 20 градусов. По мере увеличения размера молекулы и ее массы снижается и их воспламеняемость. Следовательно, легче всех воспламеняется метанол.
Соединения, имеющие в составе молекулы 9 атомов углерода, растворяются в воде (метанол и этанол – в каком угодно соотношении). Хорошо растворяются в растворителях.
Химические свойства
Рассматриваемые вещества ведут себя и как основания, и как кислоты.
Основные химические свойства одноатомных спиртов:
-
Взаимодействие с щелочными металлами. При этом образуются алкоголяты или алкоксиды. В воде эти вещества подвергаются гидролизу, образуя спирт и основание.
-
Взаимодействие с кислотами (органическими и неорганическими). По-другому они называются реакциями этерификации, поскольку конечный их продукт — сложный эфир.
-
Реакция с хлористым тионилом дает в итоге галогеналкан.
-
В результате внутримолекулярного обезвоживания получают алкены.
-
При межмолекулярной дегидратации образуются простые эфиры.
-
Химическая реакция одноатомного алкоголя с перманганатом калия дает альдегид. Дальнейшим окислением альдегида можно получить одноатомную карбоновую кислоту.
Получение
Известно несколько методов получения простых спиртов:
1. Гидратация алкенов (с присоединением молекулы воды):
CH2 = CH2 + H2O → CH3CH2OH.
2. Гидролиз алкилгалогенидов (с добавлением водных растворов щелочей):
CH3CH2Сl + NaOH → CH3CH2OH + NaCl.
3. Восстановление кетонов:
CH3-C(O)-CH3 + Н2 → CH3-CH(CH)-CH3.
4. Этанол получают путем разложения глюкозы:
C6H12O6 → 2C2H5OH + 2CO2.
5. Восстановление карбоновых кислот и сложных эфиров.
6. Присоединение металлорганических химических соединений к кетонам и альдегидам.
Применение одноатомных спиртов
Одноатомные спирты широко применяются как исходный реагент для получения альдегидов, кетонов, карбоновых кислот и эфиров. Все эти вещества широко применяются в производстве и быту.
Вот примеры использования наиболее распространенных спиртов:
-
Метанол является прекрасным органическим растворителем. Его применяют в производстве лаков и красок, органических смол.
-
Этанол широко используется в медицине как антисептик и растворитель. В пищевой промышленности его используют для получения алкогольных напитков. Он является основой для получения сложных эфиров, уксуса.
-
Бутанол применяется как растворитель и основа для получения веществ с приятным ароматом.
-
Бензиловый спирт является основой для получения душистых веществ.
Рассмотренные в статье вещества имеют широкое применение в промышленности. Без них невозможно получение многих веществ, использующихся в быту.
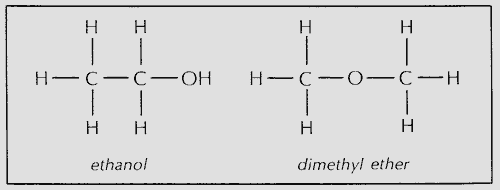
Конституционная изомерия не ограничивается алканами — она широко распространена в органической химии. Конституциональные изомеры могут иметь разные углеродные скелеты (как в изобутане и бутане), разные функциональные группы (как в этаноле и диметиловом эфире) или разные местоположения функциональной группы вдоль цепи (как в изопропиламине и пропиламине).Независимо от причины изомерии конституциональные изомеры — это всегда разные соединения с разными свойствами, но с одинаковой формулой. [Pg.81]
Когда два разных соединения имеют одинаковую молекулярную формулу, но различаются по природе или последовательности связывания, их называют конституциональными изомерами. Например, этанол и диметиловый эфир имеют одинаковую молекулярную формулу, C2HgO, но они различаются по последовательности связывания. Точно так же бутан и изобутан являются двумя конституциональными изомерами.Конституциональные изомеры обычно имеют разные физические и химические свойства. [Pg.36]
Изомеры, которые имеют равные GTD между соответствующими атомами, классифицируются как стереоизомеры. Те с неравными GTD между по крайней мере одной парой атомов являются структурными изомерами, также называемыми конституциональными изомерами. Например, на рисунке 1 GTD между двумя атомами углерода в этаноле = 1, а в диметиловом эфире GTD = 2. [Pg.11]
Этанол и диметиловый эфир являются конституциональными изомерами, поскольку они имеют одинаковую молекулярную формулу, но связность их атомов различна.Например, этанол имеет одну связь C-C и одну связь O-H, тогда как диметиловый эфир имеет две связи C-O. Второй класс изомеров, называемый стереоизомерами, представлен в разделе 4.13B. [Pg.19]
Диметиловый эфир (Ch4OCh4) и этанол (Ch4Ch3OH) являются конституциональными изомерами, (a) Используйте Таблицу 9.2 для расчета AH% n для образования каждого соединения в виде газа из метана и кислорода, также образуется водяной пар, (b) Укажите, какая реакция является более экзотермической. (c) Рассчитайте AH ° для превращения этанола в диметиловый эфир.[Pg.295]
Строение молекулы (количество, вид и связность атомов) может быть представлено двумерной картой, на которой межатомные связи (связи) изображены в виде мелких частиц. Есть два конституциональных изомера, которые представлены молекулярной формулой C2HgO этанол и диметиловый эфир. Различия в связях, которые не очевидны в общем конституциональном перечне C2H6O, можно объяснить типографскими точными формулами (Ch4Ch3OH для этфианола и Ch4OCh4 для диметилового эфира) или структурными представлениями (см. Рисунок 2).По мере увеличения количества и видов атомов в веществах количество конституциональных изомеров увеличивается. [Pg.808]
Изомеры делятся на два основных класса конституциональных изомеров и стереоизомеров. Конституциональные изомеры различаются способом, которым их атомы связаны (Раздел 2.0). Например, этанол и неприспособляемый … [Pg.182]
Конституционная изомерия определяется как тот тип изомерии (то есть различные структуры, соответствующие одной и той же молекулярной формуле), возникающие из-за различий в соседских отношениях между атомами.Примерами пар конституциональных изомеров являются -бутан и изобутан [CCCC против CC (C) C в обозначении Smiles], этанол и диметиловый эфир (CCO по сравнению с COC), 1- и 2-метилбутен (C = CCC по сравнению с CC = CC), и 1- и 2-пропанол [CCCO против CC (0) C]. Конституционная изомерия адекватно учитывается в химической теории графов матрицами смежности или расстояния, которые учитывают только отношения окрестности. … [Стр.1]
Различные соединения, имеющие одинаковую молекулярную формулу, классифицируются как изомеры. Изомеры могут быть конституциональными изомерами (различающимися по связности) или стереоизомерами (различающимися по расположению атомов в пространстве).Конституциональные изомеры также иногда называют структурными изомерами. Этанол и диметиловый эфир являются конституциональными изомерами друг друга. Стереоизомеры будут представлены в разделе 3.11. [Стр.17]
Эффект водородной связи ярко иллюстрируется сравнением температур кипения этанола (78 ° C) и его конститутивного изомера диметилового эфира (-24 ° C). Разница в температурах кипения между этими двумя соединениями происходит из-за полярной группы О — Н в спирте, которая способна образовываться… [Pg.262]
В Разделе 10.2 мы проиллюстрировали важность водородных связей в спиртах путем сравнения температур кипения этанола (точка кипения 78 ° C) и его конститутивного изомера диметилового эфира (точка кипения -24 ° C). Для сравнения: температура кипения этантиола составляет 35 ° С, а температуры его конститутивного изомера диметилсульфида — 37 ° С. [Pg.468]
Этанол (CHjCHjOH) и диметиловый эфир (Ch4OCh4) являются конституциональными изомерами. [Pg.480]
Конституционные изомеры различаются по способу, которым их атомы связаны (см. Проблему 17 на странице 18).Например, этанол и диметиловый эфир являются конституциональными изомерами, поскольку они оба имеют молекулярную формулу C2H6O, но их атомы связаны по-разному (кислород в этаноле связан с углеродом и водородом, тогда как кислород в диметиловом эфире связан с двумя атомами углерода ). [Pg.147]
Конституционные изомеры имеют одинаковые молекулярные формулы, но они имеют различные связи. Примерами конституциональных изомеров являются н-бутан и изобутан, а также этанол и диметиловый эфир.[Pg.53]
Существуют хорошо известные конституциональные изомеры, например, пара этанол-диметиловый эфир, для которой каждая структура является стабильной, и никакая фракция другого изомера не наблюдается, если растворена чистая форма одного из них. , Если K очень большое, отсутствие менее стабильной формы является разумным, когда более стабильная форма растворяется. Но в другом решении, имеющем менее стабильную форму в качестве растворенного вещества, оно все еще стабильно поддерживается. Это будет указывать на то, что термодинамический контроль не действует.[Pg.119]
Диметиловый эфир имеет ту же формулу, что и этанол, но эти два вещества имеют совершенно разные физические и химические свойства. Они имеют разные свойства, потому что у каждого своя функциональная группа (см. Таблицу 26.2). Диметиловый эфир и этанол являются конституциональными изомерами. [Pg.1243]
Когда эндотиотриазолины Буша были сформулированы как мезоионные соединения, было признано, что две конституциональные возможности (227 или 228) требуют рассмотрения. Более поздние исследования подтвердили, что эндотиотриазолины на самом деле были мезоионными 1,2,4-триазол-3-тионами (227).Недавно был получен специфический синтез их мезоионных изомеров (228), и в условиях уравновешивания в горячем этаноле происходит перегруппировка 228 — 227. Это объясняет, почему мезоионные 1,2,4-триазол-3-тионы (227) являются продуктами синтетического … [Pg.47]
F-бутоксид калия, 20,60 г (184 ммоля), было добавлено при перемешивании в атмосфере сухого аргона 20,00 г (91,69 ммоля) пиромеллитового диангидрида растворяют в 400 мл ТГФ. После перемешивания в течение ночи полученную суспензию отфильтровывают, промывают ТГФ и эфиром и сушат, получая калиевую соль желаемого продукта.Соль нейтрализовали в водном растворе разбавленной HCl, сохраняя холод (10 ° C). Продукт отфильтровали, промыли дистиллированной водой, высушили и несколько раз перекристаллизовали из этанольной воды. В трех посевах кристаллов было получено 22,08 г (выход 66%) ди-f-бутилового эфира. Эти культуры состояли из 10,50 г чистого пара-изомера, 7,43 г чистого мета-изомера и 50% -ной смеси двух изомеров, которые составляли остаток. [Pg.105]
В свете прогноза количества изомеров XCI представляет интерес обзор тех стереоизомеров CuHgeNg, которые были выделены или получены.В дополнение к d- и Z-спартеину ([a] p 17 ° в этаноле), которые вместе составляют один из трех рацематов, по-видимому, образовался новый изомер путем дегидрирования Z-спартеина с последующей регидрогенизацией. (Предполагается, что основной … [Pg.162]
В главе 7 мы обсуждали, как галогеналканы (или алкилсульфонаты) в присутствии сильного основания могут нисходить элиминирование элементов HX с одновременным образованием углерода — углерод-донорная связь. Со многими субстратами удаление водорода может происходить из более чем одного атома углерода в молекуле, что приводит к образованию конституциональных (донорной связи) изомеров.В каких случаях мы можем контролировать, какой водород удаляется, то есть региоселективность реакции (Раздел 9-9)? Ответ — да, в ограниченной степени. Простым примером является удаление бромистого водорода из 2-бром-2-метилбутана. Реакция с этоксидом натрия в горячем этаноле приводит к образованию в основном 2-метил-2-бутена, а также некоторого количества 2-метил-1-бутена. [Pg.450]
,
изомеров
ИзомерыСтруктура и реакционная способность в химии
Отношения структура-свойство
SP8. Сравнение свойств изомеров
Иногда существует несколько способов соединить данную группу атомов в молекулярная структура. Учитывая формулу C 2 H 6 O, два Возможны разные изомеры: метиловый эфир и этанол.У них одинаковые формула, но разные структуры. Слово «изомер» происходит от греческого, что означает «одни и те же вещи», ссылаясь на их идентичное содержание. Однако изомеры часто имеют очень разные физические и биологические свойства.
Эти два соединения имеют разные физические свойства, как вы можете видеть в Таблица ниже.
|
Помните, что типичная комнатная температура составляет около 25 ° C.Что означает, что при комнатной температуре диметиловый эфир является газом, потому что он находится выше температуры кипения точка. Этанол, с другой стороны, является жидкостью при комнатной температуре. Этанол при этой температуре намного выше его точки замерзания, но еще не достиг своей точки кипения.
Почему это? Каково происхождение для различий в физических свойствах между этими двумя аналогичными соединениями, одно из которых представляет собой газ при комнатной температуре а другой жидкий? Оба содержат углерод-водород и углерод-кислород облигации.Этанол также содержит углерод-углеродную связь и кислород-водород связь.
Некоторые облигации или группы облигаций придают особые соединения, в которых они находятся. Например, когда группа ОН найдена в органическое соединение, оно может сделать соединение умеренно кислым. Это также делает соединение немного более вероятно, будет твердым или жидким, а не газом. Зачем?
Доминирующее межмолекулярное притяжение между молекулами этанола — водород склеивание.Что мы имеем в виду, хотя две молекулы этанола могут быть привлечены силами рассеяния Лондона и даже диполями, оба эти фактора бледнеют в сравнение с притяжением, которое возникает из-за водородной связи. водород связь является единственным наиболее важным фактором, удерживающим две молекулы этанола все вместе.
В диметиловом эфире, с другой стороны, водородная связь не является фактором. В этой молекуле основное межмолекулярное притяжение вовлекает регулярный диполь моменты.Поскольку водородные связи, как правило, гораздо сильнее притяжения чем обычные дипольные моменты, группе молекул этанола гораздо труднее отделить друг от друга, чем группа молекул диметилового эфира. этанол имеет гораздо более высокую температуру кипения.
Задача SP8.1.
Соединения не обязательно должны быть изомерами, чтобы Сравните их таким образом. Они просто должны быть достаточно похожими, чтобы мы могли разумно сравнить их.
Например, пропан-2-он или ацетон, CH 3 (CO) CH 3 , имеет температуру кипения 56-57 ° C, тогда как 2-пропанол, CH 3 CH (OH) CH 3 , имеет температуру кипения около 83 ° C.Объясните разницу.
Различные коллекции связей, которые обычно встречаются в органических соединениях упоминаются как функциональные группы. Функциональные группы влияют на физическое свойства соединений, в которых они находятся. Они также могут влиять на биологическая активность соединения; то есть они могут помочь определить, является ли соединение может быть активным в качестве определенного типа лекарства, гормона или других типов соединений, которые регулярно взаимодействуют с организмами в природе.
В случае, который мы рассмотрели выше, мы сравнивали спирт с эфиром. В спирте есть группа ОН, присоединенная к углероду. В эфире O присоединен к двум атомам углерода. (Есть исключения из этих определения: если группа ОН присоединена к карбонилу, группе С = О, она не является спирт, но карбоновая кислота. Если кислород присоединен к карбонилу и для другого углерода, это не эфир, а эфир.) В общем, мы можем говорят, что из-за разницы в межмолекулярных влечениях, алкоголь имеет более высокую температуру кипения, чем эфир сравнительного размера.
- Свойства материалов тесно связаны с их структурой
- Два изомерных соединения, состоящих из абсолютно одинаковых элементов в точно одинаковое соотношение, может иметь очень разные свойства из-за разного способы, которыми атомы связаны внутри соединений.
Другой пример изомеров можно найти, взглянув на формулу C 3 H 9 Н. На этот раз есть три различные структуры, которые могут возникнуть с данным формула.Все три изомера содержат функциональную группу «амин». Амин это просто азот, связанный со смесью углерода и водорода. Опять же, три изомера имеют разные свойства, и эти различия не ограничиваются только точками плавления и кипения. какой Как вы думаете, фактор ответственен за эти различия?
Плотность
|
Различия в точках плавления и кипения довольно просты. Первый пример не обладает потенциалом для водородной связи. Второй делает, потому что он содержит связь N-H, а третий тем более, потому что он содержит две N-H связи, а не одну.
В отличие от спиртов и простых эфиров, содержит ли амин N-H или нет изменить название функциональной группы. Это все еще называют амином. Это может быть неудачным артефактом истории, потому что ясно, что амин может водородная связь немного отличается от амина, который не может, только так же, как алкоголь отличается от эфира.Чтобы компенсировать что отсутствие различия между аминами, дополнительный прилагательное используется для Опиши их. Амин, в котором азот присоединен только к одному углерод и два атома водорода называется «первичный амин» (первичный означает один, как в одна карбоновая насадка). Амин, в котором азот присоединен к двум углерод и один атом водорода называется «вторичный амин» (вторичные средства крепление на два углерода). Амин, в котором азот присоединен к три углерода и без водорода называется «третичный амин» (присоединение к трем атомы углерода).
Изомеры имеют множество свойств, которые отличаются от свойств других членов их группы. Не все эти свойства могут быть легко объяснить, глядя на разные структуры, но некоторые могут. Плотность материала — это отношение его веса к его объем (на более «научном» языке: масса / объем). Материал с можно считать, что плотность выше, чем у другого, с тем же весом, но сжался до меньшего объема.В качестве альтернативы, это можно рассматривать как имея такой же объем, но упакованный более массивным.
Обратите внимание, что изомеры в таблице выше имеют различную плотность. плотности в таблице относятся к плотности жидкости. Несмотря на их сходства, три соединения в жидком состоянии упаковывают вместе немного по-другому. Это тоже результат структурных различий.
Задача SP8.2.
Объясните разницу между плотностями в таблица выше.Все значения в таблице относятся к материалам в их жидкие состояния.
Задача SP8.3.
Хотя эта информация не указана в таблице выше, значения плотности обычно указываются вместе с температурой, при которой значение было измерено. Это потому, что плотность на самом деле является функцией температура. Большинство материалов становятся более плотными, поскольку они становятся холоднее и меньше плотнее, как они становятся теплее. Объясните, почему плотность зависит от температуры.
Существуют и другие свойства, которые можно сравнивать и объяснять на основе структуры соединений. Давление пара близко связанные с температурой кипения. Это относится к давлению, оказываемому молекулами выходя из жидкости в паровую фазу. Чем легче молекулы может уйти друг от друга в жидкости и уйти в паровую фазу чем выше жидкость, тем выше давление пара. Чем выше пар давление, тем легче жидкость достигает точки кипения.В простой смысл, мы можем думать о сильных притяжениях между молекулами, удерживающими их в жидкой фазе и понижение их давления паров.
Вязкость относится к сопротивлению течению в жидкости. Чем выше вязкость жидкости, тем медленнее она течет. кленовый сироп более вязкий, чем вода, но мед более вязкий, чем кленовый сироп. Упрощенно, мы можем думать о молекулах, цепляющихся за своих соседей, как они текут мимо друг друга, мешая течению и увеличивая вязкость.Таким образом, межмолекулярные притяжения между молекулами в жидкости влияют на его вязкость.
Это похоже на группу друзей, спешащих по многолюдной улице в Manhattan. Если они все держатся за руки, они не так быстро прогрессируют, как они будут индивидуально. Индивидуально каждый член группы может отойдите в сторону, броситесь вперед и пройдите мимо встречных пешеходов. Цепляясь вместе они все должны повернуться, остановиться и ждать, пока люди позволят им прошлое.
Поверхностное натяжение — это показатель того, насколько сильно жидкость сопротивляется внешнему силы. Вы можете думать об этом как о том, насколько плотно молекулы в материале цепляться друг за друга, когда вместо этого есть возможность цепляться за что-то другое.
Наиболее знакомая картина поверхностного натяжения — капля воды. вода образует капли, потому что молекулы в воде сильнее цепляются друг к другу чем они делают с молекулами в воздухе. В основном это азот молекулы, N 2 , со значительной долей молекул кислорода, O 2 .Молекулы в воздухе совершенно неполярные, потому что они сделаны из одного и того же виды атомов: два атома азота, например. Нет электроотрицательности Разница, которая придаст диполь молекуле. Это в полном контрастировать с высокополярной молекулой воды; трудно найти молекулы больше полярнее, чем это. Если бы молекула воды взаимодействовала с молекулой Динитроген, он будет торговать в некоторых сильных водородных связях с другими молекулы.Это не стоило бы того.
Задача SP8.4.
Объясните разницу в давлениях пара следующие соединения (перечислены в гекто-паскалях, гПа).
а) уксусная кислота, CH 3 CO 2 H (15,3) и пропан-2-он, CH 3 (CO) CH 3 (240)
б) этилацетат, CH 3 CO 2 CH 2 CH 3 (97) по сравнению с диэтиловым эфиром, CH 3 CH 2 OCH 2 CH 3 (587)
c) пентан, CH 3 CH 2 CH 2 CH 2 CH 3 , (573) противгептан, CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 (48)
Задача SP8.5.
Объясните разницу в вязкости следующие соединения (указаны в сантипуазах, сП или миллипаскаль-секундах, мПа . с).
а) диэтиловый эфир, CH 3 CH 2 OCH 2 CH 3 (0,22) против 2-бутанона, CH 3 (CO) CH 2 CH 3 (0.41)
б) декан, CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 (0,70) против гексана, CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 (0,26)
c) диэтиловый эфир, CH 3 CH 2 OCH 2 CH 3 (0,22) по сравнению с 1-бутанолом, CH 3 CH 2 CH 2 CH 2 OH (2.54)
Задача SP8.6.
Объясните разницу в поверхностных натяжениях следующие соединения (указаны в дин / см).
а) 1-бутанол, CH 3 CH 2 CH 2 CH 2 OH (25) против диэтилового эфира, CH 3 CH 2 OCH 2 CH 3 (16)
б) 1-бутанол, CH 3 CH 2 CH 2 CH 2 OH (25) против 1,3-бутандиола, HOCH 2 CH 2 CH (OH) CH 3 (47)
в) формамид, H (CO) NH 2 (57) противнитрометан, CH 3 NO 2 (36)
Вам не нужно иметь данные перед собой, чтобы сравнить два соединения свойства. По крайней мере, до некоторой степени, вы можете посмотреть на две подобные структуры и сделать обоснованное предположение о том, какой из них будет таять или испаряться легче, чем другие, при условии, что у них есть различные функциональные группы, которые вы можете сравнить. Знание чего-либо о структуре имеет объяснительную ценность; ты можешь объяснить различия основаны на структуре.Это также имеет прогностическое значение: вы можете прогнозировать различия на основе структуры.
Задача SP8.7.
В следующих парах изомеров, которые будут ожидается, что самая высокая точка кипения?
а) 2-пропенол, CH 2 CHCH 2 OH против пропанала, CH 3 CH 2 CHO
b) этилпентаноат, CH 3 CH 2 O 2 CCH 2 CH 2 CH 2 CH 3 против гептановой кислоты, CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CO 2 H
c) 1-гексен-3-он, CH 2 CHCOCH 2 CH 2 CH 3 против диаллилового эфира, (CH 2 CHCH 2 ) 2 O
Задача SP8.8.
В следующих парах изомеров, которые будут ожидается, что самая высокая вязкость?
а) 2-бутанон, CH 3 COCH 2 CH 3 по сравнению с метилированным аллиловым эфиром, CH 3 OCH 2 CHCH 2
б) пентан, CH 3 CH 2 CH 2 CH 2 CH 3 против октана, CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3
c) диметоксиэтан, CH 3 OCH 2 CH 2 OCH 3 против 1,3-бутандиола, HOCH 2 CH 2 CH (OH) CH 3
Задача SP8.9.
В каждом из следующих вопросов у вас есть выбор между A и B. Выберите вариант, в котором присутствуют более сильные достопримечательности.
Этот сайт написан и поддерживается Крисом П. Шаллером, доктором философии, Колледж Святого Бенедикта / Святого Иоанна Университет (с вкладами других авторов, как отмечено). Это свободно доступны для образовательного использования.
Структура и реакционная способность в органической, биологической и неорганической химии Криса Шаллера лицензирована по лицензии Creative Commons Attribution-NonCommercial 3.0 Не перенесенная лицензия.
Отправить исправления по адресу cschaller@csbsju.edu
Вернуться к структуре и свойствам: межмолекулярные аттракционы
Вернуться к материалам по структуре и реакционной способности в химии
,Структурная изомерия (IUPAC называет это конституциональной изомерией ) является разновидностью изомерии. Два химических вещества в этой изомерии имеют одинаковую молекулярную формулу, но молекулы связаны друг с другом в разных порядках. Противоположностью структурной изомерии является стереоизомерия. [1] Есть много слов, которые представляют структурные изомеры.
Существует три вида конституциональных изомеров.Это скелетные изомеры, позиционные изомеры и функциональные изомеры. Позиционные изомеры также называют региоизомерами. Таутомеры также являются своего рода функциональными изомерами.
В скелетной изомерии или цепной изомерии компоненты скелета (обычно углерод) переупорядочены для создания различных структур. Пентан имеет три изомера. Это или -пентан (часто называемый просто «пентан»), изопентан (метилбутан) и неопентан (диметилпропан).
В изомерии положения функциональная группа или другой заместитель изменяет свое положение в родительской структуре.В приведенной ниже таблице гидроксильная группа может оставаться в трех разных положениях в цепи н-пентана, образуя три разных соединения.
Существует много ароматических изомеров, поскольку заместители могут быть расположены в разных частях бензольного кольца. Существует только один изомер фенола или гидроксибензола, но крезол или метилфенол имеет три изомера, где дополнительная метильная группа может быть размещена в трех разных положениях в кольце. Ксиленол имеет одну гидроксильную группу и две метильные группы, и всего существует 6 изомеров.
Функциональные изомеры являются одним из структурных изомеров. Два соединения в функциональной изомерии имеют одинаковую молекулярную формулу (число каждого атома одинаково, как у циклогексана: C
6 H
12 и 1-гексена: C
6 H
12 ). Но атомы связаны другими способами, так что группировки различны. Мы называем эти группы атомов функциональными группами, функциональными группами или фрагментами.Другой способ сказать это состоит в том, что два соединения, которые имеют одинаковую молекулярную формулу, но имеют разные функциональные группы, являются функциональными изомерами.
Например, химическая формула циклогексана и 1-гексена C 6 H 12 . Мы называем их изомерами функциональных групп, потому что циклогексан является циклоалканом, а гекс-1-ен является алкеном.
Чтобы две молекулы были функциональными изомерами, они должны содержать ключевые группы атомов, расположенные особым образом. Некоторые из лучших примеров взяты из органической химии.C 2 H 6 O — это молекулярная формула. В зависимости от того, как расположены атомы, он может представлять собой два разных соединения: диметиловый эфир CH 3 -O-CH 3 или этанол CH 3 CH 2 -O-H. Диметиловый эфир и этанол являются функциональными изомерами. Первый — это эфир. Функциональность углеродная цепь-кислород-углеродная цепь называется эфиром. Второй алкоголь. Углеродная цепь-кислород-водородная функциональность называется спиртом.
Если функциональные возможности остаются теми же, но их местоположение изменяется, структурные изомеры не являются функциональными изомерами.1-пропанол и 2-пропанол являются структурными изомерами, но они не являются функциональными изомерами. Оба они являются спиртами. Функциональная группа (углеродная цепь -О-Н) присутствует в обоих этих соединениях, но они не одинаковы.
Хотя некоторые химики используют термины структурный изомер и функциональный изомер взаимозаменяемо, не все структурные изомеры являются функциональными изомерами.
Функциональные изомеры чаще всего идентифицируются в химии с использованием инфракрасной спектроскопии. Инфракрасное излучение соответствует энергиям, связанным прежде всего с молекулярной вибрацией.Функциональность спирта имеет очень отчетливую вибрацию, называемую OH-растяжением, которая обусловлена водородными связями. Все спирты в жидкой и твердой форме поглощают инфракрасное излучение на определенных длинах волн.
Соединения с одинаковыми функциональными группами будут поглощать инфракрасные лучи определенной длины волны из-за вибраций, связанных с этими группами. Фактически, инфракрасный спектр разделен на две области. Первая часть называется областью функциональной группы. Диметиловый эфир и этанол будут иметь разные инфракрасные спектры в области функциональной группы.
Вторая часть инфракрасного спектра называется областью отпечатков пальцев; оно связано с типами движения, допускаемыми симметрией молекулы и на которые влияют энергии связи. Область отпечатка пальца более специфична для отдельного соединения. Хотя 1-пропанол и 2-пропанол имеют сходные инфракрасные спектры в области функциональной группы, они различаются в области отпечатка пальца.
Проще говоря, функциональные изомеры — это структурные изомеры, которые имеют различные функциональные группы, такие как спирт и эфир.
В качестве примера подсчета изомеров существует 7 структурных изомеров с молекулярной формулой C 3 H 6 O, каждый из которых имеет различные связи и устойчив к воздуху при температуре окружающей среды. Два дополнительных структурных изомера представляют собой енольные таутомеры карбонильных изомеров, но они не являются стабильными.
- ↑ Кларк, Джим. «Структурная изомерия» в Chemguide , n.l., , 2000, , 7 декабря. Веб-статья.
Статья об изомере от Free Dictionary
изомер
(ī`səmər), в химии одно из двух или более соединений, имеющих одинаковую формулу молекулярной формулы , в химии, выражение, показывающее химический состав соединения. Формулы соединений используются при написании уравнений (см. Химические уравнения), которые представляют химические реакции. Соединения представляют собой комбинации в фиксированных пропорциях химических элементов.
….. Нажмите на ссылку для получения дополнительной информации.но разные структуры (расположение атомов в молекуле). Изомерия — это появление таких соединений. Изомерность была впервые признана Дж. Дж. Берцелиусом в 1827 г. Ранняя работа со стереоизомерами была проведена Луи Пастером, который разделил рацемическую кислоту на два ее оптически активных компонента винной кислоты путем кристаллизации (1848). Результаты Пастера были теоретически обоснованы Дж. Х. Вант Хоффом и независимо Дж. А. Ле Белом (1864).
Общие характеристики
Изомеры имеют одинаковое количество атомов каждого элемента в них и одинаковый атомный вес, но отличаются другими свойствами.Например, есть два соединения с молекулярной формулой C 2 H 6 O. Одним из них является этанол (также называемый этиловым спиртом), CH 3 CH 2 OH, бесцветный жидкий спирт; другой представляет собой диметиловый эфир, CH 3 OCH 3 , бесцветный газообразный эфир. Среди их различных свойств этанол имеет температуру кипения 78,5 ° С; и точка замерзания -117 ° С; диметиловый эфир имеет температуру кипения -25 ° С; и точка замерзания -138 ° С.Этанол и диметиловый эфир являются изомерами, потому что они отличаются тем, как атомы соединяются в своих молекулах:
Изомеры классифицируются как структурные изомеры, которые имеют одинаковое количество атомов каждого элемента и молекулярную массу, но разные схемы связи (см. химическую связь химическая связь, механизм
, посредством которого атомы объединяются в молекулы. Существует химическая связь между двумя атомами или группами атомов, когда силы, действующие между ними, достаточно сильны, чтобы привести к образованию агрегата с достаточной стабильностью быть расцененным как
….. Нажмите на ссылку для получения дополнительной информации. ) или в виде стереоизомеров, которые имеют одинаковое количество атомов каждого элемента, молекулярную массу и характер связи, но в которых атомы имеют разные пространственные отношения. Таутомеры Таутомеры
, один из двух или более структурных изомеров, которые существуют в равновесии и легко превращаются из одной изомерной формы в другую. Из различных возможных типов таутомерии обычно наблюдаются два.
….. Нажмите на ссылку для получения дополнительной информации.являются структурными изомерами, которые легко превращаются из одной изомерной формы в другую и, следовательно, существуют в равновесии.
Структурные изомеры
Структурные изомеры подразделяются на цепочку, положение и функциональную группу. Цепные изомеры встречаются среди алканов , алканов ,
, любых из группы алифатических углеводородов, молекулы которых содержат только одинарные связи (см. Химическую связь). Алканы имеют общую химическую формулу C n H 2 n +2 .
….. Нажмите на ссылку для получения дополнительной информации. , Например, есть два цепных изомера бутана, C 4 H 10 . В н-бутане CH 3 CH 2 CH 2 CH 3 атомы углерода соединены в так называемую прямую или неразветвленную цепь. В изобутане, CH 3 CH (CH 3 ) 2 , атомы углерода соединены в разветвленную цепь; молекула изобутана может быть визуализирована как атом углерода, связанный с одним атомом водорода и тремя метильными (CH 3 ) группами.
Позиционные изомеры встречаются среди замещенных алканов и других соединений. Например, 1-пропанол CH 3 CH 2 CH 2 OH и 2-пропанол CH 3 CH (OH) CH 3 являются позиционными изомерами, как и 1-бутен CH 2 = CHCH 2 CH 3 и 2-бутен CH 3 CH = CHCH 3 . Позиционные изомеры имеют сходные химические свойства, поскольку они отличаются только расположением функциональной группы , функциональной группы и
в органической химии, группой атомов в молекуле, которая отвечает за определенные свойства молекулы и реакциями, в которых она участвует.Органические соединения часто классифицируются в соответствии с функциональной группой или группами, которые они содержат.
….. Нажмите на ссылку для получения дополнительной информации. (например, ОН в спирте или двойная связь в алкене алкен
, любой из группы алифатических углеводородов, молекулы которых содержат одну или несколько углерод-углеродных двойных связей (см. химическую связь). Алкены только с одной двойной связью имеют общую формулу C n H 2 n .
….. Нажмите на ссылку для получения дополнительной информации. ).
Изомеры функциональных групп, с другой стороны, имеют очень разные химические свойства, потому что различия в их структуре приводят к различным функциональным группам. Этанол и диметиловый эфир (см. Пример выше) являются изомерами функциональных групп.
Стереоизомеры
Стереоизомерия возникает, когда две или более молекулы имеют одинаковое основное расположение атомов в своих молекулах, но различаются по расположению атомов в пространстве.Существует два типа стереоизомерии. Первый тип, геометрическая изомерия, может возникать, когда соединение содержит двойную связь или какую-либо другую особенность, которая придает молекуле определенную степень структурной жесткости. Геометрические изомеры различаются по физическим свойствам, таким как температура плавления и температура кипения. Например, существуют два геометрических изомера 2-бутена: CH 3 CH = CHCH 3 :
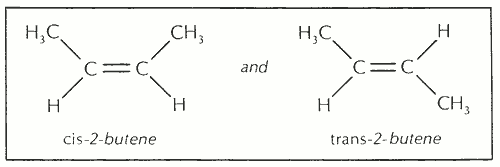
Префикс cis — означает «одна сторона», а trans — — означает «противоположная сторона»; они используются, когда группы на каждой стороне двойной связи идентичны или тесно связаны, т.е.г. метил и этил. Syn — и anti — имеют аналогичные значения, но используются, когда группы не идентичны или тесно связаны.
Второй тип стереоизомерии — оптическая изомерия. Когда плоскополяризованный свет проходит через оптический изомер, он поворачивается в другую плоскость поляризации. Оптические изомеры, также известные как хиральные молекулы или энантиомеры, проявляют эту оптическую активность в различной степени. Оптические изомеры данного соединения часто идентичны по всем физическим свойствам, кроме направления, в котором они вращают свет.Молекулы оптических изомеров асимметричны. Простейшие оптические изомеры имеют один «асимметричный атом углерода» в своих молекулах. Асимметричный атом углерода имеет четыре различных атома или радикала, связанных с ним, расположенных приблизительно в углах тетраэдра с центром в атоме углерода. Например, существует два оптических изомера молочной кислоты:
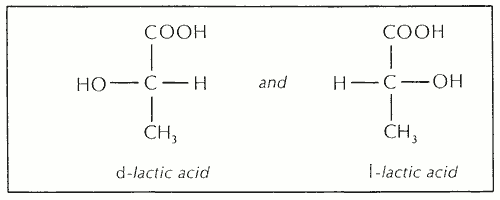
Атом и радикал по обе стороны от атома углерода визуализируются как находящиеся над плоскостью бумаги, центральный атом углерода в плоскости бумаги и радикалы выше и ниже центрального атома углерода ниже плоскости бумаги.Таким образом, видно, что две молекулы являются зеркальными изображениями друг друга и, каждая из которых является асимметричной, не могут накладываться друг на друга. Префиксы d — и l — означают dextro (справа) и levo (слева). Два оптических изомера, такие как эти, молекулы которых асимметричны и являются зеркальным отражением друг друга, называются энантиоморфами. Когда смешиваются равные количества d, — и l, — энантиоморфов, смесь не влияет на поляризованный свет; такая смесь называется рацемической.
Когда имеется более одного асимметричного атома углерода, может быть более двух оптических изомеров. Например, винная кислота имеет два асимметричных атома углерода и три оптических изомера:
, 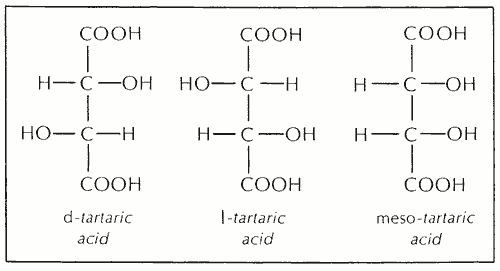 ,
,
, винная кислота d, — и l, — энантиоморфы; каждая молекула асимметрична и является зеркальным отражением другой. В мезо -винной кислоте имеется два асимметричных атома углерода, но молекула симметрична и не проявляет оптической активности; оптическая активность внутренне компенсируется, эффект одного асимметричного атома углерода уравновешивает эффект другого.Пара оптических изомеров, таких как d, -винная кислота и мезо, -винная кислота, которые не являются энантиоморфами, называются диастереоизомерами. Молекулярная дисимметрия в оптических изомерах может происходить из некоторого источника, отличного от асимметричного атома углерода, например структурной жесткости, возникающей в результате двойных связей или кольцевых структур в молекуле.
Стереоизомеры важны для обмена веществ; во многих случаях только одна из нескольких изомерных форм соединения может принимать участие в биохимических реакциях.Например, существует 16 стереоизомеров простого сахара с молекулярной формулой C 6 H 12 O 4 . Из них только d -глюкоза легко используется в метаболизме человека.

Leave A Comment