Химические свойства углекислого газа, реакции с другими веществами
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
СО2 + H2O ↔ CO2 × H2O (растворение) ↔ Н2СО3
Диоксид углерода + вода ↔ угольная кислота
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
2NH3 + CO2 + H2O = NH4HCO3
Аммиак + углекислота = гидрокарбонат аммония
Углеаммонийная сольПолученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
2NH3 + СО2 → (NH2)2СО + H2O
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Оксид цинкаZn + CO2 → ZnO + CO
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Ba(OH)2+CO2 = BaCO3 + H2O
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
Горение газа на плитеCH4 + 2O2 → CO2 + 2H2O + 891кДж
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
2С2Н6 + 7О2 → 4CO2 + 6H2O + Q
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
Молекула этанолаC2H5OH + 3O2 = 3H2O + 2CO2 + Q
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
CO2 + NaOH → NaHCO3
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
CO2 + 2 NaOH → Na2CO3 + H2O
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Ca(OH)2 + CO2 → CaCO3 + H2O
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
В зелёных растениях играет важную роль в процессе фотосинтеза:
Образование глюкозы6CO2 + 6H2O → C6H12O6 + 6O2
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
C6H5ONa + CO2 + H2O = C6H5OH + NaHCO3
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
2Na2O2 + 2CO2 → 2N2CO3 + O2
Пероксид натрия + углекислота → карбонат натрия + кислород
Колба с пероксидом натрияОбразование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
NaHCO3 + H2O → CO2 + H2O + NaOH
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
2KOH + CO2 → K2CO3 + H2O
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.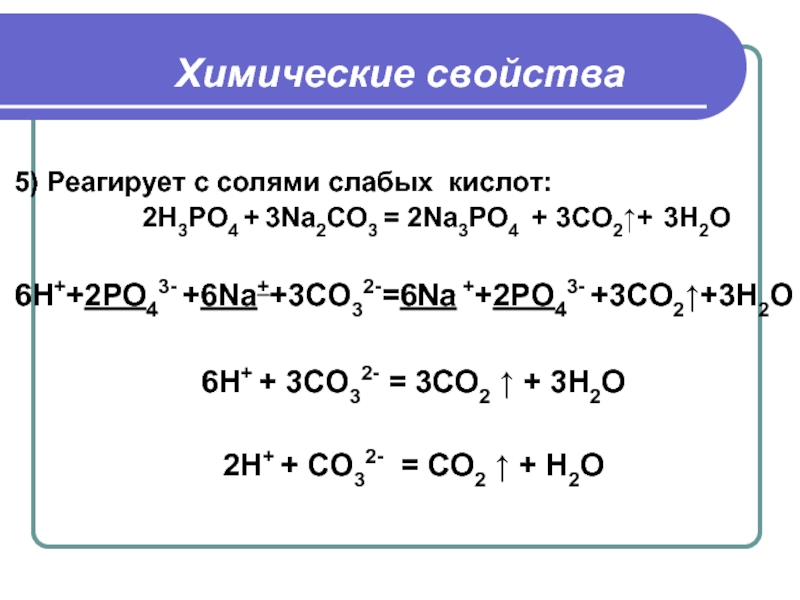
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Углекислый газ, CO2, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Химические реакции, происходящие при прямом солнечном восстановлении CO2
. 2001 28 сентября; 277 (1-3): 7-14. doi: 10.1016/s0048-9697(01)00829-4.Дж.Л. Лайма 1 , Р. Дж. Дженсен
принадлежность
- 1 Лос-Аламосская национальная лаборатория, Нью-Мексико, 87545, США.
- PMID: 11589409
- DOI: 10.1016/s0048-9697(01)00829-4
Дж. Л. Лайма и соавт.
Научная общая среда.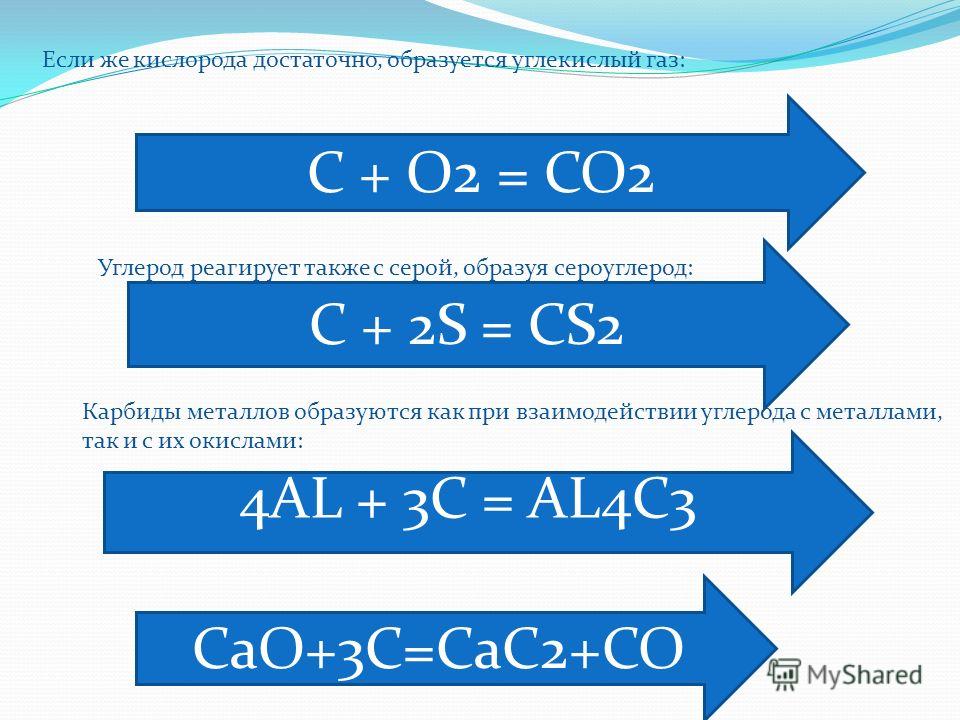 .
.
Авторы
Дж.Л. Лайма 1 , Р. Дж. Дженсен
принадлежность
- 1 Лос-Аламосская национальная лаборатория, NM 87545, США.
- PMID: 11589409
- DOI: 10.1016/s0048-9697(01)00829-4
Абстрактный
При высоких температурах двуокись углерода может поглощать солнечное излучение и вступать в реакцию с образованием угарного газа и молекулярного кислорода. CO, полученный таким образом, может быть преобразован хорошо зарекомендовавшими себя способами в горючее топливо, такое как метанол. Мы намерены в будущем продемонстрировать сокращение выбросов CO2 на солнечной энергии на основе этих процессов. Эта статья, однако, посвящена только проблеме сохранения или даже усиления исходного фотолитического СО путем гашения горячего газа более холодными Н3О или СО2. Мы представляем модельные расчеты с механизмом реакции, широко используемым в других расчетах. Если поток газа СО2 нагреть и фотолизовать интенсивным солнечным излучением, а затем дать ему медленно остыть, он снова прореагирует на первоначальный СО2 серией элементарных химических реакций. Обратная реакция на СО2 может быть остановлена быстрым добавлением СО2, воды или их смеси. Расчеты показывают, что трехкратное гашение чистым СО2 останавливает реакции и сохраняет более 90% исходного фотолитического CO. Мы находим, что вода имеет один из двух эффектов. Он может либо повышать уровень СО, либо катализировать рекомбинацию О и СО в СО2.
CO, полученный таким образом, может быть преобразован хорошо зарекомендовавшими себя способами в горючее топливо, такое как метанол. Мы намерены в будущем продемонстрировать сокращение выбросов CO2 на солнечной энергии на основе этих процессов. Эта статья, однако, посвящена только проблеме сохранения или даже усиления исходного фотолитического СО путем гашения горячего газа более холодными Н3О или СО2. Мы представляем модельные расчеты с механизмом реакции, широко используемым в других расчетах. Если поток газа СО2 нагреть и фотолизовать интенсивным солнечным излучением, а затем дать ему медленно остыть, он снова прореагирует на первоначальный СО2 серией элементарных химических реакций. Обратная реакция на СО2 может быть остановлена быстрым добавлением СО2, воды или их смеси. Расчеты показывают, что трехкратное гашение чистым СО2 останавливает реакции и сохраняет более 90% исходного фотолитического CO. Мы находим, что вода имеет один из двух эффектов. Он может либо повышать уровень СО, либо катализировать рекомбинацию О и СО в СО2. Температура газа является определяющим фактором. Если охлаждающего газа недостаточно для поддержания температуры ниже примерно 1100 К, преобладает реакция разветвления цепи и происходит реакция с образованием СО2. Если температура остается ниже этого уровня, преобладает реакция обрыва цепи и увеличивается содержание СО. Первый случай имеет место примерно после четырехкратного гашения смесью вода/СО2. Последний случай имеет место, когда гашение превышает четырехкратное. Мы заключаем, что СО2, Н3О или их смесь могут гасить поток горячего газа, фотолизированного солнечным излучением, и сохранять фотолитический СО.
Температура газа является определяющим фактором. Если охлаждающего газа недостаточно для поддержания температуры ниже примерно 1100 К, преобладает реакция разветвления цепи и происходит реакция с образованием СО2. Если температура остается ниже этого уровня, преобладает реакция обрыва цепи и увеличивается содержание СО. Первый случай имеет место примерно после четырехкратного гашения смесью вода/СО2. Последний случай имеет место, когда гашение превышает четырехкратное. Мы заключаем, что СО2, Н3О или их смесь могут гасить поток горячего газа, фотолизированного солнечным излучением, и сохранять фотолитический СО.
Похожие статьи
- Сонохимическое восстановление углекислого газа.
Харада Х. Харада Х. Ультрасон Сонохем. 1998 г., июнь; 5 (2): 73–77. doi: 10.1016/s1350-4177(98)00015-7. Ультрасон Сонохем. 1998. PMID: 11270340
- Потеря воды на Венере: роль угарного газа.

Ричардсон С.М., Поллак Дж.Б., Рейнольдс Р.Т. Ричардсон С.М. и др. Икар. 1984;60:307-16. doi: 10.1016/0019-1035(84)90191-x. Икар. 1984. PMID: 11541980
- Гомогенное восстановление углекислого газа водородом.
Донг К., Раззак Р., Ху И., Дин К. Донг К. и др. Top Curr Chem (Чам). 2017 Апрель; 375 (2): 23. doi: 10.1007/s41061-017-0107-x. Epub 2017 6 февраля. Top Curr Chem (Чам). 2017. PMID: 28168648 Обзор.
- Изучение кинетики реакций Fe+ с N2O, N2, O2, CO2 и h3O и реакций переключения лиганда Fe+.X + Y —> Fe+.Y + X (X = N2, O2, CO2; Y = O2 , Н3О).
Вондрак Т., Вальдшнеп К.Р., Плейн Дж.М. Вондрак Т. и соавт. Phys Chem Chem Phys. 2006 28 января; 8 (4): 503-12. дои: 10.
 1039/b508922k. Epub 2005 4 ноября.
Phys Chem Chem Phys. 2006.
PMID: 16482293
1039/b508922k. Epub 2005 4 ноября.
Phys Chem Chem Phys. 2006.
PMID: 16482293 - Органические реакции для электрохимического и фотохимического производства химических топлив из CO2. Химия восстановления карбоновых кислот и их производных как изогнутых заменителей CO2.
Лука OR, Фенвик AQ. Лука О.Р. и соавт. J Photochem Photobiol B. 2015 ноябрь; 152 (Pt A): 26-42. doi: 10.1016/j.jphotobiol.2015.04.015. Эпаб 2015 5 мая. Дж Фотохим Фотобиол Б. 2015. PMID: 26022364 Обзор.
Посмотреть все похожие статьи
Цитируется
- CeO, легированный калием 2 -ZrO 2 для CO 2 термохимическое каталитическое расщепление.
Портарапилло М., Руссо Д., Ланди Г., Лучани Г., Ди Бенедетто А.
 Портарапилло М. и др.
RSC Adv. 2021 12 декабря; 11 (62): 39420-39427. doi: 10.1039/d1ra08315e. Электронная коллекция 2021 6 декабря.
RSC Adv. 2021.
PMID: 35492484
Бесплатная статья ЧВК.
Портарапилло М. и др.
RSC Adv. 2021 12 декабря; 11 (62): 39420-39427. doi: 10.1039/d1ra08315e. Электронная коллекция 2021 6 декабря.
RSC Adv. 2021.
PMID: 35492484
Бесплатная статья ЧВК. - Механизм электрохимического восстановления CO₂ с помощью ионной жидкости при комнатной температуре: обзор.
Лим Х.К., Ким Х. Лим Х.К. и др. Молекулы. 2017 28 марта; 22 (4): 536. doi: 10.3390/молекулы22040536. Молекулы. 2017. PMID: 28350332 Бесплатная статья ЧВК. Обзор.
Типы публикаций
термины MeSH
вещества
Разрушение CO2 быстрее, дешевле и эффективнее
Исследования
15 ноября 2019 г. | Ким Кригер — UConn Communications
| Ким Кригер — UConn Communications
Новое открытие может позволить экономично превращать углекислый газ в топливо.
Открытие группы исследователей может сделать более реальным превращение углекислого газа в топливо. (Предоставлено Стивом Суибом)
Новый катализатор расщепляет углекислый газ на полезные химические вещества быстрее, дешевле и эффективнее, чем стандартный метод, сообщает группа исследователей в выпуске PNAS за эту неделю. Открытие может позволить экономично превращать углекислый газ в топливо.
Углекислый газ является стабильным, широко распространенным газом. На самом деле его слишком много, а лишний углекислый газ в атмосфере меняет климат планеты. Зная это, многие химики работают над эффективными способами превращения углекислого газа в другие полезные продукты. Но стабильность двуокиси углерода усложняет задачу. Трудно заставить молекулу, счастливую саму по себе, реагировать с чем-либо еще.
В наилучшей из существующих технологий электрохимического разложения углекислого газа на части, которые вступят в химическую реакцию, используется катализатор из платины. Но платина — редкий и дорогой металл.
Но платина — редкий и дорогой металл.
Теперь группа исследователей под руководством Йонгтао Менга, бывшего аспиранта Университета Коннектикута в лаборатории Института материаловедения директора Стива Суиба, а ныне исследователя Стэнфордского университета, придумала лучший способ. Они создали электрохимическую ячейку, заполненную пористым пенистым катализатором из никеля и железа. Оба металла дешевы и распространены. Когда газообразный диоксид углерода поступает в электрохимическую ячейку и прикладывается напряжение, катализатор помогает диоксиду углерода (атому углерода с двумя атомами кислорода) отделить кислород с образованием монооксида углерода (атома углерода с одним атомом кислорода). реактивный и полезный прекурсор для производства многих видов химикатов, включая пластмассы и топливо, такое как бензин.
Новый железоникелевый катализатор не только хорошо работает; на самом деле он более эффективен, чем дорогой платиновый процесс, который он мог бы заменить. Электрохимическая ячейка с использованием никель-железного катализатора достигает почти 100% КПД.


 1039/b508922k. Epub 2005 4 ноября.
Phys Chem Chem Phys. 2006.
PMID: 16482293
1039/b508922k. Epub 2005 4 ноября.
Phys Chem Chem Phys. 2006.
PMID: 16482293 Портарапилло М. и др.
RSC Adv. 2021 12 декабря; 11 (62): 39420-39427. doi: 10.1039/d1ra08315e. Электронная коллекция 2021 6 декабря.
RSC Adv. 2021.
PMID: 35492484
Бесплатная статья ЧВК.
Портарапилло М. и др.
RSC Adv. 2021 12 декабря; 11 (62): 39420-39427. doi: 10.1039/d1ra08315e. Электронная коллекция 2021 6 декабря.
RSC Adv. 2021.
PMID: 35492484
Бесплатная статья ЧВК.
Leave A Comment