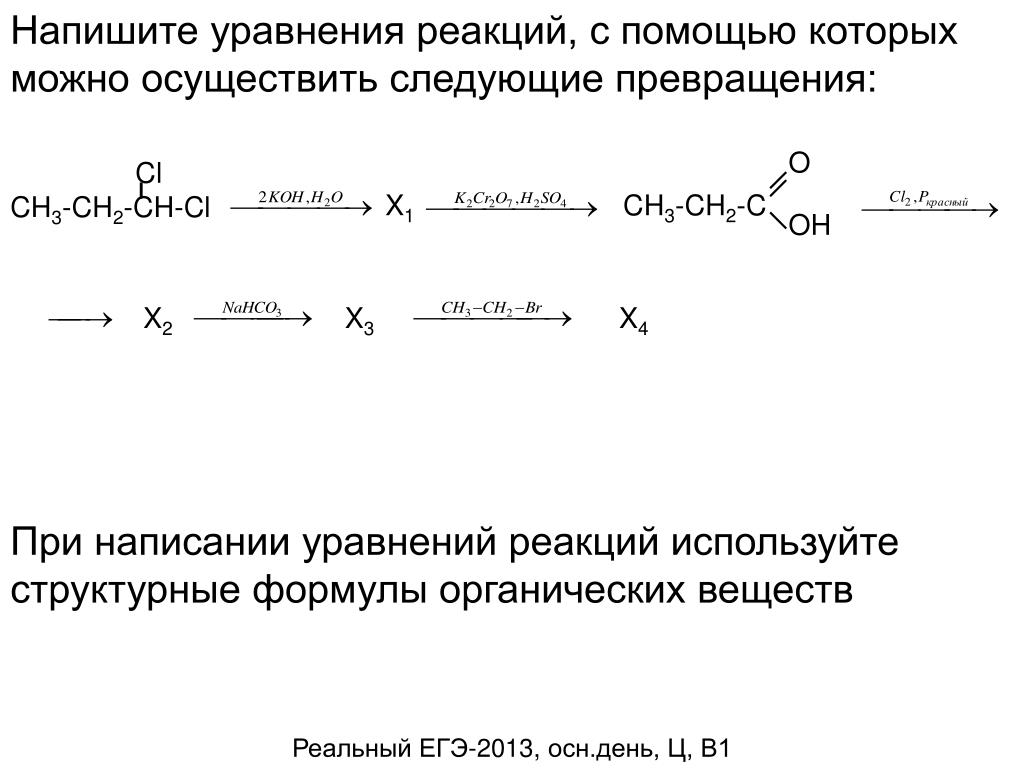
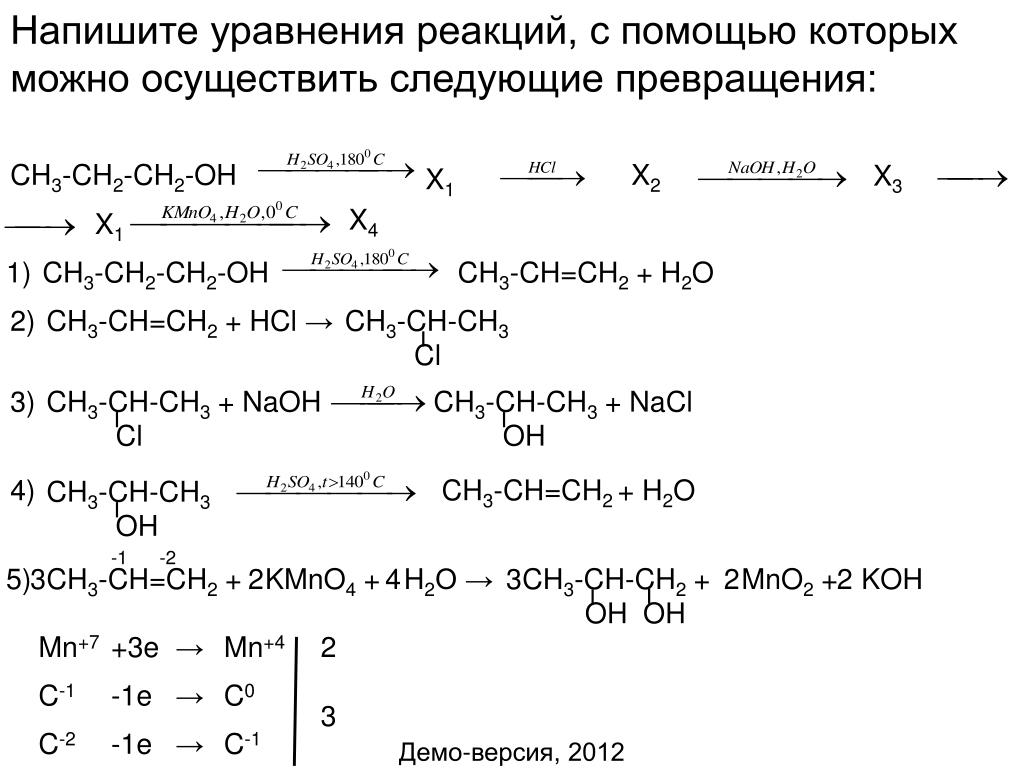
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
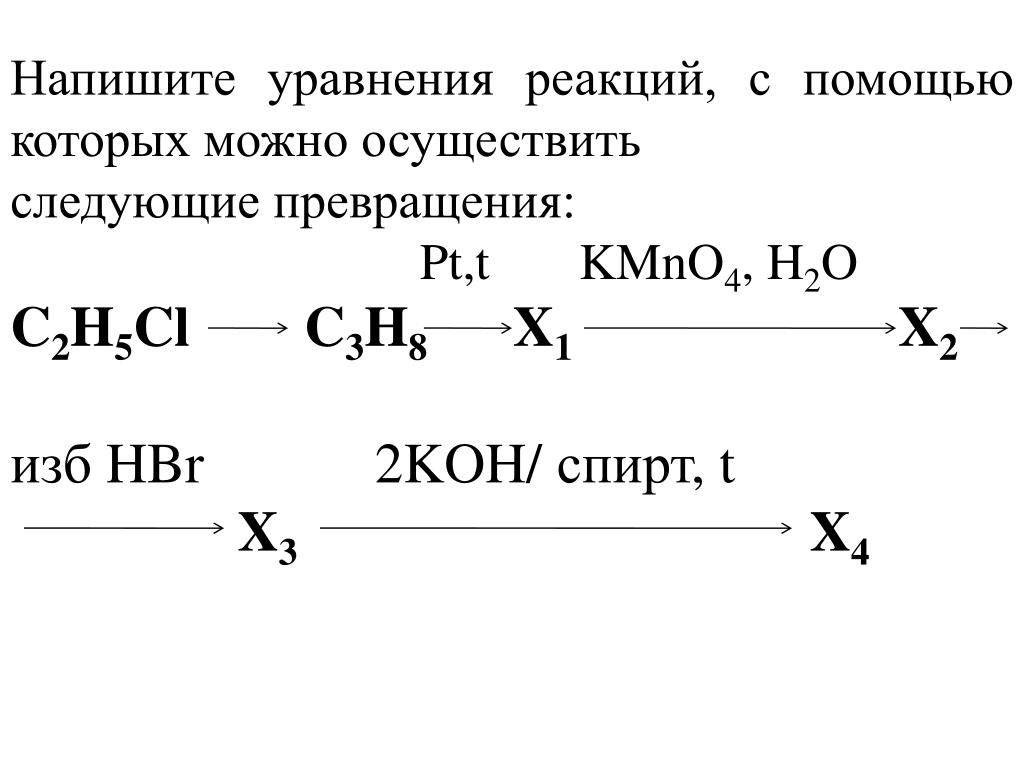
крізь вапняну воду що містить кальцій гідроксид масою 14. 8 г пропустили карбон(IV) оксид об’ємом 6,72 л. Обчисліть масу середньою солі що утворилася внаслідок цього
8 г пропустили карбон(IV) оксид об’ємом 6,72 л. Обчисліть масу середньою солі що утворилася внаслідок цього
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Составить схемы электролиза водных растворов h3SO4, CuCl2, Pb(NO3)2 с платиновыми электродами
решите, пожалуйста. ( Электронный баланс, желательно подробно) Ch4-CH=CH-Ch4 + KMnO4 + h3SO4 = Ch4-COOH + MnSO4 + K2SO4 + h3O.
как смыть краску с денежных купюр
Пользуйтесь нашим приложением
Что такое химическая реакция? | Глава 6: Химические изменения
Тебе это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Урок 6.1
Ключевые понятия:
- Физическое изменение, такое как изменение состояния или растворение, не создает новое вещество, а химическое изменение создает.

- В химической реакции взаимодействующие друг с другом атомы и молекулы называются реагентами.
- В химической реакции атомы и молекулы, образующиеся в результате реакции, называются продуктами.
- В химической реакции в продукты могут попасть только атомы, присутствующие в реагентах. Новые атомы не создаются и не разрушаются.
- В химической реакции реагенты контактируют друг с другом, связи между атомами в реагентах разрываются, атомы перестраиваются и образуют новые связи, образуя продукты.
Резюме
Учитель использует небольшое пламя свечи, чтобы продемонстрировать химическую реакцию между воском свечи и кислородом воздуха. Студенты увидят молекулярную анимацию горения метана и кислорода как модель подобной реакции. Учащиеся будут использовать вырезки моделей атомов, чтобы смоделировать реакцию и увидеть, что все атомы в реагентах проявляются в продуктах.
Задача
Учащиеся смогут объяснить, что для того, чтобы произошла химическая реакция, связи между атомами в реагентах разрываются, атомы перестраиваются и образуются новые связи между атомами для образования продуктов. Студенты также смогут объяснить, что в химической реакции атомы не образуются и не разрушаются.
Студенты также смогут объяснить, что в химической реакции атомы не образуются и не разрушаются.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки. Будьте осторожны при зажигании свечи. Убедитесь, что спичка и свеча полностью погашены, когда вы закончите демонстрацию.
Материалы для демонстрации
- Чайная свеча или другая небольшая стабильная свеча
- совпадений
- Стеклянная банка, достаточно большая, чтобы ее можно было поставить над свечой
Материалы для каждого учащегося
- Вырезки атомов из рабочего листа
- Лист цветной бумаги или плотной бумаги
- Цветные карандаши
- Ножницы
- Клей или лента
Рассмотрите, что происходит во время физического изменения, и познакомьте с понятием химического изменения.

Скажите учащимся, что в предыдущих главах они изучали различные аспекты физических изменений. Когда атомы и молекулы ускоряются или замедляются, это физическое изменение. Когда они меняют свое состояние с жидкого на твердое или с газообразного на жидкое, это физическое изменение. Когда вещество растворяется в воде или каком-либо другом растворителе, новое вещество на самом деле не образуется. Ионы или молекулы все еще могут собраться вместе, чтобы сформировать исходное вещество.
Сообщите учащимся, что в этой главе они будут изучать, что происходит во время химического превращения. При химическом изменении атомы в реагентах перестраиваются и связываются друг с другом по-разному, образуя один или несколько новых продуктов с другими характеристиками, чем у реагентов. Когда образуется новое вещество, это изменение называется химическим изменением.
В качестве демонстрации зажгите свечу и объясните, что происходит, используя термины
реагенты , продукты и химическая реакция .
Объясните, что в большинстве химических реакций два или более вещества, называемые реагентами , взаимодействуют с образованием различных веществ, называемых продуктами. Скажите учащимся, что горение свечи является примером химической реакции.
Материалы для демонстрации
- Совпадений
- Стеклянная банка, достаточно большая, чтобы ее можно было поставить над свечой
Процедура
- Осторожно зажгите чайную свечу или другую маленькую свечу.
- Держите свечу горящей, пока вы задаете ученикам приведенные ниже вопросы. Вы потушите свечу во второй части демонстрации.
Ожидаемые результаты
Фитиль загорится, а пламя будет поддерживаться химической реакцией.
Следующий вопрос непрост, и на данный момент учащиеся не должны знать ответ. Тем не менее, если рассматривать горение свечи с точки зрения химической реакции, это будет хорошей отправной точкой для понимания того, что имеется в виду, когда вещества вступают в химическую реакцию.

Спросите студентов:
- Как вы думаете, какие реагенты участвуют в этой химической реакции?
- Реагентами являются воск и кислород воздуха.
Студенты часто говорят, что горит нить или фитиль. Верно, что нить фитиля горит, но это воск на нитке, а не столько сама нить, которая горит и поддерживает горение свечи. Объясните, что молекулы воска соединяются с кислородом воздуха, образуя углекислый газ и водяной пар.
Укажите учащимся, что это одна из основных характеристик химической реакции: в химической реакции атомы реагентов объединяются новыми и разными способами, образуя молекулы продуктов.
Студенты могут быть удивлены тем, что вода может быть получена в результате горения. Поскольку мы используем воду для тушения огня, может показаться странным, что вода на самом деле образуется в результате горения. Вы можете сообщить учащимся, что когда они «сжигают» пищу в своем теле, они также производят углекислый газ и воду.

Поставьте банку на свечу, чтобы помочь учащимся понять, что кислород является реагентом при горении свечи.
Напомните учащимся, что воздух представляет собой смесь газов. Объясните, что когда что-то горит, оно вступает в реакцию с кислородом воздуха.
Попросите учащихся сделать прогноз:
- Будет ли свеча гореть, если один из реагентов (воск или кислород) больше не доступен?
- Учащиеся могут предположить, что свеча не будет гореть, потому что для продолжения химической реакции необходимы оба реагента.
Процедура
Осторожно поставьте стеклянную банку на зажженную свечу.
Ожидаемые результаты
Пламя гаснет.
Спросите студентов:
- Как вы думаете, почему пламя гаснет, когда мы ставим банку на свечу?
- Помещение банки над свечой ограничивает количество кислорода в воздухе вокруг свечи. Без достаточного количества кислорода для реакции с воском химическая реакция не может произойти, и свеча не может гореть.

- Когда свеча горит какое-то время, она постепенно становится все меньше и меньше. Куда девается воск свечи?
- Когда горит свеча, кажется, что воск свечи «исчезает». Однако на самом деле он не исчезает: он вступает в химическую реакцию, и новые продукты попадают в воздух.
Примечание: некоторые любопытные студенты могут спросить, из чего сделано пламя. Это отличный вопрос, и на него не так просто ответить. Пламя горит парами воска. Свет пламени вызван процессом, называемым хемилюминесценцией. Энергия, высвобождаемая в результате химической реакции, заставляет электроны разных молекул переходить в более высокое энергетическое состояние. Когда электроны возвращаются вниз, энергия высвобождается в виде света.
Представьте химическое уравнение горения метана и объясните, что атомы перестраиваются, превращаясь в другие молекулы.
Объясните учащимся, что воск состоит из длинных молекул, называемых парафином, и что парафин состоит только из атомов углерода и атомов водорода, связанных вместе.
 Молекулы, состоящие только из углерода и водорода, называются углеводородами. Скажите учащимся, что вы будете использовать простейший углеводород (метан) в качестве модели, чтобы показать, как горит воск или любой другой углеводород.
Молекулы, состоящие только из углерода и водорода, называются углеводородами. Скажите учащимся, что вы будете использовать простейший углеводород (метан) в качестве модели, чтобы показать, как горит воск или любой другой углеводород.Спроецируйте изображение Химическая реакция между метаном и кислородом.
Покажите учащимся, что метан и кислород находятся в левой части химического уравнения, а углекислый газ и вода — в правой. Объясните, что молекулы слева — это реагенты, а молекулы справа — продукты. Когда свеча горела, парафин реагировал с кислородом воздуха с образованием углекислого газа и воды, подобно химической реакции между метаном и кислородом.
Объясните учащимся, что химическая формула метана – CH 4 . Это означает, что метан состоит из одного атома углерода и четырех атомов водорода.
Покажите учащимся, что другим реагентом являются две молекулы газообразного кислорода. Укажите, что каждая молекула газообразного кислорода состоит из двух атомов кислорода, связанных вместе.
 Студентов может сбить с толку тот факт, что атом кислорода и молекула кислорода называются кислородом. Пусть студенты знают, что когда мы говорим о кислороде в воздухе, это всегда молекула кислорода, которая представляет собой два атома кислорода, связанных вместе, или O 2 .
Студентов может сбить с толку тот факт, что атом кислорода и молекула кислорода называются кислородом. Пусть студенты знают, что когда мы говорим о кислороде в воздухе, это всегда молекула кислорода, которая представляет собой два атома кислорода, связанных вместе, или O 2 .Спросите студентов:
- Откуда берутся атомы, составляющие углекислый газ и воду в правой части уравнения?
- Атомы в продуктах образуются из атомов в реагентах. В химической реакции связи между атомами в реагентах разрываются, а атомы перестраиваются и образуют новые связи, образуя продукты.
Примечание. Оставьте это уравнение спроецированным на протяжении всего занятия в разделе «Изучение» этого урока. Студенты должны будут обращаться к нему, когда они моделируют химическую реакцию.
Дайте каждому учащемуся рабочий лист.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Возьмите на вооружение» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций.
 Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.Предложите учащимся построить модель, показывающую, что в химической реакции атомы реагентов перестраиваются с образованием продуктов.
Вопрос для расследования
Откуда берутся атомы в продуктах химической реакции?
Материалы для каждого учащегося
- Вырезы модели Atom (углерод, кислород и водород)
- Лист цветной бумаги или плотной бумаги
- Цветные карандаши
- Ножницы
- Клей или лента
Процедура
Подготовить атомы
- Раскрасьте атомы углерода в черный цвет, атомы кислорода в красный цвет, а атомы водорода оставьте белыми.
- Используйте ножницы, чтобы аккуратно вырезать атомы.
Создание реактивов
На листе бумаги поместите атомы вместе, чтобы получились молекулы реагентов в левой части химического уравнения горения метана.

- Напишите химическую формулу под каждой молекулой реагентов. Также нарисуйте знак + между реагентами.
После того, как вы убедитесь, что учащиеся составили и записали формулы молекул реагентов, скажите учащимся, что они будут переставлять атомы в реагентах для образования продуктов.
Создание продуктов
- Нарисуйте стрелку после второй молекулы кислорода, чтобы показать, что происходит химическая реакция.
- Переставьте атомы в реагентах так, чтобы молекулы продуктов оказались справа от стрелки.
- Напишите химическую формулу под каждой молекулой продукта. Также нарисуйте знак + между продуктами.
Скажите учащимся, что в химической реакции атомы реагентов расходятся, перестраиваются и образуют новые связи, образуя продукты.
Представьте химическое уравнение
- Предложите учащимся использовать оставшиеся атомы, чтобы снова составить реагенты, чтобы представить химическую реакцию в виде полного химического уравнения.

- Приклейте или приклейте скотчем атомы к бумаге, чтобы составить более надежное химическое уравнение горения метана.
- Предложите учащимся использовать оставшиеся атомы, чтобы снова составить реагенты, чтобы представить химическую реакцию в виде полного химического уравнения.
Помогите учащимся подсчитать количество атомов в каждой части уравнения.
Спроектируйте анимацию «Движущееся химическое уравнение горения метана».
Покажите учащимся, что атомы в метане и кислороде должны разделиться, как в их моделях. Также отметьте, что атомы располагаются по-разному и снова соединяются, образуя новые продукты. Это также похоже на их модель. Убедитесь, что учащиеся понимают, что атомы в продуктах образуются только из реагентов. Других атомов нет. Никакие новые атомы не создаются и никакие атомы не разрушаются.
Объясните учащимся, что химические реакции более сложны, чем упрощенная модель, показанная на анимации. Анимация показывает, что связи между атомами в реагентах разрываются, а атомы перестраиваются и образуют новые связи, образуя продукты. На самом деле реагенты должны столкнуться и взаимодействовать друг с другом, чтобы их связи разорвались и перестроились.
 Кроме того, анимация показывает, как все атомы в реагентах распадаются и перестраиваются, образуя продукты. Но во многих химических реакциях разрываются только некоторые связи, а группы атомов остаются вместе, поскольку реагенты образуют продукты.
Кроме того, анимация показывает, как все атомы в реагентах распадаются и перестраиваются, образуя продукты. Но во многих химических реакциях разрываются только некоторые связи, а группы атомов остаются вместе, поскольку реагенты образуют продукты.Подробнее о сжигании метана читайте в разделе «История учителя».
Помогите учащимся вместе ответить на следующий вопрос:
- Сколько атомов углерода, водорода и кислорода содержится в реагентах по сравнению с числом атомов углерода, водорода и кислорода в продуктах?
- Покажите учащимся, как использовать большое число (коэффициент) перед молекулой и маленькое число после атома молекулы (нижний индекс) для подсчета атомов в обеих частях уравнения. Объясните учащимся, что нижний индекс говорит о том, сколько атомов определенного типа содержится в молекуле. Коэффициент говорит, сколько существует молекул определенного типа. Таким образом, если перед молекулой стоит коэффициент, а после атома — нижний индекс, вам нужно умножить коэффициент на нижний индекс, чтобы получить количество атомов.

- Например, в продуктах химической реакции 2H 2 O. Коэффициент означает, что молекул воды две. Нижний индекс означает, что каждая молекула воды имеет два атома водорода. Так как в каждой молекуле воды два атома водорода, а молекул воды две, то атомов водорода должно быть 4 (2 × 2).
Таблица 1. Подсчет атомов в реагентах и продуктах химического уравнения горения метана. 903:00 Атомы Сторона реагента Сторона продукта Углерод Водород Кислород Примечание: Коэффициенты фактически показывают соотношение количества молекул в химической реакции.
 Это не фактическое число, как в двух молекулах кислорода и одной молекуле метана, поскольку обычно реагируют миллиарды триллионов молекул. Коэффициент показывает, что молекул кислорода в два раза больше, чем молекул метана. Правильно было бы сказать, что в этой реакции на каждую молекулу метана приходится две молекулы кислорода.
Это не фактическое число, как в двух молекулах кислорода и одной молекуле метана, поскольку обычно реагируют миллиарды триллионов молекул. Коэффициент показывает, что молекул кислорода в два раза больше, чем молекул метана. Правильно было бы сказать, что в этой реакции на каждую молекулу метана приходится две молекулы кислорода.Объясните, что в химической реакции масса сохраняется.
Спросите студентов:
- Атомы образуются или разрушаются в результате химической реакции?
- №
- Откуда ты знаешь?
- В исследованном нами химическом уравнении имеется одинаковое количество атомов каждого типа как на стороне реагента, так и на стороне продукта.
- При физических изменениях, например переходе из твердого состояния в жидкое, само вещество на самом деле не меняется. Чем химическое изменение отличается от физического?
- При химическом изменении молекулы реагентов взаимодействуют с образованием новых веществ.
 При физическом изменении, таком как изменение состояния или растворение, не образуется никакой новой субстанции.
При физическом изменении, таком как изменение состояния или растворение, не образуется никакой новой субстанции.
Объясните, что еще один способ сказать, что атомы не образуются и не разрушаются в химической реакции, это сказать: «Масса сохраняется».
Спроецируйте изображение Balanced Equation.
Объясните, что весы показывают, что масса метана и кислорода с одной стороны точно равна массе углекислого газа и воды с другой. Когда уравнение химической реакции написано, оно «уравновешено» и показывает, что атомы в реагентах в конечном итоге превращаются в продукты и что новые атомы не создаются и не разрушаются.
Расскажите о двух других реакциях горения и попросите учащихся проверить, сбалансированы ли они.
Сообщите учащимся, что, помимо воска и метана, распространенными углеводородами являются пропан (топливо для уличных газовых грилей) и бутан (топливо для одноразовых зажигалок). Попросите учащихся подсчитать количество атомов углерода, водорода и кислорода в реагентах и продуктах каждого уравнения, чтобы проверить, сбалансировано ли уравнение.
 Они должны записать количество атомов каждого типа в таблице на своем рабочем листе.
Они должны записать количество атомов каждого типа в таблице на своем рабочем листе.Зажигание уличного газового гриля — сжигание пропана
C 3 H 8 + 5O 2 → 3CO 2 + 4H 2 0
Использование одноразовой зажигалки — сжигание бутана
2C 4 H 10 + 13O 2 → 8CO 2 + 10H 2 O
После того, как учащиеся подсчитали каждый тип атома, просмотрите их ответы, чтобы убедиться, что они знают, как интерпретировать индексы и коэффициенты.
Химические реакции. Общая информация
Химические реакции – общая информация Химические уравнения — это сокращенный метод представления химических реакций. В химической реакции реагенты (то, что вы начинаете) превращаются в продукты (то, чем вы заканчиваете). Реагенты, показанные в левой части уравнения, и продукты, показанные в правой, разделены стрелкой. Уравнение ниже представляет собой реакцию углерода с газообразным кислородом с образованием двуокиси углерода.
Уравнение ниже представляет собой реакцию углерода с газообразным кислородом с образованием двуокиси углерода.
Эту реакцию также можно представить графически:
Обратите внимание, что число атомов углерода одинаково по обеим сторонам стрелки. На стороне реагента находится один атом углерода, а на стороне продукта — один атом углерода. То же верно и для кислорода, за исключением того, что с каждой стороны находится по два атома кислорода (помните, что индекс «два» в молекуле кислорода означает, что два атома кислорода связаны вместе). Когда количество атомов в каждой части уравнения одинаково, говорят, что уравнение уравновешено. Сбалансированное уравнение согласуется с законом сохранения материи, который гласит, что материя не создается и не разрушается во время химической реакции.
При взаимодействии метана (CH 4 ) с кислородом образуется двуокись углерода и вода.
Здесь мы замечаем, что реакция не уравновешена, так как количество атомов водорода с каждой стороны разное.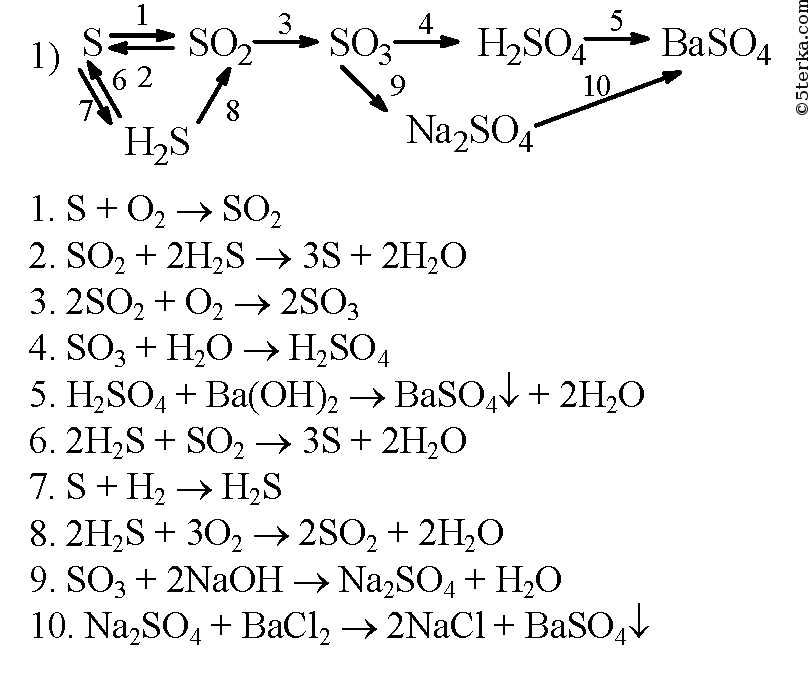




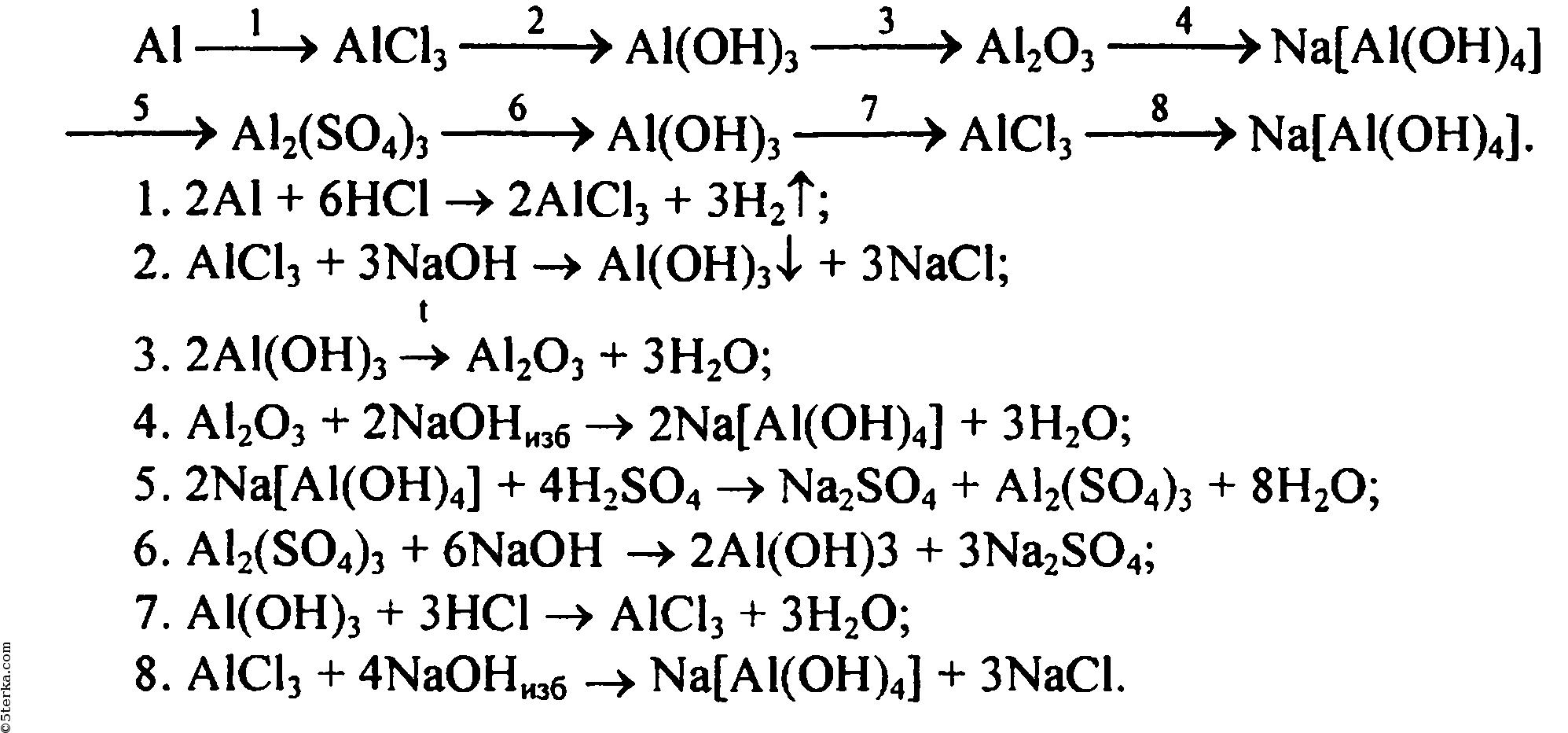

 Молекулы, состоящие только из углерода и водорода, называются углеводородами. Скажите учащимся, что вы будете использовать простейший углеводород (метан) в качестве модели, чтобы показать, как горит воск или любой другой углеводород.
Молекулы, состоящие только из углерода и водорода, называются углеводородами. Скажите учащимся, что вы будете использовать простейший углеводород (метан) в качестве модели, чтобы показать, как горит воск или любой другой углеводород.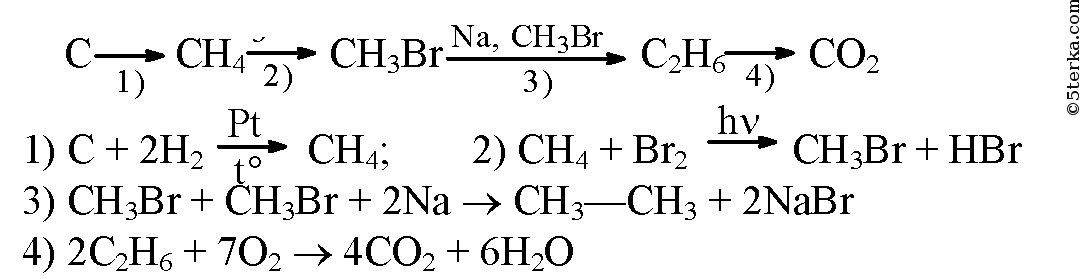 Студентов может сбить с толку тот факт, что атом кислорода и молекула кислорода называются кислородом. Пусть студенты знают, что когда мы говорим о кислороде в воздухе, это всегда молекула кислорода, которая представляет собой два атома кислорода, связанных вместе, или O 2 .
Студентов может сбить с толку тот факт, что атом кислорода и молекула кислорода называются кислородом. Пусть студенты знают, что когда мы говорим о кислороде в воздухе, это всегда молекула кислорода, которая представляет собой два атома кислорода, связанных вместе, или O 2 .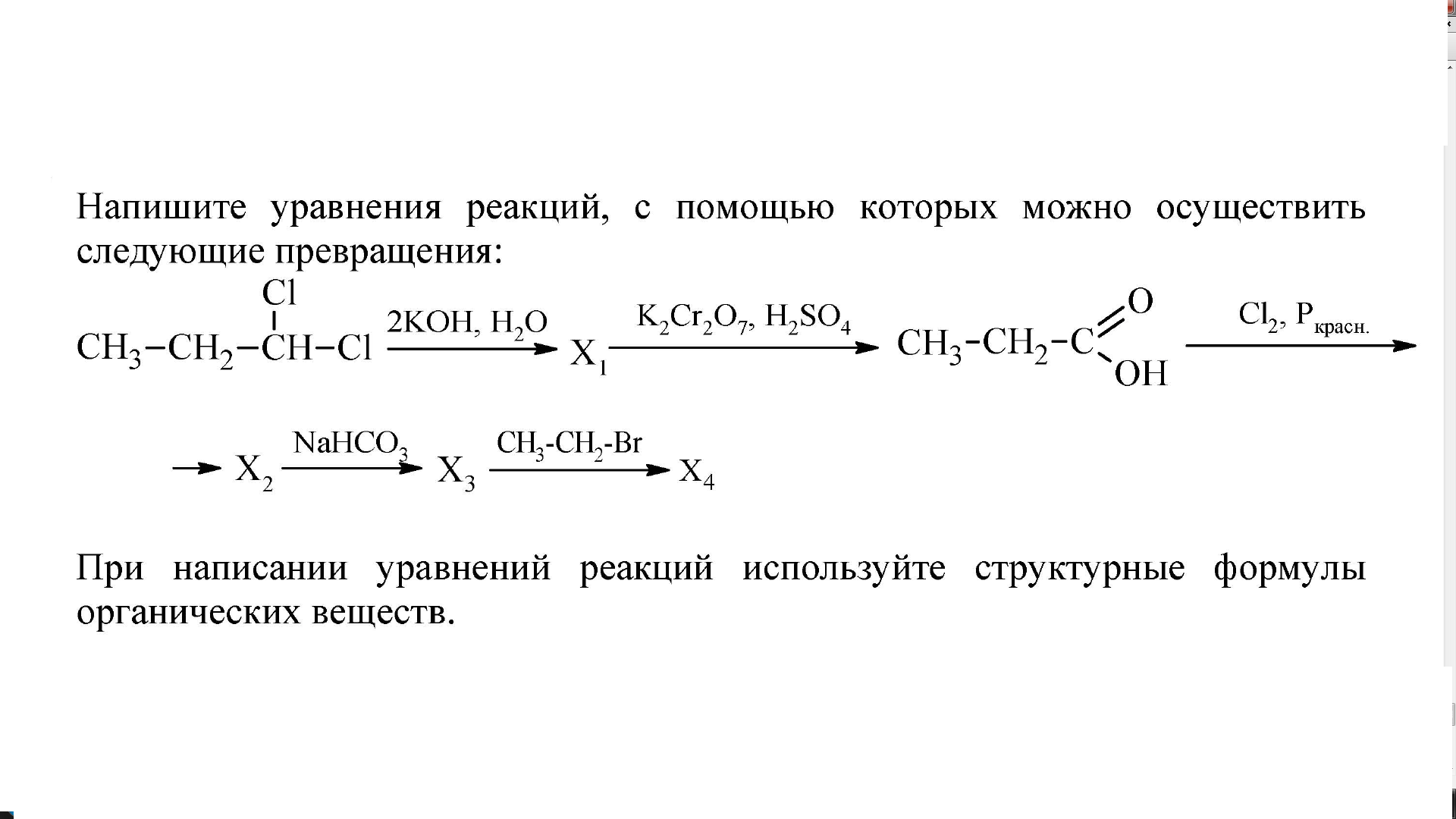 Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.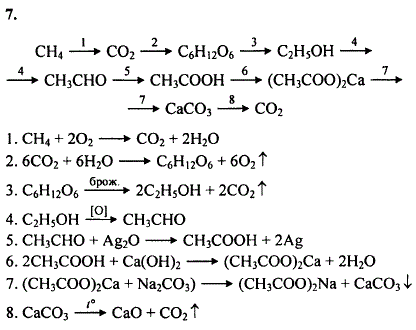

 Кроме того, анимация показывает, как все атомы в реагентах распадаются и перестраиваются, образуя продукты. Но во многих химических реакциях разрываются только некоторые связи, а группы атомов остаются вместе, поскольку реагенты образуют продукты.
Кроме того, анимация показывает, как все атомы в реагентах распадаются и перестраиваются, образуя продукты. Но во многих химических реакциях разрываются только некоторые связи, а группы атомов остаются вместе, поскольку реагенты образуют продукты.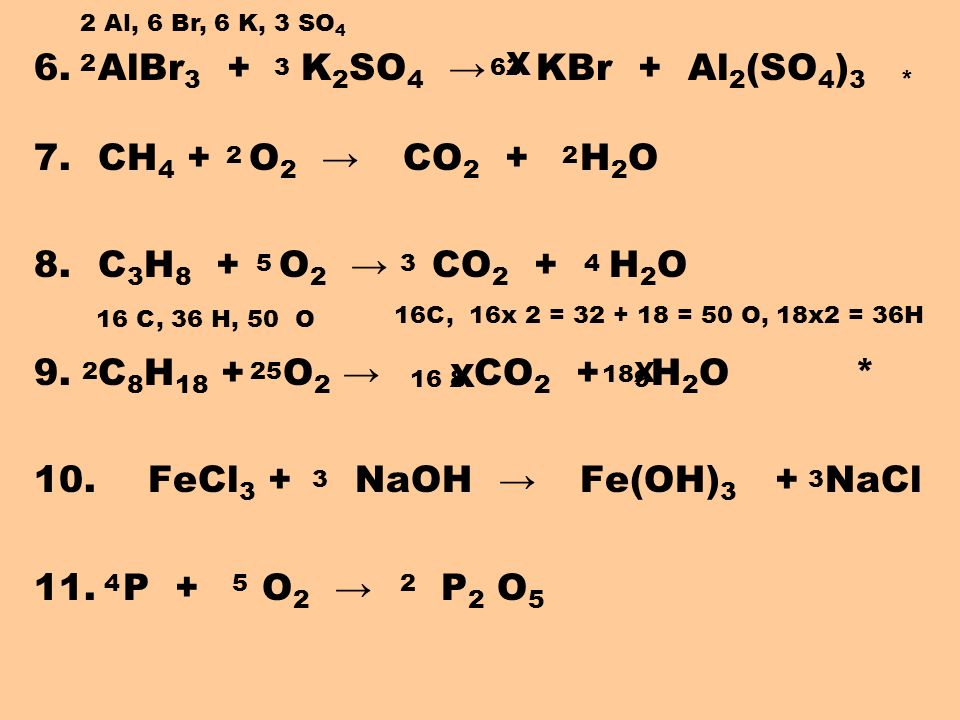
 Это не фактическое число, как в двух молекулах кислорода и одной молекуле метана, поскольку обычно реагируют миллиарды триллионов молекул. Коэффициент показывает, что молекул кислорода в два раза больше, чем молекул метана. Правильно было бы сказать, что в этой реакции на каждую молекулу метана приходится две молекулы кислорода.
Это не фактическое число, как в двух молекулах кислорода и одной молекуле метана, поскольку обычно реагируют миллиарды триллионов молекул. Коэффициент показывает, что молекул кислорода в два раза больше, чем молекул метана. Правильно было бы сказать, что в этой реакции на каждую молекулу метана приходится две молекулы кислорода. При физическом изменении, таком как изменение состояния или растворение, не образуется никакой новой субстанции.
При физическом изменении, таком как изменение состояния или растворение, не образуется никакой новой субстанции.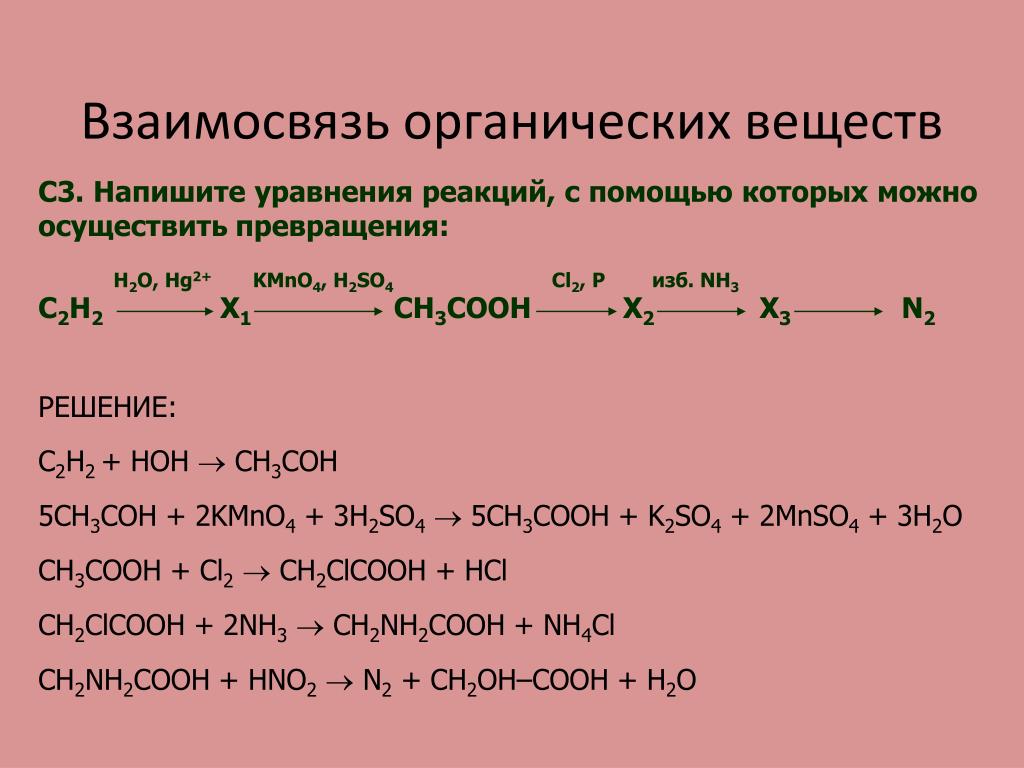 Они должны записать количество атомов каждого типа в таблице на своем рабочем листе.
Они должны записать количество атомов каждого типа в таблице на своем рабочем листе.
Leave A Comment