Кислоты и основания — Электронный учебник K-tree
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое pH раствора, какими общими свойствами обладают кислоты и основания.
Простым языком, кислота — это всё что с H, а основание — c OH. НО! Не всегда. Что бы отличать кислоту от основания необходимо… запомнить их! Сожалею. Что бы хоть как то облегчить жизнь, три наших друга, Аррениус и Бренстед с Лоури, придумали две теории, которые зовутся их именем.
Как металлы и неметаллы, кислоты и основания — это разделение веществ по схожим свойствам. Первая теория кислот и оснований принадлежала швецкому учёному Аррениусу. Кислота по Аррениусу — это класс веществ, которые в реакции с водой диссоциируют (распадаются), образовывая катион водорода H+. Основания Аррениуса в водном растворе образуют анионы OH—. Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания, соответственно, — это вещества, способные принять протон в реакции. Актуальная на данный момент теория — теория Льюиса. Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты — это распад HCl на H+ и Cl—.
Свойства кислот и оснований
Кислоты, содержащие водород, в водном растворе выделяют катионы водорода. Основания, содержащие гидроксид-ион, в водном растворе выделяют анион OH—.
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется газ.
Часто используемые кислоты:
H2O, H3O+, CH3CO2H, H2SO4, HSO4−, HCl, CH3OH, NH3
Часто используемые основания:
OH−, H2O, CH3CO2−, HSO4−, SO42−, Cl−
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H+ и анионы. Пример сильной кислоты — соляная кислота HCl:
HCl(р-р) + H2O(ж) → H3O+(р-р) + Cl—(р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
- HCl — соляная кислота
- HBr — бромоводород
- HI — йодоводород
- HNO3 — азотная кислота
- HClO4 — хлорная кислота
- H2SO4 — серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF(р-р)+ h3O(ж) → h4O+(р-р) + F—(р-р) — в такой реакции более 90% кислоты не диссоциирует:
[H3O+]=[F—] < 0,01M для вещества 0,1М
Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов, чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
- HF фтороводородная
- H3PO4 фосфорная
- H2SO3 сернистая
- H2S сероводородная
- H2CO3 угольная
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH(р-р) + H2O ↔ NH4
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH)2 гидроксид бария
- Ca(OH)2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH
NH3 (р-р) + H2O ↔ NH+4 (р-р) + OH—(р-р)
Большинство слабых оснований — это анионы:
F—(р-р) + H2O ↔ HF(р-р) + OH—(р-р)
Список слабых оснований
- Mg(OH)2 гидроксид магния
- Fe(OH)2 гидроксид железа (II)
- Zn(OH)2 гидроксид цинка
- NH4OH гидроксид аммония
- Fe(OH)3 гидроксид железа (III)
Реакции кислот и оснований
Сильная кислота и сильное основание
Пример:
H3O+ + OH— ↔ 2H2O
Слабое основание и слабая кислота
Общий вид реакции:
Слабое основание(р-р) + H2O ↔ Слабая кислота(р-р) + OH—(р-р)
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
HX(р-р) + OH—(р-р) ↔ H2O + X—(р-р)
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
NH3 (р-р) + H+ ↔ NH4
Диссоциация воды
Диссоциация — это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от равновесия, которое присутствует в воде:
H2O + H2O ↔ H3O+(р-р) + OH—(р-р)
Kc = [H3O+][OH—]/[H2O]2
Константа равновесия воды при t=25°: Kc = 1.83⋅10-6, также имеет место следующее равенство: [H3O+][OH—] = 10-14, что называется константой диссоциации воды. Для чистой воды [H3O+] = [OH—] = 10-7, откуда -lg[H3O] = 7.0.
Данная величина (-lg[h3O]) называется pH — потенциал водорода. Если pH < 7, то вещество имеет кислотные свойства, если pH > 7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр — устройство, трансформирующее концентрацию протонов в растворе в электрический сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль — это ионное соединение образованное катионом отличным от H+ и анионом отличным от O2-. В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли, необходимо определить, какие ионы присутствуют
в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH:
не отдают ионы ни H
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F—, CH3COO—, CO2-3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
- Ёмкость раствора — количество сильной кислоты или сильного основания, которые можно добавить не повлияв на pH раствора
- Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
Тест:
Кисло́ты и основания
Классы химических соединений. Обычно кислотами называют вещества, содержащие водород (HCl, HNO3, H2SO4, CH3COOH и т.д.) и диссоциирующие в воде с образованием ионов Н+ (точнее, ионов гидроксония H3O+). Присутствие этих ионов обусловливает характерный острый вкус водных растворов кислот, а также их способность изменять окраску индикаторов химических (См. Индикаторы химические). По числу отщепляющихся протонов различают кислоты одноосновные (например, азотная HNO3, соляная HCl, уксусная CH3COOH), двухосновные (серная H2SO4, угольная H2CO3), трехосновные (ортофосфорная H3PO4). Чем больше ионов гидроксония присутствует в водном растворе кислоты, т. е. чем выше степень диссоциации последней, тем кислота сильнее. Кислоты, полностью диссоциированные в разбавленных растворах, называют сильными. К слабым относятся кислоты с константой ионизации (характеризующей степень диссоциации кислоты в растворе, например, при 25 °С) ниже 10-5 (уксусная 1,8․10-5, синильная 7,9․10-10). Диссоциация многоосновных кислот происходит в несколько ступеней, каждая из которых имеет свою константу ионизации. Например, константа ионизации H3PO4 на
Н+ и H2PO—4 7․10-3, H2PO4— на Н+ и HPO42- 8․10-8, HPO42- на Н+ и PO43- 4,8․10-13. Об органических кислотах см. также Карбоновые кислоты. Основаниями обычно называют вещества, содержащие гидроксильную группу OH [КОН, NaOH, Ca (OH)2 и др.] и способные диссоциировать в водном растворе с образованием гидроксильных ионов OH—. Большинство оснований нерастворимо в воде. Растворимые в воде основания называют щелочами (См. Щёлочи). Присутствием ионов OH— и объясняется характерный щелочной вкус растворов щелочей, а также их способность изменять окраску индикаторов. Основания с 1, 2, 3 гидроксильными группами называются соответственно одно-, двух-, трёхкислотными. Не полностью диссоциирующие при растворении в воде основания называются, как и кислоты, слабыми. К сильным основаниям относятся гидроокиси калия KOH, натрия NaOH, бария Ba (OH)3. О принципах установления названий К. и о. см. Номенклатура неорганических соединений.
Понятия К. и о. возникли ещё на заре развития химии. В 1778 французский химик А. Л. Лавуазье попытался объяснить особенности свойств кислот содержанием кислорода. Несостоятельность такого мнения стала очевидной, когда оказалось, что многие кислородсодержащие вещества (окислы металлов, щелочи, соли и др.) не проявляют кислотных свойств, а ряд типичных кислот (соляная, синильная, плавиковая и др.), как показали английский учёный Г. Дэви (1810) и французский учёный Ж. Л. Гей-Люссак (1814), не содержат кислорода. Шведский химик И. Я. Берцелиус (1812—19) видел причину кислотных и основных свойств в электрической природе окислов: электроотрицательные окислы неметаллов (и некоторых металлов — хрома, марганца) он считал кислотами, а электроположительные окислы металлов — основаниями. В 1814 Г. Дэви предложил признать носителем кислотных свойств водород, входящий в состав всех известных тогда соединений, обладающих кислотными свойствами, а немецкий химик Ю. Либих (1833) внёс существенное уточнение, что кислотные свойства вещества обусловлены не всеми содержащимися в нём атомами водорода, а лишь теми из них, которые могут замещаться металлом с образованием солей (См. Соли). После появления (1884—87) теории электролитической диссоциации (См. Электролитическая диссоциация) шведского учёного С. Аррениуса кислотами стали называть соединения, при диссоциации которых в водном растворе образуются ионы водорода Н+, а основаниями — соединения, диссоциирующие с отщеплением иона гидроксила OH—. По мере развития теории растворов (См. Растворы) стало ясно, что важную роль в процессе электролитической диссоциации веществ играет взаимодействие как самих веществ, так и продуктов их диссоциации с растворителем. Было выяснено также, что ион Н+ не может находиться в растворе в свободном виде: вследствие очень высокой плотности заряда он прочно соединяется с молекулами растворителя (сольватируется) и реально существует в виде сольватного иона, в водных растворах — иона гидроксония, который и является носителем кислотных свойств.
Определение понятий К. и о. на основе теории электролитической диссоциации часто вполне достаточно для практических целей. Однако, как было установлено уже давно, многие соединения, проявляющие типичные свойства К. и о., не содержат ни водорода ни групп ОН. Кроме того, одно и то же вещество нередко в одних реакциях ведёт себя как кислота, а в других — как основание (см. Амфотерность). Способность вещества реагировать как кислота или основание является, таким образом, не абсолютным свойством этого вещества, а выражается в конкретных химических реакциях, относимых к классу кислотно-основных. В таких реакциях одно из взаимодействующих веществ играет роль кислоты по отношению к другому веществу, играющему роль основания. Итак, способность вещества реагировать в качестве кислоты или основания является его функциональной характеристикой. Было предпринято множество попыток разработать единую теорию, которая позволила бы, с учётом указанных обстоятельств, однозначно относить данное вещество к классу кислот или оснований. Однако до сих пор единого критерия для этого не найдено. Наиболее распространены две концепции — датского физико-химика И. Н. Брёнстеда и американского физико-химика Г. Н. Льюиса (1923). Брёнстед относит к классу кислот водородсодержащие вещества, отдающие при реакциях положительные ионы водорода — протоны (т. н. протонные, или брёнстедовские, кислоты), а к классу оснований — вещества, присоединяющие протоны. Функции К. и о., по Брёнстеду, могут выполнять как нейтральные молекулы, так и ионы. Химическая реакция, при которой происходит передача протона от кислоты к основанию: АН+В— ⇔ А—+ВН (где АН — кислота, а В— — основание), называется кислотно-основной, или протолитической. Поскольку протолитические реакции обратимы, причем в обратной реакции, так же как и в прямой, происходит передача протона, продукты прямой реакции также выполняют друг по отношению к другу функцию К. и о. (так называемые сопряженные К. и о.), то есть ВН — кислота, а А— — основание. Например, в реакции: H2SO4 + H2O ⇔ HSO—4 + H3O+ кислотами являются H2SO4, и H3O+, а HSO—4 и H2O — основания. Концепция Брёнстеда дает четкий критерий для отнесения химических реакций к типу кислотно-основных, позволяет выражать в количественной форме основные характеристики протолитических равновесий и расположить водородсодержащие вещества в ряд по возрастанию их способности отдавать протон, то есть по их кислотности. Эти достоинства теории протолитических равновесий обусловили ее предсказательную силу и обеспечили широкое использование брёнстедовских представлений в химической практике. В то же время концепции Брёнстеда свойственна ограниченность, выражающаяся в том, что, связывая кислотные свойства вещества с наличием в его составе водорода, она все же оставляет в стороне большое число веществ кислотного характера, не содержащих водорода. К таким веществам, получившим в химии название апротонных, или льюисовских, кислот, относятся электронно-ненасыщенные соединения, например галогениды бора, алюминия и олова, окислы некоторых металлов и т.д. Согласно концепции Льюиса, восполняющей в какой-то степени вышеуказанный пробел, кислотой называют вещество, присоединяющее при химической реакции пару электронов, а основанием — вещество, отдающее пару электронов. Результатом является восполнение электронной ненасыщенности молекулы кислоты за счет электронов основания, а также возникновения нового соединения (соли) с устойчивой электронной оболочкой (в частности, октетом) и донорно-акцепторной связью, например:

где BF3 — кислота, а NH3 — основание. Важная особенность кислотно-основных реакций, по Льюису, состоит в обобществлении электронной пары основания. Этим они отличаются от окислительно-восстановительных реакций, в ходе которых молекулы окислителя полностью отбирают по одному или несколько электронов у молекул восстановителя; никаких обобществленных орбит при этом не возникает. В отличие от Брёнстеда, Льюис связывает кислотно-основные свойства не с наличием определенных химических элементов (в частности, водорода), а исключительно со строением внешних электронных оболочек атомов. В то же время между обеими концепциями имеется внутренняя связь, основанная на том, что для иона Н+, так же как и для льюисовских кислот, характерно сильное сродство к электронной паре. Кроме двух рассмотренных концепций К и о., известны некоторые другие, которые не получили, однако, столь широкого распространения.
Как брёнстедоские, так и льюисовские теории К. и о. широко применяются на практике. Изменение кислотности или основности среды часто используют с целью увеличения скорости реакций и изменения механизма взаимодействия. В этом состоит сущность кислотно-основного Катализа, широко используемого в химической промышленности; при этом важно, что брёнстедовские и льюисовские кислоты оказывают во многих случаях сходное каталитическое действие. Широкое применение получили кислотно-основные процессы в химической промышленности (Нейтрализация, Гидролиз, Травление металлов и т.д.). Многие кислоты (серная, азотная, соляная, ортофосфорная и др.) и щёлочи (едкое кали, едкий натр и др.) являются основными продуктами химического производства и используются в качестве исходных веществ в важнейших отраслях химической промышленности.
Многообразные — структурные и динамические — функции К. и о. выполняют в живых организмах, принимая участие во многих биохимических процессах. Как правило, эти процессы очень чувствительны к кислотности или основности среды (см. Водородный показатель, Кислотно-щелочное равновесие). Направленное воздействие К. и о. используется в медицине. Так, разбавленные растворы соляной кислоты употребляются для усиления секреции желудка, борной — для дезинфицирующих и вяжущих полосканий и т.д. В то же время при попадании в организм концентрированных К. и о. возможны сильные ожоги внутренних органов, падение сердечной деятельности и т.д., приводящие в ряде случаев к гибели организма.
Лит.: Людер В., Цуффанти С., Электронная теория кислот и оснований, пер. с англ., М.,1950; Усанович М. И., Что такое кислоты и основания, А.-А., 1953; Полинг Л., Общая химия, пер. с англ., М.. 1964; Краткая химическая энциклопедия, т. 2, М., 1963.
Я. М. Варшавский.
Источник: Большая советская энциклопедия на Gufo.me
Значения в других словарях
- кислоты и основания — КИСЛОТЫ И ОСНОВАНИЯ Термины «кислоты» и «основания» вполне сформировались в 17 в. Их содержание неоднократно пересматривалось и дополнялось. Этот процесс происходил и происходит в острых столкновениях представителей разных взглядов на природу К. Химическая энциклопедия

Простые и сложные вещества
1. Простыми называются вещества, которые состоят из атомов одного химического элемента (О2, Н2, Na, Al)
2. Сложными называются вещества, которые состоят из нескольких химических элементов (H2O, CuSO4)
3. Оксиды — сложные вещества, которые состоят из атомов двух химических элементов, один из которых кислород со степенью окисления -2.
4. Основные оксиды — оксиды, которым соответствуют основания (CaO — Ca(OH)2)
5. Кислотные оксиды — оксиды, которым соответствуют кислоты (P2O5 — H3PO4, Mn2O7 — HMnO4)
6. Амфотерные оксиды — оксиды, проявляющие основные и кислотные свойства (Al2O3, BeO, ZnO, Cr2O3)
7. Несолеобразующие оксиды — не проявляют ни основных ни кислотных свойств (N2O, NO, CO)
8. Кислоты — сложные вещества, которые состоят из атомов водорода и кислотных остатков
HCl — соляная кислота (хлороводородная) (хлориды)
HNO3 — азотная (нитраты)
H2SO4 — серная (сульфаты)
H3PO4 — фосфорная (фосфаты)
H2CO3 — угольная (карбонаты)
H2S — сероводородная (сульфиды)
H2SO3 — сернистая (сульфиты)
H2SiO3 — кремниевая (силикаты)
HF — фтороводородная (плавиковая) (фториды)
HBr — бромоводородная (бромиды)
HNO2 — азотистая (нитриты)
9. Основания — сложные вещества, которые состоят из катиона металла и гидроксид-ионов (NaOH, Fe(OH)3). Растворимые в воде основания называют щелочами.
10. Соли — сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков (NaCl, CuSO4)
Давайте порассуждаем вместе
1. Сульфат алюминия относят к классу:
1) оксидов
2) оснований
3) солей
4) кислот
Ответ: сульфат алюминия Al2(SO4)3 относят к классу солей, т.к. это сложное вещество, которое состоит из катионов металла алюминия и кислотных остатков сульфат-анионов.
2. Кислотой и щелочью соответственно являются вещества, формулы которых:
1) HCl, Cu(OH)2
2) HNO3, Ba(OH)2
3) NaCl, NaOH
4) H2SiO3, Fe(OH)2
Ответ: правильный ответ №2, т.к. HNO3 — это азотная кислота, а Ва(OH)2 — основание, которое хорошо растворяется в воде, значит является щелочью
3. Основному оксиду соответствует формула:
1) SO3
2) NO2
3) MgO
4) P2O5
Ответ: MgO — основный оксид, т.к. ему соответствует основание Mg(OH)2
4. Амфотерным оксидом и кислотным оксидом соответственно явлются вещества:
1) Al2O3, SO2
2) NaOH, P2O5
3) ZnO, HCl
4) Zn(OH)2, H2SO4
Ответ: правильный ответ №1, т.к. Al2O3 — амфотерный оксид, а SO2 — кислотный оксид, ему соответствует сернистая кислота H2SO3
5. Нерастворимым основанием и солью соответственно являются вещества:
1) KOH, Ca(NO3)2
2) CaO, Na2CO3
3) Mg(OH)2, H2SO4
4) Fe(OH)3, AgBr
Ответ: правильный ответ №4, т.к. Fe(OH)3 — нерастворимое основание, а AgBr — бромид серебра — соль
Урок 16. Кислоты и основания – HIMI4KA
В уроке 16 «Кислоты и основания» из курса «Химия для чайников» дадим определение кислотам и основаниям, рассмотрим процесс их диссоциации в водном растворе и различия слабых кислот и оснований от сильных. Кроме того, вы узнаете самые распространенные кислоты и основания. Основы химии, которые вы должны знать перед прочтением данного урока, содержатся в уроке 9 «Ионы в водном растворе».


Что такое кислота и основание?
Для тех, кто только к нам присоединился напоминаю, что ионы — это все те же атомы веществ, просто с бОльшим или меньшим количеством электронов относительно числа протонов. Для кислот и оснований наиболее популярны следующие определения:
Кислота — это вещество, которое при добавлении к воде повышает концентрацию ионов водорода [H+].
Основание — это вещество, которое при добавлении к воде повышает концентрацию гидроксидных ионов [OH—]. Забегая вперед, скажу, что основанием также называют вещество, которое забирает ионы водорода [H+].
Если данные определения вам не понятны, то скорее всего вам нужно вспомнить, что такое простые и сложные ионы. Дальше все будет проще, ведь сложные лишь определения!
Диссоциация кислот
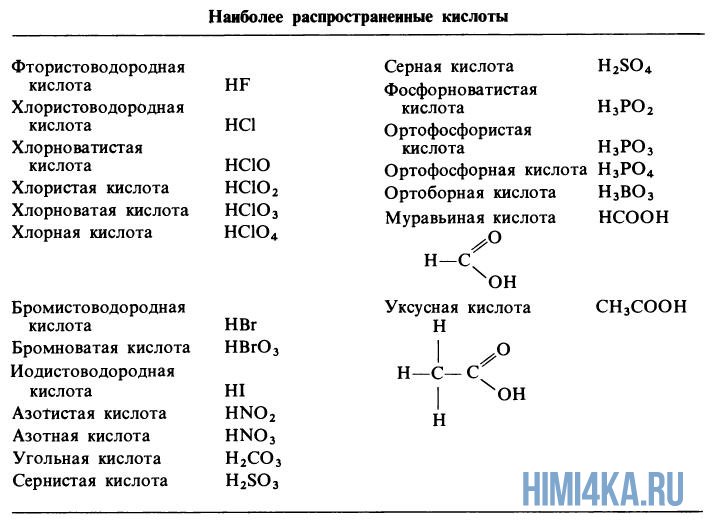

Диссоциация кислот, от HF до HNO3, в водном растворе сопровождается высвобождением одного протона, т.е иона водорода H+.
- HNO3 → H+(водн.) + NO3—(водн.)
В дальнейшем не будем указывать сокращение (водн.), означающее что ион гидратирован, поскольку в водном растворе любой ион гидратирован. Кислоты H2CO3, H2SO3 и H2SO4 диссоциируют в водном растворе с высвобождением двух протонов. Это происходит не в одну, а в две стадии:
- H2CO3 → H+ + HCO3— → 2H+ + CO—
- H2SO3 → H+ + HSO3— → 2H+ + SO—
- H2SO4 → H+ + HSO4— → 2H+ + SO42-
Угольная кислота дает протоны в раствор только частично, так помимо смеси HCO3— и CO— ионов в водном растворе присутствует немного недиссоциированной угольной к-ты. Зато серная кислота полностью высвобождает первый из двух ионов H+, поэтому она считается сильной кислотой. Самые распространенные сильные кислоты — это хлористоводородная и азотная, а распространенная слабая кислота — фосфорная кислота.
Каждая фосфорсодержащая кислота высвобождает в водном растворе три протона, и соответственно осуществляется это в 3 стадии:
- H3PO4 → H+ + H2PO4— → 2H+ + HPO42- → 3H+ + PO43-
Органические кислоты, такие как уксусная и муравьиная кислота, дают H+ из своих карбоксигрупп –COOH.
- CH3 –COOH → CH3 –COO— + H+
Диссоциация оснований
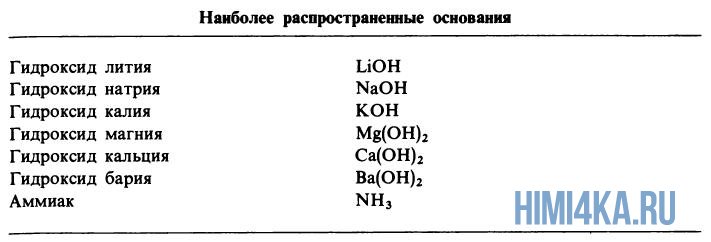

Диссоциация оснований, содержащие OH-группы (гидроксигруппы), например LiOH или Ca(OH)2, дает в водный раствор гидроксидные ионы OH—:
- LiOH → Li+ + OH—
- Ca(OH)2 → Ca2+ + 2OH—
Хотя у аммиака отсутствуют OH— ионы, тем не менее NH3 является основанием, поскольку он образует гидроксидные ионы при реакции с молекулами воды:
- NH3 + H2O → NH4+ + OH—
Надеюсь урок 16 «Кислоты и основания» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Задания
1. Определи название и класс вещества, напиши формулу.
2. Дайте названия солей, кислот, приведите формулы кислот.
3. Тест с выбором правильного ответа.
1. Кислотными оксидами являются все вещества в группе:
а) ZnO, SO2 , H2 SO4
б) SiO2, Cl2O7, P2 O5
в) CO2, Al2O3, Fe2O3
г) Li2O, NO, FeO
2. Вещество, название которого нитрат железа (II), имеет формулу:
а) FeN
б) Fe(NO3)3
в) Fe(NO2)2
г) Fe(NO3)2
3. Солями являются:
а) Al2 S3, NH4Cl, H2SiO4
б) Al2 O3, NH4 NO3, K2SiO4
в) Al ( OH)3, NH4 Cl, Na2SiO4
г) Al2 S3, NH4Cl, K2SiO4
4. К основным оксидам относится группа веществ:
а) SO3, HCl, CuO
б) CuO, Na2O, CaO
в) CaO, BaO, SiO2
г) SiO2, OF2, Al2O3
5. К кислотам относится группа веществ:
а) H2 S, HNO3, HBr
б) KCl, HCl, H2 SO4
в) NH 3, HNO3 , HJ
г) NaOH, H 2SO4 , H2 S
6. Вещество, название которого сульфит натрия, имеет формулу:
а) Na2SO3
б) Na2 SO4
90000 Difference Between Acid and Base 90001 90002 Acid and Base Introduction and Examples 90003 90004 VIEW MORE 90005 90004 Acid and base are the form of chemicals which plays a vital role in chemistry and are readily available in our daily life.Examples of acids include citric acid and lactic acid present in lemons and in dairy respectively. Some examples of bases include cleaning products like bleach and ammonia. Just about every liquid that we can think about in our day-to-day life are acid or base with the exception of water. Acid and base definition was evolved with the time through 3 sets of theories, which includes Arrhenius, Brønsted and Lewis theories. The substances which act as both acids and base are called as Amphoterism, water is the most common example of amphoterism, as it acts like both acid and base.90005 90004 90009 What is Acid? 90010 90005 According to Arrhenius, a substance can be said acid if they ionize or break-off in an aqueous solution to form hydrogen ions (H + ions), this type of classification of acids can work for aqueous solutions. The limitation of this type of classification is that when both acids and bases react with each other then they will get neutralized as hydrogen ions and hydroxide ions react to produce water. 90004 90013 H + (aq) + OH- (aq) h3O (l) 90005 90004 90013 According to Brønsted theory, a substance is said to be acid if they are donating a proton (Hydrogen ion donor).Brønsted did not go against the theory of Arrhenius, he just added to it. A compound that donates H + ions is called as Brønsted-Lowry acid including typical acids, plus amines, and alcohol. This Brønsted-Lowry definition of an acid is the best definition acid can get. 90013 According to Lewis theory, a substance is said to be acid if they are accepting electrons from the other substance included in the reaction. The outer shell of the acids gets complete after accepting the electron-pairs in their valence shell.There is no change in the oxidation state of the reaction including acids. 90005 90004 90013 90009 Properties of acids are as follows: 90010 90005 • Acids conduct electricity (ie they are electrolytes) 90013 • They turn blue litmus to red 90013 • Most of the acids are solid 90013 • It has a sour taste 90013 • They produce hydrogen after reacting with active metals like zinc, magnesium, aluminum or iron. 90013 • Acids have a low pH value i.e. below 7. 90013 • Salts and water are produced when an acid reacts with base or alkalis.90013 • Most of the acids are solids. 90013 • Some of the acids can be said corrosive in nature. 90013 • Weak and more volatile acids are replaced by strong and less volatile acids from their salts. 90004 90013 90009 Types of acids are as follows: 90010 90005 Strong acids completely dissociate ions in water while weak acids partly dissociate ions in water. Acids are divided into 2 types based on the ion dissociation in water, i.e. strong acids and weak acids as stated below: — 90004 90013 1.90040 Strong Acids 90041 — A strong acid completely dissociates ions in water. There are only 6 strong acids which are as follows: 90005 90004 90013 • HCL (hydrochloric acid) 90013 • HNO3 (nitric acid) 90013 • HBr (hydrobromic acid) 90013 • HI (hydroiodic acid) 90013 • HClO4 (perchloric acid) 90013 • HClO3 (chloric acid) 90005 90004 90013 2. 90040 Weak Acids- 90041 A weak acid partly dissociates ions in water. The rest of the acids except for those 6 acids are weak acids.The hydrogen and halogen combine in a reaction to form a weak acid namely hydrofluoric acid, while hydrochloric acid is a very strong and extremely powerful and also corrosive in nature, but stated as weak acid. 90005 90004 90013 90009 What is B 90010 90009 ase? 90010 90005 A base is a chemical species that donates electrons, accept protons or release hydroxide (OH-) ions in aqueous solutions. There are certain characteristics displayed by the base that can be used to identify them. You can identify base with the help of these given ways like they are slippery to touch (e.g. soap), bitter in taste, react with acid to form a salt and catalyze certain reactions. It includes Arrhenius base, Bronsted-Lowry base and Lewis base as types of bases. There are some examples of bases such as alkaline metal hydroxides, alkaline earth metal hydroxide, and soap. 90004 90013 Properties of base can be listed as follows: 90005 90004 90013 • A base solution has pH balance more than 7. 90013 • Bases have a bitter flavour so never try to taste it. 90013 • When an aqueous base solution or molten bases solution is dissociated into ions they conduct electricity.90013 • Strong base reacts vigorously with acids and organic matter because these bases are caustic. 90013 • Bases react in correct way with pH indicators. It turns litmus paper blue, methyl orange yellow and phenolphthalein pink whereas Bromothymol blue remains blue in the presence of a base. 90005 90004 90013 Types of bases 90005 90004 90013 1. Strong base — It completely dissociates into its ions in water or in a compound that can remove a proton (H +) from a weak acid. Examples of strong base are sodium hydroxide (NaOH) and potassium hydroxide (KOH).90013 2. Weak Base- these bases completely dissociate in water. The aqueous solution is one of the examples that include a base and its conjugate acid. 90013 3. Neutral base — It is the one that forms a bond with a neutral acid. 90013 4. Superbase — This type of base is formed by alkali metal with its conjugate acid and even better in comparison to a strong base. One of the examples of the super base is sodium hydride (NaH). 90013 5. Solid Base — It may be used in anion exchange resins or for reactions with gaseous acids.It is active in solid form. Silicon Dioxide (SiO2) and NaOH mounted on alumina are the examples of Solid base. 90005 90004 90013 90009 Differences between Acid a 90010 90009 nd Base 90010 90005 90090 90091 90092 90093 Basis 90094 90093 Acid 90094 90093 Base 90094 90099 90092 90093 1. Arrhenius Definition 90094 90093 Acid is a kind of chemical compound that when dissolved in water gives a solution with H + ion activity more than purified water. 90094 90093 A base is an aqueous substance that donates electrons, accept protons or release hydroxide (OH-) ions.90094 90099 90092 90093 2. Bronstead Lowry Definition 90094 90093 An acid is a proton donor. 90094 90093 While a base is a proton acceptor. 90094 90099 90092 90093 3. Examples 90094 90093 Acetic acid (Ch4COOH) and sulphuric acid are two examples of Acid. 90094 90093 Sodium Hydroxide (NaOH) and Ammonia are two examples of Bases. 90094 90099 90092 90093 4. PH value 90094 90093 pH values of acid are less than 7.0. 90094 90093 On the other hand, the pH value of base is greater than 7.0. 90094 90099 90092 90093 5. Phenolphthalein 90094 90093 Acid remains colourless when dissolved. 90094 90093 Bases make the solution turn pink when dissolved. 90094 90099 90092 90093 6. Chemical formula 90094 90093 Acid starts with chemical formula H, for example, HCL (Hydrochloric Acid) but there is an exception of Ch3COOH. 90094 90093 At the same time, base has a chemical formula OH at the end of it. For example- NaOH (Sodium Hydroxide). 90094 90099 90092 90093 7. Litmus paper 90094 90093 Acid turns blue litmus paper into red.90094 90093 Base turns red litmus paper into blue. 90094 90099 90092 90093 8. Strength 90094 90093 Acid mainly depends on the concentration of the hydronium ions. 90094 90093 Similarly happens in a base. 90094 90099 90092 90093 9. Characteristics 90094 90093 Acid can be in the form of solid, liquid or gas form depending on the temperature. 90094 90093 Bases have a bitter taste having a bit slippery and solid appearance except ammonia which is present in the gaseous state 90094 90099 90092 90093 10.Dissociation 90094 90093 When acids dissolved in water, it release hydrogen ions (H +). 90094 90093 Base release hydroxide ions (OH-) when dissolved in water. 90094 90099 90092 90093 11. Examples 90094 90093 Examples of acids are acetic acid, sulphuric acid, etc. 90094 90093 Examples of bases are sodium hydroxide, ammonia, etc. 90094 90099 90188 90189 .90000 Acids And Bases | Types Of Reactions 90001 90002 What are acids and bases? (ESBQV) 90003 90004 Household acids and bases 90005 90006 Look around your home and school and find examples of acids and bases. Remember that foods can also be acidic or basic. 90007 90006 Make a list of all the items you find. Why do you think they are acids or bases? 90007 90006 Some common acids and bases, and their chemical formulae, are shown in Table 13.1. 90007 90012 90013 90014 90006 90016 Acid 90017 90007 90019 90014 90006 90016 Formula 90017 90007 90019 90014 90006 90016 Base 90017 90007 90019 90014 90006 90016 Formula 90017 90007 90019 90038 90013 90014 90006 Hydrochloric acid 90007 90019 90014 90006 \ (\ text {HCl} \) 90007 90019 90014 90006 Sodium hydroxide 90007 90019 90014 90006 \ (\ text {NaOH} \) 90007 90019 90038 90013 90014 90006 Sulfuric acid 90007 90019 90014 90006 \ (\ text {H} _ {2} \ text {SO} _ {4} \) 90007 90019 90014 90006 Potassium hydroxide 90007 90019 90014 90006 \ (\ text {KOH} \) 90007 90019 90038 90013 90014 90006 Sulfurous acid 90007 90019 90014 90006 \ (\ text {H} _ {2} \ text {SO} _ {3} \) 90007 90019 90014 90006 Sodium carbonate 90007 90019 90014 90006 \ (\ text {Na} _ {2} \ text {CO} _ {3} \) 90007 90019 90038 90013 90014 90006 Acetic (ethanoic) acid 90007 90019 90014 90006 \ (\ text {CH} _ {3} \ text {COOH} \) 90007 90019 90014 90006 Calcium hydroxide 90007 90019 90014 90006 \ (\ text {Ca} (\ t ext {OH}) _ {2} \) 90007 90019 90038 90013 90014 90006 Carbonic acid 90007 90019 90014 90006 \ (\ text {H} _ {2} \ text {CO} _ {3} \) 90007 90019 90014 90006 Magnesium hydroxide 90007 90019 90014 90006 \ (\ text {Mg} (\ text {OH}) _ {2} \) 90007 90019 90038 90013 90014 90006 Nitric acid 90007 90019 90014 90006 \ (\ text {HNO} _ {3} \) 90007 90019 90014 90006 Ammonia 90007 90019 90014 90006 \ (\ text {NH} _ {3} \) 90007 90019 90038 90013 90014 90006 Phosphoric acid 90007 90019 90014 90006 \ (\ text {H} _ {3} \ text {PO} _ {4} \) 90007 90019 90014 90006 Sodium bicarbonate 90007 90019 90014 90006 \ (\ text {NaHCO} _ {3} \) 90007 90019 90038 90165 90006 Table 13.1: Some common acids and bases and their chemical formulae. 90007 90006 Most acids share certain characteristics, and most bases also share similar characteristics. It is important to be able to have a definition for acids and bases so that they can be correctly identified in reactions. 90007 90002 Defining acids and bases (ESBQW) 90003 90006 One of the first things that was noted about acids is that they have a sour taste. Bases were noted to have a soapy feel and a bitter taste.{-} \) ions and is therefore a 90181 base 90182. 90007 90006 Note that we write \ (\ stackrel {\ text {H} _ {2} \ text {O}} {\ longrightarrow} \) to indicate that water is needed for the dissociation. 90007 90200 90211 90006 However, this definition could only be used for acids and bases 90181 in water 90182. Since there are many reactions which do not occur in water it was important to come up with a much broader definition for acids and bases. 90007 90006 In 1923 Lowry and Bronsted took the work of Arrhenius further to develop a broader definition for acids and bases.{-} \ text {(aq)} \) 90007 90006 We highlight the chlorine and the nitrogen so that we can follow what happens to these two elements as they react. We do not highlight the hydrogen atoms as we are interested in how these change. This colour coding is simply to help you identify the parts of the reaction and does not represent any specific property of these elements. 90007 90006 \ (\ text {H} {\ color {red} {\ text {Cl}}} \ text {(aq)} + {\ color {blue} {\ text {N}}} \ text {H} _ {3} \ text {(aq)} \ rightarrow {\ color {blue} {\ text {N}}} \ text {H} _ {4} ^ {+} \ text {(aq)} + {\ color {red} {\ text {Cl}}} ^ {-} \ text {(aq)} \) 90007 90006 In order to decide which substance is a proton donor and which is a proton acceptor, we need to look at what happens to each reactant.{+} \ Text {(aq)} \) 90007 90006 Water donates a proton and is therefore an 90016 acid 90017 in this reaction. Ammonia accepts the proton and is therefore the 90016 base 90017. 90007 90200 90211 90006 Notice in these examples how we looked at the common elements to break the reaction into two parts. So in the first example we followed what happened to chlorine to see if it was part of the acid or the base. And we also followed nitrogen to see if it was part of the acid or the base.You should also notice how in the reaction for the acid there is one less hydrogen on the right hand side and in the reaction for the base there is an extra hydrogen on the right hand side. 90007 90314 Amphoteric substances 90315 90006 In examples \ (\ text {2} \) and \ (\ text {3} \) above we notice an interesting thing about water. In example \ (\ text {2} \) we find that water acts as a base (it accepts a proton). In example \ (\ text {3} \) however we see that water acts as an acid (it donates a proton)! 90007 90006 Depending on what water is reacting with it can either react as a base or as an acid.Water is said to be 90016 amphoteric 90017. Water is not unique in this respect, several other substances are also amphoteric. 90007 90220 90221 Amphoteric 90222 90223 90006 An amphoteric substance is one that can react as either an acid or base. 90007 90230 90231 90006 When we look just at Bronsted-Lowry acids and bases we can also talk about amphiprotic substances which are a special type of amphoteric substances. 90007 90220 90221 Amphiprotic 90222 90223 90006 An amphiprotic substance is one that can react as either a proton donor (Bronsted-Lowry acid) or as a proton acceptor (Bronsted-Lowry base).{-} \)). 90007 90230 90231 90006 90016 Note: 90017 You may also see the term 90016 ampholyte 90017 used to mean a substance that can act as both an acid and a base. This term is no longer in general use in chemistry. 90007 90314 Polyprotic acids [NOT IN CAPS] 90315 90006 A polyprotic (many protons) acid is an acid that has more than one proton that it can donate. For example sulfuric acid can donate one proton to form the hydrogen sulfate ion: 90007 \ [\ Text {H} _ {2} \ text {SO} _ {4} \ text {(aq)} + \ text {OH} ^ {-} \ text {(aq)} \ rightarrow \ text {HSO } _ {4} ^ {-} \ text {(aq)} + \ text {H} _ {2} \ text {O (l)} \] 90006 Or it can donate two protons to form the sulfate ion: 90007 \ [\ Text {H} _ {2} \ text {SO} _ {4} \ text {(aq)} + 2 \ text {OH} ^ {-} \ text {(aq)} \ rightarrow \ text { SO} _ {4} ^ {2 -} \ text {(aq)} + 2 \ text {H} _ {2} \ text {O (l)} \] 90006 In this chapter we will mostly consider monoprotic acids (acids with only one proton to donate).If you do see a polyprotic acid in a reaction then write the resulting reaction equation with the acid donating all its protons. 90007 90006 Some examples of polyprotic acids are: \ (\ text {H} _ {2} \ text {SO} _ {4} \), \ (\ text {H} _ {2} \ text {SO} _ {3 } \), \ (\ text {H} _ {2} \ text {CO} _ {3} \) and \ (\ text {H} _ {3} \ text {PO} _ {4} \). 90007 90006 Sign up to get a head start on bursary and career opportunities. Use Siyavula Practice to get the best marks possible. 90007 Sign up to unlock your future 90004 Acids and bases 90005 Exercise 13.{+} \ Text {(aq)} \) 90007 90006 From this we see that the Bronsted-Lowry acid is \ (\ text {HNO} _ {3} \) and the Bronsted-Lowry base is \ (\ text {NH} _ {3} \). 90007 90006 \ (\ Text {HBr (aq)} + \ text {KOH (aq)} \ rightarrow \ text {KBr (aq)} + \ text {H} _ {2} \ text {O (l)} \) 90007 90006 We break the reaction into two parts: 90007 90006 \ (\ text {HBr (aq)} \ rightarrow \ text {KBr (aq)} \) and 90007 90006 \ (\ text {KOH (aq)} \ rightarrow \ text {H} _ {2} \ text {O (l)} \) 90007 90006 From this we see that the Bronsted-Lowry acid is \ (\ text {HBr} \) and the Bronsted-Lowry base is \ (\ text {KOH} \).{+} \) Form a conjugate acid-base pair. 90007 90006 The word conjugate means coupled or connected. 90007 90006 We can represent this as: 90007 90004 Conjugate acid-base pairs 90005 90006 Using the common acids and bases in Table 13.1, pick an acid and a base from the list. Write a chemical equation for the reaction of these two compounds. 90007 90006 Now identify the conjugate acid-base pairs in your chosen reaction. Compare your results to those of your classmates. 90007 90006 Sign up to get a head start on bursary and career opportunities.{+} \ Text {(aq)} \) 90007 90006 From this we see that the Bronsted-Lowry acid is \ (\ text {H} _ {2} \ text {O} \) and the Bronsted-Lowry base is \ (\ text {NH} _ {3} \) . 90007 90006 Label the conjugate acid-base pairs. 90007 90006 In your own words explain what is meant by the term conjugate acid-base pair. 90007 90006 A conjugate acid-base pair is a reactant and product pair that is transformed into each other through the loss or gain of a proton.So for example an acid loses a proton to form a base. The acid and the resulting base are said to be a conjugate acid-base pair. 90007 .90000 2.7: Ions as Acids and Bases 90001 90002 Learning Objectives 90003 90004 90005 Extend previously introduced equilibrium concepts to acids and bases that may donate or accept more than one proton 90006 90007 90002 We can also use the relative strengths of conjugate acid-base pairs to understand the acid-base properties of solutions of salts. A neutralization reaction can be defined as the reaction of an acid and a base to produce a salt and water. That is, another cation, such as \ (Na ^ + \), replaces the proton on the acid.An example is the reaction of \ (\ ce {Ch4CO2H} \), a weak acid, with \ (\ ce {NaOH} \), a strong base: 90003 90002 \ [\ underset {acid} {\ ce {Ch4CO2H (l)}} + \ underset {base} {\ ce {NaOH (s)}} \ overset {\ ce {h3O}} {\ longrightarrow} \ underset { salt} {\ ce {h3OCh4CO2Na (aq)}} + \ underset {water} {\ ce {h3O (l)}} \ label {16.35} \] 90003 90002 Depending on the acid-base properties of its component ions, however, a salt can dissolve in water to produce a neutral solution, a basic solution, or an acidic solution. 90003 90002 When a salt such as \ (NaCl \) dissolves in water, it produces \ (Na ^ + _ {(aq)} \) and \ (Cl ^ -_ {(aq)} \) ions.{-} (aq)} \] 90003 90002 Neither reaction proceeds very far to the right as written because the formation of the weaker acid-base pair is favored. Both \ (HCN \) and acetic acid are stronger acids than water, and hydroxide is a stronger base than either acetate or cyanide, so in both cases, the equilibrium lies to the left. Nonetheless, each of these reactions generates enough hydroxide ions to produce a basic solution. For example, the \ (pH \) of a 0.1 M solution of sodium acetate or potassium cyanide at 25 ° C is 8.- \) is a stronger base (\ (pK_b = 4.79 \)) than acetate (\ (pK_b = 9.24 \)), which is consistent with \ (KCN \) producing a more basic solution than sodium acetate at the same concentration. 90003 90002 In contrast, the conjugate acid of a weak base should be a weak acid. For example, ammonium chloride and pyridinium chloride are salts produced by reacting ammonia and pyridine, respectively, with \ (HCl \). As you already know, the chloride ion is such a weak base that it does not react with water. In contrast, the cations of the two salts are weak acids that react with water as follows: 90003 90002 \ [\ ce {NH ^ {+} 4 (aq) + h3O (l) << => Nh4 (aq) + h4O ^ {+} (aq)} \] 90003 90002 \ [\ ce {C5H5NH ^ {+} (aq) + h3O (l) << => C5H5NH (aq) + h4O ^ {+} (aq)} \] 90003 90002 \ (H_3O ^ + \) is a stronger acid than either \ (NH_4 ^ + \) or \ (C_5H_5NH ^ + \), and conversely, ammonia and pyridine are both stronger bases than water.+ \) Concentration produced by the reactions is great enough, however, to decrease the \ (pH \) of the solution significantly: the \ (pH \) of a 0.10 M solution of ammonium chloride or pyridinium chloride at 25 ° C is 5.13 or 3.12, respectively. 90003 90002 What happens with aqueous solutions of a salt such as ammonium acetate, where both the cation and the anion can react separately with water to produce an acid and a base, respectively? According to Figure 16.10, the ammonium ion will lower the \ (pH \), while according to Figure 16.9, the acetate ion will raise the \ (pH \). This particular case is unusual, in that the cation is as strong an acid as the anion is a base (pKa ≈ pKb). Consequently, the two effects cancel, and the solution remains neutral. With salts in which the cation is a stronger acid than the anion is a base, the final solution has a \ (pH \) <7.00. Conversely, if the cation is a weaker acid than the anion is a base, the final solution has a \ (pH \)> 7.00. 90003 90002 Solutions of simple salts of metal ions can also be acidic, even though a metal ion can not donate a proton directly to water to produce \ (H_3O ^ + \).Instead, a metal ion can act as a Lewis acid and interact with water, a Lewis base, by coordinating to a lone pair of electrons on the oxygen atom to form a hydrated metal ion (Figure \ (\ PageIndex {1a} \)) . A water molecule coordinated to a metal ion is more acidic than a free water molecule for two reasons. First, repulsive electrostatic interactions between the positively charged metal ion and the partially positively charged hydrogen atoms of the coordinated water molecule make it easier for the coordinated water to lose a proton.{3 +} \) with water to form the hydrated metal ion is an example of a Lewis acid-base reaction. (B) The positive charge on the aluminum ion attracts electron density from the oxygen atoms, which shifts electron density away from the O-H bonds. The decrease in electron density weakens the O-H bonds in the water molecules and makes it easier for them to lose a proton. 90002 The magnitude of this effect depends on the following two factors (Figure \ (\ PageIndex {3} \)): 90003 90040 90005 The charge on the metal ion.+ \)) Of the same radius. 90006 90005 The radius of the metal ion. For metal ions with the same charge, the smaller the ion, the shorter the internuclear distance to the oxygen atom of the water molecule and the greater the effect of the metal on the electron density distribution in the water molecule. 90006 90045 Figure \ (\ PageIndex {3} \): The Effect of the Charge and Radius of a Metal Ion on the Acidity of a Coordinated Water Molecule. The contours show the electron density on the O atoms and the H atoms in both a free water molecule (left) and water molecules coordinated to \ (Na ^ + \), \ (Mg ^ {2 +} \), and \ ( Al ^ {3 +} \) ions.{3 +} \), have different sizes and charges, but similar charge-to-radius ratios. As a result, these pairs of metal ions have similar effects on the acidity of coordinated water molecules, and they often exhibit other significant similarities in chemistry as well. 90003 90002 Acidic Metal Ions 90003 90002 Solutions of small, highly charged metal ions in water are acidic. 90003 90002 Reactions such as those discussed in this section, in which a salt reacts with water to give an acidic or basic solution, are often called hydrolysis reactions.Using a separate name for this type of reaction is unfortunate because it suggests that they are somehow different. In fact, hydrolysis reactions are just acid-base reactions in which the acid is a cation or the base is an anion; they obey the same principles and rules as all other acid-base reactions. 90003 90002 Hydrolysis 90003 90002 A hydrolysis reaction is an acid-base reaction. 90003 90002 Example \ (\ PageIndex {1} \) 90003 90002 Predict whether aqueous solutions of these compounds are acidic, basic, or neutral.90003 90066 90005 \ (KNO_3 \) 90006 90005 \ (CrBr_3 \ cdot H_2O \) 90006 90005 \ (Na_2SO_4 \) 90006 90045 90002 90075 Given 90076: compound 90003 90002 90075 Asked for 90076: acidity or basicity of aqueous solution 90003 90002 90075 Strategy 90076: 90003 90066 90005 Assess the acid-base properties of the cation and the anion. If the cation is a weak Lewis acid, it will not affect the pH of the solution. If the cation is the conjugate acid of a weak base or a relatively highly charged metal cation, however, it will react with water to produce an acidic solution.{2 -}} \) ion will react with water as shown in Figure 16.6 to give a slightly basic solution. 90006 90045 90002 Exercise \ (\ PageIndex {1} \) 90003 90002 Predict whether aqueous solutions of the following are acidic, basic, or neutral. 90003 90066 90005 \ (\ ce {KI} \) 90006 90005 \ (\ ce {Mg (ClO4) 2} \) 90006 90005 \ (\ ce {NaHS} \) 90006 90045 90132 90133 90075 Answer a 90076 90136 90137 90002 neutral 90003 90140 90133 90075 Answer b 90076 90136 90137 90002 acidic 90003 90140 90133 90075 Answer c 90076 90136 90137 90002 basic (due to the reaction of \ (HS ^ — \) with water to form \ (H_2S \) and \ (\ ce {OH ^ {-}} \)) 90003 90140 90157 90158 Summary 90159 90002 A salt can dissolve in water to produce a neutral, a basic, or an acidic solution, depending on whether it contains the conjugate base of a weak acid as the anion (\ (A ^ — \)), the conjugate acid of a weak base as the cation (\ (BH ^ + \)), or both.Salts that contain small, highly charged metal ions produce acidic solutions in water. The reaction of a salt with water to produce an acidic or a basic solution is called a hydrolysis reaction. 90003 .90000 Acid-Base Reactions Are Fast (Compared To Substitution And Addition) 90001 90002 90003 Acid-Base Reactions Are Generally Faster Than Substitution Or Addition Reactions 90004 90005 90002 Here is a 90003 very 90004 common dilemma in organic chemistry as you move through the latter parts of Org 1 and then into Org 2: 90005 90002 When more than one reaction is possible, how do you know which one will happen? 90005 90002 90003 In a steel cage match between an acid base reaction and other types of reactions, which wins? 90004 90005 90002 In this post we postulate a good rule of thumb to keep in mind: 90003 acid-base reactions are fast, relative to other reactions.90004 90005 90002 Here are three examples — and by the way … 90003 these are common trick questions for exams! 90004 90005 90002 90003 Table Of Contents 90004 90005 90028 90029 Acid-Base vs Nucleophilic Substitution Reactions (S 90030 N 90031 2 reactions). 90032 90029 Acid-Base Reaction vs Addition To A Carboxylic Acid 90032 90029 Grignard Reaction To A Molecule With A Hydroxyl Functional Group 90032 90029 Why Acid-Base Reactions Are Fast: The Principle of Least Motion 90032 90029 Notes 90032 90029 (Advanced) References and Further Reading 90032 90043 90044 90045 90003 1.90004 Acid-Base vs Nucleophilic Substitution Reactions (S 90030 N 90031 2 reactions). 90050 90002 90005 90002 Here, note that our nucleophile (the conjugate base of an alkyne, pKa 25) can remove the proton of an alcohol (pKa ~ 15) or perform an S 90030 N 90031 2 reaction on the primary alkyl halide. 90003 With a difference of 10 pKa units between the alkyne and the alcohol, the acid-base reaction between the deprotonated alkyne ( «acetylide», stronger base) to produce a deprotonated alcohol ( «alkoxide», weaker base) is extremely favorable 90004.And since acid-base reactions are fast, relative to other reactions, the preferred first reaction here is deprotonation of the alcohol to give the conjugate base ( «alkoxide») 90005 90002 Bonus question: what would be the 90003 final 90004 product of this reaction , after the deprotonation? Answer below. 90005 90045 90003 2. Acid-Base Reaction vs Addition To A Carboxylic Acid 90004 90050 90002 90003 Grignard reagents 90004 are very good nucleophiles — reacting with carbonyl compounds such as ketones, aldehydes, and esters.But as the conjugate bases of alkanes (pKa ~ 50) they are also extremely strong bases. 90003 When combined with a carboxylic acid (pKa ~ 4 or 5) the result is not an addition to the carbonyl, but an acid base reaction 90004 (45 pKa units makes for a pretty favorable reaction!). 90005 90002 It’s always helpful to remember that carboxylic acids … are acids! 90005 90002 90005 90045 90003 3. Grignard Reaction To A Molecule With A Hydroxyl Functional Group 90004 90050 90002 The same applies for reactions of Grignard reagents with molecules that have hydroxyl groups in addition to aldehydes or ketones.If merely one equivalent is added, the first thing to happen will be deprotonation of the alcohol, which is faster than addition to the ketone carbonyl carbon. 90005 90002 90003 It’s only after addition of a second equivalent of Grignard that addition to the ketone will occur. 90004 90005 90002 90005 90002 So what ‘s going on? 90005 90045 4. Why Acid-Base Reactions Are Fast: The Principle of Least Motion 90050 90002 What’s going on here is an application of a handy principle in chemistry called the 90003 Principle of Least Motion.90004 90005 90002 Simply stated, it’s this. 90005 90002 Acid-base reactions on «heteroatoms» (that means atoms other than carbon, such as O, N, and S) generally require very little reorganization of the nuclei in the structure. 90003 Therefore these reactions are fast 90004, relative to reactions where the nuclei have to move or be reorganized. 90005 90002 Think about removing a proton from an O-H. 90005 90002 After loss of hydrogen, the oxygen gains a new lone pair. 90003 But its hybridization does not change 90004 — it started as sp 90108 3 90109, and it’s still sp 90108 3 90109.So the nuclei (other than the H, of course) do not significantly change positions in these reactions. 90003 No extra atomic motion 90004, in other words. 90005 90002 However when bonds are formed or broken at carbon — such as in the S 90030 N 90031 2 reaction or in additions to carbonyl carbons — a lot of atomic furniture has to get rearranged. 90005 90002 For instance, the 90003 S 90030 N 90031 2 proceeds through a backside attack, which means that the geometry of the molecule changes from tetrahedral to trigonal bipyramidal 90004 (that’s the 5-coordinate transition state) 90003 and then back to tetrahedral.90004 90005 90002 In 90003 addition reactions to carbonyl compounds, we’re changing the hybridization of carbon from sp 90108 2 90109 to sp 90108 3 90109. 90004 That requires a shift from trigonal planar to tetrahedral geometry. 90005 90002 Extra atomic motion means it will be a slower reaction, relative to an acid-base reaction. 90005 90002 90003 Bottom line: 90004 acid base reactions on oxygen, sulfur, or nitrogen are fast. So long as the acid base equilibrium is reasonable [How to use a pKa table, a handy rule of thumb for acid-base reactions] do them first.90005 90002 90003 Next Post: Acid-Base Reactions — What’s The Point? 90004 90005 90044 90045 Notes 90050 90002 P.S. It’s interesting that Grignard reagents (the conjugate bases of alkanes, pKa ~ 50) do not usually deprotonate the alpha-carbon of aldehydes (pKa ~ 18) or ketones (pKa ~ 20). 90005 90002 That’s another application of this principle. Removing a proton from an aldehyde or ketone requires breaking a C-H bond, and the resulting base (called an «enolate») will undergo a change in hybridization from sp 90108 3 90109 to sp 90108 2 90109.Therefore, it’s slow. 90005 90002 P.P.S. After the first acid-base reaction, the deprotonated alcohol can then do an S 90030 N 90031 2 reaction on the primary alkyl bromide. 90005 90002 90005 90044 90045 (Advanced) References And Further Reading 90050 90028 90029 Hine, J. The Principle of Least Nuclear Motion. Advances in Physical Organic Chemistry, Academic Press, Volume 15, 1977, Pages 1-61. ISSN 0065-3160. 90167 DOI: 10.1016 / S0065-3160 (08) 60117-3 90167 In this book chapter, Prof. Hine of The Ohio State University reviews the principle of least ncuelar motion.Particularly notable is the graph on page 40, which shows that HCN has the lowest barrier to deprotonation of any carbon-based acid, consistent with a small change in internal geometry. 90032 90043.
Leave A Comment