Ученые нашли новый способ повысить уровень оксида азота в организме
Ученые нашли новый способ повысить уровень оксида азота в организме с помощью арилазофуроксанов. Это химические соединения, которые на свету переходят в изомерную форму и начинают сильнее выделять оксид азота – важнейший регулятор во множестве процессов нервной, иммунной и сердечно-сосудистой системах. Исследования ученых из Института органической химии имени Зелинского РАН опубликованы в журнале ChemPhotoChem.
О важности оксида азота в организме ученые узнали относительно недавно – около 30 лет назад. Оксид азота (NO) – это природный газ, который способствует расширению сосудов, увеличению содержания кислорода в крови, препятствует образованию тромбов и снижает пагубное воздействие стрессовых гормонов. Оксид азота вырабатывается в организме под действием определенных ферментов – синтазов оксида азота. Однако зачастую внутренней выработки оксида азота недостаточно, поэтому требуется использовать вещества, обладающие NO-донорной способностью.
Ученые из Институт органической химии им. Н.Д. Зелинского РАН синтезировали серию фуроксанов, облучили их видимым светом (обычной настольной лампой) и увидели, что они переходят в изомерную форму, которая обладает гораздо более сильной способностью выделять оксид азота.
«Химией фуроксанов лично я занимаюсь уже на протяжении десяти лет, – рассказывает старший научный сотрудник, кандидат химических наук Леонид Ферштат. – История такова: на химические структуры всех фотопереключателей влияет энергия света. Она может обратимо изменить их структуру и свойства. Вслед за открытием фотопереключателей появилось целое направление – фотофармакология: молекула или вещество попадает в организм человека в неактивном состоянии, добирается до “плохих” клеток и дальше на свету переходит в активную форму, чтобы оказать нужный терапевтический эффект. Подробно этот вопрос мы изучили во время составления заявки на грант.
Полученные вещества можно облучать не ультрафиолетом, который оказывает вредное воздействие на организм человека, а обычным видимым светом. Дальше фуроксаны «пойдут» к биологам для исследований in vitro и in vivo. «Когда мы отдаем биологам наши вещества, мы сразу оговариваем, какой вид активности ожидаем получить. Они проводят комплексное изучение веществ, и по их результатам мы понимаем, куда дальше двигаться, какие вещества следует более углубленно изучать, а от каких придется отказаться, потому что они окажутся чуть хуже других
 Пока ученые могут с уверенностью сказать, что токсичности по отношению к здоровым клеткам у полученных фуроксанов нет.
Пока ученые могут с уверенностью сказать, что токсичности по отношению к здоровым клеткам у полученных фуроксанов нет.
Проект ученых ИОХ РАН выиграл грант Российского фонда фундаментальных исследований. Рентгеновские дифракционные эксперименты выполнены при финансовой поддержке Министерства науки и высшего образования Российской Федерации на оборудовании Центра исследования молекулярного состава ИНЭОС РАН.
Окись азота и судьба человека
Бесцветный газ — окись азота — всегда считался вредным для организма человека. Инженеры разрабатывают более совершенные двигатели внутреннего сгорания, в меньшей степени загрязняющие атмосферу окисью азота, конструируют системы регенерации окиси азота в другие вещества. Но в конце ушедшего века ученые неожиданно обнаружили, что окись азота присутствует в любом живом организме в довольно больших концентрациях. И не просто присутствует, а управляет важнейшими физиологическими процессами.
Профессор Анатолий Федорович Ванин, впервые обнаруживший радикалы окиси азота в живых клетках, беседует с нобелевским лауреатом Робертом Форшготтом, впервые описавшим явление, обусловленное действием окиси азота. Москва, 1989 год.
Электронная формула окиси азота (NO).
Наука и жизнь // Иллюстрации
Схема физиологических воздействий окиси азота на тонус сосудов.
‹
›
Открыть в полном размере
Окись азота (химическое название — оксид азота) — новая «путеводная звезда» в медицине, указывающая направление поиска лекарственных средств против множества болезней. Именно так считают сейчас большинство исследователей.
Лавинообразный рост числа публикаций по исследованию роли окиси азота в биологических объектах дал основание Американской ассоциации развития науки и авторитетному научному журналу «Science» («Наука») назвать в 1992 году окись азота молекулой года.
Чем же продиктован такой все возрастающий научный интерес к окиси азота?
Оказалось, что окись азота управляет как внутриклеточными, так и межклеточными процессами в живой клетке. Многие болезни — гипертония, ишемия миокарда, тромбозы, рак — вызваны нарушением физиологических процессов, которые регулирует окись азота. Именно по этой причине окись азота представляет огромный интерес для биологов и медиков самых разных специальностей.
Многие болезни — гипертония, ишемия миокарда, тромбозы, рак — вызваны нарушением физиологических процессов, которые регулирует окись азота. Именно по этой причине окись азота представляет огромный интерес для биологов и медиков самых разных специальностей.
Нейрофизиологи и нейрохимики интересуются окисью азота в связи с тем, что она управляет важнейшими процессами, происходящими в нервной системе. Высшая нервная деятельность человека во многом обусловлена прохождением импульса с одной нервной клетки (нейрона) на другую — так называемой синаптической передачей. Если попытаться описать этот процесс в двух словах, то можно сказать, что при прохождении нервного импульса из окончания одного нейрона «выбрасывается» молекула сигнального вещества — нейромедиатора (например, ацетилхолина, глутамата), которую «захватывает» специальный белок (рецептор) на мембране нервного окончания другого нейрона. Затем сложная цепь биохимических и электрохимических реакций обеспечивает прохождение нервного импульса по этому нейрону.
Таким образом, в мыслительной деятельности окись азота является и непосредственным участником, и косвенным регулятором. Что касается телесного существования, то и здесь ее роль не меньшая.
Кардиологи и специалисты, изучающие систему кровообращения, интересуются окисью азота, поскольку она регулирует расслабление гладких мышц сосудов и синтез так называемых «белков теплового шока», которые «защищают» сосуды при ишемической болезни сердца.
Гематологов окись азота интересует в связи с тем, что она тормозит агрегацию (слипание) тромбоцитов, влияет на перенос кислорода эритроцитами, а также на реакции с участием химически активных молекул (свободных радикалов) в крови.
Иммунологов окись азота интересует потому, что активация клеток, участвующих в иммунном ответе, — макрофагов и нейтрофилов — сопровождается высвобождением этими клетками окиси азота.
Онкологи проявляют повышенный интерес к окиси азота из-за ее предполагаемого участия в процессе развития злокачественных образований.
Физиологи, занимающиеся проблемами регуляции водно-солевого обмена в организме, и нефрологи интересуются окисью азота по той причине, что она регулирует почечный кровоток и солевой обмен в почечных канальцах.
Даже интимная жизнь без окиси азота невозможна — ее высвобождение способствует эрекции.
Но и это еще не все. В последние годы лавинообразно нарастает поток информации о влиянии окиси азота на функционирование генома.
Судьба человека определяется его поведением и характером, на которые, в свою очередь, влияет состояние его души и тела. Значит, судьба человека в некотором смысле связана с окисью азота.
Что же представляет собой молекула окиси азота?
Известно, что, когда в электронном семействе какой-либо молекулы имеется электрон без своей пары, то есть для него нет партнера, все семейство испытывает беспокойство и проявляет повышенную агрессивность по отношению к другим соединениям, стремясь найти и отобрать чужой недостающий электрон. Соединения, имеющие неспаренный электрон, называются радикалами. Радикалы обычно неустойчивы и появляются на промежуточных стадиях химических реакций.
Окись азота из-за наличия в ее электронной структуре неспаренного электрона относится к разряду радикалов и, следовательно, как и все радикалы, стремится «найти» недостающий электрон для создания новой электронной пары. Когда это удается сделать, образуется молекула NO_ — нитроксил-анион.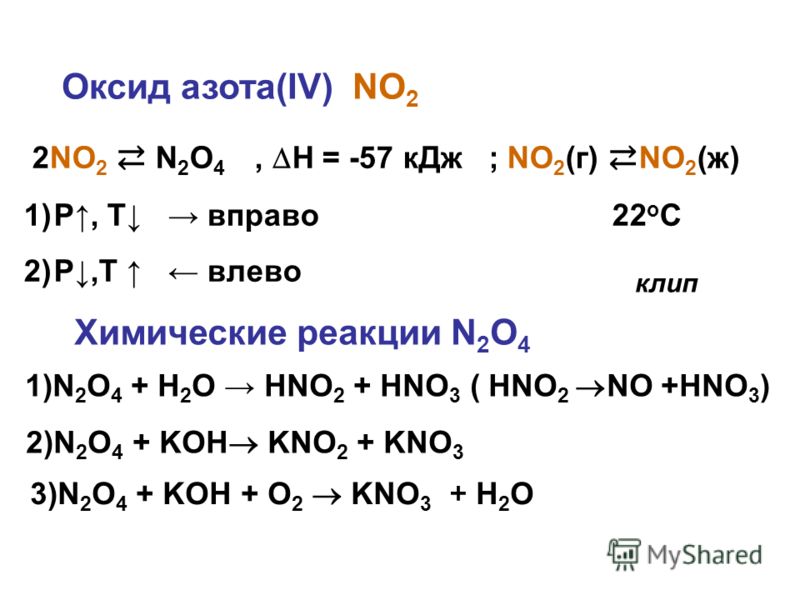 Чаще же приобрести недостающий электрон, отнимая его у другой молекулы, без «войны» не удается. В результате происходят самые разнообразные реакционные процессы, в ходе которых окись азота может претерпевать различные превращения.
Чаще же приобрести недостающий электрон, отнимая его у другой молекулы, без «войны» не удается. В результате происходят самые разнообразные реакционные процессы, в ходе которых окись азота может претерпевать различные превращения.
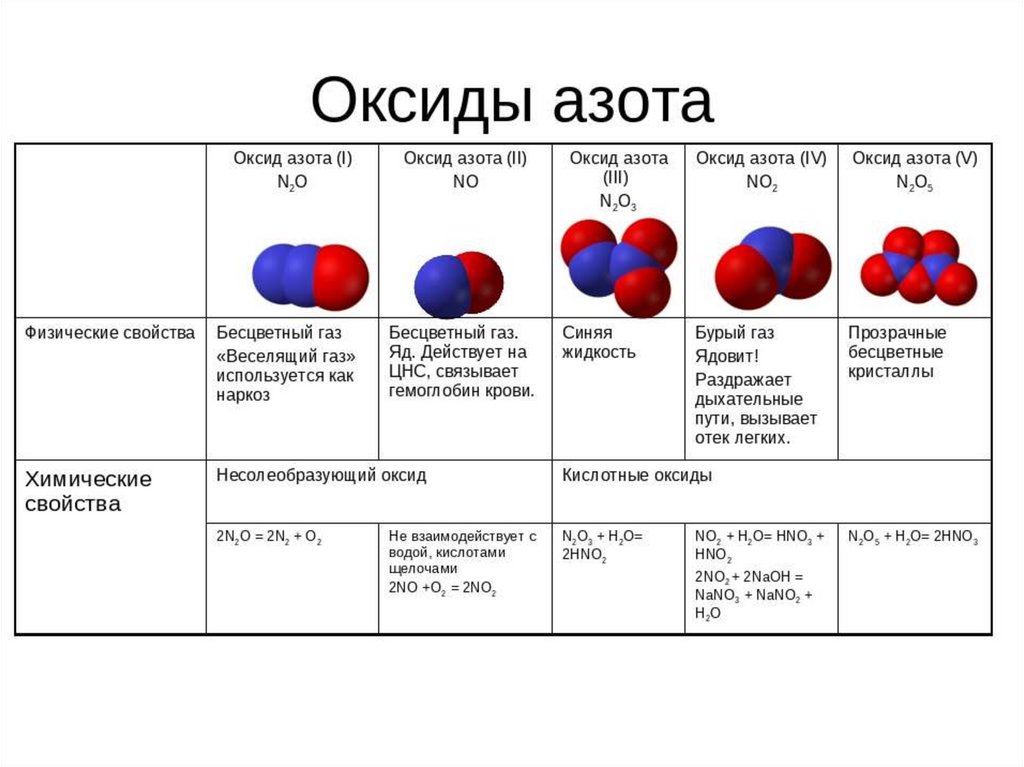
Не стоит путать окись азота с закисью азота (ее химическая формула — N2O), тоже бесцветным газом со сладковатым вкусом, кратковременное вдыхание которого вызывает признаки истерии, а большие количества действуют на нервную систему возбуждающе, вызывая состояние, сходное с опьянением. В связи с этим закись азота называют «веселящим газом». Длительное вдыхание «веселящего газа» приводит к притуплению болевой чувствительности и потере сознания, благодаря чему в смеси с кислородом (80% N2о+20% О2) он иногда применяется для наркоза.
Окись азота же сама по себе таких эффектов не вызывает. Но закись азота, поступающая в определенные отделы мозга, химически разрушается там с образованием окиси азота, действие которой на нервные клетки и определяет эффекты, вызываемые вдыханием закиси. Алкоголь действует на клетки головного мозга так же опосредованно и через окись азота.
Алкоголь действует на клетки головного мозга так же опосредованно и через окись азота.
За разработку проблемы окиси азота в биологии и медицине ряд ученых удостоен Нобелевской премии по физиологии и медицине 1998 года. Точная формулировка звучит так: «Нобелевская премия по физиологии и медицине присуждена за открытие роли оксида азота как сигнальной молекулы в сердечно-сосудистой системе». Нобелевскими лауреатами стали американские ученые Роберт Форшготт, Ферид Мьюрэд и Луис Игнарро.
А началось все с открытия, результаты которого были опубликованы Робертом Форшготтом в 1955 году. Ученый, проводя физиологические эксперименты с кровеносными сосудами, обнаружил расслабляющее действие света на аорту кролика. Это загадочное поведение аорты в ответ на действие света стало в дальнейшем для него и других исследователей объектом пристального внимания. Можно считать, что оно явилось своеобразной точкой отсчета нового раздела биологической науки.
Следующий шаг был сделан в нашей стране человеком, который совершил открытие, ставшее вехой в понимании роли окиси азота в биологии и медицине. Это — профессор, доктор биологических наук Анатолий Федорович Ванин, заведующий лабораторией Института химической физики Российской академии наук.
Это — профессор, доктор биологических наук Анатолий Федорович Ванин, заведующий лабораторией Института химической физики Российской академии наук.
В 1965 году журнал «Биофизика» опубликовал его небольшую, но, как позже оказалось, чрезвычайно важную статью под названием «Свободные радикалы нового типа в дрожжевых клетках». В ней говорилось, что в биологических объектах обнаружены радикалы неизвестной природы, которые никто в мире еще не наблюдал. Наша страна тогда была «впереди планеты всей» по части создания аппаратуры для обнаружения радикалов, основанной на явлении электронного парамагнитного резонанса (ЭПР). Приборы и средства обнаружения радикалов, работающие на его основе, называются радиоспектрометрами. Именно этими приборами и была оснащена лаборатория, где работал Анатолий Федорович, который сегодня считается одним из признанных авторитетов в области ЭПР-спектроскопии.
Явление ЭПР в 1944 году открыл профессор Казанского университета Е. К. Завойский. Суть этого явления связана со способностью радикалов, находящихся в магнитном поле, избирательно поглощать энергию радиоволн.
Завойский. Суть этого явления связана со способностью радикалов, находящихся в магнитном поле, избирательно поглощать энергию радиоволн.
Неизвестная радикальная субстанция сначала была обнаружена в культурах дрожжей, а затем и в клетках животного происхождения. Стало понятным, что открыто новое вещество, которое присутствует во всех живых клетках.
Работы Форшготта и Ванина застолбили новое научное направление. Сейчас ученым понятно, что открытые Анатолием Федоровичем неизвестные радикалы не что иное, как молекулы окиси азота. Но в то время предстояло еще выполнить немало сложнейших исследований, чтобы узнать, какие именно радикалы подают необычный ЭПР-сигнал. Одно было ясно уже тогда: науке эти радикалы неизвестны. Годы напряженного труда позволили Ванину сделать второе открытие. Он доказал, что сигналы подает окись азота, причем не одна, а в комплексе с ионами железа и белками, содержащими сульфгидрильные группы. Теперь их называют «динитрозильные комплексы».
Какова роль комплекса окиси азота и белка в живой клетке? На этом вопросе и сконцентрировалось внимание Ванина и других исследователей, подключившихся к изучению проблемы.
Между тем Р. Форшготт продолжал изучать природу открытого им явления. В 1961 году он опубликовал обзорную статью, в которой еще раз осветил вопрос о расслабляющем действии видимого света на кровеносные сосуды. Результатом исследований, продолжавшихся четверть века, явилось открытие Форшготтом в 1980 году неизвестного физиологически активного вещества — эндотелиального фактора расслабления сосудов (EDRF).
Форшготт обнаружил, что ацетилхолин, являющийся одним из медиаторов нервной системы, обычно вызывал сжатие кровеносных сосудов, но в некоторых опытах он их почему-то расслаблял. Анализируя эти эксперименты, Форшготт обратил внимание, что расслабляющее действие ацетилхолина на сосуды наблюдалось только в тех случаях, когда они были плохо очищены от эндотелиальных клеток, выстилающих внутреннюю поверхность сосудов.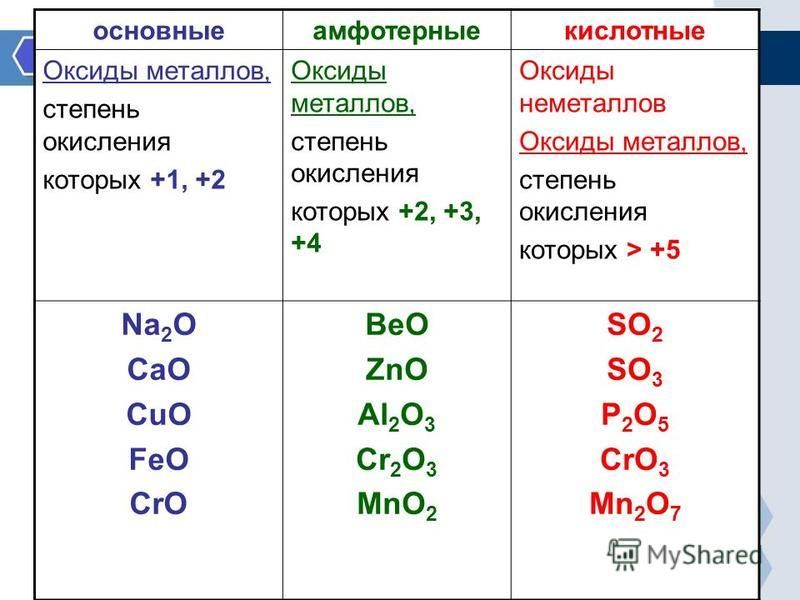 Форшготт догадался, что именно присутствие эндотелия меняло физиологический эффект ацетилхолина на противоположный. После проведения серии остроумных опытов сомнений не оставалось: сделано открытие. Так и был обнаружен эндотелиальный фактор расслабления сосудов (EDRF). Это научное достижение приобрело широкий общественный резонанс и взбудоражило весь ученый мир. Большинство ученых сразу поняли, насколько оно важно для физиологии, патофизиологии и практической медицины.
Форшготт догадался, что именно присутствие эндотелия меняло физиологический эффект ацетилхолина на противоположный. После проведения серии остроумных опытов сомнений не оставалось: сделано открытие. Так и был обнаружен эндотелиальный фактор расслабления сосудов (EDRF). Это научное достижение приобрело широкий общественный резонанс и взбудоражило весь ученый мир. Большинство ученых сразу поняли, насколько оно важно для физиологии, патофизиологии и практической медицины.
В 1991 году Форшготт публикует целую серию статей, в которых он обосновывает утверждение, что EDRF — это не что иное, как молекула окиси азота. То есть, под действием ацетилхолина происходит выброс окиси азота из эндотелия кровеносных сосудов, которая затем поступает в слой мышечных клеток. И именно молекула окиси азота оказывает расслабляющее действие на стенки сосудов. А что же происходит под действием света? Почему он тоже вызывает сосудистую релаксацию? Видимо, под действием светового излучения высвобождается та же самая окись азота, которая (как показал Ванин) существует в виде динитрозильного комплекса с белками.
Как ученый-физиолог, Форшготт в своих научных исследованиях шел от явлений (физиологии) к их механизмам. Это путь от сложного к простому. Для Ванина, как биофизика и биохимика, путь от простого к сложному, от факта к его роли и значению был более естественным. Ванин и начал с того, что открыл существование радикальной субстанции в живых объектах и стал изучать, что это за молекула и какие функции она выполняет.
Форшготт первым в мире описал явление, обусловленное действием окиси азота, — релаксацию кровеносных сосудов. Ванин открыл наличие неизвестной субстанции в живой материи. В своих дальнейших исследованиях они шли навстречу друг другу, быстро сближаясь. Ими как бы были поставлены две вехи, между которыми пролегла невидимая связующая нить.
Результаты исследований не заставили себя ждать. Уже вскоре обозначена еще одна важная веха. Ее поставил американский ученый Ферид Мьюрэд, после того как в середине 70-х годов он сделал важное открытие, касающееся гуанилатциклазы. Гуанилатциклаза — один из ключевых ферментов, управляющих жизнью клетки. Мьюрэд показал, что гуанилатциклаза активируется при действии нитро- и нитрозосоединений. Мьюрэд высказывает идею, что действующим активным началом этих соединений являются не они сами, а окись азота, выделяемая из них, и экспериментально ее подтверждает.
Гуанилатциклаза — один из ключевых ферментов, управляющих жизнью клетки. Мьюрэд показал, что гуанилатциклаза активируется при действии нитро- и нитрозосоединений. Мьюрэд высказывает идею, что действующим активным началом этих соединений являются не они сами, а окись азота, выделяемая из них, и экспериментально ее подтверждает.
В это же время Ванин изучает биологическое действие динитрозильных комплексов железа и показывает, что они обладают мощным гипотензивным действием — расслабляют кровеносные сосуды.
Ванин также предложил метод обнаружения окиси азота в органах и тканях, получивший широкое распространение. Следующий шаг его в научном поиске не менее важен. Он первым приходит к убеждению и обосновывает, что EDRF имеет прямое отношение к окиси азота. Когда авторы открытий буквально наступают друг другу на пятки, дышат в затылок в гонке за приоритетом, обычно учитывается, чьи результаты раньше увидели свет. Ванин, получив данные, что EDRF имеет отношение к окиси азота, в 1985 году решил их опубликовать в журнале «Бюллетень экспериментальной биологии и медицины», но напечатана статья была только через три года после подачи. Тут начал расти вал публикаций на эту тему в зарубежных изданиях. Такие же данные в 1986 году получили Форшготт и Игнарро, а в 1987 году — Сальвадор Монкада. Последний убедительно показал, что в состав EDRF входит окись азота, и немедленно опубликовал свои данные в международном научном журнале «Nature» («Природа») . Все эти публикации вышли в свет раньше, чем оригинальная статья Анатолия Федоровича.
Тут начал расти вал публикаций на эту тему в зарубежных изданиях. Такие же данные в 1986 году получили Форшготт и Игнарро, а в 1987 году — Сальвадор Монкада. Последний убедительно показал, что в состав EDRF входит окись азота, и немедленно опубликовал свои данные в международном научном журнале «Nature» («Природа») . Все эти публикации вышли в свет раньше, чем оригинальная статья Анатолия Федоровича.
Форшготт и Ванин, пройдя каждый свою половину пути, встретились в 1989 году во Всесоюзном кардиологическом научном центре в Москве. О чем они говорили тогда, понятно: конечно же, о научных планах, своих невероятных догадках и сомнениях. Их общение продолжилось в Лондоне на 1-й конференции по биологической роли оксида азота и в последующей переписке.
Авторитет Ванина как основоположника нового научного направления общепризнан. Но вот парадокс: главная научная награда — Нобелевская премия обошла его стороной. Незаслуженно — это не то слово. Видимо, выбор Нобелевского комитета не всегда основывается на научной значимости работ. Величие Анатолия Федоровича в том, что он не стал оспаривать решение комитета. А мы знаем, что такие гении, как Ньютон и Лейбниц, оспаривали друг у друга научные приоритеты. И это при том, что о Ньютоне говорили как о единственном смертном, вставшем вровень с богами. Да и Лейбниц за заслуги перед человечеством также вполне может быть приравнен к ним. Так что даже боги не всегда могут поделить между собой пальму первенства.
Величие Анатолия Федоровича в том, что он не стал оспаривать решение комитета. А мы знаем, что такие гении, как Ньютон и Лейбниц, оспаривали друг у друга научные приоритеты. И это при том, что о Ньютоне говорили как о единственном смертном, вставшем вровень с богами. Да и Лейбниц за заслуги перед человечеством также вполне может быть приравнен к ним. Так что даже боги не всегда могут поделить между собой пальму первенства.
Но и исследователи, которым присудили Нобелевскую премию (напомним, что это Форшготт, Мьюрэд и Игнарро), — воистину великие ученые и, вне всякого сомнения, заслужили столь высокое признание. Тем не менее можно констатировать, что одно из главных действующих лиц в истории про окись азота просто вычеркнули из списков.
Возможно, с историей открытия действия окиси азота кто-то будет и не во всем согласен — неудивительно: логика исследований и роль каждого из ведущих ученых, разрабатывавших эту тему, может видеться всем по-разному. Но вряд ли кто усомнится и будет оспаривать, что все началось с основополагающих открытий Форшготта и Ванина. Именно они были пионерами в установлении всеобъемлющей роли окиси азота в живой природе.
Именно они были пионерами в установлении всеобъемлющей роли окиси азота в живой природе.
Где же те весы, на которых можно было бы объективно взвесить признание заслуг ученого, чтобы справедливо воздать ему за них?
Руководство для начинающих по NOx, NO и NO2 как загрязнителям воздуха
Блог
Руководство для начинающих по NOx, NO и NO2 как загрязнителям воздуха
Подробности статьи
Последнее обновление
9000 2 09 декабря 2021 г.Опубликовано
13 декабря 2018 г.
Категория
На открытом воздухе
Знакомство с семейством оксидов азота: NOX, NO и NO2
Знакомство с азотом, обычно обозначаемым просто химическим символом N. Когда два атома азота соединяются вместе, они образуют газообразный азот ( N 2 ). Газообразный азот не имеет запаха, цвета и вкуса. Он негорюч и не поддерживает горение. Интересный факт: азот составляет 78% атмосферы Земли.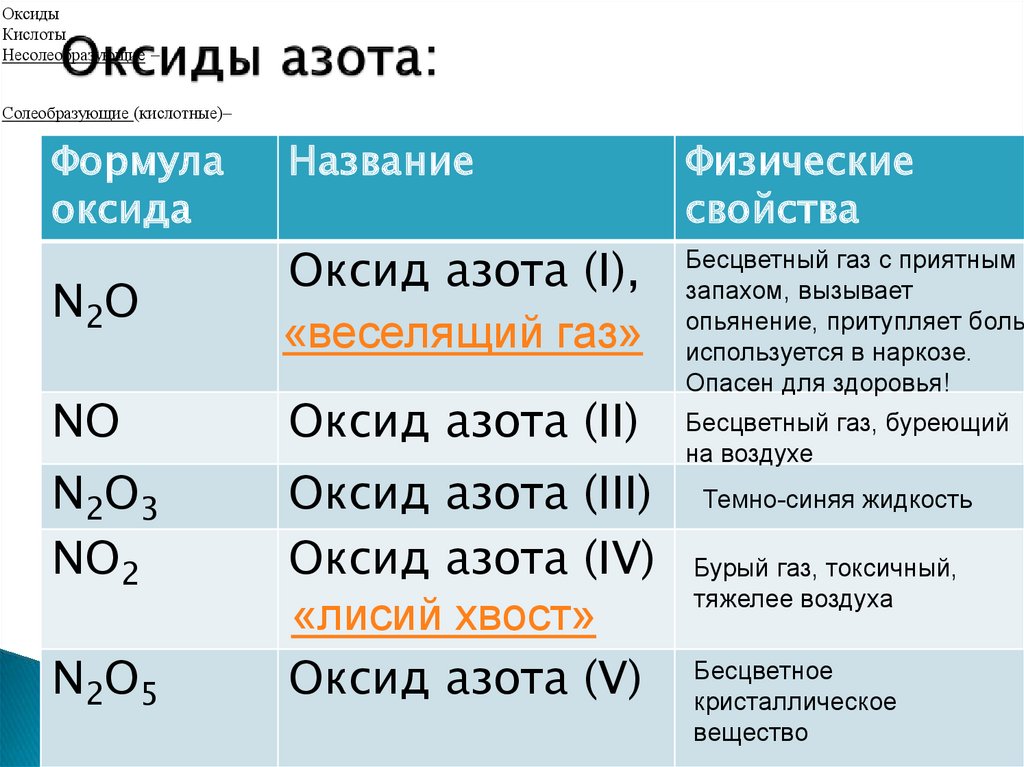 Вы, наверное, помните, как в школе узнавали о круговороте азота и о том, как он важен для всей жизни на Земле.
Вы, наверное, помните, как в школе узнавали о круговороте азота и о том, как он важен для всей жизни на Земле.
Познакомьтесь с кислородом, другом азота ( O ), высокореактивным неметаллом, окислителем, который легко образует оксиды с большинством элементов и других соединений. При нормальном давлении и температуре молекулы кислорода связываются с образованием дикислорода ( O 2 ), который присутствует в атмосфере.
Кислород является третьим по распространенности элементом во Вселенной и, конечно же, имеет решающее значение для нашего дальнейшего существования. Интересный факт: самый распространенный цвет полярного сияния (бледный желтовато-зеленый) в северном сиянии создается молекулами кислорода, находящимися примерно в 60 милях над землей. Как это круто!
Когда азот встречается с кислородом
При комнатной температуре азот является очень неактивным газом, можно сказать, домоседом. Но между этими двумя может пролететь искра. В присутствии молнии или искры азот соединяется с кислородом, образуя несколько различных оксидов.
В присутствии молнии или искры азот соединяется с кислородом, образуя несколько различных оксидов.
Оксид азота или оксид азота (NO) и диоксид азота (NO 2 ) являются наиболее распространенными. NO и NO 2 представляют собой два вида газов и называются оксидами азота (NO x ). Молекулы NO x содержат атомы азота и кислорода.
В чем разница между NOX, NO и NO2?
Оксиды азота (NO x ) — это собирательный термин, используемый для обозначения монооксида азота (оксид азота или NO) и диоксида азота (NO 2 )
Монооксид азота (NO) — бесцветный газ и один из основных оксидов азота мягкий, резкий запах и один из нескольких оксидов азота.
Источники NOX – NO и NO2
Теперь, когда вы официально ознакомились с NO x , NO и NO 2 – как образуются оксиды азота и откуда они берутся?
Оксиды азота образуются в результате реакции газов азота и кислорода в воздухе во время горения, особенно при высоких температурах. При нормальных температурах газообразные кислород и азот не реагируют вместе.
При нормальных температурах газообразные кислород и азот не реагируют вместе.
Оксиды азота естественным образом образуются при ударе молнии. Вспышка молнии может достигать температуры примерно 30 000 кельвинов (53 540 градусов по Фаренгейту). Вы спросите, сколько раз молния ударяет в землю? Каждую секунду на поверхность Земли ударяет около 100 молний. В сутках 86 400 секунд, а в году 365 дней — посчитайте сами… скажем так, это много.
В крупных городах оксиды азота образуются при сжигании топлива в мобильных и стационарных источниках. При сгорании бензина в автомобилях в атмосферу выбрасываются оксиды азота (мобильный источник). Стационарные выбросы происходят от угольных электростанций, котлов электростанций.
NOX может происходить из природных, биогенных и промышленных источников
Естественные источники: В основном грозы из-за сильного нагрева молнии. Лесной пожар является еще одним природным источником.
Биогенный: Сельскохозяйственное удобрение и использование азотфиксирующих растений (путем азотфиксации микроорганизмами).
Промышленные источники: Тепловой № x , топливный № x и подсказка № x .
Тепловой NO x – наиболее подходящий источник сжигания природного газа
Топливо NO x – транспортное топливо оценивается как 54% от NO x , вызванный человеком
Подсказка NO x – происходит на ранней стадии сгорания, образуя фиксированные формы азота (такие как NH…и т.д.), которые могут окисляться до NO
производимые выбросы, NOx из природных источников обычно находятся на высоте более 5 км. Искусственные выбросы в результате сжигания ископаемого топлива либо из стационарных источников (24%), либо из мобильных источников (49%), как правило, обнаруживаются рядом с источниками на приповерхностной высоте, где они могут оказывать значительное воздействие на здоровье.
Воздействие NOX на человека и окружающую среду
Как присутствие оксидов азота влияет на меня? Есть ли какие-либо неблагоприятные последствия для моего здоровья и стоит ли мне беспокоиться?
Оксиды азота (NO x ) реагируют с образованием смога и кислотных дождей. NO x реагирует с аммиаком, влагой и другими соединениями с образованием паров азотной кислоты и связанных с ними частиц. Воздействие NO x на здоровье человека включает повреждение легочной ткани, проблемы с дыханием и респираторными заболеваниями.
NO x реагирует с аммиаком, влагой и другими соединениями с образованием паров азотной кислоты и связанных с ними частиц. Воздействие NO x на здоровье человека включает повреждение легочной ткани, проблемы с дыханием и респираторными заболеваниями.
Оксид азота (NO) не считается опасным для здоровья при обычных условиях окружающей среды. Однако избыток оксида азота и его продуктов может вызывать респираторные заболевания, гематологические побочные эффекты, нарушения обмена веществ, низкое кровяное давление, тошноту, рвоту и диарею.
Двуокись азота (NO 2 ) в высоких концентрациях вызывает воспаление дыхательных путей. Вдыхание высоких концентраций NO 2 может повысить вероятность возникновения респираторных заболеваний: свистящее дыхание, кашель, простуда, грипп и бронхит. Люди с астмой склонны к более интенсивным приступам. Длительное воздействие высоких уровней NO 2 может вызвать необратимые повреждения дыхательной системы.
Влияет ли это на окружающую среду?
Высокие уровни NOx могут оказывать негативное воздействие на растительность, делая ее более восприимчивой к болезням и повреждениям от заморозков. Когда NOx вступает в реакцию с другими загрязняющими веществами в присутствии солнечного света, он образует озон. Озон в высоких концентрациях также повреждает растительность.
NO2 и загрязнение воздуха
Что такое загрязнение воздуха и является ли NO 2 загрязнителем воздуха?
Загрязнение воздуха происходит при попадании в атмосферу газов, частиц пыли, паров или запахов, которые оказывают вредное или ядовитое воздействие. Обычными загрязнителями воздуха являются (также известные как критериальные загрязнители):
Двуокись азота (NO 2 )
Твердые частицы (PM 10 и PM 2,5 9 0029 )
Озон (О 3 )
Окись углерода (СО)
Двуокись серы (SO 2 )
Что вызывает NO 2 загрязнение воздуха?
Количество оксидов азота, выбрасываемых в атмосферу в качестве загрязнения воздуха из обоих техногенных источников, может быть весьма значительным. В основном он производится дорожным движением и производством энергии.
В основном он производится дорожным движением и производством энергии.
В то время как NO 2 является первичным загрязнителем, он также является компонентом вторичных загрязнителей, образующихся в результате химической реакции. Наиболее распространенным является озон. Фотохимический смог, наиболее распространенный в солнечных и сухих местах, образуется, когда NO 2 при сгорании газа подвергается воздействию солнечного света, расщепляется и выделяет ион кислорода (O).
Высвобожденный O соединяется с молекулой кислорода (O 2 ), образуя озон (O 3 ). Озон является одним из основных вторичных загрязнителей. Вы можете прочитать больше об озоновом загрязнении в нашем блоге: Почему у меня проблема с озоновым загрязнением (и что я могу с этим поделать)?
Внутренний № 2 Уровни являются результатом как внутренних, так и наружных источников. В помещении NO 2 производится невентилируемыми обогревателями и газовыми плитами, высокие уровни наружного воздуха NO 2 , возникающие из-за местного движения и других источников возгорания, могут влиять на уровни внутри помещений.
Безопасен ли воздух, которым мы дышим? Должны ли мы быть обеспокоены?
Загрязнение воздуха является серьезной проблемой, и мы все должны быть обеспокоены. Всемирная организация здравоохранения (ВОЗ) оценивает 4,2 миллиона смертей ежегодно в результате воздействия загрязнения атмосферного (наружного) воздуха и 3,8 миллиона смертей ежегодно в результате воздействия дыма от грязных кухонных плит и топлива в домохозяйствах. Во всем мире больше смертей в год связано с загрязнением воздуха, чем с автомобильными авариями.
NO 2 является как первичным, так и вторичным загрязнителем. Загрязнение воздуха влияет на всех, но некоторые из нас более восприимчивы, чем другие: дети и пожилые люди, люди с заболеваниями легких и сердца, люди, работающие и занимающиеся спортом на открытом воздухе.
Как проверить чистоту воздуха на улице? Важно ли контролировать NO2 в окружающем воздухе?
Для борьбы с серьезными последствиями для здоровья важно больше узнать о загрязнении воздуха, например, о районах высокой концентрации, элементах состава и причинах. Чтобы получить эту информацию, необходимо провести всесторонний мониторинг качества воздуха с использованием устройств мониторинга воздуха, таких как показано ниже. Они могут быть портативными, идеальными для проверки очагов загрязнения или личного воздействия, или стационарными мониторами, которые непрерывно измеряют воздух, чтобы вы знали, когда NO 2 высокие уровни. Оба измеряют воздух в режиме реального времени, предоставляя вам точные показания для принятия обоснованных решений.
Чтобы получить эту информацию, необходимо провести всесторонний мониторинг качества воздуха с использованием устройств мониторинга воздуха, таких как показано ниже. Они могут быть портативными, идеальными для проверки очагов загрязнения или личного воздействия, или стационарными мониторами, которые непрерывно измеряют воздух, чтобы вы знали, когда NO 2 высокие уровни. Оба измеряют воздух в режиме реального времени, предоставляя вам точные показания для принятия обоснованных решений.
Портативные мониторы для измерения NO2
Портативные мониторы для измерения NO2
Кто такое Aeroqual?
Aeroqual производит датчики и оборудование для контроля качества воздуха. Наши портативные мониторы — это простые инструменты для компаний и сообществ, которые могут использовать даже обычные люди — измерение воздуха не обязательно должно быть сложной задачей. Мониторинг NO 2 и других загрязнителей прост как 1-2-3. Ознакомьтесь с нашими портативными мониторами качества наружного воздуха, чтобы узнать больше.
Если вы хотите узнать больше о мониторах качества наружного воздуха Aeroqual, свяжитесь с нами, чтобы рассказать нам больше о ваших требованиях к мониторингу воздуха.
Сопутствующие продукты
Серия 500 — портативный монитор качества воздуха
Набор для проверки качества наружного воздуха (Pro)
AQM 65 Станция мониторинга окружающего воздуха
Aeroqual Cloud — программное обеспечение для мониторинга качества воздуха
9000 4 Мониторинг воздуха стал прощеКлассификация оксидов — введение, классификация, примеры и реакции
Вы должны хорошо знать соединение, которым является углекислый газ. Как и в процессе дыхания, мы выдыхаем углекислый газ. Кроме того, он используется и в процессе фотосинтеза. Как следует из названия, углекислый газ является разновидностью оксида. Кислород может реагировать с металлами и неметаллами с образованием соединений, содержащих кислород и другой элемент металла или неметалла. Оксиды можно разделить на четыре типа.
Оксиды можно разделить на четыре типа.
Многие элементы естественным образом окисляются на воздухе или в воде. По этой причине многие оксиды встречаются в природе в виде минералов. Большая часть земной коры состоит из твердых оксидов. Как мы знаем, кислород является сильно электроотрицательным элементом, поэтому он образует связи почти со всеми элементами и, таким образом, образует устойчивые соответствующие оксиды. Хотя эта чрезмерная склонность кислорода к образованию оксидов иногда также вредна. Так как он разъедает металлы и делает изделия из металлов непрочными. В этой статье мы обсудим все четыре типа оксидов с примерами и примерами их использования, однако перед этим мы кратко объясним, что такое оксиды.
Что такое оксиды?
Оксид — это химическое соединение, содержащее по крайней мере один атом кислорода и еще один элемент. Дианион кислорода также называют оксидом, который представлен O-2. Все соединения оксидов содержат по крайней мере один дианион кислорода. Оксиды обычно представляют собой бинарные соединения, состоящие из кислорода и другого элемента.
Все соединения оксидов содержат по крайней мере один дианион кислорода. Оксиды обычно представляют собой бинарные соединения, состоящие из кислорода и другого элемента.
Примеры оксидов – Al2O3 – оксид алюминия, CO2 – диоксид углерода, SO2 – диоксид серы, CaO – оксид кальция, MgO – оксид магния, Na2O – оксид натрия и т. д.
Классификация оксидов
Оксиды можно разделить на следующие типы на основе валентности другого элемента в оксидах –
Простые оксиды
Смесь ed Оксиды
Простые оксиды – Простые оксиды производятся из одного металла или полуметалла и кислорода. Эти оксиды несут только то количество атомов кислорода, которое допускается нормальной валентностью элемента или металла.
Примеры простых оксидов – h3O, MgO, CaO, SiO2 и т. д.
д.
Смешанные оксиды – Смешанные оксиды образуются при соединении простых оксидов. Эти два простых оксида могут быть одного и того же металла (элемента) или разных.
Примеры смешанных оксидов – сурик (Pb3O) представляет собой смешанный оксид двуокиси свинца (PbO2) и монооксида свинца (PbO). Другим примером является оксид железа-железа (Fe3O4), который представляет собой смешанный оксид двух простых оксидов – оксида железа (Fe2O3) и оксида железа (FeO).
Оксиды можно разделить на следующие типы в зависимости от металлического характера другого элемента в оксидах –
Оксиды металлов
Основной оксид
Амфотерный оксид
- 903 02 Неметаллический оксид
Кислый оксид
Нейтральный оксид
Металлические оксиды. из металла и кислорода. Обычно они встречаются в природе в виде полезных ископаемых. Они образуются при окислении металлов.
из металла и кислорода. Обычно они встречаются в природе в виде полезных ископаемых. Они образуются при окислении металлов.
Примеры оксидов металлов – CaO, MgO, Fe3O4, BaO, ZnO и т. д.
Их можно разделить на следующие два типа:
Основной оксид
Амфотерный оксид
Основной оксид — Если оксид реагирует с водой и образует основание, его называют основным оксидом. Таким образом, основной оксид, реагируя с водой, дает основание. Это означает, что если мы приготовим раствор основного оксида и воды и окунем в него красную лакмусовую бумажку, то она станет синей.
Примеры основных оксидов – MgO, CaO, BaO и т. д.
Сжигание магниевой ленты. Когда мы сжигаем магниевую ленту, она вступает в реакцию с кислородом воздуха и образует соединение серого цвета, представляющее собой оксид магния. Теперь, когда мы растворяем это серое соединение в воде и опускаем в него красную лакмусовую бумажку, тогда она превращает красную лакмусовую бумагу в синюю, так как при реакции с водой образует гидроксид магния. Участвующие реакции приведены ниже:0003
Теперь, когда мы растворяем это серое соединение в воде и опускаем в него красную лакмусовую бумажку, тогда она превращает красную лакмусовую бумагу в синюю, так как при реакции с водой образует гидроксид магния. Участвующие реакции приведены ниже:0003
Амфотерный оксид. Амфотерный оксид представляет собой оксид металла, проявляющий двойное поведение. Он ведет себя как кислотный оксид и основной оксид. Он также реагирует как с основаниями, так и с кислотами.
Примеры амфотерных оксидов – оксид цинка (ZnO)
Когда оксид цинка реагирует с конц. Гидроксид натрия действует как кислотный оксид, а когда он реагирует с HCl, он действует как основной оксид. Реакции приведены ниже –
\[ZnO + 2H_{2}O + 2NaOH \rightarrow Na_{3}ZnOH_{4} + H_{2}\]
Кислый оксид цинка
\[ZnO + 2Hcl \rightarrow Zncl_{2} + H_{2}O\]
Основной оксид цинка
Другой пример амфотерного оксид Al2O3 – оксид алюминия. Когда он реагирует с серной кислотой, он действует как основание, а когда он реагирует с гидроксидом натрия, он действует как кислота. Реакции приведены ниже –
Когда он реагирует с серной кислотой, он действует как основание, а когда он реагирует с гидроксидом натрия, он действует как кислота. Реакции приведены ниже –
\[Al_{2} + 3H_{2}SO_{4} \rightarrow Al_{2}(SO_{4})_{3} + 3H_{2}O\]
Базовый
\[Al_{2} + 2NaOH \rightarrow 2NaAlO_{2} + H_{2}O\]
Кислый Алюминат натрия
Другими примерами амфотерных оксидов являются BeO, SnO и т. д.
Неметаллический Оксид – неметаллический Оксиды образуются из неметалла и кислорода. Обычно они встречаются в природе в виде газов, таких как углекислый газ. Они образуются при окислении неметаллов.
Примеры оксидов металлов – CO2, SO2, P2O5, CO и т. д.
Их можно разделить на следующие два типа:
Кислотные оксиды
Нейтральные оксиды с водой и образует кислоту, называемую кислотным оксидом.
 Таким образом, кислотный оксид, реагируя с водой, дает основание. Это означает, что если мы приготовим раствор кислого оксида и воды и окунем в него синюю лакмусовую бумажку, то она станет красной. В основном кислотные оксиды представляют собой оксиды неметаллов, но некоторые оксиды металлов с высокими степенями окисления также обладают кислотным характером. Таким образом, некоторые оксиды металлов, такие как CrO3, Mn2O7 и т. д., также являются кислотными.
Таким образом, кислотный оксид, реагируя с водой, дает основание. Это означает, что если мы приготовим раствор кислого оксида и воды и окунем в него синюю лакмусовую бумажку, то она станет красной. В основном кислотные оксиды представляют собой оксиды неметаллов, но некоторые оксиды металлов с высокими степенями окисления также обладают кислотным характером. Таким образом, некоторые оксиды металлов, такие как CrO3, Mn2O7 и т. д., также являются кислотными.Примеры кислых оксидов – SO2, CO2, SO3 и т. д.
Когда триоксид серы реагирует с водой, он образует серную кислоту. Реакция приведена ниже –
\[SO_{3} + H_{2}O \rightarrow H_{2}SO_{4}\]
Нейтральный оксид. основные свойства. Они не образуют соли при взаимодействии с кислотой или основанием.
Примеры нейтральных оксидов – N2O, NO, CO и т. д.
Это все о классификации оксидов, если вы ищете решения проблем NCERT на основе оксидов, войдите на веб-сайт Vedantu или загрузите приложение Vedantu Learning.


 Таким образом, кислотный оксид, реагируя с водой, дает основание. Это означает, что если мы приготовим раствор кислого оксида и воды и окунем в него синюю лакмусовую бумажку, то она станет красной. В основном кислотные оксиды представляют собой оксиды неметаллов, но некоторые оксиды металлов с высокими степенями окисления также обладают кислотным характером. Таким образом, некоторые оксиды металлов, такие как CrO3, Mn2O7 и т. д., также являются кислотными.
Таким образом, кислотный оксид, реагируя с водой, дает основание. Это означает, что если мы приготовим раствор кислого оксида и воды и окунем в него синюю лакмусовую бумажку, то она станет красной. В основном кислотные оксиды представляют собой оксиды неметаллов, но некоторые оксиды металлов с высокими степенями окисления также обладают кислотным характером. Таким образом, некоторые оксиды металлов, такие как CrO3, Mn2O7 и т. д., также являются кислотными.
Leave A Comment