Способы получения FeCl2
ок-е вос-е
вос-ль ок-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль
вос-е
ок-ль
ок-е
вос-ль
вос-е ок-е
ок-ль вос-ль
Номенклатура соединений железа
[Fe(CO)5] | пентакарбанилжелезо |
[Fe(NH3)4Cl2] | дихлоротетраамминжелезо |
[Fe(C5H5)2] | бис(циклопентадиенил)железо, ферроцен |
FeO | оксид железа (II) |
Fe(OH)2 | гидроксид железа (II) |
FeS | сульфид железа (II) |
FeS2 | дисульфид железа (II), пирит, серный колчедан, железный колчедан |
Fe(CN)2 | цианид железа (II) |
Fe(NCS)2 | тиоцианат железа (II) |
FeCl2 | хлорид железа (II) |
FeCl2. | тетрагидрат хлорида железа (II) |
FeI2 | йодид железа (II) |
FeSO4.7H2O | гептагидрат сульфата железа (II) |
FeSO3.3H2O | тригидрат сульфита железа (II) |
Fe(NO3)2.6H2O | гексагидрат нитрата железа (II) |
Fe3(PO4)2.8H2O | октагидрат ортофосфата железа (II) |
FeHPO4.2H2O | дигидрат гидроортофосфата железа (II) |
Fe(H2PO4)2. | дигидрат дигидроортофосфата железа (II) |
FeCO3 | карбонат железа (II), сидерит |
Fe(HCO3)2 | гидрокарбонат железа (II) |
(CH3 | тетрагидрат ацетата железа (II) |
(HCOO)2Fe.2H2O | дигидрат формиата железа (II) |
FeSiO3 | силикат железа (II) |
Fe2SiO4 | ортосиликат железа (II) |
FeC2O4. | пентагидрат оксалата железа (II) |
Fe(ClO4)2.6H2O | гексагидрат перхлората железа (II) |
FeSO4.(NH4)2SO4.6H2O | гексагидрат сульфата диаммония-железа (II), соль Мора |
K4[Fe(CN)6] | гексацианоферрат (II) калия, «желтая кровяная соль» |
[Fe(H2O)6]SO4 | сульфат гексаакважелеза (II) |
Na2[Fe(NO+)(CN)5] | пентацианонитрозилийферрат (II) натрия, нитропруссид натрия |
(FeFe2)O4 | оксид дижелеза (III) – железа (II), железная окалина, магнитный железняк, магнетит |
(FeFe2)I8 | йодид дижелеза (III) – железа (II) |
Fe2O3 | |
Fe(OH)3 | гидроксид железа (III) |
FeO(OH) | метагидроксид железа (III) |
FeBr3. | гексагидрат бромида железа (III) |
Fe2(SO4)3.9H2O | нонагидрат сульфата железа (III) |
Fe(OH)SO4 | сульфат гидроксожелеза (III) |
(Fe(OH)2)2SO4 | сульфат дигидроксожелеза (III) |
Fe2(SeO3)3.3H2O | тригидрат селенита железа (III) |
Fe(NO3)3.9H2O | нонагидрат нитрата железа (III) |
FePO4 | фосфат железа (III) |
Fe(H2PO4)3 | дигидроортофосфат железа (III) |
Fe2(C2O4)3 | оксалат железа (III) |
Fe(CN)3 | цианид железа (III) |
Fe(NCS)3 | тиоцианат железа (III) |
KFeO2 | феррат (III) калия |
NH4Fe(SO4  12H2O 12H2O | железоаммонийные квасцы |
Fe(ClO4)3.10H2O | декагидрат перхлората железа (III) |
K3[Fe(CN)6] | гексацианоферрат (III) калия, «красная кровяная соль» |
K3[Fe(NCS)6] | гексатиоцианатоферрат (III) калия |
K[Fe(OH)4] | тетрагидроксоферрат (III) калия |
K3[Fe(C2O4)3] | триаксалатоферрат (III) калия |
[Fe(C2H5)2]NO3 | нитрат бис(циклопентадиенил)железа (III) |
K2FeO4 | феррат (VI) калия |
BaFeO4 | феррат (VI) бария |
FeO4 | оксид железа феррат (VIII) калия |
Fe3C | карбид железа, цементит |
(Cr2Fe)O4 | оксид дихрома (II) – железа (III) |
Fe(CrO2) | хромистый железняк |
Fe2(CrO4)3 | хромат железа (III) |
Fe2(Cr2O7)3 | дихромат железа (III) |
KFe+3[Fe+2(CN)6] | гексацианоферрат (II) железа (III) – калия, берлинская лазурь, турнбулева синь |
KFe+2[Fe+3(CN)6] | гексацианоферрат (III) железа (II) – калия, берлинская лазурь, турнбулева синь |
Fe+34[Fe+2(CN)6]3 | гексацианоферрат (II) железа (III) |
Fe+23[Fe+3(CN)6]2 | гексацианоферрат (III) железа (II) |
Fe feso4 х feo fe fecl2 fes помогите пожалуйста сделать химическую цепочку? — в Пензе
Дарья МихайловнаОператор справочной
{«start»:»\u003cb\u003eПривет! 👋 Мы поможем найти товар, услугу, телефон, адрес, сайт. \u003c/b\u003e\r\n\r\nПодробнее \u003ca href=’/promo/#fh5co-features-2′ target=’_blank’\u003eна странице помощи\u003c/a\u003e. Задайте вопрос, если согласны с \u003ca href=’https://nashaspravka.ru/pages/politic_site’ target=’_blank’\u003eправилами\u003c/a\u003e.»,»hello»:»Чем помочь сегодня? Что найти?»,»zero»:»Сейчас отвечает ассистент. Напишите в чат, если предоставленный ответ требует уточнения. Оператор увидит сообщение и обязательно ответит позднее.»}
\u003c/b\u003e\r\n\r\nПодробнее \u003ca href=’/promo/#fh5co-features-2′ target=’_blank’\u003eна странице помощи\u003c/a\u003e. Задайте вопрос, если согласны с \u003ca href=’https://nashaspravka.ru/pages/politic_site’ target=’_blank’\u003eправилами\u003c/a\u003e.»,»hello»:»Чем помочь сегодня? Что найти?»,»zero»:»Сейчас отвечает ассистент. Напишите в чат, если предоставленный ответ требует уточнения. Оператор увидит сообщение и обязательно ответит позднее.»}
- Ответ справочной
- 1 организация
Ксения СергеевнаОператор справочной
Здравствуйте!
Вы обратились в НАШУ СПРАВКУ — федеральную информационную городскую интернет-справочную. Мы отвечаем на вопросы по городам России. Бесплатно и круглосуточно, в режиме online.
Обратитесь:
Студенческий квартал
Студенческий Квартал предоставляет услуги репетиторов по написанию научных работ по разной специальности, сложности и в короткие сроки. Дипломные,…
Дипломные,…
Пензенская область, город Пенза
Спасибо за обращение в нашу службу!
Пользователь
спасибо
АссистентОператор справочной
Пожалуйста! Рады были Вам помочь!
АссистентОператор справочной
⚠️ Обратите внимание! ⚠️
Все диалоги сохраняются. Ответ будет всегда доступен и его можно найти в поиске.
Если вас интересует статистика по любой организации из ответа, то напишите нам
Адреса и телефоны, участвующие в ответе, выбраны оператором из нашего справочника. В нем организации находятся в порядке актуальности телефонов, адресов и полноты информации об организации. Отзывы помогут сделать правильный выбор. Если вы заметили, что контакты изменились, сообщите и мы проверим и исправим.
Оцените ответ ниже👇, пользователи будут благодарны за ваш личный опыт, а мы за сотрудничество.
Вы можете помочь и дополнить ответ оператора
Ваша оценка:
Организации на карте
Вы нашли то, что искали?
АссистентОператор справочной
Посмотрите на похожие вопросы. Возможно в них есть уже готовый ответ.
Возможно в них есть уже готовый ответ.
Как найти хорошего репетитора, нужен репетитор ребёнку?
Подскажите пожалуйста можно ли спустя 10 -15 лет после окончания школы 9 классов доучиться или как там называется по другому короч получить аттестат об окончании 10 -11 классов и получить аттестат?
Где найти хорошего репетитора нужен репетитор ребёнку ?
Мы сохраняем «куки» по правилам, чтобы улучшить сайт для вас. Отменить можно в настройках браузера.
РЕДОКСB2
РЕДОКСB2Окислительно-восстановительные реакции
(продолжение)Задача B: Учитывая реакцию окисления, определить, что окисляется, а что восстанавливается.
Пример: CuCl2 + Fe = FeCl2 + Cu
- Для каждого атома запишите степень окисления до и после реакции:
Реагенты: номер окисления | Продукты: номер окисления |
В CuCl 2 , каждый Cl = -1 | В FeCl 2 , каждый Cl = -1 |
В CuCl 2 , Cu = +2, из x + 2(-1) = 0, | Cu = нейтральный = 0 |
Fe= нейтральный = 0 | В FeCl 2 , Fe = +2 от x + 2(-1) = 0, |
Cu снижается с 2 до 0. Таким образом, Cu восстанавливается до
Таким образом, Cu восстанавливается до
Число Fe увеличивается от 0 до 2, так что Fe считается
окисленным .Если степень окисления уменьшилась, говорят, что атом был восстановлен. Число уменьшается от прироста электронов, имеющих отрицательный заряд.
Если степень окисления увеличилась, говорят, что атом окислился. Число увеличивается из-за потери электронов. Убирая минусы, добавляешь плюсы.
Что происходит с атомами в окислительно-восстановительных реакциях?
БЮЛЛЕТЕНЬ ЗВЕЗДЫ ГОНОЛУЛУ
Лев ЛЕО сказал ГЕРрррр!
L = Потери
E= электронов=
О = Окисление
G= усиление
E= Электронов
R= Сокращение
Напишите полуреакции для Fe и Cu+2.
Помните, что Fe окисляется:
Fe —> Fe + 2e ( электроны являются продуктами, поэтому они теряются.
Cu +2 тем временем восстанавливается, поэтому получает электроны:
Cu +2 + 2e —> Cu
Чтобы атом восстановился, он должен получить электроны. Но эти электроны должны быть предварительно отданы другим атомом.
Итак, окисление и восстановление всегда происходят вместе.
Другие примеры:
В каждом из следующих случаев определите, что окисляется, а что восстанавливается.
1. С + О2 —> СО2
Ответ:
углерод окисляется от 0 до +4
каждый кислород уменьшен с 0 до -2
2. 2 Al + 3 Cu +2 —> 2 Al +3 + 3 Cu
Ответ:
Каждый Al окисляется от 0 до +3
каждый Cu +2 уменьшен с 2 до 0
3. 4 H +1
+ NO3 -1 + Fe +2 —> 2H 2 O + NO + Fe +3Ответ:
N снижается с +5 в группе
NO3 -1 до +2 в NO.
Fe +2 окисляется от 2 до 3
Упражнения для цели B
1. В каждом из следующих случаев определите, что окисляется и что восстанавливается .
а. Cu +2 + Fe —> Fe +2 + Cu
б. Co + Sn +2 —> Co +2 + Sn
в. 4H +1 + NO 3 -1
+ 3 Fe +2 —> 2 H 2 O + NO + 3 Fe +3д. 2 Cr + 3 Sn +2 —> 2 Cr +3 + 3 Sn
эл. S -2 + 2 NO 3 -1
+ 4H +1 —> SO2 + NO2 + 2h3Oф. CH
4 + 2 O2 —> CO2 + 2h3Oг. 2 NH
4 +1 + 2 NO3 -1 —> 2 N2 + 4 h3O + O2ч. Al + SO
4 -2 + H +1 —> SO2 + Al +3 + h3O(не сбалансировано, но не волнуйтесь)
я. Mg + CO
2 —> 2MgO + C Дж. Cr
Cr
(не сбалансировано, но не беспокойтесь)
9 фактов, которые вы должны знать —
В этой статье мы должны обсудить структуру Льюиса FeCl2. Давайте поговорим о структуре Льюиса FeCl2 и 9 различных характеристиках.
FeCl2 часто называют хлоридом железа. Железистый термин подходит для Fe в степени окисления +2. В FeCl2 Fe находится в степени окисления +2. Электронная конфигурация Fe(II) d 6 . Поскольку FeCl2 является координационным соединением, Cl является здесь не только противоионом, но и лигандом. Геометрия структуры Льюиса FeCl2 представляет собой изогнутую форму, хотя в кристаллической форме она принимает октаэдрическую форму.
Поскольку Cl является лигандом с мягким полем, электронная пара не образуется на d-орбитали. Итак, Fe(II) здесь представляет собой высокоспиновую систему d 6 . Только одно подмножество спарено из-за шести электронов, присутствующих в пяти подмножествах. Структура Льюиса FeCl2 может быть ионизирована до ионов двухвалентного железа и хлорида.
Структура Льюиса FeCl2 может быть ионизирована до ионов двухвалентного железа и хлорида.
FeCl2 представляет собой твердую кристаллическую молекулу белого цвета. Это парамагнитное твердое тело из-за наличия четырех неспаренных электронов на d-орбитали. Цвет его тетрагидратной формы зеленоватый из-за его октаэдрической формы и перехода Лапорта. Но в безводной форме имеет белый цвет.
Ангидратная форма может быть получена реакцией стальных отходов с соляной кислотой.
Fe + 2 HCl → FeCl 2 + H 2
Температура плавления и кипения FeCl2 составляют 950 К и 1296 К соответственно.
1. Как нарисовать структуру Льюиса FeCl2? Начертить структуру Льюиса FeCl2 — непростая задача. Поскольку FeCl2 является координационным соединением, а не ковалентной молекулой. Таким образом, здесь d-электроны будут участвовать в формировании связи, и управлять d-электронами для рисования структуры Льюиса непросто, потому что d-электроны следуют правилу 18 электронов, а не правилу октетов. Итак, мы попытаемся легко нарисовать структуру Льюиса FeCl2 следующими способами.
Итак, мы попытаемся легко нарисовать структуру Льюиса FeCl2 следующими способами.
Шаг 1 – Сначала мы должны подсчитать валентные электроны для Fe и Cl. Валентные электроны Fe представляют собой d-электроны и p-электроны для атомов Cl и суммируются. В структуре Льюиса FeCl32, 90 253, валентных электронов для Fe 6, так как оно находится в степени окисления +2, 90 256, и все электроны принадлежат только его d-орбитали, 90 253, для трех атомов Cl 7*2 = 14. Итак, общее количество валентных электронов равно 6 + 14 = 20.
Шаг 2 – Fecl2 будет следовать правилу 18 электронов, потому что это координационное соединение. Это похоже на правило октета координационной молекулы. Электронов, которые будут необходимы для структуры Льюиса FeCl2, будет 8 + (2*8) = 24, потому что правило октета требовало 8 электронов в валентной оболочке для каждого атома. Мы получаем, что доступные валентные электроны равны 20 из предыдущего расчета для FeCl2. Теперь необходимые электроны будут (24-20) = 4 90 256 электронов, а минимальное количество связей, необходимое для того, чтобы все три атома были соединены 90 253 в этой молекуле, составляет 4/2 = 2 связи 90 256 .
Теперь необходимые электроны будут (24-20) = 4 90 256 электронов, а минимальное количество связей, необходимое для того, чтобы все три атома были соединены 90 253 в этой молекуле, составляет 4/2 = 2 связи 90 256 .
Шаг 3. Пришло время определиться с центральным атомом в структуре Льюиса FeCl2. Fe здесь является центральным атомом, так как он является электроположительным, поскольку является переходным металлом , , тогда как Cl относится к семейству галогенов и является более электроотрицательным атомом.
Шаг 4 – Соедините два атома Cl с центральным Fe через минимальное количество необходимых одинарных связей, т.е. две. Так, Fe образует две одинарные связи с двумя атомами Cl от своих d-орбитальных электронов в структуре FeCl2 льюиса.
Шаг -5 После образования связи мы должны проверить количество неподеленных пар, доступных в молекуле. Итак, проверяем, какие атомы в структуре Льюиса FeCl2 содержат неподеленные пары. В структуре FeCl2 льюиса Fe имеет степень окисления +2, поэтому это система d 6 и у нее нет неподеленных пар на d-орбитали . Итак, мы проверяем неподеленные пары над атомами Cl. Cl относится к группе 17 й элемент и относится к семейству галогенов. Итак, после образования связи у него есть три пары неподеленных пар. Таким образом, неподеленные пары отнесены только к атомам Cl.
В структуре FeCl2 льюиса Fe имеет степень окисления +2, поэтому это система d 6 и у нее нет неподеленных пар на d-орбитали . Итак, мы проверяем неподеленные пары над атомами Cl. Cl относится к группе 17 й элемент и относится к семейству галогенов. Итак, после образования связи у него есть три пары неподеленных пар. Таким образом, неподеленные пары отнесены только к атомам Cl.
Весь октет завершен после образования связи и назначения неподеленных пар, поэтому нет необходимости добавлять какие-либо множественные связи в структуру Льюиса FeCl2.
2. Гибридизация FeCl2 Метод связывания координационного соединения или металлического соединения отличается. Они не следуют правилу теории валентных связей (VBT). Они будут следовать CFT, т.е. теории кристаллического поля. Гибридизация является следствием VBT. Таким образом, сложно определить гибридизацию структуры Льюиса FeCl2.
Итак, мы предсказываем гибридизацию структуры Льюиса FeCl2 по ее форме. Форма изогнута, присутствуют два окружающих атома и не участвуют неподеленные пары, поэтому в гибридизации будут участвовать две орбитали, и гибридизация будет сп .
В гибридизации FeCl2 не участвует его d-электроны, потому что они не являются его самой внешней орбиталью, и из-за присутствия лиганда слабого поля Cl вклад будет вносить только внешняя орбиталь, они являются 3s- и 4p-орбиталью. Итак, это еще один пример внешнего орбитального комплекса, такого как FeCl3.
Если использовать типовую формулу расчета гибридизации, H = 0,5(V+M-C+A),
H = ½(2+2+0+0) =2 (sp), Fe имеет два электрона, кроме шести электронов на его d-орбитали, и присутствуют два атома Cl. Из теории VSEPR, если количество орбиталей, смешанных при гибридизации, равно 2, то центральный атом имеет sp 2 гибридизированный.
Давайте нарисуем и поймем гибридизацию структуры Льюиса FeCl2.
Из диаграммы Fe(II) мы можем сказать, что только 4s- и 4p-орбитали участвуют в образовании связи для структуры Льюса FeCl2. Итак, гибридизация sp. 4s- и 4p-орбитали являются внешними орбиталями для Fe, поэтому это внешний орбитальный комплекс. Когда он образует тетрагидраты, четыре молекулы воды связываются с четырьмя неспаренными электронами на d-орбитали и образуют октаэдрический комплекс.
1. Является ли FeCl2 ионным или ковалентным?Координационное соединение является несколько ковалентным. Но в структуре Льюиса FeCl2 два иона Fe и Cl могут быть разделены из-за больших ионных различий и также проявляют ионный характер. В водном растворе он легко ионизируется, а Fe(II) легко поляризует хлорид-анионы. Таким образом, FeCl2 помимо ковалентного характера имеет ионный характер.
2. Растворяется ли FeCl2 в воде? Любая полярная молекула растворима в полярном растворителе (подобное растворяется подобно). Вода является полярным протонным растворителем и также может образовывать Н-связь. FeCl2 является полярной молекулой, потому что разница зарядов между Fe и Cl настолько велика, а из-за изогнутой формы молекула делает ее полярной. Так что, естественно, FeCl2 растворим в воде.
Вода является полярным протонным растворителем и также может образовывать Н-связь. FeCl2 является полярной молекулой, потому что разница зарядов между Fe и Cl настолько велика, а из-за изогнутой формы молекула делает ее полярной. Так что, естественно, FeCl2 растворим в воде.
После растворения в воде любой молекулы эта форма называется водной формой этой конкретной молекулы. Как обсуждалось ранее, структура Льюиса FeCl2 растворима в воде, поэтому после растворимости весь раствор называется водным раствором FeCl2. Таким образом, FeCl2 может легко превращаться в водный раствор после растворения в воде.
В водном растворе FeCl2 легко ионизируется для разделения двух ионных форм.
FeCl2(водн.) = Fe 2+ (водн.) + 2Cl – (водн.)
4. Является ли FeCl2 солью? Реакция между кислотой и основанием всегда дает нам соль и воду. Итак, если молекула образуется в результате реакции между кислотой и основной молекулой, она называется солью. Соль представляет собой комбинацию встречного катиона основной молекулы и встречного аниона кислых молекул.
Итак, если молекула образуется в результате реакции между кислотой и основной молекулой, она называется солью. Соль представляет собой комбинацию встречного катиона основной молекулы и встречного аниона кислых молекул.
Если мы прореагируем гидроксид железа с соляной кислотой, мы должны получить FeCl2 в виде соли вместе с водой в качестве побочного продукта.
Fe(OH) 2 + 2HCl = FeCl 2 + 2H 2 O
Таким образом, в основном, соль является частью нейтрализации кислоты и основания после реакции, и соль не имеет ни кислоты, ни щелочи. имущество в нем. Итак, FeCl2 — это соль.
5. Является ли FeCl2 сильным электролитом? Вещество, которое растворяется в воде или любом другом полярном растворителе с образованием ионов и раствора, проводящего электричество, называется электролитом. В водном растворе FeCl2 мы уже видим, что FeCl2 полностью ионизируется в этом растворе с образованием ионов двухвалентного железа и хлорида. Эти ионы являются очень хорошими проводниками электричества. Так вот, если мы пропускали ток в водном растворе FeCl2, то он может очень хорошо проводить ток. Таким образом, FeCl2 является сильным электролитом.
Эти ионы являются очень хорошими проводниками электричества. Так вот, если мы пропускали ток в водном растворе FeCl2, то он может очень хорошо проводить ток. Таким образом, FeCl2 является сильным электролитом.
Если соединение нерастворимо в воде, его можно осадить в реакционном сосуде. Но FeCl2 растворим в воде, поэтому FeCl2 не может существовать в виде осадка. Осадок также может образовываться за счет реакции двух соединений и в водном растворе продукт будет нерастворим в воде.
7. Реагирует ли FeCl2 с HCl?При взаимодействии Fe с HCl вместо FeCl3 образуется FeCl2. Потому что FeCl2 является термодинамически более стабильным продуктом. Это реакция замещения, и металл может легко вытеснить H 2 из HCl, поэтому вместо FeCl3 образуется FeCl2.
Заключение FeCl2 также является координационным соединением и может образовывать тетрагидраты с октаэдрической геометрией.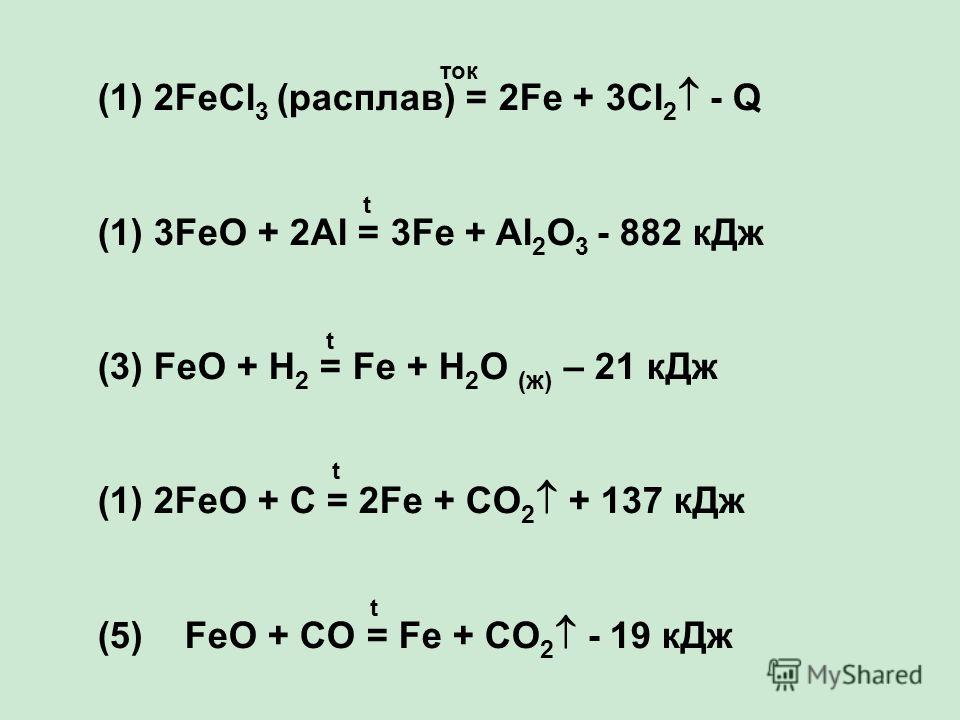

 H2O
H2O 2H2O
2H2O 5H2O
5H2O 6H2O
6H2O
Leave A Comment