Соединения кремния и их свойства 9 класс онлайн-подготовка на Ростелеком Лицей
Кремний как химический элемент
Кремний как химический элемент. На внешнем слое в атоме кремния 4 электрона (рис. 1).
Рис. 1. Электроны в атоме кремния
Кремний – элемент третьего периода, а значит, радиус его атома больше, чем углерода. Отсюда следует, что внешние электроны кремния слабее притягиваются к ядру, и его относительная электроотрицательность будет меньше, чем углерода.
Кремний может проявлять степень окисления -4 в соединениях с металлами. В большинстве остальных соединений кремний проявляет степень окисления +4 (рис. 2).
Рис. 2. Степени окисления кремния
Свойства простого вещества кремния
Для кремния известны две аллотропные модификации. Наиболее устойчивая аллотропная модификация кремния имеет строение, подобное алмазу, т. е. атомное строение. Это тугоплавкое, твердое, но хрупкое вещество, черно-серого цвета (рис. 3).
3).
Рис. 3. Кремний
Химические свойства кремния во многом подобны углероду. Для него характерны реакции с кислородом, галогенами и металлами. В отличие от углерода, кремний не взаимодействует с водородом. Его водородное соединение получают с помощью реакции между силицидом магния и соляной кислотой.
Si + O2 = SiO2
Si + 2Cl2 = SiCl4
2Mg + Si = Mg2Si
Mg2Si + 4HCl = 2MgCl2 + SiH4↑
Наиболее характерная степень окисления кремния +4. Рассмотрим свойства некоторых соединений кремния, в которых он проявляет степень окисления +4.
Оксид кремния (IV)
Оксид кремния (IV), или кремнезем – тугоплавкий, нелетучий, практически нерастворимый в воде. Специально приготовленный порошок оксида кремния (силикагель) используется в качестве адсорбента (рис. 4). Гранулированный силикагель используется для осушки воздуха.
Рис. 4. Силикагель
4. Силикагель
По своей структуре оксид кремния представляет собой неорганический полимер, в котором атомы кремния и кислорода, связанные между собой, образуют своеобразные цепочки, ленты и сетки. Этим и объясняется тугоплавкость и твердость оксида кремния.
В природе встречаются многие разновидности кремнезема. Главным образом, это кварц, который известен в виде обычного песка или крупных кристаллов. Некоторые разновидности кварца имеют особые названия: горный хрусталь, аметист, дымчатый топаз, агат и яшма и другие.
По химическим свойствам оксид кремния – кислотный оксид, а значит, он вступает в реакции со щелочами, при этом образуются силикаты. Например, при взаимодействии оксида кремния с избытком гидроксида калия образуются силикат калия и вода
SiO2 + 2KOH = K2SiO3 + H2O
При сплавлении он взаимодействует с основными оксидами, например с оксидом кальция:
CaO + SiO2 = CaSiO3
В ряду специфических свойств оксида кремния следует отметить его растворение в плавиковой кислоте (поскольку оксид кремния является одной из составных частей любого стекла, эта реакция называется реакцией «травления стекла»):
SiO2 + 4HF = SiF4 + 2H2O
Оксид кремния не взаимодействует с водой, но ему соответствует кремниевая кислота H2SiO3.
Кремниевая кислота
Правильнее формулу кремниевой кислоты следует записывать так: SiO2*nH2O, т. к. она не имеет постоянного состава. Кремниевая кислота нестойкая и со временем разлагается на оксид кремния и воду:
Н2SiO3 = SiO2 + H2O
Соли кремниевой кислоты – силикаты. Большинство силикатов не растворяется в воде. Их строение в основном сходно со строением оксида кремния. Поэтому силикаты тоже тугоплавкие вещества.
Так как кремниевая кислота – очень слабая, то из своих солей она вытесняется не только сильными кислотами, но и угольной кислотой, которая сильнее ее:
Na2SiO3 + H2O + CO2 = Na2CO3 + H2SiO3↓
Список литературы
- Микитюк А. Д. Сборник задач и упражнений по химии. 8–11 классы / А. Д. Микитюк. – М.: Изд. «Экзамен», 2009 (с.

- Оржековский П. А. Сборник задач и упражнений по химии: 9-й кл. / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2007 (с. 124–128).
- Оржековский П. А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. – М.: АСТ: Астрель, 2007 (§40).
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008 (с. 78–79).
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003 (с. 207–212).
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник)
- Электронная версия журнала «Химия и жизнь» (Источник)
Домашнее задание
- Оржековский П. А. Химия: 9-й класс: учеб.
 для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. – М.: АСТ: Астрель, 2007. – с. 191 №№ 1, 2.
для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. – М.: АСТ: Астрель, 2007. – с. 191 №№ 1, 2. - Сборник задач и упражнений по химии: 9-й кл. / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2007. –
Валентность кремния – возможности, число валентных электронов
4.2
Средняя оценка: 4.2
Всего получено оценок: 119.
4.2
Средняя оценка: 4.2
Всего получено оценок: 119.
В соединениях с другими химическими элементами проявляется II или IV валентность кремния. Проявление валентности зависит от состояния атома. Об образовании валентности в соединениях кремния читайте ниже.
Как определить
Высшая валентность кремния определяется по группе периодической таблицы Менделеева. Кремний находится в IV группе, значит, имеет четвёртую высшую валентность.
Разностью между числом восемь и номером группы определить низшую валентность кремния нельзя.
Элемент находится под 14 номером, в третьем периоде. Это значит, что вокруг ядра атома на трёх энергетических уровнях находится 14 электронов. Электронная конфигурация атома кремния – 1s22s22p63s23p2.
Число валентных электронов зависит от состояния атома. В обычном состоянии два спаренных электрона находится на s-подуровне и два неспаренных электрона – на p-подуровне. Эти два неспаренных электрона указывают на низшую валентность – II. В возбуждённом состоянии один электрон с s-подуровня распаривается и переходит на p-подуровень. В результате образуется четыре неспаренных электрона, определяющих высшую валентность IV.
Для определения валентности в соединениях необходимо ориентироваться на нижние индексы формул элемента.
Степень окисления
Кремний (Si) – хрупкий неметалл, не встречающийся в природе в чистом виде. Простое вещество можно получить промышленным или лабораторным путём. В этом случае степень окисления элемента будет равна нулю.
Кремний может образовывать бинарные соединения с простыми веществами. Степень окисления в соединениях, как и валентность, зависит от состояния атома кремния. Элемент быстро переходит в возбуждённое состояние, поэтому степень окисления чаще всего равно +4 или -4.
Соединения, образующиеся при окислении металлов атомами кремния, называются силицидами. В этом случае кремний является окислителем и имеет отрицательную степень окисления -4:
- 2Mg + Si → Mg2Si-4;
- 6MnO + 5Si → 2Mn3Si-4 + 3SiO2;
- 2Ca + Si → Ca2Si-4
В соединениях с галогенами и неметаллами (кислородом, серой, азотом, углеродом, водородом) кремний проявляет степень окисления +4:
- Si+4Cl4;
- Si+4Br4;
- Si+4O2;
- Si+4H4;
- Si+43N4;
- Si+4C;
- H2Si+4O3.

Степень окисления +2 кремний проявляет редко. Например, в монооксиде SiO, который не встречается в природе и получается только искусственным путём.
Что мы узнали?
Выяснили валентные возможности кремния. Элемент имеет две валентности – II и IV. Вторая валентность проявляется в обычном состоянии. Четвёртная валентность характерна для кремния в возбуждённом состоянии, когда один электрон переход с s- на p-подуровень. От состояния атома также зависит степень окисления. Кремний проявляет степени окисления +2, +4, -4. С галогенами и неметаллами кремний имеет +4 степень окисления. В реакциях с металлами элемент выступает в роли окислителя и имеет -4 степень окисления. В редких случаях кремний имеет степень окисления +2. Например, она проявляется в монооксиде кремния SiO.
Тест по теме
Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Будьте первым!
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 119.
А какая ваша оценка?
What, How to Balance & FAQs —
By Tomleshkumar Deshmukh
Соляная кислота является сильной кислотой, а силицид магния представляет собой бесцветное соединение. Сообщите нам о реакции HCl + Mg 2 Si.
Соляная кислота представляет собой водный раствор хлороводорода. Он также известен как соляная кислота, которая представляет собой бесцветный растворитель с резким запахом. Силицид магния представляет собой кристаллическое неорганическое соединение, которое используется в полупроводниках с проводимостью N-типа.
В этой статье мы обсудим реакцию между соляной кислотой и силицидом магния, уравновешивание реакции и окислительно-восстановительный механизм реакции и т. д.
Что является продуктом HCl и Mg и хлорид магния образуется, когда соляная кислота реагирует с силицидом магния.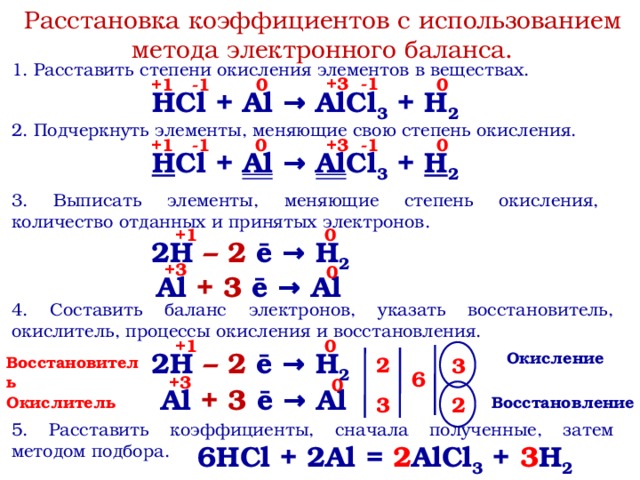
4HCl + Mg 2 Si = SiH 4 + 2MgCl 2
Какой тип реакции HCl+Mg 2 SiHCl + Mg 2 Si является окислительно-восстановительной реакцией. В которой реакции окисления и восстановления происходят одновременно, HCl действует как восстановитель, а Mg 2 Si действует как окислитель.
Как сбалансировать HCl+Mg 2 SiРеакцию уравновешивают, используя следующие шаги
HCl + Mg 2 Si = SiH0005 4 + MgCl 2
- Подсчитывается число атомов, присутствующих с обеих сторон, которое должно быть одинаковым.
| Сторона реагента | Сторона продукта |
| 1-атом водорода | |
| 1-атом хлора | 2-атом хлора |
| 2 -Атом магния | 1-Атом магния |
| 1-Атом кремния | 1-Атом кремния |
- Количество атомов водорода на обеих сторонах реакции уравновешивается добавлением коэффициента 4 к соляной кислоте на стороне реагента .

- 4HCl + Mg 2 Si = SiH 4 + MgCl 2
- 4HCl + Mg 2 Si = SiH 4 + 2MgCl 2
- 1 90 Таким образом, химическая реакция сбалансирована 90:
- 4HCl + Mg 2 Si = SiH 4 + 2MgCl 2
HCl нельзя титровать с помощью Sines 900 90 0 Mg2 силицид не является основанием.
HCl + Mg 2 Si результирующее ионное уравнениерезультирующее ионное уравнение реакции водный) + Mg 2 Si (т) = SiH 4 + 2Mg 2+ (водн.)
Итоговое ионное уравнение выводится с использованием следующих шагов.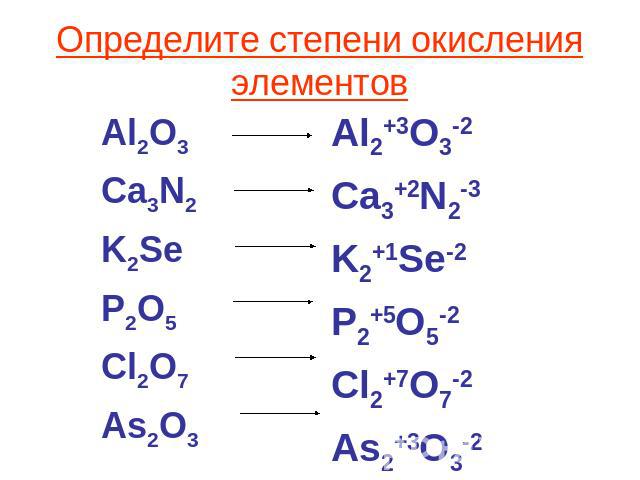
- Реакции, записанные в виде ионных соединений со своим зарядом, следующие:
- 4H + (водн.) + 4Cl – (водн.) + Mg 2 Si (тв.) = SiH 4 + 2Mg 2 + 0 –aкв. (водный )
- Итоговое ионное уравнение выглядит следующим образом, если исключить ионы-спектаторы (ионы, одинаковые со стороны реагента и продукта) с) = SiH 4 + 2Mg 2+ (водн.)
- Сопряженное основание HCl – Cl – .
- Сопряженное основание Mg 2 Si есть Si 4-
- 19 9 Соляная кислота имеет диполь-дипольных и лондонских дисперсионных сил притяжения и показывает ионные взаимодействия в водной среде.
- Силицид магния ковалентно связан друг с другом.

Энтальпия реакции HCl + Mg 2 Si 858,53 9090 10 Дж 0077 Соединение Моль Энтальпия образования, ΔH 0 f (кДж/моль) HCl 4 -92,3 Mg 2 Si 1 -21.20 SiH 4
9 1 2 MgCl 2 2 -641,62 Связь Значения энтальпии- Стандартная энтальпия реакции рассчитывается с использованием формулы:
- ΔH 0 F (реакция) = σδH 0 F (реакция) = σδH 0 F (реакция) = σΔH 0 F (реакция) = σΔH 0 .
 0005 f (продукт) – ΣΔH 0 f (реагенты)
0005 f (продукт) – ΣΔH 0 f (реагенты)
- Таким образом, изменение энтальпии = [4*(-92,3) + 1(-21,20)] – [1*(34)]. 2*(-641,62)] кДж/моль
- = 858,53 кДж/моль
Is HCl + Mg + Mg 90 Si 2 900 буферный раствор 9
HCl + Mg 2 Si не образует буферный раствор из-за присутствия сильной соляной кислоты.
Is HCl + Mg 2 Si полная реакцияHCl + Mg 2 Si является полной реакцией, поскольку она дает стабильные соединения силан и хлорид магния.
Is HCl + Mg 2 Si экзотермическая или эндотермическая реакция. Is HCl + Mg 2 Si окислительно-восстановительная реакция HCl + Mg 2 Si является окислительно-восстановительной реакцией из-за изменения степени окисления иона кремния в реагенте и продукте.
4H + + 4Cl – + Mg 2 2+ + Si 4- = Si 4+0 – 0 + H 0 4 + 2Mg 2+ + 2Cl – 2
Is HCl + Mg 2 Si реакция осажденияHCl + Mg 2 Si не является реакцией осаждения, поскольку во время реакции не образуется осадок.
Is HCl + Mg 2 Si обратимая или необратимая реакцияHCl + Mg 2 Si является необратимой реакцией, т.
Is HCl + Mg 2 Si реакция замещенияHCl + Mg 2 Si реакция двойного замещения. Потому что здесь ион хлорида вытесняется из молекулы HCl, а ионы кремния из Mg 2 Si Молекула для производства силана и хлорида магния.
4H + + 4Cl – + Mg 2 + Si = SiH 4 + 2Mg 2+ + 4Cl – 90 0547 Заключение
HCl + Mg 2 Si произвел силан и хлорид магния, который используется как в коммерческих, так и в лабораторных целях. Силан является предшественником элементарного кремния, а также эффективным водоотталкивающим средством для минеральных поверхностей. Хлорид магния является важным предшественником металлического магния.
Силан является предшественником элементарного кремния, а также эффективным водоотталкивающим средством для минеральных поверхностей. Хлорид магния является важным предшественником металлического магния.
6.5: Классификация химических реакций (окислительно-восстановительные) (проблемы)
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 111356
Некоторые из этих проблем представляют собой кульминацию всех типов реакций, которые мы рассмотрели в Блоке 6!
ЗАДАЧА \(\PageIndex{1}\)
Укажите, какой тип или типы реакции представляет каждый из следующих:
- \(\ce{Ca}(s)+\ce{Br2}(l) \rightarrow \ce{CaBr2}(s)\)
- \(\ce{Ca(OH)2}(водн.
 )+\ce{2HBr}(водн.)\rightarrow \ce{CaBr2}(водн.)+\ce{2h3O}(l)\)
)+\ce{2HBr}(водн.)\rightarrow \ce{CaBr2}(водн.)+\ce{2h3O}(l)\) - \(\ce{C6h22}(л)+\ce{9O2}(г)\rightarrow \ce{6CO2}(г)+\ce{6h3O}(г)\)
- Ответить на
окислительно-восстановительные (присоединение)
- Ответ b
кислотно-щелочной (нейтрализация)
- Ответ c
окисление-восстановление (сгорание)
ПРОБЛЕМА \(\PageIndex{2}\)
Укажите, какой тип или типы реакции представляет каждый из следующих:
- \(\ce{h3O}(g)+\ce{C}(s) \rightarrow \ce{CO}(g)+\ce{h3}(g)\)
- \(\ce{2KClO3}(s)\rightarrow \ce{2KCl}(s)+\ce{3O2}(g)\)
- \(\ce{Al(OH)3}(водн.)+\ce{3HCl}(водн.)\rightarrow \ce{AlBr3}(водн.)+\ce{3h3O}(l)\)
- \(\ce{Pb(NO3)2}(водн.)+\ce{h3SO4}(водн.)\rightarrow \ce{PbSO4}(s)+\ce{2HNO3}(водн.)\)
- Ответить на
окислительно-восстановительные (односкоростные)
- Ответ b
окисление-восстановление (диссоциация)
- Ответ c
кислотно-щелочной (нейтрализация)
- Ответ d
осадки (двойная замена)
ПРОБЛЕМА \(\PageIndex{3}\)
Серебро можно отделить от золота, поскольку серебро растворяется в азотной кислоте, а золото — нет.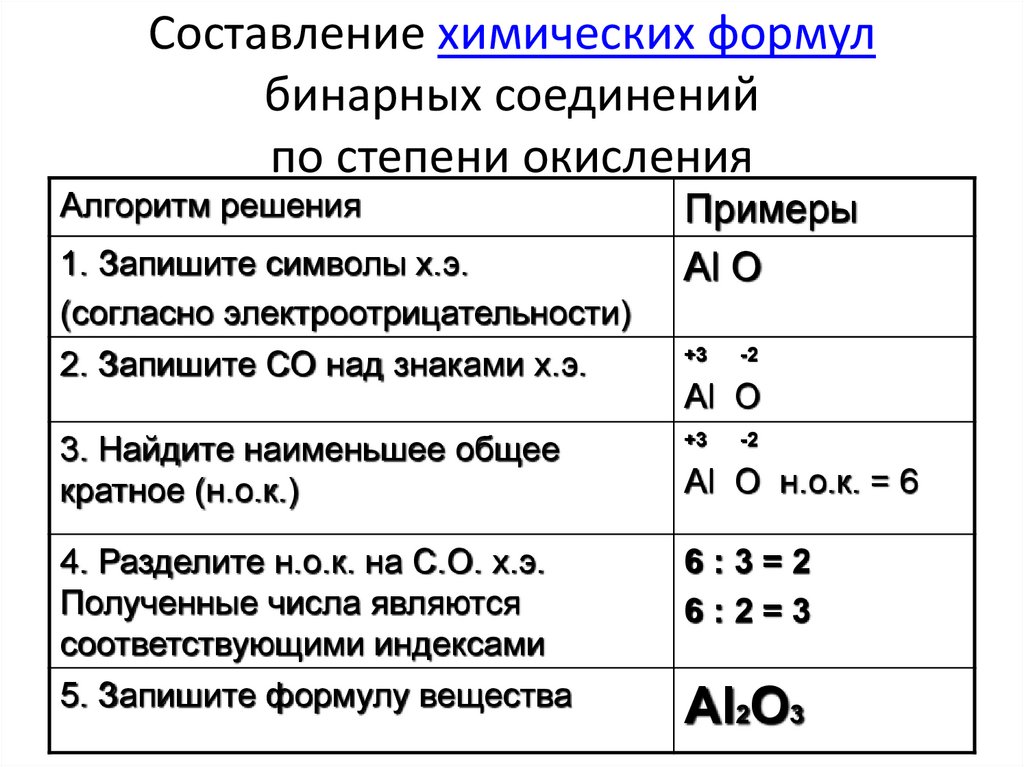
- Ответить
Это окислительно-восстановительная реакция, поскольку степень окисления серебра изменяется во время реакции.
ЗАДАЧА \(\PageIndex{4}\)
Определите степени окисления элементов в следующих соединениях:
- NaI
- GdCl 3
- LiNO 3
- Н 2 Se
- Мг 2 Si
- РбО 2 (супероксид рубидия)
- ВЧ
- Ответить на
На +1, И -1
- Ответ b
Gd +3, Cl-1
- Ответ c
Ли +1, Н +5, О -2
- Ответ d
Н+1, Се-2
- Ответ e
Mg+2, Si-4
- Ответить f
Руб +1, О -1/2
- Ответ г
Г+1, Ф-1
- Нажмите здесь, чтобы посмотреть видео о решении
ЗАДАЧА \(\PageIndex{5}\)
Определите степени окисления элементов в перечисленных соединениях. Ни одно из кислородсодержащих соединений не является пероксидом или супероксидом.
- H 3 Заказ на поставку 4
- Ал(ОН) 3
- СеО 2
- КНО 2
- В 2 С 3
- Р 4 О 6
- Ответить на
Н+1, Р+5, О-2
- Ответ b
Алюминий +3, Н +1, О-2
- Ответ c
Se +4, О-2
- Ответ d
К +1, Н +3, О -2
- Ответ e
В +3, С -2
- Ответить f
Р +3, О-2
ЗАДАЧА \(\PageIndex{6}\)
Определите степени окисления элементов в перечисленных соединениях. Ни одно из кислородсодержащих соединений не является пероксидом или супероксидом.
Ни одно из кислородсодержащих соединений не является пероксидом или супероксидом.
- H 2 SO 4
- Са(ОН) 2
- БроОН
- ClNO 2
- TiCl 4
- NaH
- Ответить на
Ч +1, О -2, С +6
- Ответ b
Н +1, О -2, Са +2
- Ответ c
Н+1, О-2, Вг+1,
- Ответ d
О-2, Кл-1, Н+5
- Ответ e
Кл-1, Ти +4
- Ответить f
Н +1, На -1
ЗАДАЧА \(\PageIndex{7}\)
Классифицируйте следующие реакции как кислотно-основные или окислительно-восстановительные:
- \(\ce{Na2S}(водн.
 )+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3S}(г)\)
)+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3S}(г)\) - \(\ce{2Na}(т)+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3}(г)\)
- \(\ce{Mg}(s)+\ce{Cl2}(g)\rightarrow \ce{MgCl2}(s)\)
- \(\ce{MgO}(s)+\ce{2HCl}(водн.)\rightarrow \ce{MgCl2}(водн.)+\ce{h3O}(l)\)
- \(\ce{K3P}(s)+\ce{2O2}(g)\rightarrow \ce{K3PO4}(s)\)
- \(\ce{3KOH}(водн.)+\ce{h4PO4}(водн.)\rightarrow \ce{K3PO4}(водн.)+\ce{3h3O}(l)\)
- Ответить на
кислотно-щелочной
- Ответ b
окисление-восстановление: Na окисляется, H + восстанавливается
- Ответ c
окисление-восстановление: Mg окисляется, Cl 2 восстанавливается
- Ответ d
кислотно-щелочной
- Ответ e
окислительно-восстановительный: P 3− окисляется, O 2 восстанавливается
- Ответить f
кислотно-щелочной
ЗАДАЧА \(\PageIndex{8}\)
Определите атомы, которые окисляются и восстанавливаются, изменение степени окисления для каждого из них, а также окислители и восстановители в каждом из следующих уравнений:
- \(\ce{Mg}(s)+\ce{NiCl2}(водн.
 )\rightarrow \ce{MgCl2}(водн.)+\ce{Ni}(s)\)
)\rightarrow \ce{MgCl2}(водн.)+\ce{Ni}(s)\) - \(\ce{PCl3}(l)+\ce{Cl2}(g)\rightarrow \ce{PCl5}(s)\)
- \(\ce{C2h5}(г)+\ce{3O2}(г)\rightarrow \ce{2CO2}(г)+\ce{2h3O}(г)\)
- \(\ce{Zn}(s)+\ce{h3SO4}(водный раствор)\rightarrow \ce{ZnSO4}(водный раствор)+\ce{h3}(g)\)
- \(\ce{2K2S2O3}(s)+\ce{I2}(s)\rightarrow \ce{K2S4O6}(s)+\ce{2KI}(s)\)
- \(\ce{3Cu}(т)+\ce{8HNO3}(водн.)\rightarrow \ce{3Cu(NO3)2}(водн.)+\ce{2NO}(г)+\ce{4h3O}( л)\)
- Ответить на
мг: 0 \(\стрелка вправо\) +2; теряет электроны; окисленный; восстановитель
Ni: +2 \(\стрелка вправо\) 0; получает электроны; уменьшенный; окислитель
- Ответ b
П: +3 \(\стрелка вправо\) +5; теряет электроны; окисленный; восстановитель
Кл: 0 \(\стрелка вправо\) -1; получает электроны; уменьшенный; окислитель
- Ответ c
К: -2 \(\стрелка вправо\) +4; теряет электроны; окисленный; восстановитель
О: 0 \(\стрелка вправо\) -2; получает электроны; уменьшенный; окислитель
- Ответ d
Zn: 0 \(\стрелка вправо\) +2; теряет электроны; окисленный; восстановитель
Ч: +1 \(\стрелка вправо\) 0; получает электроны; уменьшенный; окислитель
- Ответ e
С: +2 \(\стрелка вправо\) +5/2; теряет электроны; окисленный; восстановитель
I: 0 \(\стрелка вправо\) -1; получает электроны; уменьшенный; окислитель
- Ответить f
Cu: 0 \(\стрелка вправо\) +2; теряет электроны; окисленный; восстановитель
Н: +5 \(\стрелка вправо\) +2; получает электроны; уменьшенный; окислитель
- Нажмите здесь, чтобы посмотреть видео о решении
ЗАДАЧА \(\PageIndex{10}\)
При нагревании до 700–800 °C алмазы, представляющие собой чистый углерод, окисляются кислородом воздуха. (Они горят!) Напишите уравнение этой реакции.
- Ответить
\(\ce{C_{diamond}}(s)+\ce{O2}(g)\rightarrow \ce{CO2}(g)\)
ПРОБЛЕМА \(\PageIndex{11}\)
Военные экспериментировали с лазерами, излучающими очень интенсивный свет при взрывном соединении фтора с водородом. Каково сбалансированное уравнение этой реакции?
- Ответить
\(\ce{h3}(g)+\ce{F2}(g)\стрелка вправо \ce{2HF}(g)\)
ЗАДАЧА \(\PageIndex{12}\)
В обычном эксперименте в лаборатории общей химии (который вы проведете, если еще не сделали), металлический магний нагревают на воздухе для получения MgO. MgO представляет собой белое твердое вещество, но в этих экспериментах он часто выглядит серым из-за небольшого количества Mg9. 0005 3 N 2 , соединение, образующееся в результате реакции некоторого количества магния с азотом. Напишите сбалансированное уравнение для каждой реакции.
0005 3 N 2 , соединение, образующееся в результате реакции некоторого количества магния с азотом. Напишите сбалансированное уравнение для каждой реакции.
- Ответить
\(\ce{2Mg}(s)+\ce{O2}(g)\rightarrow \ce{2MgO}(s)\)
\(\ce{3Mg}(s)+\ce{N2}(g)\rightarrow \ce{Mg3N2}(s)\)
ЗАДАЧА \(\PageIndex{13}\)
Сульфид меди(II) окисляется молекулярным кислородом с образованием газообразного триоксида серы и твердого оксида меди(II). Затем газообразный продукт реагирует с жидкой водой с образованием жидкого гидросульфата в качестве единственного продукта. Напишите два сбалансированных уравнения, которые представляют эти реакции.
- Ответить
\(\ce{CuS}(s)+\ce{2O2}(g)\rightarrow \ce{SO3}(g)+\ce{CuO}(s)\)
\(\ce{SO3}(g)+\ce{h3O}(l)\rightarrow \ce{h3SO4}(l)\)
Авторы
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф.



 для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. – М.: АСТ: Астрель, 2007. – с. 191 №№ 1, 2.
для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. – М.: АСТ: Астрель, 2007. – с. 191 №№ 1, 2.

 0005 f (продукт) – ΣΔH 0 f (реагенты)
0005 f (продукт) – ΣΔH 0 f (реагенты)  )+\ce{2HBr}(водн.)\rightarrow \ce{CaBr2}(водн.)+\ce{2h3O}(l)\)
)+\ce{2HBr}(водн.)\rightarrow \ce{CaBr2}(водн.)+\ce{2h3O}(l)\)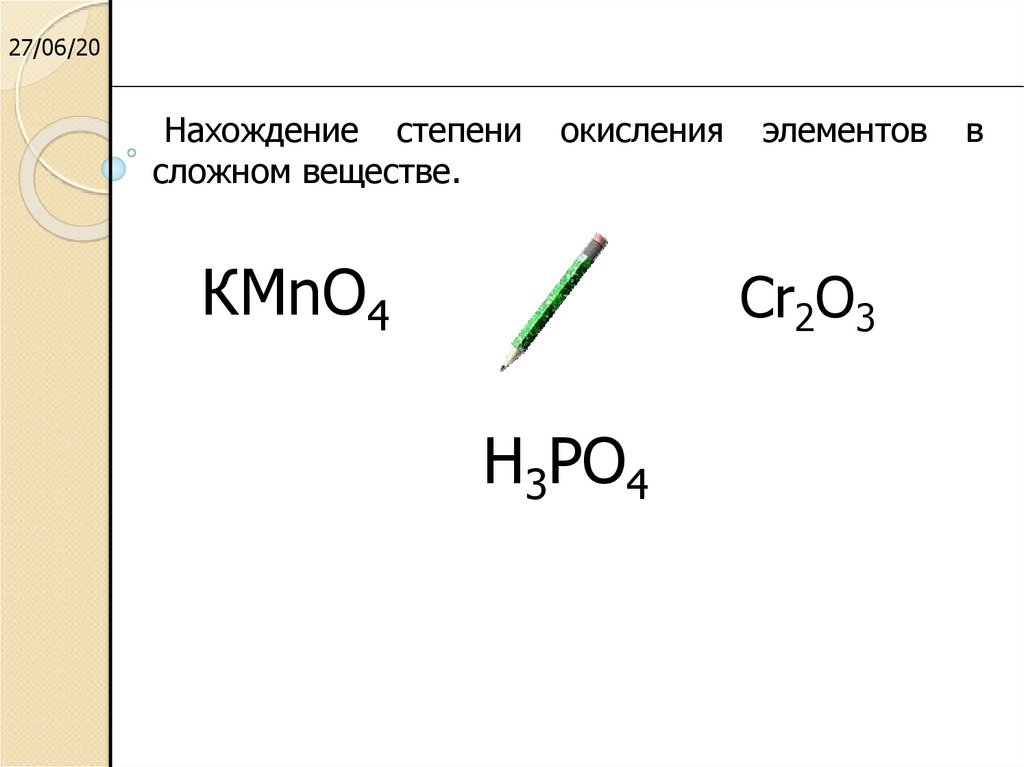 )+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3S}(г)\)
)+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3S}(г)\)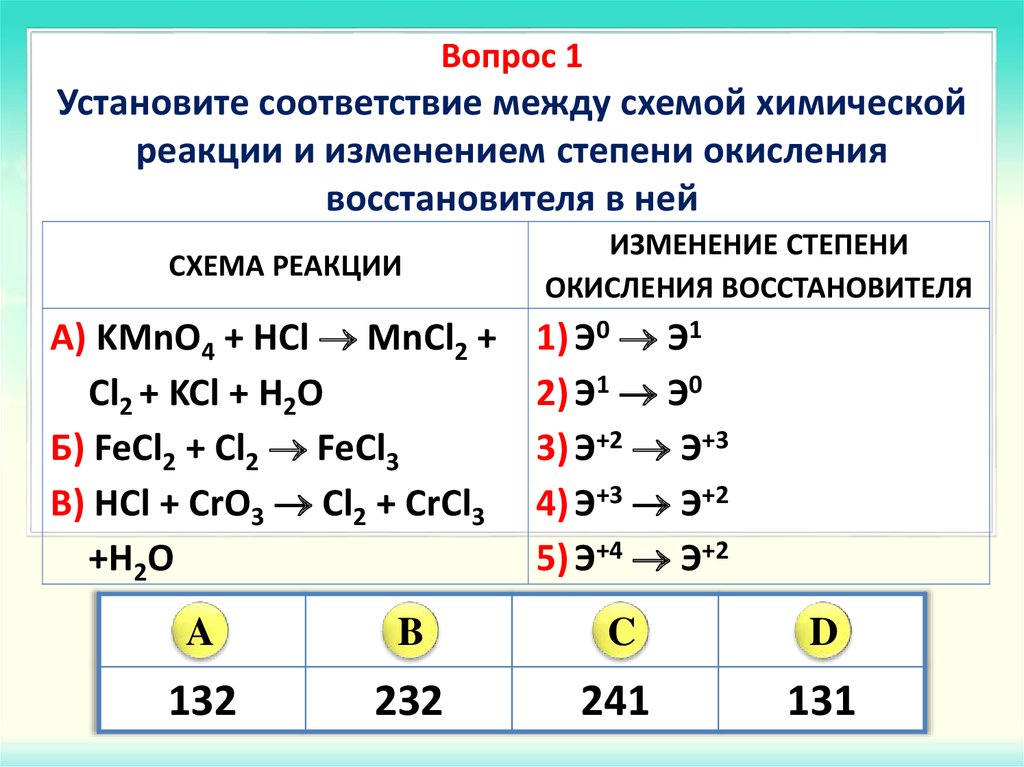 )\rightarrow \ce{MgCl2}(водн.)+\ce{Ni}(s)\)
)\rightarrow \ce{MgCl2}(водн.)+\ce{Ni}(s)\)
Leave A Comment