404 Cтраница не найдена
Мы используем файлы cookies для улучшения работы сайта МГТУ и большего удобства его использования. Более подробную информацию об использовании файлов cookies можно найти здесь. Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Тест.
 Химическая связь — презентация онлайн
Химическая связь — презентация онлайнПохожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Тест
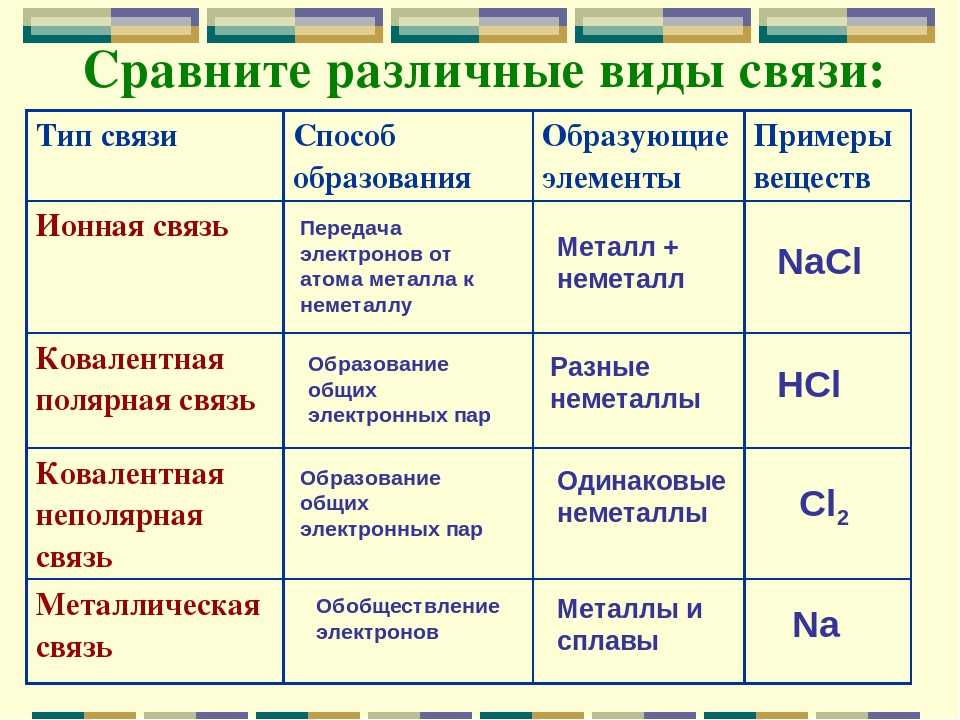
Химическая связь
1.В молекуле CO2 химическая связь
а)ионная
б)ковалентная полярная
в) ковалентная неполярная
г) водородная
2. Соединениями с ковалентной
полярной и ковалентной неполярной
связью являются соответственно
а) NaCl и Cl2
б) O3 и HF
в)HCl и O2
г) Nh4 и h3O
3. В хлориде натрия химическая связь
а) ионная
б) ковалентная полярная
в) ковалентная неполярная
г) водородная
4. В HCl химическая связь
а) ковалентная полярная
б) ковалентная неполярная
в) ионная
г) водородная
5. В молекулеNh4 химическая связь
В молекулеNh4 химическая связь
а) ковалентная полярная
б) ковалентная неполярная
в) ионная
г) водородная
6. Соединениями с ковалентной
полярной и ковалентной неполярной
связью являются соответственно
а)HI и h3
б)HCl и Ca
в)O3 и Ph4
г)P4 и h3Se
7. Соединениями с ковалентной
полярной и ковалентной неполярной
связью являются соответственно
а)I2 и h3Te
б)HBr и N2
в)Fe и HF
г)CO и SO2
8.В каком ряду записаны вещества только с
ионной связью
а) MgO, NaI, Cs2O
б) SiO2, CaO, Na2SO4,
в) HClO4, CO2, NaBr
Г)
h3O, AlCl3, Rb I
9. В каком ряду записаны вещества только с
ионной связью
а) CO, NaIO3, C2H5OH
б) TiO2, Ca3N2, Na2S
в) KClO3, C2h3, NaBr
г) h3S, AlCl3,
NaHCO3
10. В каком ряду записаны вещества только
с ионной связью
а) CaO, BaI2, Li2O
б) KClO3, C2h3, NaBr
в) h3S, AlCl3, NaI
г) SO2, CaO,K2SO4
11. В каком ряду записаны вещества
только с ионной связью
а)Ch4COONa, Al4C3, Na2SO4
б)CO, NaIO3, C2H5OH
в)KCl, Cah3, NaCl
г)S8, Al(NO3)3, O3
12. Прочность углерод- углеродной связи в
Прочность углерод- углеродной связи в
ряду: C3H8 или C3H6
а)увеличивается
б)уменьшается
в) сначала увеличивается, затем уменьшается
г) не изменяется
13. Прочность углерод- углеродной
связи в ряду:C2H6 C2h5
а) увеличивается
б)уменьшается
в) не изменяется
15.Схема связей в молекуле P2O5
16. Составьте схему связи в молекуле
этанола,укажите тип связи.
C2H5OH
18.Какая молекула прочнее CO2 или O3 ?
Почему?
19. Число общих связей в молекулах
N2
Cl2 ?
20. Схема в молекуле серной кислоты
21. Число ¶-связей в молекуле фосфорной
кислоты
а)8
б)1
в)6
г)2
22.В оксидах металлов связь
а)ионная
б)ковалентная полярная
в) ковалентная неполярная
г) ковалентная слабополярная
23.В гидроксосоединениях неметаллов связь
а) ионная
б) ковалентная полярная
в) ковалентная неполярная
г) ковалентная слабополярная
24.В оксидах неметаллов связь
а) ковалентная неполярная
б) ковалентная полярная
в) ионная
г) ковалентная слабополярная
25. По донорно-акцепторному механизму
По донорно-акцепторному механизму
образована одна из ковалентных связей в
соединении или ионе
а)Nh4
б) CCl4
в) (Nh5)2S
в) SiF4
26. По донорно-акцепторному механизму
образована одна из ковалентных связей в
соединении или ионе
а) ОНб) Н3O+
в) SО42г) CaОН+
28.Химическая связь в молекулах водорода
и этанола соответственно
а) ковалентная слабополярная и ионная
б) водородная и ковалентная полярная
в) ковалентная неполярная и ковалентная полярная
г) ионная и ковалентная неполярная
29.Химическая связь в молекулах хлористого
метила и азота соответственно
а) водородная и ковалентная полярная
б) ковалентная полярная и ковалентная неполярная
в) ионная и ковалентная неполярная
г) ковалентная слабополярная и ионная
30. Соединениями с ковалентной полярной и
ковалентной неполярной связью являются
соответственно
а) HF и Fe
б) I2 и S2O
в) HBr и O2
в) CO и CaO
Молодец!
English Русский Правила
Справочник покупателя по нитрату алюминия
Начинаете проект, требующий использования нитрата алюминия? Это простое руководство для покупателя поможет вам ознакомиться с компаундом, чтобы обеспечить успех вашего следующего проекта.
Знакомство с нитратом алюминия: основные сведения
Нитрат алюминия ( Al (NO 3 ) 3 ·9h3O) представляет собой водорастворимое твердое химическое соединение алюминия и азотной кислоты. Физически это белое кристаллическое твердое вещество без запаха. Оказывает окисляющее действие на другие вещества. Хотя нитрат алюминия является негорючим, его можно использовать для ускорения горения других горючих материалов.
Нитрат алюминия известен под несколькими другими названиями, включая:
- нитрат алюминия(III) (1:3)
- тринитрат алюминия
- азотная кислота, соль алюминия
- азотная кислота, соль алюминия (3+).
Ключевые свойства
- Молекулярная масса 213 г/моль
- Температура плавления 73,5 °С.
- Разлагается при 150 °C и в горячей воде. В процессе разложения он выделяет токсичные оксиды азота.

- Сложность 18.8
- Принимает 9 водородных связей
- Содержит 13 тяжелых атомов
Подготовка
Производство нитрата алюминия не является простым процессом. Алюминий нельзя просто смешивать с азотной кислотой, так как алюминий будет реагировать, образуя защитную пленку. Вместо этого необходимо следовать многоступенчатому процессу.
Сначала растворяют алюминий в растворе соляной кислоты. Получается трихлорид алюминия. Далее к раствору добавляют азотную кислоту. Раствор будет пузыриться по мере того, как азотная кислота окисляется, и раствор медленно выделяет токсичный газ нитрозилхлорида. Как только раствор осветляется, полученный нитрат алюминия кристаллизуют. Конечным продуктом является белое кристаллизованное твердое вещество.
Общее применение
Нитрат алюминия используется во многих областях в различных отраслях промышленности. Главным образом, это помогает индустриальному миру работать бесперебойно. Одним из наиболее распространенных применений является использование в качестве ингибитора коррозии машин и другого промышленного оборудования.
Одним из наиболее распространенных применений является использование в качестве ингибитора коррозии машин и другого промышленного оборудования.
Производители кожи используют нитрат алюминия в процессе дубления. Но нитрат алюминия используется для производства ряда продуктов, включая лампы накаливания, изоляционную бумагу и текстиль, где он используется в качестве протравы. Нефтеперерабатывающие заводы используют его в качестве катализатора, и он даже используется для создания ядерной энергетики.
Доступные степени чистоты и сорта
Уровень химической чистоты, который вы должны приобрести, будет сильно зависеть от того, как вы будете его использовать. Нитрат алюминия можно приобрести с различной степенью чистоты, от низкой технической чистоты до высшей степени чистоты ACS Regent.
Класс реагента ACS означает, что он соответствует спецификациям реагента ACS Американского химического общества. Спецификации изложены в их публикации Reagent Chemicals. Чтобы соответствовать требованиям, химикат должен соответствовать спецификациям, изложенным в последнем издании Reagent Chemicals. Этот сорт стал отраслевым эталоном для химических веществ высокой чистоты, используемых в химическом анализе и физических испытаниях.
Чтобы соответствовать требованиям, химикат должен соответствовать спецификациям, изложенным в последнем издании Reagent Chemicals. Этот сорт стал отраслевым эталоном для химических веществ высокой чистоты, используемых в химическом анализе и физических испытаниях.
Noah Chemicals специализируется на химических веществах высокой чистоты и предлагает два типа нитрата алюминия высокой чистоты:
АЛЮМИНИЙ НИТРАТ, НОНАГИДРАТ, чистота 99,999%, кристаллический, Al(NO3)3.9h3O
3
2 ALUMIN
ТРАТ, НОНАГИДРАТ , Реагент ACS, кристалл, Al(NO3)3.9h3O
Откройте для себя эти и другие соединения алюминия в обширном онлайн-каталоге Noah Chemicals. Или свяжитесь с нами, чтобы поговорить с одним из наших знающих штатных химиков о нестандартных химикатах или оптовом заказе.
Нитрат алюминия | Сульфат алюминия
Нитрат алюминия представляет собой соединение, представляющее собой соль азотной кислоты и алюминия. В нормальных условиях нитрат алюминия существует в виде кристаллогидрата. Что касается визуальной формы нитрата алюминия, то она обычно представляет собой кристаллическое твердое вещество или порошок и имеет желтую окраску. Нитрат алюминия является твердым соединением в соответствии со Стандартной температурой и давлением. Формула соединения – Al(NO3)3.
Что касается визуальной формы нитрата алюминия, то она обычно представляет собой кристаллическое твердое вещество или порошок и имеет желтую окраску. Нитрат алюминия является твердым соединением в соответствии со Стандартной температурой и давлением. Формула соединения – Al(NO3)3.
Физические свойства нитрата алюминия
У этого соединения много различных физических свойств. Например, нитрат алюминия имеет молярную массу, равную 212,996 г/моль. Что касается плотности соединения, то она составляет 1,401 г/см3. Кроме того, как и любое другое соединение, нитрат алюминия имеет температуры плавления и кипения, которые составляют 72,8°С и 135°С соответственно. Растворимость нитрата алюминия известна в различных жидкостях. Нитрат алюминия не имеет запаха, а его молекулярная масса составляет 375,13. Химическая формула нитрата алюминия – Al(NO₃)₃.
Получение нитрата алюминия
Вы не сможете легко получить нитрат алюминия, просто объединив азотную кислоту и алюминий.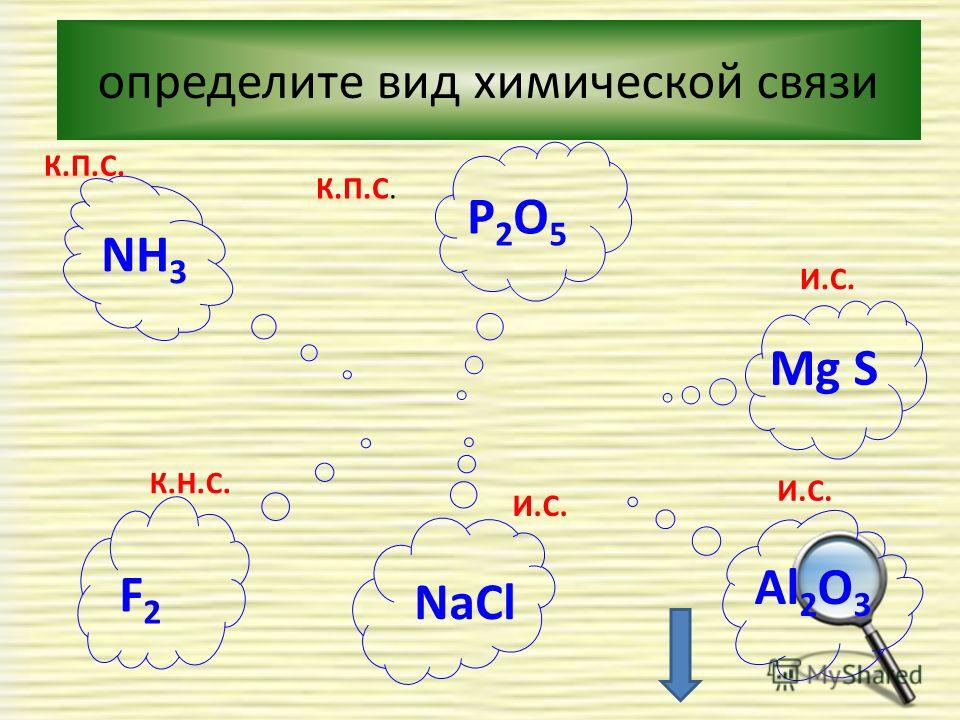 В этом случае алюминий образует пассивирующий слой. Но нитрат алюминия можно получить, если соединить трихлорид алюминия и азотную кислоту. Поступая таким образом, вы также создадите побочный продукт, нитрозилхлорид, который выделяется из раствора в виде газа. Нитрат алюминия можно также получить, если смешать сульфат алюминия и нитрат свинца. Из раствора выпадет сульфат свинца, а в растворе останется только нитрат алюминия.
В этом случае алюминий образует пассивирующий слой. Но нитрат алюминия можно получить, если соединить трихлорид алюминия и азотную кислоту. Поступая таким образом, вы также создадите побочный продукт, нитрозилхлорид, который выделяется из раствора в виде газа. Нитрат алюминия можно также получить, если смешать сульфат алюминия и нитрат свинца. Из раствора выпадет сульфат свинца, а в растворе останется только нитрат алюминия.
Растворимость нитрата алюминия в различных веществах
Нитрат алюминия пытались растворить в таких веществах, как вода, метанол, этанол и этиленгликоль. Нитрат алюминия растворим во всех этих веществах. Что касается воды, он растворяется в количестве 160 г/100 мл при 100 °C. В случае метанола растворимый показатель составляет 14,45 г/100 мл. Нитрат алюминия растворяется в этаноле при концентрации 8,63 г/100 мл. А когда дело доходит до этиленгликоля, существует коэффициент растворимости 18,32 г/100 мл.
Применение нитрата алюминия
Это соединение представляется весьма ценным и имеет множество важных применений. Во-первых, нитрат алюминия оказался очень сильным окислителем. По этой причине он абсолютно бесценен в процессе окисления. Хотя это основное применение нитрата алюминия, существуют и другие применения, и их тоже следует учитывать.
Во-первых, нитрат алюминия оказался очень сильным окислителем. По этой причине он абсолютно бесценен в процессе окисления. Хотя это основное применение нитрата алюминия, существуют и другие применения, и их тоже следует учитывать.
Нитрат алюминия используется для извлечения урана. Процесс добычи урана заключается в извлечении урана из земли. Учитывая, насколько важен уран, без него очень сложно представить современный мир. Нитрат алюминия используется для этого процесса извлечения урана. Поэтому проведение экстракции было бы намного сложнее без нитрата алюминия.
Наверное, каждый человек нашего века знает об антиперспирантах и области их применения. Антиперспиранты относятся к группе дезодорантов и препятствуют потоотделению, а также влияют на запах тела человека. Обычно антиперспиранты наносят под руки. Нитрат алюминия является незаменимым компонентом антиперспирантов, производство которых невозможно без нитрата алюминия.
Соединение нитрата алюминия также широко используется в качестве компонента ингибиторов коррозии.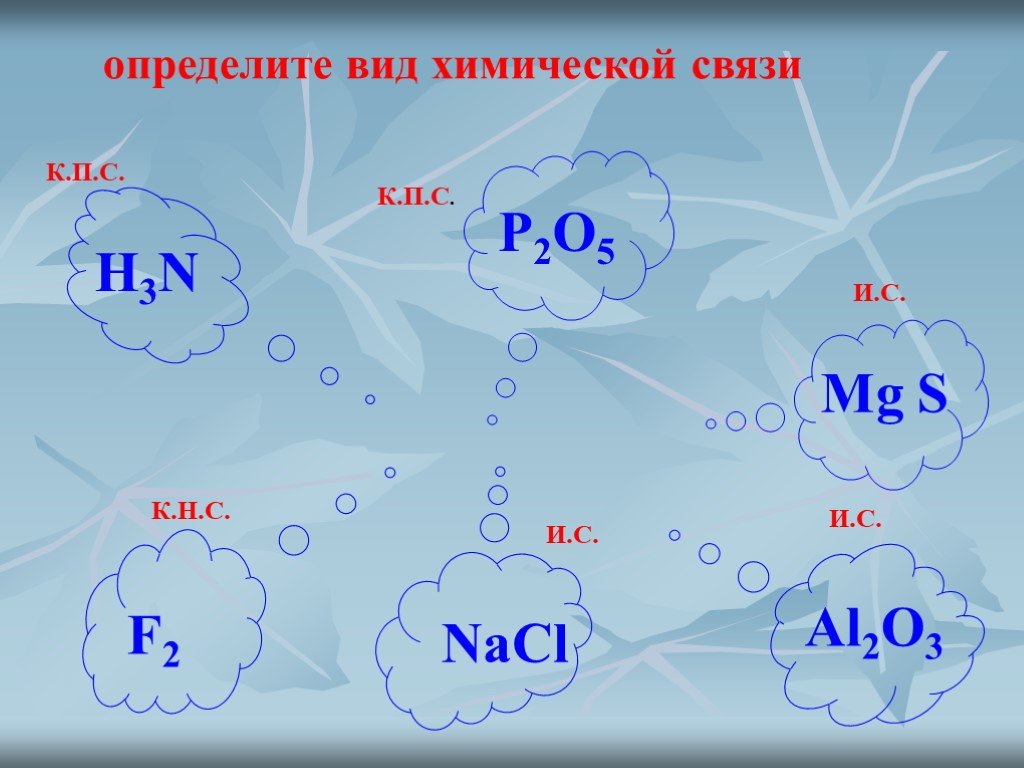 Ингибиторы коррозии — это вещества, которые добавляют в различные устройства для предотвращения коррозии этих устройств. Например, ингибиторы коррозии широко используются со всеми типами ультразвуковых очистителей. А нитрат алюминия всегда добавляется в ингибиторы коррозии и служит одним из важнейших компонентов этих средств.
Ингибиторы коррозии — это вещества, которые добавляют в различные устройства для предотвращения коррозии этих устройств. Например, ингибиторы коррозии широко используются со всеми типами ультразвуковых очистителей. А нитрат алюминия всегда добавляется в ингибиторы коррозии и служит одним из важнейших компонентов этих средств.
Другой важной областью применения нитрата алюминия является крашение, где он используется в качестве протравы. Морилка – это специальное средство, которое служит определенной цели, заключающейся в связывании красителей с материалами. Когда дело доходит до нитрата алюминия, он специально используется с хлопком. Без использования нитрата алюминия красители просто не будут связываться с хлопком. По этой причине нитрат алюминия является очень важным компонентом в процессе окрашивания хлопкового материала.
Нефть и масла также очищаются нитратом алюминия. Большое значение в промышленности имеют процессы переработки нефти и нефти. Например, благодаря такой переработке сырая нефть может быть преобразована в бензин или газолин, LPG (сжиженный нефтяной газ), керосин, дизельное топливо, мазут и реактивное топливо. И ни один из этих процессов не может осуществляться без использования нитрата алюминия. Это еще одно доказательство важности нитрата алюминия для промышленности.
И ни один из этих процессов не может осуществляться без использования нитрата алюминия. Это еще одно доказательство важности нитрата алюминия для промышленности.
И, конечно же, азотнокислый алюминий, как химическое соединение, широко используется для демонстрации студентам и учащимся различных типов химических реакций. При применении нитрата алюминия эти реакции приобретают действительно интересный и яркий вид. Видя такие яркие реакции, студенты и школьники лучше понимают процессы, происходящие в химии, становятся более умными и образованными.
Что касается других гидратированных и негидратированных типов нитратов алюминия, они также находят широкое применение в промышленности. Использование, которое выделяется среди всех, заключается в следующем. Соли нитрата алюминия используются для производства глинозема, который затем используется для производства различных видов изоляционной бумаги. Электронно-лучевая трубка состоит из различных элементов, а в ее нагревательных элементах используется нитрат алюминия.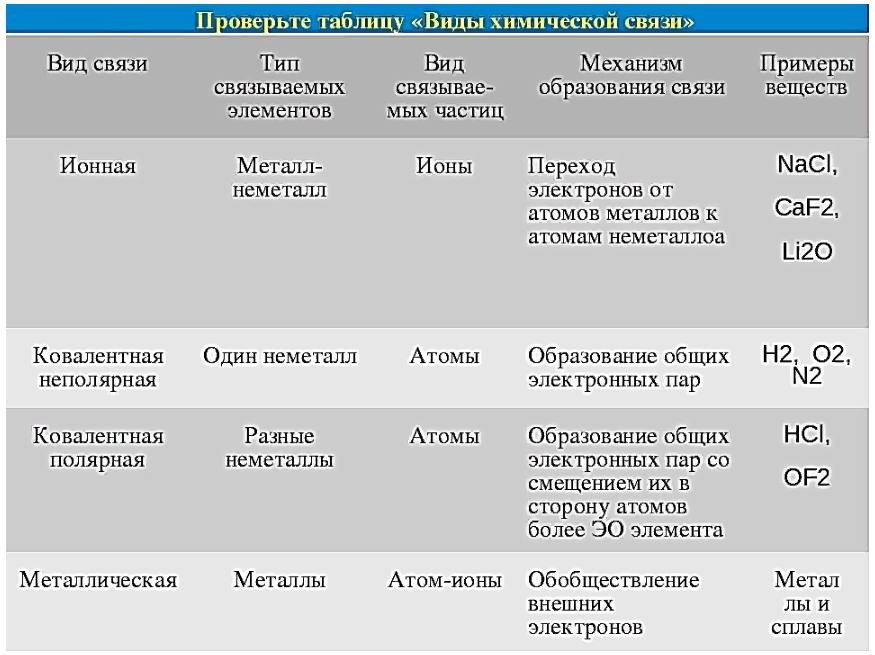 Кроме того, ламинаты трансформаторных сердечников также содержат этот тип соединения. Актинидные элементы извлекаются и с использованием этих солей.
Кроме того, ламинаты трансформаторных сердечников также содержат этот тип соединения. Актинидные элементы извлекаются и с использованием этих солей.
Хорошо известно, что различные соединения широко используются в области медицины, и в этой области также предпринимались попытки применить нитрат алюминия. Однако на данный момент его применяли только к крысам во время различных испытаний. Результаты этих тестов были разными, включая как эффективное, так и неэффективное использование нитрата алюминия по отношению к крысам. Что касается применения нитрата алюминия для человека, то оно еще не применялось. В то же время исследования в этой области продолжаются и, возможно, когда-нибудь нитрат алюминия будет применяться по отношению к человеку. Нитрат алюминия может стать эффективным для лечения людей, как и любое другое соединение.
Меры предосторожности при пожаре
Несмотря на то, что нитрат алюминия является легковоспламеняющимся соединением, он может вызвать некоторые проблемы, связанные с пожаром, поэтому при работе с ним необходимо соблюдать некоторые меры предосторожности.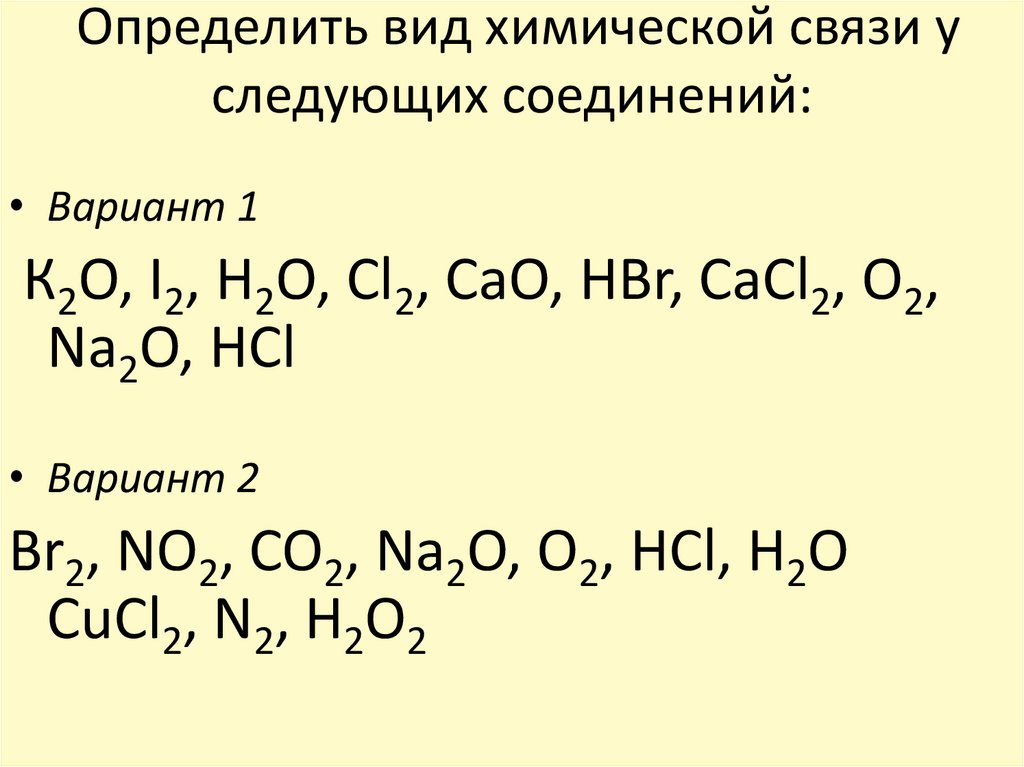 При сгорании нитрата алюминия могут образовываться токсичные оксиды азота. А если компаунд сгорит вместе с некоторыми горючими продуктами, то пожар в результате может существенно увеличиться. Кроме того, все емкости, служившие для хранения нитрата алюминия, следует тщательно промыть водой. В случае пожара вы должны распылять воду, чтобы контролировать пламя. Опрыскивание следует проводить как можно дальше. Использование пены и химикатов не допускается.
При сгорании нитрата алюминия могут образовываться токсичные оксиды азота. А если компаунд сгорит вместе с некоторыми горючими продуктами, то пожар в результате может существенно увеличиться. Кроме того, все емкости, служившие для хранения нитрата алюминия, следует тщательно промыть водой. В случае пожара вы должны распылять воду, чтобы контролировать пламя. Опрыскивание следует проводить как можно дальше. Использование пены и химикатов не допускается.
Нитрат алюминия следует хранить вдали от канализации и источников воды. Следует избегать контакта нитрата алюминия с пламенем, искрами и различного рода возгораниями.
Как защитить себя при работе с нитратом алюминия?
Хотя это вещество не очень опасно, вы должны действовать надлежащим образом, чтобы защитить себя при обращении с ним. Например, при работе с нитратом алюминия следует надевать средства защиты. Защитное снаряжение включает лицевой щиток и защитные очки. Кроме того, следует также использовать перчатки из резины и пылезащитные респираторы.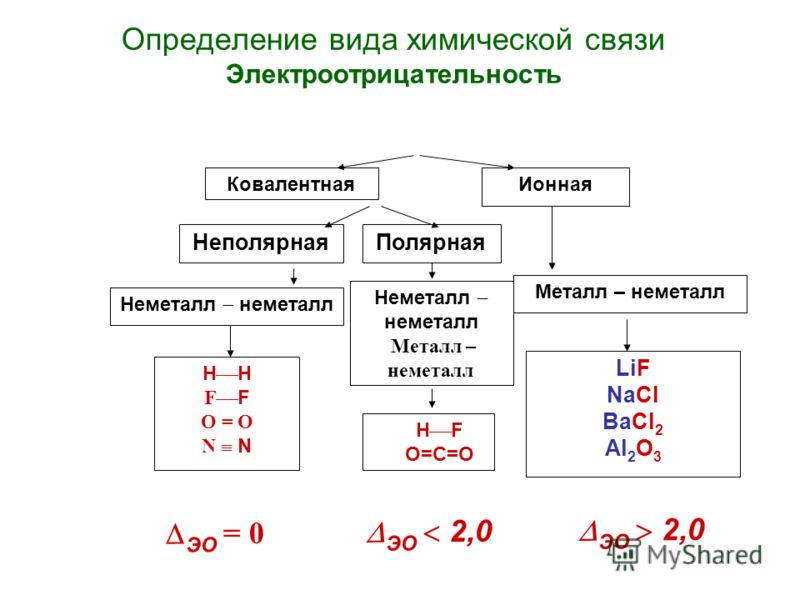

 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав
Leave A Comment