Глава 6. Вопрос 35 ГДЗ Химия 10-11 класс Цветков. Изобразите схематически водородные связи в феноле. – Рамблер/класс
Глава 6. Вопрос 35 ГДЗ Химия 10-11 класс Цветков. Изобразите схематически водородные связи в феноле. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Помогите мне выполнить!
Кристаллическое состояние фенола обусловлено наличием водородных связей между его молекулами.
ответы
Эти связи более прочные, чем в молекулах одноатомных спиртов.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Юмор
Олимпиады
ЕГЭ
9 класс
похожие вопросы 5
Глава 11. Вопрос 5 ГДЗ Химия 10-11 класс Цветков. Какую роль играют водородные связи в построении белковой молекулы?
Какую роль играют водородные связи в построении белковой
молекулы? Какие еще вам известны примеры зависимости свойств ве-
(Подробнее…)
ГДЗХимия10 класс11 классЦветков Л.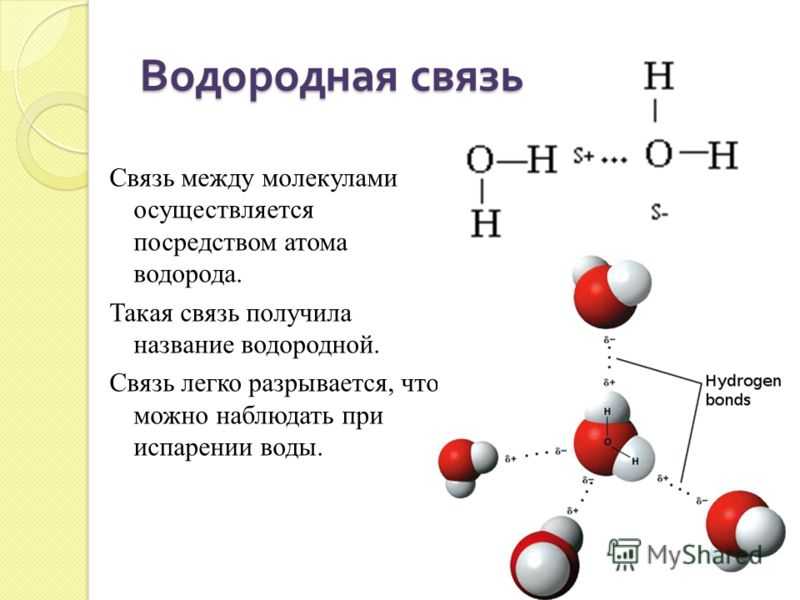 А.
А.
Почему сейчас школьники такие агрессивные ?
Читали новость про 10 классника который растрелял ? как вы к этому относитесь
Новости10 классБезопасность
Здравствуйте.
(Подробнее…)
Химия
Какой был проходной балл в вузы в 2017 году?
Какой был средний балл ЕГЭ поступивших в российские вузы на бюджет в этом году? (Подробнее…)
Поступление11 классЕГЭНовости
11. Выпишите слово, в котором на месте пропуска пишется буква Е. Русский язык ЕГЭ-2017 Цыбулько И. П. ГДЗ. Вариант 12.
11.
Выпишите слово, в котором на месте пропуска пишется буква Е.
произнос., шь (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
3.4: Водородная связь — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 263102
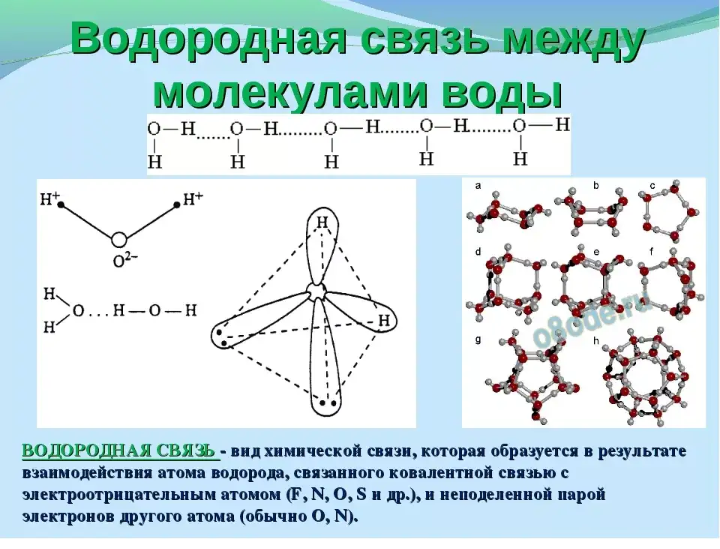
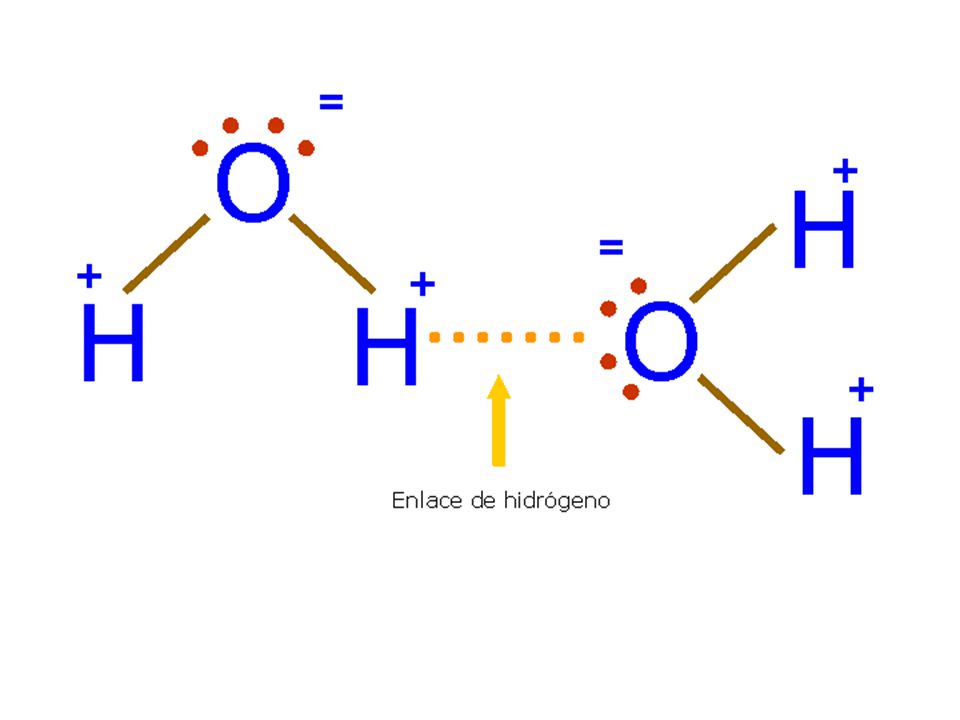
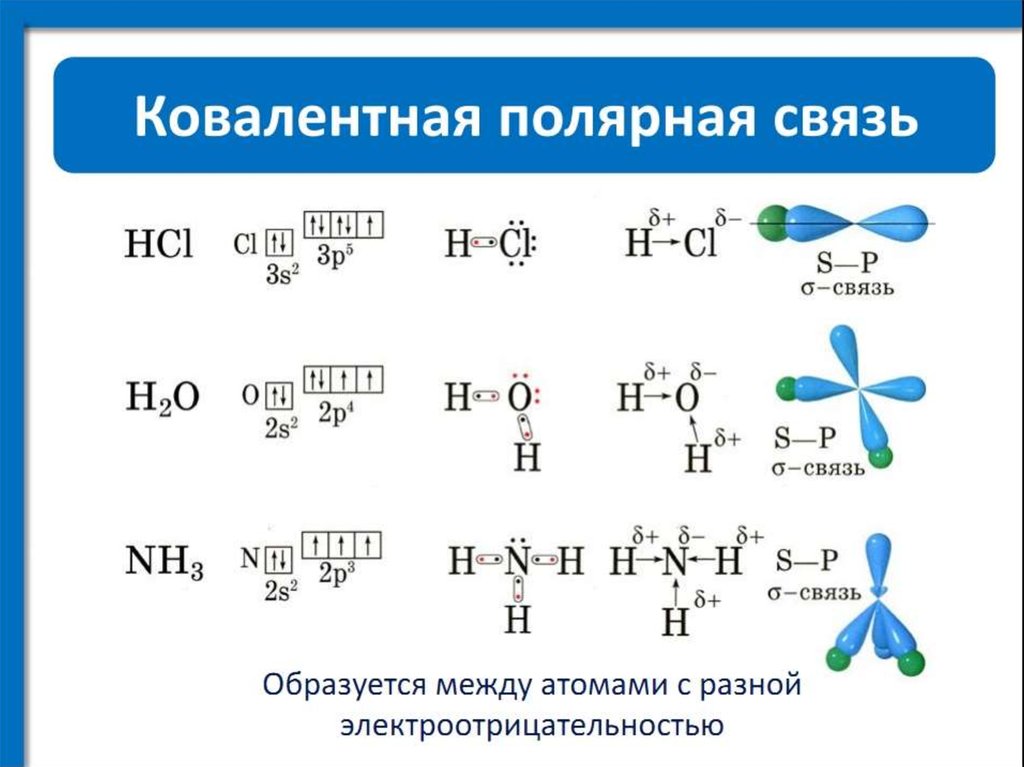
Водородная связь представляет собой межмолекулярную силу (IMF), которая образует особый тип диполь-дипольного притяжения, когда атом водорода, связанный с сильно электроотрицательным атомом, существует вблизи другого электроотрицательного атома с неподеленной парой электронов.
Доказательства водородной связи
Многие элементы образуют соединения с водородом. Если вы нанесете точки кипения соединений элементов группы 14 с водородом, вы обнаружите, что точки кипения увеличиваются по мере того, как вы спускаетесь по группе.
Рис. 1: Температуры кипения галогенидов 14-й группы.Повышение температуры кипения происходит из-за того, что молекулы становятся больше с большим количеством электронов, и поэтому дисперсионные силы Ван-дер-Ваальса становятся больше. Если вы повторите это упражнение с соединениями элементов групп 15, 16 и 17 с водородом, произойдет нечто странное.
Рисунок 2: Температуры кипения галогенидов элементов 15-17 групп. Хотя те же рассуждения применимы к группе 4 периодической таблицы, температура кипения соединения водорода с первым элементом в каждой группе аномально высока. В случаях \(NH_3\), \(H_2O\) и \(HF\) должны существовать какие-то дополнительные силы межмолекулярного притяжения, требующие значительно большей тепловой энергии для разрыва ММП. Эти относительно мощные межмолекулярные силы описываются как водородные связи.
В случаях \(NH_3\), \(H_2O\) и \(HF\) должны существовать какие-то дополнительные силы межмолекулярного притяжения, требующие значительно большей тепловой энергии для разрыва ММП. Эти относительно мощные межмолекулярные силы описываются как водородные связи.
Происхождение водородных связей
Молекулы, способные образовывать водородные связи, включают следующее:
Рисунок 3: Неподеленные пары, ответственные за водородные связи в \(NH_3\), \(H_2O\) и \(HF\). Сплошная линия представляет собой связь в плоскости экрана или бумаги. Точечные связи уходят обратно в экран или бумагу от вас, а клиновидные выходят к вам.Обратите внимание, что в каждой из этих молекул:
- Водород присоединен непосредственно к сильно электроотрицательным атомам, в результате чего водород приобретает сильно положительный заряд.
- Каждый из сильно электроотрицательных атомов приобретает высокий отрицательный заряд и имеет по крайней мере одну «активную» неподеленную пару.
 У неподеленных пар на уровне 2 электроны содержатся в относительно небольшом объеме пространства, что приводит к высокой плотности отрицательного заряда. Неподеленные пары на более высоких уровнях более рассеяны, что приводит к более низкой плотности заряда и меньшему сродству к положительному заряду.
У неподеленных пар на уровне 2 электроны содержатся в относительно небольшом объеме пространства, что приводит к высокой плотности отрицательного заряда. Неподеленные пары на более высоких уровнях более рассеяны, что приводит к более низкой плотности заряда и меньшему сродству к положительному заряду.
Если вы не знакомы с электроотрицательностью, вам следует перейти по этой ссылке, прежде чем продолжить. 9+\) водород настолько сильно притягивается к неподеленной паре, что создается впечатление, будто вы начинаете формировать координационную (дательную ковалентную) связь. Это не заходит так далеко, но притяжение значительно сильнее, чем обычное диполь-дипольное взаимодействие. Водородные связи имеют примерно одну десятую прочности средней ковалентной связи и постоянно разрываются и восстанавливаются в жидкой воде. Если вы сравните ковалентную связь между кислородом и водородом со стабильным браком, водородная связь имеет статус «просто хороших друзей». 9+\) атомов водорода и неподеленных пар, каждый из которых участвует в образовании водородных связей.
Вот почему температура кипения воды выше, чем у аммиака или фтористого водорода. В случае аммиака количество водородных связей ограничено тем фактом, что каждый атом азота имеет только одну неподеленную пару. В группе молекул аммиака не хватает неподеленных пар, чтобы удовлетворить все атомы водорода. Во фтороводороде проблема заключается в нехватке водорода. В воде две водородные связи и две неподеленные пары позволяют образовывать взаимодействия водородных связей в решетке молекул воды. Таким образом, вода считается идеальной системой с водородными связями.
Более сложные примеры водородных связей
Гидратация отрицательных ионов
Когда ионное вещество растворяется в воде, молекулы воды группируются вокруг разделенных ионов. Этот процесс называется гидратацией. Вода часто присоединяется к положительным ионам координационными (дательными ковалентными) связями. Он связывается с отрицательными ионами с помощью водородных связей.
Если вас интересует связь в гидратированных положительных ионах, вы можете перейти по этой ссылке, чтобы ознакомиться с координационной (дательной ковалентной) связью.
На схеме показаны потенциальные водородные связи, образованные ионом хлора Cl-. Хотя неподеленные пары в ионе хлорида находятся на уровне 3 и обычно недостаточно активны для образования водородных связей, в этом случае они становятся более привлекательными за счет полного отрицательного заряда хлора.
Рис. 5: Водородная связь между ионами хлора и водой.Каким бы сложным ни был отрицательный ион, всегда будут неподеленные пары, с которыми атомы водорода из молекул воды могут водородно связываться.
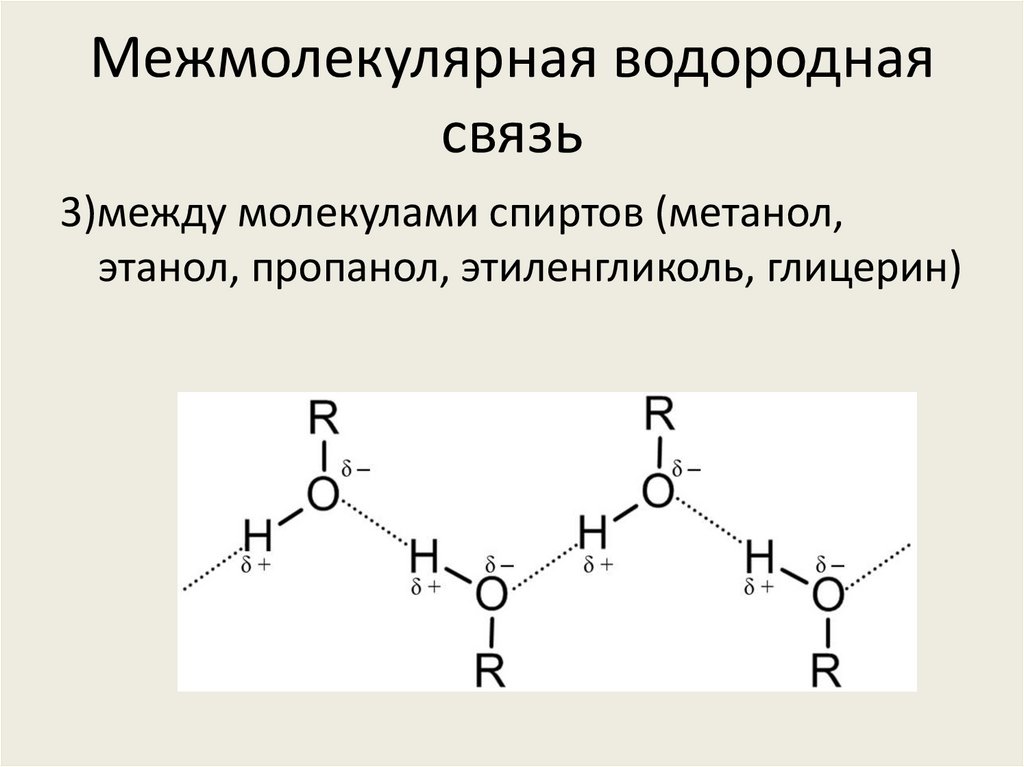
Водородная связь в спиртах
Спирт представляет собой органическую молекулу, содержащую группу -ОН. Любая молекула, в которой атом водорода присоединен непосредственно к кислороду или азоту, способна образовывать водородные связи. Водородные связи также возникают, когда водород связан со фтором, но группа HF не появляется в других молекулах. Молекулы с водородными связями всегда будут иметь более высокую температуру кипения, чем молекулы аналогичного размера, которые не имеют группы -ОН или -NH.
Водородная связь делает молекулы «более липкими», так что для их разделения требуется больше тепла (энергии). Это явление можно использовать для анализа температуры кипения различных молекул, определяемой как температура, при которой происходит фазовый переход от жидкости к газу. Этанол, \(\ce{Ch4Ch3-O-H}\), и метоксиметан, \(\ce{Ch4-O-Ch4}\), имеют одинаковую молекулярную формулу, \(\ce{C2H6O}\).
У них одинаковое количество электронов и одинаковая длина. Притяжение Ван-дер-Ваальса (как дисперсионные силы, так и диполь-дипольное притяжение) в каждом из них будет одинаковым. Однако у этанола атом водорода присоединен непосредственно к кислороду; здесь у кислорода все еще есть две неподеленные пары, как у молекулы воды. Водородная связь может возникать между молекулами этанола, хотя и не так эффективно, как в воде. Водородная связь ограничена тем фактом, что в каждой молекуле этанола имеется только один водород с достаточным зарядом +.
В метоксиметане неподеленные пары кислорода все еще присутствуют, но атомов водорода недостаточно + для образования водородных связей.
За исключением некоторых довольно необычных случаев, атом водорода должен быть присоединен непосредственно к самому электроотрицательному элементу, чтобы возникла водородная связь. Температуры кипения этанола и метоксиметана показывают резкое влияние водородных связей на липкость молекул этанола:
этанол (с водородными связями) 78,5°С метоксиметан (без водородной связи) -24,8°С Водородная связь в этаноле подняла его температуру кипения примерно на 100°C. Важно понимать, что помимо притяжения Ван-дер-Ваальса существуют водородные связи. Например, все следующие молекулы содержат одинаковое количество электронов, а первые две имеют одинаковую длину цепи. Более высокая температура кипения бутан-1-ола обусловлена дополнительной водородной связью.
При сравнении двух спиртов (содержащих группы -ОН) оба имеют высокие температуры кипения из-за дополнительной водородной связи; однако значения не совпадают.
Температура кипения 2-метилпропан-1-ола не такая высокая, как у бутан-1-ола, потому что разветвление молекулы делает ван-дер-ваальсово притяжение менее эффективным, чем у более длинного бутан-1-ола.
Водородная связь в органических молекулах, содержащих азот
Водородная связь также возникает в органических молекулах, содержащих группы N-H; вспомните водородные связи, возникающие с аммиаком. Примеры варьируются от простых молекул, таких как CH 3 NH 2 (метиламин) в большие молекулы, такие как белки и ДНК. Две нити знаменитой двойной спирали в ДНК удерживаются вместе водородными связями между атомами водорода, присоединенными к азоту на одной цепи, и неподеленными парами на другой азот или кислород на другой.
Доноры и акцепторы
Для образования водородной связи должны присутствовать как донор водорода, так и акцептор. Донором в водородной связи обычно является сильно электроотрицательный атом, такой как N, O или F, который ковалентно связан с водородной связью.
Акцептор водорода представляет собой электроотрицательный атом соседней молекулы или иона, который содержит неподеленную пару, участвующую в водородной связи.
Почему возникает водородная связь?
Поскольку донор водорода (N, O или F) является сильно электроотрицательным, он притягивает ковалентно связанную электронную пару ближе к своему ядру и от атома водорода. Затем атом водорода остается с частичным положительным зарядом, создавая диполь-дипольное притяжение между атомом водорода, связанным с донором, и неподеленной электронной парой акцептора. Это приводит к образованию водородной связи (см. Взаимодействие между молекулами с постоянными диполями)
Типы водородных связей
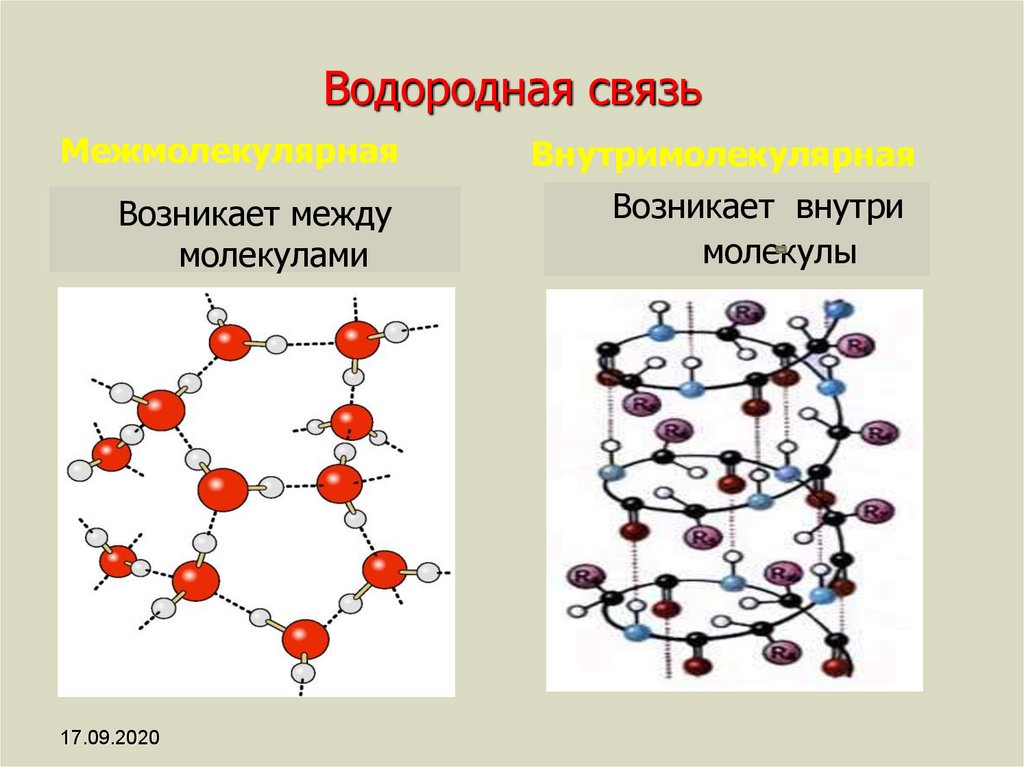
Хотя водородные связи хорошо известны как тип IMF, эти связи также могут возникать внутри одной молекулы, между двумя идентичными молекулами или между двумя разнородными молекулами.
Внутримолекулярные водородные связи
Внутримолекулярные водородные связи возникают внутри одной единственной молекулы.
Это происходит, когда две функциональные группы молекулы могут образовывать водородные связи друг с другом. Для этого в одной молекуле должны присутствовать как донор водорода, так и акцептор водорода, и они должны находиться в непосредственной близости друг от друга в молекуле. Например, внутримолекулярная водородная связь возникает в этиленгликоле (C 2 H 4 (OH) 2 ) между двумя его гидроксильными группами из-за молекулярной геометрии.
Межмолекулярные водородные связи
Межмолекулярные водородные связи возникают между отдельными молекулами вещества. Они могут возникать между любым количеством одинаковых или разных молекул, если доноры и акцепторы водорода находятся в положениях, в которых они могут взаимодействовать друг с другом. Например, межмолекулярные водородные связи могут возникать между NH 3 только молекулы, только между H 2 молекулами O или между NH 3 и H 2 молекулами O.
Свойства и влияние водородных связей
О температуре кипения
Когда мы рассматриваем точки кипения молекул, мы обычно ожидаем, что молекулы с большей молярной массой будут иметь более высокие нормальные точки кипения, чем молекулы с меньшей молярной массой. Это, без учета водородных связей, связано с большими дисперсионными силами (см. Взаимодействие между неполярными молекулами). Более крупные молекулы имеют больше места для распределения электронов и, следовательно, больше возможностей для мгновенного дипольного момента. Однако, если мы рассмотрим приведенную ниже таблицу, то увидим, что это не всегда так.
Соединение Молярная масса Нормальная температура кипения \(H_2O\) 18 г/моль 373 К \(ВЧ\) 20 г/моль 292,5 К \(NH_3\) 17 г/моль 239,8 К \(H_2S\) 34 г/моль 212,9 К \(HCl\) 36,4 г/моль 197,9 К \(PH_3\) 34 г/моль 185,2 К Мы видим, что H 2 O, HF и NH 3 имеют более высокие точки кипения, чем одно и то же соединение, образующееся между водородом и следующим элементом, движущимся вниз по соответствующей группе, что указывает на то, что первые обладают большими межмолекулярными силами.
. Это потому, что Н 2 O, HF и NH 3 все имеют водородные связи, тогда как другие нет. Кроме того, \(H_2O\) имеет меньшую молярную массу, чем HF, но имеет больше водородных связей на молекулу, поэтому его температура кипения выше.
О вязкости
Тот же эффект, что и при температуре кипения в результате образования водородных связей, можно наблюдать и в отношении вязкости некоторых веществ. Вещества, способные образовывать водородные связи, как правило, имеют более высокую вязкость, чем те, которые не образуют водородных связей. Как правило, вещества, которые могут иметь несколько водородных связей, обладают еще более высокой вязкостью.
Факторы, препятствующие образованию водородной связи
Электроотрицательность
Водородная связь не может возникнуть без значительных различий в электроотрицательности между водородом и атомом, с которым он связан. Таким образом, мы видим такие молекулы, как PH 3 , которые не участвуют в водородных связях.
PH 3 имеет тригонально-пирамидальную молекулярную геометрию, как у аммиака, но в отличие от NH 3 не может образовывать водородные связи. Это связано со сходством электроотрицательностей фосфора и водорода. Оба атома имеют электроотрицательность 2,1, поэтому дипольный момент отсутствует. Это предотвращает получение атомом водорода частичного положительного заряда, необходимого для водородной связи с неподеленной электронной парой в другой молекуле. (см. Поляризуемость)
Размер атома
Размер доноров и акцепторов также может влиять на способность к образованию водородных связей. Это может объяснить относительно низкую способность Cl образовывать водородные связи. Когда радиусы двух атомов сильно различаются или велики, их ядра не могут достичь непосредственной близости при взаимодействии, что приводит к слабому взаимодействию.
Водородные связи в природе
Водородные связи играют решающую роль во многих биологических процессах и могут объяснить многие природные явления, такие как необычные свойства воды.
Помимо того, что они присутствуют в воде, водородные связи также важны в водной транспортной системе растений, вторичной и третичной структуре белков и спаривании оснований ДНК.
Растения
Когезионно-адгезионная теория транспорта в сосудистых растениях использует водородные связи для объяснения многих ключевых компонентов движения воды через ксилему растения и другие сосуды. Молекулы воды внутри сосуда водородно связываются не только друг с другом, но и с цепочкой целлюлозы, из которой состоит стенка растительной клетки. Поскольку сосуд относительно мал, притяжение воды к целлюлозной стенке создает своего рода капиллярную трубку, обеспечивающую капиллярное действие. Этот механизм позволяет растениям втягивать воду в свои корни. Кроме того, водородные связи могут создать длинную цепочку молекул воды, которая может преодолеть силу гравитации и подняться на большие высоты листьев.
Белки
Водородные связи в изобилии присутствуют во вторичной структуре белков, а также редко в третичной конформации.
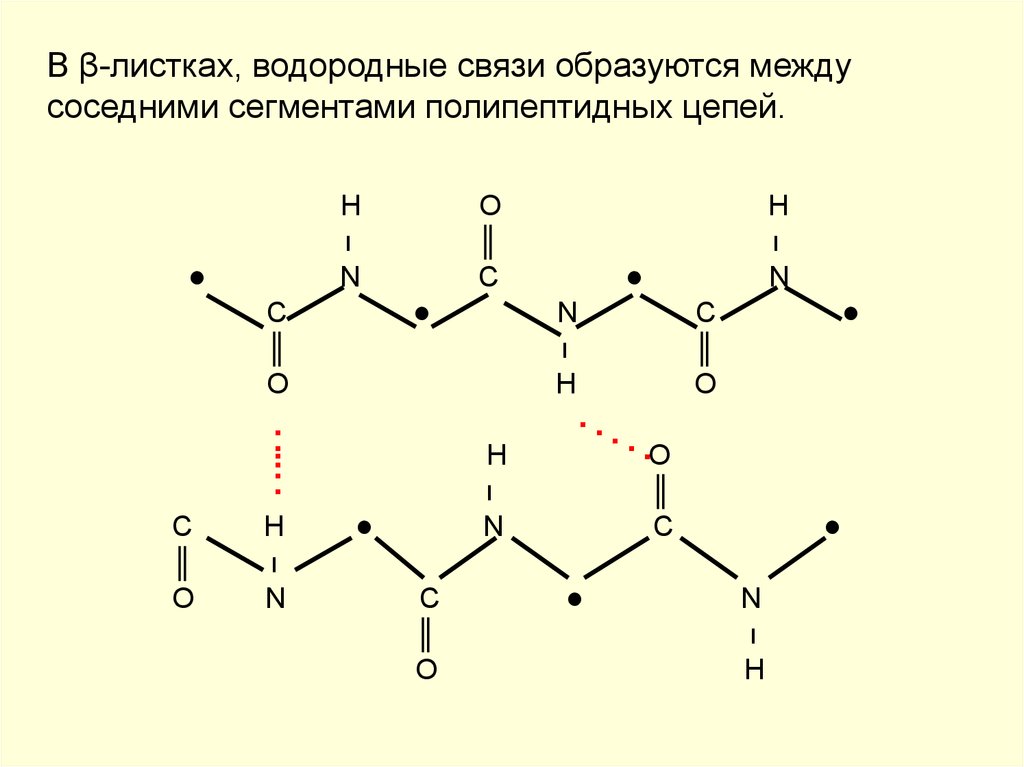
Вторичная структура белка включает взаимодействия (в основном водородные связи) между соседними полипептидными остовами, которые содержат пары, связанные азотом и водородом, и атомы кислорода. Поскольку и N, и O сильно электроотрицательны, атомы водорода, связанные с азотом в одной полипептидной цепи, могут водородно связываться с атомами кислорода в другой цепи, и наоборот. Хотя они относительно слабые, эти связи обеспечивают существенную устойчивость вторичной белковой структуры, поскольку они повторяются много раз и работают коллективно.
В третичной структуре белка взаимодействия в основном происходят между функциональными R-группами полипептидной цепи; одно такое взаимодействие называется гидрофобным взаимодействием. Эти взаимодействия происходят из-за водородных связей между молекулами воды вокруг гидрофоба, что еще больше укрепляет конформацию белка.
Ссылки
- Brown, et al. Химия: центральная наука. 11-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2008 г.
.- Чанг, Рэймонд. Общая химия: основные понятия. 3-е изд. Нью-Йорк: Макгроу Хилл, 2003 г.
- Петруччи и др. Общая химия: принципы и современные приложения. 9-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2007.
.3.4: Hydrogen Bonding распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Включено
- да
- Теги
- источник[1]-хим-151369
межмолекулярная связь — водородные связи
МЕЖМОЛЕКУЛЯРНАЯ СВЯЗЬ — ВОДОРОДНЫЕ СВЯЗИ
На этой странице объясняется происхождение водородных связей — относительно сильной формы межмолекулярного притяжения.
Если вас также интересуют другие межмолекулярные силы (дисперсионные силы Ван-дер-Ваальса и диполь-дипольные взаимодействия), ссылка внизу страницы.
Доказательства наличия водородных связей
Многие элементы образуют соединения с водородом. Если вы нанесете на график точки кипения соединений элементов группы 4 с водородом, вы обнаружите, что точки кипения увеличиваются по мере того, как вы спускаетесь по группе.
Повышение температуры кипения происходит из-за того, что молекулы становятся больше с большим количеством электронов, и поэтому дисперсионные силы Ван-дер-Ваальса становятся больше.
Примечание: Если вы не уверены в дисперсионных силах Ван-дер-Ваальса, вам будет полезно перейти по этой ссылке, прежде чем продолжить.
Если повторить это упражнение с соединениями элементов групп 5, 6 и 7 с водородом, произойдет нечто странное.
Хотя по большей части тенденция точно такая же, как и в группе 4 (точно по тем же причинам), температура кипения соединения водорода с первым элементом в каждой группе аномально высока.
В случае NH 3 , H 2 O и HF должны существовать дополнительные межмолекулярные силы притяжения, для разрыва которых требуется значительно больше тепловой энергии. Эти относительно мощные межмолекулярные силы описываются как водородных связей.
Происхождение водородной связи
Молекулы, которые имеют эту дополнительную связь:
Примечание: Сплошная линия представляет собой соединение в плоскости экрана или бумаги. Точечные связи уходят обратно в экран или бумагу от вас, а клиновидные выходят к вам.
Обратите внимание, что в каждой из этих молекул:
Водород присоединяется непосредственно к одному из наиболее электроотрицательных элементов, в результате чего водород приобретает значительный положительный заряд.
Каждый из элементов, к которым присоединен водород, не только существенно отрицателен, но также имеет по крайней мере одну «активную» неподеленную пару.
Неподеленные пары на уровне 2 имеют электроны, содержащиеся в относительно небольшом объеме пространства, которое, следовательно, имеет высокую плотность отрицательного заряда. Одинокие пары на более высоких уровнях более рассеяны и не так привлекательны для положительных вещей.
Примечание: Если вас не устраивает электроотрицательность, перейдите по этой ссылке, прежде чем продолжить.
Представьте, что две молекулы воды приближаются друг к другу.
Водород δ+ так сильно притягивается к неподеленной паре, что создается впечатление, будто вы начинаете формировать координационную (дативную ковалентную) связь. Это не заходит так далеко, но притяжение значительно сильнее, чем обычное диполь-дипольное взаимодействие.
Водородные связи имеют примерно десятую часть прочности средней ковалентной связи и постоянно разрываются и восстанавливаются в жидкой воде. Если вы сравните ковалентную связь между кислородом и водородом со стабильным браком, водородная связь имеет статус «просто хороших друзей».
Вода как «идеальный» пример водородной связи
Обратите внимание, что каждая молекула воды потенциально может образовать четыре водородные связи с окружающими молекулами воды. Существует точно такое количество атомов водорода δ+ и неподеленных пар, чтобы каждый из них мог участвовать в образовании водородных связей.
Вот почему температура кипения воды выше, чем у аммиака или фтористого водорода.
Примечание: Вы найдете больше информации о влиянии водородных связей на свойства воды на странице молекулярных структур.
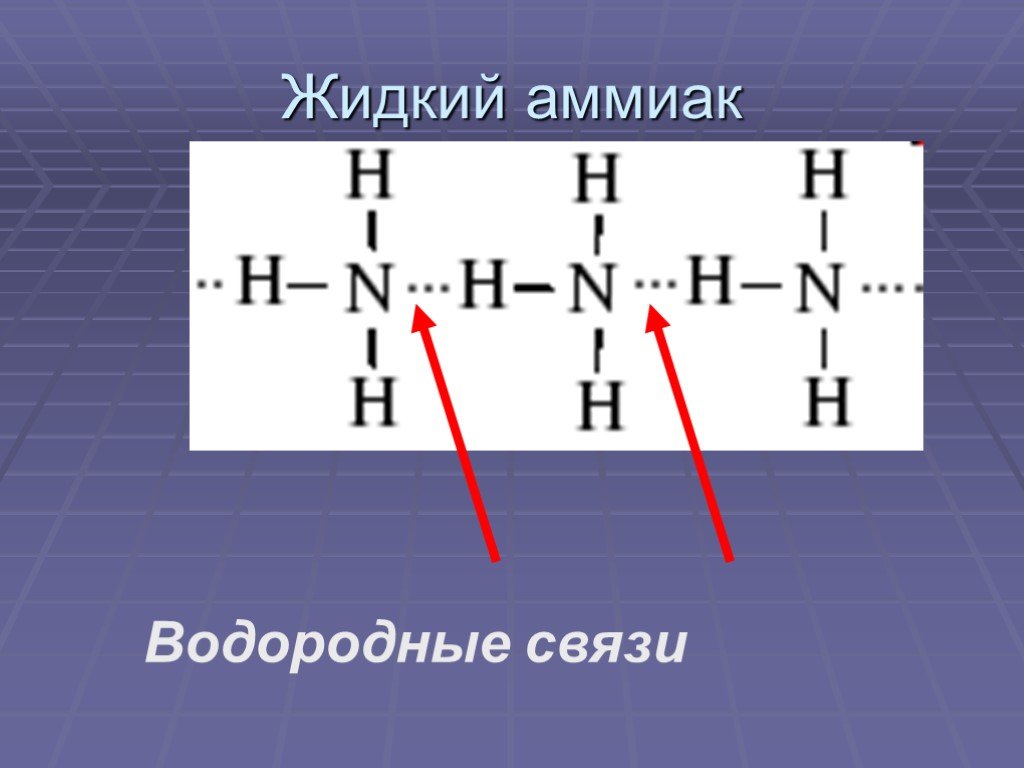
В случае аммиака количество водородных связей ограничено тем фактом, что каждый атом азота имеет только одну неподеленную пару.
В группе молекул аммиака не хватает неподеленных пар, чтобы удовлетворить все атомы водорода.
Это означает, что в среднем каждая молекула аммиака может образовать одну водородную связь, используя свою неподеленную пару, и одну, используя один из своих атомов водорода δ+. Остальные водороды тратятся впустую.
Во фтороводороде проблема заключается в нехватке водорода. Таким образом, в среднем каждая молекула может образовать только одну водородную связь с использованием своего δ+ водорода и одну с участием одной из своих неподеленных пар. Остальные одинокие пары по существу потрачены впустую.
В воде их ровно столько, сколько нужно. Воду можно рассматривать как «идеальную» систему с водородными связями.
Предупреждение: Мне было указано, что некоторые источники (в том числе одна из экзаменационных комиссий уровня A в Великобритании) подсчитывают количество водородных связей, образованных водой, скажем, по-разному.Говорят, что вода образует 2 водородные связи, а не 4. Это часто сопровождается диаграммой льда рядом с этим утверждением, ясно показывающим 4 водородные связи!
Читая то, что они говорят, кажется, что они считают водородную связь принадлежащей конкретной молекуле только в том случае, если она исходит от атома водорода в этой молекуле. Мне это кажется нелогичным. Водородная связь состоит из двух частей: водорода δ+, присоединенного к достаточно электроотрицательному элементу, и активной неподеленной пары. Они взаимодействуют, образуя водородную связь, и это все еще водородная связь, независимо от того, с какой стороны на нее смотреть.
Определения водородной связи ИЮПАК вообще не ссылаются на что-либо из этого, поэтому, похоже, нет какой-либо «официальной» поддержки для этого так или иначе.
Однако очень важно выяснить, чего ожидают ваши экзаменаторы. Они устанавливают правила для экзамена, который вы будете сдавать, и у вас нет другого выбора, кроме как играть по этим правилам.

Более сложные примеры водородных связей
Водородная связь в спиртах
Спирт представляет собой органическую молекулу, содержащую группу -ОН.
Любая молекула, в которой атом водорода присоединен непосредственно к кислороду или азоту, способна образовывать водородные связи. Такие молекулы всегда будут иметь более высокие температуры кипения, чем молекулы аналогичного размера, которые не имеют группы -OH или -NH. Водородная связь делает молекулы «более липкими», и для их разделения требуется больше тепла.
Этанол, CH 3 CH 2 -OH, и метоксиметан, CH 3 -O-CH 3 , оба имеют одинаковую молекулярную формулу C 2 H 6 O.
Примечание: Если вы еще не занимались органической химией, не беспокойтесь о названиях.
У них одинаковое количество электронов и одинаковая длина молекулы.
Другие ван-дер-ваальсовы притяжения (как дисперсионные силы, так и диполь-дипольные притяжения) в каждом из них будут во многом одинаковыми.
Однако у этанола есть атом водорода, присоединенный непосредственно к кислороду, и этот кислород по-прежнему имеет точно такие же две неподеленные пары, как и в молекуле воды. Водородная связь может возникать между молекулами этанола, хотя и не так эффективно, как в воде. Водородная связь ограничена тем фактом, что в каждой молекуле этанола имеется только один водород с достаточным зарядом δ+.
В метоксиметане неподеленные пары кислорода все еще присутствуют, но атомы водорода недостаточно δ+ для образования водородных связей. За исключением некоторых довольно необычных случаев, атом водорода должен быть присоединен непосредственно к очень электроотрицательному элементу для возникновения водородной связи.
Температуры кипения этанола и метоксиметана показывают резкое влияние водородных связей на липкость молекул этанола:
этанол (с водородной связью) 78,5°C метоксиметан (без водородной связи) -24,8°C 900 0591 Водородная связь в этаноле повысила его температуру кипения примерно на 100°C.
Важно понимать, что существует водородная связь в дополнение к другим ван-дер-ваальсовым притяжениям. Например, все следующие молекулы содержат одинаковое количество электронов, а первые две имеют почти одинаковую длину. Более высокая температура кипения бутан-1-ола обусловлена дополнительной водородной связью.
При сравнении двух спиртов (содержащих группы -ОН) оба имеют высокие температуры кипения из-за дополнительных водородных связей из-за того, что водород присоединен непосредственно к кислороду, но это не одно и то же.
Температура кипения 2-метилпропан-1-ола не такая высокая, как у бутанола-1, потому что разветвление молекулы делает ван-дер-ваальсово притяжение менее эффективным, чем у более длинного бутанола-1.
Водородные связи в органических молекулах, содержащих азот
Водородная связь также возникает в органических молекулах, содержащих группы N-H, таким же образом, как и в аммиаке.
Примеры варьируются от простых молекул, таких как CH 3 NH 2 (метиламин) в большие молекулы, такие как белки и ДНК.
Две нити знаменитой двойной спирали в ДНК удерживаются вместе водородными связями между атомами водорода, присоединенными к азоту на одной цепи, и неподеленными парами азота или кислорода на другой.
Вопросы для проверки вашего понимания
Если это первый набор вопросов, который вы задали, пожалуйста, прочтите вводную страницу, прежде чем начать. Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже.
вопроса о водородных связях
ответы

 У неподеленных пар на уровне 2 электроны содержатся в относительно небольшом объеме пространства, что приводит к высокой плотности отрицательного заряда. Неподеленные пары на более высоких уровнях более рассеяны, что приводит к более низкой плотности заряда и меньшему сродству к положительному заряду.
У неподеленных пар на уровне 2 электроны содержатся в относительно небольшом объеме пространства, что приводит к высокой плотности отрицательного заряда. Неподеленные пары на более высоких уровнях более рассеяны, что приводит к более низкой плотности заряда и меньшему сродству к положительному заряду.
 Температура кипения 2-метилпропан-1-ола не такая высокая, как у бутан-1-ола, потому что разветвление молекулы делает ван-дер-ваальсово притяжение менее эффективным, чем у более длинного бутан-1-ола.
Температура кипения 2-метилпропан-1-ола не такая высокая, как у бутан-1-ола, потому что разветвление молекулы делает ван-дер-ваальсово притяжение менее эффективным, чем у более длинного бутан-1-ола.
 Это происходит, когда две функциональные группы молекулы могут образовывать водородные связи друг с другом. Для этого в одной молекуле должны присутствовать как донор водорода, так и акцептор водорода, и они должны находиться в непосредственной близости друг от друга в молекуле. Например, внутримолекулярная водородная связь возникает в этиленгликоле (C 2 H 4 (OH) 2 ) между двумя его гидроксильными группами из-за молекулярной геометрии.
Это происходит, когда две функциональные группы молекулы могут образовывать водородные связи друг с другом. Для этого в одной молекуле должны присутствовать как донор водорода, так и акцептор водорода, и они должны находиться в непосредственной близости друг от друга в молекуле. Например, внутримолекулярная водородная связь возникает в этиленгликоле (C 2 H 4 (OH) 2 ) между двумя его гидроксильными группами из-за молекулярной геометрии.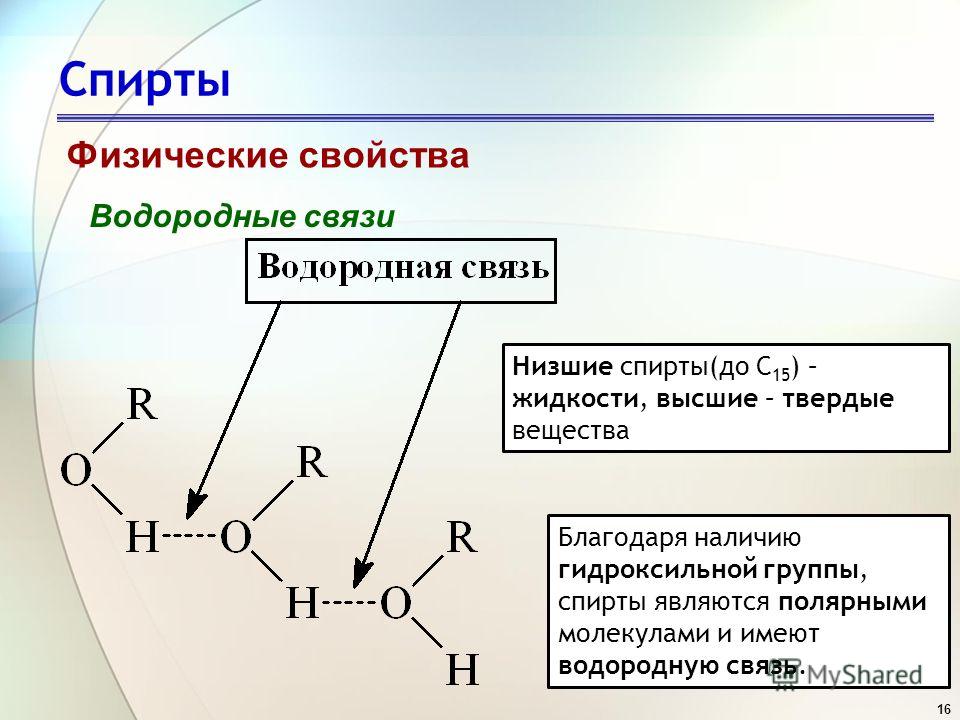
 . Это потому, что Н 2 O, HF и NH 3 все имеют водородные связи, тогда как другие нет. Кроме того, \(H_2O\) имеет меньшую молярную массу, чем HF, но имеет больше водородных связей на молекулу, поэтому его температура кипения выше.
. Это потому, что Н 2 O, HF и NH 3 все имеют водородные связи, тогда как другие нет. Кроме того, \(H_2O\) имеет меньшую молярную массу, чем HF, но имеет больше водородных связей на молекулу, поэтому его температура кипения выше.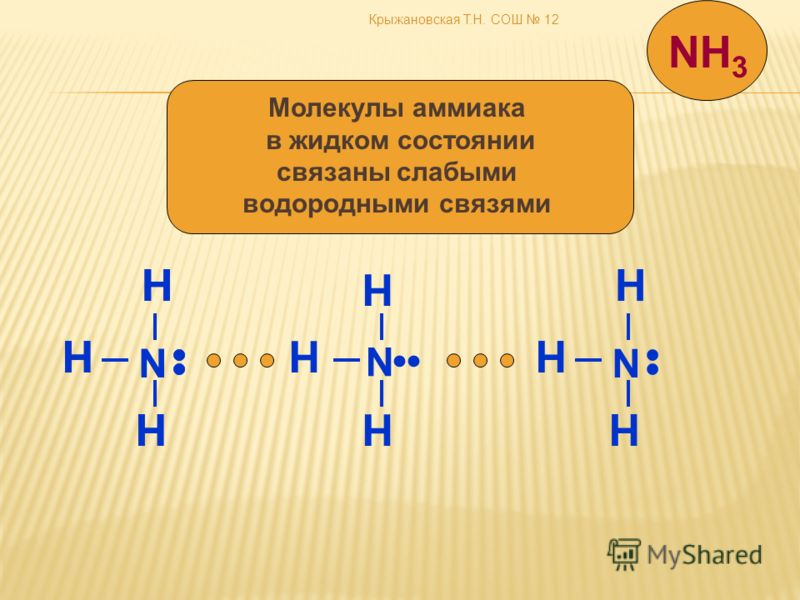 PH 3 имеет тригонально-пирамидальную молекулярную геометрию, как у аммиака, но в отличие от NH 3 не может образовывать водородные связи. Это связано со сходством электроотрицательностей фосфора и водорода. Оба атома имеют электроотрицательность 2,1, поэтому дипольный момент отсутствует. Это предотвращает получение атомом водорода частичного положительного заряда, необходимого для водородной связи с неподеленной электронной парой в другой молекуле. (см. Поляризуемость)
PH 3 имеет тригонально-пирамидальную молекулярную геометрию, как у аммиака, но в отличие от NH 3 не может образовывать водородные связи. Это связано со сходством электроотрицательностей фосфора и водорода. Оба атома имеют электроотрицательность 2,1, поэтому дипольный момент отсутствует. Это предотвращает получение атомом водорода частичного положительного заряда, необходимого для водородной связи с неподеленной электронной парой в другой молекуле. (см. Поляризуемость)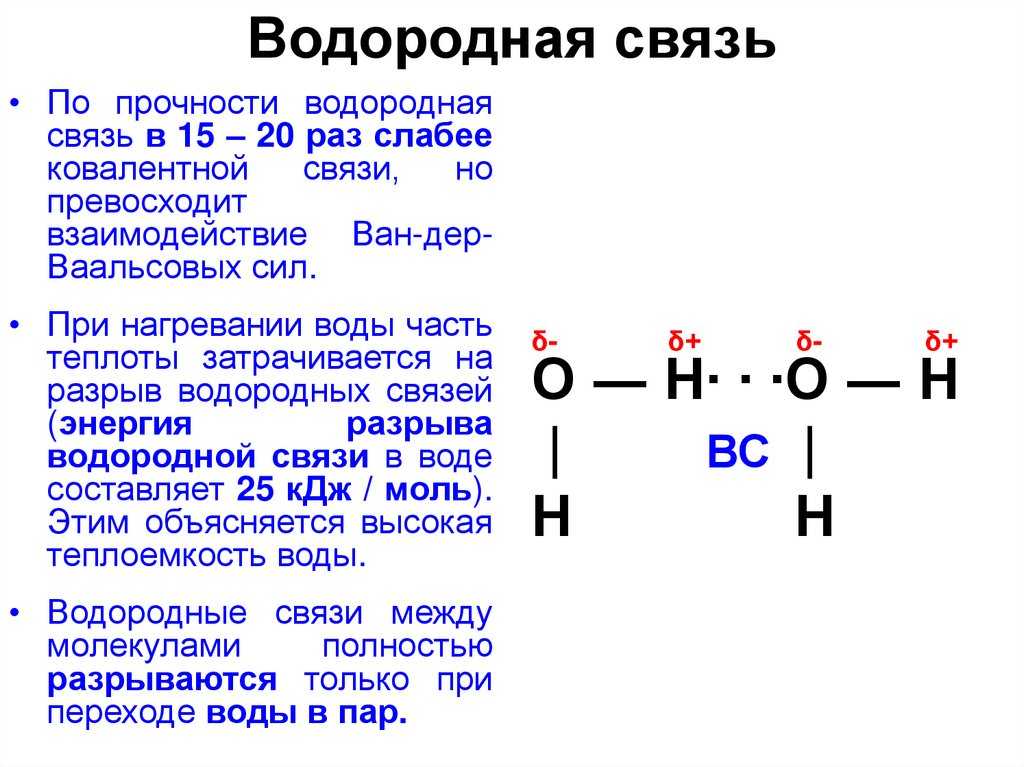 Помимо того, что они присутствуют в воде, водородные связи также важны в водной транспортной системе растений, вторичной и третичной структуре белков и спаривании оснований ДНК.
Помимо того, что они присутствуют в воде, водородные связи также важны в водной транспортной системе растений, вторичной и третичной структуре белков и спаривании оснований ДНК. Вторичная структура белка включает взаимодействия (в основном водородные связи) между соседними полипептидными остовами, которые содержат пары, связанные азотом и водородом, и атомы кислорода. Поскольку и N, и O сильно электроотрицательны, атомы водорода, связанные с азотом в одной полипептидной цепи, могут водородно связываться с атомами кислорода в другой цепи, и наоборот. Хотя они относительно слабые, эти связи обеспечивают существенную устойчивость вторичной белковой структуры, поскольку они повторяются много раз и работают коллективно.
Вторичная структура белка включает взаимодействия (в основном водородные связи) между соседними полипептидными остовами, которые содержат пары, связанные азотом и водородом, и атомы кислорода. Поскольку и N, и O сильно электроотрицательны, атомы водорода, связанные с азотом в одной полипептидной цепи, могут водородно связываться с атомами кислорода в другой цепи, и наоборот. Хотя они относительно слабые, эти связи обеспечивают существенную устойчивость вторичной белковой структуры, поскольку они повторяются много раз и работают коллективно.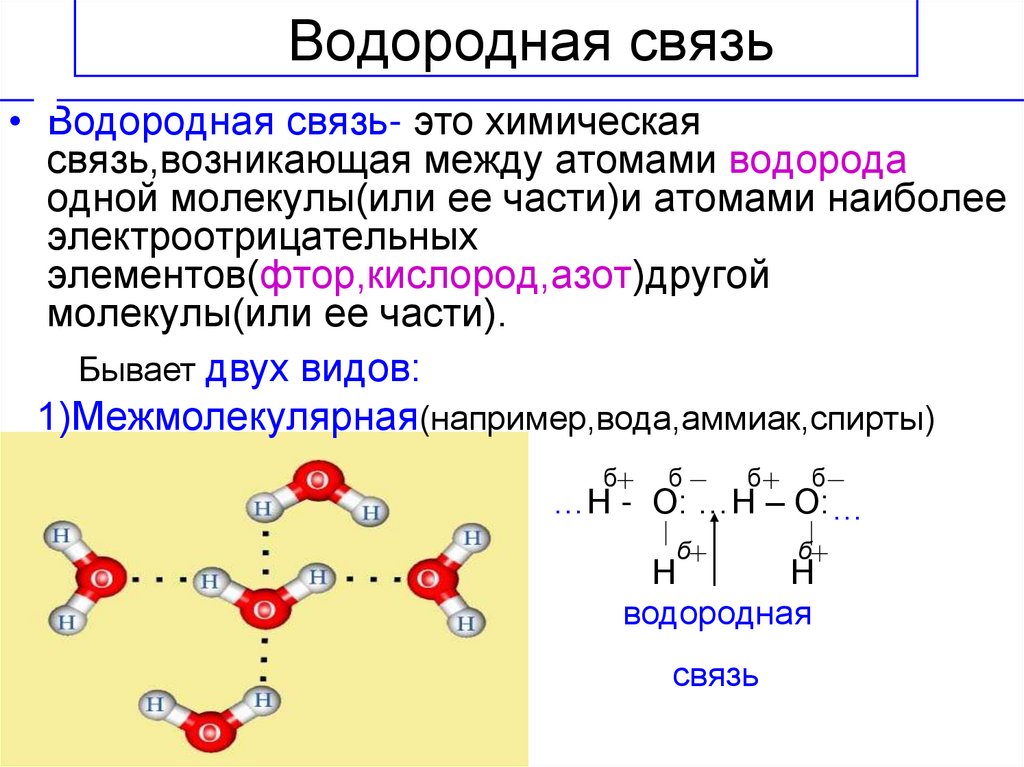
 Если вас также интересуют другие межмолекулярные силы (дисперсионные силы Ван-дер-Ваальса и диполь-дипольные взаимодействия), ссылка внизу страницы.
Если вас также интересуют другие межмолекулярные силы (дисперсионные силы Ван-дер-Ваальса и диполь-дипольные взаимодействия), ссылка внизу страницы.
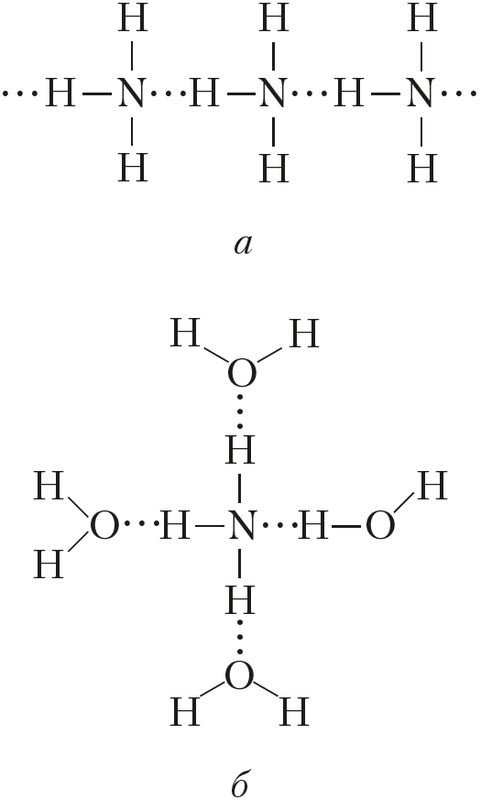
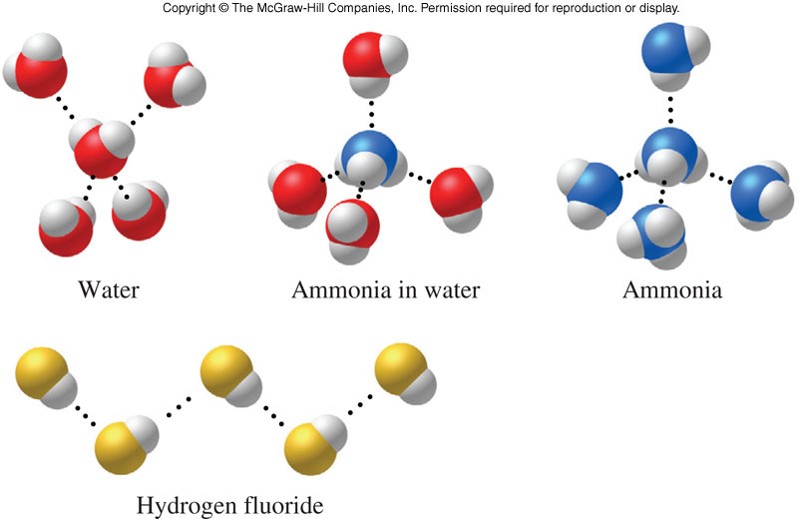
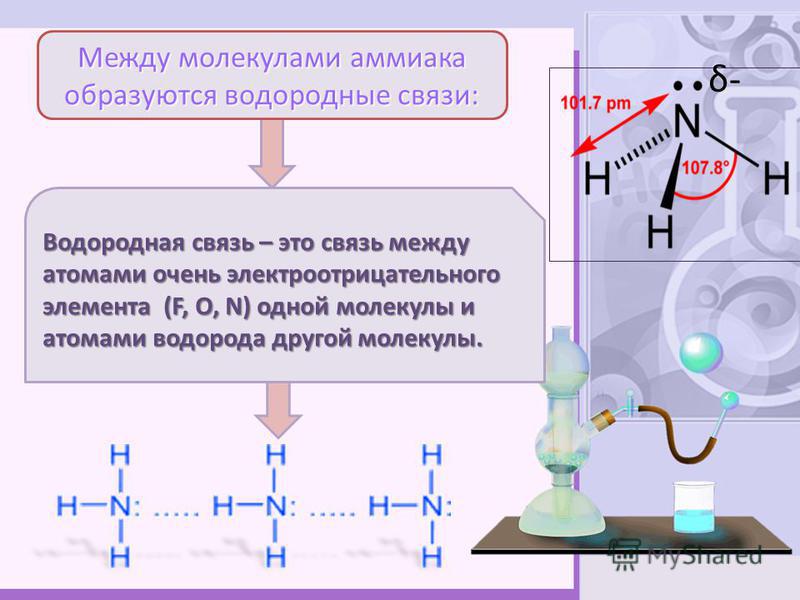 В группе молекул аммиака не хватает неподеленных пар, чтобы удовлетворить все атомы водорода.
В группе молекул аммиака не хватает неподеленных пар, чтобы удовлетворить все атомы водорода.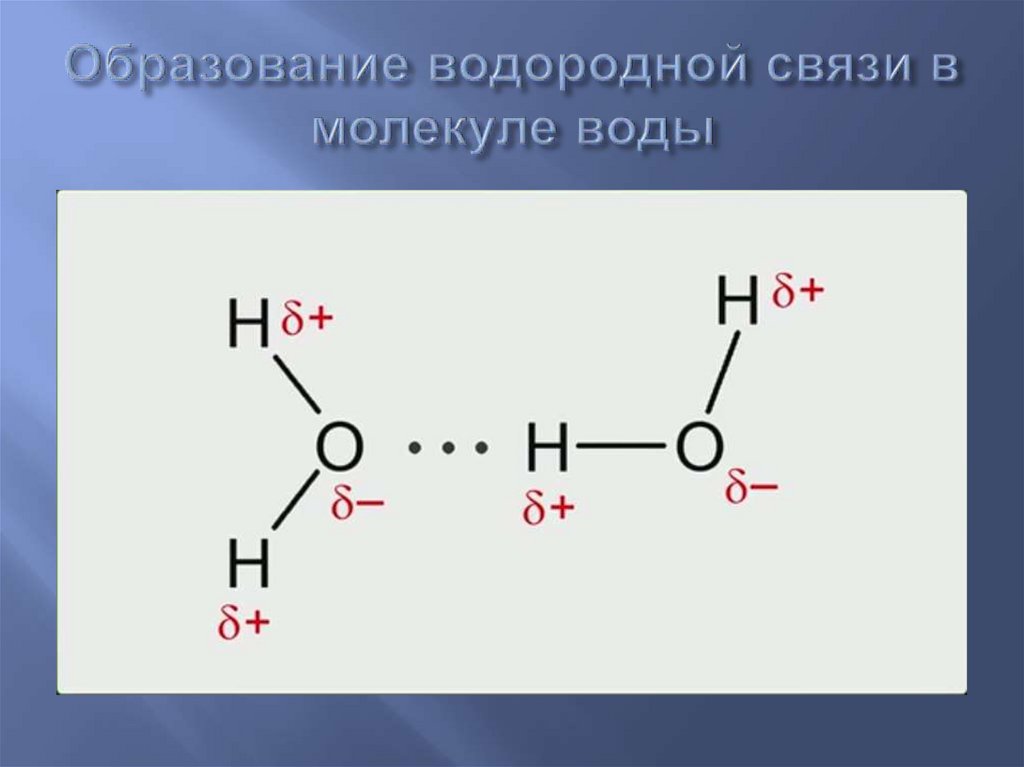 Говорят, что вода образует 2 водородные связи, а не 4. Это часто сопровождается диаграммой льда рядом с этим утверждением, ясно показывающим 4 водородные связи!
Говорят, что вода образует 2 водородные связи, а не 4. Это часто сопровождается диаграммой льда рядом с этим утверждением, ясно показывающим 4 водородные связи!
 Другие ван-дер-ваальсовы притяжения (как дисперсионные силы, так и диполь-дипольные притяжения) в каждом из них будут во многом одинаковыми.
Другие ван-дер-ваальсовы притяжения (как дисперсионные силы, так и диполь-дипольные притяжения) в каждом из них будут во многом одинаковыми.
 Примеры варьируются от простых молекул, таких как CH 3 NH 2 (метиламин) в большие молекулы, такие как белки и ДНК.
Примеры варьируются от простых молекул, таких как CH 3 NH 2 (метиламин) в большие молекулы, такие как белки и ДНК.
Leave A Comment